Автори: Roy Huynh, Corinne Owers, Christopher Pinto, Thuy-My Nguyen, Titus Kwok
Зміст:
- ВСТУП
- ПЛАНОВІ ЕНДОСКОПІЧНІ МЕТОДИ
- Ендоскопічна ретроградна холангіопанкреатографія
- Ендоскопічна УЗД
- Внутрішньопротокова УЗД
- Холангіоскопія
- НЕВІДКЛАДНІ ЕНДОСКОПІЧНІ МЕТОДИ
- Конфокальна лазерна ендомікроскопія
- Флуоресцентна гібридизація in situ
- ВИСНОВКИ
ВСТУП
Біліарні стриктури можна поділити на доброякісні та злоякісні. Диференціація цих двох етіологій дозволяє своєчасно лікувати злоякісні стриктури та уникнути непотрібних операцій при доброякісних випадках.
Поширеним правилом серед хірургів є припущення, що всі стриктури жовчовивідних шляхів є злоякісними, доки не буде доведено протилежне. Це оберігає від втраченого діагнозу злоякісного новоутворення, але сприяє тому, що значна кількість пацієнтів із доброякісними стриктурами жовчовивідних шляхів піддається хірургічному втручанню.
На жаль, діагностичні дослідження стриктур жовчовивідних шляхів у кращому разі скромні, що призводить до частини випадків, коли етіологія залишається невідомою. Ці біліарні стриктури називаються “невизначені стриктури” і представляють терапевтичну дилему для клініцистів, які займаються їх лікуванням.
Етіологія доброякісних стриктур жовчовивідних шляхів різноманітна. Ятрогенне пошкодження жовчних проток після холецистектомії або трансплантації печінки є найчастішою загальною причиною стриктур жовчовивідних шляхів. Автозапальні причини включають первинний склерозуючий холангіт (ПСХ), імуноглобулін G4 (IgG4)-асоційований холангіт та саркоїдоз.
Вдавлення жовчного каміння в міхурову протоку або кишеню Гартмана може призвести до зовнішньої компресії протоки. Інфекційні причини, такі як холангіопатія при синдромі набутого імунодефіциту, пов’язані з декількома патогенами, найчастішими є Cryptosporidium parvum, хоча в деяких випадках збудники можуть не бути ідентифіковані.
Що стосується злоякісних біліарних стриктур, то двома основними причинами є холангіокарцинома та аденокарцинома підшлункової залози. Злоякісні стриктури проксимальних та середніх відділів жовчних проток з більшою ймовірністю є холангіокарциномою, ніж аденокарциномою підшлункової залози, яка має тенденцію викликати стриктури дистальних жовчних проток.
Більш рідкісні причини злоякісних біліарних стриктур включають метастатичне ураження, лімфопроліферативне захворювання, карциному жовчного міхура та гепатоцелюлярну карциному.
Сучасні підходи до оцінки стриктур жовчовивідних шляхів мають високу специфічність, але недостатню чутливість, що призводить до діагностичної невизначеності. Страх пропустити потенційне злоякісне новоутворення спонукало багатьох хірургів оперувати у випадках, коли діагноз залишається невизначеним. До 20% підозрюваних злоякісних новоутворень жовчовивідних шляхів після хірургічної резекції виявляються доброякісними. Хірургія пов’язана з помітними показниками захворюваності та смертності. Отже, існує необхідність у розробці методів, які покращать діагностику біліарних стриктур.
ПЛАНОВІ ЕНДОСКОПІЧНІ МЕТОДИ
Ендоскопічна ретроградна холангіопанкреатографія
Ендоскопічна ретроградна холангіопанкреатографія (ЕРХПГ) залишається найбільш широко використовуваним діагностичним підходом для оцінки стриктур жовчовивідних шляхів. Початкова оцінка за допомогою ЕРХПГ дозволяє точно визначити розташування, довжину та морфологію стриктур жовчовивідних шляхів (зобр. 1).
Злоякісні стриктури зазвичай характеризуються як довгі та нерівномірні з ознаками уступу. На жаль, морфологія стриктур марна для встановлення конкретного діагнозу, і потрібен забір тканини з використанням щіткової цитології або внутрішньопротокової біопсії. Щіткова цитологія найчастіше виконується, тому що вона простіша і пов’язана з меншою кількістю ускладнень. І навпаки, внутрішньопротокова біопсія забезпечує більш докладну мікроархітектоніку, але вимагає сфінктеротомії і може бути складним завданням при вузьких жовчних протоках. Діагностична перевага внутрішньопротокової біопсії перед цитологічним мазком також не була продемонстрована.
Метааналіз проведений Navaneethan et al. показали, що сукупна чутливість і специфічність щіткової цитології в діагностиці злоякісних стриктур становили 45% (95% довірчий інтервал [ДІ], 40-50%) та 99% (95% ДІ, 98-100%) відповідно. Для внутрішньопротокових біопсій зведена чутливість і специфічність були співставними і становили 48,1% (95% ДІ, 42,8-53,4%) та 99,2% (95% ДІ, 97,6-99,8%) відповідно. Комбінація двох методів трохи підвищила чутливість до 59,4% (95% ДІ, 53,7–64,8%) зі специфічністю 100%.
Зображення 1: Ендоскопічна ретроградна холангіопанкреатографія показує виражений стеноз у середній та дистальній третині загальної жовчної протоки з супутнім розширенням вгору за течією.
Погана чутливість добору проб тканин за допомогою ЕРХПГ пояснюється декількома факторами, у тому числі ефектами десмоплазії при злоякісних новоутвореннях, що може знизити кількість зразків, отриманих за допомогою щіткової цитології. Крім того, запалення, вторинне по відношенню до обструкції або інфекції, може викликати клітинні зміни, такі як гіперплазія або дегенеративні порушення, що ускладнює розрізнення доброякісних та злоякісних уражень. Хоча діагностичний результат взяття зразків тканини залежить від морфології стриктури, інші фактори, включаючи технічні навички ендоскопіста та здатність до інтерпретації патологоанатома, залишаються важливими факторами. Було показано, що збільшення кількості чисток покращує точність діагностики; однак дилатація стриктури або збільшення довжини пензля не впливає.
Ендоскопічна УЗД
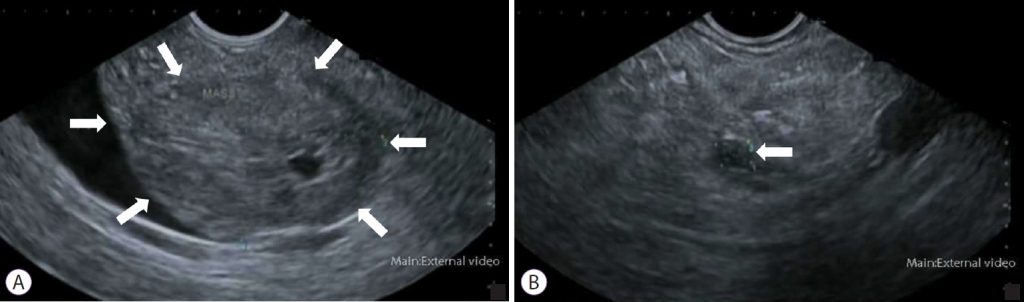
Ендоскопічне ультразвукове дослідження (ЕУЗД) може диференціювати доброякісні та злоякісні стриктури, дозволяючи проводити ультразвукову візуалізацію жовчних шляхів разом з оточуючими органами, включаючи підшлункову залозу (зобр. 2).
У дванадцятипалу кишку просувають ехоендоскоп, який містить датчик-перетворювач, вбудований у кінчик ендоскопа. Датчик може бути конвексним чи лінійним. Конвексні датчики забезпечують повний ротаційний огляд анатомії, тоді як лінійні датчики більше підходять для інтервенційних процедур, таких як тонкоголкова аспірація (FNA).
Оцінка загальної жовчної протоки зазвичай виконується з цибулини дванадцятипалої кишки, де безпосередня близькість жовчної протоки і датчика дозволяє візуалізувати жовчні шляхи разом з навколишніми структурами, такими як верхні брижові судини і парааортальні вузли.
Зображення 2: Гіпоехогенне утворення, що візуалізується за допомогою ендоскопічного УЗД. (А) Головка підшлункової залози. (B) Хвіст підшлункової залози
Забір зразків тканини за допомогою FNA під контролем ЕУЗД був вперше виконаний Fritscher-Ravens et al. у 10 пацієнтів із невизначеними біліарними стриктурами. Подальші дослідження FNA під контролем ЕУЗД продемонстрували підвищення точності при використанні у поєднанні з ЕРХПГ та щітковою цитологією.
Нещодавній метааналіз Садеги та співавт. встановив, що сукупна чутливість та специфічність FNA під контролем ЕУЗД у діагностиці злоякісних стриктур жовчовивідних шляхів становлять 80% (95% ДІ, 74–86%) та 97% (95% ДІ, 94–99%) відповідно. Коли бралося до уваги розташування стриктури жовчовивідних шляхів, FNA дистальних стриктур під контролем ЕУЗД мала більш високу чутливість (83% [95% ДІ, 68–98%]), ніж чутливість проксимальних стриктур (76% [95% ДІ, 66–85% ]); однак різниці у специфічності не було.
Практична ефективність FNA під контролем ЕУЗД залежить від локалізації, розміру та характеристик цільового ураження. Це послужило поштовхом до розробки тонкоголкової біопсії (FNB) під контролем ЕУЗД, в якій використовується голка більшого розміру для отримання основної біопсії з передбачуваного ураження. FNB під контролем ЕУЗД дозволяє отримати тканину з кращою цілісністю та мікроархітектурою, що дозволяє проводити інноваційну оцінку біомаркерів.
Нещодавнє рандомізоване перехресне дослідження показало, що FNB під контролем ЕУЗД має значно більшу діагностичну цінність та адекватність зразка, ніж FNA. Використання FNA та FNB під контролем ЕУЗД для передопераційної діагностики в даний час є дискусійним, з суперечливими точками зору, опублікованими різними керівними органами. Враховуючи відсутність зведених доказів, ендоскопісти завжди повинні враховувати ризик злоякісного обсіменіння при виконанні FNA або FNB під контролем ЕУЗД та приймати рішення у кожному конкретному випадку.
Внутрішньопротокова УЗД
Було показано, що внутрішньопротокове ультразвукове дослідження (ВУЗД) є більш точним, ніж забір тканини за допомогою ЕРХПГ при диференціації доброякісних і злоякісних біліарних стриктур. У цьому методі використовується тонкий ультразвуковий датчик, який можна вводити у жовчні шляхи без сфінктеротомії. Механічне обертання датчика дозволяє побачити поперечний переріз жовчної протоки.
Ознаки, що вказують на злоякісність, включають наявність сидячої пухлини, переривчасту структуру стінки та розмір пухлини >10 мм. Тамада та інших. продемонстрували, що якщо на ВУЗД виявляються як мінімум дві з цих ознак, слід запідозрити злоякісне новоутворення, навіть якщо результати гістологічного дослідження негативні.
Діагностичну корисність ВУЗД було оцінено Heinzow et al. у 234 пацієнтів із невизначеними біліарними стриктурами. ВУЗД діагностично перевершувала ендоскопічну транспапілярну біопсію, ЕУЗД та комп’ютерну томографію у виявленні злоякісних біліарних стриктур. Чутливість та специфічність ВУЗД у цьому дослідженні були визначені як 93% (95% ДІ, 88–97%) та 89% (95% ДІ, 83–95%) відповідно.
Основним обмеженням раннього ВУЗД була неможливість отримати біопсію для патологічної діагностики. Зовсім недавно транспапілярна біопсія була виконана під контролем ВУЗД. Кім та ін. провели проспективне порівняльне дослідження, яке показало, що транспапілярна біопсія під контролем ВУЗД має більш високу діагностичну точність, ніж транспапілярна біопсія під рентгеноскопічним контролем для діагностики злоякісних біліарних стриктур (90,8% проти 76,9%, p) .
Роль ЕУЗД може виходити за рамки діагностики та визначати стадію злоякісних стриктур. Було показано, що метод ВУЗД точніший, ніж ЕУЗД, при Т-стадії пухлин. Однак високі частоти, які використовуються при ВУЗД, не дозволяють точно визначити вузлову стадію через погане проникнення в тканини. ВУЗД може грати роль оцінці невизначених біліарних стриктур; проте нині воно обмежене відсутністю технічних знань, що необхідні для виконання цієї процедури. Крім того, раніше встановлені стенти можуть створювати акустичні перешкоди, знижуючи діагностичну цінність ВУЗД.
Холангіоскопія
Пряму візуалізацію жовчних проток може бути досягнуто за допомогою пероральної холангіоскопії. Спочатку цей метод втратив популярність через те, що для роботи з ендоскопом “mother-baby” була потрібна участь двох ендоскопістів. Крім того, процедура була обмежена поганою маневреністю, маленькими інструментальними каналами та неадекватним відхиленням кінчика.
Розвиток однооператорної холангіоскопії останнім часом спричинив відродження інтересу до використання цієї методики. Холангіоскопічне дослідження епітелію може надати макроскопічні ознаки злоякісності. Будь-які внутрішньопротокові утворення, вузлики або виразки вимагають прямої біопсії з ділянки. Наявність «пухлинної судини», розширеної та звивистої судини неправильної форми вважається надійною ознакою злоякісного новоутворення жовчовивідних шляхів.
Метааналіз проведений Sun et al. продемонстрував, що тільки візуальний огляд з використанням холангіоскопії корисний для виявлення злоякісних новоутворень жовчовивідних шляхів із сукупною чутливістю та специфічністю 90% (95% ДІ, 73–97%) та 87% (95% ДІ, 76–94) . Тим не менш, як і раніше, необхідно підтвердження за допомогою холангіоскопічної біопсії, яка має загальну чутливість і специфічність 69% (95% ДІ, 57-79%) і 98% (95% ДІ, 92-99%), відповідно.
Незважаючи на свою діагностичну цінність застосування холангіоскопії в багатьох центрах ендоскопії було відносно обмеженим. Багато ендоскопістів вважають цю процедуру технічно складною, оскільки вона вимагає майстерності в ЕРХПГ за одночасної роботи холангіоскопа через робочий канал. Проте дослідження продемонстрували відносно швидку криву навчання: за повідомленнями, для досягнення майстерності потрібно було лише 10 процедур. Холангіоскопія була оцінена в багатьох дослідженнях як безпечна процедура навіть у пацієнтів похилого віку і пацієнтів з супутніми захворюваннями. Подальші дослідження та розробки у галузі холангіоскопії можуть збільшити поширення цієї техніки у майбутньому.
НЕВІДКЛАДНІ ЕНДОСКОПІЧНІ МЕТОДИ
Конфокальна лазерна ендомікроскопія
Конфокальна лазерна ендомікроскопія (КЛЕМС) є перспективним методом, який може забезпечити гістологічну візуалізацію жовчних проток in vivo у режимі реального часу під час ЕРХПГ.
Принцип КЛЕМС заснований на відображенні сфокусованого світла через конфокальну апертуру для отримання високої роздільної здатності гістологічних зображень. Ця методика виконується за допомогою катетерного зонда, який вводиться через робочий канал ендоскопа (зондова КЛЕМС) або апаратуру FNA (гольчаста КЛЕМС).
Зонд просувають у біліарну систему, і пацієнту вводять контрастну речовину, таку як флуоресцеїн, який проникає в жовчовивідні шляхи, виділяючи епітеліальні та субепітеліальні структури. Діагноз злоякісного новоутворення за допомогою КЛЕМС ґрунтується на критеріях класифікації Майамі.
Злоякісні ознаки відповідно до цих критеріїв включають товсті темні смуги > 40 мкм, товсті білі смуги > 20 мкм, епітеліальні структури та темні скупчення. КЛЕМС та класифікація Майамі продемонстрували кращу чутливість, але меншу специфічність, ніж традиційна гістологія в оцінці стриктур жовчних шляхів. Низька специфічність пояснюється змінами, спричиненими хронічним запаленням або процедурами, що виконуються під час ЕРХПГ, такими як цитологічне очищення. Для вирішення цієї проблеми Caillol та ін. розробили Паризьку класифікацію для диференціації доброякісних запальних стриктур та злоякісних стриктур. Наявність судинної гіперемії, збільшення міжзалізистого простору, потовщення ретикулярних структур і зернистий малюнок із лусочками — все це ознаки, що вказують на запальні стриктури жовчовивідних шляхів.
Результати ранніх досліджень, що вивчають використання КЛЕМС у діагностиці стриктур жовчовивідних шляхів, припускають оптимістичне майбутнє. У недавньому метааналізі, який аналізує 12 досліджень за участю 591 пацієнта, Gao et al. визначили, що сукупна чутливість та специфічність КЛЕМС при розрізненні доброякісних та злоякісних стриктур жовчовивідних шляхів склала 87% (95% ДІ, 83–91%) та 76% (95% ДІ, 70–81%) відповідно.
При використанні у поєднанні із взяттям зразків тканин чутливість та специфічність збільшувалися до 93% (95% ДІ, 88–96%) та 82% (95% ДІ, 74–89%) відповідно. Проте запровадження КЛЕМС було повільним. Це може бути пов’язано з тим, що процедура технічно складна, тому що вимагає стабільності датчика для забезпечення високоякісних зображень. Крім того, згода між експертами та досвідченими ендоскопістами погана, що викликає сумніви щодо її діагностичної надійності. Однак ці недоліки можна подолати за допомогою стандартизованого навчання.
В даний час КЛЕМС практикується лише в кількох спеціалізованих центрах і потребує подальшої валідації для закріплення свого місця у клінічній практиці.
Флуоресцентна гібридизація in situ
Флуоресцентна гібридизація in situ (FISH) використовувалася для виявлення інших злоякісних новоутворень, таких як уротеліальна карцинома, до застосування для оцінки біліарних стриктур.
У цьому методі використовуються ДНК-зонди з флуоресцентною міткою для виявлення анеуплоїдії, пов’язаної зі злоякісними стриктурами жовчовивідних шляхів. Більш конкретно, полісомія хромосом 3, 7 і 17 центромірних або хромосомних областей 1q21, 7p12 або 8q24 вважається корисною для виявлення злоякісних біліарних стриктур.
Численні дослідження показали, що FISH може підвищити чутливість цитологічного дослідження за збереження специфічності. Останнє дослідження Liew et al., які провели ретроспективний аналіз 30 послідовних пацієнтів, яким виконували як рутинну цитологію, так і FISH в центрі третинної медичної допомоги. При незалежному використанні звичайна щіткова цитологія мала більшу чутливість (53,8% проти 30,8%), але нижчу специфічність (82,4% проти 100%), ніж FISH. Однак, коли результати FISH інтерпретувалися у випадках негативних або атипових результатів цитологічного дослідження, чутливість щіткової цитології покращувалася з 53,8 до 69,2% без шкоди для специфічності.
Добре вивченим аспектом FISH є виявлення холангіокарцином при ПСХ. ПСХ може бути важко відрізнити від холангіокарциноми, тому що ці два стани можуть мати схожі особливості візуалізації. Крім того, у деяких пацієнтів з ПСХ може розвинутись холангіокарцинома. У таких випадках FISH можна використовувати для визначення того, чи відбулося прогресування холангіокарциноми.
Метааналіз восьми досліджень за участю 828 пацієнтів показав, що сукупна чутливість та специфічність діагностики холангіокарциноми при ПСХ склала 68% (95% ДІ, 61–74%) та 70% (95% ДІ, 66–73%) відповідно. Ці результати показали, що FISH лише трохи збільшує чутливість взяття проб тканин при ПСХ. Проте висока вартість FISH спонукала деяких ендоскопістів вибірково використовувати цей інструмент виявлення злоякісних новоутворень. FISH не рекомендується як інструмент скринінгу для всіх пацієнтів з ПСХ, але його слід розглянути, якщо підозра на злоякісність залишається високою після непереконливого мазкового цитологічного дослідження.
ВИСНОВКИ
Оцінка стриктур жовчовивідних шляхів залишається складним завданням, незважаючи на останні досягнення в області ендоскопічних методів. Рішення про перевагу одного ендоскопічного доступу над іншим має прийматись індивідуально; однак відсутність великомасштабних проспективних досліджень нових методів ускладнює це рішення. Діагнозу біліарних стриктур може допомогти розвиток методів цитопатологічного фарбування та візуалізації. Таким чином, міждисциплінарний підхід за участю ендоскопістів, хірургів, патологів та рентгенологів необхідний для забезпечення цілісного спрямування діагностики. Майбутні досягнення в галузі ендоскопії, поза сумнівом, покращать виявлення злоякісних біліарних стриктур. Тим часом, клініцисти повинні адаптувати свої рішення до клінічного стану окремих пацієнтів при діагностиці біліарних стриктур.