Авторы: , , , ,
Содержание:
- ВВЕДЕНИЕ
- ПЛАНОВЫЕ ЭНДОСКОПИЧЕСКИЕ МЕТОДЫ
- Эндоскопическая ретроградная холангиопанкреатография
- Эндоскопическое УЗИ
- Внутрипротоковое УЗИ
- Холангиоскопия
- НЕОТЛОЖНЫЕ ЭНДОСКОПИЧЕСКИЕ МЕТОДЫ
- Конфокальная лазерная эндомикроскопия
- Флуоресцентная гибридизация in situ
- ВЫВОДЫ
ВВЕДЕНИЕ
Билиарные стриктуры можно разделить на доброкачественные и злокачественные. Дифференциация этих двух этиологий позволяет своевременно лечить злокачественные стриктуры и избежать ненужных операций при доброкачественных вариантах.
Распространенным правилом среди хирургов является предположение, что все стриктуры желчевыводящих путей являются злокачественными, пока не будет доказано обратное. Это предохраняет от упущенного диагноза злокачественного новообразования, но способствует тому, что значительное число пациентов с доброкачественными стриктурами желчевыводящих путей подвергается хирургическому вмешательству.
К сожалению, диагностические исследования стриктур желчевыводящих путей в лучшем случае скромны, что приводит к части случаев, когда этиология остается неизвестной. Эти билиарные стриктуры называются «неопределенные стриктуры» и представляют терапевтическую дилемму для клиницистов, занимающихся их лечением.
Этиология доброкачественных стриктур желчевыводящих путей разнообразна. Ятрогенное повреждение желчных протоков после холецистэктомии или трансплантации печени является наиболее частой общей причиной стриктур желчевыводящих путей. Аутовоспалительные причины включают первичный склерозирующий холангит (ПСХ), иммуноглобулин G4 (IgG4)-ассоциированный холангит и саркоидоз.
Вдавление желчных камней в пузырный проток или карман Гартмана может привести к внешней компрессии протока. Инфекционные причины, такие как холангиопатия при синдроме приобретенного иммунодефицита, связаны с несколькими патогенами, наиболее частыми из которых являются Cryptosporidium parvum, хотя в некоторых случаях возбудители могут не быть идентифицированы.
Что касается злокачественных билиарных стриктур, то двумя основными причинами являются холангиокарцинома и аденокарцинома поджелудочной железы. Злокачественные стриктуры проксимальных и средних отделов желчных протоков с большей вероятностью являются холангиокарциномой, чем аденокарциномой поджелудочной железы, которая имеет тенденцию вызывать стриктуры дистальных желчных протоков.
Более редкие причины злокачественных билиарных стриктур включают метастатическое поражение, лимфопролиферативное заболевание, карциному желчного пузыря и гепатоцеллюлярную карциному.
Современные подходы к оценке стриктур желчевыводящих путей обладают высокой специфичностью, но недостаточной чувствительностью, что приводит к диагностической неопределенности. Страх пропустить потенциальное злокачественное новообразование побудил многих хирургов оперировать в случаях, когда диагноз остается неопределенным. До 20% подозреваемых злокачественных новообразований желчевыводящих путей после хирургической резекции оказываются доброкачественными. Хирургия связана с заметными показателями заболеваемости и смертности. Следовательно, существует необходимость в разработке методов, которые улучшат диагностику билиарных стриктур.
ПЛАНОВЫЕ ЭНДОСКОПИЧЕСКИЕ МЕТОДЫ
Эндоскопическая ретроградная холангиопанкреатография
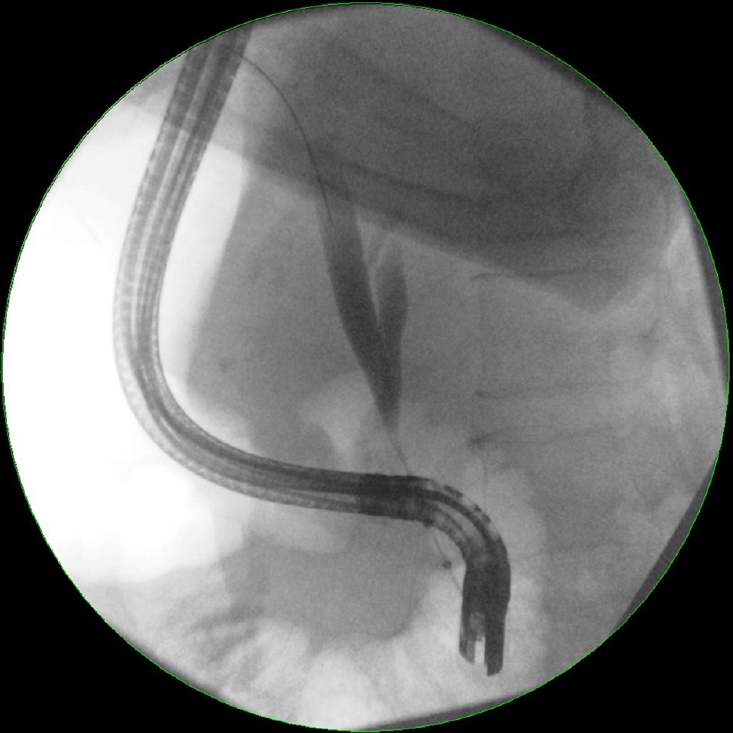
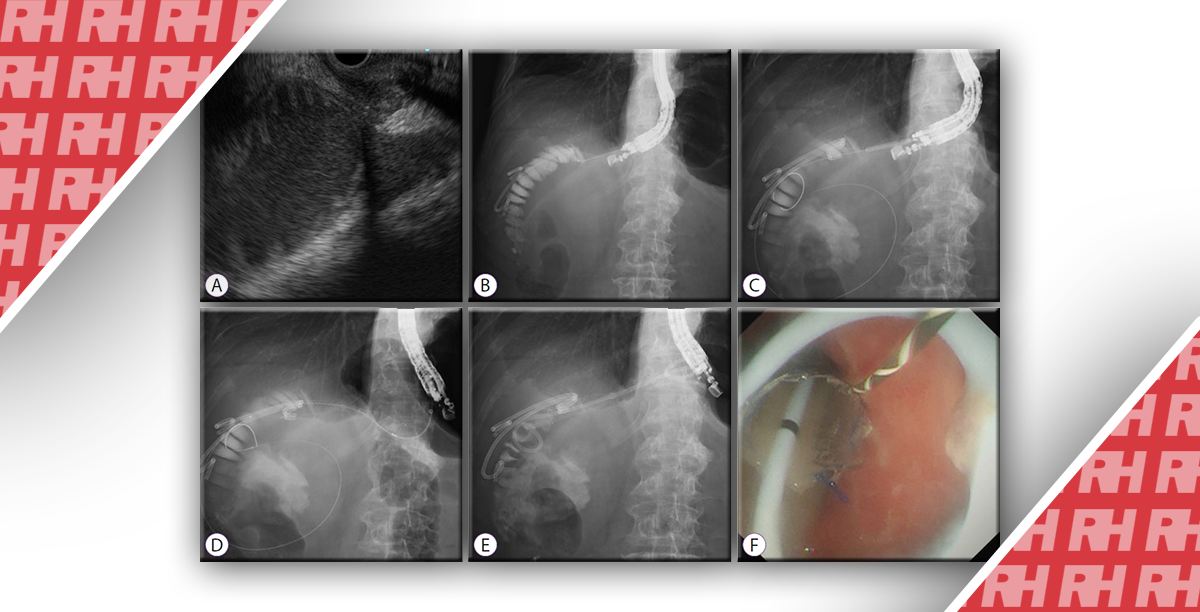
Эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) остается наиболее широко используемым диагностическим подходом для оценки стриктур желчевыводящих путей. Первоначальная оценка с помощью ЭРХПГ позволяет точно определить расположение, протяженность и морфологию стриктур желчевыводящих путей (рис. 1).
Злокачественные стриктуры обычно характеризуются как длинные и неравномерные с признаками уступа. К сожалению, морфология стриктур бесполезна для постановки конкретного диагноза, и требуется забор ткани с использованием щеточной цитологии или внутрипротоковой биопсии. Щеточная цитология чаще выполняется, потому что она проще и связана с меньшим количеством осложнений. И наоборот, внутрипротоковая биопсия обеспечивает более подробную микроархитектонику, но требует сфинктеротомии и может быть сложной задачей при узких желчных протоках. Диагностическое преимущество внутрипротоковой биопсии перед цитологическим мазком также не было продемонстрировано.
Метаанализ, проведенный Navaneethan et al. показали, что совокупная чувствительность и специфичность щеточной цитологии в диагностике злокачественных стриктур составляли 45% (95% доверительный интервал [ДИ], 40–50%) и 99% (95% ДИ, 98–100%), соответственно. Для внутрипротоковых биопсий сводная чувствительность и специфичность были сопоставимы и составляли 48,1% (95% ДИ, 42,8–53,4%) и 99,2% (95% ДИ, 97,6–99,8%) соответственно. Комбинация двух методов незначительно повысила чувствительность до 59,4% (95% ДИ, 53,7–64,8%) со специфичностью 100%.
Рисунок 1: Эндоскопическая ретроградная холангиопанкреатография показывает выраженный стеноз в средней и дистальной трети общего желчного протока с сопутствующим расширением вверх по течению.
Плохая чувствительность отбора проб тканей с помощью ЭРХПГ объясняется несколькими факторами, в том числе эффектами десмоплазии при злокачественных новообразованиях, что может снизить количество образцов, полученных с помощью щеточной цитологии. Кроме того, воспаление, вторичное по отношению к обструкции или инфекции, может вызывать клеточные изменения, такие как гиперплазия или дегенеративные нарушения, что затрудняет различение доброкачественных и злокачественных поражений. Хотя диагностический результат взятия образцов ткани зависит от морфологии стриктуры, другие факторы, включая технические навыки эндоскописта и способность к интерпретации патологоанатома, остаются важными факторами. Было показано, что увеличение количества чисток улучшает точность диагностики; однако дилатация стриктуры или увеличение длины кисти не влияет.
Эндоскопическое УЗИ
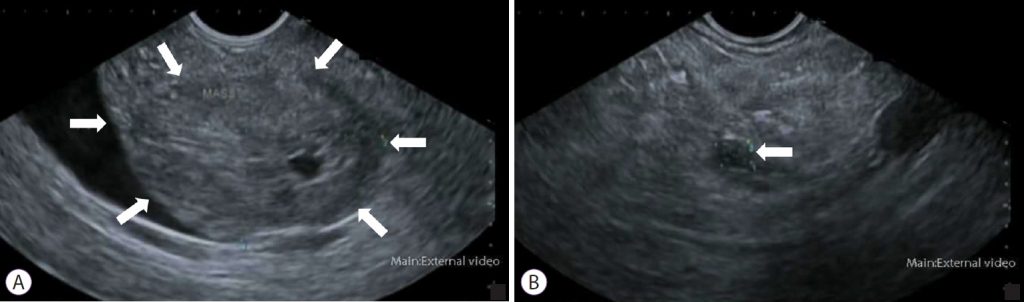
Эндоскопическое ультразвуковое исследование (ЭУЗИ) может дифференцировать доброкачественные и злокачественные стриктуры, позволяя проводить ультразвуковую визуализацию желчных путей вместе с окружающими органами, включая поджелудочную железу (рис. 2).
В двенадцатиперстную кишку продвигают эхоэндоскоп, который содержит датчик-преобразователь, встроенный в кончик эндоскопа. Датчик может быть конвексным или линейным. Конвексные датчики обеспечивают полный ротационный обзор анатомии, в то время как линейные датчики больше подходят для интервенционных процедур, таких как тонкоигольная аспирация (FNA).
Оценка общего желчного протока обычно выполняется из луковицы двенадцатиперстной кишки, где непосредственная близость желчного протока и датчика позволяет визуализировать желчные пути вместе с окружающими структурами, такими как верхние брыжеечные сосуды и парааортальные узлы.
Рисунок 2: Гипоэхогенное образование, визуализируемое с помощью эндоскопического УЗИ. (А) Головка поджелудочной железы. (B) Хвост поджелудочной железы
Забор образцов ткани с помощью FNA под контролем ЭУЗИ был впервые выполнен Fritscher-Ravens et al. у 10 пациентов с неопределенными билиарными стриктурами. Дальнейшие исследования FNA под контролем ЭУЗИ продемонстрировали повышение точности при использовании в сочетании с ЭРХПГ и щеточной цитологией.
Недавний метаанализ Садеги и соавт. установил, что совокупная чувствительность и специфичность FNA под контролем ЭУЗИ в диагностике злокачественных стриктур желчевыводящих путей составляют 80% (95% ДИ, 74–86%) и 97% (95% ДИ, 94–99%) соответственно. Когда принималось во внимание расположение стриктуры желчевыводящих путей, FNA дистальных стриктур под контролем ЭУЗИ имела более высокую чувствительность (83% [95% ДИ, 68–98%]), чем чувствительность проксимальных стриктур (76% [95% ДИ, 66–85%]); однако разницы в специфичности не было.
Практическая эффективность FNA под контролем ЭУЗИ зависит от локализации, размера и характеристик целевого поражения. Это послужило толчком к разработке тонкоигольной биопсии (FNB) под контролем ЭУЗИ, в которой используется игла большего размера для получения основной биопсии из предполагаемого поражения. FNB под контролем ЭУЗИ позволяет получить ткань с лучшей целостностью и микроархитектурой, что позволяет проводить инновационную оценку биомаркеров.
Недавнее рандомизированное перекрестное исследование показало, что FNB под контролем ЭУЗИ имеет значительно более высокую диагностическую ценность и адекватность образца, чем FNA. Использование FNA и FNB под контролем ЭУЗИ для предоперационной диагностики в настоящее время является дискуссионным, с противоречивыми точками зрения, опубликованными различными руководящими органами. Учитывая отсутствие сводных доказательств, эндоскописты всегда должны учитывать риск злокачественного обсеменения при выполнении FNA или FNB под контролем ЭУЗИ и принимать решение в каждом конкретном случае.
Внутрипротоковое УЗИ
Было показано, что внутрипротоковое ультразвуковое исследование (ВУЗИ) является более точным, чем забор ткани с помощью ЭРХПГ, при дифференциации доброкачественных и злокачественных билиарных стриктур. В этом методе используется тонкий ультразвуковой датчик, который можно вводить в желчные пути без сфинктеротомии. Механическое вращение датчика позволяет увидеть поперечное сечение желчного протока.
Признаки, указывающие на злокачественность, включают наличие сидячей опухоли, прерывистую структуру стенки и размер опухоли >10 мм. Тамада и др. продемонстрировали, что если при ВУЗИ выявляются как минимум два из этих признаков, следует заподозрить злокачественное новообразование, даже если результаты гистологического исследования отрицательны.
Диагностическая полезность ВУЗИ была оценена Heinzow et al. у 234 пациентов с неопределенными билиарными стриктурами. ВУЗИ диагностически превосходила эндоскопическую транспапиллярную биопсию, ЭУЗИ и компьютерную томографию в выявлении злокачественных билиарных стриктур. Чувствительность и специфичность ВУЗИ в этом исследовании были определены как 93% (95% ДИ, 88–97%) и 89% (95% ДИ, 83–95%) соответственно.
Основным ограничением более раннего ВУЗИ была невозможность получить биопсию для патологической диагностики. Совсем недавно транспапиллярная биопсия была выполнена под контролем ВУЗИ. Ким и др. провели проспективное сравнительное исследование, которое показало, что транспапиллярная биопсия под контролем ВУЗИ имеет более высокую диагностическую точность, чем транспапиллярная биопсия под рентгеноскопическим контролем для диагностики злокачественных билиарных стриктур (90,8% против 76,9%, p = 0,027).
Роль ЭУЗИ может выходить за рамки диагностики и определять стадию злокачественных стриктур. Было показано, что метод ВУЗИ более точен, чем ЭУЗИ, при Т-стадии опухолей. Однако высокие частоты, используемые при ВУЗИ, не позволяют точно определить узловую стадию из-за плохого проникновения в ткани. ВУЗИ может играть роль в оценке неопределенных билиарных стриктур; однако в настоящее время оно ограничено отсутствием технических знаний, необходимых для выполнения этой процедуры. Кроме того, ранее установленные стенты могут создавать акустические помехи, снижая диагностическую ценность ВУЗИ.
Холангиоскопия
Прямая визуализация желчных протоков может быть достигнута с помощью пероральной холангиоскопии. Первоначально этот метод потерял популярность из-за того, что для работы с эндоскопом “mother–baby” требовалось участие двух эндоскопистов. Кроме того, процедура была ограничена плохой маневренностью, маленькими инструментальными каналами и неадекватным отклонением кончика.
Развитие однооператорной холангиоскопии в последнее время привело к возрождению интереса к использованию этой методики. Холангиоскопическое исследование эпителия может дать макроскопические признаки злокачественности. Любые внутрипротоковые образования, узелки или изъязвления требуют прямой биопсии из участка. Наличие «опухолевого сосуда», расширенного и извитого сосуда неправильной формы считается надежным признаком злокачественного новообразования желчевыводящих путей.
Метаанализ, проведенный Sun et al. продемонстрировал, что только визуальный осмотр с использованием холангиоскопии полезен для выявления злокачественных новообразований желчевыводящих путей с совокупной чувствительностью и специфичностью 90% (95% ДИ, 73–97%) и 87% (95% ДИ, 76–94%) соответственно. Тем не менее, по-прежнему необходимо подтверждение с помощью холангиоскопической биопсии, которая имеет общую чувствительность и специфичность 69% (95% ДИ, 57-79%) и 98% (95% ДИ, 92-99%), соответственно.
Несмотря на свою диагностическую ценность, применение холангиоскопии во многих центрах эндоскопии было относительно ограниченным. Многие эндоскописты считают эту процедуру технически сложной, поскольку она требует мастерства в ЭРХПГ при одновременной работе холангиоскопа через рабочий канал. Тем не менее, исследования продемонстрировали относительно быструю кривую обучения: по сообщениям, для достижения мастерства требовалось всего 10 процедур. Холангиоскопия была оценена во многих исследованиях как безопасная процедура даже у пожилых пациентов и пациентов с сопутствующими заболеваниями. Дальнейшие исследования и разработки в области холангиоскопии могут увеличить распространение этой техники в будущем.
НЕОТЛОЖНЫЕ ЭНДОСКОПИЧЕСКИЕ МЕТОДЫ
Конфокальная лазерная эндомикроскопия
Конфокальная лазерная эндомикроскопия (КЛЭМС) является перспективным методом, который может обеспечить гистологическую визуализацию желчных протоков in vivo в режиме реального времени во время ЭРХПГ.
Принцип КЛЭМС основан на отражении сфокусированного света через конфокальную апертуру для получения гистологических изображений высокого разрешения. Эта методика выполняется с помощью катетерного зонда, который вводится через рабочий канал эндоскопа (зондовая КЛЭМС) или аппаратуры FNA (игольчатая КЛЭМС).
Зонд продвигают в билиарную систему, и пациенту вводят контрастное вещество, такое как флуоресцеин, который проникает в желчевыводящие пути, выделяя эпителиальные и субэпителиальные структуры. Диагноз злокачественного новообразования с помощью КЛЭМС основывается на критериях классификации Майами.
Злокачественные признаки в соответствии с этими критериями включают толстые темные полосы> 40 мкм, толстые белые полосы> 20 мкм, эпителиальные структуры и темные скопления. КЛЭМС и классификация Майами продемонстрировали лучшую чувствительность, но меньшую специфичность, чем традиционная гистология при оценке стриктур желчных путей. Низкая специфичность объясняется изменениями, вызванными хроническим воспалением или процедурами, выполняемыми во время ЭРХПГ, такими как цитологическая очистка. Для решения этой проблемы Caillol et al. разработали Парижскую классификацию для дифференциации доброкачественных воспалительных стриктур и злокачественных стриктур. Наличие сосудистой гиперемии, увеличение межжелезистого пространства, утолщение ретикулярных структур и зернистый рисунок с чешуйками — все это признаки, указывающие на воспалительные стриктуры желчевыводящих путей.
Результаты ранних исследований, изучающих использование КЛЭМС в диагностике стриктур желчевыводящих путей, предполагают оптимистичное будущее. В недавнем метаанализе, анализирующем 12 исследований с участием 591 пациента, Gao et al. определили, что совокупная чувствительность и специфичность КЛЭМС при различении доброкачественных и злокачественных стриктур желчевыводящих путей составила 87% (95% ДИ, 83–91%) и 76% (95% ДИ, 70–81%) соответственно.
При использовании в сочетании с взятием образцов тканей чувствительность и специфичность увеличивались до 93% (95% ДИ, 88–96%) и 82% (95% ДИ, 74–89%) соответственно. Однако внедрение КЛЭМС было медленным. Это может быть связано с тем, что процедура технически сложна, так как требует стабильности датчика для обеспечения высококачественных изображений. Кроме того, согласие между экспертами и опытными эндоскопистами плохое, что вызывает сомнения в ее диагностической надежности. Однако эти недостатки можно преодолеть с помощью стандартизированного обучения.
В настоящее время КЛЭМС практикуется лишь в нескольких специализированных центрах и требует дальнейшей валидации для закрепления своего места в клинической практике.
Флуоресцентная гибридизация in situ
Флуоресцентная гибридизация in situ (FISH) использовалась для выявления других злокачественных новообразований, таких как уротелиальная карцинома, до ее применения для оценки билиарных стриктур.
В этом методе используются ДНК-зонды с флуоресцентной меткой для обнаружения анеуплоидии, связанной со злокачественными стриктурами желчевыводящих путей. Более конкретно, полисомия хромосом 3, 7 и 17 центромерных областей или хромосомных областей 1q21, 7p12 или 8q24 считается полезной для выявления злокачественных билиарных стриктур.
Многочисленные исследования показали, что FISH может повысить чувствительность цитологического исследования при сохранении специфичности. Самое последнее исследование Liew et al., которые провели ретроспективный анализ 30 последовательных пациентов, которым выполняли как рутинную цитологию, так и FISH в центре третичной медицинской помощи. При независимом использовании обычная щеточная цитология имела более высокую чувствительность (53,8% против 30,8%), но более низкую специфичность (82,4% против 100%), чем FISH. Однако, когда результаты FISH интерпретировались в случаях отрицательных или атипичных результатов цитологического исследования, чувствительность щеточной цитологии улучшалась с 53,8% до 69,2% без ущерба для специфичности.
Хорошо изученным аспектом FISH является обнаружение холангиокарциномы при ПСХ. ПСХ может быть трудно отличить от холангиокарциномы, потому что эти два состояния могут иметь схожие особенности визуализации. Кроме того, у некоторых пациентов с ПСХ может развиться холангиокарцинома. В таких случаях FISH можно использовать для определения того, произошло ли прогрессирование холангиокарциномы.
Метаанализ восьми исследований с участием 828 пациентов показал, что совокупная чувствительность и специфичность диагностики холангиокарциномы при ПСХ составила 68% (95% ДИ, 61–74%) и 70% (95% ДИ, 66–73%) соответственно. Эти результаты показали, что FISH лишь незначительно увеличивает чувствительность взятия проб тканей при ПСХ. Однако высокая стоимость FISH побудила некоторых эндоскопистов избирательно использовать этот инструмент для выявления злокачественных новообразований. FISH не рекомендуется в качестве инструмента скрининга для всех пациентов с ПСХ, но его следует рассмотреть, если подозрение на злокачественность остается высоким после неубедительного мазкового цитологического исследования.
ВЫВОДЫ
Оценка стриктур желчевыводящих путей остается сложной задачей, несмотря на недавние достижения в области эндоскопических методов. Решение о предпочтительности одного эндоскопического доступа над другим должно приниматься индивидуально; однако отсутствие крупномасштабных проспективных исследований новых методов затрудняет это решение. Диагнозу билиарных стриктур может помочь развитие методов цитопатологического окрашивания и визуализации. Таким образом, междисциплинарный подход с участием эндоскопистов, хирургов, патологов и рентгенологов необходим для обеспечения целостного направления диагностики. Будущие достижения в области эндоскопии, несомненно, улучшат обнаружение злокачественных билиарных стриктур. Тем временем клиницисты должны адаптировать свои решения к клиническому состоянию отдельных пациентов при диагностике билиарных стриктур.