Резюме
Передумови
Лапароскопічна операція (ЛО) все частіше застосовується при перихілярній холангіокарциномі (ПХХК). У цьому дослідженні ми маємо намір порівняти короткострокові результати ЛО і Відритих хірургічних операцій (ВО) при ПХХК у багатоцентровій практиці в Китаї.
Методи
Цей реальний аналіз включав 645 пацієнтів з ПХХК, яким проводили лапароскопічні та відкриті операції в 11 центрах-учасниках у Китаї в період з січня 2013 року по січень 2019 року. Порівняльний аналіз проводився до і після узгодження оцінки схильності (УОС) в групах ЛО і ВО, а також в підгрупах вісмуту. Для виявлення значущих прогностичних факторів несприятливих хірургічних результатів і післяопераційної тривалості перебування в стаціонарі (ППС) були використані одновимірні і багатовимірні моделі.
Результати
Серед 645 пацієнтів з ПХХК, 256 виконали ЛО і 389 – ВО. У групі ЛО спостерігали меншу кількість гепатикоєюностомій (30,89% проти 51,40%, P = 0,006), меншу потребу в біліарній пластиці (19,51% проти 40,16%, P = 0,001), коротший ППС (в середньому 14,32 проти 17,95 д, P < 0,001) і меншу кількість тяжких ускладнень (CD ≥ III) (12,11% проти 22,88%, P = 0,006) порівняно з групою ВО. Основні післяопераційні ускладнення, такі як кровотеча, жовчна нориця, абсцес черевної порожнини та печінкова недостатність, були подібними між ЛО та ВО (P > 0,05 для всіх). Після УОС короткострокові результати двох хірургічних методів були подібними, за винятком коротшого ППС при ЛО порівняно з ВО (в середньому 15,19 проти 18,48 д, P = 0,0007). Серійний аналіз підгруп продемонстрував, що ЛО є безпечним і має переваги в скороченні ППС.
Висновок
Незважаючи на складні хірургічні процедури, ЛО здається безпечною і здійсненною для досвідчених хірургів.
Передумови
Перихілярна холангіокарцинома (ПХХК) є руйнівним захворюванням, щорічна захворюваність на яке становить один-два випадки на 100 000 осіб [1]. Радикальне хірургічне втручання є найважливішим потенційно виліковним методом лікування ПХХК. Водночас, радикальна хірургія, безсумнівно, є однією з найскладніших і найдосконаліших навичок для хірургів [2]. Останні досягнення в хірургічній техніці та періопераційному менеджменті дозволили підвищити резектабельність та покращити результати хірургічного втручання, проте післяопераційна захворюваність та смертність залишаються проблемою [3].
Лапароскопічні операції (ЛО) все частіше застосовуються при всіх видах гепато-панкреато-біліарних резекцій, включаючи панкреатектомію та гепатектомію [4,5,6]. У хірургії печінки ЛО демонструє кращі післяопераційні результати порівняно з відкритим доступом [7]. Останнім часом зростає інтерес до виконання лапароскопічної панкреатодуодентектомії (ПДЕ), яка, як було продемонстровано, є доцільною та безпечною, а її результати є співставними з результатами відкритої ПДЕ [8]. Хірургічні процедури при ПХХК передбачають резекцію перихілярного відділу загальної жовчної протоки з розширеною гепатектомією, що вимагає супутньої резекції та відновлення судин або навіть комбінованої гепато-панкреато-дуодентектомії. Основною проблемою є складне анатомічне розташування ураження, яке знаходиться в безпосередній близькості до ворітної вени (ВВ), печінкових артерій та паренхіми печінки [9, 10]. Таким чином, повідомлень про лапароскопічну резекцію з приводу ПХХК небагато через складність хірургічного втручання. До цього часу вважалося, що лапароскопічна резекція при ПХХК перебуває в зародковому стані [11]. Однак наявні докази щодо застосування лапароскопічного доступу при ПХХК обмежені; лапароскопічний доступ не може розглядатися як догматичне протипоказання при ПХХК. Таким чином, вкрай важливо провести масштабні багатоцентрові дослідження для вивчення технічної можливості та безпеки ЛО при ПХХК [12].
У цій роботі ми порівняли періопераційні результати ЛО і відкритих операцій (ВО) у 654 пацієнтів з ПХХК в Китаї до і після аналізу на основі оцінки схильності. Наскільки нам відомо, це найбільша на сьогоднішній день серія операцій з використанням ЛО у порівнянні з ВО при ПХХК, яку досліджували.
Методи
Пацієнти та збір даних
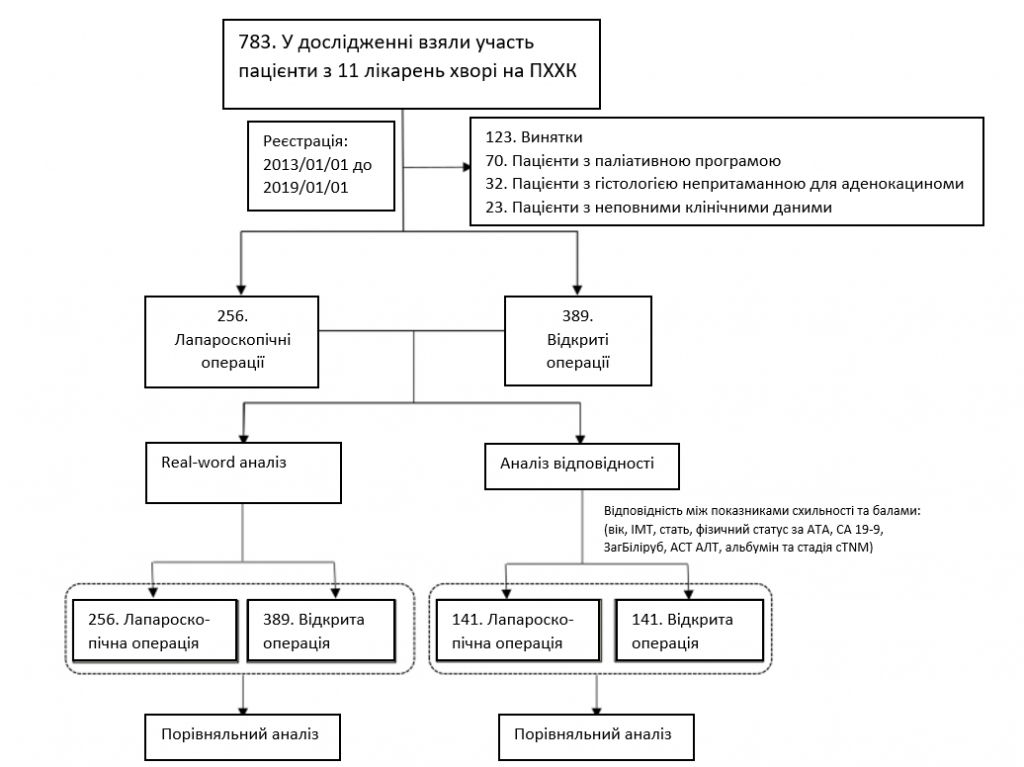
Ретроспективний аналіз інституційних баз даних 11 лікарень Китаю виявив 645 пацієнтів з ПХХК, які перенесли радикальну операцію в період з січня 2013 року по січень 2019 року, в тому числі 256 пацієнтів перенесли операції з використанням ЛС і 389 – ВО. У всіх випадках була гістологічно підтверджена ПХХК. Критерії виключення були наступними: (1) пацієнти з перитонеальним метастазуванням або метастазами в печінку, парааортальні лімфатичні вузли або віддалені ділянки; (2) пацієнти з гістологією, не схожою на аденокарциному; і (3) пацієнти з неповними клінічними даними. Детальний хід дослідження показано на зобр. 1. Дослідження було схвалено етичним комітетом / Інституційною наглядовою радою етичного комітету лікарні Тонджі (номер схвалення: TJ-IRB20220531). Необхідність отримання інформованої згоди була скасована комітетом з питань етики / Інституційною наглядовою радою Комітету з питань етики лікарні Тунцзи (номер схвалення: TJ-IRB20220531) через ретроспективний характер дослідження. Це дослідження також було зареєстровано на сайті ClinicalTrials.gov (ідентифікатор: NCT05402618; дата першої реєстрації: 02/06/2022). Уся робота проводилася відповідно до “Керівництва з гендерної та статевої рівності в дослідженнях – SAGER” і була оформлена відповідно до критеріїв STROCSS [13].
Зображення. 1
Хід дослідження
Техніка проведення операцій
ЛО визначалася як тотальна лапароскопічна операція (ТЛО), коли і резекція, і реконструкція травного тракту виконувалися лапароскопічно. Гепатектомія з блоковою резекцією хвостової частки і позапечінкової жовчної протоки та дисекцією реґіонарних лімфатичних вузлів застосовувалася як у лапароскопічних, так і у відкритих операціях. Розширені резекції (ліва/права трисекційна ектомія), артеріальне облямування, резекція/реконструкція судин, біліарне стентування були необхідні пацієнтам у залежності від стадії Bismuth.
Змінні та визначення
Збір даних включав демографічні, клінічні та онкологічні дані. Пацієнти були розподілені за стадіями відповідно до системи клінічного стадіювання метастазів у вузли пухлини (TNM) Національної всеосяжної онкологічної мережі (НВОМ), версія 2.2019 р., для ПХХК [14]. Місцеве поширення захворювання виражалося переважно за класифікацією Bismuth-Corlette [15]. Тривалість операції визначали як час від розрізу шкіри або встановлення троакара до повного зашиття шкіри. Інтраопераційну крововтрату (ІКВ) ретельно реєстрував анестезіолог за допомогою вакуумної системи. Реконструкцію судин визначали як будь-яке відновлення або заміну магістральних судин під час операції. Основним короткостроковим результатом у цьому дослідженні була післяопераційна тривалість перебування у стаціонарі (ППС), яка визначалася як час від операції до виписки. Пацієнти, які перебували в стаціонарі більше 30 днів або менше трьох днів, вважатимуться виключеними з дослідження. Інші короткострокові оцінки включали захворюваність і смертність, які визначалися як будь-яке ускладнення або смерть, відповідно, які сталися під час госпіталізації або протягом 90 днів після виписки. Реєстрували повторні операції протягом 30 днів, а післяопераційну захворюваність оцінювали відповідно до класифікації Clavien-Dindo (CD) [16]. Основні післяопераційні ускладнення, такі як витікання жовчі, післяопераційна кровотеча та печінкова недостатність, класифікували, як повідомлялося раніше [17,18,19]. Хірургічна невдача визначалася як тяжке ускладнення (CD ≥ III), або повторна операція під час госпіталізації, або смерть протягом 30 днів після операції.
Статистичний аналіз
Пацієнти, які перенесли ЛО, були зіставлені з пацієнтами, які перенесли ВО, у співвідношенні 1:1 на основі моделі оцінки схильності [20], де в якості коваріантів були обрані вік, ІМТ, стать, фізичний статус за ASA, CA 19-9, передопераційний Загальний білірубін, АСТ, АЛТ, альбумін, клас за Bismuth-Corlett, гепатектомія, час операції, реконструкція травного тракту, ІКВ, резекція та реконструкція судин, позитивний край, кількість лімфатичних вузлів та стадія TNM. Порівняння з найближчим сусіднім регіоном без заміни проводилося з шириною штангенциркуля, встановленою на рівні 0,2.
Неперервні дані представлені як середні значення зі стандартними відхиленнями (СВ) або медіани з інтерквартильним розмахом (ІКР) і порівнюються за допомогою t-критерію для незалежних вибірок або U-критерію Манна-Уітні. Категоріальні дані представлені у вигляді чисел і відсотків і порівнювалися за допомогою критерію хі-квадрат або точного критерію Фішера, відповідно. Логістичний регресійний аналіз використовували для визначення факторів ризику несприятливих післяопераційних ускладнень (стадія CD ≥ III). Для оцінки факторів ризику, пов’язаних з післяопераційною летальністю, використовували регресійну модель Кокса, при цьому припущення про пропорційний ризик перевіряли методом зважених незв’язок. Крім того, враховуючи, що післяопераційні ускладнення збільшують тривалість госпіталізації, для вивчення прогностичних факторів тривалості перебування в стаціонарі була використана модель Файн-Грея, в якій несприятливі післяопераційні ускладнення і смерть протягом 30 днів були конкуруючими подіями ризику. Під час регресійного аналізу безперервні змінні будуть перетворені в дві або кілька категорій фіктивних змінних відповідно до нормального діапазону. Всі статистичні процедури були проведені з використанням програмного забезпечення SAS версії 9.40 (SAS Institute, Inc., Cary, NC). Статистично значущою вважалася двостороння перевірка гіпотез із заздалегідь визначеним рівнем P < 0,05.
Результати
Учасники та вихідні характеристики
Вихідні демографічні характеристики та передопераційна супутня патологія включених 645 резекцій гістологічно підтвердженого ПХХК наведені в таблиці 1. У вихідній когорті більшість початкових характеристик були порівнянними в групах ЛО і ВО, за винятком більшої кількості пацієнтів жіночої статі (49,61% проти 40,36%; P = 0,021), кращого показника печінкової функції (нижчі рівні загального білірубіну, АСТ і АЛТ) і нижчої стадії за шкалою TNM, що спостерігалися в групі ЛО порівняно з групою ВО. Для подолання упередженості ретроспективного дослідження був проведений аналіз зіставлення балів схильності, в якому 141 пацієнт з ПХХК, що переніс ЛО, був зіставлений з 141 пацієнтом, що переніс ВО. Всі вихідні характеристики були збалансовані після УОС.
Таблиця 1 Вихідні характеристики до та після УОС
| Показники | Необроблена когорта(N = 645) | Узгоджена за оцінкою схильності когорта (N = 282) | |||||
| ЛО (n = 256) | ВО (n = 389) | P-value | ЛО (N = 141) | ВО (N = 141) | P-value | MSD | |
| Стать, Кількість (%)) | 1.000 | < 0.01 | |||||
| Чоловік | 129(50.39) | 232(59.64) | 0.021 | 86(60.99) | 86(60.99) | ||
| Жінка | 127(49.61) | 157(40.36) | 55(39.01) | 55(39.01) | |||
| Вік (років), середнє (СВ) | 62.83(9.70) | 62.10(9.17) | 0.333 | 62.55(9.15) | 63.09(9.03) | 0.624 | 0.06 |
| ІМТ (кг/см2), середнє (СВ) | 23.12(3.09) | 22.75(2.80) | 0.112 | 22.92(3.09) | 22.66(2.81) | 0.459 | 0.09 |
| Оцінка АТА, кількість (%) | 0.872 | 0.471 | 0.05 | ||||
| I | 57(22.27) | 82(21.08) | 39(27.66) | 34(24.11) | |||
| II | 156(60.94) | 245(62.98) | 77(54.61) | 87(61.70) | |||
| III | 43(16.80) | 62(15.94) | 25(17.73) | 20(14.18) | |||
| CA199 (Од/мл), медіана (ІКР) | 204.40(69.50 ~ 814.70) | 256.00(98.50 ~ 455.00) | 0.791 | 202.30(100.10 ~ 545.80) | 187.60(72.70 ~ 369.80) | 0.843 | 0.02 |
| ЗагБіліруб (мкмоль/л), медіана (ІКР) | 47.85(44.10 ~ 53.65) | 131.00(73.10 ~ 230.30) | < 0.001 | 49.70(44.70 ~ 57.30) | 60.50(28.90 ~ 108.80) | 0.798 | 0.03 |
| ЛФ (мкмоль/л), медіана (ІКР) | 362.65(216.40 ~ 451.15) | 327.00(225.00 ~ 462.00) | 0.168 | 345.00(210.00 ~ 440.00) | 269.00(189.30 ~ 424.80) | 0.856 | 0.02 |
| АСТ (мкмоль/л), медіана (ІКР) | 43.00(33.20 ~ 87.60) | 89.00(54.00 ~ 156.30) | < 0.001 | 60.60(35.50 ~ 132.00) | 74.00(46.00 ~ 119.30) | 0.909 | 0.01 |
| АЛТ (мкмоль/л), медіана (ІКР) | 59.10(30.90 ~ 133.65) | 115.30(60.00 ~ 183.90) | < 0.001 | 78.50(36.60 ~ 154.60) | 92.90(56.70 ~ 143.40) | 0.874 | 0.02 |
| Альбумін (мкмоль/л), медіана (ІКР) | 35.60(33.35 ~ 38.45) | 35.90(33.40 ~ 39.20) | 0.639 | 35.60(33.00 ~ 38.20) | 35.60(32.50 ~ 39.60) | 0.928 | 0.01 |
| Кількість лімфовузлів, медіана (ІКР) | 12.00(8.00 ~ 16.00) | 14.00(5.00 ~ 21.00) | 0.760 | 12.00(6.00 ~ 18.00) | 13.00(7.00 ~ 17.00) | 0.701 | 0.05 |
| Максимальний розмір пухлини (мм), середнє значення (СВ) | 3.03(1.35) | 2.89(1.26) | 0.167 | 2.73(1.18) | 2.83(1.29) | 0.492 | 0.08 |
| Передопераційне дренування жовчних шляхів, кількість (%) | 193(75.39) | 268(69.25) | 0.091 | 105(74.47) | 90(64.29) | 0.064 | 0.19 |
| Bismuth-Corlett Тип, Кількість (%) | 0.895 | 0.95 | 0.01 | ||||
| I | 72(28.13) | 108(27.76) | 44(31.21) | 39(27.66) | |||
| II | 63(24.61) | 85(21.85) | 24(17.02) | 23(16.31) | |||
| IIIa | 24(9.38) | 35(9.00) | 9(6.38) | 10(7.09) | |||
| IIIb | 33(12.89) | 52(13.37) | 23(16.31) | 27(19.15) | |||
| IV | 64(25.00) | 109(28.02) | 41(29.08) | 42(29.79) | |||
| TNM стадія, Кількість (%) | < 0.001 | 0.725 | 0.11 | ||||
| – | 8(3.13) | 9(2.31) | 4(2.84) | 7(4.96) | |||
| I(T1N0M0) | 25(9.77) | 66(16.97) | 22(15.60) | 23(16.31) | |||
| II(T2a/2bN0M0) | 108(42.19) | 148(38.05) | 60(42.55) | 56(39.72) | |||
| IIIA(T3N0M0) | 38(14.84) | 31(7.97) | 8(5.67) | 12(8.51) | |||
| IIIB(T4N0M0) | 30(11.72) | 25(6.43) | 7(4.96) | 11(7.80) | |||
| IVA(T, N2M0) | 34(13.28) | 80(20.57) | 30(21.28) | 23(16.31) | |||
| IVB(T,N,M1) | 13(5.08) | 30(7.71) | 10(7.09) | 9(6.38) | |||
- УОС Узгодженість оцінки схильності, ЛО Лапароскопічна операція, ВО Відкрита операція, ІМТ Індекс маси тіла, ЗагБіліруб Загальний білірубін, ЛФ Лужна фосфатаза, АСТ Аспартатамінотрансфераза, АЛТ Аланінамінотрансфераза
Періопераційні результати
Перед УОС 19 пацієнтам (7,42%) було виконано лапаротомію. Середній операційний час у групі ЛО був подібним до групи ВО (353,4 проти 342,1 хв, P = 0,176). Більше пацієнтів отримали гепатектомію в ЛО порівняно з ВО (63,67% проти 55,53%, P = 0,013), особливо більше ліву гемігепатектомію в ЛО (47,66% проти 36,76%). У групі ЛО було виконано менше гепатикоєюностомій (39,06% проти 61,44%, P < 0,0001), біліарної пластики (28,91% проти 48,84%, P < 0,001), судинної резекції (8,59% проти 23,39%, P < 0,0001) і менше гепатикоєюностомії (43,48% проти 65,48%, P < 0,0001) у порівнянні з групою ВО. Показники R0, ІКВ, частота та об’єм трансфузій, а також каудальна лобектомія були подібними між групами (табл. 2).
Таблиця 2. Інтраопераційні результати до та після УОС
| Показники | Необроблена когорта (N = 645) | Узгоджена за оцінкою схильності когорта (N = 282) | |||||
| ЛО
(N = 256) |
ВО
(N = 389) |
P-value | ЛО (N = 141) | ВО (N = 141) | P-value | MSD | |
| Конверсія на лапаротомію, кількість (%) | 19(7.42) | 0(0.00) | < 0.001* | 11(7.80) | 0(0.00) | < 0.001* | 4.86 |
| Гепатектомія, кількість (%) 0.001* | 0.076* | 0.38 | |||||
| Тільки жовчна протока | 93(36.33) | 173(44.47) | 66(46.81) | 57(40.43) | |||
| Ліва гемігепатектомія | 122(47.66) | 143(36.76) | 47(33.33) | 52(36.88) | |||
| Права гемігепатектомія | 19(7.42) | 57(14.65) | 12(8.51) | 25(17.73) | |||
| Ліва сегментектомія | 4(1.56) | 3(0.77) | 2(1.42) | 1(0.71) | |||
| Права сегментектомія | 6(2.34) | 2(0.51) | 5(3.55) | 1(0.71) | |||
| Жовчна протока та частина гепатектомії | 12(4.69) | 11(2.83) | 9(6.38) | 5(3.55) | |||
| Тривалість операції (хв), середнє значення (СВ) | 353.39(113.71) | 342.10(96.52) | 0.176 | 359.45(105.47) | 342.43(92.42) | 0.151 | 0.09 |
| Кількість лімфатичних вузлів, середнє значення (СВ) | 12(4.06) | 10(3.24) | 0.213 | 12(5.12) | 11(4.31) | 0.542 | 0.08 |
| Резекція судин, кількість (%) | < 0.001* | < 0.001* | 0.53 | ||||
| Жодної | 234(91.41) | 298(76.61) | 126(89.36) | 110(78.01) | |||
| Печінкова артерія | 13(5.08) | 23(5.91) | 11(7.80) | 8(5.67) | |||
| Портальна вена | 8(3.13) | 14(3.60) | 3(2.13) | 3(2.13) | |||
| Печінкова артерія та ворітна вена | 1(0.39) | 54(13.88) | 1(0.71) | 20(14.18) | |||
| Біліарна пластика, кількість(%) | 74(28.91) | 190(48.84) | < 0.001 | 61 (43.3) | 74 (52.5) | 0.153 | 0.11 |
| Реконструкція жовчовивідних шляхів, кількість (%) | < 0.001 | < 0.001 | 0.41 | ||||
| Холедохоєюностомія | 130(56.52) | 126(34.52) | 68(52.71) | 40(30.77) | |||
| Гепатикоєюностомія | 100(43.48) | 239(65.48) | 61(47.29) | 90(69.23) | |||
| Каудальна лобектомія, кількість (%) | 138(54.12) | 220(56.70) | 0.519 | 85(60.71) | 82(58.57) | 0.715 | 0.05 |
| ІКВ (мл), медіана (ІКР) | 200.00(100.00 ~ 500.00) | 300.00(200.00 ~ 500.00) | 0.685 | 300.00(150.00 ~ 500.00) | 300.00(150.00 ~ 500.00) | 0.573 | 0.07 |
| Переливання крові під час операції, кількість (%) | 80(31.25) | 150(38.56) | 0.0579 | 47(33.33) | 52(36.88) | 0.533 | 0.07 |
| Об’єм перелитої крові (мл), медіана (ІКР) | 0.00(0.00 ~ 600.00) | 0.00(0.00 ~ 750.00) | 0.9535 | 0.00(0.00 ~ 600.00) | 0.00(0.00 ~ 600.00) | 0.680 | 0.07 |
| R0, No. (%) | 218(85.16) | 341(87.66) | 0.360 | 115(81.56) | 119(84.40) | 0.526 | 0.08 |
- УОС Узгодженість оцінки схильності, ЛО Лапароскопічна операція, ВО Відкрита операція, ІКВ Інтраопераційна крововтрата
- *Точний тест Фішера
Не було достовірних відмінностей щодо загальних післяопераційних ускладнень між двома групами, за винятком серцевої недостатності (0,78% проти 3,60%, P = 0,0244) та тяжких ускладнень у групі ЛО (12,11% проти 22,88%, P = 0,0006). Пацієнти в групі ЛО потребували коротшої післяопераційної тривалості утримання дренажної трубки (ПТУД) (медіана [ІКР], 8.00 [5.00 ~ 11.00] проти 9.00 [6.00 ~ 14.00], P < 0.0001) та післяопераційного ППС (медіана [ІКР], 13.00 [10.00 ~ 18.00] проти 15.00 [12.00 ~ 23.00], P < 0.0001), ніж пацієнти в групі ВО. Не було достовірної різниці щодо частоти повторних операцій або смерті протягом 30 або 90 днів. Подібна частота деяких найпоширеніших післяопераційних ускладнень між двома хірургічними групами все ще була порівнянною в зіставленій когорті (Таблиця 3).
Таблиця 3 Післяопераційні результати відповідно до різного рівня ІМТ до та після УОС
| Показники | Необроблена когорта (N = 645) | Узгоджена за оцінкою схильності когорта (N = 282) | |||||
| ЛО (n = 256) | ВО (n = 389) | P-value * | ЛО (N = 141) | ВО (N = 141) | P-value * | ||
| Серйозні ускладнення, кількість (%) | |||||||
| Кровотеча | 17(6.64) | 19(4.88) | 0.342 | 10(7.09) | 5(3.55) | 0.185 | |
| Жовчна нориця | 19(7.42) | 29(7.46) | 0.988 | 14(9.93) | 7(4.96) | 0.112 | |
| Абсцес черевної порожнини | 20(7.81) | 47(12.08) | 0.082 | 17(12.06) | 17(12.06) | > 0.999* | |
| Печінкова недостатність | 3(1.17) | 9(2.31) | 0.294 | 2(1.42) | 4(2.84) | 0.684* | |
| Шлунково-кишкова нориця | 1(0.39) | 4(1.03) | 0.653 | 1(0.71) | 4(2.84) | 0.371* | |
| Інфекція розрізу | 4(1.56) | 16(4.11) | 0.068 | 3(2.13) | 8(5.67) | 0.124 | |
| Пневмонія | 16(6.25) | 28(7.20) | 0.640 | 12(8.51) | 9(6.38) | 0.496 | |
| Ниркова недостатність | 3(1.17) | 10(2.57) | 0.216 | 3(2.13) | 5(3.55) | 0.723* | |
| Серцева недостатність | 2(0.78) | 14(3.60) | 0.024 | 2(1.42) | 3(2.13) | > 0.99* | |
| ГРДС | 3(1.17) | 9(2.31) | 0.294 | 3(2.13) | 3(2.13) | > 0.99* | |
| CD стадія ≥ III, кількість (%) | 31(12.11) | 89(22.88) | 0.001 | 26(18.44) | 32(22.70) | 0.377 | |
| Повторні операції, кількість (%) | 5(1.95) | 7(1.80) | 0.888 | 4(2.84) | 4(2.84) | > 0.99* | |
| Смерть (30 днів), кількість (%) | 8(3.13) | 24(6.17) | 0.082 | 7(4.96) | 12(8.51) | 0.235 | |
| Смерть (90д), кількість (%) | 12(4.69) | 34(8.74) | 0.050 | 9(6.38) | 15(10.64) | 0.200 | |
| Час позаліжкової активності (d), медіана (ІКР) | 4.00(3.00 ~ 7.00) | 5.00(3.00 ~ 7.00) | 0.406 | 4.00(3.00 ~ 7.00) | 4.00(3.00 ~ 6.00) | 0.649 | |
| ПТУД (d), медіана(ІКР) | 8.00(5.00 ~ 11.00) | 9.00(6.00 ~ 14.00) | < 0.001 | 8.00(5.00 ~ 12.00) | 9.00(5.00 ~ 13.00) | 0.225 | |
| Час перебування у відділенні інтенсивної терапії (d), медіана (ІКР) | 0.00(0.00 ~ 2.00) | 0.00(0.00 ~ 1.00) | 0.137 | 0.00(0.00 ~ 1.00) | 0.00(0.00 ~ 1.00) | 0.762 | |
| ППС (d), медіана (ІКР) | 13.00(10.00 ~ 18.00) | 15.00(12.00 ~ 21.00) | < 0.001 | 14.00(11.00 ~ 19.00) | 15.00(12.00 ~ 23.00) | 0.001 | |
- УОС Узгодженість оцінки схильності, ЛО Лапароскопічна операція, ВО Відкрита операція, ГРДС Гострий респіраторний дистрес-синдром, CD Clavien-Dindo, ПТУД Післяопераційна ривалість утримання дренажної трубки, ППС Післяопераційна тривалість перебування у стаціонарі
- *Точний тест Фішера
Післяопераційні результати в залежності від класу за Bismuth
У цьому дослідженні 328 пацієнтів з ПХХК мали низький тип за (Bismuth I/II) і 317 – високий тип за Bismuth (Bismuth III/V), з істотно різними хірургічними характеристиками і післяопераційними короткостроковими результатами. Медіана ППС була значно коротшою при низькому типі за Bismuth (15 днів; 95% ДІ, 14 ~ 16), ніж при високому типі за Bismuth (18 днів; 95% ДІ, 17 ~ 20, P < 0,0001). Крім того, у пацієнтів з I-II типами за Bismuth спостерігалися коротші ППС і ПТУД, а також менша кількість трансфузій під час операції у пацієнтів, які перенесли ЛО, порівняно з тими, які перенесли ВО, при цьому інші післяопераційні ускладнення були співставними в обох групах. Серед пацієнтів з III-V типом за Bismuth, яким було виконано ЛО, показали порівнянні або кращі короткострокові результати, ніж група ВО, такі як менша загальна кількість післяопераційних ускладнень (39(32,23)86(43,88), P = 0,0393), менша тривалість перебування в стаціонарі (середня кількість днів, 14 проти 17 днів) і нижча частота тяжких ускладнень (10,74% проти 26,02%), що демонструє гарантовану безпеку лапароскопічної резекції при вищих типах ПХХК за Bismuth. Крім того, в групі ЛО спостерігали достовірно меншу кількість судинних резекцій та біліарної пластики.
Аналіз підгруп щодо невдач хірургічного втручання та ППС
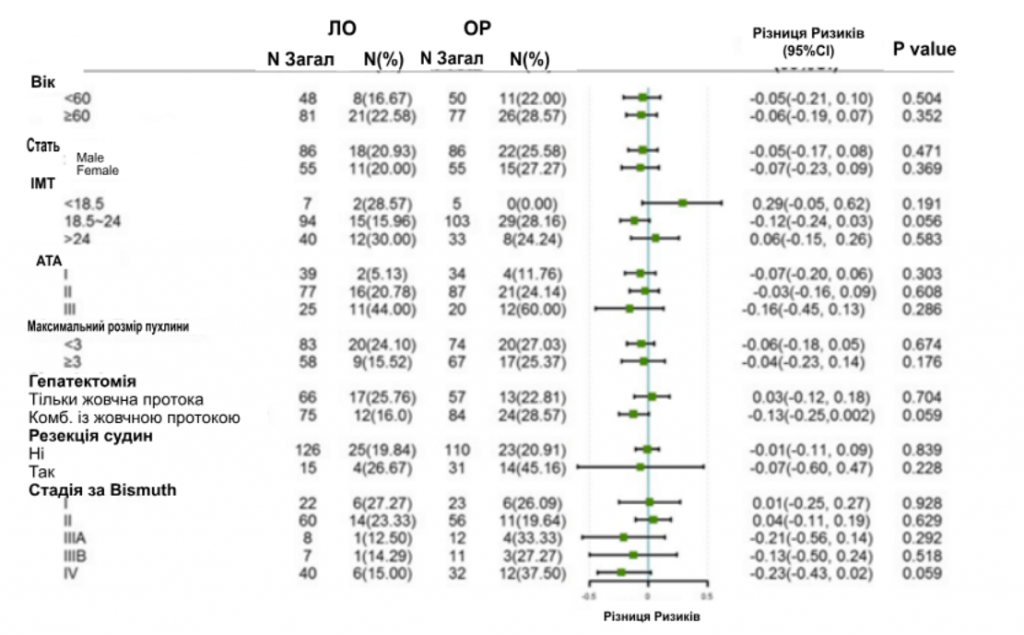
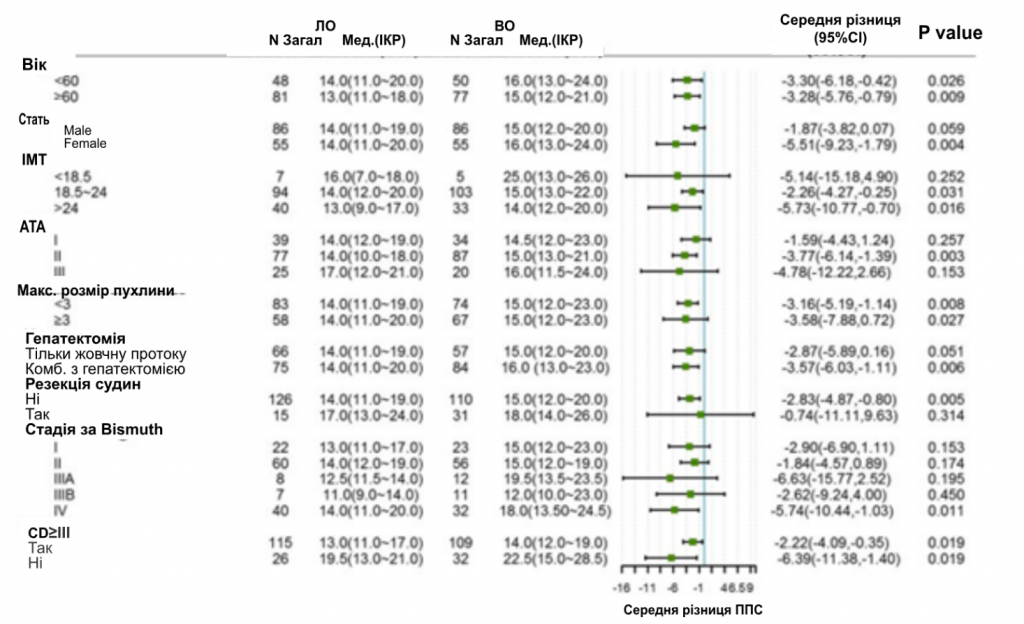
Аналіз підгруп щодо невдач хірургічного втручання та ППС проводили за віком, статтю, рівнем ІМТ, показником Американського Товариства Анастезіологів (АТА), розміром пухлини, гепатектомією, судинною резекцією та стадією за Bismuth. Після УОС частота хірургічних невдач була подібною в групі ЛО порівняно з групою ВО в цілому (4,30% проти 7,20%, P = 0,131) і в усіх підгрупах (зобр. 2). Однак аналіз підгруп щодо ППС показав, що для швидкого одужання пацієнтам, незалежно від віку, розміру пухлини та тяжких післяопераційних ускладнень, буде ефективною ЛО для швидкого одужання. Інші пацієнти, такі як ті, що мали недостатню вагу, I або III ступінь за шкалою АТА або перенесли резекцію судин, мали співставні показники ППС в групі ЛО і ВО (зобр. 3).
Зображення 2
Лісова діаграма аналізу підгруп щодо хірургічної невдачі. Хірургічна невдача визначалася як тяжке ускладнення (CD ≥ III), або повторна операція під час госпіталізації, або смерть протягом 30 днів після операції.
Зображення 3
Лісова діаграма аналізу підгруп за тривалістю перебування у стаціонарі
Аналіз ризику несприятливого хірургічного результату та тривалості перебування в стаціонарі
Аналіз ризику показав, чим вищий бал АТА, більша інтраопераційна крововтрата та більша кількість судинних реконструкцій були виявлені незалежними факторами ризику післяопераційних ускладнень як серед зіставлених, так і серед незіставлених вибірок (скориговане відношення шансів (СВШ) > 1, P < 0,05 для всіх) (Таблиця 4). Крім того, ми виявили, що ВО, вищий рівень CA19-9, а також деякі поширені післяопераційні ускладнення та повторна операція були пов’язані з більшою тривалістю ППС після коригування інших коваріатів у зіставленій когорті (табл. 5).
Таблиця 4 Аналіз факторів ризику післяопераційних несприятливих наслідків за даними одновимірного та багатовимірного аналізу з використанням необробленої та зіставленої когорти
| Фактори ризику | Необроблена когорта | Узгоджена за оцінкою схильності когорта | ||||||
| Однофакторний аналіз | Багатофакторний аналіз | Однофакторний аналіз | Багатофакторний аналіз | |||||
| ВР
(95%ДІ) |
P value | ВР
(95%ДІ) |
P value | ВР
(95%ДІ) |
P value | ВР
(95%ДІ) |
P value | |
| Вид доступу | ||||||||
| ЛО | Реф | Реф | ||||||
| ВО | 1.68(1.20,2.35) | 0.002 | 0.97(0.60,1.56) | 0.904 | ||||
| Жінка | 0.79(0.57,1.08) | 0.141 | 1.07(0.66,1.75) | 0.776 | ||||
| Вік ≥ 60 р | 0.95(0.68,1.34) | 0.780 | 0.77(0.47,1.27) | 0.305 | ||||
| ІМТ ,кг/см2 | ||||||||
| 18.5 | Реф | Реф | ||||||
| 18.5 ~ 24 | 0.72(0.32,1.64) | 0.436 | 2.09(0.64,6.82) | 0.221 | ||||
| > 24 | 0.79(0.55,1.13) | 0.195 | 0.98(0.57,1.70) | 0.955 | ||||
| АТА | ||||||||
| I | Реф | Реф | Реф | Реф | ||||
| II | 1.88(1.22,2.89) | 0.004 | 1.938(1.203,3.121) | 0.007 | 1.75(0.97,3.18) | 0.064 | 2.36(1.23,4.53) | 0.010 |
| III | 2.41(1.40,4.13) | 0.001 | 2.578(1.388,4.788) | 0.003 | 3.39(1.56,7.38) | 0.002 | 5.11(2.15,12.17) | < 0.001 |
| Розмір пухлини > 3 см | 0.67(0.48,0.95) | 0.025 | 0.88(0.51,1.49) | 0.624 | ||||
| Позитивні лімфовузли≥ 1 | 1.20(0.85,1.70) | 0.295 | 1.25(0.74,2.10) | 0.402 | ||||
| Лімфовузли > 8 | 1.56(1.09,2.23) | 0.016 | 1.16(0.68,1.98) | 0.584 | ||||
| Післяопераційний Загбіліруб > 85,5 мкмоль/л | 1.58(1.146,2.18) | 0.005 | 1.68(0.99,2.85) | 0.053 | ||||
| Передопераційний рівень АСТ > 40 мкмоль/л | 2.20(1.50,3.23) | < .0001 | 1.97(1.10, 3.54) | 0.023 | ||||
| Передопераційна АЛТ > 40 мкмоль/л | 2.12(1.42,3.18) | 0.0003 | 1.75(0.96,3.20) | 0.068 | ||||
| CA199, Од/мл | ||||||||
| ≤ 50 | Реф | Реф | ||||||
| 50 ~ 400 | 1.38(0.88,2.19) | 0.164 | 0.98(0.49,1.94) | 0.944 | ||||
| ≥ 400 | 1.45(0.89,2.36) | 0.137 | 1.11(0.51,2.41) | 0.788 | ||||
| Тривалість операції, хв | ||||||||
| ≤ 200 | Реф | Реф | ||||||
| 200 ~ 400 | 1.35(0.75,2.42) | 0.315 | 2.22(0.90,5.47) | 0.082 | ||||
| ≥ 400 | 2.11(1.13,3.96) | 0.020 | 2.66(1.01,7.01) | 0.048 | ||||
| ІКВ, мл | ||||||||
| ≤ 100 | Реф | Реф | Реф | Реф | ||||
| 100 ~ 500 | 2.45(1.58,3.80) | < .0001 | 2.23(1.40,3.55) | < 0.001 | 2.45(1.27,4.72) | 0.008 | 2.28(1.14,4.54) | 0.019 |
| ≥ 500 | 3.41(2.15,5.42) | < .0001 | 2.75(1.64,4.62) | < 0.001 | 2.33(1.17,4.62) | 0.016 | 1.54(0.74,3.21) | 0.254 |
| Переливання крові під час операції | 2.00(1.44,2.78) | < .0001 | 1.43(0.87,2.35) | 0.154 | ||||
| Гепатектомія | ||||||||
| Тільки жовчна протока | Реф | Реф | ||||||
| Ліва гемігепатектомія | 0.80(0.56,1.14 | 0.212 | 0.49(0.32,0.74) | < 0.001 | 1.06(0.617,1.82) | 0.835 | ||
| Права гемігепатектомія | 2.36(1.40,3.96) | 0.001 | 1.02(0.54,1.92) | 0.955 | 1.33(0.633,2.79) | 0.453 | ||
| Ліва сегментектомія | 4.29(0.82,22.51) | 0.086 | 4.06(0.66,25.02) | 0.131 | 3.13(0.28,35.41) | 0.358 | ||
| Права сегментектомія | 1.71(0.42,7.01) | 0.453 | 1.46(0.34,6.22) | 0.613 | 1.56(0.30,8.06) | 0.594 | ||
| Жовчна протока та частково гепатектомія | 0.91(0.37,2.23) | 0.844 | 1.37(0.47,4.11) | 0.576 | 0.87(0.27,2.75) | 0.810 | ||
| Перехід до лапаротомії | 1.21(0.48,3.05) | 0.686 | 1.78(0.53,5.99) | 0.349 | ||||
| Резекція судин | ||||||||
| Жодної | Реф | Реф | ||||||
| Печінкова артерія | 1.30(0.65,2.60) | 0.461 | 1.35(0.65,2.82) | 0.419 | 1.00(0.38,2.63) | 0.999 | ||
| Портальна вена | 2.95(1.24,7.03) | 0.015 | 1.97(0.71,5.49) | 0.196 | 8.56(0.98,74.49) | 0.052 | ||
| Печінкова артерія та ворітна вена | 5.97(3.17,11.25) | < .0001 | 3.47(1.70,7.07) | < 0.001 | 5.48(1.94,15.48) | 0.003 | ||
| Реконструкція судин | 3.28(1.44,7.49) | 0.005 | 12.41(1.53,100.65) | 0.013 | 13.18(1.53,113.89) | 0.019 | ||
| Реконструкція травної системи | ||||||||
| Холедохоєюностомія | Реф | Реф | Реф | |||||
| Гепатикоєюностомія | 2.01(1.43,2.82) | < .0001 | 1.81(1.22,2.70) | 0.004 | 1.80(1.08,2.99) | 0.024 | 2.13(1.21,3.75) | 0.009 |
| Пластика жовчовивідних шляхів | 1.33(0.96,1.84) | 0.082 | 0.84(0.52,1.35) | 0.459 | ||||
| TNM стадія | ||||||||
| I(T1N0M0) | Реф | Реф | ||||||
| II(T2a/2bN0M0) | 0.78(0.48,1.28) | 0.325 | 0.84(0.42,1.69) | 0.617 | ||||
| IIIA(T3N0M0) | 0.84(0.44,1.60) | 0.602 | 1.67(0.58,4.83) | 0.342 | ||||
| IIIB(T4N0M0) | 0.62(0.31,1.27) | 0.191 | 1.10(0.36,3.30) | 0.872 | ||||
| IVA(T, N2M0) | 1.01(0.58,1.77) | 0.960 | 1.05(0.47,2.34) | 0.907 | ||||
| IVB(T,N,M1) | 0.91(0.44,1.91) | 0.807 | 0.80(0.27,2.41) | 0.689 | ||||
- УОС Узгодженість оцінки схильності, ЛО Лапароскопічна операція, ВО Відкрита операція, ІМТ Індекс маси тіла, ЗагБіліруб Загальний білірубін, ЛФ Лужна фосфатаза, АСТ Аспартатамінотрансфераза, АЛТ Аланінамінотрансфераза, ІКВ інтраопераційна крововтрата, ГРДС гострий респіраторний дистрес синдром.Таблиця 5 Аналіз моделі пропорційного ризику Кокса щодо тривалості перебування з використанням необробленої когорти та зіставленої когорт
| Фактори ризику | Необроблена когорта | Узгоджена за оцінкою схильності когорта | ||||||
| Однофакторний аналіз | Мультифакторний аналіз | Однофакторний аналіз | Мультифакторний аналіз | |||||
| ВР(95%ДІ) | P value | ВР(95%ДІ) | P value | ВР(95%ДІ) | P value | ВР(95%ДІ) | P value | |
| Вид доступу | ||||||||
| ЛО | Реф | Реф | Реф | Реф | ||||
| ВО | 0.67(0.57,0.80) | < .0001 | 0.74(0.61,0.90) | 0.002 | 0.66(0.51,0.85) | 0.001 | 0.58(0.45,0.75) | < .0001 |
| Жінка | 1.08(0.91,1.27) | 0.378 | 0.83(0.64,1.07) | 0.147 | ||||
| Вік ≥ 60р | 1.11(0.94,1.32) | 0.228 | 1.10(0.85,1.43) | 0.465 | ||||
| ІМТ | ||||||||
| 18.5 | Реф | Реф | ||||||
| 18.5 ~ 24 | 1.39(0.93,2.06) | 0.108 | 0.84(0.44,1.59) | 0.584 | ||||
| > 24 | 1.07(0.89,1.29) | 0.480 | 1.14(0.86,1.52) | 0.360 | ||||
| АТА | ||||||||
| I | Реф | Реф | ||||||
| II | 0.91(0.74,1.11) | 0.347 | 0.91(0.68,1.20) | 0.494 | ||||
| III | 0.81(0.62,1.06) | 0.131 | 0.73(0.49,1.09) | 0.120 | ||||
| CA199, ОД/мл | ||||||||
| ≤ 50 | Реф | Реф | Реф | Реф | ||||
| 50 ~ 400 | 0.57(0.46,0.72) | < .0001 | 0.60(0.47,0.76) | < .0001 | 0.67(0.48,0.95) | 0.025 | 0.455(0.315,0.658) | < .0001 |
| ≥ 400 | 0.64(0.50,0.81) | 0.001 | 0.59(0.450,0.77) | < .0001 | 0.75(0.50,1.11) | 0.144 | 0.424(0.279,0.645) | < .0001 |
| Розмір пухлини > 3 см | 1.12(0.94,1.33) | 0.214 | 1.01(0.76,1.33) | 0.963 | ||||
| Лімфовузли> 8 | 0.91(0.75,1.09) | 0.292 | 1.03(0.78,1.36) | 0.855 | ||||
| Передопераційний ЗагБіліруб > 85,5 мкмоль/л | 0.85(0.73,1.01) | 0.057 | 0.77(0.58,1.02) | 0.064 | ||||
| Передопераційний рівень АСТ > 40 мкмоль/л | 0.69(0.58,0.83) | < .0001 | 0.83(0.62,1.11) | 0.208 | ||||
| Передопераційна АЛТ > 40 мкмоль/л | 0.59(0.48,0.71) | < .0001 | 0.74(0.59,0.91) | 0.005 | 0.62(0.46,0.84) | 0.002 | ||
| CA199, ОД/мл | ||||||||
| ≤ 50 | Реф | Реф | Реф | Реф | ||||
| 50 ~ 400 | 0.57(0.46,0.72) | < .0001 | 0.60(0.47,0.76) | < .0001 | 0.67(0.48,0.95) | 0.025 | 0.46(0.32,0.66) | < .0001 |
| ≥ 400 | 0.64(0.50,0.81) | < .0001 | 0.59(0.45,0.77) | < .0001 | 0.75(0.50,1.11) | 0.144 | 0.42(0.28,0.65) | < .0001 |
| Тривалість операції, хв | ||||||||
| ≤ 200 | Реф | Реф | ||||||
| 200 ~ 400 | 1.13(0.84,1.51) | 0.428 | 1.23(0.79,1.91) | 0.353 | ||||
| ≥ 400 | 0.94(0.68,1.29) | 0.683 | 1.20(0.75,1.93) | 0.446 | ||||
| ІКВ, мл | ||||||||
| ≤ 100 | Реф | Реф | ||||||
| 100 ~ 500 | 0.75(0.62,0.92) | 0.004 | 0.95(0.77,1.17) | 0.625 | 0.90(0.66,1.23) | 0.523 | ||
| ≥ 500 | 0.49(0.39,0.61) | < .0001 | 0.54(0.42,0.69) | < .0001 | 0.66(0.47,0.91) | 0.013 | ||
| Переливання крові під час операції | ||||||||
| Гепатектомія | ||||||||
| Тільки жовчна протока | Реф | Реф | ||||||
| Ліва гемігепатектомія | 1.16(0.97,1.39) | 0.100 | 1.26(1.02,1.55) | 0.029 | 1.02(0.77,1.35) | 0.909 | ||
| Права гемігепатектомія | 0.57(0.43,0.75) | < .0001 | 0.78(0.57,1.05) | 0.104 | 0.72(0.49,1.07) | 0.102 | ||
| Ліва сегментектомія | 0.73(0.32,1.64) | 0.444 | 1.06(0.45,2.47) | 0.895 | 0.81(0.25,2.55) | 0.712 | ||
| Права сегментектомія | 0.73(0.34,1.54) | 0.403 | 0.88(0.38,2.02) | 0.761 | 0.64(0.26,1.58) | 0.336 | ||
| Жовчна протока та частина гепатектомії | 0.67(0.41,1.08) | 0.098 | 0.78(0.45,1.37) | 0.390 | 0.86(0.47,1.56) | 0.618 | ||
| Перехід до лапаротомії | 0.80(0.50,1.28) | 0.351 | 0.79(0.43,1.44) | 0.440 | ||||
| Резекція судин | ||||||||
| Жодної | Реф | Реф | ||||||
| Печінкова артерія | 0.74(0.52,1.06) | 0.101 | 0.79(0.48,1.29) | 0.342 | ||||
| Портальна вена | 0.71(0.46,1.10) | 0.127 | 0.54(0.24,1.22) | 0.138 | ||||
| Печінкова артерія та ворітна вена | 0.44(0.32,0.61) | < .0001 | 0.49(0.29,0.81) | 0.006 | ||||
| Реконструкція судин | 0.74(0.50,1.11) | 0.141 | 0.58(0.30,1.12) | 0.105 | ||||
| Реконструкція травної системи | ||||||||
| Холедохоєюностомія | Реф | Реф | ||||||
| Гепатикоєюностомія | 0.69(0.58,0.82) | < .0001 | 0.808(0.662,0.986) | 0.035 | 0.75(0.58,0.98) | 0.034 | ||
| Пластика жовчовивідних шляхів | 0.93(0.79,1.10) | 0.377 | 1.02(0.80,1.308) | 0.868 | ||||
| TNM | ||||||||
| I(T1N0M0) | Реф | Реф | Реф | |||||
| II(T2a/2bN0M0) | 0.94(0.73,1.21) | 0.636 | 1.04(0.80,1.36) | 0.777 | 0.97(0.67,1.39) | 0.851 | ||
| IIIA(T3N0M0) | 0.82(0.59,1.14) | 0.238 | 0.95(0.66,1.36) | 0.761 | 0.88(0.511,1.53) | 0.655 | ||
| IIIB(T4N0M0) | 1.43(1.01,2.03) | 0.047 | 2.40(1.62,3.55) | < .0001 | 1.29(0.72,2.31) | 0.388 | ||
| IVA(T, N2M0) | 0.80(0.60,1.06) | 0.119 | 1.13(0.83,1.54) | 0.444 | 0.82(0.53,1.24) | 0.343 | ||
| IVB(T,N,M1) | 0.95(0.65,1.38) | 0.788 | 1.09(0.74,1.62) | 0.665 | 0.83(0.47,1.48) | 0.534 | ||
| Абсцес черевної порожнини | 0.44(0.33,0.59) | < .0001 | 0.46(0.34,0.62) | < .0001 | 0.47(0.31,0.70) | 0.0002 | 0.41(0.27,0.63) | < .0001 |
| Кровотеча | 0.44(0.29,0.67) | < .0001 | 0.39(0.26,0.61) | < .0001 | 0.50(0.28,0.92) | 0.027 | 0.33(0.18,0.63) | 0.0007 |
| Жовчна нориця | 0.49(0.35,0.68) | < .0001 | 0.50(0.36,0.71) | < .0001 | 0.64(0.39,1.04) | 0.074 | 0.54(0.33,0.89) | 0.016 |
| Серцева недостатність | 0.46(0.25,0.86) | 0.016 | 0.26(0.13,0.51) | < .0001 | 0.39(0.14,1.05) | 0.061 | 0.18(0.07,0.50) | 0.001 |
| Інфекція розрізу | 0.31(0.17,0.54) | < .0001 | 0.37(0.21,0.66) | 0.001 | 0.39(0.19,0.80) | 0.009 | ||
| Пневмонія | 0.49(0.35,0.69) | < .0001 | 0.49(0.34,0.71) | < .0001 | 0.67(0.41,1.09) | 0.105 | ||
| ГРДС | 0.36(0.17,0.75) | 0.007 | 0.45(0.17,1.20) | 0.109 | ||||
| Печінкова недостатність | 0.37(0.18,0.79) | 0.010 | 0.38(0.12,1.17) | 0.092 | ||||
| Повторна операція | 0.25(0.10,0.61) | 0.002 | 0.21(0.07,0.65) | 0.007 | 0.308(0.10,0.98) | 0.046 | ||
| Ниркова недостатність | 0.28(0.12,0.69) | 0.005 | 0.29(0.09,0.90) | 0.032 | ||||
УОС Узгодженість оцінки схильності, ЛО Лапароскопічна операція, ВО Відкрита операція, ІМТ Індекс маси тіла, ЗагБіліруб Загальний білірубін, ЛФ Лужна фосфатаза, АСТ Аспартатамінотрансфераза, АЛТ Аланінамінотрансфераза, ІКВ інтраопераційна крововтрата, ГРДС гострий респіраторний дистрес синдром.
Крім того, для подальшого дослідження зв’язку між хірургічними методами та ППС було застосовано модель Fine Gray, де післяопераційні ускладнення, повторні операції під час госпіталізації або смерть впродовж 30 днів після операції були визначені як конкуруючі події при аналізі ППС. Після коригування конкуруючих ризиків було виявлено, що відкрите хірургічне втручання є незалежним фактором ризику збільшення тривалості ППС як у неспівставленому, так і в співставленому аналізі.
Обговорення
Короткострокові результати цього ретроспективного дослідження показали, що ЛО має перевагу в показниках ППС і відновлення функцій, таких як післяопераційна тривалість утримання дренажної трубки, порівняно з ВО у пацієнтів з ПХХК. Більше того, показники смертності, частоти післяопераційних ускладнень та онкологічних результатів суттєво не відрізнялися між двома хірургічними методами. Це найбільше на сьогоднішній день дослідження реальних даних щодо порівняння ЛО та ВО при ПХХК. Вони показали, що ЛО, хоча і є складним, але здійсненним і безпечним методом для пацієнтів з ПХХК. Ми також провели УОС, щоб усунути потенційні упередження, і виявили, що група ЛО була сприятливою для післяопераційного функціонального відновлення, без відмінностей в ускладненнях і смертності в порівнянні з групою ВО. Багатофакторний аналіз також підтвердив, що ЛО є безпечною щодо періопераційних ускладнень і може значно скоротити післяопераційний ППС.
Хоча кілька кумулятивних доказів з мета-аналізом показали застосування ЛО при ПХХК [21,22,23,24], ця методика все ще обмежена меншістю висококваліфікованих хірургів і спеціалізованих установ, а також відсутністю великих вибіркових багатоцентрових доказів. ЛО застосовується для всіх типів пухлин за Bismuth-Corlette, хоча переважно використовується у пацієнтів з пухлинами з низькими стадіях [25,26,27]. Bismuth III-IV становили 47,26% у цьому дослідженні, і в групі ЛО порівняно з групою ВО у цій вибірці також було виявлено однакову безпеку і краще післяопераційне відновлення, що відображається коротшими ППС і ПТУД. Крім того, доцільність лапароскопічного підходу підтверджується частотою конверсії (19/256 випадків, 7,4% до У; і 11/141 випадок, 7,8% після УОС), яка була значно нижчою, ніж загалом повідомлялося про операції з приводу ПХХК [28], а також нижчою при великих гепатектоміях [29, 30]. Насправді, хоча хірургічне лікування ПХХК передбачає технічні складності зв’язані з портальною інфільтрацією, артеріальним обволіканням або інфільтрацією жовчних проток, потреби в ургентній конверсії виявляють відносно рідко. Оскільки операційне поле легко доступне для огляду оператору, а отже, деякі оперативні процедури з високим ступенем технічної складності були більш контрольованими при лапароскопії.
На сьогоднішній день лише ретроспективні дослідження з невеликим розміром вибірки повідомляють про періопераційні результати ЛО та ВО при ПХХК. Ефективність і безпека ЛО при ПХХК є значною мірою суперечливою [11, 12, 31, 32]. Єдине порівняльне дослідження, проведене Xu зі співавторами, показало, що роботизована резекція несприятливо порівнювалася з традиційною відкритою резекцією за тривалістю часу операції. Не було виявлено суттєвої різниці в показниках крововтрати, смертності або тривалості післяопераційного перебування в стаціонарі. У той час як витрати на госпіталізацію були набагато вищими в роботизованих групах, виживаність без рецидиву пухлини була нижчою [33]. Дослідження, що узагальнило серію лапароскопічних операцій, показало, що в групі ЛО була значно менша крововтрата, менше інтраопераційних і післяопераційних переливань крові і коротший ППС. Як загальна захворюваність, так і захворюваність, пов’язана з лімфаденектомією, була нижчою в групі ЛО [34]. У цьому дослідженні не було достовірних відмінностей у тривалості операції, ІКВ, післяопераційних ускладненнях або смертності між двома групами, але в групі ЛО спостерігалася менша тривалість ППС. Крім того, хірургічні методи, незалежно від того, відкриті вони чи лапароскопічні, не були пов’язані з несприятливими післяопераційними ускладненнями як у порівнюваних, так і в непорівнянних вибірках. Крім того, в однофакторному аналізі ЛО була більш протективним чинником щодо несприятливих післяопераційних ускладнень, ніж ВО. Ці дані продемонстрували, що ЛО є безпечним і доцільним для пацієнтів з ПХХК.
Найважливішою потенційною перевагою ЛО є більш широке застосування післяопераційних шляхів функціонального відновлення і скорочення терміну перебування в лікарні [35]. Методика ЛО може забезпечити функціональне відновлення не тільки після простих операцій, таких як ЛХЕ герніорафія, але і після складних операцій, таких як ЛПДЕ, лапароскопічна гепатектомія або лапароскопічна гастректомія [36,37,38,39]. У нашому дослідженні спостерігався протективний ефект ЛО щодо скорочення ППС з урахуванням або без урахування післяопераційних ускладнень, які є конкуруючими факторами ризику. Періопераційні ускладнення потенційно можуть впливати на оцінку короткострокового результату при наявності подій, що загрожують життю, і, таким чином, на оцінку чистого кумулятивного ефекту ЛО у скороченні ППС. Нехтування існуванням цих конкуруючих подій ризику призведе до неточних розрахунків кумулятивної частоти виписки при використанні класичних методів аналізу виживання [40, 41]. До цього часу лише в небагатьох дослідженнях розглядалося використання моделі Файн-Грея для вивчення післяопераційних переваг ЛО. УОС був ще одним статистичним методом для контролю упередженості в цьому дослідженні. Він був запропонований як метод подолання упередженості відбору та підвищення рівня доказовості в обсерваційних та рандомізованих дослідженнях [42, 43]. У цьому дослідженні ми продемонстрували, що в групі ЛО менше гепатикоєюностомії, менше судинних резекцій, коротший ППС і тенденція до меншої кількості тяжких ускладнень (стадія CD ≥ III) порівняно з групою ВО до і після УОС. Результати показали, що ЛО може достовірно скоротити термін перебування в стаціонарі та забезпечити переваги щодо післяопераційного функціонального відновлення у пацієнтів з ПХХК.
Крім того, ми виявили, що високий бал за шкалою АТА, більша інтраопераційна крововтрата та гепатикоєюностомія є постійними факторами ризику несприятливого хірургічного результату. Крім того, більша інтраопераційна крововтрата була визначена як фактор ризику для збільшення ППС як в моделі загального ризику, так і в моделі конкуруючого ризику. Ці результати вказують на те, що кращий передопераційний стан і менша інтраопераційна крововтрата асоціюються з кращим короткостроковим прогнозом у пацієнтів з ПХХК. Під час хірургічного лікування ПХХК більшість технічних складнощів пов’язані з лікуванням портальної інфільтрації, або обволіканням артерії пухлинною тканиною, або інфільтрації вздовж жовчних проток. Разом з тим, ці стани і пов’язані з ними ризики пошкодження судин, як правило, краще піддаються лікуванню при лапароскопії, оскільки операційне поле є легкодоступним і знаходиться в полі зору оператора, а кровотеча може бути зупинена за допомогою тимчасового затискача, якщо виникла екстрена ситуація. Таким чином, ЛО краще підходить для зупинки інтраопераційних кровотеч, що потенційно може принести користь для короткострокового результату, як нещодавно повідомлялося [28, 44]. Передопераційний стан пацієнта є найбільш важливим питанням при призначенні хірургічного втручання. Відбір пацієнтів є поширеним явищем у клінічній практиці, а також ключовим викликом, який досі спантеличує більшість хірургічних експертів. У нашому дослідженні ми виявили, що частота резекції судин, післяопераційних жовчних нориць та печінкової недостатності є дуже низькою, що свідчить про очевидний відбір пацієнтів перед хірургічним лікуванням. У повсякденній практиці пацієнтам з ПХХК перед операцією пропонується пройти тест з індоціаніном зеленим, тестування функції печінки та 3D візуалізацію, щоб допомогти хірургам розрахувати об’єм печінки, оцінити функцію печінки та визначити точну анатомічну структуру ураження. Деякі хірурги відносно консервативно ставляться до радикального хірургічного втручання з приводу ПХХК, коли стикаються зі складною резекцією та реконструкцією, особливо при лапароскопічній операції. Незважаючи на труднощі, серед хірургів зростає ентузіазм щодо лапароскопічної радикальної хірургії перехілярної холангіокарциноми. Відбір відповідних пацієнтів для лапароскопічного радикального лікування перехілярної холангіокарциноми, щоб допомогти хірургам орієнтуватися в кривій навчання, буде в центрі уваги наших майбутніх досліджень.
Наскільки нам відомо, це найбільша серія клінічних випадків ПХХК, в якій порівнюються ЛО та ВО. Однак слід зазначити деякі обмеження. По-перше, ретроспективний характер дослідження наражає на ризик упередженості відбору, і не можна повністю виключити несподівану упередженість. По-друге, мультицентричний характер дослідження створює ризик різних критеріїв відбору, що застосовуються в установах, які беруть участь у дослідженні. В той час як через складність процедури лапароскопічна резекція зараз виконується дуже рідко, цей аналіз на великій вибірці може надати кілька важливих відомостей про лапароскопічну хірургію ПХХК. По-третє, всі лапароскопічні резекції, виконані досвідченими фахівцями, все ще перебувають на ранніх і дослідницьких стадіях і виконуються лише в окремих випадках. Крім того, всі центри, включені в це дослідження, були центрами з великим обсягом направлень в Китаї. Отриманий досвід може бути важко узагальнити для хірургів з менш інтенсивною підготовкою. Тим не менш, з огляду на триваючі дебати щодо цієї складної процедури та поточний перехід до моделей відшкодування витрат на охорону здоров’я, заснованих на цінності, наші висновки є актуальними та своєчасними.
Висновки
Таким чином, це масштабне багатоцентрове дослідження продемонструвало, що Ло не збільшує інтраопераційні та післяопераційні ризики при ПХХК. Таким чином, цей звіт слугує основою для національних протоколів, спрямованих на безпечне виконання ЛО у пацієнтів з ПХХК. Для подальшого вивчення цієї теми необхідні більші проспективні когортні серії та проспективні рандомізовані дослідження в різних країнах.
Абревіатури
ЛО:
Лапароскопічна операція
ПХХК:
Перехілярна холангіокарцинома
ОВ:
Відкрита операція
УОС:
Узгодження оцінки схильності
ППС:
Післяопераційна тривалість перебування в стаціонарі
ВВ:
Ворітна вена
ТЛО:
Тотальна лапароскопічна операція
TNM:
Tumor, nodus, metastasis
НВОМ:
Національна всеосяжна онкологічна мережа
ЛПДЕ:
Лапароскопічна панкреатодуоденектомія
ІКВ:
Інтраопераційна крововтрата
CD:
Clavien-Dindo
ІКР:
Інтерквартильний ромах
СВ:
Стандартне відхилення
ІМТ:
Індекс маси тіла
ЗагБіліруб:
Загальний білірубін
АЛТ:
Аланінамінотрансфераза
АСТ:
Аспартатамінотрансфераза
ГРДС:
Гострий респіраторний дистрес синдром
ПТУД:
Післяопераційна тривалість утримання дренажної трубки
Посилання на джерела
-
- Groot Koerkamp B, Wiggers JK, Allen PJ, Busch OR, D’Angelica MI, DeMatteo RP, et al. American Joint Committee on Cancer staging for resected perihilar cholangiocarcinoma: a comparison of the 6th and 7th editions. HPB (Oxford). 2014;16(12):1074–82.
- Kimura N, Young AL, Toyoki Y, Wyatt JI, Toogood GJ, Hidalgo E, et al. Radical operation for hilar cholangiocarcinoma in comparable Eastern and Western centers: Outcome analysis and prognostic factors. Surgery. 2017;162(3):500–14.
- Tang Z, Yang Y, Zhao Z, Wei K, Meng W, Li X. The clinicopathological factors associated with prognosis of patients with resectable perihilar cholangiocarcinoma: A systematic review and meta-analysis. Medicine. 2018;97(34):e11999.
- Wang Y, Ma K, Zhong A, Xiong Q, Chen J. Hepatopulmonary syndrome after radiofrequency ablation of recurrent intrahepatic cholangiocarcinoma: a case report. Onco Targets Ther. 2019;12:2431–8.
- de Rooij T, van Hilst J, van Santvoort H, Boerma D, van den Boezem P, Daams F, et al. Minimally Invasive Versus Open Distal Pancreatectomy (LEOPARD): A Multicenter Patient-blinded Randomized Controlled Trial. Ann Surg. 2019;269(1):2–9.
- Wang M, Peng B, Liu J, Yin X, Tan Z, Liu R, et al. Practice Patterns and Perioperative Outcomes of Laparoscopic Pancreaticoduodenectomy in China: A Retrospective Multicenter Analysis of 1029 Patients. Ann Surg. 2021;273(1):145–53.
- Jin B, Chen MT, Fei YT, Du SD, Mao YL. Safety and efficacy for laparoscopic versus open hepatectomy: A meta-analysis. Surg Oncol. 2018;27(2):a26–34.
- Nickel F, Haney CM, Kowalewski KF, Probst P, Limen EF, Kalkum E, et al. Laparoscopic Versus Open Pancreaticoduodenectomy: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Ann Surg. 2020;271(1):54–66.
- Hosokawa I, Shimizu H, Yoshidome H, Ohtsuka M, Kato A, Yoshitomi H, et al. Surgical strategy for hilar cholangiocarcinoma of the left-side predominance: current role of left trisectionectomy. Ann Surg. 2014;259(6):1178–85.
- Gumbs AA, Jarufe N, Gayet B. Minimally invasive approaches to extrapancreatic cholangiocarcinoma. Surg Endosc. 2013;27(2):406–14.
- Franken LC, van der Poel MJ, Latenstein AEJ, Zwart MJ, Roos E, Busch OR, et al. Minimally invasive surgery for perihilar cholangiocarcinoma: a systematic review. J Robot Surg. 2019;13(6):717–27.
- Hu HJ, Wu ZR, Jin YW, Ma WJ, Yang Q, Wang JK, et al. Minimally invasive surgery for hilar cholangiocarcinoma: state of art and future perspectives. ANZ J Surg. 2019;89(5):476–80.
- Agha R, Abdall-Razak A, Crossley E, Dowlut N, Iosifidis C, Mathew G; the STROCSS Group. The STROCSS. Guideline: Strengthening the Reporting of Cohort Studies in Surgery. Int J Surg. 2019;2019(72):156–65.
- Edge SBBD, Compton CC, Fritz AG, Greene FL, Trotti A. American Joint Committee on cancer. Cancer staging manual: Springer, New York; 2020.
- Bismuth H, Nakache R, Diamond T. Management strategies in resection for hilar cholangiocarcinoma. Ann Surg. 1992;215(1):31–8.
- Clavien PA, Barkun J, de Oliveira ML, Vauthey JN, Dindo D, Schulick RD, et al. The Clavien-Dindo classification of surgical complications: five-year experience. Ann Surg. 2009;250(2):187–96.
- Koch M, Garden OJ, Padbury R, Rahbari NN, Adam R, Capussotti L, et al. Bile leakage after hepatobiliary and pancreatic surgery: a definition and grading of severity by the International Study Group of Liver Surgery. Surgery. 2011;149(5):680–8.
- Rahbari NN, Garden OJ, Padbury R, Maddern G, Koch M, Hugh TJ, et al. Post-hepatectomy haemorrhage: a definition and grading by the International Study Group of Liver Surgery (ISGLS). HPB (Oxford). 2011;13(8):528–35.
- Rahbari NN, Garden OJ, Padbury R, Brooke-Smith M, Crawford M, Adam R, et al. Posthepatectomy liver failure: a definition and grading by the International Study Group of Liver Surgery (ISGLS). Surgery. 2011;149(5):713–24.
- Brookhart MA, Schneeweiss S, Rothman KJ, Glynn RJ, Avorn J, Stürmer T. Variable selection for propensity score models. Am J Epidemiol. 2006;163(12):1149–56.
- Cipriani F, Ratti F, Fiorentini G, Reineke R, Aldrighetti L. Systematic review of perioperative and oncologic outcomes of minimally-invasive surgery for hilar cholangiocarcinoma. Updates Surg. 2021;73(2):359–77.
- Rahnemai-Azar AA, Abbasi A, Tsilimigras DI, Weber SM, Pawlik TM. Current Advances in Minimally Invasive Surgical Management of Perihilar Cholangiocarcinoma. J Gastrointest Surg. 2020;24(9):2143–9.
- Wang W, Fei Y, Liu J, Yu T, Tang J, Wei F. Laparoscopic surgery and robotic surgery for hilar cholangiocarcinoma: an updated systematic review. ANZ J Surg. 2021;91(1–2):42–8.
- Lin E, Sarmiento JM. Laparoscopic extended right hepatectomy, portal lymphadenectomy, and hepaticojejunostomy for hilar cholangiocarcinoma. J Laparoendosc Adv Surg Tech A. 2014;24(6):411–6.
- Yu H, Wu SD, Chen DX, Zhu G. Laparoscopic resection of Bismuth type I and II hilar cholangiocarcinoma: an audit of 14 cases from two institutions. Dig Surg. 2011;28(1):44–9.
- Zhang CW, Liu J, Hong DF, Wang ZF, Hu ZM, Huang DS, et al. Pure laparoscopic radical resection for type IIIa hilar cholangiocarcinoma. Surg Endosc. 2018;32(3):1581–2.
- Yu H, Wu SD, Tian Y, Su Y, Li YN. Single-incision laparoscopic resection of Bismuth I hilar cholangiocarcinoma. Surgical innovation. 2013;20(3):209–13.
- Ratti F, Fiorentini G, Cipriani F, Catena M, Paganelli M, Aldrighetti L. Perihilar cholangiocarcinoma: are we ready to step towards minimally invasiveness? Updates Surg. 2020;72(2):423–33.
- Cipriani F, Alzoubi M, Fuks D, Ratti F, Kawai T, Berardi G, et al. Pure laparoscopic versus open hemihepatectomy: a critical assessment and realistic expectations – a propensity score-based analysis of right and left hemihepatectomies from nine European tertiary referral centers. J Hepatobiliary Pancreat Sci. 2020;27(1):3–15.
- Cipriani F, Ratti F, Cardella A, Catena M, Paganelli M, Aldrighetti L. Laparoscopic Versus Open Major Hepatectomy: Analysis of Clinical Outcomes and Cost Effectiveness in a High-Volume Center. J Gastrointest Surg. 2019;23(11):2163–73.
- Li J, Zhao L, Zhang J, Li Z, Li A, Wei Y, et al. Application of the laparoscopic technique in perihilar cholangiocarcinoma surgery. Int J Surg. 2017;44:104–9.
- Ebata T, Nagino M, Kamiya J, Uesaka K, Nagasaka T, Nimura Y, et al. Hepatectomy with portal vein resection for hilar cholangiocarcinoma: audit of 52 consecutive cases. Ann Surg. 2003;238(5):720–7.
- Xu Y, Wang H, Ji W, Tang M, Li H, Leng J, et al. Robotic radical resection for hilar cholangiocarcinoma: perioperative and long-term outcomes of an initial series. Surg Endosc. 2016;30(7):3060–70.
- Ratti F, Fiorentini G, Cipriani F, Paganelli M, Catena M, Aldrighetti L. Perioperative and Long-Term Outcomes of Laparoscopic Versus Open Lymphadenectomy for Biliary Tumors: A Propensity-Score-Based. Case-Matched Analysis Ann Surg Oncol. 2019;26(2):564–75.
- Slim K. Laparoscopy within fast-track or within enhanced recovery after surgery? Ann Surg. 2014;259(2):e24.
- Ni X, Jia D, Chen Y, Wang L, Suo J. Is the Enhanced Recovery After Surgery (ERAS) Program Effective and Safe in Laparoscopic Colorectal Cancer Surgery? A Meta-Analysis of Randomized Controlled Trials. J Gastrointest Surg. 2019;23(7):1502–12.
- Morgan KA, Lancaster WP, Walters ML, Owczarski SM, Clark CA, McSwain JR, et al. Enhanced Recovery After Surgery Protocols Are Valuable in Pancreas Surgery Patients. J Am Coll Surg. 2016;222(4):658–64.
- Wong-Lun-Hing EM, van Dam RM, van Breukelen GJ, Tanis PJ, Ratti F, van Hillegersberg R, et al. Randomized clinical trial of open versus laparoscopic left lateral hepatic sectionectomy within an enhanced recovery after surgery programme (ORANGE II study). Br J Surg. 2017;104(5):525–35.
- Bednarski BK, Nickerson TP, You YN, Messick CA, Speer B, Gottumukkala V, et al. Randomized clinical trial of accelerated enhanced recovery after minimally invasive colorectal cancer surgery (RecoverMI trial). Br J Surg. 2019;106(10):1311–8.
- Varadhan R, Weiss CO, Segal JB, Wu AW, Scharfstein D, Boyd C. Evaluating health outcomes in the presence of competing risks: a review of statistical methods and clinical applications. Med Care. 2010;48(6 Suppl):S96-105.
- Koller MT, Raatz H, Steyerberg EW, Wolbers M. Competing risks and the clinical community: irrelevance or ignorance? Stat Med. 2012;31(11–12):1089–97.
- Willms AG, Schaaf S, Zimmermann N, Schwab R, Güsgen C, Vilz TO, et al. The Significance of Visceral Protection in Preventing Enteroatmospheric Fistulae During Open Abdomen Treatment in Patients With Secondary Peritonitis: A Propensity Score-matched Case-control Analysis. Ann Surg. 2021;273(6):1182–8.
- Bonnot PE, Piessen G, Kepenekian V, Decullier E, Pocard M, Meunier B, et al. Cytoreductive Surgery With or Without Hyperthermic Intraperitoneal Chemotherapy for Gastric Cancer With Peritoneal Metastases (CYTO-CHIP study): A Propensity Score Analysis. J Clin Oncol. 2019;37(23):2028–40.
- Jingdong L, Yongfu X, Yang G, Jian X, Xujian H, Jianhua L, et al. Minimally invasive surgery for hilar cholangiocarcinoma: a multicenter retrospective analysis of 158 patients. Surg Endosc. 2021;35(12):6612–22.