Резюме
Здоров’я кісток починається зі здоров’я та харчування матері, які впливають на масу та щільність кісткової тканини вже в утробі матері. Механізми, що лежать в основі впливу внутрішньоутробного середовища на здоров’я кісток, частково невідомі, але, безумовно, включають “внутрішньоутробне програмування” оксидативного стресу та ендокринної системи, які впливають на подальший ріст і розвиток скелета. У цьому наративному огляді ми описуємо сучасні докази для виявлення пацієнтів з факторами ризику розвитку остеопенії, сучасні методи ведення цих груп населення, а також програми скринінгу та профілактики, що базуються на гестаційному віці, вазі та рівнях захворюваності. Виклики для профілактики здоров’я кісткової тканини включають потребу в нових технологіях, які є специфічними і застосовними для вагітних жінок, плоду і, пізніше, новонароджених. Радіочастотна ультразвукова спектрометрія (РЕМС) виявилася корисним інструментом в оцінці мінеральної щільності кісткової тканини (МЩКТ) у вагітних жінок. Нечисленні дослідження повідомляють, що трансмісійний ультразвук також можна використовувати для оцінки МЩКТ у новонароджених. Перевагами цієї технології у плода та новонародженого є відсутність іонізуючого випромінювання, простота використання і, перш за все, можливість проведення лонгітюдних досліджень від внутрішньоутробного до позаутробного життя. Застосування цих технологій вже у внутрішньоутробному періоді може допомогти запобігти супутнім захворюванням, таким як остеопороз та остеопенія, які характеризуються зменшенням кісткової маси та дегенерацією кісткової структури і призводять до підвищеного ризику переломів у дорослому віці зі значними соціальними наслідками, пов’язаними з прямими та непрямими витратами.
Ключові слова: новонароджена дитина; мінеральна щільність кісткової тканини; ультразвук; окислювальний стрес; ендокринні дизраптори
1. Вступ
Здоров’я кісток починається зі здоров’я та харчування матері, які впливають на масу скелета та щільність кісткової тканини у плода [1]. У загальній популяції продемонстрована значна варіабельність кісткової маси, яка, як видається, бере свій початок ще у внутрішньоутробному та ранньому постнатальному періоді [2].
Хоча вага суб’єктів у віці одного року є найбільш вивченою в літературі, оскільки вона корелює з піковою кістковою масою в дорослому віці, нещодавній систематичний огляд показав сильну кореляцію кісткової маси дорослих з вагою при народженні, що свідчить про вплив стимулів навколишнього середовища, отриманих у критичний період розвитку скелету, починаючи з внутрішньоутробного життя [3,4].
Нещодавно було виявлено, що механізми, опосередковані епігенетикою, зокрема мікроРНК, здатні контролювати експресію генів на посттранскрипційному рівні, забезпечуючи епігенетичні модифікації та спрямовуючи пластинку росту.
Метаболічне захворювання кісток (МЗК) визначається як зниження вмісту мінеральних речовин у кістковій тканині порівняно з очікуваним рівнем для дитини певної ваги або гестаційного віку, що виявляється за допомогою змін при лабораторних та рентгенологічних обстеженнях [5].
До груп ризику розвитку МЗК належать передчасно народжені діти, немовлята з низькою масою тіла при народженні, особливо з дуже низькою масою тіла при народженні (ДНМТ) та екстремально низькою масою тіла при народженні (ЕНМТ), діти із затримкою внутрішньоутробного розвитку (ЗВУР), немовлята з супутніми захворюваннями, що зазвичай асоціюються з недоношеністю (наприклад, сепсис, холестаз, бронхолегенева дисплазія (БЛД), некротичний ентероколіт (НЕК)), немовлята, які потребують тривалого повного парентерального харчування (ППХ), немовлята, народжені від матерів із захворюваннями, пов’язаними з вагітністю (прееклампсія, хоріоамніоніт, гестаційний діабет), та немовлята, народжені від матерів з дефіцитом вітаміну D [5]. Немовлята з цими характеристиками повинні бути ретельно та адекватно обстежені, включаючи лабораторні, сечові та інструментальні дослідження, для раннього виявлення будь-яких ознак МЗК та якнайшвидшого призначення відповідних мінеральних добавок на основі лабораторних даних.
Найчастіше МЗК виникає між 6 і 16 тижнями після народження [6]; вона проявляється через недостатні запаси кальцію і фосфору і посилюється недостатнім споживанням мінеральних речовин і високою швидкістю росту скелета, що зазвичай відбувається в перші кілька тижнів життя [6,7].
МЗК найчастіше зустрічається у новонароджених <28 тижнів гестації; частота МЗК у недоношених ДНВН становила 32%, а для ЕНВН – 54%, з піком на 4-8 тижні постнатального віку [8].
Ефективна профілактика, раннє виявлення факторів ризику, використання уніфікованих діагностичних алгоритмів та неінвазивних технологій можуть сприяти покращенню здоров’я кісткової тканини та зниженню захворюваності на МЗК і пов’язані з ним хвороби, які становлять значну частину витрат на лікування.
Проблеми профілактики здоров’я кісткової тканини включають потребу в нових технологіях, які є специфічними і можуть бути застосовані до вагітних жінок, плоду і, пізніше, новонароджених. Цей навчальний огляд має на меті описати сучасні докази щодо ранньої ідентифікації та ведення груп населення з високим ризиком розвитку остеопенії, а також впровадження скринінгових і профілактичних програм, заснованих на гестаційному віці, вазі та захворюваності.
2. Скелетний розвиток плода
Кісткова тканина складається з трьох типів клітин: остеобластів, остеоцитів та остеокластів. Вони походять з матриксу, що складається переважно з колагенових волокон, глікопротеїнів, які надають кістці форму та еластичність, і мінеральних солей, переважно кальцію та фосфору, які надають їй жорсткість і твердість. Кісткова тканина також є метаболічно активною і надзвичайно динамічною тканиною через її безперервне ремоделювання протягом усього життя [9].
Розвиток скелета починається з перших тижнів вагітності і відбувається під впливом генетичних, ендокринних та екологічних факторів [10]. Проліферація, диференціація попередників хряща та процеси окостеніння тонко регулюються гормонами, такими як паратиреоїдний гормон (ПТГ), цитокінами та вітамінами (A, D, C і K) [11].
Іншим ключовим елементом для гарного розвитку скелета є судинна підтримка, яка забезпечує достатнє надходження мінеральних речовин. Насправді, такі стани, як прееклампсія, хоріоамніоніт та ЗВУР, що відображають хронічне пошкодження плаценти, пов’язані з підвищеним ризиком МЗК [12].
Крім того, деякі фактори навколишнього середовища, такі як вплив наркотиків, токсичних речовин та умови харчування матері [13], вважаються епігенетичними факторами, що впливають на масу та щільність кісткової тканини плода, а також на кількість та якість кісткової тканини у дорослих [14].
Ембріологічно кісткова тканина є похідною від мезодерми, листка, який генерує всі сполучні тканини протягом ембріонального життя. Першою скелетною структурою, що формується, є нотохорда, яка з’являється в середній лінії ембріонального диска приблизно на 15-й день розвитку, беручи початок з примітивної ямки, розташованої на підвищенні ектодерми, відомої як вузол Хенсена, в кінці примітивної лінії [15].
Зокрема, черепно-лицьовий скелет утворюється з клітин нервового гребеня, осьовий скелет – з параксіальних мезодермальних клітин, а апендикулярний скелет – з мезодермальних клітин латеральної пластинки [16].
Формування кісткової тканини може відбуватися за двома моделями окостеніння: внутрішньомембранною або ендохондральною [17].
Внутрішньомембранне або пряме окостеніння відбувається, коли кісткова тканина заміщає хрящову тканину. Мезенхімальні клітини проліферують і конденсуються в компактні вузлики. Деякі з цих клітин формують капіляри; інші індукуються кістковим морфогенетичним білком (КМБ) до експресії Runx2 і диференціюються в остеобласти, які, в свою чергу, починають виробляти остеоїдний матрикс, що формує кінчики кісток після процесу мінералізації [18]. Внутрішньомембранне окостеніння є звичайним засобом розвитку плоских кісток черепа, нижньої щелепи та ключиці. Перетинчасті кістки черепної коробки та обличчя формуються між 9-м та 12-м тижнем [16].
Ендохондральне або непряме окостеніння вимагає формування хрящової тканини із сукупності мезенхімальних клітин і подальшої заміни хряща на кістку. Ендохондральне окостеніння дає початок більшості кісток в організмі людини [16,17], які також є кістками з підвищеним ризиком розриву в більш пізньому віці [18].
Непряме окостеніння можна розділити на п’ять послідовних фаз. Під час цього процесу хондробласти повинні генерувати, проліферувати, гіпертрофуватися, гинути і замінюватися остеобластами. Послідовні зміни в поведінці хондробластів жорстко контролюються системними та паракринними факторами, які, зв’язуючись з рецепторами, активують внутрішньоклітинні сигнальні шляхи та визначають активацію специфічних факторів транскрипції, таких як парний бокс l (PAXl) та склераксис, що відповідають за активацію специфічних для хряща генів. Дочірні клітини, які депонують хрящ, розташовані в кінцівках довгих кісток [19,20,21]. Першими з’являються тяжі верхніх кінцівок (24-й день), а потім – нижніх (28-й день). Зачатки кінцівок спочатку складаються з мезенхімального ядра, що походить із соматоплеври латеральної мезодерми. Через п’ять тижнів у ембріона формуються куприкові хребці [15].
Наприкінці 5-го тижня добре сформовані хрящові ескізи представляють всі майбутні основні кістки скелета кінцівки [18]. Ця хрящова модель згодом заміщується новоутвореною кісткою [17]. Перші зміни в хрящовому контурі довгої кістки відбуваються в центральній частині діафіза приблизно на 7-му тижні ембріонального життя, коли в кістку, що розвивається, проникають численні кровоносні судини, одна з яких стає живильною артерією кістки. Хрящовий скелет плода та формування первинних центрів окостеніння у хребцях і довгих кістках завершують свій розвиток у першому триместрі [22]. Першою кісткою, в якій з’являється первинний центр окостеніння, є стегнова кістка. Останньою кісткою є під’язикова кістка, в якій центр окостеніння з’являється в 36 тижнів. Деякі менші кістки зап’ястка і передплесна починають окостеніння лише в ранньому дитинстві. Процес окостеніння відбувається від первинного центру окостеніння до епіфізів. При народженні діафізи повністю окостеніли, в той час як кінці кісток, які називаються епіфізами, ще хрящові. Отже, після народження у всіх кістках на рівні епіфізів з’являються центри вторинного окостеніння. Однак між епіфізом і зростаючим кінцем діафіза зберігається шар хряща, який називається епіфізарним хрящем. У цьому шарі відбувається безперервна проліферація хондроцитів з подальшою диференціацією і заміщенням хрящової тканини кістковою, що дозволяє діафізу подовжуватися. Епіфізарна пластинка повністю костеніє приблизно у двадцятирічному віці, коли завершується ріст організму [23].
3. Роль епігенетики в регуляції розвитку плаценти та кісткової тканини плода
Кожна стадія розвитку скелета регулюється численними транскрипційними факторами (наприклад, SOX9, RUNX2), факторами росту (наприклад, ФРФ, ІФР, ФРЕС, КМБ та інші з родини ТФР-β) та іншими сигнальними молекулами (наприклад, Wnt/β-катенін, Hedgehog, ПТГпП) [24].
Існує гіпотеза, що різні епігенетичні зміни в плаценті, які відповідають за передачу поживних речовин плоду, також відіграють певну роль в аномальному розвитку скелета плоду і, таким чином, остеопорозу в дорослому віці. Це можна припустити з відкриттям зв’язку між порушенням регуляції генів та остеопенією [13, 24].
Нещодавні дослідження показали, зокрема, що ферменти, здатні модифікувати структуру гістонів або контролювати метилювання ДНК та некодуючі мікроРНК, також відіграють фундаментальну роль у розвитку скелета як епігенетичні фактори, здатні діяти на транскрипційному та посттранскрипційному рівнях на експресію генів [25].
Надмірна експресія деяких груп мікроРНК (наприклад, miR-10b, miR-19a-3p, miR-29a, miR26b) in vitro індукує диференціацію остеобластів, тоді як пригнічення інших (наприклад, miR-9-5p, miR-16-2-3p) пригнічує остеогенез [25]. У доклінічних дослідженнях гіперекспресія остеоіндуцибельних мікроРНК, схоже, здатна індукувати утворення мінералізованого позаклітинного матриксу та експресію генів, пов’язаних з остеобластичною функцією, в мезенхімальних клітинах-попередниках людини або мишей через різні епігенетичні механізми: інгібування епігенетичних регуляторів, таких як HDAC4 або HMGA2, інгібування Wnt-опосередкованого сигнального каскаду (напр., DKK1, GSK3β), модуляція негативних регуляторів RUNX2 (наприклад, SMAD6 або SMURF2) та регуляція Rorβ [26,27,28].
Ген WNT2 кодує білок, що бере участь у клітинних сигнальних шляхах, відіграє важливу роль у розвитку плаценти миші та високо виражений у плаценті людини [29]. Ferreira та співавт. показали зв’язок між метилюванням промотора WNT2 у плаценті людини та низькою вагою при народженні [29].
Tenta та співавт. визначили роль в індукції остеокластогенезу рецептора, що ядерний активуючий фактор каппа-В рецептора (RANKL), та рецептор приманки остеопротегерину (ОПГ) RANK, виявивши значну надмірну регуляцію співвідношення ОПГ/RANKL у немовлят із МГВ, що підкреслює їхню роль у кістковому обігу в компенсації внутрішньоутробної затримки росту [10].
Дослідження показали поліморфізм генів шляху ПТГ (ПТГ, ПТГ-подібного гормону (ПТГПГ) і рецептора ПТГ1 (РПТГ)), що свідчить про те, що гени, пов’язані з ПТГ, є сильними кандидатами на генетичну регуляцію розвитку кісткової тканини і втрати кісткової маси. Існують докази того, що вони можуть бути пов’язані з ризиком переломів або МЩКТ [30,31,32].
Іншими факторами ризику МЗК у недоношених новонароджених є чоловіча стать і поліморфізм певних генів (рецептора вітаміну D, рецептора естрогену і гена колагену альфа-1) [33].
Дані показують, що вітамін D і рецептор вітаміну D відіграють певну роль у рості кісток, впливаючи на проліферацію та диференціацію клітин і, зокрема, на гомеостаз кальцію, що є критично важливими процесами для здоров’я кісток [34].
COL1A1 Sp1 відіграє важливу роль у розвитку кісток ембріона. COL1A1 Sp1 для колагену 1-го типу – це транскрипт гена основного білка кісткової тканини. Встановлено, що остеопоротичні переломи та МЩКТ асоціюються з поліморфізмами COL1A1 Sp1 [35].
Інші гени, такі як Sox9, Runx2, Osterix, ALP, остеокальцин і кістковий сіалопротеїн (Ксп), відіграють певну роль у диференціації остеобластів і, таким чином, у формуванні кісток [36,37].
4. Мінералізація кісток
Мінералізація кісток є незамінним процесом для правильного формування скелета [38]. Підтримання адекватного вмісту мінералів є критично важливим для ефективної мінералізації кісткової тканини [39]. Мінерали всмоктуються кишечником і за потреби відновлюються або виводяться нирками. Споживання мінеральних речовин є важливим для забезпечення мінерального гомеостазу та профілактики мінеральних захворювань кісток, а також для збалансування дії різних регуляторів біомінералізації, включаючи паратиреоїдний гормон, кальцитонін, вітамін D, вітамін К, фактор росту фібробластів 23 (ФРФ23) та ферменти фосфатази. Насправді на мінералізацію кісткової тканини впливають кілька факторів, включаючи адекватне споживання мінералів, баланс між активаторами та інгібіторами мінералізації, а також наявність колагенових фібрил [38]. Організм також використовує скелет як джерело мінералів у разі їх дефіциту. Кістка відіграє важливу роль як метаболічне сховище, яке регулює внутрішньоклітинні та позаклітинні рівні мінералів, зокрема кальцію та фосфатів [38].
Близько 70 відсотків ваги кістки складають мінерали, решта 30 відсотків – органічні речовини. Мінеральна частина в основному представлена кристалами гідроксилапатиту, високоорганізованими структурами кальцію і фосфату та іншими іонами, такими як натрій, магній, фтор і стронцій. Неорганічна частина складається з колагенових волокон, глікопротеїнів і протеогліканів [40].
Мінералізація кісткової тканини – це двоетапний біологічний процес, який регулюється кількома факторами: первинною та вторинною мінералізацією. Під час первинної мінералізації відбувається відкладення аморфних кальцій-фосфатних солей, а під час вторинної мінералізації – поступове дозрівання мінералів з утворенням гідроксилапатиту [41].
Мінералізація кісткової тканини починається з невеликих везикул позаклітинного матриксу, що виділяються хондроцитами та остеобластами [42].
Надходження іонів кальцію та неорганічних фосфатів у ці маленькі везикули регулюється мембранними транспортерами та ферментами, що беруть участь у мінералізації (наприклад, тканинною неспецифічною лужною фосфатазою (ТНЛФ), ектонуклеотидною пірофосфатазою (ЕНПФ) та анкілозом (АНК)) [43,44,45].
При первинній мінералізації накопичення фосфатів і кальцію в матричних везикулах призводить до зародження і прогресуючої акреції кристалів гідроксилапатиту, які поступово формують мінералізовані вузлики [46].
Ці вузлики, які також називають кальцифікуючими вузликами, контактують з колагеновими волокнами, що призводить до мінералізації колагену від точок контакту до периферії [47].
Під час вторинної мінералізації мінеральна щільність кісткової тканини поступово зростає завдяки процесам транспорту мінералів за участю остеоцитів. Остеоцити мають лакунарну остеоцитарно-канальцеву систему, яка дозволяє їм транспортувати мінерали та регулювати метаболізм кісткової тканини [48].
Таким чином, остеоцити та остеобласти співпрацюють для підтримки адекватного стану мінералізації кісткової тканини [49].
Рівень кальцію та неорганічних фосфатів у сироватці крові є двома важливими детермінантами мінералізації кісткової тканини [50].
Крім того, 80% перенесення кальцію і фосфору відбувається між 25 і 40 тижнями вагітності, а максимальна кількість досягається на 34 тижні [51,52,53].
У плода добове накопичення кальцію на 24-му тижні становить 60 мг, тоді як між 35-м і 40-м тижнем вагітності воно досягає 300-350 мг. Загальний середній нерест кальцію і фосфору становить 100-150 мг/кг/добу та 50-65 мг/кг/добу відповідно [54].
Рівень позаклітинного кальцію регулюється ПТГ, секреція якого залежить від концентрації кальцію в крові, що визначається кальцій-чутливими рецепторами (КаЧР) на клітинах паращитовидних залоз. Секреція ПТГ активує механізми підвищення рівня кальцію в сироватці крові, включаючи резорбцію кісткової тканини остеокластами [40].
Рівень фосфату в крові залежить від всмоктування харчового фосфату кишечником, вивільнення фосфату з кісток і особливо від його відновлення в нефронах. Екскреція та реабсорбція відфільтрованого нирками фосфату відбувається в проксимальних канальцях за допомогою специфічних транспортерів, відповідно до потреб організму, і є основними механізмами регуляції вмісту фосфату в крові [55].
Активність цих транспортерів модулюється ПТГ і ФРФ23, гормоном, що виробляється остеоцитами, в результаті чого збільшується екскреція фосфатів і знижується рівень фосфатів у крові [56].
ФРФ23 і ПТГ також впливають на метаболізм вітаміну D і кістковий метаболізм з протилежними ефектами. ПТГ підвищує рівень кальцію і фосфатів у сироватці крові, стимулюючи активацію вітаміну D і сприяючи всмоктуванню мінералів у кишечнику. Натомість ФРФ23 пригнічує утворення кальцитріолу, активної форми вітаміну D [38].
ФРФ23 також пригнічує мінералізацію кісткової тканини, пригнічуючи синтез і секрецію ПТГ і особливо сприяючи утворенню пірофосфату (PPi), одного з найпотужніших інгібіторів мінералізації [57].
PPi перешкоджає агрегації кальцію та фосфатів, запобігаючи утворенню та росту кристалів гідроксилапатиту [58]. Він гідролізується ферментом лужною фосфатазою (ЛФ); цей процес знижує рівень PPi, що пригнічує мінералізацію кісткової тканини, і в той же час збільшує доступну кількість фосфату [50].
Про незамінну функцію ЛФ свідчить той факт, що у новонароджених з мутаціями в гені ЛФ спостерігається тяжка остеомаляція, фетальна/перинатальна летальність [59].
Іншим важливим регулятором кальцієвого та фосфатного гомеостазу є вітамін D. Кінцевий етап перетворення неактивної форми вітаміну D в його активну форму, кальцитріол, стимулюється різними факторами, включаючи ПТГ, інсуліноподібний фактор росту 1, знижене споживання кальцію та фосфатів, а також низький позаклітинний рівень цих мінералів [38].
Вітамін D сприяє підтримці адекватного вмісту кальцію та фосфатів у плазмі крові, стимулюючи всмоктування мінералів з кишечника та їх мобілізацію з кісток [60].
Досягнення перенасичених позаклітинних концентрацій кальцію та фосфатів дозволяє мінералізувати гіпертрофовані хрящі та кістки. Кальцитріол також сприяє мінералізації, стимулюючи диференціацію остеобластів, ріст матриксних везикул, з яких починається процес, і вироблення матриксних неколагенових білків, що беруть участь у регуляції мінералізації [61].
Нещодавній огляд показує важливу роль вітаміну К у метаболізмі та мінералізації кісткової тканини. Вітамін К, завдяки своїм анаболічним властивостям, сприяє Y-глутамілкарбоксилюванню та диференціюванню остеобластів, регулює мінералізацію позаклітинного матриксу через активацію кістково-асоційованих вітамін К-залежних білків та інгібує остеокластогенез. Всі ці ефекти стимулюють формування та мінералізацію кісткової тканини [9].
5. Фактори, що впливають на мінералізацію кісток
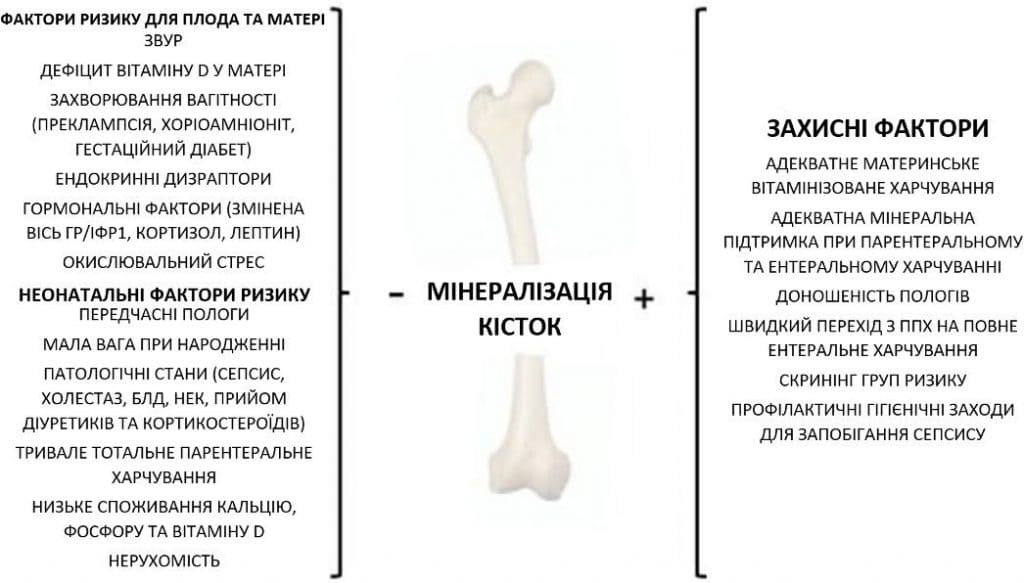
Багато факторів, що діють у пре- та постнатальному періоді, можуть впливати на мінералізацію кісткової тканини (Зобр. 1)
Зображення 1. Фактори, що впливають на мінералізацію кісткової тканини: материнський, ембріональний та неонатальний ризик і захисні фактори.
5.1. Материнські та ембріональні фактори
5.1.1. Вітамін D
Зв’язок між МЗК та рівнем вітаміну D у вагітних жінок все ще обговорюється: дослідження не дають переконливих результатів. Деякі дослідження не виявили кореляції між рівнем вітаміну D у матері та параметрами кісткової тканини в неонатальному періоді [62,63].
Інші дослідження показують негативний зв’язок з щільністю кісткової маси нащадків [64] або позитивний зв’язок [65,66].
Інші дослідження показують, що вагітним жінкам слід давати добавки вітаміну D, щоб забезпечити достатній рівень вітаміну D для новонародженого, оскільки концентрація 25-гідроксивітаміну D (25(OH)D) у новонароджених становить приблизно 80% від материнського рівня [67,68].
Крім того, клінічні дослідження показали, що прийом вітаміну D вагітними жінками знижує ризик МЗК, оскільки зменшує ймовірність прееклампсії та гестаційного діабету, які є факторами ризику МЗК [69,70].
5.1.2. ГР/ІФР-1 Вісь
Вісь гормон росту/інсуліноподібний фактор росту 1 (ГР/ІФР-1) вважається вирішальною у формуванні кісткової маси. Обмеження росту плода, ймовірно, має негативний вплив на цю вісь [71].
Інсуліноподібний фактор росту (ІФР-1) сприяє мітозу диференційованих хондроцитів як у внутрішньоутробному періоді, так і в дитинстві, і є одним з найважливіших ендокринних факторів. Недостатня секреція супроводжується зниженням рівня росту, і це може бути причиною меншої кісткової маси у дітей, які народилися з меншою вагою при народженні [72].
5.1.3. Кортизол
У метааналізі також було продемонстровано зв’язок, хоча і слабкий, між немовлятами, які народилися з меншою масою тіла, та рівнем кортизолу в сироватці крові: у цієї категорії немовлят рівень кортизолу був підвищеним [73].
Ендогенний кортизол, по суті, пригнічує функцію остеобластів, тому його високий рівень може негативно впливати на кісткову масу [74,75].
5.1.4. Лептин
Лептин – цитокіновий гормон, що секретується адипоцитами; серед його численних функцій, він також має здатність пов’язувати зміни у складі тіла з формуванням та резорбцією кісткової тканини [76].
5.1.5. Окислювальний стрес та ендокринні дизраптори
Окислювальний стрес (ОС) та ендокринні дизраптори (ЕД) у вагітних жінок можуть потенційно впливати на здоров’я кісткової тканини матері та плода через ембріональне програмування. Оксидативний стрес може спричинити внутрішньоутробну затримку росту при найпоширеніших станах вагітності, таких як діабет матері, прееклампсія та хоріоамніоз, створюючи внутрішньоутробне середовище, потенційно несприятливе для розвитку плода [77].
Насправді, під час вагітності відбувається надлишкове утворення вільних радикалів по відношенню до антиоксидантної здатності організму. Джерелами вільних радикалів є дихальний ланцюг мітохондрій, індукція синтаз оксиду азоту (ОА-синтаз) і нікотинамідаденіндинуклеотидфосфат-оксидази (НАДФ-оксидази), а також вільні метали, такі як залізо, мідь і марганець [77].
Вільні радикали можуть через численні епігенетичні механізми модулювати експресію генів у критичні періоди внутрішньоутробного розвитку прямо або опосередковано через молекули, окислені самими радикалами [77].
Longini та співавт. продемонстрували, що ізопростани в амніотичній рідині є надійним маркером перекисного окислення ліпідів: вільні радикали, розриваючи пептидні зв’язки амінокислотного ланцюга колагену та перекисне окислення поліненасичених жирних кислот клітинного фосфоліпідного бішару, пошкоджують структуру хоріоамніотичних мембран, що призводить до передчасного розриву мембран, а отже, до передчасних пологів [78].
Ендокринні дизраптори (ЕД) здатні впливати на плаценту, змінюючи її морфологію та функцію за допомогою механізмів, які досі залишаються невідомими, але, ймовірно, пов’язані з сигнальними шляхами, пов’язаними з інсуліном, глюкокортикоїдами, естрогеном та гормонами щитовидної залози, епігенетикою та запаленням [79,80,81,82].
Література про наслідки впливу ендокринних дизрапторів під час внутрішньоутробного життя представляє великий інтерес, хоча все ще обмежена, і зосереджена на можливих наслідках для росту плода та довгострокових когнітивно-поведінкових несприятливих явищах [83].
Нещодавно Dirkers та співавт. у доклінічному дослідженні на мишачій моделі дослідили, як вплив бісфенолу А під час вагітності призводить до послаблення трабекулярної мікроархітектури та геометрії кортикальної кістки у нащадків, що зазнали впливу. У досліджуваній групі, порівняно з контрольною групою, спостерігалося статистично значуще зменшення трабекулярного об’єму кістки і товщини кортикального шару разом зі збільшенням трабекулярного простору і, в кінцевому підсумку, ослаблення кістки [84].
На сьогоднішній день немає даних про зв’язок між раннім впливом ЕД і змінами якості та складу кісткової тканини у людей. Деякі з цих змін можуть бути зумовлені епігенетичними змінами і, зокрема, змінами в мережі мікроРНК [13]. МікроРНК – це ендогенні малі некодуючі РНК, які діють як транскрипційні та посттранскрипційні регулятори. Можуть відбуватися множинні зміни в кількості мікроРНК, де одночасно регульовані вгору і вниз мікроРНК можуть бути мішенню для одного і того ж гена з цілим рядом передбачуваних ефектів і, навпаки, одна мікроРНК може регулювати кілька генів-мішеней. МікроРНК відіграють певну роль у регуляції розвитку скелета, з ефектами на різних стадіях розвитку кісток і в різних типах кісткових клітин [85,86]. Дослідження у новонароджених та дітей показало різні рівні експресії мікроРНК залежно від стадії розвитку [87]. Зокрема, рівень експресії 36 мікроРНК збільшувався від народження до середини дитинства. Молекулярні механізми, за допомогою яких мікроРНК виконують свою регуляторну роль у поздовжньому рості кісток, пов’язані з регуляцією росту клітин, зокрема хондроцитів [88].
Хондроцити беруть участь у рості скелета: ендохондральне формування кістки відбувається в ростовій пластинці, яка є тонким шаром хряща, розташованим в метафізі довгих кісток. Пластинка росту демонструє високий ступінь просторової регуляції і гістологічно утворена трьома різними зонами: зоною спокою, яка містить хондроцити-попередники; проліферативною зоною, яка характеризується хондроцитами, що проліферують односпрямовано, утворюючи стовпчасті клітинні клони і виробляючи специфічні позаклітинні матриксні білки (наприклад, колаген II типу і агрекан); і гіпертрофічною зоною, в якій зрілі хондроцити виходять з клітинного циклу, проходять гіпертрофічну диференціацію і експресують колаген X типу. Хрящовий матрикс мінералізується, а термінально диференційовані хондроцити піддаються апоптозу [89].
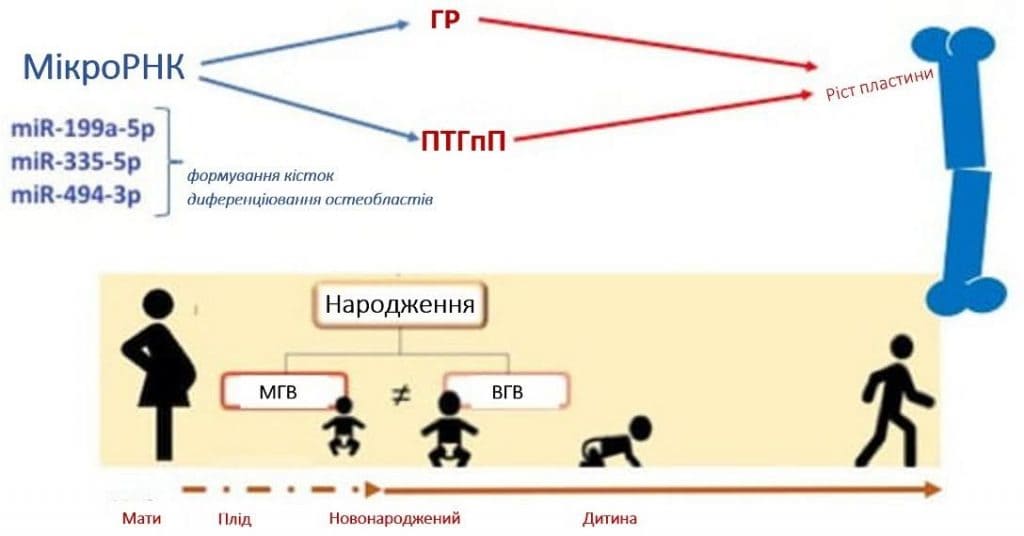
Патерн експресії мікроРНК може бути залучений до контролю проліферативних та диференціювальних механізмів, які регулюють долю клітин у певних зонах ростової пластинки. Більше того, на чіткі патерни в ростовій пластинці впливають градієнти концентрації протеїну, подібного до паратиреоїдного гормону (ПТГпП), в різних зонах, що дозволяє припустити роль мікроРНК в механізмі дії ПТГпП для контролю клітин ростової пластинки [90], Зобр. 2.
Зображення 2. Схематичне зображення ролі мікроРНК у розвитку кісткової тканини. miR = мікроРНК; ГР: гормон росту; ПТГпП: протеїн подібний до паратиреоїдного гормону.
Крім того, мікроРНК є критично важливими для регуляції функції гіпоталамуса та розвитку гіпофіза, а отже, і для секреції та дії гормону росту. Було продемонстровано, що три специфічні мікроРНК, які регулюють гени, пов’язані з ростом кісток, безпосередньо регулюються гормонами росту і становлять великий інтерес з точки зору поздовжнього росту, а саме miR-199a-5p, miR-335-5p і miR-494-3p. miR-199a-5p і miR-335-5p відіграють важливу роль у формуванні кісток і диференціації остеобластів in vitro. Зокрема, miR-199a-5p бере участь у диференціації остеобластів, а надмірна експресія miR-335-5p, як повідомлялося, сприяє формуванню та регенерації кісткової тканини в моделі трансгенних мишей [91].
miR-494-3p ще не вивчався в контексті розвитку кісток або ростових пластинок, однак повідомлялося, що він сприяє активації шляху PI3K/AKT [92], який, як відомо, контролює гіпертрофічну диференціацію хондроцитів і бере участь в ендохондральному рості кісток і диференціації остеобластів [93,94].
Дані свідчать про те, що в найближчому майбутньому поживні речовини або препарати, спрямовані на цей шлях, або генна терапія можуть відігравати певну роль у пацієнтів, які належать до групи високого ризику, для запобігання розвитку остеопенії та остеопорозу в подальшому житті.
5.1.6. ЗВУР
Метааналіз Wang вказав, що ЗВУР є незалежним фактором ризику МЗК [95].
Olmos-Ortiz та співавт. виявили кореляцію між ЗВУР та дефіцитом вітаміну D3 у матері; останній призводить до дефекту імплантації плаценти [96].
Цей випадок призводить до хронічного порушення функціонування плаценти з блокуванням транспорту фосфору і поганої внутрішньоутробної кальцифікації кісток [97].
5.2. Неонатальні фактори
5.2.1. Передчасні пологи
Wang та співавт. підкреслюють, що гестаційний вік < 32 тижнів є фактором ризику МЗК [95].
Це пов’язано з двома причинами: (1) мінералізація кісткової тканини відбувається переважно в третьому триместрі, а передчасні пологи спричиняють нестачу мінеральних запасів плода; (2) недоношені діти, госпіталізовані з різних причин (низький гестаційний вік або потреба у штучній вентиляції легень), є малорухомими, тому може існувати ризик дефектів мінералізації кісткової тканини [98,99]; крім того, малорухомість може бути зумовлена малорухомістю, спричиненою порушенням обміну речовин, нервово-м’язовими чи системними захворюваннями [100].
Якщо передчасні пологи відбуваються між 24 і 40 тижнями гестаційного віку, новонароджені пропускають оптимальну фазу для отримання максимальних запасів кальцію і фосфору і часто не мають адекватних запасів цих мінералів, тому вони особливо чутливі до змін у постнатальному періоді і, крім того, через супутні захворювання, пов’язані з недоношеністю, піддаються факторам ризику зниження мінералізації кісткової тканини [101,102].
У недоношених дітей вміст мінеральних речовин у кістках недостатній для нормального росту кісток; про це можуть свідчити зміни у візуалізації та електролітах, а також аномальні рівні певних ферментів у крові [5].
5.2.2. Низька вага при народженні
Низька вага немовлят при народженні може бути пов’язана з серйозними метаболічними порушеннями, які виникають у дорослому віці, такими як метаболічний синдром та остеопороз [103]. Доведено, що низька вага при народженні є детермінантою низької кісткової маси [104].
Як показали численні дослідження, маса тіла при народженні < 1000 г також є фактором ризику МЗК; дійсно, зі збільшенням маси тіла при народженні ризик МЗК зменшується. Існує дві основні причини цього: (1) передчасні пологи, як пояснювалося вище [18]; (2) зміни функції плаценти, що призводять до порушення передачі поживних речовин і мінералів [51].
Систематичний огляд та метааналіз корелює між вагою при народженні та вмістом мінеральних речовин у кістковій тканині дорослих, демонструючи позитивний зв’язок. Цей метааналіз показує, що вміст мінеральних речовин у стегновій кістці зростає зі збільшенням маси тіла при народженні [2].
Однак є деякі докази того, що більш пізній ріст є більш важливим фактором, ніж вага при народженні [105,106].
5.2.3. Передчасні захворювання
Поширені неонатальні захворювання, особливо у передчасно народжених дітей (сепсис, хронічний легеневий ацидоз, некротичний ентероколіт, холестатична жовтяниця), а також тривале лікування такими препаратами, як діуретики та глюкокортикоїди, яких часто потребують передчасно народжені діти, можуть погіршити ремоделювання кісткової тканини. Знижується проліферативна активність остеобластів і підвищується руйнівна активність остеокластів, що зменшує всмоктування кальцію і збільшує втрату кальцію з сечею [107,108,109].
Діти з сепсисом мають вищий ризик МЗК [110,111]. Ця кореляція зумовлена взаємодією між імунною системою та метаболізмом кісткової тканини [112]. Вплив ліпополісахаридів може спричинити втрату щільності кісткової тканини [113], оскільки призводить до активації В- і Т-клітин, які регулюють резорбцію кісткової тканини [112].
Крім того, лікування сепсису і саме захворювання, пов’язане з фізичним розпадом новонародженого, може подовжити застосування парентерального харчування з підвищеним ризиком МЗК [111].
Холестаз призводить до зниження абсорбції вітаміну D. Недоношені діти, особливо з гестаційним віком < 32 тижнів, зазвичай мають низький рівень 25-гідроксивітаміну D у сироватці крові [114].
Літохолева кислота посилює холестаз і діє як аналог вітаміну D, зменшуючи його всмоктування [115].
Крім того, білірубін і жовчна кислота підвищують і пригнічують функцію остеобластів, що негативно впливає на процес мінералізації [116].
Lee та співавт. у своєму ретроспективному дослідженні “випадок-контроль” вивчили історії хвороби 55 немовлят, госпіталізованих у відділення інтенсивної терапії новонароджених у дитячій лікарні Severance. Їх дослідження продемонструвало позитивний зв’язок серед немовлят з ЕНВН з холестазом, пов’язаним з парентеральним харчуванням, БЛД і поганою мінералізацією кісток [107].
5.2.4. Ятрогенні фактори
Можна визначити ятрогенні фактори ризику, такі як прийом препаратів, які можуть змінювати рівень мінералів, і тривале парентеральне харчування [6].
Наріжними каменями терапії хронічних захворювань легень є діуретики та стероїди; за своїм механізмом дії ці препарати призводять до мобілізації кальцію з кісток, загострюючи МЗК – вони зменшують проліферацію остеобластів, стимулюють активацію остеокластів, зменшують абсорбцію кальцію та збільшують ниркову екскрецію [117].
Дефіцит кальцію може призвести до метаболічних змін, пов’язаних із вторинним гіперпаратиреозом. Підвищення рівня ПТГ призводить до втрати фосфатів із сечею і, як наслідок, до гіпофосфатемії. Підвищення ПТГ спричиняє підвищення рівня кальцію в сироватці крові через посилення кісткової реабсорбції, а також ниркової та кишкової абсорбції кальцію. Тому ізольований рівень кальцію в плазмі може не бути корисним скринінговим показником для дітей з ризиком МЗК [5].
Тривале парентеральне харчування часто необхідне недоношеним дітям, які не отримують ентеральне харчування в післяпологовому періоді та/або не можуть досягти повного ентерального харчування в короткостроковій перспективі [118].
Якщо ППХ необхідна протягом періоду, що перевищує 4 тижні, низьке споживання кальцію та фосфатів є поширеним явищем [101].
Пацієнтам на парентеральному харчуванні важко досягти нормального рівня мінералів у сироватці крові – споживання мінералів не досягає навіть 50% від рівня, досягнутого під час внутрішньоутробного життя [119].
Нестача мінеральних препаратів, погана розчинність мінералів та рН перешкоджає використанню парентерального харчування, оскільки не дозволяє забезпечити достатнє надходження мінералів. На розчинність кальцію і фосфатів впливають умови навколишнього середовища, такі як температура і вміст амінокислот, глюкози і ліпідів, а також рН розчину [118,120].
Тому відкладення в кістках мінералів, таких як кальцій і фосфор, у перші тижні життя передчасно народжених дітей не відповідає рівню, необхідному для правильного росту кісток, порівняно з внутрішньоутробним ростом [101]. Крім того, дослідження показують забруднення алюмінієм під час парентерального харчування, що може призвести до МЗК [121], оскільки відбувається надмірне відкладення алюмінію на поверхні мінералізації кісток, що перешкоджає формуванню кісткової тканини, не даючи остеобластам функціонувати [122].
6. Скринінг та моніторинг
Важливість максимального зміцнення здоров’я кісток сьогодні визнається лікарями, тому було розроблено багато скринінгових тестів, але оптимальний з них ще не визначений [12,123].
Фактори ризику допомагають нам у виборі того, на що проводити скринінг [12,118].
У недоношених дітей вміст мінералів у кістковій тканині недостатній для нормального росту кісток; про це можуть свідчити електролітні зміни та аномальні рівні деяких гормонів у крові та при візуалізації [5].
Для покращення лінійного росту передчасно народжених дітей з факторами ризику МЗК необхідне регулярне спостереження та моніторинг. Метою є підтримання рівня кальцію та фосфору в крові в межах норми та уникнення надмірної екскреції кальцію з сечею [95].
Kolisambeevi та співавт. провели проспективне дослідження з метою зниження частоти МЗК у немовлят з ДНВН з гестаційним віком ≤ 30 тижнів [124].
Згідно з цим дослідженням, моніторинг рівня фосфору необхідний з перших днів життя, а добавки, внутрішньовенні та/або пероральні, – з 4-го дня життя. При досягненні 40 мл/кг/добу ентерального людського молока поступово вводять збагачувач грудного молока. Частота МЗК становить 2,8% у новонароджених з гестаційним віком від 28 до 30 тижнів і 69,2% у новонароджених з гестаційним віком ≤ 26 тижнів. З огляду на отримані результати, автори пропагують обов’язкове раннє використання фосфорних добавок [124].
Для ранньої діагностики мінерального дефіциту важливе значення має визначення біохімічних маркерів у сироватці крові. Найчастіше використовують такі біохімічні показники крові, як сироватковий кальцій, сироватковий фосфор, лужна фосфатаза, ПТГ і 25(OH)D [95].
Кальцій: гіпокальціємія (скориговані значення для альбумінемії) свідчить про гіпокальціємію, якщо <8,5 мг/дл. Рівень кальцію в сироватці крові регулюється кальцитоніном і ПТГ. Коли рівень циркулюючого кальцію знижується, організм мобілізує кальцій під кістковою тканиною, стимулюючи ПТГ підтримувати адекватний рівень кальцію в сироватці крові; крім того, на рівень кальцію в сироватці крові може впливати гіпофосфатемія [102].
Кальцій у крові знижується лише тоді, коли виснажуються запаси кісткового кальцію, тобто на пізній стадії МЗК. Тому діагностика МЗК на ранній стадії за рівнем кальцію в крові не має сенсу [95].
Фосфати: фосфоремія є хорошим показником для оцінки запасів фосфору в кістках; стійке зниження рівня фосфору в сироватці крові свідчить про недостатнє його надходження, що підвищує ризик розвитку остеопорозу. Коли рівень фосфору в крові залишається стійко низьким, посилюється резорбція кісток, екскреція кальцію з сечею продовжує збільшуватися, що призводить до виснаження кальцію [95].
Рівень фосфатів у сироватці крові <5,5 мг/дл є підозрілим; це перший маркер порушення мінерального обміну в кістках, який з’являється у 7-14-денному віці. У новонароджених, які перебувають виключно на грудному вигодовуванні, рівень фосфору в сироватці крові < 3,6 мг/дл свідчить про тяжкий дефіцит мінеральних речовин, а отже, про вищий ризик розвитку МЗК [125].
Протягом перших місяців життя у недоношених дітей, особливо з проблемами дихання та шлунково-кишковими ускладненнями або тих, хто приймав метилксантини, діуретики чи кортикостероїди, слід ретельно контролювати рівень фосфору в сироватці крові [51].
Гіпофосфатемія також стимулює нирковий канальцевий синтез вітаміну D з подальшим сприянням всмоктуванню кальцію в кишечнику. Таким чином, дефіцит фосфатів може бути причиною гіперкальціємії, гіперкальціурії та нефрокальцинозу [5].
Лужна фосфатаза (ЛФ): ЛФ, маркер кісткового обміну, фізіологічно зростає протягом перших 3 тижнів життя з піком у віці 6-12 тижнів [126].
Рівень ЛФ > 500 МО/л вказує на порушення кісткового гомеостазу. Якщо показники становлять 700 МО/л, вони вказують на демінералізацію, навіть у безсимптомних пацієнтів; насправді, підвищення рівня лужної фосфатази в крові може передувати появі клінічних симптомів [95,127]. У деяких дослідженнях для немовлят з ДНВН рекомендується проводити рентгенографію зап’ястя та/або колінних суглобів, якщо принаймні два значення ЛФ > 800 МО/л реєструються через 1 тиждень [128].
Viswanathan та співавт. продемонстрували, що у немовлят з ЕНВН з терміном гестації <30 тижнів виявлення ЛФ > 500 МО/л асоціюється з МЗК [117].
ЛФ > 1000 МО/л можна вважати маркером рахіту [129]. Використання ЛФ у поєднанні з фосфором крові підвищує специфічність. ЛФ > 900 МО/л при фосфорі сироватки крові < 5,6 мг/дл (< 1,8 ммоль/л) має чутливість 100% і специфічність 70% [130]. Вимірювання сироваткового фосфату та ЛФ рекомендовано проводити щотижня або раз на два тижні [131].
Паратиреоїдний гормон (ПТГ): Концентрація іонів кальцію в плазмі регулює секрецію ПТГ. Дослідження показують, що концентрацію ПТГ можна використовувати як інструмент, поряд з іншими параметрами, для скринінгу та моніторингу МЗК [132]. Зокрема, рівень ПТГ у сироватці крові може бути корисним маркером для виявлення немовлят з ЕНВН, які мають ризик розвитку МЗК: ПТГ > 100 пг/мл може свідчити про наявність у немовлят з ЕНВН ризику розвитку МЗК [133]. Дослідження показують, що рівень ПТГ у сироватці крові може прогнозувати зниження вмісту мінеральних речовин у кістковій тканині у недоношених дітей, які досягли доношеного віку [134].
ПТГ є маркером вторинного гіперпаратиреозу і в поєднанні з канальцевою реабсорбцією фосфору (КРФ) може допомогти розрізнити причини гіпофосфатемії. Низька КФК при високих рівнях ПТГ може вказувати на дефіцит кальцію. Висока КФК при низьких рівнях ПТГ або нормальних показниках, навпаки, вказує на нестачу фосфору [5].
При застосуванні лише фосфорних добавок для немовлят з низькою вагою при народженні відбувається стимуляція вторинного гіперпаратиреозу, що може підвищити ризик МЗК [51].
Підвищений рівень ПТГ у сироватці крові був виявлений у понад 80% немовлят з ЕНВН з ознаками остеопенії [133].
Вітамін D (25(OH)D): У разі МЗК рівень 25(OH)D у сироватці крові може бути нормальним, зниженим або підвищеним, тому його не використовують як скринінговий маркер [95].
Кілька досліджень задокументували зв’язок між низьким рівнем 25(OH)D і низьким гестаційним віком на момент пологів, тому недоношені діти є вразливою групою щодо статусу вітаміну D [114].
Ретельний моніторинг рівня вітаміну D не є необхідним, якщо немає протипоказань для регулярного прийому вітаміну D, оскільки це дорогий моніторинг [67]. За даними літератури, рівень 25(OH)D > 50 нмоль/л запобігає розвитку рахіту у немовлят і дітей [135].
Нещодавня література, в тому числі щодо неонатальних популяцій, демонструє нормалізацію ПТГ до рівня > 75 нмоль/л за наявності адекватного рівня 25(OH)D у сироватці крові [136].
Сироватковий остеокальцин (ОК) Сироватковий остеокальцин – це білок кісткового матриксу, рівень якого підвищується під час високого обороту кісткової тканини. Однак немає доказів того, що підвищений рівень ОК в сироватці крові корелює з вмістом мінеральних речовин у кістковій тканині в перші чотири місяці життя [137]. Czech-Kowalska та співавт. припускають, що рівень ОК та екскреція фосфатів із сечею можуть бути маркерами поганої мінералізації кісткової тканини у 3-місячному віці [134].
Маркери сечі: Біохімічні показники сечі включають фосфор сечі, кальцій сечі, фосфор/креатинін сечі, кальцій/креатинін сечі та КРФ [12]. Формула для розрахунку КРФ виглядає наступним чином: [1 – (фосфор сечі/креатинін сечі × креатинін сироватки/фосфор сироватки)] × 100. Нормальне значення КРФ становить 78-91%; при значеннях > 95% – це маркер недостатньої фосфатної інтеграції [138]. Діти, народжені в терміні гестації < 28 тижнів, мають нижчий рівень фосфатів, ніж інші передчасно народжені, з високою екскрецією фосфатів із сечею, навіть за наявності низького рівня фосфатів у сироватці крові. Ниркова реабсорбція фосфатів збільшується внаслідок підвищення рівня ПТГ, спричиненого, в свою чергу, гіпосфатемією. Чітких рекомендацій щодо моніторингу не існує, хоча багато клініцистів погоджуються контролювати лабораторні аналізи кожні 1-2 тижні. Abrams та співавт. рекомендують вимірювати рівень фосфору в крові та ЛФ щотижня або раз на два тижні [118]. Land та співавт. рекомендують вимірювати рівень кальцію та фосфору в сироватці крові, що супроводжується кальціурією та фосфатурією, щотижня у недоношених дітей віком до трьох тижнів та двічі на тиждень у дітей віком понад 3 тижні [139]. Harrison та співавт. рекомендують щотижневе вимірювання рівнів кальцію та фосфору в сироватці крові, а також лужної фосфатази та креатинфосфокінази [12].
Рентгенівські промені корисні лише при важкій МЗК зі значними ознаками остеопорозу або переломами кісток; остеопороз із втратою <20-40% кісткової тканини може бути неочевидним за допомогою цього методу, тому вони не підходять для ранньої діагностики. Зміни, які можна виявити за допомогою рентгенівських променів, – це демінералізація або “остеопенія”, рахітичні зміни, остеопороз кінців довгих кісток, епіфізарні зміни (чашоподібні або задирки), розширення кінців ребер, субперіостальне утворення нової кісткової тканини або переломи [12,95].
Koo та співавт. описують рентгенологічні зміни: ступінь (1) розрідження кісткової тканини; ступінь (2) розрідження кісткової тканини з метафізарними змінами та субперіостальними кістковими утвореннями; ступінь (3) спонтанні переломи [140].
Деякі переломи можуть бути гострими, що проявляється болем або неможливістю рухів, але частіше переломи протікають безсимптомно [141]. Американська академія педіатрії рекомендує робити рентгенограми кожні 5-6 тижнів, поки не покращиться мінералізація [118].
Золотим стандартом для виявлення остеопорозу є двоенергетична рентгенівська абсорбціометрія (ДЕРА) [142], придатна для передчасно народжених дітей [143]. ДЕРА розраховує МЩКТ [142,144], тобто вміст кісткового кальцію в грамах гідроксиапатиту на квадратний сантиметр, використовуючи низьку дозу іонізуючого випромінювання (діапазон 1-13 мкЗв) [145,146].
У клінічній практиці, однак, важко використовувати цей інструмент у недоношених та доношених дітей з різних причин: інструментальні розміри, час, що витрачається на рухові артефакти; його використання для скринінгу МЗК не підходить для рутинного скринінгу, оскільки його складно виконати [95,102].
Ультразвукова кількісна денситометрія (УКД) вимірює вміст мінеральних речовин у кістковій тканині та органічний матрикс кістки [147]. Перевагами його використання порівняно з іншими інструментальними дослідженнями є дешевизна та простота використання портативних приладів. Зазвичай її вимірюють на великогомілковій кістці. УКД оцінює швидкість звуку (ШЗ) та час кісткового проведення (ЧКП). У деяких дослідженнях, щоб зменшити вплив м’яких тканин, для плечової кістки або п’ясткової кістки перевагу надавали ШЗ, а не ЧКП[148,149]. Altuncu та співавт. спостерігали за допомогою УКД зниження мінералізації кісткової тканини у недоношених дітей в ранньому постнатальному періоді: Z-бали великогомілкової кістки недоношених дітей (<33 тижнів, середня маса тіла при народженні 1650 г), оцінені у віці, скоригованому на термін вагітності, були нижчими порівняно з Z-балами на першому тижні постнатального життя. У цьому дослідженні було виявлено, що показники Z гомілкової кістки у недоношених новонароджених у віці, скоригованому на термін доношеності, були обернено пропорційними до рівня ЛФ у сироватці крові: в осіб з рівнем ЛФ > 900 МО/л показники Z гомілкової кістки були нижчими, ніж у немовлят з рівнем ЛФ < 900 МО/л [150].
Rack та співавт. оцінювали якість кісткової тканини за допомогою УКД у когорті 172 недоношених та доношених дітей (гестаційний вік від 23 до 42 тижнів; маса тіла при народженні від 405 до 5130 г): Параметри УКД, оцінені на першому тижні життя, корелювали з гестаційним віком та масою тіла при народженні [151].
З огляду на наявні в літературі дослідження, оцінка УКД у передчасно народжених дітей може відігравати важливу роль у моніторингу здоров’я кісткової тканини. Однак необхідні подальші дослідження для виявлення біохімічних змін, які можуть краще корелювати з показниками УКД [102].
7. Профілактика та лікування остеопенії
При МЗК профілактика відіграє важливішу роль, ніж лікування, і спрямована на забезпечення адекватного надходження кальцію і фосфору для сприяння нормальному розвитку кісток [51].
Для профілактики МЗК необхідно оптимізувати дієту, приділяючи особливу увагу споживанню мінералів (кальцію, фосфору) та вітаміну D. Необхідне індивідуальне призначення мінеральних добавок. Також бажано, за можливості, обмежити тривалий прийом лікарських засобів: петльових діуретиків, метилксантинів та глюкокортикоїдів [11].
Важливо враховувати, що передчасно народжені діти мають інші потреби в мінеральних речовинах, ніж доношені новонароджені [118].
Концентрація 25(OH)D у новонароджених становить близько 80% від материнського рівня, тому немовлята, народжені від матерів з дефіцитом вітаміну D, ймовірно, також мають дефіцит вітаміну D. Рівень 25(OH)D у новонароджених швидко знижується, оскільки період напіввиведення становить близько 21 дня, якщо не розпочати прийом вітаміну D одразу з початком ентерального харчування. Для забезпечення достатнього рівня вітаміну D у новонароджених, особливо в країнах, де дефіцит вітаміну D є поширеним явищем, слід призначати добавки вітаміну D вагітним жінкам [67,68].
Багато груп, включаючи Американську академію педіатрії, Інститут медицини, Ендокринне товариство та Європейське товариство дитячої гастроентерології, гепатології та харчування (ESPGHAN), рекомендують додавання вітаміну D недоношеним та доношеним дітям [118,152,153,154].
Рекомендації Інституту медицини, частково засновані на роботі Priemel та співавт., стверджують, що рівень 25(OH)D повинен становити 50 нмоль/л для досягнення хорошої мінералізації кісткової тканини [155].
Ендокринне товариство рекомендує цільовий рівень >75 нмоль/л та ESPGHAN >80 нмоль/л [153,154].
Існує мало даних про відповідь на прийом вітаміну D у немовлят з масою тіла при народженні < 1200 г [156].
Anderson-Berry та співавт. провели рандомізоване дослідження, щоб оцінити найбільш підходящу дозу вітаміну D для передчасно народжених дітей [156]. Когорта складалася з 32 немовлят, які народилися між 24 і 32 тижнями гестації. Результати цього дослідження підтримують розгляд добової дози 800 МО вітаміну D для немовлят віком < 32 тижнів, які перебувають у відділенні інтенсивної терапії новонароджених, що призвело до покращення рівня 25(OH)D у 4 тижні, підвищення щільності кісткової тканини та покращення лінійного росту [156].
Деякі неонатологи рекомендують добавки вітаміну D для недоношених дітей у дозах 800-1000 МО/добу, що вище, ніж рекомендовано для доношених дітей (400 МО/добу), хоча доказів на користь цього мало, якщо тільки немає дисфункції печінки або кишківника [67,68]. Немає доведених переваг використання активованого вітаміну D (кальцитріолу або альфакальцидолу) порівняно з використанням батьківського вітаміну D, за винятком випадків тяжких захворювань нирок або печінки [67].
Під час ППХ-годування необхідна адекватна кількість кальцію та фосфатів, яка збільшується під час переходу на ентеральне харчування та під час повного ентерального харчування [120].
Pereira-da-Silva та співавт. продемонстрували, що ППХ, які містять високі концентрації кальцію та фосфору протягом перших тижнів життя, можуть запобігти порушенню кісткової тканини у недоношених дітей із середнім гестаційним віком 29,6 тижнів та вагою при народженні 1262 г [120]. Сучасні рекомендації в клінічній практиці відрізняються: для кальцію – від 40 до 120 мг/кг/добу, для фосфатів – від 30 до 70 мг/кг/добу [120]. Введення високого споживання білка та калорій в ППХ в перші дні життя, пов’язане з раннім ентеральним харчуванням, має ефект збільшення клітинного поглинання фосфатів [157].
Щоб запобігти шкоді від ППХ, перехід від повного парентерального харчування до ентерального має бути максимально прискорений [95].
Насправді, під час ентерального харчування через шлунково-кишковий тракт всмоктування фосфору може сягати понад 90% [158]. Тому в перші тижні життя недоношених дітей ентеральне харчування забезпечує ефективне засвоєння кальцію та фосфору [95].
Деякі дослідження показують, що немовлята, яких годували виключно грудним молоком, мали нижчий рівень фосфору в сироватці крові, ніж ті, кого годували спеціальними сумішами або приймали мінеральні добавки [159].
Дослідження показують, що рахіт зустрічається в 40% випадків у недоношених дітей, яких вигодовували незбагаченим грудним молоком, порівняно з 16% тих, кого годували спеціальними сумішами [160].
Фортифікація залишається важливою для забезпечення адекватного споживання мінеральних речовин: 180 і 200 мл/день незбагаченого грудного молока, ймовірно, забезпечують лише 1/3 рівня кальцію і фосфору під час росту, незважаючи на те, що дитина поглинає 60% кальцію і 80% фосфору з грудного молока [161].
Слід дотримуватися обережності при використанні не збагаченого донорського молока через нижчий вміст фосфору, ніж у свіжому грудному молоці [11]. Новонароджені досягають оптимального рівня споживання мінеральних речовин при приблизно 180-220 мг/кг/добу кальцію та 100-130 мг/кг/добу фосфору [118]. Діти з критичними захворюваннями можуть потребувати цільових мінеральних добавок кальцію та/або фосфору [5].
Нещодавнє дослідження, проведене у Великій Британії, підкреслює, що неонатологи вважають фосфатні добавки стандартним методом лікування метаболічних захворювань кісток у недоношених дітей. Добавки кальцію асоціюються лише з меншою кількістю випадків [132].
Фосфорні добавки слід призначати, якщо показники знижуються до <5,5 мг/дл [118].
Рекомендована доза фосфорних добавок становить від 10 мг/кг/добу до 50 мг/кг/добу. Індивідуальна реакція на лікування може відрізнятися залежно від клінічного стану, рН кишечника, всмоктування та індивідуальної переносимості. Найкращою формою фосфорних добавок є фосфат калію для внутрішньовенного введення, який призначають ентерально через кишкову непереносимість інших доступних фосфорних солей. Також можуть використовуватися альтернативні препарати, наприклад, у формі таблеток або порошку. Пацієнти, які приймають калійзберігаючі діуретики, повинні перебувати під ретельним наглядом, звертаючи увагу на будь-які електролітні порушення, оскільки ці альтернативні препарати містять натрій і калій [5]. Слід призначати фосфатні добавки, переконавшись, що підтримується збалансоване співвідношення кальцію та фосфатів [51].
Ідеальне співвідношення споживання кальцію і фосфатів для оптимізації утримання фосфатів і засвоєння кальцію становить приблизно 1,5-1,7:1 [118].
У випадках вторинного гіперпаратиреозу та низької КРФ можна розглянути можливість призначення препаратів кальцію [5]. Якщо ПТГ підвищений, що свідчить про дефіцит кальцію, рекомендується пероральне застосування кальцію для нормалізації рівнів ПТГ, фосфатів та ЛФ у плазмі крові. Рекомендована доза препаратів кальцію становить спочатку 20 мг/кг/добу до 70-100 мг/кг/добу [118,133]. Ця доза може бути збільшена у недоношених дітей з тяжкими порушеннями кісткового метаболізму [51].
Існують також немедикаментозні методи лікування МЗК. Відомо, що механічна стимуляція відіграє певну роль у стимулюванні росту кісток. Рухи плода, що здійснюються проти стінки матки, допомагають забезпечити адекватну мінералізацію кісткової тканини та адекватний розвиток м’язів [162]. Ці рухи не можуть бути відтворені в перинатальному періоді під час перебування у відділенні інтенсивної терапії новонароджених. Фізична терапія може забезпечити необхідну стимуляцію за допомогою механічного навантаження на кістки та суглоби, що стимулює формування та ріст кісток [163].
Фізіотерапевтичні методики, засновані на застосуванні пасивних рухів з легкою компресією, продемонстрували сприятливий вплив на передчасно народжених дітей. З іншого боку, відсутність навантаження збільшує резорбцію кісткової тканини і зменшує кісткову масу [164].
Нещодавнє дослідження використовувало рефлекторно-локомоторну терапію (РЛТ) для вироблення мимовільних активно-резистивних рухів у недоношених немовлят [165].
РЛТ є ефективним методом, більш ефективним, ніж інші фізіотерапевтичні методи, для сприяння росту і формуванню кісток та запобігання остеопенії [166]. РЛТ через пропріоцептивні стимули викликає реакцію центральної нервової системи, що призводить до мимовільних активних рухів у дітей [167].
Отже, адекватний прийом добавок кальцію, фосфору та вітаміну D і протокол фізіотерапії, а також оптимальне харчування є основою профілактики та лікування метаболічних захворювань кісток у немовлят.
8. Подальші дії після виписки
Отже, новонароджена дитина має набагато нижчу швидкість росту скелета, ніж плід, оскільки, незалежно від гестаційного віку, трансплацентарний транспорт знижується при народженні з негайним зменшенням циркулюючого кальцію [38].
Рівень кальцію, гарантований плоду протягом третього триместру, дуже важко досягти “штучно”. Однак існують фортифікатори, спеціально розроблені для немовлят, які харчуються материнським молоком, а також деякі молочні суміші з високою концентрацією мінералів, які забезпечують ріст кісткової тканини на рівні або близькому до внутрішньоутробного [161].
Збагачене грудне молоко та суміші для передчасно народжених дітей, як правило, є кращими, ніж суміші з соєю або елементарні суміші, в яких не вистачає кальцію та фосфору на рівні, достатньому для передчасно народженої дитини [118].
Суміші для недоношених дітей або збагачення грудного молока показані максимум до 52 тижнів з моменту зачаття або, у разі поганого росту, до 6 місяців. Тривалість збагачення все ще обговорюється. Немовлята, яких вигодовували недоношеними сумішами, у віці близько 6 місяців досягають мінералізації кісток, порівнянної з мінералізацією кісток у доношених немовлят. З іншого боку, недоношені діти, яких годують грудним молоком, досягають мінералізації кісток, порівнянної з мінералізацією кісток доношених дітей, у віці близько 2 років [168].
Рішення щодо харчової підтримки приймаються на основі показників росту, а частота біохімічного моніторингу визначається тяжкістю лабораторних показників МЗК.
Особливу увагу слід звернути на адекватне харчування, оскільки надмірні дози можуть спричинити гіперкальціурію та нефрокальциноз [5]. З цієї причини може бути корисним мультидисциплінарний підхід із залученням дієтолога, який має досвід у сфері здоров’я новонароджених та/або кісткової тканини.
9. Нові технології
На сьогоднішній день рання інструментальна діагностика МЗК є досить складною. Насправді, традиційні методи візуалізації в основному виявляють відверті ознаки патології, такі як переломи або значна демінералізація (зниження мінералізації на 20-40%), події, які відбуваються на запущеній стадії, тому не підходять для ранньої діагностики [169].
В даний час першим кроком, який використовує клініцист для виявлення низької мінералізації кісткової тканини, є рентгенографія або УКД, коли це можливо, навіть якщо золотим стандартом є ДЕРА.
Цю методику можна використовувати як у доношених, так і недоношених дітей, при цьому поперековий відділ хребта, передпліччя і п’ятка вважаються переважними областями обстеження [170]. Однак її використання суттєво обмежене розміром інструменту, часом, необхідним для виконання знімків, наявністю рухомих артефактів та неможливістю виконання у ліжку [102].
Застосування ДЕРА не дозволяється під час вагітності, оскільки це може призвести до впливу іонізуючого випромінювання на плід [171,172].
Більше того, ДЕРА надає кількісну інформацію про кісткову тканину, але не оцінює якісну інформацію [144].
Новою неінвазивною інструментальною методикою є УКД, яка за допомогою ультразвуку розраховує ШЗ і ЧКП кістки, оцінюючи як мінеральний вміст кістки, так і органічний матрикс [147,170].
Порівняно з ДЕРА, ця методика має переваги: низька вартість, невеликий інструментарій, можливість проведення обстеження біля ліжка пацієнта і, особливо, відсутність іонізуючого випромінювання. Однак результати цього методу залежать від оператора і мають нижчу діагностичну точність, ніж у ДЕРА. Тому використання УКД також суттєво обмежене в клінічній практиці [173,174].
Нещодавно була валідована нова технологія, відома як радіочастотна ультразвукова спектрометрія (РЕМС), що базується на використанні ультразвуку. Вона є дуже корисною в клінічній практиці для оцінки міцності кісток, прогнозування ризику переломів та загального ведення пацієнта з остеопорозом [144,175].
Технологія РЕМС точно оцінює МЩКТ на рівні шийки стегнової кістки та поперекових хребців, які вважаються центральними анатомічними референтними ділянками. Під час ультразвукового сканування приймаються так звані радіочастотні сигнали, які інтегруються з ультразвуковим зображенням. Радіочастоти – це нативні нефільтровані ультразвукові сигнали, які дозволяють отримати максимум інформації про досліджувану тканину, на відміну від того, що відбувається в звичайному ультразвуковому процесі, де обробляються лише деякі сигнали [144]. Завдяки повністю автоматичному алгоритму величезна кількість зібраних даних перетворюється в специфічний спектр пацієнта, який потім порівнюється з еталонними спектральними моделями за статтю, віком, ділянкою та ІМТ, витягнутими зі спеціальної бази даних [176,177]. Таким чином, можна отримати дуже точну оцінку здоров’я кістки, як кількісну, так і якісну, що дозволяє класифікувати тканину як здорову, остеопенічну або остеопоротичну [144].
Метод РЕМС, як продемонстровано в декількох дослідженнях, має чутливість і специфічність 90,4% і 95,5% відповідно, порівняно з ДЕРА [178], і є таким же точним і відтворюваним, як і ДЕРА, в оцінці МЩКТ шийки стегнової кістки [179,180]. Перевагами технології РЕМС є нижча вартість, доступність в умовах первинної медичної допомоги без потреби в спеціальному обладнанні або сертифікованих операторах, надзвичайна простота використання завдяки простій та інтуїтивно зрозумілій процедурі збору даних, високі показники відтворюваності досліджень, що гарантуються швидкою та повністю автоматизованою обробкою даних, а також використання ультразвуку, безпечного для плода [144,175]. Всі ці якості роблять РЕМС вибірковою технологією для розширеного масового скринінгу [175].
Наразі використання РЕМС не є настільки поширеним у клінічній практиці. На Зобр. 3 ми пропонуємо алгоритм, який передбачає використання РЕМС у пренатальному періоді для виявлення новонароджених з групи ризику, а в постнатальному періоді – інтеграцію отриманих даних з лабораторними маркерами для визначення рівня мінералізації кісткової тканини.
Зображення 3. Пропозиція алгоритму: комплексне використання лабораторних та сечових аналізів з новими технологіями для оцінки рівня мінералізації кісткової тканини.
10. Заключення
Кісткова маса чутлива до багатьох пре- та постнатальних ушкоджень. Досягнення біотехнології та генетики дозволили ідентифікувати численні мікроРНК, які сприяють розвитку кісткової тканини, що відіграє важливу роль у ранньому виявленні пацієнтів з високим ризиком розвитку остеопенії. Для впровадження більш комплексної профілактики важливо не лише визначити фактори, які впливають на кісткову тканину в постнатальному періоді, але й, за можливості, втручатися в пренатальному періоді, оптимізуючи харчування матері та внутрішньоутробний ріст. Такі стратегії слід заохочувати як заходи громадської охорони здоров’я для зменшення витрат, пов’язаних з ускладненнями остеопенії. На сьогоднішній день не існує уніфікованих рекомендацій, які б роз’яснювали правильний процес діагностики та ведення пацієнтів з остеопенією. У літературі також бракує загальних рекомендацій щодо належної профілактики. Тому існує необхідність заохочення використання неінвазивних методів у пре- та післяпологовому періоді для здійснення найкращої профілактики та створення нових алгоритмів діагностики та моніторингу мінеральної щільності кісткової тканини.
Абревіатури
| РЕМС | радіочастотна ультразвукова спектрометрія |
| МЩКТ | мінеральна щільність кісткової тканини |
| МЗК | метаболічне захворювання кісток |
| ДНВН | дуже низька вага при народженні |
| ЕНВН | екстремально низька вага при народженні |
| ЗВУР | затримка внутрішньоутробного розвитку |
| БЛД | бронхолегенева дисплазія |
| НЕК | некротизуючий ентероколіт |
| ППХ | повне парентеральне харчування |
| ПТГ | паратгормон |
| ПТГпП | протеїн, подібний до паратиреоїдного гормону |
| КМБ | кістковий морфогенетичний білок |
| ЕД | ендокринні дизраптори |
| PAX1 | ген парного боксу 1 |
| RANKL | ядерний активуючий фактор каппа-b рецептора |
| ОПГ | остеопротегерин |
| ФРФ23 | фактор росту фібробластів 23 |
| ТНЛФ | тканинно неспецифічна лужна фосфатаза |
| ЕНПФ | ектонуклеотид пірофосфатаза |
| АНК | анкілоз |
| КаЧР | кальцій-чутливі рецептори |
| ЛФ | лужна фосфатаза |
| ГР/ІФР-1 | гормон росту/інсуліноподібний фактор росту 1 |
| ОА | оксид азоту |
| НАДФ | нікотинамідаденіндинуклеотидфосфат |
| ОС | окислювальний стрес |
| ЕД | ендокринні дизраптори |
| КРФ | канальцева реабсорбція фосфору |
| ОК | остеокальцин |
| ДЕРА | двохенергетична рентгенівська абсорбціометрія |
| УКД | ультразвукова кількісна денситометрія |
| ШЗ | швидкість звуку |
| ЧКП | час кісткового проведення |
| РЛТ | рефлекторно-локомоторна терапія |
Посилання на джерела
- Masztalerz-Kozubek, D.; Zielinska-Pukos, M.A.; Hamulka, J. Maternal Diet, Nutritional Status, and Birth-Related Factors Influencing Offspring’s Bone Mineral Density: A Narrative Review of Observational, Cohort, and Randomized Controlled Trials. Nutrients 2021, 13, 2302.
- Baird, J.; Kurshid, M.A.; Kim, M.; Harvey, N.; Dennison, E.; Cooper, C. Does birthweight predict bone mass in adulthood? A systematic review and meta-analysis. Osteoporos. Int. 2011, 22, 1323–1334.
- Godfrey, K.; Walker-Bone, K.; Robinson, S.; Taylor, P.; Shore, S.; Wheeler, T.; Cooper, C. Neonatal bone mass: Influence of parental birthweight, maternal smoking, body composition, and activity during pregnancy. J. Bone Miner. Res. 2001, 16, 1694–1703.
- Lanham, S.A.; Roberts, C.; Perry, M.J.; Cooper, C.; Oreffo, R.O. Intrauterine programming of bone. Part 2: Alteration of skeletal structure. Osteoporos. Int. 2008, 19, 157–167.
- Rustico, S.E.; Calabria, A.C.; Garber, S.J. Metabolic bone disease of prematurity. J. Clin. Transl. Endocrinol. 2014, 1, 85–91.
- Backström, M.C.; Kuusela, A.L.; Mäki, R. Metabolic bone disease of prematurity. Ann. Med. 1996, 28, 275–282.
- Rigo, J.; Pieltain, C.; Salle, B.; Senterre, J. Enteral calcium, phosphate and vitamin D requirements and bone mineralization in preterm infants. Acta Paediatr. 2007, 96, 969–974.
- Schulz, E.V.; Wagner, C.L. History, epidemiology and prevalence of neonatal bone mineral metabolic disorders. Semin. Fetal Neonatal Med. 2020, 25, 101069.
- Akbari, S.; Rasouli-Ghahroudi, A.A. Vitamin K and Bone Metabolism: A Review of the Latest Evidence in Preclinical Studies. Biomed Res. Int. 2018, 2018, 4629383.
- Tenta, R.; Bourgiezi, I.; Aliferis, E.; Papadopoulou, M.; Gounaris, A.; Skouroliakou, M. Bone metabolism compensates for the delayed growth in small for gestational age neonates. Organogenesis 2013, 9, 55–59.
- Poundarik, A.A.; Boskey, A.; Gundberg, C.; Vashishth, D. Biomolecular regulation, composition and nanoarchitecture of bone mineral. Sci. Rep. 2018, 8, 1191.
- Harrison, C.M.; Johnson, K.; McKechnie, E. Osteopenia of prematurity: A national survey and review of practice. Acta Paediatr. 2008, 97, 407–413.
- Bocheva, G.; Boyadjieva, N. Epigenetic regulation of fetal bone development and placental transfer of nutrients: Progress for osteoporosis. Interdiscip. Toxicol. 2011, 4, 167–172.
- Dimas, A.; Politi, A.; Bargiota, A.; Panoskaltsis, T.; Vlahos, N.F.; Valsamakis, G. The Gestational Effects of Maternal Bone Marker Molecules on Fetal Growth, Metabolism and Long-Term Metabolic Health: A Systematic Review. Int. J. Mol. Sci. 2022, 23, 8328.
- Berendsen, A.D.; Olsen, B.R. Bone development. Bone 2015, 80, 14–18.
- Olsen, B.R.; Reginato, A.M.; Wang, W. Bone development. Annu. Rev. Cell Dev. Biol. 2000, 16, 191–220.
- Sethi, A.; Priyadarshi, M.; Agarwal, R. Mineral and bone physiology in the foetus, preterm and full-term neonates. Semin. Fetal Neonatal Med. 2020, 25, 101076.
- Cooper, C.; Westlake, S.; Harvey, N.; Javaid, K.; Dennison, E.; Hanson, M. Review: Developmental origins of osteoporotic fracture. Osteoporos. Int. 2006, 17, 337–347.
- Fernandez-Teran, M.; Ros, M.A. The Apical Ectodermal Ridge: Morphological aspects and signaling pathways. Int. J. Dev. Biol. 2008, 52, 857–871.
- Mackie, E.J.; Ahmed, Y.A.; Tatarczuch, L.; Chen, K.S.; Mirams, M. Endochondral ossification: How cartilage is converted into bone in the developing skeleton. Int. J. Biochem. Cell Biol. 2008, 40, 46–62.
- Shum, L.; Nuckolls, G. The life cycle of chondrocytes in the developing skeleton. Arthritis Res. 2002, 4, 94–106.
- Vortkamp, A.; Lee, K.; Lanske, B.; Segre, G.V.; Kronenberg, H.M.; Tabin, C.J. Regulation of rate of cartilage differentiation by Indian hedgehog and PTH-related protein. Science 1996, 273, 613–622.
- Caetano-Lopes, J.; Canhão, H.; Fonseca, J.E. Osteoblasts and bone formation. Acta Reumatol. Port. 2007, 32, 103–110.
- Karsenty, G.; Wagner, E.F. Reaching a genetic and molecular understanding of skeletal development. Dev. Cell 2002, 2, 389–406.
- Hensley, A.P.; McAlinden, A. The role of microRNAs in bone development. Bone 2021, 143, 115760.
- Yan, X.; Wang, H.; Li, Y.; Jiang, Y.; Shao, Q.; Xu, W. MicroRNA-92a overexpression promotes the osteogenic differentiation of bone mesenchymal stem cells by impeding Smad6-mediated runt-related transcription factor 2 degradation. Mol. Med. Rep. 2018, 17, 7821–7826.
- Gao, X.L.; Cao, M.G.; Ai, G.G.; Hu, Y.B. Mir-98 reduces the expression of HMGA2 and promotes osteogenic differentiation of mesenchymal stem cells. Eur. Rev. Med. Pharmacol. Sci. 2018, 22, 3311–3317.
- Aquino-Martinez, R.; Farr, J.N.; Weivoda, M.M.; Negley, B.A.; Onken, J.L.; Thicke, B.S.; Fulcer, M.M.; Fraser, D.G.; van Wijnen, A.J.; Khosla, S.; et al. miR-219a-5p Regulates Rorβ During Osteoblast Differentiation and in Age-related Bone Loss. J. Bone Miner. Res. 2019, 34, 135–144.
- Ferreira, J.C.; Choufani, S.; Grafodatskaya, D.; Butcher, D.T.; Zhao, C.; Chitayat, D.; Shuman, C.; Kingdom, J.; Keating, S.; Weksberg, R. WNT2 promoter methylation in human placenta is associated with low birthweight percentile in the neonate. Epigenetics 2011, 6, 440–449.
- Scillitani, A.; Jang, C.; Wong, B.Y.; Hendy, G.N.; Cole, D.E. A functional polymorphism in the PTHR1 promoter region is associated with adult height and BMD measured at the femoral neck in a large cohort of young caucasian women. Hum. Genet. 2006, 119, 416–421.
- Vilariño-Güell, C.; Miles, L.J.; Duncan, E.L.; Ralston, S.H.; Compston, J.E.; Cooper, C.; Langdahl, B.L.; MacLelland, A.; Pols, H.A.; Reid, D.M.; et al. PTHR1 polymorphisms influence BMD variation through effects on the growing skeleton. Calcif. Tissue Int. 2007, 81, 270–278.
- Gupta, A.; Välimäki, V.-V.; Välimäki, M.J.; Löyttyniemi, E.; Richard, M.; Bukka, P.L.; Goltzman, D.; Karaplis, A.C. Variable number of tandem repeats polymorphism in parathyroid hormone-related protein as predictor of peak bone mass in young healthy Finnish males. Eur. J. Endocrinol. 2008, 158, 755–764.
- Funke, S.; Morava, E.; Czakó, M.; Vida, G.; Ertl, T.; Kosztolányi, G. Influence of genetic polymorphisms on bone disease of preterm infants. Pediatr. Res. 2006, 60, 607–612.
- Sundar, I.K.; Rahman, I. Vitamin d and susceptibility of chronic lung diseases: Role of epigenetics. Front. Pharmacol. 2011, 2, 50.
- Ralston, S.H. Genetics of osteoporosis. Ann. N. Y. Acad. Sci. 2010, 1192, 181–189.
- Baek, W.Y.; Kim, J.E. Transcriptional regulation of bone formation. Front. Biosci. 2011, 3, 126–135.
- іMatsubara, T.; Kida, K.; Yamaguchi, A.; Hata, K.; Ichida, F.; Meguro, H.; Aburatani, H.; Nishimura, R.; Yoneda, T. BMP2 regulates Osterix through Msx2 and Runx2 during osteoblast differentiation. J. Biol. Chem. 2008, 283, 29119–29125.
- Arnold, A.; Dennison, E.; Kovacs, C.S.; Mannstadt, M.; Rizzoli, R.; Brandi, M.L.; Clarke, B.; Thakker, R.V. Hormonal regulation of biomineralization. Nat. Rev. Endocrinol. 2021, 17, 261–275.
- Couce, M.L.; Saenz de Pipaon, M. Bone Mineralization and Calcium Phosphorus Metabolism. Nutrients 2021, 13, 3692.
- Vannucci, L.; Fossi, C.; Quattrini, S.; Guasti, L.; Pampaloni, B.; Gronchi, G.; Giusti, F.; Romagnoli, C.; Cianferotti, L.; Marcucci, G.; et al. Calcium Intake in Bone Health: A Focus on Calcium-Rich Mineral Waters. Nutrients 2018, 10, 1930.
- Boivin, G.; Meunier, P.J. The degree of mineralization of bone tissue measured by computerized quantitative contact microradiography. Calcif. Tissue Int. 2002, 70, 503–511.
- Michigami, T.; Ozono, K. Roles of Phosphate in Skeleton. Front. Endocrinol. 2019, 10, 180.
- de Bruyn, J.R.; Goiko, M.; Mozaffari, M.; Bator, D.; Dauphinee, R.L.; Liao, Y.; Flemming, R.L.; Bramble, M.S.; Hunter, G.K.; Goldberg, H.A. Dynamic light scattering study of inhibition of nucleation and growth of hydroxyapatite crystals by osteopontin. PLoS ONE 2013, 8, e56764.
- Kato, K.; Nishimasu, H.; Okudaira, S.; Mihara, E.; Ishitani, R.; Takagi, J.; Aoki, J.; Nureki, O. Crystal structure of Enpp1, an extracellular glycoprotein involved in bone mineralization and insulin signaling. Proc. Natl. Acad. Sci. USA 2012, 109, 16876–16881.
- Gurley, K.A.; Reimer, R.J.; Kingsley, D.M. Biochemical and genetic analysis of ANK in arthritis and bone disease. Am. J. Hum. Genet. 2006, 79, 1017–1029.
- Hasegawa, T. Ultrastructure and biological function of matrix vesicles in bone mineralization. Histochem. Cell Biol. 2018, 149, 289–304.
- Hasegawa, T.; Li, M.; Hara, K.; Sasaki, M.; Tabata, C.; de Freitas, P.H.L.; Hongo, H.; Suzuki, R.; Kobayashi, M.; Inoue, K.; et al. Morphological assessment of bone mineralization in tibial metaphyses of ascorbic acid-deficient ODS rats. Biomed Res. 2011, 32, 259–269.
- Ubaidus, S.; Li, M.; Sultana, S.; de Freitas, P.H.L.; Oda, K.; Maeda, T.; Takagi, R.; Amizuka, N. FGF23 is mainly synthesized by osteocytes in the regularly distributed osteocytic lacunar canalicular system established after physiological bone remodeling. J. Electron. Microsc. 2009, 58, 381–392.
- Hasegawa, T.; Hongo, H.; Yamamoto, T.; Abe, M.; Yoshino, H.; Haraguchi-Kitakamae, M.; Ishizu, H.; Shimizu, T.; Iwasaki, N.; Amizuka, N. Matrix Vesicle-Mediated Mineralization and Osteocytic Regulation of Bone Mineralization. Int. J. Mol. Sci. 2022, 23, 9941.
- Murshed, M. Mechanism of Bone Mineralization. Cold Spring Harb. Perspect. Med. 2018, 8, a031229.
- Chinoy, A.; Mughal, M.Z.; Padidela, R. Metabolic bone disease of prematurity: Causes, recognition, prevention, treatment and long-term consequences. Arch. Dis. Child. Fetal Neonatal Ed. 2019, 104, F560–F566.
- Nehra, D.; Carlson, S.J.; Fallon, E.M.; Kalish, B.; Potemkin, A.K.; Gura, K.M.; Simpser, E.; Compher, C.; Puder, M.A.S.P.E.N. clinical guidelines: Nutrition support of neonatal patients at risk for metabolic bone disease. J. Parenter. Enteral Nutr. 2013, 37, 570–598.
- Lothe, A.; Sinn, J.; Stone, M. Metabolic bone disease of prematurity and secondary hyperparathyroidism. J. Paediatr. Child Health 2011, 47, 550–553.
- Ziegler, E.E.; O’Donnell, A.M.; Nelson, S.E.; Fomon, S.J. Body composition of the reference fetus. Growth 1976, 40, 329–341.
- Levi, M.; Gratton, E.; Forster, I.C.; Hernando, N.; Wagner, C.A.; Biber, J.; Sorribas, V.; Murer, H. Mechanisms of phosphate transport. Nat. Rev. Nephrol. 2019, 15, 482–500.
- Christov, M.; Jüppner, H. Phosphate homeostasis disorders. Best Pract. Res. Clin. Endocrinol. Metab. 2018, 32, 685–706.
- Sapir-Koren, R.; Livshits, G. Bone mineralization is regulated by signaling cross talk between molecular factors of local and systemic origin: The role of fibroblast growth factor 23. Biofactors 2014, 40, 555–568.
- Terkeltaub, R.A. Inorganic pyrophosphate generation and disposition in pathophysiology. Am. J. Physiol. Cell Physiol. 2001, 281, C1–C11.
- Mornet, E. Hypophosphatasia: The mutations in the tissue-nonspecific alkaline phosphatase gene. Hum. Mutat. 2000, 15, 309–315.
- Goltzman, D. Functions of vitamin D in bone. Histochem. Cell Biol. 2018, 149, 305–312.
- van Driel, M.; van Leeuwen, J.P. Vitamin D endocrinology of bone mineralization. Mol. Cell. Endocrinol. 2017, 453, 46–51.
- Balasuriya, C.N.D.; LaRose, T.L.; Mosti, M.P.; Evensen, K.A.I.; Jacobsen, G.W.; Thorsby, P.M.; Stunes, A.K.; Syversen, U. Maternal serum retinol, 25(OH)D and 1,25(OH)2D concentrations during pregnancy and peak bone mass and trabecular bone score in adult offspring at 26-year follow-up. PLoS ONE 2019, 14, e0222712.
- Velkavrh, M.; Paro-Panjan, D.; Benedik, E.; Mis, N.F.; Godnov, U.; Salamon, A.S. The Influence of Maternal Levels of Vitamin D and Adiponectin on Anthropometrical Measures and Bone Health in Offspring. Prilozi 2019, 40, 91–98.
- Boghossian, N.S.; Koo, W.; Liu, A.; Mumford, S.L.; Tsai, M.Y.; Yeung, E.H. Longitudinal measures of maternal vitamin D and neonatal body composition. Eur. J. Clin. Nutr. 2019, 73, 424–431.
- Zhu, K.; Whitehouse, A.J.O.; Hart, P.H.; Kusel, M.; Mountain, J.; Lye, S.; Pennell, C.; Walsh, J.P. Maternal vitamin D status during pregnancy and bone mass in offspring at 20 years of age: A prospective cohort study. J. Bone Miner. Res. 2014, 29, 1088–1095.
- Hyde, N.K.; Brennan-Olsen, S.L.; Mohebbi, M.; Wark, J.D.; Hosking, S.M.; Pasco, J.A. Maternal vitamin D in pregnancy and offspring bone measures in childhood: The Vitamin D in Pregnancy study. Bone 2019, 124, 126–131.
- Pettifor, J.M.; Thandrayen, K. Metabolic Bone Disease of Prematurity. Indian Pediatr. 2022, 59, 833–834.
- Abrams, S.A. Vitamin D and bone minerals in neonates. Early Hum. Dev. 2021, 162, 105461.
- Wagner, C.L.; McNeil, R.B.; Johnson, D.D.; Hulsey, T.C.; Ebeling, M.; Robinson, C.; Hamilton, S.A.; Hollis, B.W. Health characteristics and outcomes of two randomized vitamin D supplementation trials during pregnancy: A combined analysis. J. Steroid Biochem. Mol. Biol. 2013, 136, 313–320.
- von Websky, K.; Hasan, A.A.; Reichetzeder, C.; Tsuprykov, O.; Hocher, B. Impact of vitamin D on pregnancy-related disorders and on offspring outcome. J. Steroid Biochem. Mol. Biol. 2018, 180, 51–64.
- Setia, S.; Sridhar, M.G. Changes in GH/IGF-1 axis in intrauterine growth retardation: Consequences of fetal programming? Horm. Metab. Res. 2009, 41, 791–798.
- Jones, I.E.; Williams, S.M.; Goulding, A. Associations of birth weight and length, childhood size, and smoking with bone fractures during growth: Evidence from a birth cohort study. Am. J. Epidemiol. 2004, 159, 343–350.
- van Montfoort, N.; Finken, M.J.J.; le Cessie, S.; Dekker, F.W.; Wit, J.M. Could cortisol explain the association between birth weight and cardiovascular disease in later life? A meta-analysis. Eur. J. Endocrinol. 2005, 153, 811–817.
- Lillycrop, K.A.; Slater-Jefferies, J.L.; Hanson, M.A.; Godfrey, K.M.; Jackson, A.A.; Burdge, G.C. Induction of altered epigenetic regulation of the hepatic glucocorticoid receptor in the offspring of rats fed a protein-restricted diet during pregnancy suggests that reduced DNA methyltransferase-1 expression is involved in impaired DNA methylation and changes in histone modifications. Br. J. Nutr. 2007, 97, 1064–1073.
- Heppe, D.H.; Medina-Gomez, C.; De Jongste, J.C.; Raat, H.; Ap Steegers, E.; Hofman, A.; Rivadeneira, F.; Jaddoe, V.W. Fetal and childhood growth patterns associated with bone mass in school-age children: The Generation R Study. J. Bone Miner. Res. 2014, 29, 2584–2593.
- Dennison, E.M.; Syddall, H.E.; Fall, C.H.; Javaid, M.K.; Arden, N.K.; Phillips, D.I.W.; Cooper, C. Plasma leptin concentration and change in bone density among elderly men and women: The Hertfordshire Cohort Study. Calcif. Tissue Int. 2004, 74, 401–406.
- Perrone, S.; Santacroce, A.; Picardi, A.; Buonocore, G. Fetal programming and early identification of newborns at high risk of free radical-mediated diseases. World J. Clin. Pediatr. 2016, 5, 172–181.
- Longini, M.; Perrone, S.; Kenanidis, A.; Vezzosi, P.; Marzocchi, B.; Petraglia, F.; Centini, G.; Buonocore, G. Isoprostanes in amniotic fluid: A predictive marker for fetal growth restriction in pregnancy. Free. Radic. Biol. Med. 2005, 38, 1537–1541.
- Yu, Z.; Han, Y.; Shen, R.; Huang, K.; Xu, Y.-Y.; Wang, Q.-N.; Zhou, S.-S.; Xu, D.-X.; Tao, F.-B. Gestational di-(2-ethylhexyl) phthalate exposure causes fetal intrauterine growth restriction through disturbing placental thyroid hormone receptor signaling. Toxicol. Lett. 2018, 294, 1–10.
- Xu, X.; Yekeen, T.A.; Xiao, Q.; Wang, Y.; Lu, F.; Huo, X. Placental IGF-1 and IGFBP-3 expression correlate with umbilical cord blood PAH and PBDE levels from prenatal exposure to electronic waste. Environ. Pollut. 2013, 182, 63–69.
- Bommarito, P.A.; Martin, E.; Fry, R.C. Effects of prenatal exposure to endocrine disruptors and toxic metals on the fetal epigenome. Epigenomics 2017, 9, 333–350.
- Kelley, A.S.; Banker, M.; Goodrich, J.M.; Dolinoy, D.C.; Burant, C.; Domino, S.E.; Smith, Y.R.; Song, P.X.K.; Padmanabhan, V. Early pregnancy exposure to endocrine disrupting chemical mixtures are associated with inflammatory changes in maternal and neonatal circulation. Sci. Rep. 2019, 9, 5422.
- Street, M.E.; Bernasconi, S. Endocrine-Disrupting Chemicals in Human Fetal Growth. Int. J. Mol. Sci. 2020, 21, 1430.
- Dirkes, R.K.; Welly, R.J.; Mao, J.; Kinkade, J.; Vieira-Potter, V.J.; Rosenfeld, C.S.; Bruzina, P.S. Gestational and lactational exposure to BPA or BPS has minimal effects on skeletal outcomes in adult female mice. Bone Rep. 2021, 15, 101136.
- Papaioannou, G.; Mirzamohammadi, F.; Kobayashi, T. MicroRNAs involved in bone formation. Cell. Mol. Life Sci. 2014, 71, 4747–4761.
- Papaioannou, G. miRNAs in Bone Development. Curr. Genom. 2015, 16, 427–434.
- Berger, K.; Hyland, C.; Ames, J.L.; Mora, A.M.; Huen, K.; Eskenazi, B.; Holland, N.; Harley, K.G. Prenatal Exposure to Mixtures of Phthalates, Parabens, and Other Phenols and Obesity in Five-Year-Olds in the CHAMACOS Cohort. Int. J. Environ. Res. Public Health 2021, 18, 1796.
- Lui, J.C.; Garrison, P.; Nguyen, Q.; Ad, M.; Keembiyehetty, C.; Chen, W.; Jee, Y.H.; Landman, E.; Nilsson, O.; Barnes, K.M.; et al. EZH1 and EZH2 promote skeletal growth by repressing inhibitors of chondrocyte proliferation and hypertrophy. Nat. Commun. 2016, 7, 13685.
- Holroyd, C.; Harvey, N.; Dennison, E.; Cooper, C. Epigenetic influences in the developmental origins of osteoporosis. Osteoporos. Int. 2012, 23, 401–410.
- Jee, Y.H.; Wang, J.; Yue, S.; Jennings, M.; Clokie, S.; Nilsson, O.; Lui, J.C.; Baron, J. mir-374-5p, mir-379-5p, and mir-503-5p Regulate Proliferation and Hypertrophic Differentiation of Growth Plate Chondrocytes in Male Rats. Endocrinology 2018, 159, 1469–1478.
- Zhang, L.; Tang, Y.; Zhu, X.; Tu, T.; Sui, L.; Han, Q.; Yu, L.; Meng, S.; Zheng, L.; Valverde, P.; et al. Overexpression of MiR-335-5p Promotes Bone Formation and Regeneration in Mice. J. Bone Miner. Res. 2017, 32, 2466–2475.
- Lin, H.; Huang, Z.-P.; Liu, J.; Qiu, Y.; Tao, Y.-P.; Wang, M.-C.; Yao, H.; Hou, K.-Z.; Gu, F.-M.; Xu, X.-F. MiR-494-3p promotes PI3K/AKT pathway hyperactivation and human hepatocellular carcinoma progression by targeting PTEN. Sci. Rep. 2018, 8, 10461.
- Ulici, V.; Hoenselaar, K.D.; Gillespie, J.R.; Beier, F. The PI3K pathway regulates endochondral bone growth through control of hypertrophic chondrocyte differentiation. BMC Dev. Biol. 2008, 8, 40.
- Mukherjee, A.; Rotwein, P. Akt promotes BMP2-mediated osteoblast differentiation and bone development. J. Cell Sci. 2009, 122 Pt 5, 716–726.
- Wang, J.; Zhao, Q.; Chen, B.; Sun, J.; Huang, J.; Meng, J.; Li, S.; Yan, W.; Ren, C.; Hao, L. Risk factors for metabolic bone disease of prematurity: A meta-analysis. PLoS ONE 2022, 17, e0269180.
- Olmos-Ortiz, A.; Avila, E.; Durand-Carbajal, M.; Díaz, L. Regulation of calcitriol biosynthesis and activity: Focus on gestational vitamin D deficiency and adverse pregnancy outcomes. Nutrients 2015, 7, 443–480.
- Holland, P.C.; Wilkinson, A.R.; Diez, J.; Lindsell, D.R. Prenatal deficiency of phosphate, phosphate supplementation, and rickets in very-low-birthweight infants. Lancet 1990, 335, 697–701.
- Eliakim, A.; Litmanovitz, I.; Nemet, D. The Role of Exercise in Prevention and Treatment of Osteopenia of Prematurity: An Update. Pediatr. Exerc. Sci. 2017, 29, 450–455.
- Done, S.L. Fetal and neonatal bone health: Update on bone growth and manifestations in health and disease. Pediatr. Radiol. 2012, 42 (Suppl. S1), S158–S176.
- Miller, M.E. The bone disease of preterm birth: A biomechanical perspective. Pediatr. Res. 2003, 53, 10–15.
- Mimouni, F.B.; Mandel, D.; Lubetzky, R.; Senterre, T. Calcium, phosphorus, magnesium and vitamin D requirements of the preterm infant. World Rev. Nutr. Diet. 2014, 110, 140–151.
- Faienza, M.F.; D’Amato, E.; Natale, M.P.; Grano, M.; Chiarito, M.; Brunetti, G.; D’Amato, G. Metabolic Bone Disease of Prematurity: Diagnosis and Management. Front. Pediatr. 2019, 7, 143.
- Lee, P.A.; Chernausek, S.D.; Hokken-Koelega, A.C.S.; Czernichow, P.; International Small for Gestational Age Advisory Board. International Small for Gestational Age Advisory Board consensus development conference statement: Management of short children born small for gestational age, April 24–October 1, 2001. Pediatrics 2003, 111 Pt 1, 1253–1261.
- Gale, C.R.; Martyn, C.N.; Kellingray, S.; Eastell, R.; Cooper, C. Intrauterine programming of adult body composition. J. Clin. Endocrinol. Metab. 2001, 86, 267–272.
- Yang, Y.; Wu, F.; Dwyer, T.; Antony, B.; Winzenberg, T.; Jones, G. Associations of Breastfeeding, Maternal Smoking, and Birth Weight With Bone Density and Microarchitecture in Young Adulthood: A 25-Year Birth-Cohort Study. J. Bone Miner. Res. 2020, 35, 1652–1659.
- Jones, G.; Hynes, K.L.; Dwyer, T. The association between breastfeeding, maternal smoking in utero, and birth weight with bone mass and fractures in adolescents: A 16-year longitudinal study. Osteoporos. Int. 2013, 24, 1605–1611.
- Lee, S.M.; Namgung, R.; Park, M.S.; Eun, H.S.; Park, K.I.; Lee, C. High incidence of rickets in extremely low birth weight infants with severe parenteral nutrition-associated cholestasis and bronchopulmonary dysplasia. J. Korean Med. Sci. 2012, 27, 1552–1555.
- Ukarapong, S.; Venkatarayappa, S.K.B.; Navarrete, C.; Berkovitz, G. Risk factors of metabolic bone disease of prematurity. Early Hum. Dev. 2017, 112, 29–34.
- Brunetti, G.; Faienza, M.F.; Piacente, L.; Ventura, A.; Oranger, A.; Carbone, C.; Di Benedetto, A.; Colaianni, G.; Gigante, M.; Mori, G.; et al. High dickkopf-1 levels in sera and leukocytes from children with 21-hydroxylase deficiency on chronic glucocorticoid treatment. Am. J. Physiol. Endocrinol. Metab. 2013, 304, E546–E554.
- Stoll, B.J.; Hansen, N.; Fanaroff, A.A.; Wright, L.L.; Carlo, W.A.; Ehrenkranz, R.A.; Lemons, J.A.; Donovan, E.F.; Stark, A.R.; Tyson, J.E.; et al. Late-onset sepsis in very low birth weight neonates: The experience of the NICHD Neonatal Research Network. Pediatrics 2002, 110 Pt 1, 285–291.
- White, A.M.; Liu, P.; Yee, K.; Waber, B.; Monk, H.M.; Zhang, H.; Jensen, E.A. Determinants of Severe Metabolic Bone Disease in Very Low-Birth-Weight Infants with Severe Bronchopulmonary Dysplasia Admitted to a Tertiary Referral Center. Am. J. Perinatol. 2016, 33, 107–113.
- Horowitz, M.C.; Fretz, J.A.; Lorenzo, J.A. How B cells influence bone biology in health and disease. Bone 2010, 47, 472–479.
- Dusad, A.; Thiele, G.M.; Klassen, L.W.; Gleason, A.M.; Bauer, C.; Mikuls, T.R.; Duryee, M.J.; West, W.W.; Romberger, D.J.; Poole, J.A. Organic dust, lipopolysaccharide, and peptidoglycan inhalant exposures result in bone loss/disease. Am. J. Respir. Cell Mol. Biol. 2013, 49, 829–836.
- Burris, H.H.; Van Marter, L.J.; McElrath, T.F.; Tabatabai, P.; Litonjua, A.A.; Weiss, S.T.; Christou, H. Vitamin D status among preterm and full-term infants at birth. Pediatr. Res. 2014, 75, 75–80.
- Ruiz-Gaspà, S.; Guañabens, N.; Enjuanes, A.; Peris, P.; Martinez-Ferrer, A.; de Osaba, M.J.M.; Gonzalez, B.; Alvarez, L.; Monegal, A.; Combalia, A.; et al. Lithocholic acid downregulates vitamin D effects in human osteoblasts. Eur. J. Clin. Investig. 2010, 40, 25–34.
- Ruiz-Gaspà, S.; Martinez-Ferrer, A.; Guañabens, N.; Dubreuil, M.; Peris, P.; Enjuanes, A.; de Osaba, M.J.M.; Alvarez, L.; Monegal, A.; Combalia, A.; et al. Effects of bilirubin and sera from jaundiced patients on osteoblasts: Contribution to the development of osteoporosis in liver diseases. Hepatology 2011, 54, 2104–2113.
- Viswanathan, S.; Khasawneh, W.; McNelis, K.; Dykstra, C.; Amstadt, R.; Super, D.M.; Groh-Wargo, S.; Kumar, D. Metabolic bone disease: A continued challenge in extremely low birth weight infants. J. Parenter. Enteral. Nutr. 2014, 38, 982–990.
- Abrams, S.A.; Committee on Nutrition; Bhatia, J.J.S.; Corkins, M.R.; De Ferranti, S.D.; Golden, N.H.; Silverstein, J. Calcium and vitamin d requirements of enterally fed preterm infants. Pediatrics 2013, 131, e1676–e1683.
- Pelegano, J.F.; Rowe, J.C.; Carey, D.E.; LaBarre, D.J.; Edgren, K.W.; Lazar, A.M.; Horak, E. Effect of calcium/phosphorus ratio on mineral retention in parenterally fed premature infants. J. Pediatr. Gastroenterol. Nutr. 1991, 12, 351–355.
- Pereira-Da-Silva, L.; Costa, A.; Pereira, L.; Filipe, A.; Virella, D.; Leal, E.; Moreira, A.; Rosa, M.; Mendes, L.; Serelha, M. Early high calcium and phosphorus intake by parenteral nutrition prevents short-term bone strength decline in preterm infants. J. Pediatr. Gastroenterol. Nutr. 2011, 52, 203–209.
- Lima-Rogel, V.; Romano-Moreno, S.; de Jesús López-López, E.; de Jesús Escalante-Padrón, F.; Hurtado-Torres, G.F. Aluminum Contamination in Parenteral Nutrition Admixtures for Low-Birth-Weight Preterm Infants in Mexico. J. Parenter. Enteral. Nutr. 2016, 40, 1014–1020.
- Hall, A.R.; Arnold, C.J.; Miller, G.G.; Zello, G.A. Infant Parenteral Nutrition Remains a Significant Source for Aluminum Toxicity. J. Parenter. Enteral. Nutr. 2017, 41, 1228–1233.
- Kelly, A.; Kovatch, K.J.; Garber, S.J. Metabolic bone disease screening practices among U.S. neonatologists. Clin. Pediatr. 2014, 53, 1077–1083.
- Kolisambeevi, A.A.; Pournami, F.; Prithvi, A.K.; Nandakumar, A.; Prabhakar, J.; Jain, N. Incidence of Metabolic Bone Disease After Implementation of Bone Protective Nutritional Strategies: A Prospective Cohort Study. Indian Pediatr. 2022, 59, 841–846.
- Catache, M.; Leone, C.R. Role of plasma and urinary calcium and phosphorus measurements in early detection of phosphorus deficiency in very low birthweight infants. Acta Paediatr. 2003, 92, 76–80.
- Hung, Y.-L.; Chen, P.-C.; Jeng, S.-F.; Hsieh, C.-J.; Peng, S.S.-F.; Yen, R.-F.; Chou, H.-C.; Chen, C.-Y.; Tsao, P.-N.; Hsieh, W.-S. Serial measurements of serum alkaline phosphatase for early prediction of osteopaenia in preterm infants. J. Paediatr. Child Health 2011, 47, 134–139.
- Dokos, C.; Tsakalidis, C.; Tragiannidis, A.; Rallis, D. Inside the “fragile” infant: Pathophysiology, molecular background, risk factors and investigation of neonatal osteopenia. Clin. Cases Miner. Bone Metab. 2013, 10, 86–90.
- Chan, G.M.; Armstrong, C.; Moyer-Mileur, L.; Hoff, C. Growth and bone mineralization in children born prematurely. J. Perinatol. 2008, 28, 619–623.
- Mitchell, S.M.; Rogers, S.P.; Hicks, P.D.; Hawthorne, K.M.; Parker, B.R.; Abrams, S.A. High frequencies of elevated alkaline phosphatase activity and rickets exist in extremely low birth weight infants despite current nutritional support. BMC Pediatr. 2009, 9, 47.
- Backström, M.C.; Kouri, T.; Kuusela, A.L.; Sievänen, H.; Koivisto, A.M.; Ikonen, R.S.; Mäki, M. Bone isoenzyme of serum alkaline phosphatase and serum inorganic phosphate in metabolic bone disease of prematurity. Acta Paediatr. 2000, 89, 867–873.
- Rehman, M.U.; Narchi, H. Metabolic bone disease in the preterm infant: Current state and future directions. World J. Methodol. 2015, 5, 115–121.
- Chinoy, A.; Mughal, M.Z.; Padidela, R. Metabolic bone disease of prematurity-National survey of current neonatal and paediatric endocrine approaches. Acta Paediatr. 2021, 110, 1855–1862.
- Moreira, A.; February, M.; Geary, C. Parathyroid hormone levels in neonates with suspected osteopenia. J. Paediatr. Child Health 2013, 49, E12–E16.
- Czech-Kowalska, J.; Czekuc-Kryskiewicz, E.; Pludowski, P.; Zaniuk, K.; Jaworski, M.; Łuba, A.; Grzybowska, K.; Piłat, K.; Dobrzanska, A. The Clinical and Biochemical Predictors of Bone Mass in Preterm Infants. PLoS ONE 2016, 11, e0165727.
- Baek, J.H.; Shin, Y.H.; Chung, I.H.; Kim, H.J.; Yoo, E.-G.; Yoon, J.W.; Jee, H.M.; Chang, Y.E.; Han, M.Y. The link between serum vitamin D level, sensitization to food allergens, and the severity of atopic dermatitis in infancy. J. Pediatr. 2014, 165, 849–854.e1.
- Maguire, J.L.; Birken, C.; Thorpe, K.E.; Sochett, E.B.; Parkin, P.C. Parathyroid hormone as a functional indicator of vitamin D sufficiency in children. JAMA Pediatr. 2014, 168, 383–385.
- Pittard, W.B., 3rd; Geddes, K.M.; Hulsey, T.C.; Hollis, B.W. Osteocalcin, skeletal alkaline phosphatase, and bone mineral content in very low birth weight infants: A longitudinal assessment. Pediatr. Res. 1992, 31, 181–185.
- Pohlandt, F.; Mihatsch, W.A. Reference values for urinary calcium and phosphorus to prevent osteopenia of prematurity. Pediatr. Nephrol. 2004, 19, 1192–1193.
- Land, C.; Schoenau, E. Fetal and postnatal bone development: Reviewing the role of mechanical stimuli and nutrition. Best Pract. Res. Clin. Endocrinol. Metab. 2008, 22, 107–118.
- Koo, W.W.; Gupta, J.M.; Nayanar, V.V.; Wilkinson, M.; Posen, S. Skeletal changes in preterm infants. Arch. Dis. Child. 1982, 57, 447–452.
- Koo, W.W.; Sherman, R.; Succop, P.; Krug-Wispe, S.; Tsang, R.C.; Steichen, J.J.; Crawford, A.H.; Oestreich, A.E. Fractures and rickets in very low birth weight infants: Conservative management and outcome. J. Pediatr. Orthop. 1989, 9, 326–330.
- Rigo, J.; Nyamugabo, K.; Picaud, J.C.; Gerard, P.; Pieltain, C.; De Curtis, M. Reference values of body composition obtained by dual energy X-ray absorptiometry in preterm and term neonates. J. Pediatr. Gastroenterol. Nutr. 1998, 27, 184–190.
- Figueras-Aloy, J.; Álvarez-Domínguez, E.; Pérez-Fernández, J.M.; Moretones-Suñol, G.; Vidal-Sicart, S.; Botet-Mussons, F. Metabolic bone disease and bone mineral density in very preterm infants. J. Pediatr. 2014, 164, 499–504.
- Diez-Perez, A.; Brandi, M.L.; Al-Daghri, N.; Branco, J.C.; Bruyère, O.; Cavalli, L.; Cooper, C.; Cortet, B.; Dawson-Hughes, B.; Dimai, H.P.; et al. Radiofrequency echographic multi-spectrometry for the in-vivo assessment of bone strength: State of the art-outcomes of an expert consensus meeting organized by the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Aging Clin. Exp. Res. 2019, 31, 1375–1389.
- Fogelman, I.; Blake, G.M. Different approaches to bone densitometry. J. Nucl. Med. 2000, 41, 2015–2025.
- Damilakis, J.; Adams, J.E.; Guglielmi, G.; Link, T.M. Radiation exposure in X-ray-based imaging techniques used in osteoporosis. Eur. Radiol. 2010, 20, 2707–2714.
- De Terlizzi, F.; Battista, S.; Cavani, F.; Canè, V.; Cadossi, R. Influence of bone tissue density and elasticity on ultrasound propagation: An in vitro study. J. Bone Miner. Res. 2000, 15, 2458–2466.
- Gonnelli, S.; Montagnani, A.; Gennari, L.; Martini, S.; Merlotti, D.; Cepollaro, C.; Perrone, S.; Buonocore, G.; Nuti, R. Feasibility of quantitative ultrasound measurements on the humerus of newborn infants for the assessment of the skeletal status. Osteoporos. Int. 2004, 15, 541–546.
- Ritschl, E.; Wehmeijer, K.; De Terlizzi, F.; Wipfler, E.; Cadossi, R.; Douma, D.; Urlesberger, B.; Müller, W. Assessment of skeletal development in preterm and term infants by quantitative ultrasound. Pediatr. Res. 2005, 58, 341–346.
- Altuncu, E.; Akman, I.; Yurdakul, Z.; Özdoğan, T.; Solakoğlu, M.; Selim, N.; Bilgen, H.; Özek, E.; Bereket, A. Quantitative ultrasound and biochemical parameters for the assessment of osteopenia in preterm infants. J. Matern. Fetal Neonatal Med. 2007, 20, 401–405.
- Rack, B.; Lochmüller, E.-M.; Janni, W.; Lipowsky, G.; Engelsberger, I.; Friese, K.; Küster, H. Ultrasound for the assessment of bone quality in preterm and term infants. J. Perinatol. 2012, 32, 218–226.
- Institute of Medicine (US); Committee to Review Dietary Reference Intakes for Vitamin D and Calcium. Dietary Reference Intakes for Calcium and Vitamin D; Ross, A.C., Taylor, C.L., Yaktine, A.L., Del Valle, H.B., Eds.; National Academies Press: Washington, DC, USA, 2011.
- Agostoni, C.; Buonocore, G.; Carnielli, V.P.; De Curtis, M.; Darmaun, D.; Decsi, T.; Domellöf, M.; Embleton, N.D.; Fusch, C.; Genzel-Boroviczeny, O.; et al. Enteral nutrient supply for preterm infants: Commentary from the European Society of Paediatric Gastroenterology, Hepatology and Nutrition Committee on Nutrition. J. Pediatr. Gastroenterol. Nutr. 2010, 50, 85–91.
- Misra, M.; Pacaud, D.; Petryk, A.; Collett-Solberg, P.F.; Kappy, M.; on behalf of the Drug and Therapeutics Committee of the Lawson Wilkins Pediatric Endocrine Society. Vitamin D deficiency in children and its management: Review of current knowledge and recommendations. Pediatrics 2008, 122, 398–417.
- Priemel, M.; von Domarus, C.; Klatte, T.O.; Kessler, S.; Schlie, J.; Meier, S.; Proksch, N.; Pastor, F.; Netter, C.; Streichert, T.; et al. Bone mineralization defects and vitamin D deficiency: Histomorphometric analysis of iliac crest bone biopsies and circulating 25-hydroxyvitamin D in 675 patients. J. Bone Miner. Res. 2010, 25, 305–312.
- Anderson-Berry, A.; Thoene, M.; Wagner, J.; Lyden, E.; Jones, G.; Kaufmann, M.; Van Ormer, M.; Hanson, C. Randomized trial of two doses of vitamin D3 in preterm infants <32 weeks: Dose impact on achieving desired serum 25(OH)D3 in a NICU population. PLoS ONE 2017, 12, e0185950.
- Bonsante, F.; Iacobelli, S.; Latorre, G.; Rigo, J.; De Felice, C.; Robillard, P.Y.; Gouyon, J.B. Initial amino acid intake influences phosphorus and calcium homeostasis in preterm infants—it is time to change the composition of the early parenteral nutrition. PLoS ONE 2013, 8, e72880.
- Alizadeh Taheri, P.; Sajjadian, N.; Beyrami, B.; Shariat, M. Prophylactic effect of low dose vitamin D in osteopenia of prematurity: A clinical trial study. Acta Med. Iran. 2014, 52, 671–674.
- Angelika, D.; Ugrasena, I.D.G.; Etika, R.; Rahardjo, P.; Bos, A.F.; Sauer, P.J.J. The incidence of osteopenia of prematurity in preterm infants without phosphate supplementation: A prospective, observational study. Medicine 2021, 100, e25758.
- Adamkin, D.H.; Radmacher, P.G. Current trends and future challenges in neonatal parenteral nutrition. J. Neonatal Perinatal Med. 2014, 7, 157–164.
- Abrams, S.A. In utero physiology: Role in nutrient delivery and fetal development for calcium, phosphorus, and vitamin D. Am. J. Clin. Nutr. 2007, 85, 604S–607S.
- Demarini, S. Calcium and phosphorus nutrition in preterm infants. Acta Paediatr. Suppl. 2005, 94, 87–92.
- Nikander, R.; Sievänen, H.; Heinonen, A.; Daly, R.M.; Uusi-Rasi, K.; Kannus, P. Targeted exercise against osteoporosis: A systematic review and meta-analysis for optimising bone strength throughout life. BMC Med. 2010, 8, 47.
- Torró-Ferrero, G.; Fernández-Rego, F.J.; Gómez-Conesa, A. Physical Therapy to Prevent Osteopenia in Preterm Infants: A Systematic Review. Children 2021, 8, 664.
- Torró-Ferrero, G.; Fernández-Rego, F.J.; Jiménez-Liria, M.R.; Agüera-Arenas, J.J.; Piñero-Peñalver, J.; Sánchez-Joya, M.d.M.; Fernández-Berenguer, M.J.; Rodríguez-Pérez, M.; Gomez-Conesa, A. Effect of physical therapy on bone remodelling in preterm infants: A multicenter randomized controlled clinical trial. BMC Pediatr. 2022, 22, 362.
- Schulzke, S.M.; Kaempfen, S.; Trachsel, D.; Patole, S.K. Physical activity programs for promoting bone mineralization and growth in preterm infants. Cochrane Database Syst. Rev. 2014, 4, CD005387.
- Sanz-Esteban, I.; Calvo-Lobo, C.; Ríos-Lago, M.; Álvarez-Linera, J.; Muñoz-García, D.; Rodríguez-Sanz, D. Mapping the human brain during a specific Vojta’s tactile input: The ipsilateral putamen’s role. Medicine 2018, 97, e0253.
- Arslanoglu, S.; Boquien, C.-Y.; King, C.; Lamireau, D.; Tonetto, P.; Barnett, D.; Bertino, E.; Gaya, A.; Gebauer, C.; Grovslien, A.; et al. Fortification of Human Milk for Preterm Infants: Update and Recommendations of the European Milk Bank Association (EMBA) Working Group on Human Milk Fortification. Front. Pediatr. 2019, 7, 76.
- Betto, M.; Gaio, P.; Ferrini, I.; De Terlizzi, F.; Zambolin, M.; Scattolin, S.; Pasinato, A.; Verlato, G. Assessment of bone health in preterm infants through quantitative ultrasound and biochemical markers. J. Matern. Fetal Neonatal Med. 2014, 27, 1343–1347.
- Chacham, S.; Pasi, R.; Chegondi, M.; Ahmad, N.; Mohanty, S.B. Metabolic Bone Disease in Premature Neonates: An Unmet Challenge. J. Clin. Res. Pediatr. Endocrinol. 2020, 12, 332–339.
- Quintal, V.S.; Diniz, E.M.; Caparbo Vde, F.; Pereira, R.M. Bone densitometry by dual-energy X-ray absorptiometry (DXA) in preterm newborns compared with full-term peers in the first six months of life. J. Pediatr. 2014, 90, 556–562.
- Brunton, J.A.; Bayley, H.S.; Atkinson, S.A. Validation and application of dual-energy x-ray absorptiometry to measure bone mass and body composition in small infants. Am. J. Clin. Nutr. 1993, 58, 839–845.
- Manhard, M.K.; Nyman, J.S.; Does, M.D. Advances in imaging approaches to fracture risk evaluation. Transl. Res. 2017, 181, 1–14.
- Hans, D.; Baim, S. Quantitative Ultrasound (QUS) in the Management of Osteoporosis and Assessment of Fracture Risk. J. Clin. Densitom. 2017, 20, 322–333.
- Degennaro, V.A.; Brandi, M.L.; Cagninelli, G.; Casciaro, S.; Ciardo, D.; Conversano, F.; Di Pasquo, E.; Gonnelli, S.; Lombardi, F.A.; Pisani, P.; et al. First assessment of bone mineral density in healthy pregnant women by means of Radiofrequency Echographic Multi Spectrometry (REMS) technology. Eur. J. Obstet. Gynecol. Reprod. Biol. 2021, 263, 44–49.
- Conversano, F.; Franchini, R.; Greco, A.; Soloperto, G.; Chiriacò, F.; Casciaro, E.; Aventaggiato, M.; Renna, M.D.; Pisani, P.; Di Paola, M.; et al. A novel ultrasound methodology for estimating spine mineral density. Ultrasound Med. Biol. 2015, 41, 281–300.
- Casciaro, S.; Peccarisi, M.; Pisani, P.; Franchini, R.; Greco, A.; De Marco, T.; Grimaldi, A.; Quarta, L.; Quarta, E.; Muratore, M.; et al. An Advanced Quantitative Echosound Methodology for Femoral Neck Densitometry. Ultrasound Med. Biol. 2016, 42, 1337–1356.
- Cortet, B.; Dennison, E.; Diez-Perez, A.; Locquet, M.; Muratore, M.; Nogués, X.; Crespo, D.O.; Quarta, E.; Brandi, M.L. Radiofrequency Echographic Multi Spectrometry (REMS) for the diagnosis of osteoporosis in a European multicenter clinical context. Bone 2021, 143, 115786.
- Di Paola, M.; Gatti, D.; Viapiana, O.; Cianferotti, L.; Cavalli, L.; Caffarelli, C.; Conversano, F.; Quarta, E.; Pisani, P.; Girasole, G.; et al. Radiofrequency echographic multispectrometry compared with dual X-ray absorptiometry for osteoporosis diagnosis on lumbar spine and femoral neck. Osteoporos. Int. 2019, 30, 391–402.
- Adami, G.; Arioli, G.; Bianchi, G.; Brandi, M.L.; Caffarelli, C.; Cianferotti, L.; Gatti, D.; Girasole, G.; Gonnelli, S.; Manfredini, M.; et al. Radiofrequency echographic multi spectrometry for the prediction of incident fragility fractures: A 5-year follow-up study. Bone 2020, 134, 115297.