Резюме
Здоровье костей начинается со здоровья и питания матери, которые влияют на массу и плотность костной ткани уже в утробе матери. Механизмы, лежащие в основе влияния внутриутробной среды на здоровье костей, частично неизвестны, но, безусловно, включают “внутриутробное программирование” оксидативного стресса и эндокринной системы, которые влияют на дальнейший рост и развитие скелета. В этом нарративном обзоре мы описываем современные доказательства для выявления пациентов с факторами риска развития остеопении, современные методы ведения этих групп населения, а также программы скрининга и профилактики, основанные на гестационном возрасте, весе и уровнях заболеваемости. Вызовы для профилактики здоровья костной ткани включают потребность в новых технологиях, которые являются специфическими и применимыми для беременных женщин, плода и, позже, новорожденных. Радиочастотная ультразвуковая спектрометрия (РЭМС) оказалась полезным инструментом в оценке минеральной плотности костной ткани (МПКТ) у беременных женщин. Немногочисленные исследования сообщают, что трансмиссионный ультразвук также можно использовать для оценки МПКТ у новорожденных. Преимуществами этой технологии у плода и новорожденного является отсутствие ионизирующего излучения, простота использования и, прежде всего, возможность проведения лонгитюдных исследований от внутриутробной до внеутробной жизни. Применение этих технологий уже во внутриутробном периоде может помочь предотвратить сопутствующие заболевания, такие как остеопороз и остеопения, которые характеризуются уменьшением костной массы и дегенерацией костной структуры и приводят к повышенному риску переломов во взрослом возрасте со значительными социальными последствиями, связанными с прямыми и непрямыми затратами.
Ключевые слова: новорожденный ребенок; минеральная плотность костной ткани; ультразвук; окислительный стресс; эндокринные дизрапторы;
1. Вступление
Здоровье костей начинается со здоровья и питания матери, которые влияют на массу скелета и плотность костной ткани у плода [1]. В общей популяции продемонстрирована значительная вариабельность костной массы, которая, как представляется, берет свое начало еще во внутриутробном и раннем постнатальном периоде [2].
Хотя вес субъектов в возрасте одного года является наиболее изученным в литературе, поскольку он коррелирует с пиковой костной массой во взрослом возрасте, недавний систематический обзор показал сильную корреляцию костной массы взрослых с весом при рождении, что свидетельствует о влиянии стимулов окружающей среды, полученных в критический период развития скелета, начиная с внутриутробной жизни [3,4].
Недавно было обнаружено, что механизмы, опосредованные эпигенетикой, в частности микроРНК, способны контролировать экспрессию генов на посттранскрипционном уровне, обеспечивая эпигенетические модификации и направляя пластинку роста.
Метаболическое заболевание костей (МЗК) определяется как снижение содержания минеральных веществ в костной ткани по сравнению с ожидаемым уровнем для ребенка определенного веса или гестационного возраста, что выявляется с помощью изменений при лабораторных и рентгенологических обследованиях [5].
К группам риска развития МЗК относятся недоношенные дети, младенцы с низкой массой тела при рождении, особенно с очень низкой массой тела при рождении (ОНМТ) и экстремально низкой массой тела при рождении (ЭНМТ), дети с задержкой внутриутробного развития (ЗВУР), младенцы с сопутствующими заболеваниями, которые обычно ассоциируются с недоношенностью (например, сепсис, холестаз, бронхолегочная дисплазия (БЛД), некротический энтероколит (НЭК)), младенцы, требующие длительного полного парентерального питания (ППП), младенцы, рожденные от матерей с заболеваниями, связанными с беременностью (преэклампсия, хориоамнионит, гестационный диабет), и младенцы, рожденные от матерей с дефицитом витамина D [5]. Младенцы с этими характеристиками должны быть тщательно и адекватно обследованы, включая лабораторные, мочевые и инструментальные исследования, для раннего выявления любых признаков МЗК и скорейшего назначения соответствующих минеральных добавок на основе лабораторных данных.
Чаще всего МЖК возникает между 6 и 16 неделями после рождения [6]; она проявляется из-за недостаточных запасов кальция и фосфора и усугубляется недостаточным потреблением минеральных веществ и высокой скоростью роста скелета, что обычно происходит в первые несколько недель жизни [6,7].
МЗК чаще всего встречается у новорожденных <28 недель гестации; частота МЗК у недоношенных ОНМТ составляла 32%, а для ЭНМТ – 54%, с пиком на 4-8 неделе постнатального возраста [8].
Эффективная профилактика, раннее выявление факторов риска, использование унифицированных диагностических алгоритмов и неинвазивных технологий могут способствовать улучшению здоровья костной ткани и снижению заболеваемости МЗК и связанных с ним болезней, которые составляют значительную часть расходов на лечение.
Проблемы профилактики здоровья костной ткани включают потребность в новых технологиях, которые являются специфическими и могут быть применены к беременным женщинам, плоду и, позже, новорожденным. Этот учебный обзор имеет целью описать современные доказательства по ранней идентификации и ведению групп населения с высоким риском развития остеопении, а также внедрение скрининговых и профилактических программ, основанных на гестационном возрасте, весе и заболеваемости.
2. Скелетное развитие плода
Костная ткань состоит из трех типов клеток: остеобластов, остеоцитов и остеокластов. Они происходят из матрикса, состоящего преимущественно из коллагеновых волокон, гликопротеинов, которые придают кости форму и эластичность, и минеральных солей, преимущественно кальция и фосфора, которые придают ей жесткость и твердость. Костная ткань также является метаболически активной и чрезвычайно динамичной тканью из-за ее непрерывного ремоделирования в течение всей жизни [9].
Развитие скелета начинается с первых недель беременности и происходит под влиянием генетических, эндокринных и экологических факторов [10]. Пролиферация, дифференциация предшественников хряща и процессы окостенения тонко регулируются гормонами, такими как паратиреоидный гормон (ПТГ), цитокинами и витаминами (A, D, C и K) [11].
Другим ключевым элементом для хорошего развития скелета является сосудистая поддержка, которая обеспечивает достаточное поступление минеральных веществ. На самом деле, такие состояния, как преэклампсия, хориоамнионит и ЗВУР, отражающие хроническое повреждение плаценты, связанные с повышенным риском МЗК [12].
Кроме того, некоторые факторы окружающей среды, такие как воздействие наркотиков, токсичных веществ и условия питания матери [13], считаются эпигенетическими факторами, влияющими на массу и плотность костной ткани плода, а также на количество и качество костной ткани у взрослых [14].
Эмбриологически костная ткань является производной от мезодермы, листка, который генерирует все соединительные ткани в течение эмбриональной жизни. Первой формирующейся скелетной структурой является нотохорда, которая появляется в средней линии эмбрионального диска примерно на 15-й день развития, беря начало из примитивной ямки, расположенной на возвышении эктодермы, известной как узел Хенсена, в конце примитивной линии [15].
В частности, черепно-лицевой скелет образуется из клеток нервного гребня, осевой скелет – из параксиальных мезодермальных клеток, а аппендикулярный скелет – из мезодермальных клеток латеральной пластинки [16].
Формирование костной ткани может происходить по двум моделям окостенения: внутримембранной или эндохондральной [17].
Внутримембранное или прямое окостенение происходит, когда костная ткань замещает хрящевую ткань. Мезенхимальные клетки пролиферируют и конденсируются в компактные узелки. Некоторые из этих клеток формируют капилляры; другие индуцируются костным морфогенетическим белком (КМБ) к экспрессии Runx2 и дифференцируются в остеобласты, которые, в свою очередь, начинают производить остеоидный матрикс, формирующий кончики костей после процесса минерализации [18]. Внутримембранное окостенение является обычным способом развития плоских костей черепа, нижней челюсти и ключицы. Перепончатые кости черепной коробки и лица формируются между 9-й и 12-й неделей [16].
Эндохондральное или непрямое окостенение требует формирования хрящевой ткани из совокупности мезенхимальных клеток и последующей замены хряща на кость. Эндохондральное окостенение дает начало большинству костей в организме человека [16,17], которые также являются костями с повышенным риском разрыва в более позднем возрасте [18].
Непрямое окостенение можно разделить на пять последовательных фаз. Во время этого процесса хондробласты должны генерировать, пролиферировать, гипертрофироваться, погибать и заменяться остеобластами. Последовательные изменения в поведении хондробластов жестко контролируются системными и паракринными факторами, которые, связываясь с рецепторами, активируют внутриклеточные сигнальные пути и определяют активацию специфических факторов транскрипции, таких как парный бокс l (PAXl) и склераксис, отвечающих за активацию специфических для хряща генов. Дочерние клетки, которые депонируют хрящ, расположены в конечностях длинных костей [19,20,21]. Первыми появляются тяжи верхних конечностей (24-й день), а затем – нижних (28-й день). Зачатки конечностей сначала состоят из мезенхимального ядра, происходящего из соматоплевры латеральной мезодермы. Через пять недель у эмбриона формируются копчиковые позвонки [15].
К концу 5-й недели хорошо сформированные хрящевые эскизы представляют все будущие основные кости скелета конечности [18]. Эта хрящевая модель впоследствии замещается новообразованной костью [17]. Первые изменения в хрящевом контуре длинной кости происходят в центральной части диафиза примерно на 7-й неделе эмбриональной жизни, когда в развивающуюся кость проникают многочисленные кровеносные сосуды, один из которых становится питательной артерией кости. Хрящевой скелет плода и формирование первичных центров окостенения в позвонках и длинных костях завершают свое развитие в первом триместре [22]. Первой костью, в которой появляется первичный центр окостенения, является бедренная кость. Последней костью является подъязычная кость, в которой центр окостенения появляется в 36 недель. Некоторые меньшие кости запястья и предплечья начинают окостенение только в раннем детстве. Процесс окостенения происходит от первичного центра окостенения к эпифизам. При рождении диафизы полностью окостенели, в то время как концы костей, которые называются эпифизами, еще хрящевые. Следовательно, после рождения во всех костях на уровне эпифизов появляются центры вторичного окостенения. Однако между эпифизом и растущим концом диафиза сохраняется слой хряща, который называется эпифизарным хрящом. В этом слое происходит непрерывная пролиферация хондроцитов с последующей дифференциацией и замещением хрящевой ткани костной, что позволяет диафизу удлиняться. Эпифизарная пластинка полностью окостеневает примерно в двадцатилетнем возрасте, когда завершается рост организма [23].
3. Роль эпигенетики в регуляции развития плаценты и костной ткани плода
Каждая стадия развития скелета регулируется многочисленными транскрипционными факторами (например, SOX9, RUNX2), факторами роста (например, ФРФ, ИФР, ФРЭС, КМБ и другие из семейства ТФР-β) и другими сигнальными молекулами (например, Wnt/β-катенин, Hedgehog, ПТГпП) [24].
Существует гипотеза, что различные эпигенетические изменения в плаценте, которые отвечают за передачу питательных веществ плоду, также играют определенную роль в аномальном развитии скелета плода и, таким образом, остеопороза во взрослом возрасте. Это можно предположить с открытием связи между нарушением регуляции генов и остеопенией [13, 24].
Недавние исследования показали, в частности, что ферменты, способные модифицировать структуру гистонов или контролировать метилирование ДНК и некодирующие микроРНК, также играют фундаментальную роль в развитии скелета как эпигенетические факторы, способные действовать на транскрипционном и посттранскрипционном уровнях на экспрессию генов [25].
Чрезмерная экспрессия некоторых групп микроРНК (например, miR-10b, miR-19a-3p, miR-29a, miR26b) in vitro индуцирует дифференциацию остеобластов, тогда как угнетение других (например, miR-9-5p, miR-16-2-3p) подавляет остеогенез [25]. В доклинических исследованиях гиперэкспрессия остеоиндуцибельных микроРНК, похоже, способна индуцировать образование минерализованного внеклеточного матрикса и экспрессию генов, связанных с остеобластической функцией, в мезенхимальных клетках-предшественниках человека или мышей через различные эпигенетические механизмы: ингибирование эпигенетических регуляторов, таких как HDAC4 или HMGA2, ингибирование Wnt-опосредованного сигнального каскада (напр, DKK1, GSK3β), модуляция негативных регуляторов RUNX2 (например, SMAD6 или SMURF2) и регуляция Rorβ [26,27,28].
Ген WNT2 кодирует белок, участвующий в клеточных сигнальных путях, играет важную роль в развитии плаценты мыши и высоко выражен в плаценте человека [29]. Ferreira и соавт. показали связь между метилированием промотора WNT2 в плаценте человека и низким весом при рождении [29].
Tenta и соавт. определили роль в индукции остеокластогенеза рецептора, ядерный активирующий фактор каппа-В рецептора (RANKL), и рецептор приманки остеопротегерина (ОПГ) RANK, обнаружив значительную чрезмерную регуляцию соотношения ОПГ/RANKL у младенцев с МГВ, что подчеркивает их роль в костном обороте в компенсации внутриутробной задержки роста [10].
Исследования показали полиморфизм генов пути ПТГ (ПТГ, ПТГ-подобного гормона (ПТГПГ) и рецептора ПТГ1 (РПТГ)), что свидетельствует о том, что гены, связанные с ПТГ, являются сильными кандидатами на генетическую регуляцию развития костной ткани и потери костной массы. Существуют доказательства того, что они могут быть связаны с риском переломов или МПКТ [30,31,32].
Другими факторами риска МЗК у недоношенных новорожденных являются мужской пол и полиморфизм определенных генов (рецептора витамина D, рецептора эстрогена и гена коллагена альфа-1) [33].
Данные показывают, что витамин D и рецептор витамина D играют определенную роль в росте костей, влияя на пролиферацию и дифференциацию клеток и, в частности, на гомеостаз кальция, что является критически важными процессами для здоровья костей [34].
COL1A1 Sp1 играет важную роль в развитии костей эмбриона. COL1A1 Sp1 для коллагена 1-го типа – это транскрипт гена основного белка костной ткани. Установлено, что остеопоротические переломы и МПКТ ассоциируются с полиморфизмами COL1A1 Sp1 [35].
Другие гены, такие как Sox9, Runx2, Osterix, ALP, остеокальцин и костный сиалопротеин (Ксп), играют определенную роль в дифференциации остеобластов и, таким образом, в формировании костей [36,37].
4. Минерализация костей
Минерализация костей является незаменимым процессом для правильного формирования скелета [38]. Поддержание адекватного содержания минералов является критически важным для эффективной минерализации костной ткани [39].Минералы всасываются кишечником и при необходимости восстанавливаются или выводятся почками. Потребление минеральных веществ важно для обеспечения минерального гомеостаза и профилактики минеральных заболеваний костей, а также для сбалансирования действия различных регуляторов биоминерализации, включая паратиреоидный гормон, кальцитонин, витамин D, витамин К, фактор роста фибробластов 23 (ФРФ23) и ферменты фосфатазы. На самом деле на минерализацию костной ткани влияют несколько факторов, включая адекватное потребление минералов, баланс между активаторами и ингибиторами минерализации, а также наличие коллагеновых фибрилл [38]. Организм также использует скелет как источник минералов в случае их дефицита. Кость играет важную роль как метаболическое хранилище, которое регулирует внутриклеточные и внеклеточные уровни минералов, в частности кальция и фосфатов [38].
Около 70 процентов веса кости составляют минералы, остальные 30 процентов – органические вещества. Минеральная часть в основном представлена кристаллами гидроксилапатита, высокоорганизованными структурами кальция и фосфата и другими ионами, такими как натрий, магний, фтор и стронций. Неорганическая часть состоит из коллагеновых волокон, гликопротеинов и протеогликанов [40].
Минерализация костной ткани – это двухэтапный биологический процесс, который регулируется несколькими факторами: первичной и вторичной минерализацией. Во время первичной минерализации происходит отложение аморфных кальций-фосфатных солей, а во время вторичной минерализации – постепенное созревание минералов с образованием гидроксилапатита [41].
Минерализация костной ткани начинается с небольших везикул внеклеточного матрикса, выделяемых хондроцитами и остеобластами [42].
Поступление ионов кальция и неорганических фосфатов в эти маленькие везикулы регулируется мембранными транспортерами и ферментами, участвующими в минерализации (например, тканевой неспецифической щелочной фосфатазой (ТНЩФ), эктонуклеотидной пирофосфатазой (ЭНПФ) и анкилозом (АНК)) [43,44,45].
При первичной минерализации накопление фосфатов и кальция в матричных везикулах приводит к зарождению и прогрессирующей аккреции кристаллов гидроксилапатита, которые постепенно формируют минерализованные узелки [46].
Эти узелки, которые также называют кальцифицирующими узелками, контактируют с коллагеновыми волокнами, что приводит к минерализации коллагена от точек контакта к периферии [47].
Во время вторичной минерализации минеральная плотность костной ткани постепенно возрастает благодаря процессам транспорта минералов с участием остеоцитов. Остеоциты имеют лакунарную остеоцитарно-канальцевую систему, которая позволяет им транспортировать минералы и регулировать метаболизм костной ткани [48].
Таким образом, остеоциты и остеобласты сотрудничают для поддержания адекватного состояния минерализации костной ткани [49].
Уровень кальция и неорганических фосфатов в сыворотке крови являются двумя важными детерминантами минерализации костной ткани [50].
Кроме того, 80% переноса кальция и фосфора происходит между 25 и 40 неделями беременности, а максимальное количество достигается на 34 неделе. [51,52,53].
У плода суточное накопление кальция на 24-й неделе составляет 60 мг, тогда как между 35-й и 40-й неделей беременности оно достигает 300-350 мг. Общий средний нерест кальция и фосфора составляет 100-150 мг/кг/сутки и 50-65 мг/кг/сутки соответственно [54].
Уровень внеклеточного кальция регулируется ПТГ, секреция которого зависит от концентрации кальция в крови, что определяется кальций-чувствительными рецепторами (КаЧР) на клетках паращитовидных желез. Секреция ПТГ активирует механизмы повышения уровня кальция в сыворотке крови, включая резорбцию костной ткани остеокластами [40].
Уровень фосфата в крови зависит от всасывания пищевого фосфата кишечником, высвобождения фосфата из костей и особенно от его восстановления в нефронах. Экскреция и реабсорбция отфильтрованного почками фосфата происходит в проксимальных канальцах с помощью специфических транспортеров, в соответствии с потребностями организма, и являются основными механизмами регуляции содержания фосфата в крови [55].
Активность этих транспортеров модулируется ПТГ и ФРФ23, гормоном, вырабатываемым остеоцитами, в результате чего увеличивается экскреция фосфатов и снижается уровень фосфатов в крови [56].
ФРФ23 и ПТГ также влияют на метаболизм витамина D и костный метаболизм с противоположными эффектами. ПТГ повышает уровень кальция и фосфатов в сыворотке крови, стимулируя активацию витамина D и способствуя всасыванию минералов в кишечнике. Зато ФРФ23 подавляет образование кальцитриола, активной формы витамина D [38].
ФРФ23 также подавляет минерализацию костной ткани, подавляя синтез и секрецию ПТГ и особенно способствуя образованию пирофосфата (PPi), одного из самых мощных ингибиторов минерализации [57].
PPi препятствует агрегации кальция и фосфатов, предотвращая образование и рост кристаллов гидроксилапатита [58]. Он гидролизуется ферментом щелочной фосфатазой (ЩФ); этот процесс снижает уровень PPi, что подавляет минерализацию костной ткани, и в то же время увеличивает доступное количество фосфата [50].
О незаменимой функции ЩФ свидетельствует тот факт, что у новорожденных с мутациями в гене ЩФ наблюдается тяжелая остеомаляция, фетальная/перинатальная летальность [59].
Другим важным регулятором кальциевого и фосфатного гомеостаза является витамин D. Конечный этап преобразования неактивной формы витамина D в его активную форму, кальцитриол, стимулируется различными факторами, включая ПТГ, инсулиноподобный фактор роста 1, сниженное потребление кальция и фосфатов, а также низкий внеклеточный уровень этих минералов [38].
Витамин D способствует поддержанию адекватного содержания кальция и фосфатов в плазме крови, стимулируя всасывание минералов из кишечника и их мобилизацию из костей [60].
Достижение перенасыщенных внеклеточных концентраций кальция и фосфатов позволяет минерализовать гипертрофированные хрящи и кости. Кальцитриол также способствует минерализации, стимулируя дифференциацию остеобластов, рост матриксных везикул, с которых начинается процесс, и выработку матриксных неколлагеновых белков, участвующих в регуляции минерализации [61].
Недавний обзор показывает важную роль витамина К в метаболизме и минерализации костной ткани. Витамин К, благодаря своим анаболическим свойствам, способствует Y-глутамилкарбоксилированию и дифференцировке остеобластов, регулирует минерализацию внеклеточного матрикса через активацию костно-ассоциированных витамин К-зависимых белков и ингибирует остеокластогенез. Все эти эффекты стимулируют формирование и минерализацию костной ткани [9].
5. Факторы, влияющие на минерализацию костей
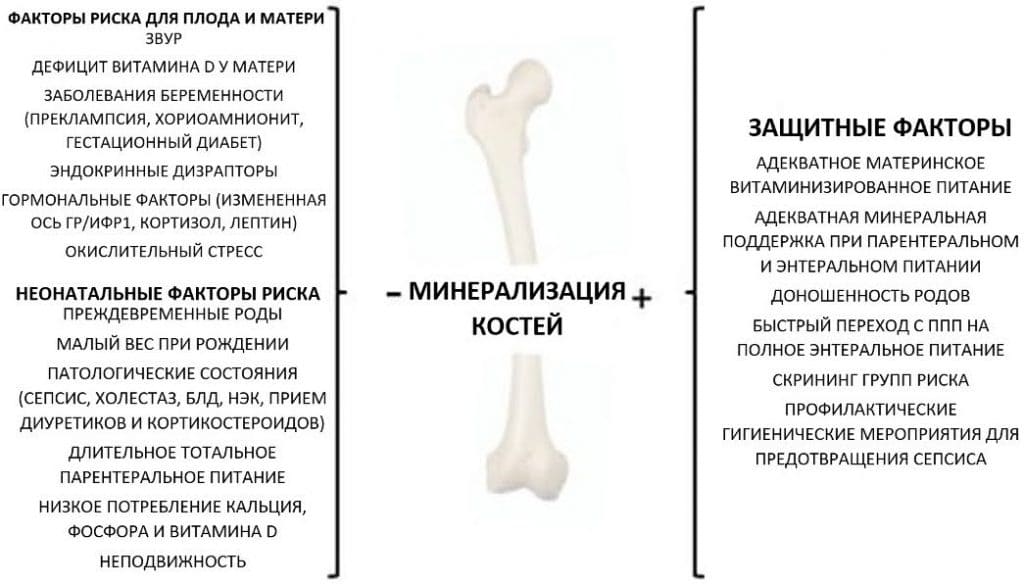
Многие факторы, действующие в пре- и постнатальном периоде, могут влиять на минерализацию костной ткани (Рис. 1)
Рисунок 1. Факторы, влияющие на минерализацию костной ткани: материнский, эмбриональный и неонатальный риск и защитные факторы.
5.1. Материнские и эмбриональные факторы
5.1.1. Витамин D
Связь между МЗК и уровнем витамина D у беременных женщин все еще обсуждается: исследования не дают убедительных результатов. Некоторые исследования не выявили корреляции между уровнем витамина D у матери и параметрами костной ткани в неонатальном периоде [62,63].
Другие исследования показывают отрицательную связь с плотностью костной массы потомков [64] или положительную связь [65,66].
Другие исследования показывают, что беременным женщинам следует давать добавки витамина D, чтобы обеспечить достаточный уровень витамина D для новорожденного, поскольку концентрация 25-гидроксивитамина D (25(OH)D) у новорожденных составляет примерно 80% от материнского уровня [67,68].
Кроме того, клинические исследования показали, что прием витамина D беременными женщинами снижает риск МЗК, поскольку уменьшает вероятность преэклампсии и гестационного диабета, которые являются факторами риска МЗК [69,70].
5.1.2. ГР/ИФР-1 Ось
Ось гормон роста/инсулиноподобный фактор роста 1 (ГР/ИФР-1) считается решающей в формировании костной массы. Ограничение роста плода, вероятно, имеет негативное влияние на эту ось [71].
Инсулиноподобный фактор роста (ИФР-1) способствует митозу дифференцированных хондроцитов как во внутриутробном периоде, так и в детстве, и является одним из важнейших эндокринных факторов. Недостаточная секреция сопровождается снижением уровня роста, и это может быть причиной меньшей костной массы у детей, родившихся с меньшим весом при рождении [72].
5.1.3. Кортизол
В мета-анализе также была продемонстрирована связь, хотя и слабая, между младенцами, которые родились с меньшей массой тела, и уровнем кортизола в сыворотке крови: у этой категории младенцев уровень кортизола был повышенным [73].
Эндогенный кортизол, по сути, подавляет функцию остеобластов, поэтому его высокий уровень может негативно влиять на костную массу [74,75].
5.1.4. Лептин
Лептин – цитокиновый гормон, секретируемый адипоцитами; среди его многочисленных функций, он также обладает способностью связывать изменения в составе тела с формированием и резорбцией костной ткани [76].
5.1.5. Окислительный стресс и эндокринные дизрапторы
Окислительный стресс (ОС) и эндокринные дизрапторы (ЭД) у беременных женщин могут потенциально влиять на здоровье костной ткани матери и плода через эмбриональное программирование. Оксидативный стресс может вызвать внутриутробную задержку роста при самых распространенных состояниях беременности, таких как диабет матери, преэклампсия и хориоамниоз, создавая внутриутробную среду, потенциально неблагоприятную для развития плода [77].
На самом деле, во время беременности происходит избыточное образование свободных радикалов по отношению к антиоксидантной способности организма. Источниками свободных радикалов являются дыхательная цепь митохондрий, индукция синтаз оксида азота (ОА-синтаз) и никотинамидадениндинуклеотидфосфат-оксидазы (НАДФ-оксидазы), а также свободные металлы, такие как железо, медь и марганец [77].
Свободные радикалы могут через многочисленные эпигенетические механизмы модулировать экспрессию генов в критические периоды внутриутробного развития прямо или опосредованно через молекулы, окисленные самими радикалами [77].
Longini и соавт. продемонстрировали, что изопростаны в амниотической жидкости являются надежным маркером перекисного окисления липидов: свободные радикалы, разрывая пептидные связи аминокислотной цепи коллагена и перекисное окисление полиненасыщенных жирных кислот клеточного фосфолипидного бислоя, повреждают структуру хориоамниотич еских мембран, что приводит к преждевременному разрыву мембран, а следовательно, к преждевременным родам [78].
Эндокринные дизрапторы (ЭД) способны влиять на плаценту, изменяя ее морфологию и функцию с помощью механизмов, которые до сих пор остаются неизвестными, но, вероятно, связаны с сигнальными путями, связанными с инсулином, глюкокортикоидами, эстрогеном и гормонами щитовидной железы, эпигенетикой и воспалением [79,80,81,82].
Литература о последствиях воздействия эндокринных дизрапторов во время внутриутробной жизни представляет большой интерес, хотя все еще ограничена, и сосредоточена на возможных последствиях для роста плода и долгосрочных когнитивно-поведенческих неблагоприятных явлениях [83].
Недавно Dirkers и соавт. в доклиническом исследовании на мышиной модели исследовали, как влияние бисфенола А во время беременности приводит к ослаблению трабекулярной микроархитектуры и геометрии кортикальной кости у потомков, подвергшихся воздействию. В исследуемой группе, по сравнению с контрольной группой, наблюдалось статистически значимое уменьшение трабекулярного объема кости и толщины кортикального слоя вместе с увеличением трабекулярного пространства и, в конечном итоге, ослабление кости [84].
На сегодняшний день нет данных о связи между ранним воздействием ЭД и изменениями качества и состава костной ткани у людей. Некоторые из этих изменений могут быть обусловлены эпигенетическими изменениями и, в частности, изменениями в сети микроРНК [13]. МикроРНК – это эндогенные малые некодирующие РНК, которые действуют как транскрипционные и посттранскрипционные регуляторы. Могут происходить множественные изменения в количестве микроРНК, где одновременно регулируемые вверх и вниз микроРНК могут быть мишенью для одного и того же гена с целым рядом предполагаемых эффектов и, наоборот, одна микроРНК может регулировать несколько генов-мишеней. МикроРНК играют определенную роль в регуляции развития скелета, с эффектами на разных стадиях развития костей и в разных типах костных клеток [85,86]. Исследование у новорожденных и детей показало различные уровни экспрессии микроРНК в зависимости от стадии развития [87]. В частности, уровень экспрессии 36 микроРНК увеличивался от рождения до середины детства. Молекулярные механизмы, с помощью которых микроРНК выполняют свою регуляторную роль в продольном росте костей, связаны с регуляцией роста клеток, в частности хондроцитов [88].
Хондроциты участвуют в росте скелета: эндохондральное формирование кости происходит в ростовой пластинке, которая является тонким слоем хряща, расположенным в метафизе длинных костей. Пластинка роста демонстрирует высокую степень пространственной регуляции и гистологически образована тремя различными зонами: зоной покоя, которая содержит хондроциты-предшественники; пролиферативной зоной, которая характеризуется хондроцитами, которые пролиферируют однонаправленно, образуя столбчатые клеточные клоны и производя специфические внеклеточные матриксные белки (например, коллаген II типа и агрекан); и гипертрофической зоной, в которой зрелые хондроциты выходят из клеточного цикла, проходят гипертрофическую дифференциацию и экспрессируют коллаген X типа. Хрящевой матрикс минерализуется, а терминально дифференцированные хондроциты подвергаются апоптозу [89].
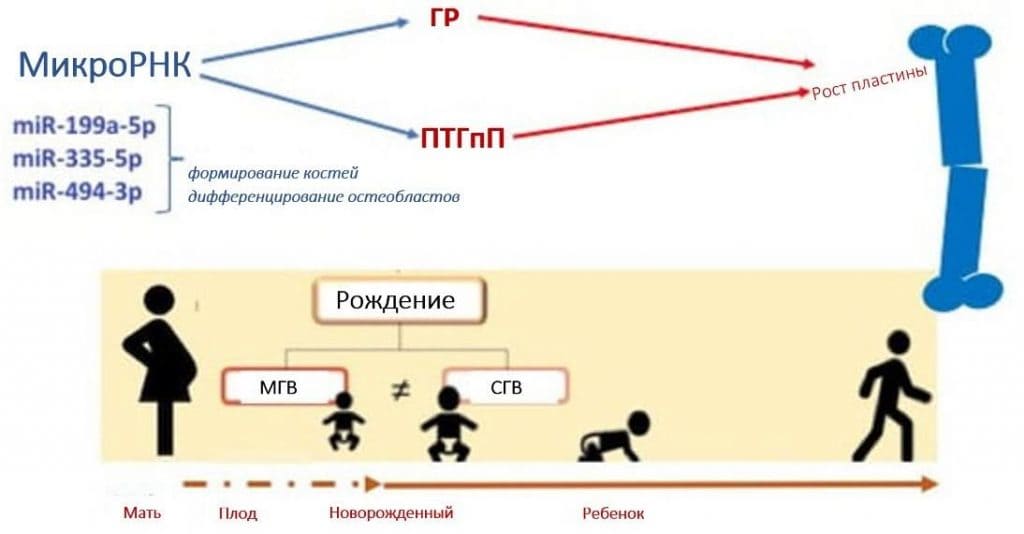
Паттерн экспрессии микроРНК может быть вовлечен в контроль пролиферативных и дифференцировочных механизмов, которые регулируют долю клеток в определенных зонах ростовой пластинки. Более того, на четкие паттерны в ростовой пластинке влияют градиенты концентрации протеина, подобного паратиреоидному гормону (ПТГпП), в различных зонах, что позволяет предположить роль микроРНК в механизме действия ПТГпП для контроля клеток ростовой пластинки [90], Рис. 2.
Рисунок 2. Схематическое изображение роли микроРНК в развитии костной ткани. miR = микроРНК; ГР: гормон роста; ПТГпП: протеин подобный паратиреоидному гормону.
Кроме того, микроРНК являются критически важными для регуляции функции гипоталамуса и развития гипофиза, а следовательно, и для секреции и действия гормона роста. Было продемонстрировано, что три специфические микроРНК, которые регулируют гены, связанные с ростом костей, непосредственно регулируются гормонами роста и представляют большой интерес с точки зрения продольного роста, а именно miR-199a-5p, miR-335-5p и miR-494-3p. miR-199a-5p и miR-335-5p играют важную роль в формировании костей и дифференциации остеобластов in vitro. В частности, miR-199a-5p участвует в дифференциации остеобластов, а чрезмерная экспрессия miR-335-5p, как сообщалось, способствует формированию и регенерации костной ткани в модели трансгенных мышей [91].
miR-494-3p еще не изучался в контексте развития костей или ростовых пластинок, однако сообщалось, что он способствует активации пути PI3K/AKT [92], который, как известно, контролирует гипертрофическую дифференциацию хондроцитов и участвует в эндохондральном росте костей и дифференциации остеобластов [93,94].
Данные свидетельствуют о том, что в ближайшем будущем питательные вещества или препараты, направленные на этот путь, или генная терапия могут играть определенную роль у пациентов, принадлежащих к группе высокого риска, для предотвращения развития остеопении и остеопороза в дальнейшей жизни.
5.1.6. ЗВУР
Мета-анализ Wang указал, что ЗВУР является независимым фактором риска МЗК [95].
Olmos-Ortiz и соавт. обнаружили корреляцию между ЗВУР и дефицитом витамина D3 у матери; последний приводит к дефекту имплантации плаценты [96].
Этот случай приводит к хроническому нарушению функционирования плаценты с блокировкой транспорта фосфора и плохой внутриутробной кальцификации костей [97].
5.2. Неонатальные факторы
5.2.1. Преждевременные роды
Wang и соавт. подчеркивают, что гестационный возраст < 32 недель является фактором риска МЗК [95].
Это связано с двумя причинами: (1) минерализация костной ткани происходит преимущественно в третьем триместре, а преждевременные роды вызывают недостаток минеральных запасов плода; (2) недоношенные дети, госпитализированные по разным причинам (низкий гестационный возраст или потребность в искусственной вентиляции легких), являются малоподвижными, поэтому может существовать риск дефектов минерализации костной ткани [98,99]; кроме того, малоподвижность может быть обусловлена малоподвижностью, вызванной нарушением обмена веществ, нервно-мышечными или системными заболеваниями [100].
Если преждевременные роды происходят между 24 и 40 неделями гестационного возраста, новорожденные пропускают оптимальную фазу для получения максимальных запасов кальция и фосфора и часто не имеют адекватных запасов этих минералов, поэтому они особенно чувствительны к изменениям в постнатальном периоде и, кроме того, из-за сопутствующих заболеваний, связанных с недоношенностью, подвергаются факторам риска снижения минерализации костной ткани [101,102].
У недоношенных детей содержание минеральных веществ в костях недостаточное для нормального роста костей; об этом могут свидетельствовать изменения в визуализации и электролитах, а также аномальные уровни определенных ферментов в крови [5].
5.2.2. Низкий вес при рождении
Низкий вес младенцев при рождении может быть связан с серьезными метаболическими нарушениями, которые возникают во взрослом возрасте, такими как метаболический синдром и остеопороз [103]. Доказано, что низкий вес при рождении является детерминантой низкой костной массы [104].
Как показали многочисленные исследования, масса тела при рождении < 1000 г также является фактором риска МЗК; действительно, с увеличением массы тела при рождении риск МЗК уменьшается. Существует две основные причины этого: (1) преждевременные роды, как объяснялось выше [18]; (2) изменения функции плаценты, приводящие к нарушению передачи питательных веществ и минералов [51].
Систематический обзор и мета-анализ коррелирует между весом при рождении и содержанием минеральных веществ в костной ткани взрослых, демонстрируя положительную связь. Этот мета-анализ показывает, что содержание минеральных веществ в бедренной кости растет с увеличением массы тела при рождении [2].
Однако есть некоторые доказательства того, что более поздний рост является более важным фактором, чем вес при рождении [105,106].
5.2.3. Преждевременные заболевания
Распространенные неонатальные заболевания, особенно у преждевременно рожденных детей (сепсис, хронический легочный ацидоз, некротический энтероколит, холестатическая желтуха), а также длительное лечение такими препаратами, как диуретики и глюкокортикоиды, в которых часто нуждаются преждевременно рожденные дети, могут ухудшить ремоделирование костной ткани. Снижается пролиферативная активность остеобластов и повышается разрушительная активность остеокластов, что уменьшает всасывание кальция и увеличивает потерю кальция с мочой [107,108,109].
Дети с сепсисом имеют более высокий риск МЗК [110,111]. Эта корреляция обусловлена взаимодействием между иммунной системой и метаболизмом костной ткани [112]. Влияние липополисахаридов может вызвать потерю плотности костной ткани [113], поскольку приводит к активации В- и Т-клеток, которые регулируют резорбцию костной ткани [112].
Кроме того, лечение сепсиса и само заболевание, связанное с физическим распадом новорожденного, может продлить применение парентерального питания с повышенным риском МЗК [111].
Холестаз приводит к снижению абсорбции витамина D. Недоношенные дети, особенно с гестационным возрастом < 32 недель, обычно имеют низкий уровень 25-гидроксивитамина D в сыворотке крови [114].
Литохолевая кислота усиливает холестаз и действует как аналог витамина D, уменьшая его всасывание [115].
Кроме того, билирубин и желчная кислота повышают и подавляют функцию остеобластов, что негативно влияет на процесс минерализации [116].
Lee и соавт. в своем ретроспективном исследовании “случай-контроль” изучили истории болезни 55 младенцев, госпитализированных в отделение интенсивной терапии новорожденных в детской больнице Severance. Их исследование продемонстрировало положительную связь среди младенцев с ЭНМТ с холестазом, связанным с парентеральным питанием, БЛД и плохой минерализацией костей [107].
5.2.4. Ятрогенные факторы
Можно определить ятрогенные факторы риска, такие как прием препаратов, которые могут изменять уровень минералов, и длительное парентеральное питание [6].
Краеугольными камнями терапии хронических заболеваний легких являются диуретики и стероиды; по своему механизму действия эти препараты приводят к мобилизации кальция из костей, обостряя МЗК – они уменьшают пролиферацию остеобластов, стимулируют активацию остеокластов, уменьшают абсорбцию кальция и увеличивают почечную экскрецию [117].
Дефицит кальция может привести к метаболическим изменениям, связанным со вторичным гиперпаратиреозом. Повышение уровня ПТГ приводит к потере фосфатов с мочой и, как следствие, к гипофосфатемии. Повышение ПТГ вызывает повышение уровня кальция в сыворотке крови из-за усиления костной реабсорбции, а также почечной и кишечной абсорбции кальция. Поэтому изолированный уровень кальция в плазме может не быть полезным скрининговым показателем для детей с риском МЗК [5].
Длительное парентеральное питание часто необходимо недоношенным детям, которые не получают энтеральное питание в послеродовом периоде и/или не могут достичь полного энтерального питания в краткосрочной перспективе [118].
Если ППП необходима в течение периода, превышающего 4 недели, низкое потребление кальция и фосфатов является распространенным явлением [101].
Пациентам на парентеральном питании трудно достичь нормального уровня минералов в сыворотке крови – потребление минералов не достигает даже 50% от уровня, достигнутого во время внутриутробной жизни [119].
Недостаток минеральных препаратов, плохая растворимость минералов и рН препятствует использованию парентерального питания, поскольку не позволяет обеспечить достаточное поступление минералов. На растворимость кальция и фосфатов влияют условия окружающей среды, такие как температура и содержание аминокислот, глюкозы и липидов, а также рН раствора [118,120].
Поэтому отложение в костях минералов, таких как кальций и фосфор, в первые недели жизни преждевременно рожденных детей не соответствует уровню, необходимому для правильного роста костей, по сравнению с внутриутробным ростом. [101]. Кроме того, исследования показывают загрязнение алюминием во время парентерального питания, что может привести к МЗК [121], поскольку происходит чрезмерное отложение алюминия на поверхности минерализации костей, что препятствует формированию костной ткани, не давая остеобластам функционировать [122].
6. Скрининг и мониторинг
Важность максимального укрепления здоровья костей сегодня признается врачами, поэтому было разработано много скрининговых тестов, но оптимальный из них еще не определен [12,123].
Факторы риска помогают нам в выборе того, на что проводить скрининг [12,118].
У недоношенных детей содержание минералов в костной ткани недостаточно для нормального роста костей; об этом могут свидетельствовать электролитные изменения и аномальные уровни некоторых гормонов в крови и при визуализации [5].
Для улучшения линейного роста преждевременно рожденных детей с факторами риска МЗК необходимо регулярное наблюдение и мониторинг. Целью является поддержание уровня кальция и фосфора в крови в пределах нормы и избежание чрезмерной экскреции кальция с мочой [95].
Kolisambeevi и соавт. провели проспективное исследование с целью снижения частоты МЗК у младенцев с ОНМТ с гестационным возрастом ≤ 30 недель[124].
Согласно этому исследованию, мониторинг уровня фосфора необходим с первых дней жизни, а добавки, внутривенные и/или пероральные, – с 4-го дня жизни. При достижении 40 мл/кг/сутки энтерального человеческого молока постепенно вводят обогатитель грудного молока. Частота МЗК составляет 2,8% у новорожденных с гестационным возрастом от 28 до 30 недель и 69,2% у новорожденных с гестационным возрастом ≤ 26 недель. Учитывая полученные результаты, авторы пропагандируют обязательное раннее использование фосфорных добавок [124].
Для ранней диагностики минерального дефицита важное значение имеет определение биохимических маркеров в сыворотке крови. Чаще всего используют такие биохимические показатели крови, как сывороточный кальций, сывороточный фосфор, щелочная фосфатаза, ПТГ и 25(OH)D [95].
Кальций: гипокальциемия (скорректированные значения для альбуминемии) свидетельствует о гипокальциемии, если <8,5 мг/дл. Уровень кальция в сыворотке крови регулируется кальцитонином и ПТГ. Когда уровень циркулирующего кальция снижается, организм мобилизует кальций под костной тканью, стимулируя ПТГ поддерживать адекватный уровень кальция в сыворотке крови; кроме того, на уровень кальция в сыворотке крови может влиять гипофосфатемия [102].
Кальций в крови снижается только тогда, когда истощаются запасы костного кальция, то есть на поздней стадии МЗК. Поэтому диагностика МЗК на ранней стадии по уровню кальция в крови не имеет смысла [95].
Фосфаты: фосфатемия является хорошим показателем для оценки запасов фосфора в костях; устойчивое снижение уровня фосфора в сыворотке крови свидетельствует о недостаточном его поступлении, что повышает риск развития остеопороза. Когда уровень фосфора в крови остается устойчиво низким, усиливается резорбция костей, экскреция кальция с мочой продолжает увеличиваться, что приводит к истощению кальция [95].
Уровень фосфатов в сыворотке крови <5,5 мг/дл является подозрительным; это первый маркер нарушения минерального обмена в костях, который появляется в 7-14-дневном возрасте. У новорожденных, находящихся исключительно на грудном вскармливании, уровень фосфора в сыворотке крови <3,6 мг/дл свидетельствует о тяжелом дефиците минеральных веществ, а следовательно, о более высоком риске развития МЗК [125].
В течение первых месяцев жизни у недоношенных детей, особенно с проблемами дыхания и желудочно-кишечными осложнениями или тех, кто принимал метилксантины, диуретики или кортикостероиды, следует тщательно контролировать уровень фосфора в сыворотке крови [51].
Гипофосфатемия также стимулирует почечный канальцевый синтез витамина D с последующим содействием всасыванию кальция в кишечнике. Таким образом, дефицит фосфатов может быть причиной гиперкальциемии, гиперкальциурии и нефрокальциноза [5].
Щелочная фосфатаза (ЩФ): ЩФ, маркер костного обмена, физиологически растет в течение первых 3 недель жизни с пиком в возрасте 6-12 недель [126].
Уровень ЩФ > 500 МЕ/л указывает на нарушение костного гомеостаза. Если показатели составляют 700 МЕ/л, они указывают на деминерализацию, даже у бессимптомных пациентов; на самом деле, повышение уровня щелочной фосфатазы в крови может предшествовать появлению клинических симптомов [95,127]. В некоторых исследованиях для младенцев с ОНМТ рекомендуется проводить рентгенографию запястья и/или коленных суставов, если по крайней мере два значения ЩФ > 800 МЕ/л регистрируются через 1 неделю [128].
Viswanathan и соавт. продемонстрировали, что у младенцев с ЭНМТ со сроком гестации <30 недель выявление ЩФ > 500 МЕ/л ассоциируется с МЗК [117].
ЩФ > 1000 МЕ/л можно считать маркером рахита [129]. Использование ЩФ в сочетании с фосфором крови повышает специфичность. ЩФ > 900 МЕ/л при фосфоре сыворотки крови < 5,6 мг/дл (< 1,8 ммоль/л) имеет чувствительность 100% и специфичность 70%. [130]. Измерение сывороточного фосфата и ЩФ рекомендуется проводить еженедельно или раз в две недели [131].
Паратиреоидный гормон (ПТГ): Концентрация ионов кальция в плазме регулирует секрецию ПТГ. Исследования показывают, что концентрацию ПТГ можно использовать как инструмент, наряду с другими параметрами, для скрининга и мониторинга МЗК [132]. В частности, уровень ПТГ в сыворотке крови может быть полезным маркером для выявления младенцев с ЭНМТ, которые имеют риск развития МЗК: ПТГ > 100 пг/мл может свидетельствовать о наличии у младенцев с ЭНМТ риска развития МЗК [133]. Исследования показывают, что уровень ПТГ в сыворотке крови может прогнозировать снижение содержания минеральных веществ в костной ткани у недоношенных детей, достигших доношенного возраста [134].
ПТГ является маркером вторичного гиперпаратиреоза и в сочетании с канальцевой реабсорбцией фосфора (КРФ) может помочь различить причины гипофосфатемии. Низкая КФК при высоких уровнях ПТГ может указывать на дефицит кальция. Высокая КФК при низких уровнях ПТГ или нормальных показателях, наоборот, указывает на недостаток фосфора [5].
При применении только фосфорных добавок для младенцев с низким весом при рождении происходит стимуляция вторичного гиперпаратиреоза, что может повысить риск МЗК [51].
Повышенный уровень ПТГ в сыворотке крови был обнаружен у более 80% младенцев с ЭНМТ с признаками остеопении [133].
Витамин D (25(OH)D): В случае МЗК уровень 25(OH)D в сыворотке крови может быть нормальным, сниженным или повышенным, поэтому его не используют как скрининговый маркер [95].
Несколько исследований задокументировали связь между низким уровнем 25(OH)D и низким гестационным возрастом на момент родов, поэтому недоношенные дети являются уязвимой группой по статусу витамина D [114].
Тщательный мониторинг уровня витамина D не является необходимым, если нет противопоказаний для регулярного приема витамина D, поскольку это дорогой мониторинг [67]. По данным литературы, уровень 25(OH)D > 50 нмоль/л предотвращает развитие рахита у младенцев и детей [135].
Недавняя литература, в том числе по неонатальным популяциям, демонстрирует нормализацию ПТГ до уровня > 75 нмоль/л при наличии адекватного уровня 25(OH)D в сыворотке крови[136].
Сывороточный остеокальцин (ОК) Сывороточный остеокальцин – это белок костного матрикса, уровень которого повышается во время высокого оборота костной ткани. Однако нет доказательств того, что повышенный уровень ОК в сыворотке крови коррелирует с содержанием минеральных веществ в костной ткани в первые четыре месяца жизни [137]. Czech-Kowalska и соавт. предполагают, что уровень ОК и экскреция фосфатов с мочой могут быть маркерами плохой минерализации костной ткани в 3-месячном возрасте [134].
Маркеры мочи: Биохимические показатели мочи включают фосфор мочи, кальций мочи, фосфор/креатинин мочи, кальций/креатинин мочи и КРФ [12]. Формула для расчета КРФ выглядит следующим образом: [1 – (фосфор мочи/креатинин мочи × креатинин сыворотки/фосфор сыворотки)] × 100. Нормальное значение КРФ составляет 78-91%; при значениях > 95% – это маркер недостаточной фосфатной интеграции [138]. Дети, рожденные в сроке гестации < 28 недель, имеют более низкий уровень фосфатов, чем другие преждевременно рожденные, с высокой экскрецией фосфатов с мочой, даже при наличии низкого уровня фосфатов в сыворотке крови. Почечная реабсорбция фосфатов увеличивается вследствие повышения уровня ПТГ, вызванного, в свою очередь, гипосфатемией. Четких рекомендаций по мониторингу не существует, хотя многие клиницисты соглашаются контролировать лабораторные анализы каждые 1-2 недели. Abrams и соавт. рекомендуют измерять уровень фосфора в крови и ЛФ еженедельно или раз в две недели [118]. Land и соавт. рекомендуют измерять уровень кальция и фосфора в сыворотке крови, что сопровождается кальциурией и фосфатурией, еженедельно у недоношенных детей в возрасте до трех недель и дважды в неделю у детей старше 3 недель [139]. Harrison и соавт. рекомендуют еженедельное измерение уровней кальция и фосфора в сыворотке крови, а также щелочной фосфатазы и креатинфосфокиназы [12].
Рентгеновские лучи полезны только при тяжелой МЗК со значительными признаками остеопороза или переломами костей; остеопороз с потерей <20-40% костной ткани может быть неочевидным с помощью этого метода, поэтому они не подходят для ранней диагностики. Изменения, которые можно обнаружить с помощью рентгеновских лучей, – это деминерализация или “остеопения”, рахитические изменения, остеопороз концов длинных костей, эпифизарные изменения (чашевидные или заусенцы), расширение концов ребер, субпериостальное образование новой костной ткани или переломы [12,95].
Koo и соавт. описывают рентгенологические изменения: степень (1) разрежение костной ткани; степень (2) разрежение костной ткани с метафизарными изменениями и субпериостальными костными образованиями; степень (3) спонтанные переломы [140].
Некоторые переломы могут быть острыми, что проявляется болью или невозможностью движений, но чаще переломы протекают бессимптомно [141]. Американская академия педиатрии рекомендует делать рентгенограммы каждые 5-6 недель, пока не улучшится минерализация [118].
Золотым стандартом для выявления остеопороза является двухэнергетическая рентгеновская абсорбциометрия (ДЭРА) [142], пригодна для преждевременно рожденных детей [143]. ДЭРА рассчитывает МПКТ [142,144], то есть содержание костного кальция в граммах гидроксиапатита на квадратный сантиметр, используя низкую дозу ионизирующего излучения (диапазон 1-13 мкЗв) [145,146].
В клинической практике, однако, трудно использовать этот инструмент у недоношенных и доношенных детей по разным причинам: инструментальные размеры, время, затрачиваемое на двигательные артефакты; его использование для скрининга МЗК не подходит для рутинного скрининга, поскольку его сложно выполнить [95,102].
Ультразвуковая количественная денситометрия (УКД) измеряет содержание минеральных веществ в костной ткани и органический матрикс кости [147]. Преимуществами его использования по сравнению с другими инструментальными исследованиями является дешевизна и простота использования портативных приборов. Обычно ее измеряют на большеберцовой кости. УКД оценивает скорость звука (СЗ) и время костного проведения (ВКП). В некоторых исследованиях, чтобы уменьшить влияние мягких тканей, для плечевой кости или пястной кости предпочтение отдавали СЗ, а не ВКП [148,149]. Altuncu и соавт. наблюдали с помощью УКИ снижение минерализации костной ткани у недоношенных детей в раннем постнатальном периоде: Z-баллы большеберцовой кости недоношенных детей (<33 недель, средняя масса тела при рождении 1650 г), оцененные в возрасте, скорректированном на срок беременности, были ниже по сравнению с Z-баллами на первой неделе постнатальной жизни. В этом исследовании было обнаружено, что показатели Z берцовой кости у недоношенных новорожденных в возрасте, скорректированном на срок доношенности, были обратно пропорциональны уровню ЩФ в сыворотке крови: у лиц с уровнем ЩФ > 900 МЕ/л показатели Z берцовой кости были ниже, чем у младенцев с уровнем ЩФ < 900 МЕ/л [150].
Rack и соавт. оценивали качество костной ткани с помощью УКД в когорте 172 недоношенных и доношенных детей (гестационный возраст от 23 до 42 недель; масса тела при рождении от 405 до 5130 г): Параметры УКД, оцененные на первой неделе жизни, коррелировали с гестационным возрастом и массой тела при рождении [151].
Учитывая имеющиеся в литературе исследования, оценка УКД у преждевременно рожденных детей может играть важную роль в мониторинге здоровья костной ткани. Однако необходимы дальнейшие исследования для выявления биохимических изменений, которые могут лучше коррелировать с показателями УКД [102].
7. Профилактика и лечение остеопении
При МЗК профилактика играет более важную роль, чем лечение, и направлена на обеспечение адекватного поступления кальция и фосфора для содействия нормальному развитию костей [51].
Для профилактики МЗК необходимо оптимизировать диету, уделяя особое внимание потреблению минералов (кальция, фосфора) и витамина D. Необходимо индивидуальное назначение минеральных добавок. Также желательно, по возможности, ограничить длительный прием лекарственных средств: петлевых диуретиков, метилксантинов и глюкокортикоидов [11].
Важно учитывать, что преждевременно рожденные дети имеют другие потребности в минеральных веществах, чем доношенные новорожденные [118].
Концентрация 25(OH)D у новорожденных составляет около 80% от материнского уровня, поэтому младенцы, рожденные от матерей с дефицитом витамина D, вероятно, также имеют дефицит витамина D. Уровень 25(OH)D у новорожденных быстро снижается, поскольку период полувыведения составляет около 21 дня, если не начать прием витамина D сразу с началом энтерального питания. Для обеспечения достаточного уровня витамина D у новорожденных, особенно в странах, где дефицит витамина D является распространенным явлением, следует назначать добавки витамина D беременным женщинам [67,68].
Многие группы, включая Американскую академию педиатрии, Институт медицины, Эндокринное общество и Европейское общество детской гастроэнтерологии, гепатологии и питания (ESPGHAN), рекомендуют добавление витамина D недоношенным и доношенным детям [118,152,153,154].
Рекомендации Института медицины, частично основанные на работе Priemel и соавт., утверждают, что уровень 25(OH)D должен составлять 50 нмоль/л для достижения хорошей минерализации костной ткани [155].
Эндокринное общество рекомендует целевой уровень >75 нмоль/л и ESPGHAN >80 нмоль/л [153,154].
Существует мало данных об ответе на прием витамина D у младенцев с массой тела при рождении < 1200 г [156].
Anderson-Berry и соавт. провели рандомизированное исследование, чтобы оценить наиболее подходящую дозу витамина D для преждевременно рожденных детей [156]. Когорта состояла из 32 младенцев, родившихся между 24 и 32 неделями гестации. Результаты этого исследования поддерживают рассмотрение суточной дозы 800 МЕ витамина D для младенцев в возрасте < 32 недель, находящихся в отделении интенсивной терапии новорожденных, что привело к улучшению уровня 25(OH)D в 4 недели, повышение плотности костной ткани и улучшение линейного роста [156].
Некоторые неонатологи рекомендуют добавки витамина D для недоношенных детей в дозах 800-1000 МЕ/сутки, что выше, чем рекомендовано для доношенных детей (400 МЕ/сутки), хотя доказательств в пользу этого мало, если только нет дисфункции печени или кишечника [67,68]. Нет доказанных преимуществ использования активированного витамина D (кальцитриола или альфакальцидола) по сравнению с использованием родительского витамина D, за исключением случаев тяжелых заболеваний почек или печени [67].
Во время ППП-кормления необходимо адекватное количество кальция и фосфатов, которое увеличивается при переходе на энтеральное питание и во время полного энтерального питания [120].
Pereira-da-Silva и соавт. продемонстрировали, что ППП, содержащие высокие концентрации кальция и фосфора в течение первых недель жизни, могут предотвратить нарушение костной ткани у недоношенных детей со средним гестационным возрастом 29,6 недель и весом при рождении 1262 г [120].Современные рекомендации в клинической практике отличаются: для кальция – от 40 до 120 мг/кг/сутки, для фосфатов – от 30 до 70 мг/кг/сутки [120]. Введение высокого потребления белка и калорий в ППП в первые дни жизни, связанное с ранним энтеральным питанием, имеет эффект увеличения клеточного поглощения фосфатов [157].
Чтобы предотвратить вред от ППП, переход от полного парентерального питания к энтеральному должен быть максимально ускорен [95].
На самом деле, во время энтерального питания через желудочно-кишечный тракт всасывание фосфора может достигать более 90% [158]. Поэтому в первые недели жизни недоношенных детей энтеральное питание обеспечивает эффективное усвоение кальция и фосфора [95].
Некоторые исследования показывают, что младенцы, которых кормили исключительно грудным молоком, имели более низкий уровень фосфора в сыворотке крови, чем те, кого кормили специальными смесями или принимали минеральные добавки [159].
Исследования показывают, что рахит встречается в 40% случаев у недоношенных детей, которых вскармливали необогащенным грудным молоком, по сравнению с 16% тех, кого кормили специальными смесями [160].
Фортификация остается важной для обеспечения адекватного потребления минеральных веществ: 180 и 200 мл/день необогащенного грудного молока, вероятно, обеспечивают лишь 1/3 уровня кальция и фосфора во время роста, несмотря на то, что ребенок поглощает 60% кальция и 80% фосфора из грудного молока [161].
Следует соблюдать осторожность при использовании не обогащенного донорского молока из-за более низкого содержания фосфора, чем в свежем грудном молоке [11].Новорожденные достигают оптимального уровня потребления минеральных веществ при примерно 180-220 мг/кг/сутки кальция и 100-130 мг/кг/сутки фосфора [118]. Дети с критическими заболеваниями могут нуждаться в целевых минеральных добавках кальция и/или фосфора [5].
Недавнее исследование, проведенное в Великобритании, подчеркивает, что неонатологи считают фосфатные добавки стандартным методом лечения метаболических заболеваний костей у недоношенных детей. Добавки кальция ассоциируются только с меньшим количеством случаев [132].
Фосфорные добавки следует назначать, если показатели снижаются до <5,5 мг/дл [118].
Рекомендуемая доза фосфорных добавок составляет от 10 мг/кг/сутки до 50 мг/кг/сутки. Индивидуальная реакция на лечение может отличаться в зависимости от клинического состояния, рН кишечника, всасывания и индивидуальной переносимости. Лучшей формой фосфорных добавок является фосфат калия для внутривенного введения, который назначают энтерально из-за кишечной непереносимости других доступных фосфорных солей. Также могут использоваться альтернативные препараты, например, в форме таблеток или порошка. Пациенты, принимающие калийсберегающие диуретики, должны находиться под тщательным наблюдением, обращая внимание на любые электролитные нарушения, поскольку эти альтернативные препараты содержат натрий и калий [5]. Следует назначать фосфатные добавки, убедившись, что поддерживается сбалансированное соотношение кальция и фосфатов [51].
Идеальное соотношение потребления кальция и фосфатов для оптимизации содержания фосфатов и усвоения кальция составляет примерно 1,5-1,7:1 [118].
В случаях вторичного гиперпаратиреоза и низкой КРФ можно рассмотреть возможность назначения препаратов кальция [5]. Если ПТГ повышен, что свидетельствует о дефиците кальция, рекомендуется пероральное применение кальция для нормализации уровней ПТГ, фосфатов и ЩФ в плазме крови. Рекомендуемая доза препаратов кальция составляет сначала 20 мг/кг/сутки до 70-100 мг/кг/сутки [118,133]. Эта доза может быть увеличена у недоношенных детей с тяжелыми нарушениями костного метаболизма [51].
Существуют также немедикаментозные методы лечения МЗК. Известно, что механическая стимуляция играет определенную роль в стимулировании роста костей. Движения плода, осуществляемые против стенки матки, помогают обеспечить адекватную минерализацию костной ткани и адекватное развитие мышц [162]. Эти движения не могут быть воспроизведены в перинатальном периоде во время пребывания в отделении интенсивной терапии новорожденных. Физическая терапия может обеспечить необходимую стимуляцию с помощью механической нагрузки на кости и суставы, что стимулирует формирование и рост костей [163].
Физиотерапевтические методики, основанные на применении пассивных движений с легкой компрессией, продемонстрировали благоприятное влияние на преждевременно рожденных детей. С другой стороны, отсутствие нагрузки увеличивает резорбцию костной ткани и уменьшает костную массу [164].
Недавнее исследование использовало рефлекторно-локомоторную терапию (РЛТ) для выработки непроизвольных активно-резистивных движений у недоношенных младенцев [165].
РЛТ является эффективным методом, более эффективным, чем другие физиотерапевтические методы, для содействия росту и формированию костей и предотвращения остеопении [166]. РЛТ через проприоцептивные стимулы вызывает реакцию центральной нервной системы, что приводит к непроизвольным активным движениям у детей [167].
Следовательно, адекватный прием добавок кальция, фосфора и витамина D и протокол физиотерапии, а также оптимальное питание являются основой профилактики и лечения метаболических заболеваний костей у младенцев.
8. Дальнейшие действия после выписки
Следовательно, новорожденный ребенок имеет гораздо более низкую скорость роста скелета, чем плод, поскольку, независимо от гестационного возраста, трансплацентарный транспорт снижается при рождении с немедленным уменьшением циркулирующего кальция [38].
Уровень кальция, гарантированный плоду в течение третьего триместра, очень трудно достичь “искусственно”. Однако существуют фортификаторы, специально разработанные для младенцев, питающихся материнским молоком, а также некоторые молочные смеси с высокой концентрацией минералов, которые обеспечивают рост костной ткани на уровне или близком к внутриутробному [161].
Обогащенное грудное молоко и смеси для преждевременно рожденных детей, как правило, лучше, чем смеси с соей или элементарные смеси, в которых не хватает кальция и фосфора на уровне, достаточном для преждевременно рожденного ребенка [118].
Смеси для недоношенных детей или обогащение грудного молока показаны максимум до 52 недель с момента зачатия или, в случае плохого роста, до 6 месяцев. Продолжительность обогащения все еще обсуждается. Младенцы, которых вскармливали недоношенными смесями, в возрасте около 6 месяцев достигают минерализации костей, сопоставимой с минерализацией костей у доношенных младенцев. С другой стороны, недоношенные дети, которых кормят грудным молоком, достигают минерализации костей, сравнимой с минерализацией костей доношенных детей, в возрасте около 2 лет [168].
Решения по пищевой поддержке принимаются на основе показателей роста, а частота биохимического мониторинга определяется тяжестью лабораторных показателей МЗК.
Особое внимание следует обратить на адекватное питание, поскольку чрезмерные дозы могут вызвать гиперкальциурию и нефрокальциноз [5]. По этой причине может быть полезным мультидисциплинарный подход с привлечением диетолога, который имеет опыт в сфере здоровья новорожденных и/или костной ткани.
9. Новые технологии
На сегодняшний день ранняя инструментальная диагностика МЗК является достаточно сложной. На самом деле, традиционные методы визуализации в основном выявляют откровенные признаки патологии, такие как переломы или значительная деминерализация (снижение минерализации на 20-40%), события, которые происходят на запущенной стадии, поэтому не подходят для ранней диагностики [169].
В настоящее время первым шагом, который использует клиницист для выявления низкой минерализации костной ткани, является рентгенография или УКД, когда это возможно, даже если золотым стандартом является ДЭРА.
Эту методику можно использовать как у доношенных, так и недоношенных детей, при этом поясничный отдел позвоночника, предплечье и пятка считаются преимущественными областями обследования [170]. Однако ее использование существенно ограничено размером инструмента, временем, необходимым для выполнения снимков, наличием подвижных артефактов и невозможностью выполнения в постели [102].
Применение ДЭРА не разрешается во время беременности, поскольку это может привести к воздействию ионизирующего излучения на плод [171,172].
Более того, ДЭРА предоставляет количественную информацию о костной ткани, но не оценивает качественную информацию [144].
Новой неинвазивной инструментальной методикой является УКД, которая с помощью ультразвука рассчитывает СЗ и ВКП кости, оценивая как минеральное содержание кости, так и органический матрикс [147,170].
По сравнению с ДЭРА, эта методика имеет преимущества: низкая стоимость, небольшой инструментарий, возможность проведения обследования у постели пациента и, особенно, отсутствие ионизирующего излучения. Однако результаты этого метода зависят от оператора и имеют более низкую диагностическую точность, чем в ДЭРА. Поэтому использование УКД также существенно ограничено в клинической практике [173,174].
Недавно была валидирована новая технология, известная как радиочастотная ультразвуковая спектрометрия (РЭМС), основанная на использовании ультразвука. Она является очень полезной в клинической практике для оценки прочности костей, прогнозирования риска переломов и общего ведения пациента с остеопорозом [144,175].
Технология РЭМС точно оценивает МПКТ на уровне шейки бедренной кости и поясничных позвонков, которые считаются центральными анатомическими референтными участками. Во время ультразвукового сканирования принимаются так называемые радиочастотные сигналы, которые интегрируются с ультразвуковым изображением. Радиочастоты – это нативные нефильтрованные ультразвуковые сигналы, которые позволяют получить максимум информации об исследуемой ткани, в отличие от того, что происходит в обычном ультразвуковом процессе, где обрабатываются только некоторые сигналы [144]. Благодаря полностью автоматическому алгоритму огромное количество собранных данных преобразуется в специфический спектр пациента, который затем сравнивается с эталонными спектральными моделями по полу, возрасту, области и ИМТ, извлеченными из специальной базы данных [176,177]. Таким образом, можно получить очень точную оценку здоровья кости, как количественную, так и качественную, что позволяет классифицировать ткань как здоровую, остеопеническую или остеопоротическую [144].
Метод РЭМС, как продемонстрировано в нескольких исследованиях, имеет чувствительность и специфичность 90,4% и 95,5% соответственно, по сравнению с ДЭРА [178], и является таким же точным и воспроизводимым, как и DERA, в оценке МПКТ шейки бедренной кости [179,180]. Преимуществами технологии РЭМС является более низкая стоимость, доступность в условиях первичной медицинской помощи без необходимости в специальном оборудовании или сертифицированных операторах, чрезвычайная простота использования благодаря простой и интуитивно понятной процедуре сбора данных, высокие показатели воспроизводимости исследований, которые гарантируются быстрой и полностью автоматизированной обработкой данных, а также использование ультразвука, безопасного для плода [144,175].Все эти качества делают РЭМС выборочной технологией для расширенного массового скрининга [175].
Сейчас использование РЭМС не является столь распространенным в клинической практике. На Рис. 3 мы предлагаем алгоритм, который предусматривает использование РЭМС в пренатальном периоде для выявления новорожденных из группы риска, а в постнатальном периоде – интеграцию полученных данных с лабораторными маркерами для определения уровня минерализации костной ткани.
Рисунок 3. Предложение алгоритма: комплексное использование лабораторных и мочевых анализов с новыми технологиями для оценки уровня минерализации костной ткани.
10. Заключение
Костная масса чувствительна ко многим пре- и постнатальным повреждениям. Достижения биотехнологии и генетики позволили идентифицировать многочисленные микроРНК, которые способствуют развитию костной ткани, что играет важную роль в раннем выявлении пациентов с высоким риском развития остеопении. Для внедрения более комплексной профилактики важно не только определить факторы, которые влияют на костную ткань в постнатальном периоде, но и, по возможности, вмешиваться в пренатальном периоде, оптимизируя питание матери и внутриутробный рост. Такие стратегии следует поощрять как меры общественного здравоохранения для уменьшения расходов, связанных с осложнениями остеопении. На сегодняшний день не существует унифицированных рекомендаций, которые бы разъясняли правильный процесс диагностики и ведения пациентов с остеопенией. В литературе также не хватает общих рекомендаций по надлежащей профилактике. Поэтому существует необходимость поощрения использования неинвазивных методов в пре- и послеродовом периоде для осуществления наилучшей профилактики и создания новых алгоритмов диагностики и мониторинга минеральной плотности костной ткани.
Аббревиатуры
| РЭМС | радиочастотная ультразвуковая спектрометрия |
| МПКТ | минеральная плотность костной ткани |
| МЗК | метаболическое заболевание костей |
| ОНМТ | очень низкая масса тела при рождении |
| ЭНМТ | экстремально низкая масса тела при рождении |
| ЗВУР | задержка внутриутробного развития |
| БЛД | бронхолегочная дисплазия |
| НЭК | некротизирующий энтероколит |
| ППП | полное парентеральное питание |
| ПТГ | паратгормон |
| ПТГпП | протеин, подобный паратиреоидному гормону |
| КМБ | костный морфогенетический белок |
| ЭД | эндокринные дизрапторы |
| PAX1 | ген парного бокса 1 |
| RANKL | ядерный активирующий фактор каппа-b рецептора |
| ОПГ | остеопротегерин |
| ФРФ23 | фактор роста фибробластов 23 |
| ТНЩФ | тканево неспецифическая щелочная фосфатаза |
| ЭНПФ | эктонуклеотид пирофосфатаза |
| АНК | анкилоз |
| КаЧР | кальций-чувствительные рецепторы |
| ЩФ | щелочная фосфатаза |
| ГР/ИФР-1 | гормон роста/инсулиноподобный фактор роста 1 |
| ОА | оксид азота |
| НАДФ | никотинамидадениндинуклеотидфосфат |
| ОС | окислительный стресс |
| ЭД | эндокринные дизрапторы |
| КРФ | канальцевая реабсорбция фосфора |
| ОК | остеокальцин |
| ДЭРА | двухэнергетическая рентгеновская абсорбциометрия |
| УКД | ультразвуковая количественная денситометрия |
| СЗ | скорость звука |
| ВКП | время костного проведения |
| РЛТ | рефлекторно-локомоторная терапия |
Ссылки на источники
- Masztalerz-Kozubek, D.; Zielinska-Pukos, M.A.; Hamulka, J. Maternal Diet, Nutritional Status, and Birth-Related Factors Influencing Offspring’s Bone Mineral Density: A Narrative Review of Observational, Cohort, and Randomized Controlled Trials. Nutrients 2021, 13, 2302.
- Baird, J.; Kurshid, M.A.; Kim, M.; Harvey, N.; Dennison, E.; Cooper, C. Does birthweight predict bone mass in adulthood? A systematic review and meta-analysis. Osteoporos. Int. 2011, 22, 1323–1334.
- Godfrey, K.; Walker-Bone, K.; Robinson, S.; Taylor, P.; Shore, S.; Wheeler, T.; Cooper, C. Neonatal bone mass: Influence of parental birthweight, maternal smoking, body composition, and activity during pregnancy. J. Bone Miner. Res. 2001, 16, 1694–1703.
- Lanham, S.A.; Roberts, C.; Perry, M.J.; Cooper, C.; Oreffo, R.O. Intrauterine programming of bone. Part 2: Alteration of skeletal structure. Osteoporos. Int. 2008, 19, 157–167.
- Rustico, S.E.; Calabria, A.C.; Garber, S.J. Metabolic bone disease of prematurity. J. Clin. Transl. Endocrinol. 2014, 1, 85–91.
- Backström, M.C.; Kuusela, A.L.; Mäki, R. Metabolic bone disease of prematurity. Ann. Med. 1996, 28, 275–282.
- Rigo, J.; Pieltain, C.; Salle, B.; Senterre, J. Enteral calcium, phosphate and vitamin D requirements and bone mineralization in preterm infants. Acta Paediatr. 2007, 96, 969–974.
- Schulz, E.V.; Wagner, C.L. History, epidemiology and prevalence of neonatal bone mineral metabolic disorders. Semin. Fetal Neonatal Med. 2020, 25, 101069.
- Akbari, S.; Rasouli-Ghahroudi, A.A. Vitamin K and Bone Metabolism: A Review of the Latest Evidence in Preclinical Studies. Biomed Res. Int. 2018, 2018, 4629383.
- Tenta, R.; Bourgiezi, I.; Aliferis, E.; Papadopoulou, M.; Gounaris, A.; Skouroliakou, M. Bone metabolism compensates for the delayed growth in small for gestational age neonates. Organogenesis 2013, 9, 55–59.
- Poundarik, A.A.; Boskey, A.; Gundberg, C.; Vashishth, D. Biomolecular regulation, composition and nanoarchitecture of bone mineral. Sci. Rep. 2018, 8, 1191.
- Harrison, C.M.; Johnson, K.; McKechnie, E. Osteopenia of prematurity: A national survey and review of practice. Acta Paediatr. 2008, 97, 407–413.
- Bocheva, G.; Boyadjieva, N. Epigenetic regulation of fetal bone development and placental transfer of nutrients: Progress for osteoporosis. Interdiscip. Toxicol. 2011, 4, 167–172.
- Dimas, A.; Politi, A.; Bargiota, A.; Panoskaltsis, T.; Vlahos, N.F.; Valsamakis, G. The Gestational Effects of Maternal Bone Marker Molecules on Fetal Growth, Metabolism and Long-Term Metabolic Health: A Systematic Review. Int. J. Mol. Sci. 2022, 23, 8328.
- Berendsen, A.D.; Olsen, B.R. Bone development. Bone 2015, 80, 14–18.
- Olsen, B.R.; Reginato, A.M.; Wang, W. Bone development. Annu. Rev. Cell Dev. Biol. 2000, 16, 191–220.
- Sethi, A.; Priyadarshi, M.; Agarwal, R. Mineral and bone physiology in the foetus, preterm and full-term neonates. Semin. Fetal Neonatal Med. 2020, 25, 101076.
- Cooper, C.; Westlake, S.; Harvey, N.; Javaid, K.; Dennison, E.; Hanson, M. Review: Developmental origins of osteoporotic fracture. Osteoporos. Int. 2006, 17, 337–347.
- Fernandez-Teran, M.; Ros, M.A. The Apical Ectodermal Ridge: Morphological aspects and signaling pathways. Int. J. Dev. Biol. 2008, 52, 857–871.
- Mackie, E.J.; Ahmed, Y.A.; Tatarczuch, L.; Chen, K.S.; Mirams, M. Endochondral ossification: How cartilage is converted into bone in the developing skeleton. Int. J. Biochem. Cell Biol. 2008, 40, 46–62.
- Shum, L.; Nuckolls, G. The life cycle of chondrocytes in the developing skeleton. Arthritis Res. 2002, 4, 94–106.
- Vortkamp, A.; Lee, K.; Lanske, B.; Segre, G.V.; Kronenberg, H.M.; Tabin, C.J. Regulation of rate of cartilage differentiation by Indian hedgehog and PTH-related protein. Science 1996, 273, 613–622.
- Caetano-Lopes, J.; Canhão, H.; Fonseca, J.E. Osteoblasts and bone formation. Acta Reumatol. Port. 2007, 32, 103–110.
- Karsenty, G.; Wagner, E.F. Reaching a genetic and molecular understanding of skeletal development. Dev. Cell 2002, 2, 389–406.
- Hensley, A.P.; McAlinden, A. The role of microRNAs in bone development. Bone 2021, 143, 115760.
- Yan, X.; Wang, H.; Li, Y.; Jiang, Y.; Shao, Q.; Xu, W. MicroRNA-92a overexpression promotes the osteogenic differentiation of bone mesenchymal stem cells by impeding Smad6-mediated runt-related transcription factor 2 degradation. Mol. Med. Rep. 2018, 17, 7821–7826.
- Gao, X.L.; Cao, M.G.; Ai, G.G.; Hu, Y.B. Mir-98 reduces the expression of HMGA2 and promotes osteogenic differentiation of mesenchymal stem cells. Eur. Rev. Med. Pharmacol. Sci. 2018, 22, 3311–3317.
- Aquino-Martinez, R.; Farr, J.N.; Weivoda, M.M.; Negley, B.A.; Onken, J.L.; Thicke, B.S.; Fulcer, M.M.; Fraser, D.G.; van Wijnen, A.J.; Khosla, S.; et al. miR-219a-5p Regulates Rorβ During Osteoblast Differentiation and in Age-related Bone Loss. J. Bone Miner. Res. 2019, 34, 135–144.
- Ferreira, J.C.; Choufani, S.; Grafodatskaya, D.; Butcher, D.T.; Zhao, C.; Chitayat, D.; Shuman, C.; Kingdom, J.; Keating, S.; Weksberg, R. WNT2 promoter methylation in human placenta is associated with low birthweight percentile in the neonate. Epigenetics 2011, 6, 440–449.
- Scillitani, A.; Jang, C.; Wong, B.Y.; Hendy, G.N.; Cole, D.E. A functional polymorphism in the PTHR1 promoter region is associated with adult height and BMD measured at the femoral neck in a large cohort of young caucasian women. Hum. Genet. 2006, 119, 416–421.
- Vilariño-Güell, C.; Miles, L.J.; Duncan, E.L.; Ralston, S.H.; Compston, J.E.; Cooper, C.; Langdahl, B.L.; MacLelland, A.; Pols, H.A.; Reid, D.M.; et al. PTHR1 polymorphisms influence BMD variation through effects on the growing skeleton. Calcif. Tissue Int. 2007, 81, 270–278.
- Gupta, A.; Välimäki, V.-V.; Välimäki, M.J.; Löyttyniemi, E.; Richard, M.; Bukka, P.L.; Goltzman, D.; Karaplis, A.C. Variable number of tandem repeats polymorphism in parathyroid hormone-related protein as predictor of peak bone mass in young healthy Finnish males. Eur. J. Endocrinol. 2008, 158, 755–764.
- Funke, S.; Morava, E.; Czakó, M.; Vida, G.; Ertl, T.; Kosztolányi, G. Influence of genetic polymorphisms on bone disease of preterm infants. Pediatr. Res. 2006, 60, 607–612.
- Sundar, I.K.; Rahman, I. Vitamin d and susceptibility of chronic lung diseases: Role of epigenetics. Front. Pharmacol. 2011, 2, 50.
- Ralston, S.H. Genetics of osteoporosis. Ann. N. Y. Acad. Sci. 2010, 1192, 181–189.
- Baek, W.Y.; Kim, J.E. Transcriptional regulation of bone formation. Front. Biosci. 2011, 3, 126–135.
- іMatsubara, T.; Kida, K.; Yamaguchi, A.; Hata, K.; Ichida, F.; Meguro, H.; Aburatani, H.; Nishimura, R.; Yoneda, T. BMP2 regulates Osterix through Msx2 and Runx2 during osteoblast differentiation. J. Biol. Chem. 2008, 283, 29119–29125.
- Arnold, A.; Dennison, E.; Kovacs, C.S.; Mannstadt, M.; Rizzoli, R.; Brandi, M.L.; Clarke, B.; Thakker, R.V. Hormonal regulation of biomineralization. Nat. Rev. Endocrinol. 2021, 17, 261–275.
- Couce, M.L.; Saenz de Pipaon, M. Bone Mineralization and Calcium Phosphorus Metabolism. Nutrients 2021, 13, 3692.
- Vannucci, L.; Fossi, C.; Quattrini, S.; Guasti, L.; Pampaloni, B.; Gronchi, G.; Giusti, F.; Romagnoli, C.; Cianferotti, L.; Marcucci, G.; et al. Calcium Intake in Bone Health: A Focus on Calcium-Rich Mineral Waters. Nutrients 2018, 10, 1930.
- Boivin, G.; Meunier, P.J. The degree of mineralization of bone tissue measured by computerized quantitative contact microradiography. Calcif. Tissue Int. 2002, 70, 503–511.
- Michigami, T.; Ozono, K. Roles of Phosphate in Skeleton. Front. Endocrinol. 2019, 10, 180.
- de Bruyn, J.R.; Goiko, M.; Mozaffari, M.; Bator, D.; Dauphinee, R.L.; Liao, Y.; Flemming, R.L.; Bramble, M.S.; Hunter, G.K.; Goldberg, H.A. Dynamic light scattering study of inhibition of nucleation and growth of hydroxyapatite crystals by osteopontin. PLoS ONE 2013, 8, e56764.
- Kato, K.; Nishimasu, H.; Okudaira, S.; Mihara, E.; Ishitani, R.; Takagi, J.; Aoki, J.; Nureki, O. Crystal structure of Enpp1, an extracellular glycoprotein involved in bone mineralization and insulin signaling. Proc. Natl. Acad. Sci. USA 2012, 109, 16876–16881.
- Gurley, K.A.; Reimer, R.J.; Kingsley, D.M. Biochemical and genetic analysis of ANK in arthritis and bone disease. Am. J. Hum. Genet. 2006, 79, 1017–1029.
- Hasegawa, T. Ultrastructure and biological function of matrix vesicles in bone mineralization. Histochem. Cell Biol. 2018, 149, 289–304.
- Hasegawa, T.; Li, M.; Hara, K.; Sasaki, M.; Tabata, C.; de Freitas, P.H.L.; Hongo, H.; Suzuki, R.; Kobayashi, M.; Inoue, K.; et al. Morphological assessment of bone mineralization in tibial metaphyses of ascorbic acid-deficient ODS rats. Biomed Res. 2011, 32, 259–269.
- Ubaidus, S.; Li, M.; Sultana, S.; de Freitas, P.H.L.; Oda, K.; Maeda, T.; Takagi, R.; Amizuka, N. FGF23 is mainly synthesized by osteocytes in the regularly distributed osteocytic lacunar canalicular system established after physiological bone remodeling. J. Electron. Microsc. 2009, 58, 381–392.
- Hasegawa, T.; Hongo, H.; Yamamoto, T.; Abe, M.; Yoshino, H.; Haraguchi-Kitakamae, M.; Ishizu, H.; Shimizu, T.; Iwasaki, N.; Amizuka, N. Matrix Vesicle-Mediated Mineralization and Osteocytic Regulation of Bone Mineralization. Int. J. Mol. Sci. 2022, 23, 9941.
- Murshed, M. Mechanism of Bone Mineralization. Cold Spring Harb. Perspect. Med. 2018, 8, a031229.
- Chinoy, A.; Mughal, M.Z.; Padidela, R. Metabolic bone disease of prematurity: Causes, recognition, prevention, treatment and long-term consequences. Arch. Dis. Child. Fetal Neonatal Ed. 2019, 104, F560–F566.
- Nehra, D.; Carlson, S.J.; Fallon, E.M.; Kalish, B.; Potemkin, A.K.; Gura, K.M.; Simpser, E.; Compher, C.; Puder, M.A.S.P.E.N. clinical guidelines: Nutrition support of neonatal patients at risk for metabolic bone disease. J. Parenter. Enteral Nutr. 2013, 37, 570–598.
- Lothe, A.; Sinn, J.; Stone, M. Metabolic bone disease of prematurity and secondary hyperparathyroidism. J. Paediatr. Child Health 2011, 47, 550–553.
- Ziegler, E.E.; O’Donnell, A.M.; Nelson, S.E.; Fomon, S.J. Body composition of the reference fetus. Growth 1976, 40, 329–341.
- Levi, M.; Gratton, E.; Forster, I.C.; Hernando, N.; Wagner, C.A.; Biber, J.; Sorribas, V.; Murer, H. Mechanisms of phosphate transport. Nat. Rev. Nephrol. 2019, 15, 482–500.
- Christov, M.; Jüppner, H. Phosphate homeostasis disorders. Best Pract. Res. Clin. Endocrinol. Metab. 2018, 32, 685–706.
- Sapir-Koren, R.; Livshits, G. Bone mineralization is regulated by signaling cross talk between molecular factors of local and systemic origin: The role of fibroblast growth factor 23. Biofactors 2014, 40, 555–568.
- Terkeltaub, R.A. Inorganic pyrophosphate generation and disposition in pathophysiology. Am. J. Physiol. Cell Physiol. 2001, 281, C1–C11.
- Mornet, E. Hypophosphatasia: The mutations in the tissue-nonspecific alkaline phosphatase gene. Hum. Mutat. 2000, 15, 309–315.
- Goltzman, D. Functions of vitamin D in bone. Histochem. Cell Biol. 2018, 149, 305–312.
- van Driel, M.; van Leeuwen, J.P. Vitamin D endocrinology of bone mineralization. Mol. Cell. Endocrinol. 2017, 453, 46–51.
- Balasuriya, C.N.D.; LaRose, T.L.; Mosti, M.P.; Evensen, K.A.I.; Jacobsen, G.W.; Thorsby, P.M.; Stunes, A.K.; Syversen, U. Maternal serum retinol, 25(OH)D and 1,25(OH)2D concentrations during pregnancy and peak bone mass and trabecular bone score in adult offspring at 26-year follow-up. PLoS ONE 2019, 14, e0222712.
- Velkavrh, M.; Paro-Panjan, D.; Benedik, E.; Mis, N.F.; Godnov, U.; Salamon, A.S. The Influence of Maternal Levels of Vitamin D and Adiponectin on Anthropometrical Measures and Bone Health in Offspring. Prilozi 2019, 40, 91–98.
- Boghossian, N.S.; Koo, W.; Liu, A.; Mumford, S.L.; Tsai, M.Y.; Yeung, E.H. Longitudinal measures of maternal vitamin D and neonatal body composition. Eur. J. Clin. Nutr. 2019, 73, 424–431.
- Zhu, K.; Whitehouse, A.J.O.; Hart, P.H.; Kusel, M.; Mountain, J.; Lye, S.; Pennell, C.; Walsh, J.P. Maternal vitamin D status during pregnancy and bone mass in offspring at 20 years of age: A prospective cohort study. J. Bone Miner. Res. 2014, 29, 1088–1095.
- Hyde, N.K.; Brennan-Olsen, S.L.; Mohebbi, M.; Wark, J.D.; Hosking, S.M.; Pasco, J.A. Maternal vitamin D in pregnancy and offspring bone measures in childhood: The Vitamin D in Pregnancy study. Bone 2019, 124, 126–131.
- Pettifor, J.M.; Thandrayen, K. Metabolic Bone Disease of Prematurity. Indian Pediatr. 2022, 59, 833–834.
- Abrams, S.A. Vitamin D and bone minerals in neonates. Early Hum. Dev. 2021, 162, 105461.
- Wagner, C.L.; McNeil, R.B.; Johnson, D.D.; Hulsey, T.C.; Ebeling, M.; Robinson, C.; Hamilton, S.A.; Hollis, B.W. Health characteristics and outcomes of two randomized vitamin D supplementation trials during pregnancy: A combined analysis. J. Steroid Biochem. Mol. Biol. 2013, 136, 313–320.
- von Websky, K.; Hasan, A.A.; Reichetzeder, C.; Tsuprykov, O.; Hocher, B. Impact of vitamin D on pregnancy-related disorders and on offspring outcome. J. Steroid Biochem. Mol. Biol. 2018, 180, 51–64.
- Setia, S.; Sridhar, M.G. Changes in GH/IGF-1 axis in intrauterine growth retardation: Consequences of fetal programming? Horm. Metab. Res. 2009, 41, 791–798.
- Jones, I.E.; Williams, S.M.; Goulding, A. Associations of birth weight and length, childhood size, and smoking with bone fractures during growth: Evidence from a birth cohort study. Am. J. Epidemiol. 2004, 159, 343–350.
- van Montfoort, N.; Finken, M.J.J.; le Cessie, S.; Dekker, F.W.; Wit, J.M. Could cortisol explain the association between birth weight and cardiovascular disease in later life? A meta-analysis. Eur. J. Endocrinol. 2005, 153, 811–817.
- Lillycrop, K.A.; Slater-Jefferies, J.L.; Hanson, M.A.; Godfrey, K.M.; Jackson, A.A.; Burdge, G.C. Induction of altered epigenetic regulation of the hepatic glucocorticoid receptor in the offspring of rats fed a protein-restricted diet during pregnancy suggests that reduced DNA methyltransferase-1 expression is involved in impaired DNA methylation and changes in histone modifications. Br. J. Nutr. 2007, 97, 1064–1073.
- Heppe, D.H.; Medina-Gomez, C.; De Jongste, J.C.; Raat, H.; Ap Steegers, E.; Hofman, A.; Rivadeneira, F.; Jaddoe, V.W. Fetal and childhood growth patterns associated with bone mass in school-age children: The Generation R Study. J. Bone Miner. Res. 2014, 29, 2584–2593.
- Dennison, E.M.; Syddall, H.E.; Fall, C.H.; Javaid, M.K.; Arden, N.K.; Phillips, D.I.W.; Cooper, C. Plasma leptin concentration and change in bone density among elderly men and women: The Hertfordshire Cohort Study. Calcif. Tissue Int. 2004, 74, 401–406.
- Perrone, S.; Santacroce, A.; Picardi, A.; Buonocore, G. Fetal programming and early identification of newborns at high risk of free radical-mediated diseases. World J. Clin. Pediatr. 2016, 5, 172–181.
- Longini, M.; Perrone, S.; Kenanidis, A.; Vezzosi, P.; Marzocchi, B.; Petraglia, F.; Centini, G.; Buonocore, G. Isoprostanes in amniotic fluid: A predictive marker for fetal growth restriction in pregnancy. Free. Radic. Biol. Med. 2005, 38, 1537–1541.
- Yu, Z.; Han, Y.; Shen, R.; Huang, K.; Xu, Y.-Y.; Wang, Q.-N.; Zhou, S.-S.; Xu, D.-X.; Tao, F.-B. Gestational di-(2-ethylhexyl) phthalate exposure causes fetal intrauterine growth restriction through disturbing placental thyroid hormone receptor signaling. Toxicol. Lett. 2018, 294, 1–10.
- Xu, X.; Yekeen, T.A.; Xiao, Q.; Wang, Y.; Lu, F.; Huo, X. Placental IGF-1 and IGFBP-3 expression correlate with umbilical cord blood PAH and PBDE levels from prenatal exposure to electronic waste. Environ. Pollut. 2013, 182, 63–69.
- Bommarito, P.A.; Martin, E.; Fry, R.C. Effects of prenatal exposure to endocrine disruptors and toxic metals on the fetal epigenome. Epigenomics 2017, 9, 333–350.
- Kelley, A.S.; Banker, M.; Goodrich, J.M.; Dolinoy, D.C.; Burant, C.; Domino, S.E.; Smith, Y.R.; Song, P.X.K.; Padmanabhan, V. Early pregnancy exposure to endocrine disrupting chemical mixtures are associated with inflammatory changes in maternal and neonatal circulation. Sci. Rep. 2019, 9, 5422.
- Street, M.E.; Bernasconi, S. Endocrine-Disrupting Chemicals in Human Fetal Growth. Int. J. Mol. Sci. 2020, 21, 1430.
- Dirkes, R.K.; Welly, R.J.; Mao, J.; Kinkade, J.; Vieira-Potter, V.J.; Rosenfeld, C.S.; Bruzina, P.S. Gestational and lactational exposure to BPA or BPS has minimal effects on skeletal outcomes in adult female mice. Bone Rep. 2021, 15, 101136.
- Papaioannou, G.; Mirzamohammadi, F.; Kobayashi, T. MicroRNAs involved in bone formation. Cell. Mol. Life Sci. 2014, 71, 4747–4761.
- Papaioannou, G. miRNAs in Bone Development. Curr. Genom. 2015, 16, 427–434.
- Berger, K.; Hyland, C.; Ames, J.L.; Mora, A.M.; Huen, K.; Eskenazi, B.; Holland, N.; Harley, K.G. Prenatal Exposure to Mixtures of Phthalates, Parabens, and Other Phenols and Obesity in Five-Year-Olds in the CHAMACOS Cohort. Int. J. Environ. Res. Public Health 2021, 18, 1796.
- Lui, J.C.; Garrison, P.; Nguyen, Q.; Ad, M.; Keembiyehetty, C.; Chen, W.; Jee, Y.H.; Landman, E.; Nilsson, O.; Barnes, K.M.; et al. EZH1 and EZH2 promote skeletal growth by repressing inhibitors of chondrocyte proliferation and hypertrophy. Nat. Commun. 2016, 7, 13685.
- Holroyd, C.; Harvey, N.; Dennison, E.; Cooper, C. Epigenetic influences in the developmental origins of osteoporosis. Osteoporos. Int. 2012, 23, 401–410.
- Jee, Y.H.; Wang, J.; Yue, S.; Jennings, M.; Clokie, S.; Nilsson, O.; Lui, J.C.; Baron, J. mir-374-5p, mir-379-5p, and mir-503-5p Regulate Proliferation and Hypertrophic Differentiation of Growth Plate Chondrocytes in Male Rats. Endocrinology 2018, 159, 1469–1478.
- Zhang, L.; Tang, Y.; Zhu, X.; Tu, T.; Sui, L.; Han, Q.; Yu, L.; Meng, S.; Zheng, L.; Valverde, P.; et al. Overexpression of MiR-335-5p Promotes Bone Formation and Regeneration in Mice. J. Bone Miner. Res. 2017, 32, 2466–2475.
- Lin, H.; Huang, Z.-P.; Liu, J.; Qiu, Y.; Tao, Y.-P.; Wang, M.-C.; Yao, H.; Hou, K.-Z.; Gu, F.-M.; Xu, X.-F. MiR-494-3p promotes PI3K/AKT pathway hyperactivation and human hepatocellular carcinoma progression by targeting PTEN. Sci. Rep. 2018, 8, 10461.
- Ulici, V.; Hoenselaar, K.D.; Gillespie, J.R.; Beier, F. The PI3K pathway regulates endochondral bone growth through control of hypertrophic chondrocyte differentiation. BMC Dev. Biol. 2008, 8, 40.
- Mukherjee, A.; Rotwein, P. Akt promotes BMP2-mediated osteoblast differentiation and bone development. J. Cell Sci. 2009, 122 Pt 5, 716–726.
- Wang, J.; Zhao, Q.; Chen, B.; Sun, J.; Huang, J.; Meng, J.; Li, S.; Yan, W.; Ren, C.; Hao, L. Risk factors for metabolic bone disease of prematurity: A meta-analysis. PLoS ONE 2022, 17, e0269180.
- Olmos-Ortiz, A.; Avila, E.; Durand-Carbajal, M.; Díaz, L. Regulation of calcitriol biosynthesis and activity: Focus on gestational vitamin D deficiency and adverse pregnancy outcomes. Nutrients 2015, 7, 443–480.
- Holland, P.C.; Wilkinson, A.R.; Diez, J.; Lindsell, D.R. Prenatal deficiency of phosphate, phosphate supplementation, and rickets in very-low-birthweight infants. Lancet 1990, 335, 697–701.
- Eliakim, A.; Litmanovitz, I.; Nemet, D. The Role of Exercise in Prevention and Treatment of Osteopenia of Prematurity: An Update. Pediatr. Exerc. Sci. 2017, 29, 450–455.
- Done, S.L. Fetal and neonatal bone health: Update on bone growth and manifestations in health and disease. Pediatr. Radiol. 2012, 42 (Suppl. S1), S158–S176.
- Miller, M.E. The bone disease of preterm birth: A biomechanical perspective. Pediatr. Res. 2003, 53, 10–15.
- Mimouni, F.B.; Mandel, D.; Lubetzky, R.; Senterre, T. Calcium, phosphorus, magnesium and vitamin D requirements of the preterm infant. World Rev. Nutr. Diet. 2014, 110, 140–151.
- Faienza, M.F.; D’Amato, E.; Natale, M.P.; Grano, M.; Chiarito, M.; Brunetti, G.; D’Amato, G. Metabolic Bone Disease of Prematurity: Diagnosis and Management. Front. Pediatr. 2019, 7, 143.
- Lee, P.A.; Chernausek, S.D.; Hokken-Koelega, A.C.S.; Czernichow, P.; International Small for Gestational Age Advisory Board. International Small for Gestational Age Advisory Board consensus development conference statement: Management of short children born small for gestational age, April 24–October 1, 2001. Pediatrics 2003, 111 Pt 1, 1253–1261.
- Gale, C.R.; Martyn, C.N.; Kellingray, S.; Eastell, R.; Cooper, C. Intrauterine programming of adult body composition. J. Clin. Endocrinol. Metab. 2001, 86, 267–272.
- Yang, Y.; Wu, F.; Dwyer, T.; Antony, B.; Winzenberg, T.; Jones, G. Associations of Breastfeeding, Maternal Smoking, and Birth Weight With Bone Density and Microarchitecture in Young Adulthood: A 25-Year Birth-Cohort Study. J. Bone Miner. Res. 2020, 35, 1652–1659.
- Jones, G.; Hynes, K.L.; Dwyer, T. The association between breastfeeding, maternal smoking in utero, and birth weight with bone mass and fractures in adolescents: A 16-year longitudinal study. Osteoporos. Int. 2013, 24, 1605–1611.
- Lee, S.M.; Namgung, R.; Park, M.S.; Eun, H.S.; Park, K.I.; Lee, C. High incidence of rickets in extremely low birth weight infants with severe parenteral nutrition-associated cholestasis and bronchopulmonary dysplasia. J. Korean Med. Sci. 2012, 27, 1552–1555.
- Ukarapong, S.; Venkatarayappa, S.K.B.; Navarrete, C.; Berkovitz, G. Risk factors of metabolic bone disease of prematurity. Early Hum. Dev. 2017, 112, 29–34.
- Brunetti, G.; Faienza, M.F.; Piacente, L.; Ventura, A.; Oranger, A.; Carbone, C.; Di Benedetto, A.; Colaianni, G.; Gigante, M.; Mori, G.; et al. High dickkopf-1 levels in sera and leukocytes from children with 21-hydroxylase deficiency on chronic glucocorticoid treatment. Am. J. Physiol. Endocrinol. Metab. 2013, 304, E546–E554.
- Stoll, B.J.; Hansen, N.; Fanaroff, A.A.; Wright, L.L.; Carlo, W.A.; Ehrenkranz, R.A.; Lemons, J.A.; Donovan, E.F.; Stark, A.R.; Tyson, J.E.; et al. Late-onset sepsis in very low birth weight neonates: The experience of the NICHD Neonatal Research Network. Pediatrics 2002, 110 Pt 1, 285–291.
- White, A.M.; Liu, P.; Yee, K.; Waber, B.; Monk, H.M.; Zhang, H.; Jensen, E.A. Determinants of Severe Metabolic Bone Disease in Very Low-Birth-Weight Infants with Severe Bronchopulmonary Dysplasia Admitted to a Tertiary Referral Center. Am. J. Perinatol. 2016, 33, 107–113.
- Horowitz, M.C.; Fretz, J.A.; Lorenzo, J.A. How B cells influence bone biology in health and disease. Bone 2010, 47, 472–479.
- Dusad, A.; Thiele, G.M.; Klassen, L.W.; Gleason, A.M.; Bauer, C.; Mikuls, T.R.; Duryee, M.J.; West, W.W.; Romberger, D.J.; Poole, J.A. Organic dust, lipopolysaccharide, and peptidoglycan inhalant exposures result in bone loss/disease. Am. J. Respir. Cell Mol. Biol. 2013, 49, 829–836.
- Burris, H.H.; Van Marter, L.J.; McElrath, T.F.; Tabatabai, P.; Litonjua, A.A.; Weiss, S.T.; Christou, H. Vitamin D status among preterm and full-term infants at birth. Pediatr. Res. 2014, 75, 75–80.
- Ruiz-Gaspà, S.; Guañabens, N.; Enjuanes, A.; Peris, P.; Martinez-Ferrer, A.; de Osaba, M.J.M.; Gonzalez, B.; Alvarez, L.; Monegal, A.; Combalia, A.; et al. Lithocholic acid downregulates vitamin D effects in human osteoblasts. Eur. J. Clin. Investig. 2010, 40, 25–34.
- Ruiz-Gaspà, S.; Martinez-Ferrer, A.; Guañabens, N.; Dubreuil, M.; Peris, P.; Enjuanes, A.; de Osaba, M.J.M.; Alvarez, L.; Monegal, A.; Combalia, A.; et al. Effects of bilirubin and sera from jaundiced patients on osteoblasts: Contribution to the development of osteoporosis in liver diseases. Hepatology 2011, 54, 2104–2113.
- Viswanathan, S.; Khasawneh, W.; McNelis, K.; Dykstra, C.; Amstadt, R.; Super, D.M.; Groh-Wargo, S.; Kumar, D. Metabolic bone disease: A continued challenge in extremely low birth weight infants. J. Parenter. Enteral. Nutr. 2014, 38, 982–990.
- Abrams, S.A.; Committee on Nutrition; Bhatia, J.J.S.; Corkins, M.R.; De Ferranti, S.D.; Golden, N.H.; Silverstein, J. Calcium and vitamin d requirements of enterally fed preterm infants. Pediatrics 2013, 131, e1676–e1683.
- Pelegano, J.F.; Rowe, J.C.; Carey, D.E.; LaBarre, D.J.; Edgren, K.W.; Lazar, A.M.; Horak, E. Effect of calcium/phosphorus ratio on mineral retention in parenterally fed premature infants. J. Pediatr. Gastroenterol. Nutr. 1991, 12, 351–355.
- Pereira-Da-Silva, L.; Costa, A.; Pereira, L.; Filipe, A.; Virella, D.; Leal, E.; Moreira, A.; Rosa, M.; Mendes, L.; Serelha, M. Early high calcium and phosphorus intake by parenteral nutrition prevents short-term bone strength decline in preterm infants. J. Pediatr. Gastroenterol. Nutr. 2011, 52, 203–209.
- Lima-Rogel, V.; Romano-Moreno, S.; de Jesús López-López, E.; de Jesús Escalante-Padrón, F.; Hurtado-Torres, G.F. Aluminum Contamination in Parenteral Nutrition Admixtures for Low-Birth-Weight Preterm Infants in Mexico. J. Parenter. Enteral. Nutr. 2016, 40, 1014–1020.
- Hall, A.R.; Arnold, C.J.; Miller, G.G.; Zello, G.A. Infant Parenteral Nutrition Remains a Significant Source for Aluminum Toxicity. J. Parenter. Enteral. Nutr. 2017, 41, 1228–1233.
- Kelly, A.; Kovatch, K.J.; Garber, S.J. Metabolic bone disease screening practices among U.S. neonatologists. Clin. Pediatr. 2014, 53, 1077–1083.
- Kolisambeevi, A.A.; Pournami, F.; Prithvi, A.K.; Nandakumar, A.; Prabhakar, J.; Jain, N. Incidence of Metabolic Bone Disease After Implementation of Bone Protective Nutritional Strategies: A Prospective Cohort Study. Indian Pediatr. 2022, 59, 841–846.
- Catache, M.; Leone, C.R. Role of plasma and urinary calcium and phosphorus measurements in early detection of phosphorus deficiency in very low birthweight infants. Acta Paediatr. 2003, 92, 76–80.
- Hung, Y.-L.; Chen, P.-C.; Jeng, S.-F.; Hsieh, C.-J.; Peng, S.S.-F.; Yen, R.-F.; Chou, H.-C.; Chen, C.-Y.; Tsao, P.-N.; Hsieh, W.-S. Serial measurements of serum alkaline phosphatase for early prediction of osteopaenia in preterm infants. J. Paediatr. Child Health 2011, 47, 134–139.
- Dokos, C.; Tsakalidis, C.; Tragiannidis, A.; Rallis, D. Inside the “fragile” infant: Pathophysiology, molecular background, risk factors and investigation of neonatal osteopenia. Clin. Cases Miner. Bone Metab. 2013, 10, 86–90.
- Chan, G.M.; Armstrong, C.; Moyer-Mileur, L.; Hoff, C. Growth and bone mineralization in children born prematurely. J. Perinatol. 2008, 28, 619–623.
- Mitchell, S.M.; Rogers, S.P.; Hicks, P.D.; Hawthorne, K.M.; Parker, B.R.; Abrams, S.A. High frequencies of elevated alkaline phosphatase activity and rickets exist in extremely low birth weight infants despite current nutritional support. BMC Pediatr. 2009, 9, 47.
- Backström, M.C.; Kouri, T.; Kuusela, A.L.; Sievänen, H.; Koivisto, A.M.; Ikonen, R.S.; Mäki, M. Bone isoenzyme of serum alkaline phosphatase and serum inorganic phosphate in metabolic bone disease of prematurity. Acta Paediatr. 2000, 89, 867–873.
- Rehman, M.U.; Narchi, H. Metabolic bone disease in the preterm infant: Current state and future directions. World J. Methodol. 2015, 5, 115–121.
- Chinoy, A.; Mughal, M.Z.; Padidela, R. Metabolic bone disease of prematurity-National survey of current neonatal and paediatric endocrine approaches. Acta Paediatr. 2021, 110, 1855–1862.
- Moreira, A.; February, M.; Geary, C. Parathyroid hormone levels in neonates with suspected osteopenia. J. Paediatr. Child Health 2013, 49, E12–E16.
- Czech-Kowalska, J.; Czekuc-Kryskiewicz, E.; Pludowski, P.; Zaniuk, K.; Jaworski, M.; Łuba, A.; Grzybowska, K.; Piłat, K.; Dobrzanska, A. The Clinical and Biochemical Predictors of Bone Mass in Preterm Infants. PLoS ONE 2016, 11, e0165727.
- Baek, J.H.; Shin, Y.H.; Chung, I.H.; Kim, H.J.; Yoo, E.-G.; Yoon, J.W.; Jee, H.M.; Chang, Y.E.; Han, M.Y. The link between serum vitamin D level, sensitization to food allergens, and the severity of atopic dermatitis in infancy. J. Pediatr. 2014, 165, 849–854.e1.
- Maguire, J.L.; Birken, C.; Thorpe, K.E.; Sochett, E.B.; Parkin, P.C. Parathyroid hormone as a functional indicator of vitamin D sufficiency in children. JAMA Pediatr. 2014, 168, 383–385.
- Pittard, W.B., 3rd; Geddes, K.M.; Hulsey, T.C.; Hollis, B.W. Osteocalcin, skeletal alkaline phosphatase, and bone mineral content in very low birth weight infants: A longitudinal assessment. Pediatr. Res. 1992, 31, 181–185.
- Pohlandt, F.; Mihatsch, W.A. Reference values for urinary calcium and phosphorus to prevent osteopenia of prematurity. Pediatr. Nephrol. 2004, 19, 1192–1193.
- Land, C.; Schoenau, E. Fetal and postnatal bone development: Reviewing the role of mechanical stimuli and nutrition. Best Pract. Res. Clin. Endocrinol. Metab. 2008, 22, 107–118.
- Koo, W.W.; Gupta, J.M.; Nayanar, V.V.; Wilkinson, M.; Posen, S. Skeletal changes in preterm infants. Arch. Dis. Child. 1982, 57, 447–452.
- Koo, W.W.; Sherman, R.; Succop, P.; Krug-Wispe, S.; Tsang, R.C.; Steichen, J.J.; Crawford, A.H.; Oestreich, A.E. Fractures and rickets in very low birth weight infants: Conservative management and outcome. J. Pediatr. Orthop. 1989, 9, 326–330.
- Rigo, J.; Nyamugabo, K.; Picaud, J.C.; Gerard, P.; Pieltain, C.; De Curtis, M. Reference values of body composition obtained by dual energy X-ray absorptiometry in preterm and term neonates. J. Pediatr. Gastroenterol. Nutr. 1998, 27, 184–190.
- Figueras-Aloy, J.; Álvarez-Domínguez, E.; Pérez-Fernández, J.M.; Moretones-Suñol, G.; Vidal-Sicart, S.; Botet-Mussons, F. Metabolic bone disease and bone mineral density in very preterm infants. J. Pediatr. 2014, 164, 499–504.
- Diez-Perez, A.; Brandi, M.L.; Al-Daghri, N.; Branco, J.C.; Bruyère, O.; Cavalli, L.; Cooper, C.; Cortet, B.; Dawson-Hughes, B.; Dimai, H.P.; et al. Radiofrequency echographic multi-spectrometry for the in-vivo assessment of bone strength: State of the art-outcomes of an expert consensus meeting organized by the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Aging Clin. Exp. Res. 2019, 31, 1375–1389.
- Fogelman, I.; Blake, G.M. Different approaches to bone densitometry. J. Nucl. Med. 2000, 41, 2015–2025.
- Damilakis, J.; Adams, J.E.; Guglielmi, G.; Link, T.M. Radiation exposure in X-ray-based imaging techniques used in osteoporosis. Eur. Radiol. 2010, 20, 2707–2714.
- De Terlizzi, F.; Battista, S.; Cavani, F.; Canè, V.; Cadossi, R. Influence of bone tissue density and elasticity on ultrasound propagation: An in vitro study. J. Bone Miner. Res. 2000, 15, 2458–2466.
- Gonnelli, S.; Montagnani, A.; Gennari, L.; Martini, S.; Merlotti, D.; Cepollaro, C.; Perrone, S.; Buonocore, G.; Nuti, R. Feasibility of quantitative ultrasound measurements on the humerus of newborn infants for the assessment of the skeletal status. Osteoporos. Int. 2004, 15, 541–546.
- Ritschl, E.; Wehmeijer, K.; De Terlizzi, F.; Wipfler, E.; Cadossi, R.; Douma, D.; Urlesberger, B.; Müller, W. Assessment of skeletal development in preterm and term infants by quantitative ultrasound. Pediatr. Res. 2005, 58, 341–346.
- Altuncu, E.; Akman, I.; Yurdakul, Z.; Özdoğan, T.; Solakoğlu, M.; Selim, N.; Bilgen, H.; Özek, E.; Bereket, A. Quantitative ultrasound and biochemical parameters for the assessment of osteopenia in preterm infants. J. Matern. Fetal Neonatal Med. 2007, 20, 401–405.
- Rack, B.; Lochmüller, E.-M.; Janni, W.; Lipowsky, G.; Engelsberger, I.; Friese, K.; Küster, H. Ultrasound for the assessment of bone quality in preterm and term infants. J. Perinatol. 2012, 32, 218–226.
- Institute of Medicine (US); Committee to Review Dietary Reference Intakes for Vitamin D and Calcium. Dietary Reference Intakes for Calcium and Vitamin D; Ross, A.C., Taylor, C.L., Yaktine, A.L., Del Valle, H.B., Eds.; National Academies Press: Washington, DC, USA, 2011.
- Agostoni, C.; Buonocore, G.; Carnielli, V.P.; De Curtis, M.; Darmaun, D.; Decsi, T.; Domellöf, M.; Embleton, N.D.; Fusch, C.; Genzel-Boroviczeny, O.; et al. Enteral nutrient supply for preterm infants: Commentary from the European Society of Paediatric Gastroenterology, Hepatology and Nutrition Committee on Nutrition. J. Pediatr. Gastroenterol. Nutr. 2010, 50, 85–91.
- Misra, M.; Pacaud, D.; Petryk, A.; Collett-Solberg, P.F.; Kappy, M.; on behalf of the Drug and Therapeutics Committee of the Lawson Wilkins Pediatric Endocrine Society. Vitamin D deficiency in children and its management: Review of current knowledge and recommendations. Pediatrics 2008, 122, 398–417.
- Priemel, M.; von Domarus, C.; Klatte, T.O.; Kessler, S.; Schlie, J.; Meier, S.; Proksch, N.; Pastor, F.; Netter, C.; Streichert, T.; et al. Bone mineralization defects and vitamin D deficiency: Histomorphometric analysis of iliac crest bone biopsies and circulating 25-hydroxyvitamin D in 675 patients. J. Bone Miner. Res. 2010, 25, 305–312.
- Anderson-Berry, A.; Thoene, M.; Wagner, J.; Lyden, E.; Jones, G.; Kaufmann, M.; Van Ormer, M.; Hanson, C. Randomized trial of two doses of vitamin D3 in preterm infants <32 weeks: Dose impact on achieving desired serum 25(OH)D3 in a NICU population. PLoS ONE 2017, 12, e0185950.
- Bonsante, F.; Iacobelli, S.; Latorre, G.; Rigo, J.; De Felice, C.; Robillard, P.Y.; Gouyon, J.B. Initial amino acid intake influences phosphorus and calcium homeostasis in preterm infants—it is time to change the composition of the early parenteral nutrition. PLoS ONE 2013, 8, e72880.
- Alizadeh Taheri, P.; Sajjadian, N.; Beyrami, B.; Shariat, M. Prophylactic effect of low dose vitamin D in osteopenia of prematurity: A clinical trial study. Acta Med. Iran. 2014, 52, 671–674.
- Angelika, D.; Ugrasena, I.D.G.; Etika, R.; Rahardjo, P.; Bos, A.F.; Sauer, P.J.J. The incidence of osteopenia of prematurity in preterm infants without phosphate supplementation: A prospective, observational study. Medicine 2021, 100, e25758.
- Adamkin, D.H.; Radmacher, P.G. Current trends and future challenges in neonatal parenteral nutrition. J. Neonatal Perinatal Med. 2014, 7, 157–164.
- Abrams, S.A. In utero physiology: Role in nutrient delivery and fetal development for calcium, phosphorus, and vitamin D. Am. J. Clin. Nutr. 2007, 85, 604S–607S.
- Demarini, S. Calcium and phosphorus nutrition in preterm infants. Acta Paediatr. Suppl. 2005, 94, 87–92.
- Nikander, R.; Sievänen, H.; Heinonen, A.; Daly, R.M.; Uusi-Rasi, K.; Kannus, P. Targeted exercise against osteoporosis: A systematic review and meta-analysis for optimising bone strength throughout life. BMC Med. 2010, 8, 47.
- Torró-Ferrero, G.; Fernández-Rego, F.J.; Gómez-Conesa, A. Physical Therapy to Prevent Osteopenia in Preterm Infants: A Systematic Review. Children 2021, 8, 664.
- Torró-Ferrero, G.; Fernández-Rego, F.J.; Jiménez-Liria, M.R.; Agüera-Arenas, J.J.; Piñero-Peñalver, J.; Sánchez-Joya, M.d.M.; Fernández-Berenguer, M.J.; Rodríguez-Pérez, M.; Gomez-Conesa, A. Effect of physical therapy on bone remodelling in preterm infants: A multicenter randomized controlled clinical trial. BMC Pediatr. 2022, 22, 362.
- Schulzke, S.M.; Kaempfen, S.; Trachsel, D.; Patole, S.K. Physical activity programs for promoting bone mineralization and growth in preterm infants. Cochrane Database Syst. Rev. 2014, 4, CD005387.
- Sanz-Esteban, I.; Calvo-Lobo, C.; Ríos-Lago, M.; Álvarez-Linera, J.; Muñoz-García, D.; Rodríguez-Sanz, D. Mapping the human brain during a specific Vojta’s tactile input: The ipsilateral putamen’s role. Medicine 2018, 97, e0253.
- Arslanoglu, S.; Boquien, C.-Y.; King, C.; Lamireau, D.; Tonetto, P.; Barnett, D.; Bertino, E.; Gaya, A.; Gebauer, C.; Grovslien, A.; et al. Fortification of Human Milk for Preterm Infants: Update and Recommendations of the European Milk Bank Association (EMBA) Working Group on Human Milk Fortification. Front. Pediatr. 2019, 7, 76.
- Betto, M.; Gaio, P.; Ferrini, I.; De Terlizzi, F.; Zambolin, M.; Scattolin, S.; Pasinato, A.; Verlato, G. Assessment of bone health in preterm infants through quantitative ultrasound and biochemical markers. J. Matern. Fetal Neonatal Med. 2014, 27, 1343–1347.
- Chacham, S.; Pasi, R.; Chegondi, M.; Ahmad, N.; Mohanty, S.B. Metabolic Bone Disease in Premature Neonates: An Unmet Challenge. J. Clin. Res. Pediatr. Endocrinol. 2020, 12, 332–339.
- Quintal, V.S.; Diniz, E.M.; Caparbo Vde, F.; Pereira, R.M. Bone densitometry by dual-energy X-ray absorptiometry (DXA) in preterm newborns compared with full-term peers in the first six months of life. J. Pediatr. 2014, 90, 556–562.
- Brunton, J.A.; Bayley, H.S.; Atkinson, S.A. Validation and application of dual-energy x-ray absorptiometry to measure bone mass and body composition in small infants. Am. J. Clin. Nutr. 1993, 58, 839–845.
- Manhard, M.K.; Nyman, J.S.; Does, M.D. Advances in imaging approaches to fracture risk evaluation. Transl. Res. 2017, 181, 1–14.
- Hans, D.; Baim, S. Quantitative Ultrasound (QUS) in the Management of Osteoporosis and Assessment of Fracture Risk. J. Clin. Densitom. 2017, 20, 322–333.
- Degennaro, V.A.; Brandi, M.L.; Cagninelli, G.; Casciaro, S.; Ciardo, D.; Conversano, F.; Di Pasquo, E.; Gonnelli, S.; Lombardi, F.A.; Pisani, P.; et al. First assessment of bone mineral density in healthy pregnant women by means of Radiofrequency Echographic Multi Spectrometry (REMS) technology. Eur. J. Obstet. Gynecol. Reprod. Biol. 2021, 263, 44–49.
- Conversano, F.; Franchini, R.; Greco, A.; Soloperto, G.; Chiriacò, F.; Casciaro, E.; Aventaggiato, M.; Renna, M.D.; Pisani, P.; Di Paola, M.; et al. A novel ultrasound methodology for estimating spine mineral density. Ultrasound Med. Biol. 2015, 41, 281–300.
- Casciaro, S.; Peccarisi, M.; Pisani, P.; Franchini, R.; Greco, A.; De Marco, T.; Grimaldi, A.; Quarta, L.; Quarta, E.; Muratore, M.; et al. An Advanced Quantitative Echosound Methodology for Femoral Neck Densitometry. Ultrasound Med. Biol. 2016, 42, 1337–1356.
- Cortet, B.; Dennison, E.; Diez-Perez, A.; Locquet, M.; Muratore, M.; Nogués, X.; Crespo, D.O.; Quarta, E.; Brandi, M.L. Radiofrequency Echographic Multi Spectrometry (REMS) for the diagnosis of osteoporosis in a European multicenter clinical context. Bone 2021, 143, 115786.
- Di Paola, M.; Gatti, D.; Viapiana, O.; Cianferotti, L.; Cavalli, L.; Caffarelli, C.; Conversano, F.; Quarta, E.; Pisani, P.; Girasole, G.; et al. Radiofrequency echographic multispectrometry compared with dual X-ray absorptiometry for osteoporosis diagnosis on lumbar spine and femoral neck. Osteoporos. Int. 2019, 30, 391–402.
- Adami, G.; Arioli, G.; Bianchi, G.; Brandi, M.L.; Caffarelli, C.; Cianferotti, L.; Gatti, D.; Girasole, G.; Gonnelli, S.; Manfredini, M.; et al. Radiofrequency echographic multi spectrometry for the prediction of incident fragility fractures: A 5-year follow-up study. Bone 2020, 134, 115297.