Ультразвуковий (УЗД) контроль для інвазивних процедур є необхідним інструментом і повинен розглядатися як метод першої лінії для більшості процедур в області живота і таза. Існує безліч умов, щоб гарантувати безпеку пацієнтів і оптимальності довкілля, де виконується процедура, в тому числі: розташування меблів в кабінеті і самого обладнання, допомога сонографіста і медсестри.
Corinne Deurdulian, MD, Nicole French, MD
ОСНОВНІ ПОЛОЖЕННЯ
• Ультразвуковий (УЗД) контроль для інвазивних процедур є необхідним інструментом і повинен розглядатися як метод першої лінії для більшості процедур в області живота і таза.
• Існує безліч умов, щоб гарантувати безпеку пацієнтів і оптимальності довкілля, де виконується процедура, в тому числі: розташування меблів в кабінеті і самого обладнання, допомога сонографіста і медсестри, порівняльний огляд історії хвороби пацієнта та отриманих зображень.
• Суміщення УЗД ще більше збільшує користь УЗД в проведенні інвазивних процедур.
ВСТУП
Черезшкірна біопсія та дренування рідини в черевній порожнині під відеоконтролем зазвичай є радіологічним втручанням. УЗД контроль і комп’ютерна томографія (КТ) використовуються для зображення інвазивної процедури. Переваги УЗД підходу включають: зниження часу процедури, відсутність випромінювання, низьку вартість, портативність, режим реального часу візуалізації розміщення голки і режим реального часу доплерівських зображень для профілактики ушкодження судини або негайної діагностики таких ускладнень, як кровотеча. УЗД контроль також дозволяє швидко, в режимі реального часу, провести аспірацію і дренування, що виключає потребу в КТ і випромінюванні для підтвердження позиції голки або катетера у більшості пацієнтів.
Для прийняття рішення про використання УЗД або КТ наведення, в першу чергу слід розглядати УЗД. Якщо ураження не видно на УЗД або, якщо безпечний шлях проведення дослідження не визначений, то тоді застосовується КТ. Іноді необхідно буде використовувати обидва методи. Наприклад, початковий доступ може бути легше виконаний під контролем УЗД, а підтвердження розташування голки або катетера – на КТ. Проте, одного УЗД більш ніж достатньо для більшості типів абдомінальних втручань.
Нові доповнення в процедурі, такі як використання УЗД контрасту, об’ємна навігація та суміщення розширюють можливості УЗД. УЗД контраст допомагає візуалізувати пошкодження, котрі може бути погано видно при звичайному УЗД, а також визначити осередки залишкової або рецидивної пухлини після абляції. Об’ємна навігація допомагає у виборі траєкторії входу з різних точок на основі розташування цілі. Технологія суміщення дозволяє накладати зображення КТ, магнітно-резонансної томографії (МРТ) і позитронно-емісійної томографії (ПЕТ) / ПЕТ-КТ на УЗД картину для проведення прицільної біопсії і абляції.
ОГЛЯД ІНШИХ ЗОБРАЖЕНЬ
Перед плануванням процедури, дуже важливо оцінити зображення інших методів візуалізації, таких як КТ, МРТ або ПЕТ, щоб допомогти локалізувати або охарактеризувати місце ураження або скупчення рідини. Поперечне сканування може допомогти виявити інші осередки, які більш придатні для біопсії, наприклад надключичні лімфатичні вузли або вузлики в м’яких тканинах. Додаткові ушкодження можуть відсунути на задній план діагноз, що може вплинути на вибір найбільш підходящого ураження для біопсії.
Радіолог потім може переглянути історію хвороби пацієнта, лабораторні показники та інформацію про алергію. Інтервенційний або хірургічний метод повинен братися уваги для випадків високого ризику. Пацієнти з більш високим ризиком кровотечі, ніж в середньому в популяції, повинні бути проінформовані про ризик і, відповідно, дати згоду.
СОНОГРАФІСТ
Сонографіст відіграє важливу роль як до, так і під час процедури. Він повинен мати все необхідне, щоб не було необхідності залишати приміщення після того, як процедура почалася. Підготовка включає наявність дублюючого обладнання на випадок, якщо щось впало чи ненавмисно було забруднено. Проведення УЗД дослідження слід також координувати з медсестрою, а також оцінити результати лабораторних досліджень до процедури.
Попереднє сканування важливо для локалізації відповідного ураження або скупчення рідини. Перед тим, як рентгенолог входить в кімнату, сонографіст може визначити місце ураження і допомогти оцінити можливі траєкторії входу голки. У тих випадках, коли необхідна зміна положення тіла пацієнта, сонографіст може також надати інформацію про положення, яке дозволяє оптимально візуалізувати ціль. Після того, як ціль визначена і положення пацієнта оптимізовано, оцінюється відстань від шкіри, або від верхньої частини голки, до цілі. Сонографіст може знайти перешкоди в можливих траєкторіях введення голки, наприклад, кишківник, легені або великі судини. При цьому необхідно, щоб була виконана кольорова доплерографія для того щоб уникнути контакту з великими судинами. Рентгенолог потім може більш точно підтвердити відповідну траєкторію.
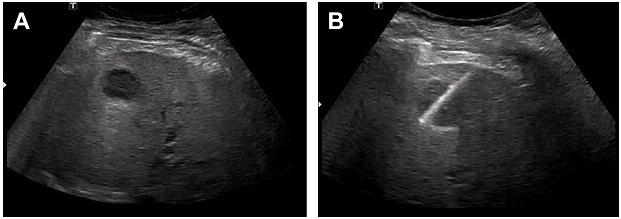
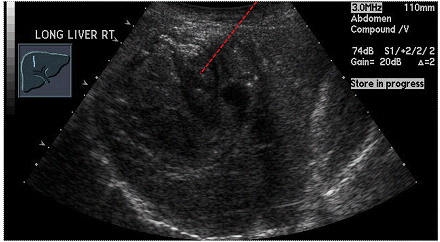
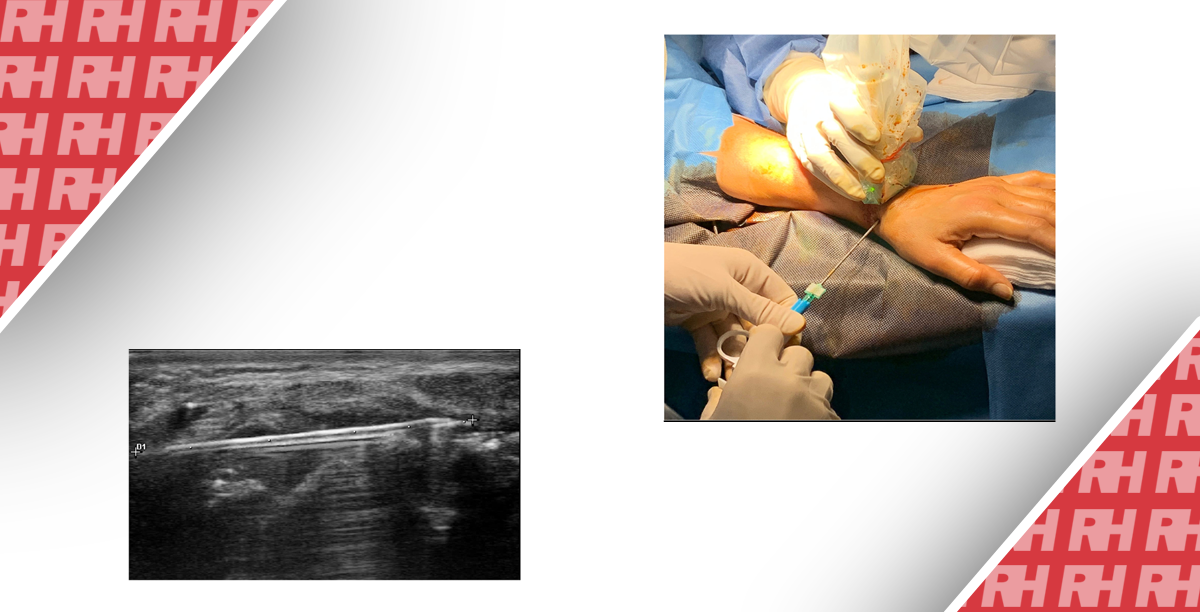
Під час процедури, сонографісту слід записати зображення, яке демонструє відповідність розміщення голки всередині мішені (Рис. 1). Сонографіст може записати відео всієї процедури, коли піднімається питання про те, чи була досягнута мета, особливо у важкодоступних для візуалізації місцях.
ОБЛАДНАННЯ КАБІНЕТУ
Рухливе, регульоване по висоті ліжко дозволяє вибрати зручний робочий рівень для рентгенолога, щоб мінімізувати непотрібну напругу. Функціонуюче джерело кисню з відповідною трубкою або маскою повинно бути легко доступним. Наявність контейнера для гострих предметів – необхідна вимога для утилізації голок, скальпелів та ін. Крім того, журнал аварій повинен бути доступний в надзвичайних ситуаціях.
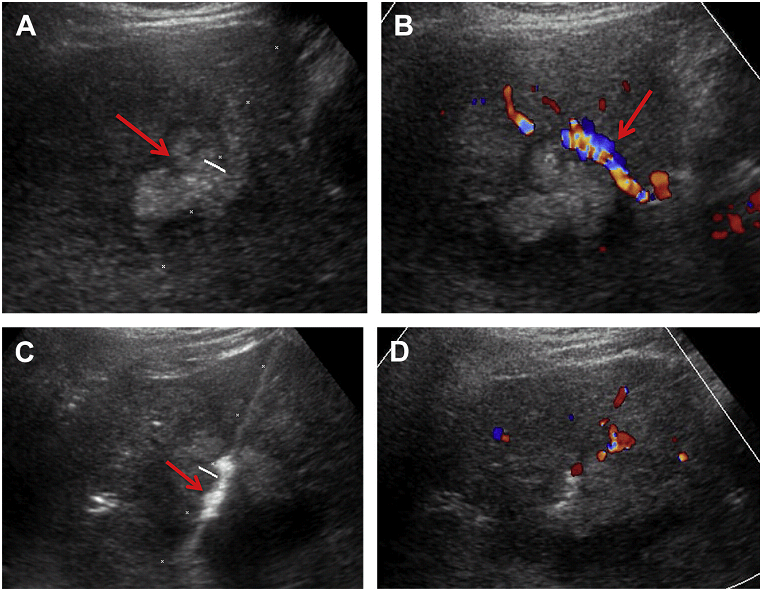
Рис. 1. Необхідні кроки під час біопсії. (А) Оцінити траєкторію до місця ураження (ехогенна пухлина печінки, стрілка). (B) Застосування кольорової доплерографії в пошуку судин на шляху (стрілка). (C) Записати кожну пункцію, показуючи розташування голки (стрілка). (D) Пошук можливих кровотеч – скан без та з кольоровим доплером (не виявлено).
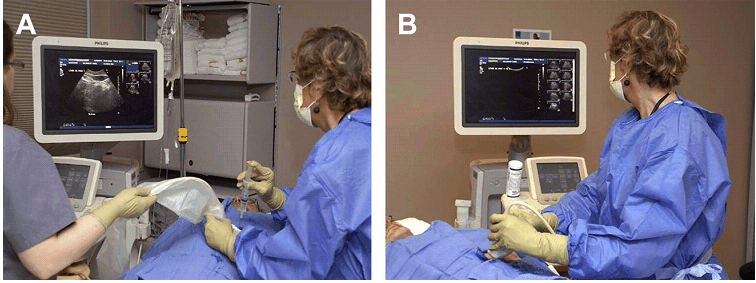
УЗД блок в ідеалі повинен бути розташований навпроти рентгенолога та положення пацієнта (Рис. 2). Ця розстановка дозволяє рентгенологу бачити те, як голка входить в пацієнта і УЗД картину – одночасно, а також дає лікареві простір на протилежній стороні для запису необхідних зображень. Коли УЗД апарат знаходиться на тій же стороні, що і лікар, останній не може дивитися на монітор і контролювати голку одночасно, а також не може ефективно скорегувати розміщення голки залежно від УЗД картини. Таке розташування також викликає напруження шиї під час процедури. Нові конфігурації монітора з регулюваннями його розташування вирішують частину проблеми. Проте, якщо необхідна документальна реєстрація процедури – простір, зайнятий УЗД апаратом і лікарем, дуже швидко захаращується.
Рис. 2. Розташування в кабінеті. (A) Ідеальна позиція лікаря, зверненого до пацієнта, голки та датчика, які розташовані на одній прямій з УЗ монітором. (В) Неідеальне положення, де лікар відвертається від хворого і не може бачити голку і датчик, коли дивиться на монітор. Там немає місця для того, щоб фіксувати зображення.
МЕДСЕСТРА
При помірному і високому ризику процедури зазвичай необхідна присутність медсестри для оцінки та спостереження за пацієнтами. Медсестра повинна вивчити актуальну історію хвороби і результати лабораторних досліджень, алергічний профіль, в тому числі раніше перенесені реакції, пов’язані з ліками, які використовуються для проведення даної процедури. Медсестра відіграє життєво важливу роль в тому, щоб вчасно підняти червоний прапор у випадку проблемної ситуації під час процедури або при подальшому відновленні. Медсестра також забезпечує необхідний лікарю седативний стан, щоб забезпечити певний рівень контролю болю і тривоги.
ЗВ’ЯЗОК З ВІДДІЛЕННЯМ ПАТОЛОГІЧНОЇ АНАТОМІЇ
Зв’язок з відділенням патологічної анатомії є дуже важливим у визначенні типу необхідної біопсії: лише тонкогольна біопсія (fine needle aspiration – FNA), кор-біопсія або обидва види одночасно. Огляд FNA або відбитків кор-біопсії, під час процедури персоналом відділу цитопатології, зменшує вірогідність неадекватного або недостатнього відбору проб для дослідження. Якщо підозрюється лімфома, FNA зразки можуть бути спрямовані на проточну цитометрію. Відділення патологічної анатомії також може надавати різні розчини для конкретних біопсій, таких як біопсія нирки.
ВИБІР ГОЛКИ
FNA для абдомінальної біопсії, як правило, здійснюється за допомогою голок від 18 до 22 розміру і може використовуватися або самостійно, або через коаксіальний датчик. Більшість абдомінальних кор-біопсій виконуються голками №18. У пацієнтів з помірною коагулопатією або з глибокими ураженнями, в яких можуть бути пошкоджені кровоносні судини, скорочення розміру голки до №20 або виконання FNA замість кор-біопсії, прийнятніше, оскільки голка більшого розміру частіше пов’язана з геморагічними ускладненнями . Тим не менш, багато дослідженнь не повідомляють про збільшення ризику кровотечі при збільшенні розміру голки. Невеликі вогнища ураження або, розташовані поблизу життєво важливих структур, вимагають використання голок з меншим кроком – наприклад: 1 см замість 2 см.
Голки, які занадто короткі, не доходять до цілі, а голки, які занадто довгі – можуть зігнутися, що знижує ефективність досягнення цілі. Фактична довжина сердечника голки, як правило, є коротшою зазначеної на етикетці (Рис. 3).
Рис. 3. Відмінності в розмірі голки. (A) 9-см голка для кор-біопсії – трохи менше 9 см в довжину. (В), однак, при введення в тіло, фактична довжина голки становить менше 7 см. Таким чином, ціль повинна бути менше 6,5 см від точки входу в шкіру.
Багато 10-см голок кор-біопсії мають ефективну довжину введення – 8 см. Це означає, що 15-см голка потрібна для досягнення цілі на глибині 7-8 см. До того ж, при використанні місцевої анестезії трохи збільшується відстань до цілі. Схожі проблеми спостерігаються при використанні коаксіальних голок, які, як правило, є коротшими зазначеної на етикетці довжини і коротшими голки для біопсії. Наприклад, 10-см коаксіальна голка №18 має довжину 6-7 см. Якщо ураження є глибшим довжини голки, то необхідно вибрати більш довгу коаксіальну систему. Іноді в довжину включають муфту, що також необхідно враховувати.
ВИБІР КАТЕТЕРА
При виборі дренажних катетерів дуже важливо підібрати відповідний діаметр, враховуючи характер дренуючої рідини. Скупчення нев’язкої рідини зазвичай дренується катетерами 8F і 10F. Для більш в’язких рідин, таких як гній і рідини змішаного характеру, можуть знадобитися великі катетери, такі як 12F і 14F. Катетер 10F 2 різних виробників може мати різний розмір pigtail і бічних отворів (Рис. 4).
Рис. 4. Два різних 10F катетера. (A) Два різнокаліберних pigtail 10F катетерів. Примітка: у верхнього катетера pigtail менше 2 см в діаметрі, а у нижнього – перевищує 3 см в діаметрі. Чим менше pigtail, тим це краще для невеликих скупчень рідини, так як необхідно ввести катетер більш короткої довжини. (В) Відмінності в розмірах бічних отворів різних катетерів. Примітка: верхній катетер має великі бічні отвори, які дренують більш в’язку рідину краще, ніж дрібніші бічні отвори.
Катетери з меншими pigtail легше розмістити в меншій порожнини, а великі бічні отвори сприяють швидшому дренуванню, особливо більш в’язкої рідини.
Слід використовувати модифікований метод Сельдингера, чи техніку з одним троакаром, залежить від обставин. Техніка Сельдингера корисна, коли порожнина невелика і глибоко розташована, або оптимальне вікно доступу вузьке, або знаходиться в чутливій зоні. Якщо порожнина велика, з широким вікном доступу, в нечутливому місці, то методика одного троакара забезпечує досить просте і швидке розміщення катетера. Багато дренажних катетерів сьогодні мають стандартну конфігурацію троакара, що замінює техніку Сельдингера, коли це можливо.
ВИБІР ДАТЧИКА
Вигнутий фазований матричний датчик (наприклад, 4-6 МГц, з діапазоном до 1 або 2 МГц) використовується для основних типів абдомінальних втручання через його глибину проникнення, широке поле зору й чудовий просторовий дозвіл. Проте дуже часто при дослідженні необхідно більше вікно і підреберний доступ. Векторний датчик має меншу площу і тому є простішим у використанні в малих просторах, особливо в межребір’ї. Хоча, традиційно, менше поле зору є недоліком, нові датчики з високою роздільною здатністю з віртуальною конвексною можливістю компенсують цей недолік і забезпечують можливість наведення на більш глибокі ушкодження. Якщо ціль розташована поверхнево, або пацієнт – худий, то високочастотний лінійний датчик (наприклад, 9 МГц) може забезпечити кращу візуалізацію ушкодження. Ці датчики мають канали для голок, що допомагає досягти необхідної цілі.
До початку процедури повинно бути виконано відповідне сканування для вибору датчика, який краще відображає ціль і оптимальну траєкторію. Якщо використовується спрямовуюча голка із зігнутим датчиком, то повітряний просвіт між краєм останнього і точкою входу на шкірі повинен бути зведений до мінімуму, щоб поліпшити видимість голки в точці входу. Це може бути досягнуто легким нахилом датчика таким чином, щоб вигнутий край зберігав контакт зі шкірою.
КОАГУЛОПАТІЯ ТА РИЗИК КРОВОТЕЧІ
Протромбіновий час (ПЧ) / міжнародне нормалізоване відношення (МНВ) і кількість тромбоцитів є найбільш важливими лабораторними показниками, які використовуються для оцінки ризику кровотеч перед процедурами. Нормальний ПЧ коливається близько 11-14 секунд, а нормальне МНВ, зазвичай, знаходиться в діапазоні від 0,9 до 1,1. МНВ – 1,5 було використано в якості порогового значення для більшості процедур. Багато досліджень показали, що ризик кровотеч з МНВ до 1,7 дещо збільшується в порівнянні з нормальним МНВ.
Активований частковий тромбопластиновий час (АЧТЧ), як правило, не розглядається в якості важливих величин, таких як як МНВ або кількість тромбоцитів. Дослідження показали, що підвищене АЧТЧ є найбільш поширеним коагуляційним відхиленням, і не прогнозує кровотечі в операційній, а аномальні значення АЧТЧ часто носять тимчасовий характер.
Нормальний рівень тромбоцитів коливається від 150000 до 450000 зі стандартним пороговим значенням 50000 для інвазивних процедур. Хоча багато радіологів і не виконують процедури у пацієнтів з рівнем тромбоцитів менше 50 000, більшість досліджень показують те, що низька кількість тромбоцитів не збільшує ризик у пацієнтів, які перенесли різні типи процедур. Кількість тромбоцитів менше 10 000-20 000 пов’язана зі спонтанними кровотечами.
АНТИКОАГУЛЯНТИ
Клопідогрель (Плавікс) і подібні засоби іноді не можуть бути відмінені в залежності від клінічної ситуації. Ні Клопідогрель, ні аспірин не можуть бути відмінені, якщо пацієнту встановили серцевий стент з покриттям за останні 12-24 місяці або непокритий металевий стент за останній місяць.
Якщо пацієнту, який отримує Клопідогрель необхідне проведення інвазивної процедури, порівняльні ризики продовження або припинення його використання для проведення процедури повинні бути обговорені з кардіологом пацієнта або клінічною групою. Пацієнт повинен знати про можливий ризик кровотечі або кардіоваскулярного ускладнення.
Для пацієнтів, що недавно отримували Клопідогрель, процедура може бути змінена таким чином, щоб можна було виконати FNA замість кор-біопсії, або використовувати голку меншого калібру (наприклад, не №20, а №18). Термін спостереження після процедури може бути більшим звичайного часу відновлення, і життєво важливі показники повинні бути досліджені частіше. Можна запланувати контрольний огляд незабаром після процедури, якщо це необхідно.
КРОВОЗУПИНЯЮЧІ ПРЕПАРАТИ
Тромбоцити
Тромбоцити можуть бути введені в кількості 5-6 одиниць пакетів з однією дозою, або 1 доза ферезного пакета. Існує загальне збільшення від 5000 до 10000 тромбоцитів на пакет з однією дозою або 25000 до 50000 на всю кількість або одноразову дозу. Оптимальний варіант – якщо остання доза тромбоцитів буде дана на початку процедури. Коли процедурна медсестра не спостерігає за потенційними реакціями на переливання, процедура повинна бути виконана протягом 1-2 годин після введення тромбоцитів. Після введення тромбоцитів, як правило, не рекомендується перевіряти їх число перед процедурою. Це затримує процедуру, що в свою чергу, зменшує ефективність тромбоцитів.
Свіжозаморожена плазма
Свіжозаморожена плазма (СЗП) вводиться пацієнтам для зниження підвищеного МНВ. Чим вище МНВ, тим більше корекція на одиницю СЗП (Таблиця 1). Як правило, дві одиниці СЗП може теоретично зменшити коагулопатію, коли МНВ становить близько 2,5 або більше. Проте, є дані на користь підтримки або спростування переваги СЗП.
Таблиця 1. Оцінка корекції МНВ на одиницю СЗП.
|
Передтрансфузійне МНВ |
Корекція за рахунок одиниці СЗП, середнє і відхилення |
|
1,3-1,7 |
0,1 (0,1-0,2) |
|
1,7-2,3 |
0,2 (0,1-0,3) |
|
2.4-2.9 |
0,4 (0.1-0.7) |
|
3.0-4.3 |
0,7 (0.2-1.5) |
|
4.4-20.0 |
3,5 (1.1-8.4) |
Примітка. Чим вище МНВ, тим більше відзначається корекції на одиницю СЗП.
Переливання плазми має мінімальний вплив на нормалізацію помірно підвищеного МНВ, і тому СЗП недоречно замовляти у 10-83% пацієнтів. Легкі та помірні порушення згортання, як правило, не збільшують ризик кровотечі, і переливання СЗП насправді не може зменшити кровотечу після процедури.
Ризик післятрансфузійних реакцій також повинен бути врахований, коли переливаються тромбоцити або СЗП. Реакції переливання включають, але не обмежуються лихоманкою, задишкою, перевантаженням об’ємом і посттранфузійними ураженнями легень.
Погоджений посібник рекомендацій Товариства інтервенційної радіології 2009 був випущений в 2009 році, з поправками та обновленнями в 2013 році. Є корисним джерелом для виконання інтервенційних процедур у пацієнтів з аномальними параметрами коагуляції або завідомо відомої коагулопатією. Процедури були розділені на: процедури з низьким, середнім та високим ризиком виникнення кровотечі з рекомендаціями для лабораторного аналізу та лікування.
Модифікації цих таблиць наведені в таблицях 2-4.
Таблиця 2. Низький ризик кровотечі
|
Процедури |
Передпроцедурні лабораторні тести |
Лікування |
|
Судинні |
|
|
|
||
|
Несудинні |
||
|
PLT-не регулярно рекомендовано |
LMWH (терапевтична доза)
|
Примітка. Будь ласка, зверніться до офіційного огляду.
Скорочення: ASA, аспірин; CVC, центральний венозний катетер; IV, внутрішньовенно; IVC, нижня порожниста вена; LMWH, низькомолекулярний гепарин; PICC, центральний катетер, що вводиться периферично; PLT, кількість тромбоцитів.
Таблиця 3. Середній ризик кровотечі
|
Процедури |
Передпроцедурні лабораторні тести |
Лікування |
|
Судинні |
МНВ АЧТЧ PLT |
МНВ корекція якщо> 1,5 (СЗП або вітамін К) АЧТЧ – немає консенсусу, можлива корекція якщо> 1,5 * норма PLT-переливання, якщо <50 К Клопідогрель (Плавикс) – відмінити на 5 днів |
|
||
|
Несудинні |
||
|
ASA-не відміняти LMWH (терапевтична доза)
|
Примітка. Будь ласка, зверніться до офіційного огляду.
Скорочення: ASA, аспірин; CVC, центральний венозний катетер; LMWH, низькомолекулярний гепарин; LP, спинномозкова пункція; PLT, кількість тромбоцитів; RFA, радіочастотна абляція; UAE, емболізація маткових артерій.
Таблиця 4. Високий ризик кровотечі
|
Процедури |
Передпроцедурні лабораторні тести |
Лікування |
|
Судинні |
МНВ АЧТЧ PLT |
МНВ корекція якщо> 1,5 АЧТЧ – зупинити або навпаки гепарин, якщо> 1,5 * норма PLT-переливання, якщо <50 К Клопідогрель (Плавикс) – відмінити на 5 днів |
|
||
|
Несудинні |
||
|
• Ниркова біопсія • Втручання на жовчних шляхах • Нефростомія |
PLT-не регулярно рекомендовано |
• RFA ASA- відмінити на 5 днів LMWH – відмінити на 24 години або 2 дози |
Примітка. Будь ласка, зверніться до офіційного огляду.
Скорочення: ASA, аспірин; LMWH, низькомолекулярний гепарин; PLT, кількість тромбоцитів; RFA, радіочастотна абляція; TIPS, трансюгулярне внутрипечінкове портосистемне шунтування.
Більша частина даних, що використовуються в даний час для процедури візуального наведення, була екстрапольована з хірургічного досвіду. Таким чином, в клінічній практиці методики відрізняються через відсутність рандомізованого контрольованого дослідження. В кінцевому рахунку, успіх залежить від порівняльної оцінки, вибору типу процедури і досвіду. Нові дослідження показують, що можна бути більш ліберальними в проведенні деяких процедур, ніж традиційно вважається, при МНВ = 1,5 і граничним значенням тромбоцитів – 50000. В міждисциплінарному дослідженні O’Connor і його колеги пропонують більш ліберальні принципи на основі фактичних даних (Таблиця 5).
При використанні цих рекомендацій, Kitchin і колеги показали, що при підвищенні порогових критеріїв коагуляції, при біопсії печінки під УЗД наведенням, МНВ – від 1,5 до 2, а тромбоцитів – від 50000 до 25000, спостерігається загальне зменшення кількості геморагічних ускладнень (у 1846 пацієнтів). Передпроцедурне переливання тромбоцитів і СЗП знизилося п’ятикратно. Хоча індивідуальний ризик кровотечі був вищим у пацієнтів з субоптимальним МНВ і значеннями тромбоцитів, вони відзначили, що переливання не знижує додатковий ризик кровотечі, при порушених значеннях лабораторних показників.
Таблиця 5. Рекомендації. Резюме
|
Втручання |
МНВ |
PLT |
|
FNA≤20 г |
Будь які |
Будь які |
|
Парацентез |
≤3.0 |
≤25К |
|
Плевроцентез, біопсія печінки, або інша біопсія |
≤2.0 |
≤25К |
Примітка. FNA≤20 г відноситься до аспірації рідини в будь-якій частині тіла. Рекомендації, запропоновані O’Connor і його колегами. Якщо лабораторні аналізи в нормі протягом 4-6 місяців після процедури і немає значущих клінічних змін, вони рекомендують не повторювати лабораторні тести, якщо це не виправдано клінічною ситуацією.
Пацієнти з печінковою недостатністю можуть бути більш схильні до кровотечі, що вимагає проведення лабораторних тестів частіше, у зв’язку зі зміною клінічного стану. Тим не менше, ці пацієнти проходять процедуру частіше, ніж багато інших, у яких частота кровотеч може бути вище. У пацієнтів зі списку на трансплантацію печінки, які отримують тромбоцити і СЗП, відзначається поліпшення параметрів згортання в динаміці, що знижує їх місце в списку на пересадку і можливий порятунок життя.
ПРОТИПОКАЗАННЯ
Хоча абсолютних протипоказань до інтервенційних процедур під УЗ наведенням і немає, відносні протипоказання включають: важку некоректуєму коагулопатію, важку серцеву недостатність або нестабільність гемодинаміки, відсутність безпечного шляху до вогнища або мішені (наприклад, великі кровоносні судини, легені, або кишківник), нездатність пацієнта терпіти процедуру (наприклад, затримувати дихання, позиціонування або відмову від співпраці) і відмова самого пацієнта. Протипоказання, що стосуються конкретних органів перераховані в кожній секції окремо.
ІНТЕРВЕНЦІЙНІ МЕТОДИ
При виконанні втручання, дуже важливо, щоб кінчик голки завжди знаходився в оптимальному полі зору на фокусі, особливо коли він проникає в мішень, що досягається настройками і використанням датчика високої частоти. Голка найкраще візуалізується в поздовжній площині, коли вона (голка) паралельна довгій осі датчика і знаходиться під кутом по відношенню до УЗД променя, так щоб вся довжина і її наконечник візуалізувалися. Після місцевої анестезії дерми, анестетик повинен бути введений під капсулу органа-мішені або місце ураження, якщо він знаходиться за межами органу. Використовуючи УЗД контроль введення голки для проведення анестезії, можна використовувати спинальну голку для досягнення потрібного рівня. Автори вважають за краще використовувати для цієї мети голки 20 діаметра, так як більш тонкі голки, як правило, згинаються в черевній порожнині або заочеревинному просторі. Якщо необхідний помірний седативний ефект, все одно пацієнт повинен бути досить бадьорим, щоб бути в змозі затримати дихання, коли це необхідно.
Існує кілька методів подолання труднощів у досягнення цілі для біопсії або дренування. Зміна положення пацієнта і дихання – прості прийоми, які можуть поліпшити доступ. Гідродісекція є дуже корисним методом, при якому використовується ін’єкція фізіологічного розчину або стерильної води для відтискування структур, що заважають прицілюванню (Рис. 5). Цей метод може бути особливо корисним при доступі до заочеревинних структур, таких як наднирники (для зміщенні плеври латерально і розширенні заднього паравертебрального простору, що дозволяє здійснити задній екстра плевральний доступ). Крім того, безперервний тиск датчиком на місце доступу, може допомогти відтіснити петлі кишківника з траєкторії біопсії.
МЕТОДИ БІОПСІЇ
Два методи використовуються для УЗД біопсії: мануальна та провідникова методика. Кожна техніка має свої переваги і недоліки. Провідникова методика забезпечує передбачувану траєкторію голки, але обмежена фіксованим кутом атаки. Кількість фіксованих кутів залежить від провідників голки, як правило, від 1 до 4. Траєкторія може бути змінена шляхом зміни кута нахилу провідника з того ж розрізу. Мануальна техніка вимагає більшого технічної майстерності і може бути складною для початківців або недосвідчених інтервенціоналістів. Це, найчастіше, вимагає коригування та виправлення шляху проведення голки. Тим не менше, відсутність фіксованого кута створює велику гнучкість в зміні кута атаки без внесення змін до провідника або необхідності нового розрізу. В дослідженні з використанням фантомів, провідникова техніка виявилася більш швидкою, ефективною і відновлюваною ніж мануальна, особливо для менш досвідчених інтервенціоналістів. Було відзначено значне зниження кількості спроб введення голки, скорочення загального часу, необхідного для виконання біопсії, зменшення кількості проходів.
Рис. 5. Гідродісекція. (А) Ураження печінки видно на ії куполі (ліворуч). По краю печінки траєкторії голки лежить кишка, що краще видно на суміщеному КТ (справа). (B) кишківник по передньому краю печінки при УЗД візуалізації. (С) Виконана гідродісекція з використанням від 100 до 150 мл фізіологічного розчину, що віддалило кишківник від поверхні печінки, щоб забезпечити безпечну точку входу. (D) Тепер біопсія може бути безпечно виконана.
Додатковий плюс черезшкірної біопсії – використання коаксіальної системи. Перевага коаксіальної методики в тому, що коаксіальна голка, як правило, вводиться тільки один раз в орган або вогнище. Цей метод може зменшити ризик таких ускладнень, як кровотеча, пневмоторакс і поширення пухлини по ходу шляху голки. Крім того, кілька зразків тканини можуть бути отримані з осередку ураження, злегка змінюючи траєкторію голки без повного її вилучення. Якщо коаксіальна голка розміщена разом з біопсійним провідником, то, можливо, буде необхідне відділення цього направляючого пристрою від коаксіальної голки, щоб уникнути переміщення голки під час процедури, доти, поки друга пара рук не триматиме датчик і голку на місці.
Існує два типи зразків біопсії, які можуть бути отримані: FNA і кор-біопсія (core needle biopsy – CNB). FNA зразки з черевної порожнини зазвичай отримують, використовуючи голки №18-22 та аналізуються цитологічно, тоді як CNB зразки, отримані з використанням більшого діаметра голок від №14 до №20 (як правило, №18), досліджуються гістологічно. Основною перевагою FNA, враховуючи менший розмір голки, є зниження ризику кровотечі. Переваги CNB включають: збереження архітектури тканини, що може вимагатися для діагностики високодиференційованих гепатом та лімфом; можливість використовувати спеціальне забарвлення і імуногістохімічні методи. При порівнянні цитології FNA і CNB в оцінці черевних новоутворень, Stewart і його колеги показали, що FNA цитологія була більш чутливою і точною, ніж CNB (FNA цитологія була ефективна в 122 з 141 [86,5%] випадках, а CNB – в 113 з 141 [80,1%] випадках). Проте, одним з переваг CNB була здатність виявляти підтипи пухлин (виявлення походження або характеристик пухлини). Поєднання двох методів забезпечують високу точність.
Мазок-відбиток є корисним доповненням до CNB, оскільки він дозволяє оцінювати якість матеріалу на місці в режимі реального часу і може містити додаткову інформацію, якщо CNB не витримає обробку. В ретроспективному огляді порівняння FNA і CNB з або без мазка-відбитка 154 патологій нирок з використанням УЗД або КТ наведення, CNB з мазком-відбитком показала більшу відповідність зразка тканини, ніж FNA. В цьому дослідженні FNA були отримані в кілька проходів голкою №21 або меншого калібру, а CNB були отримані з голками калібру №20 або більше. Відповідність зразка тканини була задовільною в 86% FNA і 94% – CNB, і в 95% CNB з мазком-відбитком. CNB з або без мазка-відбитка мала більшу адекватність зразка і діагностичну цінність, ніж FNA. Ще однією перевагою є те, що CNB надає більше діагностичної інформації (підтип і ядерний клас) в діагностиці нирково-клітинної карциноми.
Для біопсії некротичних уражень, голка повинна бути направлена в бік периферії ураження, щоб отримати адекватний клітинний матеріал. Отримання FNA або мазка-відбитка в цих випадках також мінімізує ймовірність неадекватного вибору траєкторії або місця в вогнище ураження, які можуть бути змінені, якщо отриманий зразок тканини не несе діагностичної цінності.
Число проходів при біопсії може бути скорочено, якщо патологоанатом на місці швидко виконує мазок-відбиток і аналізує основні зразки FNA або CNB. Ця експрес оцінка допомагає уникнути неінформативного результату біопсії. Проте, цитологія на місці для кожної процедури біопсії може бути неможлива через обмеженість ресурсів. В дослідженні, проведеному Appelbaum і колегами, показано, що, хоча розмір ураження і його розташування не впливають на кількість проходів голкою, необхідних для встановлення діагнозу, при метастатичних ураженнях необхідно виконувати їх менше. Без наявності цитолога 3 проходи голки будуть діагностично достовірними в 90% всіх біопсій печінки під УЗД наведенням з використанням голки №18 для CNB. В госпіталі авторів статті, для більшості біопсій твердих органів, здійснюється 2-3 проходи голкою №18.
МЕТОДИКИ ВСТАНОВЛЕННЯ ДРЕНАЖУ
Для підшкірного дренування скупчення рідини під УЗД наведенням використовується два методи. До них відносяться метод Сельдингера і троакарний метод. При методиці Сельдингера після локалізації скупчення рідини під УЗ контролем, 5F №19 Yueh (Cook Medical, Bloomington, IN) голка катетера просувається у вогнище. При аспірації рідини, зовнішня оболонка просувається далі, а голка витягується. 0.035- або 0,038-дюймовий провідник вводиться через оболонку і згортається кільцем в порожнині з рідиною. Зовнішня оболонка видаляється по провіднику і потім виконується серійна дилятація. Як правило, використовуються дилятатори з кроком 2F до остаточного розміру катетера. Катетер вибору потім просувається по провіднику, переконавшись, що всі бічні отвори розташовані в порожнині, потім провідник видаляється. Формується Pigtail катетера і під’єднується дренажний мішок. Переваги цієї техніки включають здатність маніпулювати провідником у точному місці до остаточного введення катетера. Недоліки цього методу включають підвищений час процедури порівняно з троакарним методом, проблеми з перегином провідника і витікання рідини навколо провідника під час видалення голки або дилятатора.
При троакарному методі, катетер безпосередньо монтується на стилет чи троакар і дилятація не виконується. Після локалізації порожнини і проведення місцевої анестезії, обраний катетер просувають в скупчення рідини. Після його належного розміщення для аспірації рідини і прямий УЗД візуалізації, розгортається pigtail і дренажний мішок з’єднується з катетером. Переваги цього методу включають швидке розміщення катетера через скорочення числа дій порівняно зі способом Сельдингера, а також зменшення витікання рідини вздовж каналу.
Навідна голка використовується для кращого наведення катетера на порожнину. При троакарному методі 8.5F катетер проводиться через найбільший направляючий троакар. В якості альтернативи, навідна голка може використовуватися для коригування напрямку катетера Yueh з технікою Сельдингера. Після розміщення провідника і видалення навідної голки, направляючий пристрій від’єднується, а потім вводиться катетер на направляючий провідник.
Дренажі встановлюються через прямий доступ до вогнища або через прилеглий орган, наприклад: печінка, нирки, селезінка. Гематоми і сероми після трансплантації зазвичай не потребують дренування. Лімфоцеле, абсцеси і уріноми, як правило, добре піддаються дренуванню.
РОЗТАШУВАННЯ ПАЦІЄНТА
Як правило, пацієнтам найбільш комфортно в положенні лежачи на спині із зручною подушкою і клином або валиком під колінами, для зменшення тиску в нижній частині спини. Хоча деякі пацієнти повинні бути розміщені в косих або нахилених позиціях для проведення процедури. Необхідно забезпечити комфорт пацієнтові за допомогою подушки, рушника або клинів з піни, що зменшує рух пацієнта під час процедури.
ВТРУЧАННЯ НА ПЕЧІНЦІ
Показання
Біопсії печінки є одними із найчастіше виконуваних процедур в області живота, як прицільно, так і неприцільно. Показання до біопсії печінки включають: діагноз гострого та хронічного гепатиту, аномалії метаболізму заліза і міді, хвороби накопичення глікогену, інфекції, первинний біліарний цироз печінки, діагностика злоякісних новоутворень та диференціювання доброякісних і злоякісних новоутворень. Біопсія печінки після її пересадки зазвичай виконується в разі підозри на відторгнення. Черезшкірна аспірація і дренування виконується для лікування як гнійних, так і амебних абсцесів печінки, а також симптоматичних та ехінококозних кіст печінки.
Потенційні протипоказання
Енцефалопатія, печінкова недостатність з важкою жовтяницею і серйозна системна патологія може завадити втручанню на печінці. Позапечінкова обструкція і бактеріальний холангіт – протипоказання, які можуть привести до перитоніту і сепсису. Великий об’єм асциту може ускладнити доступ до печінки, але це може бути вирішено шляхом проведення парацентеза перед процедурою і, тому, не розглядається як протипоказання. Little і колеги вважають, що асцит не впливає на частоту ускладнень при біопсії печінки.
Процедура
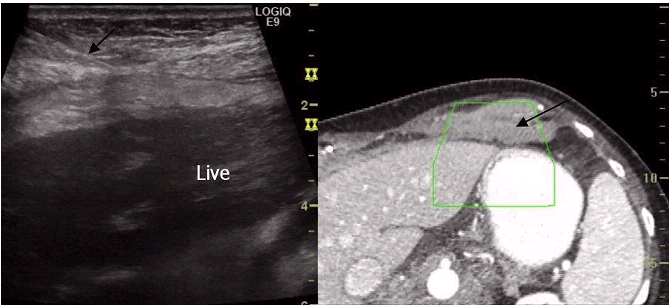
Транспаренхімальний доступ, при якому нормальна тканина печінки відокремлює місце передбачуваної біопсії, може зменшити ризик внутрішньоочеревинної кровотечі і є особливо важливим для запобігання перитонеальному витіканню рідини при підозрюваному ехінококозі. Міжреберний, підреберний і епігастральний доступи можуть використовуватися для процедури. Епігастральний або підреберний доступ часто використовуються для доступу до лівої частини печінки. Ці варіанти допомагають уникнути пошкодження плевральної порожнини (Рис. 6).
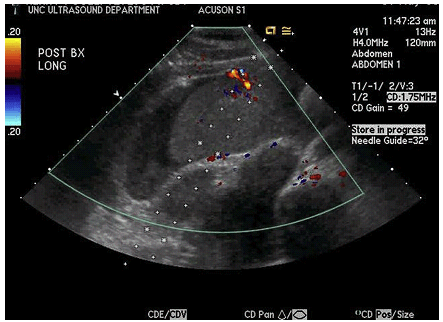
Рис. 6. УЗД біопсія трансплантата печінки з використанням голки №18 для кор-біопсії. (A) До і (B) після процедури.
Міжреберний і підреберний доступи використовуються для правої долі печінки (Мал.7). При використанні межреберного підходу, голка повинна розташовуватися безпосередньо над ребром, щоб уникнути пошкодження міжреберних судин.
Якщо використовується міжреберний доступ, слід мати на увазі, що край плеври простягається приблизно до 12-го ребра ззаду, 10 ребра збоку і 8-го ребра спереду. Пневмоторакс зустрічається рідко, навіть якщо пошкоджена плевра, але вдається уникнути пошкодження легенів. Childs and Tchelepi рекомендують стежити за рухом ехогенних легенів під час вдиху, щоб вибрати траєкторію без легеневої паренхіми. Необхідно докласти всіх зусиль, щоб уникнути судинних структур, особливо печінкових артерій та центральних судин.
Мал. 7. УЗД біопсія утворення діаметром 2,3 см в правій печінковій долі (A) коаксіальна мануальна техніка (В) голка для кор-біопсії №18. Дана патологія – гепатоцелюлярна карцинома.
Необхідно притискати пальцями місце біопсії, якщо це можливо, після кожного проходу голкою рентгенологом або сонографістом. Після процедури, пальцьове притискання місця біопсії здійснюється не менше 2 хвилин. Сканування після процедури може виконуватися на предмет кровотечі. Якщо пацієнт з коагулопатією – може бути виконана емболізація біопсійного каналу гелевою піною через коаксіальну голку для запобігання кровотечі. Проте, трансюгулярна біопсія печінки розглядається, як метод вибору у пацієнтів з тяжкою коагулопатією.
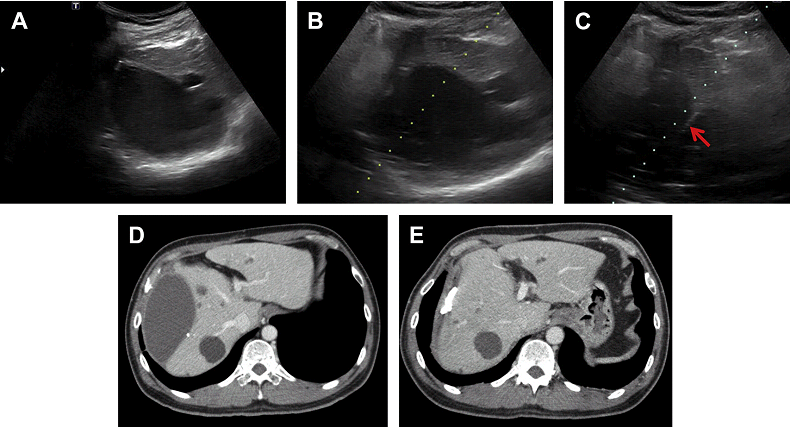
Черезшкірна голкова аспірація або катетерне дренування під візуальним контролем в поєднанні з антибактеріальною терапією – метод вибору для гнійних і амебних абсцесів печінки. Черезшкірна голкова аспірація проводиться під УЗД контролем в реальному часі для локалізації абсцесу і визначення напрямку введення голки. Розмір голки варіюється від 18 до 22 калібру в залежності від розміру вогнища. Зміна розміру порожнини повинна контролюватися в режимі реального часу на УЗД зображенні під час аспірації. Черезшкірне дренування виконується або троакаром або за допомогою техніки Сельдингера. Розміри катетерів, як правило, варіюють в діапазоні від 8F до 12F, залежно від розміру порожнини. Після установки катетера, аспірація повинна бути виконана негайно. Катетер повинен бути фіксований до шкіри для безперервного зовнішнього дренування і залишатися на місці, поки витікання рідини на припиниться. Навколопечінкові абсцеси іноді важко відрізнити від печінкових або субкапсулярних (Рис. 8).
Рис. 8. Дренування під УЗ наведенням навколопечінкові абсцесу (А) з розміщенням 10F катетера, черезпечінковий доступ. (В, C) Аспіровано 230 мл гною, дренаж залишений на місці (стрілки). КТ зображення до (D) і після (E) дренування демонструють повну евакуацію абсцесу.
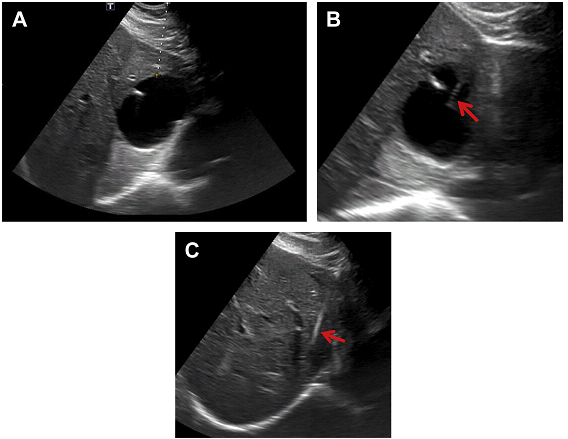
Великі симптоматичні кісти також добре піддаються дренуванню (Рис.9).
В ретроспективному дослідженні Giorgio і колег, 87 черезшкірних голкових аспірацій були виконані під контролем УЗД у пацієнтів з гнійними абсцесами печінки. Це лікування в поєднання з антибактеріальною терапією було ефективним у всіх пацієнтів. Рецидивів не було. Для більшості пацієнтів, один сеанс черезшкірного дренування був достатнім, і тільки 7,7% пацієнтам потрібно було повторне. Тим не менш, деякі дослідники виступають за використання катетерного дренування для черезшкірної аспірації. У рандомізованому проспективному дослідженні 60 пацієнтів з гнійними абсцесами печінки, черезшкірна голкова аспірація була успішною лише у 67% пацієнтів, в той час, як черезшкірне дренування катетером було ефективним у 100% хворих.
Рис. 9. Аспірація під УЗД наведенням 6 см простої кісти лівої долі печінки (А), яка викликала біль в епігастрії. 5F Yueh катетер (B, стрілка) був використаний для аспірації. (С) Після аспірації – повне розрішення кісти (стрілки). Біль у епігастрії у пацієнта зникла.
В рандомізованому дослідженні 50 пацієнтів з абсцесами печінки порівнювалася черезшкірна пункція з катетерним дренуванням. Черезшкірне катетерне дренування було більш ефективним. Черезшкірна голкова аспірація була успішна тільки у 60% пацієнтів, тоді як катетерний дренаж був ефективним в усіх пацієнтів. Хоча більшість печінкових абсцесів менше 4 або 5 см, як правило, реагують на консервативну антибіотикотерапію, абсцеси в лівій долі, близькі до перикарду, зазвичай дренують, через ризик їхнього прориву в порожнину перикарда.
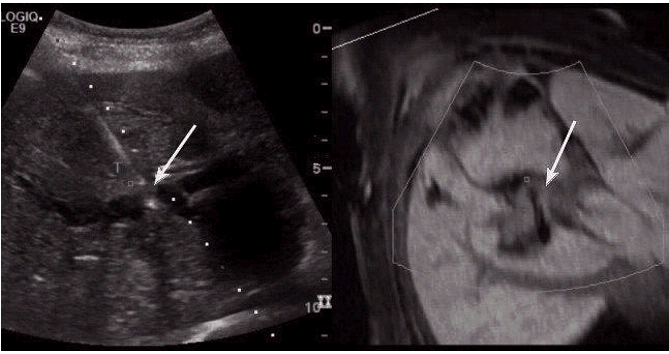
Черезшкірне лікування ехінококових кіст було вперше введено в 1985 році Mueller і його колегами, (Рис. 10 і 11). До цього, черезшкірна голкова пункція або аспірація ехінококозной кісти завжди були протипоказані через потенційні ускладненя – анафілактичного шоку або розповсюдження кіст по очеревині. При черезшкірному лікуванні ехінококових кіст, профілактична доза альбендазолу, від 15 до 20 мг / кг, дається два рази на день орально, починаючи за 1 тиждень до процедури, і продовжується в цілому 4 тижні.
Рис. 10. Розміщення дренажу під УЗД наведенням в ехінококовій кісті лівої долі печінки на МРТ. Т2-зважене МРТ зображення (А, В) демонструє велику кісту (C), на весь об’єм лівої долі печінки. Менші кістозні структури, донизу від кісти, – схожі на дочірні кісти. 12F pigtail катетер (D, стрілка) був поміщений в порожнину і аспіровано 60 мл темно-зеленою рідини. Післяпроцедурна томографія показала зменшення розміру кісти і дренаж в її порожнині.
Рис. 11. Ехінококова кіста печінки (червона лінія – траєкторія дренування).
Два різних сколецидних агента можуть бути введені в кісту, в тому числі 100% спирт або 20-30% гіпертонічний розчин. Ці агенти працюють за принципом того, що алкоголь викликає денатурацію білка і загибель клітини, а потім фіброз стінки кісти. Кілька методів були відзначені для лікування ехінококових кіст. BenAmor і колеги описують один із способів лікування кіст розміром менше 6 см, використовуючи пункцію, аспірацію, ін’єкцію і реаспірацію. Пункція кісти здійснюється голкою №19 під УЗД контролем, з подальшою аспірацією половини об’єму кісти, ін’єкцією 20% гіпертонічного сольового розчину в розмірі однієї третини початкового приблизного об’єму кісти, 20-хвилинним очікуванням і реаспірацією всієї рідини з кісти. Катетеризація використовується для кіст розміром більше 6 см. Після ін’єкції гіпертонічного сольового розчину, 6F-9F pigtail катетер поміщають в порожнину на 24 години для пасивного дренування. Якщо цистографічне дослідження через катетер не показує зв’язок між порожниною кісти і жовчними шляхами, в порожнину вводиться половина початкового передбачуваного об’єму кісти абсолютного спирту на 20 хвилин для отримання протосколецидного і склерозуючого ефекту. Якщо є зв’язок, то спирт не повинен використовуватися, оскільки може розвинутись вторинний склерозуючий холангіт.
Метод подвійний прокол-аспірація-ін’єкція (D-PAI) включає в себе тонкоголкову пункцію кісти печінки, видалення рідини кісти і ін’єкцію 95% спирту в кісту, для заміни від 50% до 60% видаленої рідини. Процедура потім повторюється через 3 дні після початкової аспірації. Друга половина процедури не включає реаспірацію сколецидного агента (95% спирт) або катетерного дренування. В огляді Giorgio і колег понад 225 кіст лікували D-PAI, при цьому результат методики дорівнював хірургічному втручанню. У довгостроковому спостереженні, в середньому – 48 місяців, в 48,4% випадків кісти зникли, в 46,2% залишилось значне вогнище за даними УЗД. Решта 5,3% кіст були представлені залишкової порожниною з мінімальним рідким компонентом, яка повторно аспірована під УЗ контролем і при цьому не виявлено життєздатних сколіксів. Нових внутрішньопечінкових або позапечінкових кіст не було виявлено. Місцеві рецидиви відзначені в 5% випадків.
Додаткові переваги печінкових втручань під УЗД наведенням включають: розміщення голок і зондів для абляції, склеротерапію симптоматичних кіст печінки, розміщення локальні міток в метастатичних ураженнях до хіміотерапії і метастазектоміі.
Післяпроцедурне спостереження
Післяпроцедурні схеми моніторингу варіюються залежно від клініки і, як правило, становлять від 2 до 6 годин. В установі авторів за пацієнтом спостерігають від 2 до 4 годин, залежно від стану хворого з повним моніторингом життєво важливих функцій. Якщо використовувався доступ в правому міжребер’ї, то пацієнт лежить на правому боці. Післяпроцедурні УЗ дослідження, як правило, не виконуються, якщо у пацієнта немає гострої симптоматики і не підозрюються ускладнення, пов’язані з процедурою. Якщо підозрюється пневмоторакс, то виконується рентгенографія.
При лікуванні кісти, УЗД оцінка розміру в динаміці та УЗД картина кісти дуже важлива. Велике зниження об’єму кісти відзначається відразу ж після процедури, а поступова зміна УЗД картини від кістозної до твердої відбувається протягом від декількох місяців до декількох років. Сталість круглої форми, анехогенний вид, гладка і тонка стінка кісти, відсутність пошкоджених ендоцист при рутинних подальших УЗД оглядах викликають підозру на рецидив. Після лікування повинно бути видно тільки твердий залишок кісти. Іноді, на місці кісти нічого не виявляють.
Ускладнення
Ускладнення включають: кровотечу (Рис. 12 і 13), пневмоторакс і поширення інфекції з каналу голки.
Рис. 12. Кровотеча після біопсії печінки.
Частота ускладнень при біопсії уражень печінки і дренування її абсцесів – не висока. При аналізі ускладнень центром, в якому виконані 2320 біопсії печінки, не було серйозних ускладнень після FNA або CNB. Малі ускладнення включали: обмежений гемоперитонеум (0,3%), вазовагальні реакції (0,04%) і транзиторні гіпотонії (0,08%). Жодного випадку пухлинного посіву вздовж каналу голки не спостерігалося. В тому ж дослідженні, значних ускладнень не спостерігалося після дренування абсцесу печінки. Незначні ускладнення включали транзиторну гіпертермію та помірний біль, який проходив протягом 24 годин.
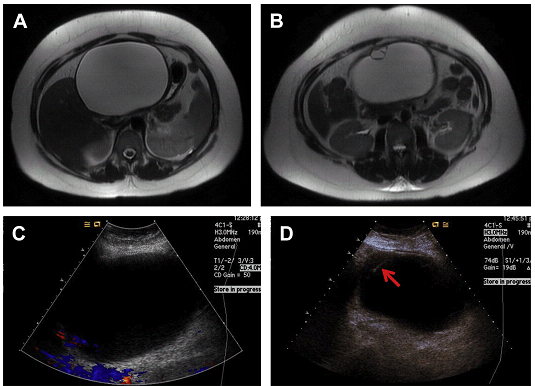
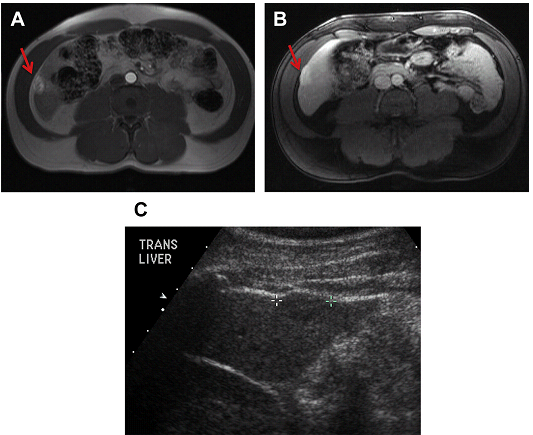
Рис. 13. Ускладнення. Ураження печінки видно на МРТ (A, B, стрілка) і УЗД (C), можливі ознаки кровотечі після виконання прямої біопсії, минаючи здорову паренхіму. Біопсія виявила гепатоцелюлярну карциному (ГЦК). Тепер більшість біопсій передбачуваної ГЦК можна уникнути за рахунок діагностичної МРТ.
Контрольне УЗ дослідження не виконуються, якщо у пацієнта немає гострої симптоматики і не підозрюються ускладнення, пов’язані з процедурою.
Віддалені результати лікування однієї установи, в якій лікувалося, в загальній складності, 72 пацієнта з 106 печінковими ехінококовими кістами говорять про 11,1% незначних ускладнень, у тому числі кропивниці та лихоманки. Основні ускладнення включали: інфікування порожнини кісти (2,8%), розвиток жовчних нориць (5,6%) і рецидив (2 хворих в терміни 6 місяців після процедури).
НАДНИРНИКИ
Показання до біопсії наднирників: діфдіагностика доброякісної і злоякісної патології, характеристика ураження наднирників у пацієнтів з декількома злоякісними новоутвореннями, визначення джерела первинної злоякісної пухлини і визначення стадії, завідомо відомого злоякісного ураження наднирників.
Протипоказання
Слід уникати біопсії наднирників, якщо підозрюється феохромоцитома.
Виконання процедури
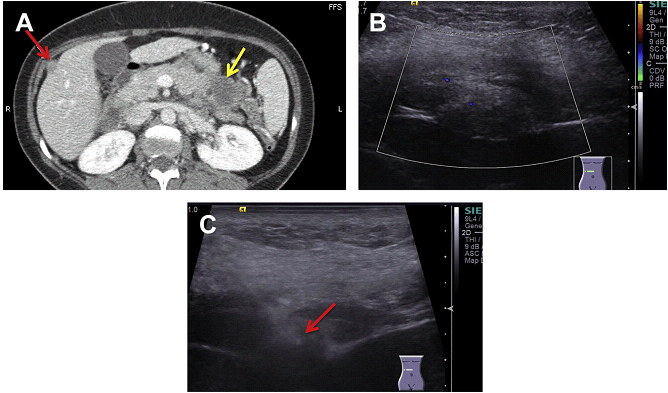
Як правило, має сенс використовувати і КТ, і УЗД з або без поєднання зображень при виконанні біопсії уражень наднирників. КТ забезпечує кращу просторову роздільну здатність, а УЗД найкращій часовий дозвіл. При використанні УЗД може використовуватися як мануальне наведення, так і техніка суміщених зображень. Седація свідомості може бути використана; однак, пацієнти повинні зберігати можливість регулювати затримку дихання, враховуючи близьке розташування наднирника до діафрагми. Для біопсії наднирників може використовуватися задній доступ; однак, розміщення пацієнта в іпсілатеральному положенні на боці може бути оптимальнішим, щоб уникнути пневмотораксу. Альтернативні доступи включають: передній, черезпанкреатичний, черезпечінковий і трансселезіночний. Каудально-цефальний доступ використовується для запобігання пошкодженням нирки і діафрагми. Якщо пухлина матиме судинну структуру або виявлено кровотечу в режимі реального часу при УЗД контролі, слід виконати емболізацію біопсійного каналу гелевою піною (Gelfoam) до вилучення голки.
Післяпроцедурне спостереження
В установі авторів за пацієнтом ведеться спостереження 2-4 годин, з ретельним моніторингом вітальних функцій. Після процедури УЗ дослідження не виконується, якщо у пацієнта немає патологічних симптомів.
Ускладнення
Найбільш поширені ускладнення включають кровотечі і пневмоторакс. Рідше розвивається панкреатит, тільки якщо використовується передній доступ. Поширення пухлинних клітин вздовж каналу голки зустрічається вкрай рідко, найчастіше це зареєстровано при первинній адренокортікальній карциномі. Використання коаксиальної техніки ефективне для зниження поширення пухлинних клітин вздовж каналу голки. В дослідженні Моді і колег, в якому були вивчені безпосередні та віддалені ускладнення черезшкірної біопсії пухлин надниркових залоз в 79 випадках, частота ускладнень була вищою при черезпечінковому доступі (12%), ніж при задньому доступі (8%). Ускладнення включали: пневмоторакс, біль, навколо ниркові крововиливи, субкапсулярні і внутрішньопечінкові гематоми і один випадок метастазу печінки вздовж біопсійного каналу голки.
ВТРУЧАННЯ НА НИРКАХ
Показання
Раніше біопсія пухлин нирки виконувалась для діагностики лімфоми, метастазів, інфекцій або пухлини у хворих з хірургічним ризиком. Проте, в даний час, показання до біопсії нирок – розширені за рахунок включення пацієнтів з: пухлинами нирок та відомого екстраренального первинного злоякісного новоутворення, пухлинами нирок з особливими ознаками, які припускають неоперабельний рак нирки, пухлинами нирок і хірургічним супутніми захворюваннями і пухлинами нирок, які можуть бути викликані інфекцією. Загальноприйняті показання для біопсії включають: пацієнтів з невеликою (до 3 см) гіперденсивною однорідною пухлиною нирки; пацієнтів з пухлиною нирки, підготованих для підшкірної абляції і пацієнтів з невизначеними кістозними пухлинами нирки.
Неприцільні кортикальні біопсії нативних нирок виконуються у пацієнтів з дифузною паренхіматозною патологією, при лабораторних показниках, що вказують на протеїнурію, гематурію або незрозумілу гостру ниркову недостатність. В цьому випадку остаточний діагноз є важливим для призначення лікування (тобто, визначення, чи процес є активним і потенційно зворотнім, чи, навпаки, – хронічним і потенційно незворотнім).
Неприцільні кортикальні біопсії трансплантованих нирок виконуються при нирковій дисфункції. Найбільш частим показанням для біопсії трансплантата нирки є діагностика відторгнення трансплантата.
Протипоказання
До протипоказань неприцільної біопсії відносяться: неконтрольована артеріальна гіпертензія (систолічний артеріальний тиск >180 мм рт.ст.), інфекція нирок або паранефрит.
Виконання процедури
Пересаджена нирка потребує тільки місцевої анестезії, так як вона вже не інервуєтся. Для біопсії нативних нирок пацієнт повинен лежати на животі або, можливо, в косому положенні на боці. Подушка або валик повинні бути поміщені під нижню частину живота пацієнта, щоб випрямити природний лордоз хребта і полегшити визначення точки входу голки над відповідною ниркою. Підреберний доступ часто використовується для виключення плеврального проколу. Біопсія нижнього полюса кори, як правило, виконується якомога ближче до її периферії, щоб уникнути контакту з нирковими воротами або судинами. Черезшкірна біопсія пересадженої нирки може бути технічно простішою, ніж біопсія нативних нирок, враховуючи поверхневе розташування алотрансплантата нирки в тазу (Рис. 14 і 15). Пацієнт може лежати на спині в більшості випадків.
Для біопсії пухлин нирок використовується кор-біопсія голкою №18, а також FNA (Рис. 16). Ниркові коркові біопсії виконуються біопсійним пістолетом з голкою №18 або більше, так як менший діаметр надає занадто тонкий стрижень тканини, що не забезпечує адекватним біопсійним матеріалом. Відповідний розмір голки, як правило, визначається вимогами патологоанатомічного відділення. Деякі патологоанатомічні відділення запрошують бути присутнім цитолога при біопсії для забезпечення вибору зразка оптимального розміру і кількості. Двох або трьох зразків, кожен – 2 см в довжину, – часто достатньо для постановки діагнозу. Як правило, один зразок поміщають в 10% формалін для світлової мікроскопії, а інший в 2,5% глутаровий альдегід для електронної мікроскопії. Зразок для імунофлюоресцентного аналізу, як правило, поміщають в розчин Зевса (Zeus (Michel)).
Рис. 14. УЗД біопсія нирки після трансплантації (у виконанні нефролога) з неналежним розміщенням кінчика голки (стрілки) в нирковій мисці.
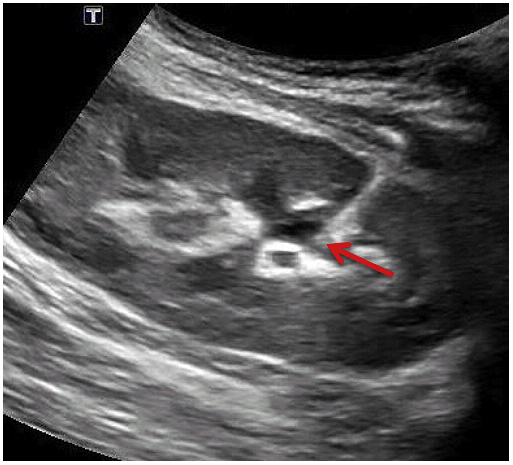
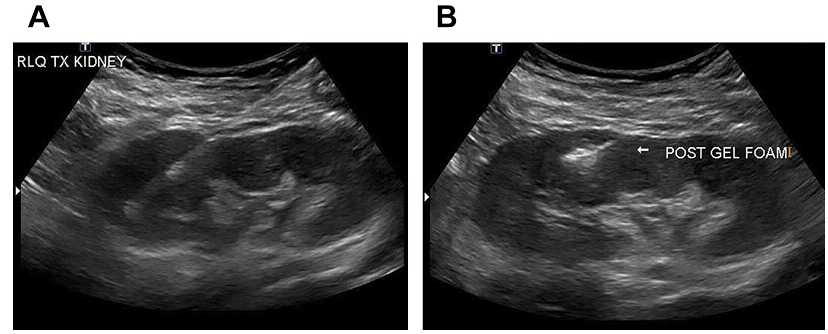
Рис. 15. УЗД біопсія нирки після трансплантації здійснюється радіологом з відповідним розміщенням кінчика голки у верхньому полюсі правого нижнього квадранта трансплантанта нирки (А). Була виконана емболізація гелевою піною (В).
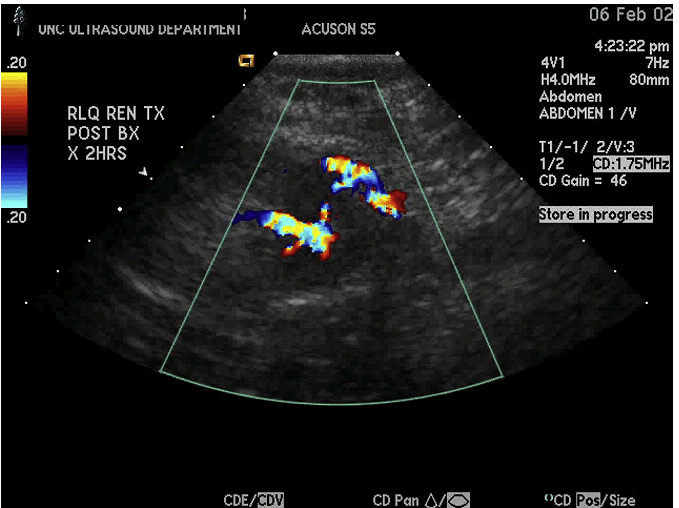
Якщо є побоювання на користь лімфопроліферативного посттрансплантаційного розладу, виконується додаткова кор-біопсія або проточний цитометричний аналіз. Під час біопсії пухлин нирок повинен бути присутнім цитолог, щоб забезпечити взяття відповідних зразків тканини. Як тільки голка витягнута, може бути використана кольорова доплерографія для оцінки можливої кровотечі з місця біопсії. Кровотеча, як правило, зупиняється пальцевим притисненням від 5 до 10 хвилин. Можна також провести емболізацію каналу гелевою піною.
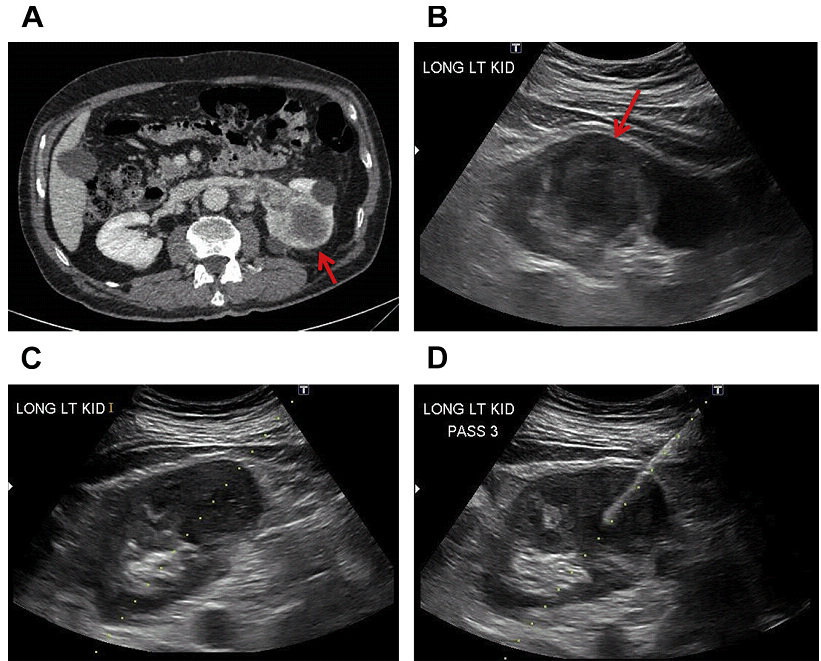
Рис. 16. УЗД біопсія пухлини лівої нирки (A, B, стрілка) у пацієнта з раком сечового міхура. Було проведено три проходи голкою №18 з використанням коаксіальної техніки (C, D). При дослідженні виявлена високодиференційована інвазивна уротеліальна карцинома.
Післяпроцедурне спостереження
Після процедури, пацієнти повинні знаходитися в ліжку протягом 4-6 годин залежно від політики відділення, з ретельним моніторингом життєво важливих функцій.
Ускладнення
Ускладнення включають: кровотечу, гематурію, псевдоаневризму, артеріовенозні фістули, пневмоторакс і поширення пухлинних клітин вздовж каналу голки. Невелика кровотеча є найбільш частим ускладненням і, як правило, зупиняється самостійно (Мал. 17).
Мал. 17. Кровотеча, пов’язана з біопсією нирки.
Це кровотеча зазвичай виявляється під час біопсії і зводиться до мінімуму застосуванням компресії під УЗД наведенням після біопсії. Гематурія, як правило, не виражена, але важливо, щоб пацієнти були в курсі цього. В одному дослідженні гематурія була в 5-7% пацієнтів.
Менш поширені ускладнення включають псевдоаневризму і артеріовенозні фістули, утворення, які часто протікають безсимптомно і вирішуються самостійно, але можуть викликати стійкий біль і кровотечу. Якщо спонтанного вирішення не відбувається, виконується транскатетерна емболізація. Пневмоторакс є рідкістю, але може розвиватися, якщо використовується міжреберний доступ. Поширення пухлинних клітин вздовж каналу голки – рідкісне ускладнення, менше 0,01% випадків. Таким чином, це не слід розглядати, як стримуючий фактор для біопсії.
ВТРУЧАННЯ НА СЕЛЕЗІНКИ
Показання
Черезшкірні втручання на селезінки не так часто виконується, як і в інших органах, швидше за все, через великий ризик розвитку кровотечі. Проте, існують дані, що свідчать про те, що черезшкірні втручання на селезінці безпечні у дорослих і дітей, і не є технікою значного ризику післяпроцедурних ускладнень. Основні показання для біопсії селезінки включають невизначене тверде або кістозне ураження у пацієнта з відомими позаселезіночними новоутвореннями, а також характеристика ураження селезінки у пацієнтів із встановленою або підозрюваної лімфомою. Інші показання включають: катетерне дренування і аспірація інфікованої рідини або абсцесів, спиртова абляція симптоматичних кіст селезінки і кіст ехінококової природи. У 10-річному огляді черезшкірних втручань на селезінці Lucey і колег частота успішних втручань склала 91% для біопсії селезінки, 100% для аспірації рідини і 86% для дренування рідини.
Виконання процедури
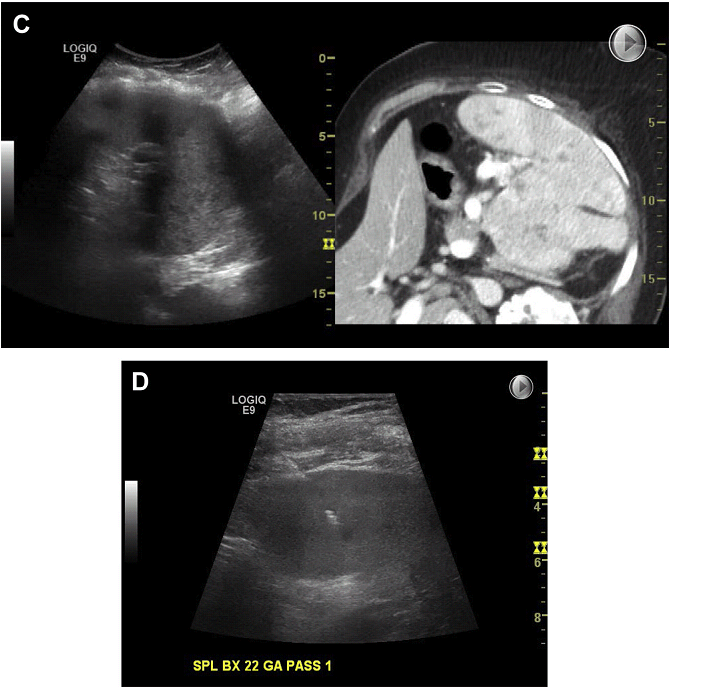
І підреберний, і міжреберний доступи можуть бути використані залежно від розташування селезінки. Міжреберний доступ частіше пов’язаний з ризиком пневмотораксу та кровотечі, якщо пошкоджується плевра або міжреберна артерія. Якщо мається множинне ураження селезінки, тоді кращим для біопсії є вогнище, розташоване ближче до периферії, щоб уникнути контакту з воротами селезінки. Розміри голок для кор-біопсії варіюють від №18 до №20 і для FNA – від №18 до №22 калібру (Мал. 18). Якщо необхідно, то вводиться желатинова губка в місці каналу голки. Для катетеризації інфікованої рідини і абсцесів, використовуються катетери від 8F до 12F, залежно від в’язкості рідини, отриманої спочатку.
Троакарний спосіб звичайно використовується частіше, ніж техніка Сельдингера. Хороший догляд за катетером, у тому числі його промивання 10-мл фізіологічним розчином, має важливе значення для адекватного дренування. Методики лікування кіст селезінки і ехінококових кіст – дивіться процедури, використовувані для лікування кіст печінки вище.
Ускладнення
Найбільший ризик при біопсії селезінки – це кровотеча, яке призводить до гіпотензивного шоку. Якщо це трапилося, необхідно проведення агресивної інфузійної терапії та переливання крові, і, якщо це необхідно, – емболізація селезінки або спленектомія. Також можливий пневмоторакс, якщо використовується міжреберний доступ, а також пошкодження ободової кишки. Імовірно, частота ускладнень для втручань на селезінці не суттєво більша, ніж при біопсії інших органів черевної порожнини.
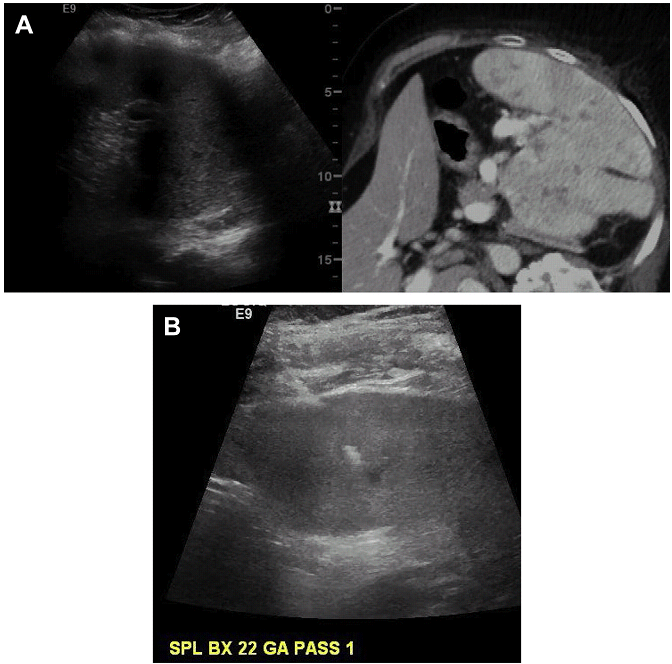
Мал. 18. Біопсія селезінки. (A) Кілька невеликих уражень селезінки. Суміщення з КТ допомагає локалізувати вогнище при УЗД візуалізації. (В) При ФНК з осередку ураження селезінки – лімфома. (C) Налаштування зображення невеликого осередку ураження селезінки, поєднане з КТ. (D) Суміщення з КТ допомагає прицільно знайти вкрай малий осередок ураження для біопсії.
Тим не менш, це може бути пов’язано з тим, що біопсії селезінки виконуються набагато рідше, ніж біопсії інших органів. В дослідженні, в якому виконано 147 біопсій, важкі ускладнення, що вимагають спленектомію були зареєстровані в 1,9%, а частота малих ускладнень склала 14,7%. Проте, у дослідження Lucey і колег було виконано 24 біопсії, в якому у одного пацієнта розвилася невелика кровотеча, яке не потребувала подальшого втручання, в той час як у одного пацієнта розвилася значна кровотеча, що потребувало спленектомії. Обидві ці біопсії проводилися як FNA. Ризик ускладнень збільшувався в іншому дослідженні при використанні більшого діаметра голок №14 CNB; однак, значних ускладнень не спостерігалося при використанні голки №18, або менше при кор-біопсії.. В дослідженні, проведеному Venkataramu і колегами, FNA уражень селезінки провели у 35 пацієнтів спінальною голкою №22. Був відзначений тільки 1 випадок внутрішньочеревної кровотечі, який не потребував втручань. Ризик суттєвої кровотечі, що вимагає спленектомії, є вищим при дренуванні селезінки. Це ускладнення спостерігалося у 1 з 7 пацієнтів в дослідженні Lucey і колег і у 1 з 9 пацієнтів в дослідженні Tasar і колег. Кровотечі, пов’язані з біопсією селезінки, за даними літератури, зустрічаються від 0% до 2%, що аналогічно частоті ускладнень при біопсії інших черевних і тазових органів.
ВТРУЧАННЯ В ПОРОЖНИНИ ТАЗА
Показання
Показання включають дренування скупчень рідини, таких як: сероми, лімфоцеле і абсцеси, що найчастіше виникають при дивертикуліті, апендициті і запальних захворюваннях органів малого таза, а також дренуванні лімфоцеле. Біопсія тазових пухлин також може бути виконана під контролем УЗД.
Виконання процедури
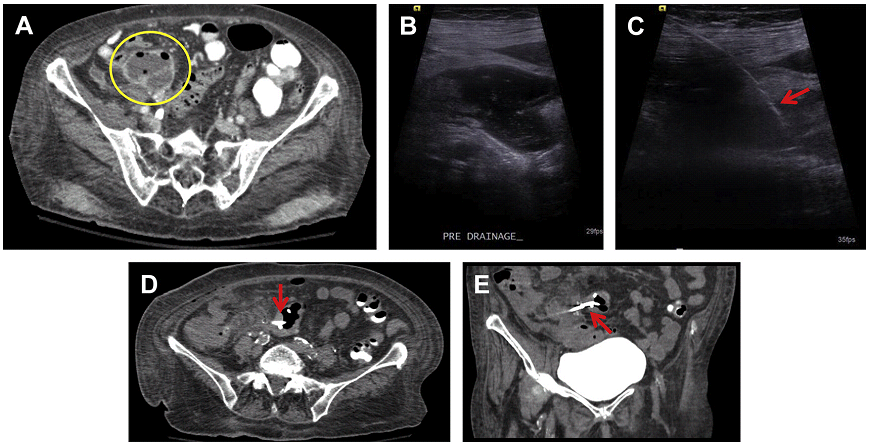
Кілька доступів використовуються для дренування скупчення рідини в тазі, залежно від її розташування. Ці доступи включають: черезшкірний (трансабдомінальний (Рис. 19) і транглютеальний) і внутрішньопорожнинний (трансвагінальний (Рис. 20) і трансректальний) методи.
Рис. 19. Дренування під УЗД наведенням з трансабдомінального доступу периапендикулярного абсцесу (А, В) – вторинного, через перфорацію червоподібного відростка. Після розміщення 8.5F pigtail катетера (C, стрілка) в абсцесі (А, коло), використовуючи техніку Сельдингера. Була виконана КТ для підтвердження відповідності розташування. КТ (D, Е) показала ненавмисне попадання pigtail катетера (стрілка) за порожнину абсцесу в сусідню сигмоподібну кишку. Pigtail катетера був залишений на місці до утворення нориці.
Транглютеальний доступ дозволяє отримати доступ до більш глибоких частин таза, в тому числі позаду прямої та сигмоподібної кишки. Седація свідомості, як правило, виконується часто на додаток до місцевих анестетиків, так як цей доступ вважається більш болючим. У пацієнтів в положенні на спині, використовуються вигнуті датчики 3-5 МГц для локалізації скупчення рідини через великий сідничний отвір, використовуючи його, як еховікно. Для цього доступу, місце пункції повинно бути каудальним і якомога ближче до крижів або куприка, щоб уникнути пошкодження великих судинно-нервових структур (сідничного нерва і сідничних судин), які проходять латерально через великий сідничний отвір, спереду і вище грушоподібного м’яза. Використовуються кісткові орієнтири, а точка входу повинна бути якомога ближче і каудальніше до куприка. Дренажний катетер повинен пройти нижче отвору і на рівні, або нижче рівня крижово-остистої зв’язки.
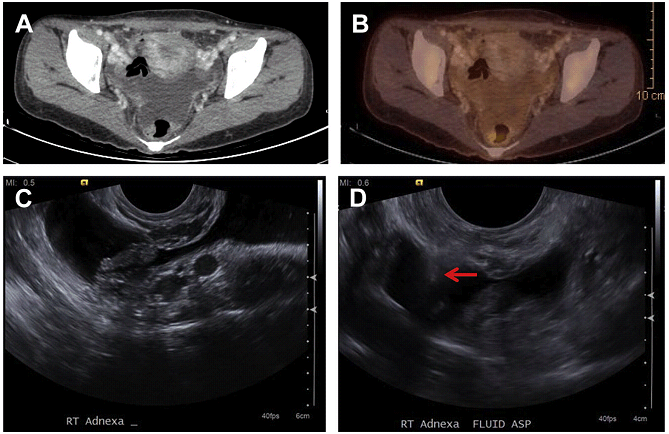
Рис. 20. Трансвагінальна аспірація асциту малого таза під УЗД наведенням у хворого з аденокарциномою шлунка (C). На попередній ПЕТ-КТ (A, B) дифузне невелике збільшення активності фтордезоксіглюкози (макс. стандартне значення поглинання1.7) – підозра на карциноматоз. Голка №20 Chiba (D, стрілка) введена в скупчення вільної рідини в тазу трансвагинально під УЗД контролем в реальному часі. Цитологія показала метастатичну аденокарциному.
Трансректальний і трансвагінальний доступи вимагають використання внутрішньопорожнинного датчика. Порівняно з транглютеальним доступом, вони вважаються безпечними в тому сенсі, що вони дозволяють уникнути пошкодження великих судинно-нервових структур. Трансвагінальний катетер відмінно підходить для дренування рідини в кишені Дугласа (Мал. 20). Для порожнин, розташованих глибоко в малому тазі і пальпуємих через пряму кишку, ефективним є трансректальний доступ. Седація та/або місцева анестезія може використовуватися, але не так важлива, як для транглютеального доступу. Як правило, використовується внутрішньопорожнинний 7-МГц датчик, а дренаж фіксується до його захисної оболонки. Троакарна техніка зазвичай використовується для введення катетера в скупчення рідини під безпосереднім УЗД контролем.
Післяпроцедурне спостереження
Забруднення катетера можна звести до мінімуму, ретельно доглядаючи за ним після процедури. Рекомендується щодня промивання катетера 10 мл фізіологічного розчину. Моніторинг відокремлюваного дозволяє видалити катетер після забезпечення ефективного дренування. Для складних абсцесів або гематом, рекомендується введення через катетер тромболітиків.
Ускладнення
Безпосередні ускладнення після процедури в основному включають біль і кровотечу. Біль з іррадіацією в ногу є вторинним через розміщення катетера занадто латерально і проксимально до сідничного нерву, що трапляється при транглютеальному доступі. Цей біль розвивається найчастіше через трансгрушеподібний доступ і пошкодження сакрального сплетення, яке знаходиться спереду грушоподібного м’яза. Такої ситуації слід уникати, розміщаючи катетер нижче грушоподібного м’яза. Вторинні кровотечі відбувається внаслідок пошкодження верхніх і нижніх сідничних судин, що лежать попереду грушоподібного м’яза. Поміщаючи катетер нижче грушоподібного м’яза, можна уникнути цього ускладнення.
В огляді трансвагінального дренування рідини в тазу (45 аспірацій і 40 катетерних дренувань), клінічний успіх досягнуто в 75% випадків. Малі ускладнення включали: випадкове пошкодження сечового міхура, інфекції, катетер-асоційований біль і передчасне зміщення катетера.
ПАРАЦЕНТЕЗ
Показання
Парацентез є одним з найбільш часто виконуваних черевних втручань. Він носить як діагностичний характер, в тому числі для оцінки інфекції або злоякісного процесу, так і терапевтичний – зниження внутрішньочеревного тиску при великому обсязі асциту.
Виконання процедури
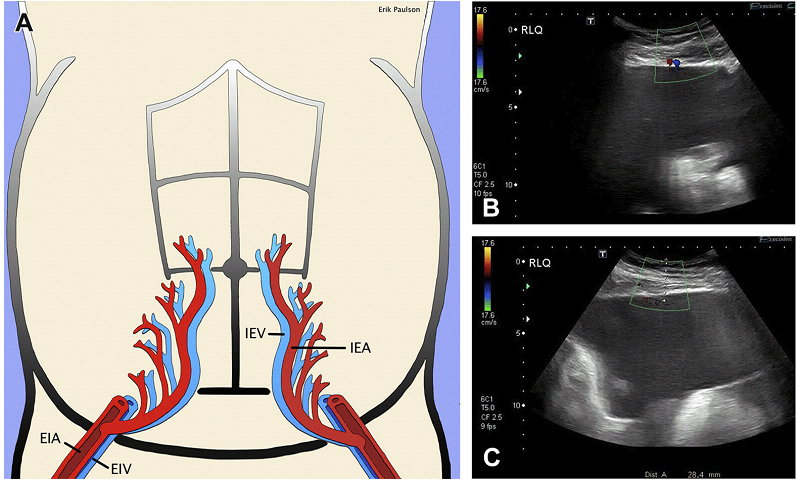
Пацієнт розташовується з піднесеним узголів’ям ліжка так, щоб рідина накопичувалася в нижній частині живота. Оптимальне місце пункції повинно бути в найбільшій кишені рідини, де немає епігастральних судин (Мал. 21), як правило, один з нижніх квадрантів.
Мал. 21. Діаграма нижніх епігастральних судин. (A) Нижні епігастральні артерії і вени і їх перфоранти (збільшені, червоний і синій). Слід їх уникати під час пункції. Можуть бути візуалізовані на кольоровому доплерівському зображенні. (B) Кольоровий доплер над правим нижнім квадрантом – нижні епігастральні артерія і вена. (С) Більш бічне позиціонування над правим нижнім квадрантом – безсудинна зона. EIA – зовнішня клубова артерія; EIV – зовнішня клубова вена; IEA – нижні епігастральні артерія і IEV – вена.
Середня лінія між лобком і пупком також може використовуватися в якості доступу, якщо можливо уникнути травми сечового міхура. Багато пацієнтів, відправлених на парацентез, мають цироз з портальною гіпертензією, тому попереднє сканування з кольоровим доплером для оцінки портосистемних анастомозів та інших судин до проколу тканин – обов’язкова умова. Більшість комплектів для парацентеза включають 5F голку з пластиковою оболонкою. В установі авторів використовується 5F Yueh катетер. Ультразвуковий контроль під час руху голки особливо важливий, якщо обсяг рідини малий, а також для виявлення рухомих петель кишківника. Після того, як голка видалена, оболонка залишається на місці для проведення пасивного або вакуумного дренування рідини. При видаленні великого обсягу асциту (> 5 л), необхідно внутрішньовенне введення сироваткового альбуміну (8 г/л) або Терлопрессіна для запобігання гіпотонії.
Ускладнення
Ускладнення включають: кровотечу, інфекцію, перфорацію кишківника і гіпотонію.
РІЗНЕ
Заочеревинні втручання, наприклад, біопсія лімфатичного вузла під УЗД наведенням, має свої переваги перед КТ, включаючи: візуалізацію голки в режимі реального часу, мультипланарної можливості та зменшення відстані до цілі. Якщо УЗД візуалізація проблематична, також може бути розглянутий черезпечінковий доступ. Підшкірні скупчення рідини поширені в післяопераційному періоді і легко піддаються УЗД дренуванню з урахуванням їх поверхневого розташування. Ці скупчення рідини зазвичай включають: післяопераційні сероми, гематоми або інфіковану рідину. Проста аспірація або катетерне дренування також може використовуватися. Підшкірні утворення є сонографічно легко доступними. Якщо підозрюється саркома, то траєкторія голки повинна бути обрана відповідно до хірургічного доступу.
Сальник добре видно при УЗ дослідженні, коли він потовщений. Враховуючи поверхневе розташування сальника і можливість диференціювання його від кишківника в реальному часі, сальникова біопсія під УЗ контролем – дуже ефективна (Мал. 22).
Мал. 22. Біопсія сальника. УЗД біопсія сальника. Технологія суміщення допомагає виявити найбільш потовщену ділянку м’яких тканин (стрілка, КТ), щоб визначити доступ при біопсії (стрілка, УЗД) і уникнути проколу печінки. Продемонстрована патологія – лімфома.
Легкий тиск датчиком може допомогти зменшити відстань до мішені та зафіксувати мобільні ділянки, якщо це необхідно.
До серозних вогнищ може бути застосований подібний підхід, як і при ураженні сальника, але, як правило, вони більш фіксовані, так як розташовані уздовж органа (Мал. 23). Повинні бути вжиті заходи, щоб не проколоти підлеглі органи, якщо це можливо.
Втручання на підшлунковій залозі, такі як: дренування псевдокіст або абсцесів, біопсія підшлункової залози, можуть виконуватися з використанням різних методик, в тому числі: ендоскопічної сонографії, хірургічно і черезшкірної сонографії або КТ наведенням. Ендоскопічна сонографія використовується частіше, так як це вона дозволяє уникнути необхідності відкритого розрізу або зовнішнього дренажного катетера. Черезшкірне дренування інтрапанкреатичної або перипанкреатичної рідини може бути виконано під УЗД контролем. Однак, панкреатичний протік може бути пов’язаний з процесом, що призводить до збільшення часу дренування. КТ може краще відобразити інтрапанкреатичну або перипанкреатичну рідину, відношення до інших анатомічних структур, особливо до шлунку і кишківника.
Мал. 23. Серозне вогнище по краю печінки у пацієнта з гіпоехогенним утворенням підшлункової залози. (А) КТ зображення демонструє утворення підшлункової залози (жовта стрілка) і серозне вогнище вздовж печінки (червона стрілка). (B) УЗД зображення показало серозне вогнище з можливим кровотоком. (C) Біопсія серозного вогнища FNA (червона стрілка). Також була проведена CNB. Була доведена аденокарцинома підшлункової залози, а не вторинний метастаз.
Черезшкірна холецистостомія під УЗД наведенням зазвичай є інтервенційна процедура при лікуванні гострого холециститу у хворих в критичному стані, які не є кандидатами на операцію. Для зменшення ускладнень повинен бути використаний через печінковий доступ. Іноді, УЗД контроль також може бути використаний при біопсії уражень жовчного міхура, також використовуючи печінковий доступ. Ускладнення включають: кровотечу, витікання жовчі і перитоніт.
КЕРІВНИЦТВО ПО СУМІЩЕННЮ КТ, МРТ, ПЕТ
Суміщення УЗ зображень з КТ, МРТ, і ПЕТ є новою технологією, яка використовується для процедур під УЗД наведенням. Найбільшого поширення це знайшло в біопсійній абляції печінки, але може бути використано практично в будь-якій частині тіла. Ця технологія дозволяє в режимі реального часу синхронізувати КТ або будь-яке багатоплощинне реконструйоване зображення з відповідною УЗД картиною. Вона проводиться на робочій станції з вбудованим програмним забезпеченням – суміщення зображень і УЗД обладнання з магнітним пристроєм стеження за рухом. Магнітний датчик прикріплюється до регістрів сонографічного датчика і передає положення й орієнтацію зонда на робочу станцію, в яку раніше завантажені дані КТ, МРТ або ПЕТ пацієнта. Потім генерується суміщене зображення і відображається або до УЗД картини, або до суміщеного зображення, наприклад КТ.
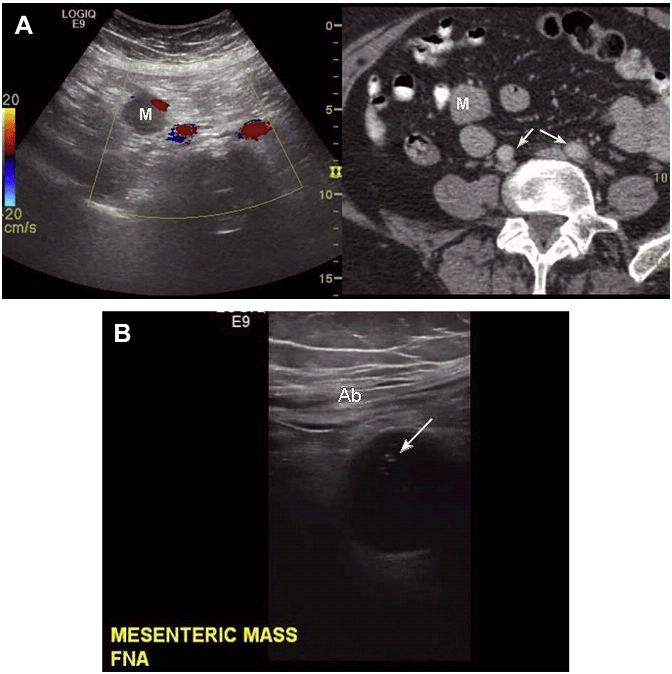
Якщо ураження важко візуалізувати за допомогою звичайного УЗД, це може привести до підвищеної радіаційної експозиції (через використання КТ), неадекватності біопсії і збільшення числа проходу голок (через недостатню кількість матеріалу). Суміщення зображень чи віртуальна КТ, МРТ або ПЕТ-УЗД, вирішує ці проблеми шляхом захоплення вогнища ураження в зображення, отримане іншими методами, яке не чітко візуалізується при УЗ дослідженні для біопсії або абляції (Мал. 24 і 25).
Перевагами використання технології суміщення УЗД є: режим реального часу зображення, простота відображення проведення втручання і відсутність радіаційної експозиції.
Мал. 24. Біопсія за допомогою суміщення ультразвуку з МРТ. Біопсія невеликого центрального ураження печінки близько стовщеної жовчної протоки (стрілки), яке краще видно на МРТ. УЗД зображення синхронізуються з МРТ і після цього виконується УЗД біопсія вогнища ураження. Біопсія показала холангіокарціному.
Мал. 25. Біопсія за допомогою суміщення ультразвуку з КТ. (А) Малі ураження брижі видно на КТ (М), а потім і на УЗД, коли зображення суміщені. Кольоровий доплер показує кровотік в клубових судинах (стрілки на КТ). Притиснення датчиком допомагає відтіснити кишківник і, таким чином, може бути виконана біопсія. (B) FNA біопсія, оминаючи кишківник і кровоносні судини, виконана успішно (стрілка).
РЕЗЮМЕ
УЗД є першочерговим методом візуалізація патології при діагностичних і лікувальних втручаннях в черевній порожнині. Можливість візуалізації в режимі реального часу траєкторії голки, її розміщення й виявлення кровоносних судин та інших важливих структур на шляху голки, без використання іонізуючого випромінювання – переваги УЗД методу проти КТ. Швидкість виконання процедури, портативність і низька вартість – додаткові переваги. Технологія суміщення дозволяє УЗД зображення накласти на КТ, МРТ і ПЕТ, щоб краще локалізувати пошкодження. Крім того, використання навідної голки і технологія об’ємної навігації допомагає точному націлюванню на складні ураження. З постійним розвитком досягнень в УЗД апаратах і технології виробництва датчиків, УЗД технології знаходять все більше застосування.
УЗД апарат Samsung Medison Accuvix V10 – краща пропозиція від компанії RH.
ДОДАТКОВІ ДАНІ
Відео, пов’язані з цією статтею можна знайти в Інтернеті за адресою:








14.10.2019
Лиза