Резюме
Дискусійним залишається питання, яка голка має явну перевагу в діагностичній ефективності при ендоскопічній ультразвуковій (ЕУЗД) тонкоголковій біопсії (ТГБ) солідних утворень підшлункової залози. Метою цього дослідження було порівняти ефективність трьох голок і визначити змінні, які впливають на точність діагностики. З березня 2014 року по травень 2020 року було ретроспективно проаналізовано 746 пацієнтів із солідними утвореннями підшлункової залози, яким було виконано ЕУЗД-ТГБ з використанням трьох типів голок (голка Franseen, голка з вістрям Menghini та голка зі зворотним скосом). Для виявлення факторів, пов’язаних з точністю діагностики, використовували багатовимірний аналіз з використанням логістичної регресійної моделі. Були виявлені значні відмінності між групами щодо частоти отримання гістологічного матеріалу та його оптимальної якості (Franseen проти вістря Menghini проти голки зі зворотним скосом: 98,0% [192/196] проти 85,8% [97/113] проти 91,9% [331/360], P < 0,001 та 95,4% [187/196] проти 65,5% [74/113] проти 88,3% [318/360], P < 0,001, відповідно). Чутливість і точність при використанні гістологічних препаратів становила 95,03% і 95,92% для голок Franseen, 82,67% і 88,50% для голок з вістрям Menghini і 82,61% і 85,56% для голок зі зворотним скосом, відповідно. При прямому порівнянні голок з використанням гістологічних зразків, голка Franseen показала значно вищу точність, ніж голка з вістрям Menghini (P = 0,018) і голка зі зворотним скосом (P < 0,001). Багатофакторний аналіз показав, що розмір пухлини ≥ 2 см (відношення шансів [ВШ] 5,36, 95% довірчий інтервал [ДІ] 3,40-8,47, P < 0,001) і віялова техніка (ВШ 1,70, 95% ДІ 1,00-2,86, P = 0,047) були достовірно пов’язані з точним діагнозом. ЕУЗД-ТГБ з використанням голки Franseen дозволяє отримати більший і якісніший гістологічний матеріал і досягти точного гістологічного діагнозу при використанні віялової техніки (взяття 2-3 фрагментів матеріалу з декількох місць).
Вступ
Хоча ендоскопічна ультразвукова діагностика (ЕУЗД), включаючи тонкоголкову аспірацію (ТГА) та тонкоголкову біопсію (ТГБ), є стандартною методикою для встановлення остаточного діагнозу та складання індивідуального терапевтичного плану при солідних пухлинах підшлункової залози 1, повідомляється, що діагностична ефективність має широкий діапазон залежно від типу голки. Нещодавно було анонсовано кілька модифікованих голок, спеціально розроблених для отримання гістологічного матеріалу з інтактною архітектурою, щоб подолати ці обмеження конкретних типів голок 2. Ці пристрої, що отримали загальну назву голки ТГБ, були оснащені унікальною формою кінчика голки, яка має або бічну фенестровану щілину (пастка біопсійного матеріалу), або спеціальну геометрію ріжучого кінчика, в той час як стандартні голки без цих підсилюючих геометрій класифікуються як голки ТГА 3.
Спочатку була розроблена нова голка ТГБ зі зворотним скосом у вигляді бічного фенестрованого отвору на стрижні голки, яка в даний час доступна на ринку у трьох калібрах (19, 22 і 25). Теоретично, вона може отримати основну тканину, зачепивши, розрізавши і захопивши її під час руху вперед-назад. Незважаючи на гіпотетичне припущення, що конструкція зі зворотним скосом дозволить отримати великий шматок тканини зі збереженням гістологічної структури, може знадобитися спеціальний маневр (наприклад, вишкрібання за допомогою сили тяги) під час руху вперед-назад, оскільки вона не має вбудованої системи різання 2. Зовсім недавно була розроблена голка Franseen, яка має новий дизайн з коронкоподібним вістрям з триплощинними симетричними ріжучими краями, що полегшує отримання більших за розміром тканин ядра.
Хоча останні клінічні настанови 3,4 припускають, що будь-який конкретний тип голки, включаючи голки ТГА або ТГБ, не гарантує вищої діагностичної точності, ніж інші, при заборі тканин під контролем ЕУЗД при солідних пухлинах підшлункової залози, голки ТГБ, як правило, використовуються для отримання достатнього зразка тканини для диференціації різних пухлин за допомогою імуногістохімічного (ІГХ) забарвлення 5,6.
Визначення оптимального типу голки для точної діагностики, особливо за відсутності швидкої цитологічної оцінки на місці (ROSE), є критично важливим для отримання тканини під контролем ЕУЗД при солідних пухлинах підшлункової залози; однак існує мало переконливої інформації щодо відносної діагностичної ефективності при порівнянні з різними типами голок. Тому, щоб надати більше доказової інформації на цю тему, ми порівняли діагностичну ефективність залежно від типу голки (голка Franseen проти голки зі зворотним скосом проти стандартної голки ТГА) і визначили змінні, які впливають на діагностичну результативність злоякісності при ЕУЗД-керованому заборі тканини солідних пухлин підшлункової залози.
Методи
Пацієнти
Це було багатоцентрове ретроспективне дослідження, проведене в Університетській лікарні Аджоу, лікарні Святого Серця Донгтан при Університеті Халлім та лікарні Бунданг при Сеульському національному університеті. У дослідження були включені пацієнти, яким послідовно виконували ЕУЗД-ТГБ або ЕУЗД-ТГА з приводу солідних пухлин підшлункової залози. Пацієнти з кістозним компонентом в утвореннях без солідного компонента з підозрою на злоякісну трансформацію були виключені. Демографічні, клінічні та ендоскопічні дані були отримані з комп’ютеризованої клінічної інформаційної системи за попередні 7 років (з березня 2014 року по травень 2020 року). Схвалення Інституційної наглядової ради було отримано від лікарні Святого Серця Донгтан Університету Халліма (номер файлу IRB: 2021-08-011). Крім того, всі процедури були виконані відповідно до етичних стандартів, викладених у Гельсінській декларації. Необхідність отримання інформованої згоди була скасована через ретроспективний характер цього дослідження Інституційною наглядовою радою Комітету з питань етики лікарні Святого Серця при Халлімському університеті Донгтан.
Ендоскопічні процедури для ЕУЗД-ТГА або ТГБ
Всі процедури виконували за допомогою ехоендоскопа з лінійною матрицею (EG-530UT2, Fujifilm Medical Systems, Токіо, Японія або UCT 260, Olympus Medical Systems, Токіо, Японія) досвідченими ендоскопістами (M.J.Y., J.K. і S.W.P.), які виконували понад 100 випадків ЕУЗД-ТГА або ТГБ на рік відповідно до добре відпрацьованого стандартного протоколу 7. ЕУЗД-ТГБ виконували біопсійною голкою (Franseen; Acquire; Boston Scientific (зорб. 1A) або Голка зі зворотнім скосом; EchoTip ProCore; Cook Endoscopy (зорб. 1B)) або ЕУЗД-ТГА голкою з вістрям Menghini (EZ shot3, Olympus Medical Systems, Токіо, Японія (зорб. 1C)) відповідно до характеристик і розташування пухлини підшлункової залози та вподобань ендоскопіста. Крім того, розмір використовуваної голки (22-го або 25-го калібру) обирали на розсуд ендоскопістів. Після підтвердження відсутності судин на очікуваній траєкторії голки за допомогою кольорового доплера, голка, встановлена на стилет, використовувалася для проколу шлунка для дослідження тіла/хвоста або дванадцятипалої кишки для дослідження голівки/гачкуватого відростка. Після проколу вогнища ураження стилет виймали, і виконували приблизно 10-20 рухів вперед-назад в межах ділянки утворення під час кожного проходження голки з безперервним відсмоктуванням за допомогою шприца об’ємом 10-20 мл, наданого виробником. Зокрема, 10 мл негативного відсмоктування було виконано при застосуванні голки зі зворотнім скосом, а 20 мл негативного відсмоктування було виконано при застосуванні голок EZ shot3 та Franseen. Крім того, ЕУЗД-ТГА або ТГБ повторювали до отримання достатньої кількості видимої основної тканини, хоча оптимальна кількість проходів голки визначалася на розсуд ендоскопістів 8. ROSE не була доступна в жодній установі.
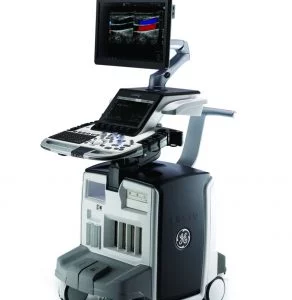
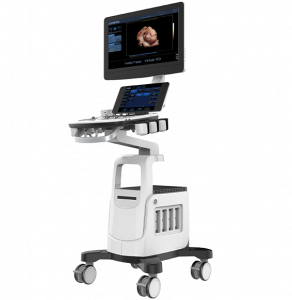
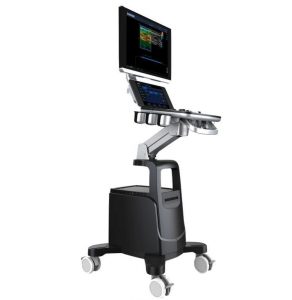
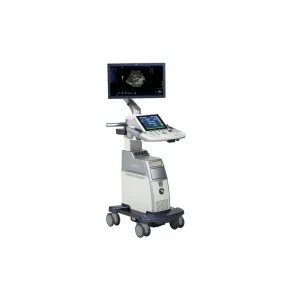
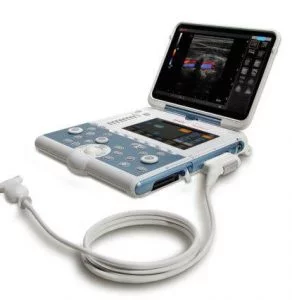
Зображення 1
(A) Голка Franseen має новий дизайн корончатого наконечника з симетричними ріжучими кромками в трьох площинах. (B) Голка зі зворотним скосом має систему зворотного скосу у вигляді бічного фенестрованого отвору на стрижні голки. (C) Голка з вістрям Menghini має конічну скошену кромку, яка полегшує виведення тканини в просвіт. Хоча вона має бічний отвір, вона класифікується як голка ТГА, оскільки бічний отвір цієї системи голок не має жодних посилюючих геометричних елементів для розрізання тканини.
Цитопатологічний аналіз з використанням кожної голки ТГБ
У цьому дослідженні цитологічні та гістологічні оцінювання виконувалися одним цитопатологом з досвідом роботи в галузі панкреатології в кожній установі. Зразки, отримані з кожного проходження шляхом введення стилета з голкою, повністю фіксували в 50% етанолі для оцінки клітинних блоків і в пляшках з формаліном для гістологічної експертизи 9. Підготовлені гістологічні зразки, зафіксовані в розчинах формаліну, повторно обробляли в касетній формі, поміщали в парафін і готували до фарбування гематоксиліном і еозином (Г та Е) для оцінки тим же патологоанатомом. За необхідності застосовували спеціальне фарбування, наприклад, ІГХ-фарбування, щоб відрізнити пухлинні клітини від регенеративної атипії або атипових пухлин, таких як лімфома, метастатична карцинома, солідні псевдопапілярні пухлини або навіть нейроендокринні пухлини. Якщо гістологічний матеріал не було отримано, цитопатолог обробляє той самий матеріал, що і клітинний блок для цитологічного аналізу.
Визначення результатів та референтних критеріїв для діагностики доброякісних або злоякісних утворень підшлункової залози
Первинним результатом цього дослідження була діагностична ефективність голок. Вторинні результати були визначені як частота отримання біопсійного матеріалу оптимальної якості для гістологічної оцінки відповідно до голок, що використовувалися для процедури ЕУЗД-ТГБ, пов’язані з процедурою небажані явища та змінні, що впливали на точність діагностики в моделі логістичної регресії. Зокрема, достатня кількість видимої основної тканини визначалася як білуваті або червонуваті шматочки тканини з видимим об’ємом на фільтрувальному папері або предметному скельці 10.
Остаточний діагноз був встановлений як злоякісне або доброякісне утворення на основі одного з наступних референтних критеріїв: (а) точний діагноз, встановлений на основі оцінки хірургічно резектованих постійних зразків у прооперованих пацієнтів, (б) смертність, специфічна для захворювання, і (в) відсутність ознак регресії або прогресування захворювання протягом більш ніж 6-місячного періоду спостереження за даними клінічного та радіологічного обстеження тільки у випадках підозри на доброякісне захворювання на момент проведення ЕУЗД-ТГБ 7,11,12. При первинній класифікації як точної або підозрілої злоякісності на основі клітинного блоку або гістологічного аналізу за допомогою ЕУЗД-ТГА або ТГБ випадки, підтверджені як злоякісні в остаточному діагнозі, вважалися істинно позитивними, тоді як ураження, які були остаточно діагностовані як доброякісні захворювання після клінічного спостереження, вважалися хибнопозитивними. Аналогічно, якщо початкові доброякісні результати були остаточно діагностовані як доброякісні захворювання, вони вважалися істинно-негативними, тоді як ті, що були підтверджені як злоякісні в остаточному діагнозі, вважалися хибно-негативними. Крім того, недіагностичні результати, включаючи недостатню кількість зразків, вважалися хибнонегативними, оскільки процедура не дозволила поставити діагноз 13.
Статистичний аналіз
Неперервні змінні були представлені у вигляді середнього значення та стандартного відхилення і порівнювалися за допомогою t-критерію Стьюдента. Категоріальні змінні були представлені у вигляді чисел (відсотків) і порівнювалися за допомогою χ2-критерію. Для оцінки зв’язку між клінічними та ендоскопічними змінними, включаючи тип голки, з точним діагнозом застосовували одновимірні та багатовимірні логістичні регресійні моделі. Змінні, які виявилися значущими (P < 0,20) в однофакторній моделі, були введені в багатофакторну логістичну регресійну модель. Діагностична чутливість, специфічність, точність, позитивна прогностична цінність (ППЦ) і негативна прогностична цінність (НПЦ) були оцінені для всіх типів голок. Всі отримані P-values були двосторонніми, а P-values< 0,05 вважалися статистично значущими. Всі статистичні аналізи були проведені з використанням статистичного програмного забезпечення R (версія 3.3.3; R Foundation for Statistical Computing, Відень, Австрія).
Результати
Досліджувана популяція та початкові характеристики
За період дослідження 828 пацієнтам було виконано ЕУЗД-ТГБ з приводу солідних пухлин підшлункової залози (зорб. 2). Були виключені пацієнти з анатомічними змінами, які унеможливлювали проведення ехоендоскопа (n = 21), зі значною обструкцією вихідного відділу шлунка (n = 12), з колатеральними проміжними судинами, які унеможливлювали пункцію голкою (n = 9), а також пацієнти з чистими кістозними ураженнями без солідного компонента, які були можливі лише для аспірації, але не для забору тканини (n = 117). Загалом в аналіз було включено 669 пацієнтів, які були розподілені на три групи: Franseen (n = 196), вістря Menghini (n = 113) і Зворотній скіс (n = 360).
Зображення 2. Схема потоку пацієнтів протягом дослідження.
У таблиці 1 представлено вихідні характеристики пацієнтів відповідно до кожної групи. Середній вік у групі де використовувалася голка Franseen був значно вищим, ніж в інших групах (група Franseen порівняно з групою вістря Menghini та групою голки зі зворотнім скосом: 66,3 ± 12,0 проти 62,5 ± 15,2 проти 65,0 ± 12,0 відповідно; P = 0,039). Частка пацієнтів чоловічої статі та індекс маси тіла між групами не відрізнялися. Крім того, голки 22-го калібру переважно використовували в групах Franseen і вістря Menghini, тоді як голки 25-го калібру частіше застосовували в групі зі зворотним скосом зі значущою різницею (P < 0,001). У всіх трьох групах підозра на злоякісне утворення була найпоширенішим показанням для проведення ЕУЗД-ТГА/Б з достовірною різницею (P = 0,008). Найчастіше утоврення розташовувалося в головці підшлункової залози (39,3%, 45,1% і 51,9% в групах Franseen, вістря Menghini і голки зі зворотнім скосом відповідно) з достовірними міжгруповими відмінностями. Середній розмір ураження становив 30,3 мм у групі Franseen, 36,3 мм у групі вістря Menghini і 29,9 мм у групі голки зі зворотнім скосом зі значними міжгруповими відмінностями.
Таблиця 1 Характеристика пацієнтів.
| Franseen n = 196 | Вістря Menghini n = 113 | Зворотній скіс n = 360 | P value | |
|---|---|---|---|---|
| Вік, рік, середнє ±СВ | 66.3 ± 12.0 | 62.5 ± 15.2 | 65.0 ± 12.0 | 0.039 |
| Стать (Чоловіки), n (%) | 111 (56.6%) | 64 (56.6%) | 192 (53.3%) | 0.694 |
| ІМТ, кг/м2, середнє ± СВ | 23.1 ± 3.5 | 22.5 ± 4.3 | 22.6 ± 3.3 | 0.202 |
| Діаметр голки, n (%) | < 0.001 | |||
| 22-калібр | 180 (91.8%) | 113 (100.0%) | 152 (42.2%) | |
| 25-калібр | 16 (8.2%) | 0 (0.0%) | 208 (57.8%) | |
| Ознака ТА, n (%) | 0.008 | |||
| Підозра на доброякісне утворення | 20 (10.2%) | 25 (22.1%) | 44 (12.2%) | |
| Підозра на злоякісне утворення | 176 (89.8%) | 88 (77.9%) | 316 (87.8%) | |
| Локалізація ураження, n (%) | 0.048 | |||
| Гачкуватий відросток | 20 (10.2%) | 9 (8.0%) | 41 (11.4%) | |
| Головка | 77 (39.3%) | 51 (45.1%) | 187 (51.9%) | |
| Тіло | 72 (36.7%) | 40 (35.4%) | 91 (25.3%) | |
| Хвіст | 27 (13.8%) | 13 (11.5%) | 41 (11.4%) | |
| Максимальний розмір ураження, мм, середнє ± СВ | 30.3 ± 10.9 | 36.3 ± 22.3 | 29.9 ± 10.5 | < 0.001 |
| Початкові лабораторні дані, медіана [IQR] | ||||
| ШОЕ, мм3 | 9750.0 [6290.0–12,600.0] | 6400.0 [4700.0–7900.0] | 8700.0 [5735.0–12,500.0] | < 0.001 |
| Гемоглобін, г/дл | 12.6 [11.4–13.7] | 12.6 [11.1–14.1] | 12.6 [11.5–13.6] | 0.831 |
| Тромбоцити, × 1000/мм3 | 221.0 [174.0–268.0] | 230.0 [178.0–266.0] | 222.0 [179.0–275.5] | 0.921 |
| АСТ, МО/Л | 32.5 [19.0–116.0] | 24.0 [19.0–42.0] | 33.0 [21.0–122.0] | 0.012 |
| АЛТ, МО/Л | 30.0 [15.0–126.0] | 25.0 [15.0–48.0] | 34.0 [16.5–149.5] | 0.053 |
| ЛФ, МО/Л | 101.0 [65.0–306.0] | 86.0 [62.0–165.0] | 117.5 [71.0–364.5] | 0.001 |
| ГГТ, МО/Л | 96.0 [21.0–592.0] | 48.0 [17.0–198.0] | 108.0 [24.0–634.0] | 0.002 |
| Загальний білірубін, мг/дл | 0.7 [0.4–6.0] | 0.6 [0.4–1.0] | 0.8 [0.4–7.1] | 0.003 |
| Амілаза, МО/л | 63.0 [38.0–93.0] | 62.0 [47.0–104.0] | 66.5 [44.0–114.0] | 0.608 |
- СВ, стандартне відхилення; ІМТ, індекс маси тіла; лейкоцити; АСТ, аспартатамінотрансфераза; МО, міжнародна одиниця; АЛТ, аланінамінотрансфераза; ЛФ, лужна фосфатаза; ГГТ, гамма-глутамілтрансфераза.
Результати, пов’язані з процедурою, між трьома групами
Результати, пов’язані з процедурою, представлені в таблиці 2. Трансдуоденальний доступ був більш поширеним, ніж черезшлуковий, у всіх трьох групах, оскільки найпоширенішою локалізацією ураження в усіх групах була головка. Крім того, кількість проходів голки була вищою в групі зі зворотним скосом, ніж у двох інших групах (Franseen проти вістря Menghini проти групи зі зворотним скосом: 2,8 ± 1,0 проти 2,9 ± 0,5 проти 3,4 ± 1,3, P < 0,001). Безперервне відсмоктування з негативним тиском за допомогою шприца застосовували під час ЕУЗД-ТГА/Б усім пацієнтам у трьох групах. Віялову техніку застосовували всім пацієнтам у групі Franseen, тоді як у групі вістря Menghini її виконували лише 53,1% пацієнтів і 82,2% пацієнтів у групі голки з зворотнім скосом (P < 0,001) із достовірними міжгруповими відмінностями.
Таблиця 2 Порівняння результатів, пов’язаних з процедурою, між трьома групами.
| Franseen n = 196 | Вістря Menghini n = 113 | Зворотній скіс n = 360 | P value | ||
|---|---|---|---|---|---|
| Доступи, n (%) | 0.004 | ||||
| Трансдуоденальний | 96 (49.0%) | 60 (53.1%) | 227 (63.1%) | ||
| Черезшлунковий | 100 (51.0%) | 53 (46.9%) | 133 (36.9%) | ||
| Кількість проходжень, середнє ± СВ | 2.8 ± 1.0 | 2.9 ± 0.5 | 3.4 ± 1.3 | < 0.001 | |
| Застосування відсмоктування, n (%) | 196 (100.0%) | 113 (100.0%) | 360 (100.0%) | ||
| Кількість застосувань відсмоктувача, n (%) | < 0.001 | ||||
| 10 мл | 0 (0.0%) | 0 (0.0%) | 235 (65.3%) | ||
| 20 мл | 196 (100.0%) | 113 (100.0%) | 125 (34.7%) | ||
| Застосування стилета, n (%) | 145 (74.0%) | 113 (100.0%) | 275 (76.4%) | < 0.001 | |
| Віялова техніка, n (%) | 196 (100.0%) | 60 (53.1%) | 296 (82.2%) | < 0.001 | |
| Технічний успіх, n (%) | 196 (100.0%) | 113 (100.0%) | 360 (100.0%) | ||
| Небажані явища, n (%) | |||||
| Миттєва кровотеча | 1 (0.5%) | 2 (1.8%) | 5 (1.4%) | 0.546 | |
| Відстрочена кровотеча | 0 (0.0%) | 0 (0.0%) | 0 (0.0%) | ||
| Панкреатит | 3 (1.5%) | 0 (0.0%) | 2 (0.6%) | 0.266 | |
| Інфекція | 0 (0.0%) | 0 (0.0%) | 0 (0.0%) | ||
| Будь-які серцево-легеневі розлади. під час процедури | 1 (0.5%) | 1 (0.9%) | 0 (0.0%) | 0.263 | |
| Остаточний діагноз, n (%) | 0.010 | ||||
| Запальна пухлина | 17 (8.7%) | 19 (16.8%) | 29 (8.1%) | ||
| Доброякісна пухлина | 18 (9.2%) | 19 (16.8%) | 32 (8.9%) | ||
| ПКБЕ | 1 (0.5%) | 2 (1.8%) | 1 (0.3%) | ||
| Лімфома | 0 (0.0%) | 1 (0.9%) | 3 (0.8%) | ||
| Метастатична карцинома | 0 (0.0%) | 1 (0.9%) | 3 (0.8%) | ||
| Протокова аденокарцинома | 160 (81.6%) | 71 (62.8%) | 292 (81.1%) | ||
| Наявність гістологічного біопсійного матеріалу, n (%) | 192 (98.0%) | 97 (85.8%) | 331 (91.9%) | < 0.001 | |
| Можливість забарвлення ІГХ, n (%) | 187 (95.4%) | 74 (65.5%) | 318 (88.3%) | < 0.001 | |
- ІГХ – імуногістохімічний; НЕП – нейроендокринна пухлина; ІПМП – інтрапротокова папілярно-муцинозна пухлина.
Жодних технічних труднощів не виникло в жодній групі, навіть при використанні трансдуоденального доступу. Щодо пов’язаних з процедурою небажаних явищ, то лише у восьми пацієнтів (8/669, 1,2%) у всій когорті виникла миттєва кровотеча як небажане явище, і всім пацієнтам у кожній групі було проведено кліпування кілька разів під час одного ендоскопічного сеансу. Крім того, лише у п’яти пацієнтів розвинувся легкий гострий панкреатит, який потребував госпіталізації протягом 3 днів (1,5% в групі Franseen і 0,6% в групі голки зі зворотнім скосом P = 0,266). У жодного пацієнта в кожній групі не було суттєво відстроченої кровотечі або інфекційних побічних явищ. Гістологічне дослідження біопсійного матеріалу було значно якіснішим у групі Franseen, ніж у групах з вістрям Menghini і голки зі зворотнім скосом (Franseen проти вістря Menghini проти голки зі зворотнім скосом: 98,0% проти 85,8% проти 91,9%, P < 0,001). Крім того, зразки біопсії, придатні для ІГХ-аналізу, були отримані в 95,4% випадків при використанні голки Franseen, 65,5% – при використанні голки з вістрям Menghini і 88,3% – при використанні голки зі зворотним скосом (P < 0,001). Найпоширенішим кінцевим діагнозом у трьох групах була протокова аденокарцинома.
Діагностичні характеристики кожної голки для ЕУЗД-ТГА/Б
Діагностична ефективність була розрахована двома різними способами з використанням методів обробки зразків. При первинній діагностиці за допомогою оцінки клітинних блоків голка Franseen мала чутливість 86,09%, специфічність 100,0%, ППЦ 100% і НПЦ 57,89%, тоді як голка з вістрям Menghini мала чутливість 55,71%, специфічність 100,0%, ППЦ 100,0% і НПЦ 54,41% (Таблиця 3). Крім того, голка зі зворотним скосом мала чутливість 71,98%, специфічність 100,0%, ППЦ 100% і НПЦ 39,50%. Крім того, діагностична точність для голки Franseen, голки з вістрям Menghini та голки зі зворотним скосом становила 88,32%, 71,03% і 76,32%, відповідно. При первинній діагностиці за допомогою гістологічної оцінки голка Franseen забезпечила кращу діагностичну ефективність (чутливість 95,03%, специфічність 100,0%, ППЦ 100,0% і НПЦ 81,40%) з точністю 95,92%; голка з вістрям Menghini забезпечила діагностичну ефективність (82. 67% чутливість, 100,0% специфічність, ППЦ 100,0% і НПЦ 74,51%) з точністю 88,50%; в той час як голка зі зворотним скосом показала діагностичну ефективність (82,61% чутливість, 100,0% специфічність, ППЦ 100,0% і НПЦ 53,98%) з точністю 85,56%.
Таблиця 3 Ефективність діагностики відповідно до голок.
| Franseen, % (95% ДІ) | Вістря Menghini, % (95% ДІ) | Зворотній скіс, % (95% ДІ) | ||||
|---|---|---|---|---|---|---|
| Клітинний блок | Гістологія | Клітинний блок | Гістологія | Клітинний блок | Гістологія | |
| Чутливість | 86.09% (78.39–91.83) | 95.03% (90.44–97.83) | 55.71% (43.34–67.59) | 82.67% (72.19–90.43) | 71.98% (66.07–77.39) | 82.61% (77.83–86.73) |
| Специфічність | 100.00% (84.56–100.00) | 100.00% (90.00–100.00) | 100.00% (90.51–100.00) | 100.00% (90.75–100.00) | 100.00% (92.45–100.00) | 100.00% (94.13–100.00) |
| Точність | 88.32% (81.73–93.18) | 95.92% (92.12–98.22) | 71.03% (61.42–79.39) | 88.50% (81.13–93.73) | 76.32% (71.13–80.98) | 85.56% (81.49–89.02) |
| Негативне прогностичне значення | 57.89% (46.60–68.42) | 81.40% (69.01–89.58) | 54.41% (47.86–60.82) | 74.51% (64.07–82.73) | 39.50% (34.92–44.26) | 53.98% (47.82–60.03) |
| Позитивне прогностичне значення | 100.00% (84.56–100.00) | 100.00% (90.00–100.00) | 100.00% (90.51–100.00) | 100.00% (90.75–100.00) | 100.00% (92.45–100.00) | 100.00% (94.13–100.00) |
- ДІ – довірчий інтервал.
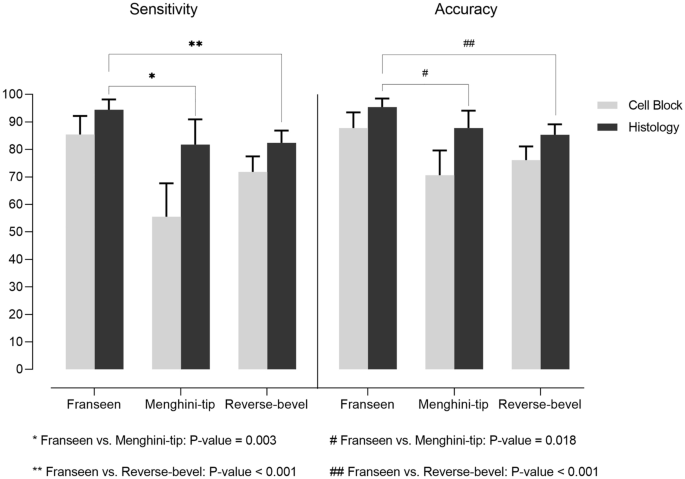
При прямому порівнянні діагностичних характеристик з використанням гістологічних зразків між голками, голка Franseen показала значно вищу чутливість, ніж голки з вістрям Menghini (P = 0,003) і голки зі зворотним скосом (P < 0,001) (зорб. 3). Крім того, голка Franseen також показала значно вищу точність, ніж голки з вістрям Menghini (P = 0,018) і голки зі зворотним скосом (P < 0,001).
Зображення 3. Порівняння ефективності діагностики відповідно до голки.
Змінні, пов’язані з точністю діагностики
Для виявлення факторів, пов’язаних з точністю діагностики, були проведені одновимірний і багатовимірний аналізи з використанням моделей логістичної регресії (табл. 4). Розмір пухлини > 2 см (відношення шансів [ВШ]: 5,36, 95% довірчий інтервал [ДІ]: 3,40-8,47) і застосування віялової техніки (ВШ: 1,70, 95% ДІ: 1,00-2,86) були достовірно пов’язані з точним діагнозом в багатофакторному аналізі. Крім того, голка з вістрям Menghini була визначена як асоційована змінна з низькою точністю діагнозу (ВШ: 0,54, 95% ДІ: 0,29-1,00, Р = 0,050) з маргінальною значущістю. Крім того, голки ТГБ, включаючи голки Fransee і голки зі зворотним скосом, були достовірно пов’язані з точним діагнозом порівняно з голками ТГБ (голки з вістрям Menghini) (ВШ: 2,03, 95% ДІ: 1,21-3,38, P = 0,007).
Таблиця 4 Змінні для точного діагнозу згідно з моделями логістичної регресії.
| Змінна | Одновимірний аналіз | Багатовимірний аналіз | ||||
|---|---|---|---|---|---|---|
| ВШ (95% ДІ) | P-value | ВШ (95% ДІ) | P-value | |||
| Вістря Menghini (vs. Franseen) | 0.43 (0.25–0.73) | 0.002 | 0.54 (0.29–1.00) | 0.050 | ||
| Зворотній скіс (vs. Franseen) | 1.07 (0.67–1.68) | 0.786 | 1.18 (0.71–1.94) | 0.509 | ||
| 25-калібр (vs. 22-калібр) | 1.23 (0.82–1.87) | 0.320 | ||||
| Розмір пухлини ≥ 2 см (проти < 2 см) | 5.36 (3.43–8.40) | < 0.001 | 5.36 (3.40–8.47) | < 0.001 | ||
| Черезшлунковий (проти транс-дуоденального) | 0.97 (0.66–1.43) | 0.889 | ||||
| Проходження голки ≥ 4 (проти < 4) | 1.83 (1.14–3.04) | 0.152 | ||||
| Віялова техніка (vs без віялової техніки) | 2.17 (1.38–3.38) | < 0.001 | 1.70 (1.00–2.86) | 0.047 | ||
| 20 мл відсмоктування (проти 10 мл відсмоктування) | 1.08 (0.73–1.60) | 0.696 | ||||
| Використання стилета (vs. без стилета) | 0.77 (0.46–1.25) | 0.310 | ||||
- ВШ, відношення шансів; ДІ, довірчий інтервал.
Обговорення
Згідно з розробкою та вдосконаленням нових типів голок для ЕУЗД-ТГА/Б, багато досліджень 2,14,15,16,17,18,19 показали, що модифіковані з посиленими геометричними елементами на вістрі забезпечують вищу точність діагностики та забір гістологічного матеріалу від солідних пухлин підшлункової залози. Наше дослідження є першим звітом, в якому порівнюються три типи голок (голка Franseen, голка зі зворотним скосом і голка з вістрям Menghini) на предмет відповідності і точності зразків, отриманих з кожної голки. У нашому ретроспективному порівняльному дослідженні ЕУЗД-ТГБ голка Franseen показала вищий рівень забирання гістологічного матеріалу, ніж голки зі зворотним скосом і навіть голки з вістрям Menghini. Крім того, голка Franseen продемонструвала значно кращі діагностичні показники, включаючи 95% чутливість, 96% точність і 81,4% НПЦ порівняно з іншими типами голок. У першому попередньому звіті про голку Franseen, Bang та співавт. продемонстрували, що унікальний корончатий наконечник з триплощинними симетричними ріжучими кромками дозволяє краще таргетувати ураження з меншою силою проникнення і ще більшим захопленням тканини 20. Після цього вони проспективно порівняли клітинну щільність і діагностичну точність чотирьох типів голок, включаючи голки Franseen, голки зі зворотним скосом і голки з вістрям Menghini 21. У цьому дослідженні автори дійшли висновку, що голка Franseen показала найвищий ступінь клітинної щільності при солідних пухлинах підшлункової залози, хоча кількість пацієнтів, віднесених до кожної групи, була відносно невеликою – 32-33 пацієнти. Крім того, голка Franseen показала найвищу діагностичну точність – 92,7%, тоді як голки з вістям Menghini та зі зворотним скосом – 74,7% і 67,7% відповідно. Ці результати повністю узгоджуються з нашими результатами і гіпотезою про те, що патологічні результати ЕУЗД-ТГА/ТГБ повністю залежать від типу голки, яка використовується для взяття зразків тканин.
Слід зазначити, що віялова техніка була незалежним сприятливим фактором для точної діагностики, хоча початкове дослідження Bang та співавт. не змогло підтвердити значний вплив цієї техніки на діагностичні показники 22. Нещодавно опублікована клінічна настанова переконливо свідчить, що віялова техніка для отримання тканин під контролем ЕУЗД пропонує технічно прийнятну реалізацію і кращі діагностичні результати, включаючи меншу кількість проходів голки, необхідних для встановлення точного діагнозу, ніж стандартна техніка 3. Таким чином, наше дослідження підтверджує необхідність рутинного застосування віялової техніки при проведенні ЕУЗД-ТГА/ТГБ згідно з клінічними настановами: віялова техніка підвищує точність діагностики. Теоретично, застосування віялової техніки може збільшити ймовірність досягнення точного діагнозу, тим самим зменшуючи ймовірність непереконливих результатів без додаткового ризику виникнення побічних ефектів або медичних витрат.
Наше дослідження має кілька цінних висновків. По-перше, ЕУЗД-ТГА/ТГБ з використанням голки Franseen може зменшити потребу в ROSE, оскільки її чутливість і точність діагностики злоякісності за результатами гістологічного дослідження перевищувала 95% без ROSE у всіх випадках. Хоча ROSE забезпечує високу адекватність зразка в кожному конкретному випадку при меншій кількості проходів голки 23, останні дані спостережень свідчать про суперечливі результати, в яких ROSE може бути не пов’язана з поліпшенням діагностичної результативності, включаючи точність і чутливість 24. По-друге, оптимальна якість гістологічного матеріалу, яка може бути досягнута при спеціальному фарбуванні, такому як ІГХ, була отримана в 95% випадків при використанні голки Franseen. Отримання надійної і достатньої кількості тканини може забезпечити збережену гістологічну архітектуру для спеціального фарбування і навіть молекулярного профілювання, що має важливе значення для диференціальної діагностики інших пухлин підшлункової залози або запальних утворень і персоналізованої протиракової терапії 25. По-третє, хоча нещодавні рекомендації 3 рекомендують, що для досягнення точного діагнозу потрібно мінімум чотири проколи, а для пухлин менше 2 см може знадобитися більше чотирьох проколів, у нашому дослідженні кращі діагностичні показники були досягнуті при меншій кількості проколів голкою Franseen, ніж голками зі зворотним скосом або з вістрям Menghini. Тому в установах, які використовують голки зі зворотним скосом і вістрям Menghini, ми наполегливо рекомендуємо проводити три-чотири проходи для досягнення точного діагнозу.
Хоча наше дослідження є першим, що оцінює діагностичну ефективність трьох типів голок для ЕУЗД-ТГА/Б у великій когорті, воно мало деякі обмеження, які могли вплинути на наші остаточні висновки. По-перше, через ретроспективний характер дослідження не вдалося повністю уникнути деяких технічних упереджень, включаючи застосування відсмоктування, стилета або віялової техніки. Крім того, при ретроспективному аналізі даних може бракувати певної інформації про важливі змінні (інформаційна похибка). Хоча ми скоригували потенційно заплутані змінні, включаючи тип голки, діаметр голки, розмір пухлини, маршрут наближення, кількість проходів голки, приховані або невимірювані фактори могли залишитися. Тому це дослідження все ще має важливі обмеження. Ми сподіваємося, що це обмеження можна буде подолати за допомогою рандомізованих контрольованих досліджень. По-друге, цитопатологічні результати визначав один патологоанатом у кожному центрі, що могло спричинити упередженість спостерігача з інтер- та інтраобсерваційними варіаціями. По-третє, наша методологія визначення доброякісних захворювань не була валідована. Тим не менш, щоб уникнути непотрібного хірургічного втручання, наша стратегія, що включала клінічне спостереження протягом ≥ 6 місяців з повторними обстеженнями, була відносно обґрунтованою для визначення доброякісних захворювань, хоча, звичайно, не ідеальною. По-четверте, між даним дослідженням і багатьма іншими дослідженнями щодо визначення злоякісності могла існувати гетерогенність, в яких “високосугестивні” зразки можна було б загалом вважати діагностичними і прийнятними 26. Однак, могли виникнути розбіжності в діагностичних показниках, якщо високосугестивні зразки були віднесені до категорії діагностики злоякісності чи ні.
На завершення, для встановлення оптимальної голки і техніки, яка може забезпечити точний діагноз, ми вважаємо, що наші пропозиції щодо використання голки Franseen при віяловій техніці можуть дозволити стандартизувати практику отримання тканин під контролем ЕУЗД при раку підшлункової залози. Крім того, голки ТГБ з будь-якою геометрією армування замість стандартних голок ТГА можуть бути рекомендовані незалежно від моделі та виробника голок.
Доступність даних
Набори даних, згенеровані та/або проаналізовані під час цього дослідження, можна отримати у відповідного автора за обґрунтованим запитом.
Посилання на джерела
- ASGE Standards of Practice Committee et al. The role of endoscopy in the evaluation and management of patients with solid pancreatic neoplasia. Gastrointest. Endosc. 83, 17–28 (2016).
- Bang, J. Y., Hawes, R. & Varadarajulu, S. A meta-analysis comparing ProCore and standard fine-needle aspiration needles for endoscopic ultrasound-guided tissue acquisition. Endoscopy 48, 339–349 (2016).
- Chung, M. J. et al. Clinical and technical guideline for endoscopic ultrasound (EUS)-guided tissue acquisition of pancreatic solid tumor: Korean society of gastrointestinal endoscopy (KSGE). Gut Liver 15, 354–374 (2021).
- Polkowski, M. et al. Technical aspects of endoscopic ultrasound (EUS)-guided sampling in gastroenterology: European Society of Gastrointestinal Endoscopy (ESGE) Technical Guideline—March 2017. Endoscopy 49, 989–1006 (2017).
- Dim, D. C. et al. The usefulness of S100P, mesothelin, fascin, prostate stem cell antigen, and 14-3-3 sigma in diagnosing pancreatic adenocarcinoma in cytological specimens obtained by endoscopic ultrasound guided fine-needle aspiration. Diagn. Cytopathol. 42, 193–199 (2014).
- Hasegawa, T. et al. Evaluation of Ki-67 index in EUS-FNA specimens for the assessment of malignancy risk in pancreatic neuroendocrine tumors. Endoscopy 46, 32–38 (2014).
- Park, S. W. et al. The diagnostic performance of novel torque technique for endoscopic ultrasound-guided tissue acquisition in solid pancreatic lesions: A prospective randomized controlled trial. J. Gastroenterol. Hepatol. 35, 508–515 (2020).
- Sun, B., Yang, X., Ping, B., He, Y. & Zhang, Z. Impact of inconclusive endoscopic ultrasound-guided fine-needle aspiration results in the management and outcome of patients with solid pancreatic masses. Dig. Endosc. 27, 130–136 (2015).
- Matsubayashi, H. et al. Pathological and molecular aspects to improve endoscopic ultrasonography-guided fine-needle aspiration from solid pancreatic lesions. Pancreas 47, 163–172 (2018).
- Oh, D. et al. The impact of macroscopic on-site evaluation using filter paper in EUS-guided fine-needle biopsy. Endosc. Ultrasound 8, 342–347 (2019).
- Iglesias-Garcia, J. et al. Feasibility and yield of a new EUS histology needle: Results from a multicenter, pooled, cohort study. Gastrointest. Endosc. 73, 1189–1196 (2011).
- Fabbri, C. et al. Endoscopic ultrasound-guided fine needle aspiration with 22- and 25-gauge needles in solid pancreatic masses: A prospective comparative study with randomisation of needle sequence. Dig. Liver Dis. 43, 647–652 (2011).
- Park, S. W. et al. Prospective study for comparison of endoscopic ultrasound-guided tissue acquisition using 25- and 22-gauge core biopsy needles in solid pancreatic masses. PLoS ONE 11, e0154401 (2016).
- Chong, C. C. N. et al. EUS-FNA using 22G nitinol or ProCore needles without on-site cytopathology. Endosc. Ultrasound 7, 56–60 (2018).
- Fujie, S. et al. Comparison of the diagnostic yield of the standard 22-gauge needle and the new 20-gauge forward-bevel core biopsy needle for endoscopic ultrasound-guided tissue acquisition from pancreatic lesions. Gut Liver 13, 349–355 (2019).
- Kandel, P. et al. EUS-guided fine needle biopsy sampling using a novel fork-tip needle: A case-control study. Gastrointest. Endosc. 84, 1034–1039 (2016).
- Naveed, M. et al. A Multicenter comparative trial of a novel EUS-guided core biopsy needle (SharkCore™) with the 22-gauge needle in patients with solid pancreatic mass lesions. Endosc. Ultrasound 7, 34–40 (2018).
- Bang, J. Y. et al. Randomized trial comparing the Franseen and Fork-tip needles for EUS-guided fine-needle biopsy sampling of solid pancreatic mass lesions. Gastrointest. Endosc. 87, 1432–1438 (2018).
- Mukai, S. et al. A retrospective histological comparison of EUS-guided fine-needle biopsy using a novel Franseen needle and a conventional end-cut type needle. Endosc. Ultrasound 8, 50–57 (2019).
- Bang, J. Y. et al. Endoscopic ultrasonography-guided biopsy using a Franseen needle design: Initial assessment. Dig. Endosc. 29, 338–346 (2017).
- Bang, J. Y. et al. Comparing needles and methods of endoscopic ultrasound-guided fine-needle biopsy to optimize specimen quality and diagnostic accuracy for patients with pancreatic masses in a randomized trial. Clin. Gastroenterol. Hepatol. 825, 19 (2021).
- Bang, J. Y., Magee, S. H., Ramesh, J., Trevino, J. M. & Varadarajulu, S. Randomized trial comparing fanning with standard technique for endoscopic ultrasound-guided fine-needle aspiration of solid pancreatic mass lesions. Endoscopy 45, 445–450 (2013).
- Matynia, A. P. et al. Impact of rapid on-site evaluation on the adequacy of endoscopic-ultrasound guided fine-needle aspiration of solid pancreatic lesions: A systematic review and meta-analysis. J. Gastroenterol. Hepatol. 29, 697–705 (2014).
- Kong, F. et al. Rapid on-site evaluation does not improve endoscopic ultrasound-guided fine needle aspiration adequacy in pancreatic masses: A meta-analysis and systematic review. PLoS ONE 11, e0163056 (2016).
- Biankin, A. V. & Hudson, T. J. Somatic variation and cancer: Therapies lost in the mix. Hum. Genet. 130, 79–91 (2011).
- Nayar, M. K. et al. Comparison of the diagnostic performance of 2 core biopsy needles for EUS-guided tissue acquisition from solid pancreatic lesions. Gastrointest. Endosc. 85, 1017–1024 (2017).