Резюме
Передумови
Дослідження для підтвердження концепції з метою оцінки можливості та безпеки малоінвазивної ультразвукової (УЗ) біопсії синовіальної тканини променево-зап’ясткового суглоба (ПЗ) з використанням анатомічної табакерки як шляху доступу.
Методи
Двадцяти послідовним пацієнтам з активним хронічним артритом зап’ястя виконали малоінвазивну синовіальну біопсію ПЗ суглоба під контролем УЗ з використанням анатомічної табакерки в якості шляху доступу. Зразки забирали з 3 попередньо визначених цільових ділянок синовії ПЗ суглоба (проксимальної, склепіння та дистальної ділянки), з метою отримання щонайменше 12 зразків. Доцільність процедури оцінювали на основі кількості та гістологічної якості отриманих фрагментів тканини, протестованих за попередньо визначеними гістологічними параметрами. Безпека і толерантність процедури оцінювалися за допомогою 1-тижневих і 1-місячних клінічних оцінок.
Результати
Для гістопатологічного дослідження було оброблено в середньому 17 фрагментів (≥ 1 мм в діаметрі при макроскопічній оцінці) за процедуру (діапазон 9-24), і присвячено вивченню. При гістопатологічній оцінці тканину, що піддається класифікації (видимий вистилаючий шар і ≥ 4 фрагментів з НСТ), було розпізнано в 19/20 біоптатах (95%), а всі попередньо визначені гістометричні параметри були визнані застосовними і успішно виміряні в 19/19 біоптатах, що піддавалися класифікації. Всі три цільові ділянки біопсії були доступні для взяття зразків. Вся процедура в цілому добре переносилася. Під час 1-місячного спостереження у жодного пацієнта не було виявлено інфекційних ускладнень.
Висновки
Шлях доступу через анатомічну табакерку в синовіальній біопсії ПЗ суглоба під контролем УЗ дозволяє безпечно і цілеспрямовано збирати адекватні зразки тканин. Ця модифікація традиційного шляху доступу може дозволити легше, багаторазово і безпечніше проводити забір зразків з анатомічно відмінних ділянок зап’ястя при артриті.
Передумови
В останні роки зросла кількість клінічних досліджень, присвячених аналізу синовіальної тканини у пацієнтів з хронічним артритом. Інтерес в основному зосереджений на вивченні ранніх стадій захворювання, не стільки як на діагностичному інструменті [1], скільки на розумінні патогенетичних механізмів і отриманні додаткових маркерів, корисних для керівництва терапевтичними стратегіями [2,3,4,5,6,7].
Для того, щоб сприяти широкому впровадженню аналізу синовіальної тканини в клінічну практику та наукові дослідження, зразки повинні бути отримані міні-інвазивно і з представницьких суглобів. Розробка та валідація методик під контролем ультразвуку (УЗ) з використанням напівавтоматичної голки або портативного безголкового ін’єктора та щипців запропонувала альтернативний артроскопії інструмент з відмінними результатами з точки зору безпеки та доступу до суглобів [8,9,10]. Проте, забір зразків з дрібних суглобів кисті, які є найбільш частою і ранньою мішенню запального процесу при багатьох ідіопатичних артритах, включаючи ревматоїдний артрит (РА), хоча і можливий [11, 12], але залишається складним через потенційно недостатній вихід тканин. У цьому контексті променево-зап’ястковий (ПЗ) суглоб є найбільш підходящою альтернативою, оскільки він більший і містить більшу кількість синовії [8, 12]. Зазвичай доступ до ПЗ суглоба для виконання внутрішньосуглобових ін’єкцій [13], артроскопії [14] або синовіальної біопсії [15] здійснюється між відділами сухожилків розгиначів III і IV, IV і V та V і VI на тильній стороні. Проте, з нашого досвіду, анатомічні особливості ПЗ суглоба та хід різних навколосуглобових структур, зокрема сухожиль, можуть зумовлювати шлях та нахил хірургічного інструменту в порожнині суглоба, з можливістю того, що частина синовіальної поверхні залишається недосяжною.
Анатомічна табакерка – це трикутне заглиблення, яке утворюється при розгинанні та відведенні великого пальця на променевій стороні зап’ястя на рівні кісток зап’ястка. Заглиблення обмежене медіально сухожиллям довгого м’яза-розгинача великого пальця, латерально – сухожиллями короткого м’яза-розгинача великого пальця та довгим відвідним м’язом великого пальця, дистально – основою І п’ясткової кістки та проксимально – шилоподібним відростком променевої кістки; дно визначають човноподібна та трапецієподібна кістки та медіальна сторона ПЗ суглоба [16]. У цій ділянці голку можна ввести через капсулу суглоба. Її можна спрямувати в променево-ліктьовому напрямку, паралельно як хрящовій поверхні, що вистилає кістки зап’ястка ( човноподібну, півмісяцеву та частину тригранної кістки), так і синовіальній вистилці верхньої частини капсули суглоба, що простягається між тильною межею променевої кістки та контуром виростка зап’ястка, доки вона не досягне трикутної зв’язки зап’ястка.
Незважаючи на цей потенційно сприятливий субстрат, в літературі наразі відсутні дані про специфічний результат синовіальної біопсії зап’ястя на основі вищеописаного анатомічного підходу. У світлі цих міркувань ми розробили дослідження для підтвердження концепції, щоб оцінити можливість і безпеку синовіальної біопсії з використанням анатомічної табакерки в якості шляху доступу.
Методи
Залучення пацієнтів
Дослідження, збір даних та звітність були виконані відповідно до пунктів EULAR, які враховують мінімальні вимоги до звітності при дослідженні синовіальної тканини в ревматології [17]. Було включено двадцять послідовних пацієнтів, яким проводили голкову синовіальну біопсію зап’ястя під контролем УЗ у відділенні ревматології Фонду IRCCS Поліклініка Сан-Маттео в Павії в період з лютого 2021 року по грудень 2022 року. Показаннями до проведення синовіальної біопсії були клінічно невизначений синовіт або персистуючий незрозумілий артрит у пацієнтів зі встановленим діагнозом. Дослідження проводилося відповідно до Гельсінської декларації. Всі пацієнти підписали інформовану згоду перед включенням у дослідження, а місцевий етичний комітет схвалив протокол дослідження.
Оцінка за допомогою УЗ та методика синовіальної біопсії під контролем УЗ
Ультразвукове дослідження (у сірій шкалі, СШ, та енергетичному доплері, ЕД) та синовіальну біопсію під контролем УЗ виконували на апараті Esaote MyLab™Seven з лінійним датчиком (6/18 МГц). Потовщення синовіальної оболонки та ступінь ЕД-сигналу зап’ястя оцінювали напівкількісно (0-3) [18] безпосередньо перед процедурою біопсії. У кожного пацієнта для біопсії обирали ПЗ суглоб з найвищою оцінкою синовіту за даними УЗ.
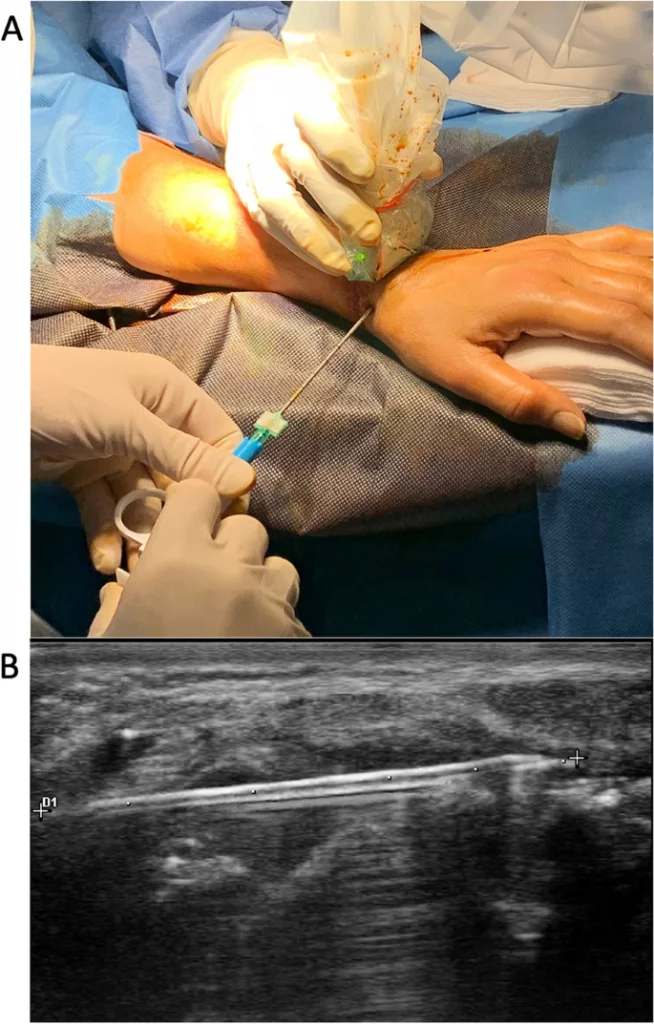
Всі процедури біопсії виконували два навчені оператори (LDS [процедура] та SB [асистент УЗ], з досвідом проведення біопсії під контролем УЗ > 5 років). Всі процедури біопсії проводилися в амбулаторних умовах у стерильному середовищі. Доступ локалізували при пронації кисті, незначному розгинанні зап’ястя і відведенні великого пальця на дні анатомічної табакерки, безпосередньо під сухожиллям довгого розгинача кисті, вище латеральної зв’язки ПЗ і приблизно на 5 мм ближче трапецієподібної кістки (Зобр. 1А). Шкіру та підшкірну клітковину анатомічної табакерки над капсулою суглоба інфільтрували 5 мл місцевого анестетика (1% лідокаїну) за допомогою голки 25-го калібру. Ще 5 мл місцевого анестетика (1% лідокаїну) вводили в синовіальний простір. Через 2 хвилини в синовіальну порожнину під прямим контролем УЗ вводили біопсійну голку Quick-Core (14Gx100 мм). Голку можна було динамічно візуалізувати по всій довжині у вигляді невеликої гіперехогенної лінії в синовіальній проліферації над кістками зап’ястя (Зобр. 1B).
Зобр. 1
Біопсія синовіальної тканини променево-зап’ясткового (ПЗ) суглоба під контролем ультразвуку (УЗ) з використанням анатомічної табакерки як шляху доступу. A Репрезентативне зображення пацієнта, якому проводять синовіальну біопсію ПЗ під контролем УЗ з використанням голки Quick-Core (14Gx100 мм). Доступ розташований при пронації кисті, незначному розгинанні зап’ястя і відведеному великому пальці кисті на дні анатомічної табакерки, безпосередньо під сухожиллям довгого м’яза-розгинача великого пальця, вище латеральної зв’язки ПЗ і приблизно на 5 мм проксимальніше трапецієподібної кістки. B УЗ-наведення дозволило голці проникнути приблизно на 3 см в ПЗ суглоб, поки вона не досягла трикутної зв’язки зап’ястка. Голку можна візуалізувати на всій її довжині у вигляді невеликої гіперехогенної лінії в межах синовіальної проліферації над кістками зап’ястка
Під контролем УЗ голка проникла приблизно на 3 см у ПЗ суглоб, поки не досягла трикутної зв’язки зап’ястка (Зобр. 1Б). Голка, паралельно хрящовій поверхні зап’ястка, залишалася на відстані приблизно 3-4 мм від неї протягом усього шляху. На противагу цьому, вона безпосередньо контактувала з синовіальною тканиною, що вистилає тильну сторону суглобової капсули. Голку можна було ввести під кутом близько 20° дорсально, а також під кутом близько 30° латерально, зап’ястково та променево. Таким чином, кінчиком голки можна було досягти будь-якої точки синовіальної тканини, що вистилає склепіння капсули суглоба, розташованої між тильним краєм суглобової поверхні променевої кістки і тильним краєм зап’ясткового відростка, за винятком лише найбільш проксимальних 5 мм променево-човникоподібного суглоба.
Заздалегідь визначеними цільовими ділянками для біопсії були (i) суглобова поверхня променевої кістки (проксимальна ділянка), (ii) суглобові поверхні кісток зап’ястя (дистальна ділянка) та (iii) склепіння суглобової капсули, особливо там, де синовіальна оболонка виглядала більш товстою (ділянка склепіння) (Зобр. 2А). Намагалися отримати максимально допустиму кількість біопсій з кожного суглоба, прагнучи отримати мінімум 12 зразків (≥ 1 мм в діаметрі при макроскопічній оцінці) з трьох цільових ділянок і за цільовий час процедури 30 хв [12].
Зобр. 2
Цільові ділянки для синовіальної біопсії променево-зап’ясткового (ПЗ) суглоба та вилучені фрагменти тканин. А Репрезентативне ультразвукове поздовжнє сканування променево-зап’ясткового суглоба. Периметр променево-зап’ясткового синовіту позначений різними кольорами для позначення 3 цільових ділянок, які використовуються для збору біопсійних зразків. Червоним кольором позначено проксимальну ділянку, чорним – ділянку склепіння, а синім – дистальну ділянку. B Репрезентативні зображення вилучених фрагментів синовіальної тканини для кожної цільової ділянки. Макроскопічні та гістологічні зображення, забарвлені гематоксиліном та еозином (при збільшенні × 10 і деталі лімфоцитарного інфільтрату при збільшенні × 20) репрезентативних синовіальних тканин для кожної ділянки-мішені
Обробка синовіальної тканини
Біоптати зберігали вологими у фізіологічному розчині протягом максимум 30 хвилин після завершення процедури та нумерували макроскопічно (вилучені фрагменти тканини). Змінна кількість фрагментів (залежно від загальної кількості та супутніх процедур) була випадковим чином відібрана для гістопатології і зафіксована в 4% формаліні до 24 год. Після заливки в парафін, за допомогою стандартного мікротома вирізали серійні зрізи товщиною 5 мкм, встановлювали на предметні скельця і фарбували гематоксиліном та еозином (ГЕ) відповідно до стандартних протоколів.
Таблиця 1 Ультразвукові та гістологічні дані
| Біопсійний код, n° | Оцінка СШ | Оцінка ЕД | Фрагменти ГЕ, n всього/НСТ(КЯТ) | Біопсія з можливістю градаціїa | Оцінка за шкалою Krenn (ступінь синовіту) | Оцінка судинного русла | Клітинна агрегація G2/G3 (ІАЛ) |
| 1 | 3 | 2 | 12/9 (75%) | + | 6.5 (високий) | 1 | + / + (0.89) |
| 2 | 2 | 2 | 16/0 (0%) | − | но (не оцінюється) | но | но (не оцінюється) |
| 3 | 2 | 2 | 21/14 (67%) | + | 3 (низький) | 0.5 | + / + (0.14) |
| 4 | 2 | 3 | 14/14 (100%) | + | 6 (високий) | 1.5 | + / + (0.86) |
| 5 | 2 | 1 | 23/22 (96%) | + | 5.5 (високий) | 0 | + / − (0.14) |
| 6 | 1 | 2 | 16/5 (31%) | + | 4 (низький) | 0.5 | − / − (0.00) |
| 7 | 3 | 3 | 13/12 (92%) | + | 4.5 (низький) | 1 | + / − (0.33) |
| 8 | 2 | 3 | 19/9 (47%) | + | 4.5 (низький) | 0.5 | + / − (0.22) |
| 9 | 3 | 2 | 12/12 (100%) | + | 7.5 (високий) | 2 | + / + (0.50) |
| 10 | 3 | 3 | 20/9 (45%) | + | 4.5 (низький) | 1 | − / − (0.00) |
| 11 | 1 | 3 | 9/7 (78%) | + | 5 (високий) | 0.5 | + / − (0.37) |
| 12 | 2 | 2 | 10/8 (80%) | + | 5 (високий) | 1.5 | + / + (0.62) |
| 13 | 2 | 1 | 17/6 (35%) | + | 3.5 (низький) | 0.5 | − / − (0.00) |
| 14 | 2 | 2 | 24/18 (75%) | + | 5.5 (високий) | 2 | + / − (0.18) |
| 15 | 3 | 2 | 19/10 (53%) | + | 4 (низький) | 0 | − / − (0.00) |
| 16 | 2 | 3 | 20/20 (100%) | + | 6 (високий) | 1.5 | + / + (0.87) |
| 17 | 2 | 3 | 18/16 (89%) | + | 4.5 (низький) | 1 | + / + (0.59) |
| 18 | 3 | 3 | 18/18 (100%) | + | 6.5 (високий) | 2.5 | + / + (0.52) |
| 19 | 3 | 2 | 16/12 (75%) | + | 5.5 (високий) | 1.5 | + / − (0.23) |
| 20 | 2 | 1 | 18/13 (72%) | + | 4.5 (низький) | 0.5 | + / − (0.16) |
-
- СШ сіра шкала біоптату зап’ястя, ЕД енергетична доплерографія біоптату зап’ястя, Фрагменти ГЕ фрагменти відібрані для гістопатології, НСТ неушкоджена синовіальна тканина, КЯТ коефіцієнт якості тканини, G2/G3 клітинні агрегати 2-го/ 3-го класу, ІАЛ індекс агрегації лімфоцитів, не підлягає оцінці
- a Характеризується видимим шаром вистилання та ≥ 4 фрагментами, що демонструють НСТ
Результати дослідження
Були розглянуті наступні основні результати.
Доцільність
Процедурна доцільність була визначена як отримання гістологічно оцінюваної тканини. Кожну біопсію оцінювали на гістологічних слайдах на одному рівні зрізу для виявлення фрагментів, що характеризуються неушкодженою синовіальною тканиною (НСТ, що визначається мікроскопічно за наявністю характерних судин і строми при відсутності артефактних змін) [5]. Біоптати визначалися як градаційні, якщо вони містили видимий шар вистилки та кількість фрагментів, що демонстрували НСТ ≥ 4 [8]. Для описових цілей кожному біоптату присвоювали коефіцієнт якості тканини (КЯТ) відповідно до співвідношення фрагментів, що містять НСТ, до загальної кількості фрагментів у зрізі.
Застосовність різних гістометричних аналізів до градуйованих біоптатів була перевірена безпосередньо за допомогою кількісної оцінки за шкалою Krenn [19], васкуляризації підстилки (напівкількісно, 0-3) [20], та клітинної агрегації (вимірювали дихотомічно з точки зору наявності/відсутності агрегатів лімфоцитів класу (G) 2/G3 [21] та у вигляді індексу [індекс агрегації лімфоцитів, ІАЛ], що виражає співвідношення між загальною кількістю агрегатів G2 та -G3/загальною кількістю фрагментів, що демонструють НСТ).
Всі оцінки тканин були виконані наосліп двома незалежними експертами з досвідом аналізу синовіальної тканини більше 5 років (TL і AM). Розбіжності вирішували за взаємною згодою або шляхом обчислення середнього балу (напівкількісні бали Krenn’s та васкуляризації).
Безпека та переносимість
Після синовіальної біопсії кожного пацієнта спостерігали протягом 7 та 30 днів шляхом безпосереднього клінічного обстеження для оцінки кількості та типу небажаних явищ та/або локального погіршення болю. Біль у суглобах вимірювали до біопсії, одразу після біопсії, через 1 тиждень та 1 місяць за візуальною аналоговою шкалою (ВАШ) в діапазоні від 0 до 100 мм. Будь-яке погіршення на ≥ 20 мм порівняно з оцінкою до біопсії може бути пов’язане з процедурою біопсії. Короткострокову безпеку та переносимість визначали як відсутність побічних явищ та погіршення болю протягом обраних часових точок порівняно з показниками до біопсії.
Результати
Десять пацієнтів мали ранній артрит (тривалість симптомів до 12 місяців), 8 – встановлений РА (тривалість симптомів > 5 років), а 2 – артрит в ході імунотерапії раку інгібіторами контрольних точок. Тринадцять з 20 пацієнтів були жінками, середній вік становив 45 років (СВ ± 7,9), серед них не було пацієнтів з ожирінням (середнє значення ІМТ 24, СВ ± 4,2). Жоден з пацієнтів не отримував ін’єкцій глюкокортикоїдів у біоптат зап’ястя протягом попередніх 4 тижнів. Усі пацієнти мали клінічні ознаки запалення суглоба в біоптаті зап’ястя (набряк і болючість) і принаймні синовіт ПЗ суглоба 2 ступеня при УЗ [18, 22]. Середній показник (діапазон) активності захворювання 28 суглобів (ПАЗ28) у досліджуваній популяції становив 3,99 (2,77-5,07).
Середня кількість фрагментів (≥ 1 мм в діаметрі при макроскопічній оцінці) за процедуру була оброблена для гістопатології (діапазон 9-24) і присвячена дослідженню (Таблиця 1). При гістопатологічному дослідженні тканину, що піддається класифікації (видимий вистилаючий шар і ≥ 4 фрагменти з НСТ), було розпізнано в 19/20 біоптатах (95%) з медіаною КЯТ 75% (діапазон 31-100) (Таблиця 1). Всі три попередньо визначені гістометричні параметри були визнані застосовними і успішно виміряні двома експертами в 19/19 градуйованих біопсіях (Таблиця 1). У перших п’яти набраних пацієнтів з раннім артритом (відібраних до біопсії і до УЗ) було відстежено анатомічне походження отриманого фрагмента для вивчення доступності та якості тканини в 3 цільових ділянках зап’ястя.
Всі три підвідділи (проксимальний, дистальний та склепіння) показали доступність для взяття зразків за допомогою біопсійної голки 14-G. Гістологічні аналізи продемонстрували можливість отримати тканину, що піддається класифікації, і виявити патологічні зміни у всіх досліджуваних ділянках зап’ястя (Зобр. 2B і Табл. 2).
Таблиця 2 Гістологічний аналіз підвідділів зап’ястка
| Біопсійний код, n | Місце взяття біопсії | Оцінка за шкалою Krenn (ступінь синовіту) | Оцінка судинного русла | Агрегація клітин G2/G3 (ІАЛ) |
| 1 | Дa | но (не оцінюється) | но | но (не оцінюється) |
| С | 6.5 (високий) | 1 | − / + (0.50) | |
| П | 7 (високий) | 1.5 | + / − (1.50) | |
| 4 | Д | 6 (високий) | 1.5 | + / + (1.50) |
| С | 4 (низький) | 1 | − / − (0.00) | |
| П | 6 (високий) | 2 | + / + (1.20) | |
| 5 | Д | 5.5 (високий) | 1 | + / − (0.11) |
| С | 4 (низький) | 0.5 | + / − (0.15) | |
| Пb | но (не оцінюється) | но | но (не оцінюється) | |
| 8 | Д | 5 (високий) | 1 | + / − (0.39) |
| С | 4 (низький) | 0 | − / − (0.00) | |
| П | 4.5 (низький) | 0.5 | + / − (0.38) | |
| 12 | Д | 6.5 (високий) | 2.5 | + / + (0.89) |
| С | 4 (низький) | 0.5 | + / − (0.25) | |
| П | 5.5 (високий) | 1.5 | + / + (0.73) |
- Д суглобова поверхня кісток зап’ястка (дистальна ділянка), С склепіння суглобової капсули (ділянка склепіння), П суглобова поверхня променевої кістки (проксимальна ділянка), G2/G3 клітинні агрегати 2-го/ 3-го класу, ІАЛ індекс агрегації лімфоцитів, но не оцінюється.
- aНе підлягає оцінці (< 4 фрагментів з інтактною синовіальною тканиною на рівні зрізу)
- bНе виконується через дискомфорт пацієнта
Процедура в цілому переносилася добре. Всі пацієнти повідомляли про легкий дискомфорт лише під час анестезії шкіри, підшкірної клітковини та капсули суглоба. Показники болю показали незначні зміни із середнім значенням (СВ) ΔВАШ – 4 (7) одразу після біопсії, 2,3 (12) через 1 тиждень і – 3,3 (3,9) через 1 місяць (Зобр. 3). Погіршення болю в суглобах ( ΔВАШ ≥ 20) спостерігалося у 2/20 (10%) пацієнтів одразу після біопсії і в жодного через 1 тиждень і через 1 місяць. У всіх випадках біль лікували анальгетиками та/або нестероїдними протизапальними препаратами. В одного пацієнта спостерігалися екхімозні прояви на рівні анатомічної табакерки: екхімозні шкірні прояви зникли протягом наступних 2 тижнів. Під час 1-місячного спостереження жоден пацієнт не скаржився на гіпестезію або дизестезію, зокрема на оніміння та печіння. У жодного пацієнта не було виявлено інфекційних ускладнень.
Зобр. 3
Біль у суглобах як показник безпеки та переносимості процедури біопсії. Біль у місці біопсії вимірювали до біопсії (до), одразу після біопсії (після), через 1 тиждень (1 тиж) та 1 місяць (1 міс) за допомогою візуальної аналогової шкали (ВАШ) в діапазоні від 0 до 100 мм. Будь-яке погіршення на ≥ 20 мм порівняно з оцінкою до біопсії інтерпретувалося як вторинне щодо процедури. Як видно на зображенні, показники болю продемонстрували незначні зміни із середнім (СВ) ΔВАШ – 4 (7) одразу після біопсії, 2,3 (12) через 1 тиждень і – 3,3 (3,9) через 1 місяць після процедури.
Обговорення
Наш досвід демонструє, що достатню кількість і якість зразків синовіальної біопсії можна безпечно отримати за допомогою напівавтоматичної голки, введеної всередину ПЗ суглоба з використанням анатомічної табакерки в якості шляху доступу. Згідно з первинними результатами дослідження, показник успішності процедури склав 95%.
Ми змогли отримати заздалегідь визначену кількість 12 зразків у 90% процедур і отримати тканину, яка піддається оцінці, для гістопатологічного аналізу в 19/20 біопсій, включаючи випадки з мінімальною синовіальною гіпертрофією при локальному УЗ. Крім того, за винятком декількох міліметрів синовії, що вистилає капсулу, розтягнуту між променевою і човноподібною кістками, ми змогли досягти і виконати прицільний забір зразків з усієї синовіальної поверхні, з постійним усвідомленням того, що завдяки УЗ також можна взяти зразок синовії, розташованої близько до хрящово-панусового з’єднання, як з променевої, так і з зап’ясткової сторони. Це питання є актуальним і може мати вплив на дослідження синовіальної тканини як у пацієнтів з клінічно активним, так і субклінічним захворюванням (ремісія та доклінічні фази). Дійсно, одним з аспектів, який слід враховувати при мікроскопічному дослідженні зразків синовіальної біопсії, є внутрішньосуглобова різноманітність, оскільки синовіальне запалення може бути по-різному виражене в різних ділянках одного і того ж суглоба. Зокрема, зразки тканини з ділянок, близьких до хрящово-зап’ясткового з’єднання, можуть мати різні запальні біомаркери, які можуть бути недооцінені/переоцінені при аналізі зразків з більш поверхневих ділянок суглоба [23,24,25]. Порівняння ступеня та якості синовіального запального процесу в різних ділянках одного і того ж суглоба може також надати просторову інформацію про специфічні патогенетичні механізми, розкриваючи ті, що мають місцеве походження, які можуть бути більш тісно пов’язані зі складними остеїтичними або ентезитними процесами [26].
Введення біопсійного інструменту через анатомічну табакерку дає достатні гарантії від можливого ятрогенного пошкодження тканин суглоба, особливо хрящових і позасуглобових. Голка залишається на достатній відстані від хрящового дна зап’ястка протягом усього свого шляху, що ускладнює, за відсутності методичних помилок, зіткнення кінчика голки з хрящовою поверхнею. Зв’язкові структури не укріплюють капсулярну ділянку, що відповідає анатомічній табакерці, оскільки променева колатеральна зв’язка, яка проходить від шилоподібного відростка променевої кістки до горбка човноподібної кістки, прикрита сухожиллям довгого відвідного м’яза великого пальця. Тому вхід через цю ділянку не здатен пошкодити структури зв’язок і не повинен спричинити нестабільність суглоба, забезпечуючи ширшу зону комфорту для внутрішньосуглобових рухів.
З іншого боку, існують також специфічні ятрогенні ризики, які слід враховувати, зосереджуючись на ділянці анатомічної табакерки: (i) шлях променевої артерії та (ii) дві поверхневі чутливі гілки променевого нерва, поверхнева гілка та бічний шкірний нерв передпліччя, які відповідають за чутливість тильної поверхні першого пальця. Однак променева артерія перетинає табакерку біля трапецієподібної кістки на середній відстані 7,5 мм від променевого шилоподібного відростка, і її пульсація легко відчутна.
Аналогічно, перетин чутливих нервових стовбурів із сухожиллями, що обмежують анатомічну табакерку, відбувається дистально. Тому найбільш проксимальна ділянка анатомічної табакерки, на відстані не більше 5 мм від променевого шилоподібного відростка і близько до довгого м’яза-розгинача великого пальця , є найбезпечнішим шляхом входу, який захищає як променеву артерію, так і сенсорні гілки.
У 1995 році Steinberg та співавт. [27] визначили невелику, але значну безпечну зону площею приблизно 0,682 см2 в межах анатомічної табакерки біля променевого шилоподібного відростка для черезшкірної фіксації дротів Кіршнера. Однак Korcek і Wongworawat [28] поставили під сумнів цю гіпотезу, показавши, що непередбачуваність ходу двох сенсорних гілок унеможливлює визначення належної безпечної зони в анатомічній табакерці. У нашому досвіді, заснованому на ідентифікації дна анатомічної табакерки безпосередньо під сухожиллям довгого м’яза-розгинача великого пальця і безпосередньо проксимальніше трапецієподібного м’язу як воріт, неврологічних ушкоджень (таких як гіпестезія або дизестезія на тильній стороні великого пальця) або ушкоджень променевої артерії (у вигляді значних геморагічних ускладнень або аневризматичної дилатації) не виникало у жодного з пацієнтів. Тому ми вважаємо, що ретельної пальпації анатомічної табакерки та визначення променевого пульсу (разом з попереднім УЗ) достатньо, щоб окреслити фактичну зону безпеки для кожного пацієнта і запобігти ятрогенному судинно-нервовому ушкодженню.
Хоча необхідні спеціальні дослідження, безпечний широкий діапазон рухів, що дозволяє введення через анатомічну табакерку, ймовірно, має потенційні переваги над найбільш використовуваними дорсальними вхідними портами [13,14,15]. Вони розташовуються в м’якотканинній увігнутості між сухожиллями довгого м’язу-розгинача великого пальця та довгого м’язу-розгинача пальців, або між довгим м’язом-розгиначем великого пальця та довгим променевим м’язом-розгиначем зап’ястка, або між м’язом-розгиначем пальців та ліктьовим м’язом-розгиначем зап’ястка, приблизно на 1 см дистальніше горбка Лістера. Через ці доступи голка входить у ПЗ суглоб у вертикальному напрямку або з нахилом, зумовленим сухожиллями розгиначів, у будь-якому випадку не менше 45° у променево-зап’ястковому або ліктьово-зап’ястковому напрямку. Таким чином, незалежно від того, чи використовуються щипці або напівавтоматична голка, інструмент проникає в суглоб менш ніж на 2 см під кутом, який досягає лише частини синовіальної поверхні, пропускаючи синовіальну мембрану, що вистилає дорсальне склепіння суглобової капсули та крайні медіальну і латеральну частини суглоба.
Нарешті, незважаючи на те, що наше дослідження дозволило підтвердити високий рівень успішності процедури, важливо підкреслити обмеження аналізу, яке полягає у відсутності тесту на міжоператорську варіабельність. Поточні результати слід інтерпретувати в контексті процедур, що виконуються одним оператором, який має > 5 років досвіду роботи з методикою біопсії під контролем УЗ.
Висновки
Таким чином, наші результати свідчать про те, що використання анатомічної табакерки як воріт для виконання синовіальної біопсії ПЗ суглоба в малоінвазивних процедурах під контролем УЗ дозволяє не тільки отримати адекватну синовіальну тканину для гістологічної оцінки, але також може запропонувати безпечний додатковий інструмент для покращеного відбору зразків і цілеспрямованого аналізу під час одиничних і серійних процедур.
Абревіатури
УЗ:
Ультразвук
ПЗ:
Променево-зап’ястковий
РА:
Ревматоїдний артрит
СШ:
Сіра шкала
ЕД:
Енергетичний доплер
ГЕ:
Гематоксилін та еозин
НСТ:
Неушкоджена синовіальна тканина
КЯТ:
Коефіцієнт якості тканини
ВАШ:
Візуальна аналогова шкала
ПАЗ28:
Показник активності захворювання 28 суглобів
Δ:
Дельта
СВ:
Стандартне відхилення
ІАЛ:
Індекс агрегації лімфоцитів
но:
Не оцінюється
Посилання на джерела
- Manzo A, Bugatti S, Rossi S. Clinical applications of synovial biopsy. Front Med (Lausanne). 2019;6:102. https://doi.org/10.3389/fmed.2019.00102. [published Online First: 20190510].
- Orr C, Vieira-Sousa E, Boyle DL, et al. Synovial tissue research: a state-of-the-art review. Nat Rev Rheumatol. 2017;13(8):463–75. https://doi.org/10.1038/nrrheum.2017.115. [published Online First: 20170713].
- Bugatti S, Manzo A, Bombardieri M, et al. Synovial tissue heterogeneity and peripheral blood biomarkers. Curr Rheumatol Rep. 2011;13(5):440–8. https://doi.org/10.1007/s11926-011-0201-y.
- Bugatti S, BozzallaCassione E, De Stefano L, et al. Established rheumatoid arthritis. The pathogenic aspects. Best Pract Res Clin Rheumatol. 2019;33(5):101478. https://doi.org/10.1016/j.berh.2019.101478. [published Online First: 20200127].
- Rivellese F, Humby F, Bugatti S, et al. B cell synovitis and clinical phenotypes in rheumatoid arthritis: relationship to disease stages and drug exposure. Arthritis Rheumatol. 2020;72(5):714–25. https://doi.org/10.1002/art.41184. [published Online First: 20200317].
- Humby F, Durez P, Buch MH, et al. Rituximab versus tocilizumab in anti-TNF inadequate responder patients with rheumatoid arthritis (R4RA): 16-week outcomes of a stratified, biopsy-driven, multicentre, open-label, phase 4 randomised controlled trial. Lancet. 2021;397(10271):305–17. https://doi.org/10.1016/s0140-6736(20)32341-2.
- Rivellese F, Surace AEA, Goldmann K, et al. Rituximab versus tocilizumab in rheumatoid arthritis: synovial biopsy-based biomarker analysis of the phase 4 R4RA randomized trial. Nat Med. 2022;28(6):1256–68. https://doi.org/10.1038/s41591-022-01789-0. [published Online First: 20220519].
- Humby F, Kelly S, Hands R, et al. Use of ultrasound-guided small joint biopsy to evaluate the histopathologic response to rheumatoid arthritis therapy: recommendations for application to clinical trials. Arthritis Rheumatol. 2015;67(10):2601–10. https://doi.org/10.1002/art.39235.
- Humby F, Kelly S, Bugatti S, et al. Evaluation of minimally invasive, ultrasound-guided synovial biopsy techniques by the OMERACT Filter–determining validation requirements. J Rheumatol. 2016;43(1):208–13. https://doi.org/10.3899/jrheum.141199. [published Online First: 20150601].
- Humby F, Romão VC, Manzo A, et al. A multicenter retrospective analysis evaluating performance of synovial biopsy techniques in patients with inflammatory arthritis: arthroscopic versus ultrasound-guided versus blind needle biopsy. Arthritis Rheumatol. 2018;70(5):702–10. https://doi.org/10.1002/art.40433. [published Online First: 20180402].
- Scirè CA, Epis O, Codullo V, et al. Immunohistological assessment of the synovial tissue in small joints in rheumatoid arthritis: validation of a minimally invasive ultrasound-guided synovial biopsy procedure. Arthritis Res Ther. 2007;9(5):R101. https://doi.org/10.1186/ar2302.
- Kelly S, Humby F, Filer A, et al. Ultrasound-guided synovial biopsy: a safe, well-tolerated and reliable technique for obtaining high-quality synovial tissue from both large and small joints in early arthritis patients. Ann Rheum Dis. 2015;74(3):611–7. https://doi.org/10.1136/annrheumdis-2013-204603. [published Online First: 20131213].
- Tortora S, Messina C, Albano D, et al. Ultrasound-guided musculoskeletal interventional procedures around the elbow, hand and wrist excluding carpal tunnel procedures. J Ultrason. 2021;21(85):e169–76. https://doi.org/10.15557/JoU.2021.0027. [published Online First: 20210618].
- Michelotti BF, Chung KC. Diagnostic wrist arthroscopy. Hand Clin. 2017;33(4):571–83. https://doi.org/10.1016/j.hcl.2017.06.004.
- Lazarou I, Kelly SG, Meric de Bellefon L. Ultrasound-guided synovial biopsies of wrists, metacarpophalangeal, metatarsophalangeal, interphalangeal joints, and tendon sheaths. Front Med (Lausanne). 2019;6:2. https://doi.org/10.3389/fmed.2019.00002. [published Online First: 20190121].
- Lampe EW. Surgical anatomy of the hand. With special reference to infections and trauma. Clin Symp. 1988;40(3):1–36.
- Najm A, Costantino F, Alivernini S, et al. EULAR points to consider for minimal reporting requirements in synovial tissue research in rheumatology. Ann Rheum Dis. 2022;81(12):1640–6. https://doi.org/10.1136/annrheumdis-2021-221875. [published OnlineFirst: 20220224].
- Bruyn GA, Iagnocco A, Naredo E, et al. OMERACT definitions for ultrasonographic pathologies and elementary lesions of rheumatic disorders 15 years on. J Rheumatol. 2019;46(10):1388–93. https://doi.org/10.3899/jrheum.181095. [published Online First: 20190201].
- Krenn V, Morawietz L, Burmester GR, et al. Synovitis score: discrimination between chronic low-grade and high-grade synovitis. Histopathology. 2006;49(4):358–64. https://doi.org/10.1111/j.1365-2559.2006.02508.x.
- Baeten D, Kruithof E, De Rycke L, et al. Diagnostic classification of spondylarthropathy and rheumatoid arthritis by synovial histopathology: a prospective study in 154 consecutive patients. Arthritis Rheum. 2004;50(9):2931–41. https://doi.org/10.1002/art.20476.
- Manzo A, Paoletti S, Carulli M, et al. Systematic microanatomical analysis of CXCL13 and CCL21 in situ production and progressive lymphoid organization in rheumatoid synovitis. Eur J Immunol. 2005;35(5):1347–59. https://doi.org/10.1002/eji.200425830.
- Terslev L, Naredo E, Aegerter P, et al. Scoring ultrasound synovitis in rheumatoid arthritis: a EULAR-OMERACT ultrasound taskforce-Part 2: reliability and application to multiple joints of a standardised consensus-based scoring system. RMD Open. 2017;3(1):e000427. https://doi.org/10.1136/rmdopen-2016-000427. [published Online First: 20170711].
- Kraan MC, Reece RJ, Smeets TJ, et al. Comparison of synovial tissues from the knee joints and the small joints of rheumatoid arthritis patients: implications for pathogenesis and evaluation of treatment. Arthritis Rheum. 2002;46(8):2034–8. https://doi.org/10.1002/art.10556.
- Kirkham B, Portek I, Lee CS, et al. Intraarticular variability of synovial membrane histology, immunohistology, and cytokine mRNA expression in patients with rheumatoid arthritis. J Rheumatol. 1999;26(4):777–84.
- Najm A, Costantino F, Weill C, et al. Impact of synovial biopsy procedures and disease-specific aspects on synovial tissue outcome: a systematic literature review informing the EULAR points to consider for the minimal reporting requirements in synovial tissue research in rheumatology. RMD Open 2022;8(1). https://doi.org/10.1136/rmdopen-2021-002116.
- Rhodes LA, Tan AL, Tanner SF, et al. Regional variation and differential response to therapy for knee synovitis adjacent to the cartilage-pannus junction and suprapatellar pouch in inflammatory arthritis: implications for pathogenesis and treatment. Arthritis Rheum. 2004;50(8):2428–32. https://doi.org/10.1002/art.20444.
- Steinberg BD, Plancher KD, Idler RS. Percutaneous Kirschner wire fixation through the snuff box: an anatomic study. J Hand Surg Am. 1995;20(1):57–62. https://doi.org/10.1016/s0363-5023(05)80059-0.
- Korcek L, Wongworawat M. Evaluation of the safe zone for percutaneous Kirschner-wire placement in the distal radius: cadaveric study. Clin Anat. 2011;24(8):1005–9.