Автори: Hippocrates Moschouris, Andreas Dimakis, Anastasia Anagnostopoulou, Konstantinos Stamatiou, Katerina Malagari
Введення
В останні роки емболізація простатичної артерії (ЕПА) стала ефективним, малоінвазивним ендоваскулярним лікуванням симптоматичної доброякісної гіперплазії передміхурової залози (ДГПЗ).
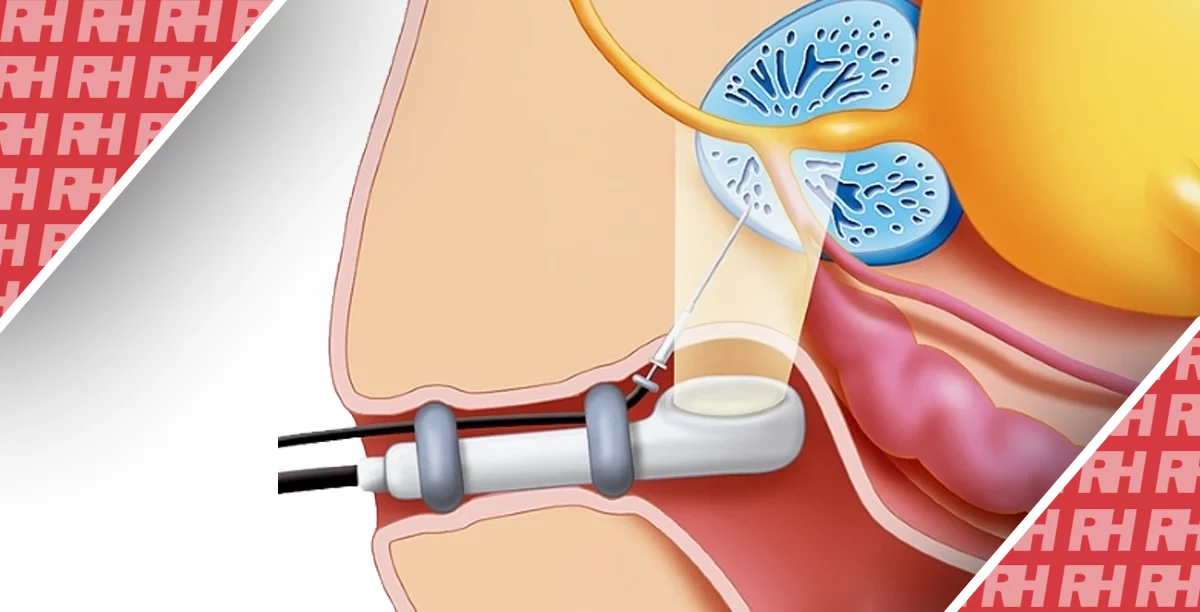
Технічно успішна ЕПА передбачає суперселективну катетеризацию і емболізацію простатичних артерій (ПА) принаймні з одного тазового боку мікрочастинками (сферичними або не сферичними, діаметром 50-500 мкм). Ішемія, викликана ЕПА, призводить до зменшення передміхурової залози і функціональних змін, які в кінцевому підсумку призводять до полегшення симптомів ДГПЗ.
Таким чином, характеристика клінічного успіху ПАЕ в першу чергу заснована на поліпшенні симптомів. Останнє кількісно виражається в зниженні показників згідно Міжнародною шкалою симптомів простати (IPSS), при цьому середні показники зниження, що повідомляються, після ЕПА складають 53,9-62,5%.
Проте, роль зображень в оцінці терапевтичної ефективності PAE також важлива. Очікується, що радіологічна візуалізація забезпечить неінвазивну, надійну і відтворену оцінку розміру передміхурової залози, а також морфологічних, текстурних і перфузійних змін, які відбуваються в простаті після ЕПА. Подальше візуалізаційне спостереження також необхідно для оцінки стійкості ефектів лікування з плином часу і для діагностики деяких ускладнень.
В даний час МРТ вважається «золотим стандартом» для візуалізації оцінки ЕПА. Завдяки чудовій контрастній роздільній здатності м’яких тканин, МРТ точно показує зміни розміру і текстури простати. Однак витрати на обладнання і обстеження можуть обмежувати доступність і відтворюваність МРТ, а методика (або відповідні контрастні речовини) може бути протипоказана деяким пацієнтам.
УЗД – більш доступний, гнучкий і широко доступний метод, який також використовувався для проведення ЕПА з самого початку застосування цього методу лікування. Хоча стандартне УЗД (сірошкальне) обмежується оцінкою розміру і форми простати до і після ЕПА, більш просунуті методи можуть значно збільшити діагностичну цінність УЗД.
Сірошкальна УЗД
Сірошкальна УЗД зазвичай використовується в багатьох центрах для розрахунку об’єму простати (PV) до і після ЕПА, а також для оцінки зменшення простати. Хоча деякі дослідники вважають за краще трансректальне УЗД (ТР-УЗД), трансабдомінальне УЗД (ТА-УЗД) також прийнятно. У досвідчених руках ТА-УЗД вимірювання об’єму простати (ОП) тісно корелюють з вимірами ТР-УЗД, і перший метод більш зручний для пацієнта і більше підходить для повторного застосування.
Слід зазначити, що було продемонстровано, що варіації об’єму сечового міхура мають незначний вплив на трансабдомінальні вимірювання ОП, якщо об’єм сечового міхура знаходиться в діапазоні 100-400 мл. При обох підходах простата сканується в аксіальній, коронарної та сагітальній площинах, а ОП розраховується за формулою еліпсоїда (довжина × висота × ширина × 0,52). Загальновизнаним недоліком цієї формули є її обмежена точність при збільшенні простати неправильної форми або асиметрично збільшеної площі.
Тривимірне УЗД може забезпечити більш точну оцінку ОП, але, як більш складний і технічно вимогливий метод, як правило, не використовується для подальшого спостереження після ЕПА. Зменшення простати, викликане технічно успішною ЕПА, незначно протягом перших днів після процедури, але стає вираженим через місяць і через 3, 6 і 12 місяців спостереження. Повідомлені середні показники зниження ОП після ЕПА складають 31,9%, 32,1% і 37,6% через 6, 12 і 24 міс після втручання, відповідно.
Внутрішньоміхурове протрузування передміхурової залози (ВПП) являє собою ступінь, в якій збільшена простата (її серединна частка, бічні частки або і те й інше) виступає в сечовий міхур. ВПП викликає закупорку кульового клапана і порушує лійкоподібну форму шийки сечового міхура, тим самим сприяючи закупорці вихідного отвору сечового міхура. ВПП більше 10 мм вважається значущим і асоціюється зі збільшенням ОП і зниженням швидкості потоку сечі. УЗД є стандартним методом для розрахунку ВПП, який вимірюється в сагітальній проекції і визначається як найбільша відстань по вертикалі від кінчика передміхурової залози до окружності сечового міхура. ЕПА довела свою ефективність в зниженні ВПП (зареєстровані показники зниження: 14,7% -25%) і цей ефект був пов’язаний з клінічним поліпшенням у пролікованих пацієнтів.
CEUS
Необоротна ішемія передміхурової залози і наступний інфаркт грають центральну роль в терапевтичній дії ЕПА. Емболізованні інфарктні аденоми поступово зменшуються в розмірах, зменшується масовий вплив на простатичну уретру і поліпшуються симптоми, а також сечовипускання.
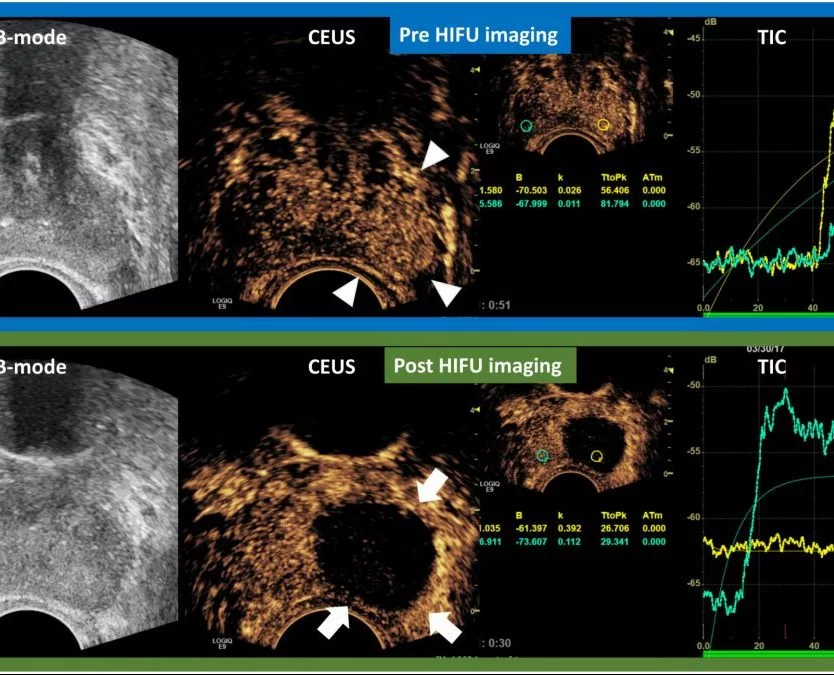
В даний час наші знання щодо візуалізації ішемії передміхурової залози після ЕПА отримані в основному з досліджень МРТ з контрастуванням. Проте, УЗД з контрастним посиленням (CEUS), як метод детальної візуалізації мікро- і макроциркуляції в реальному часі, також дав багатообіцяючі результати. Фактично, завдяки своєму анатомічному розташуванню, дость невеликому розміру і нерухомості простата може бути навіть більш підходящою мішенню для дослідження CEUS в порівнянні з печінкою і іншими органами черевної порожнини.
Дійсно, CEUS пост-ЕПА довів свою здійсненність, рентабельність і здатність детально відображати інфаркти простати. Подібно до інших абдомінальних аплікацій CEUS, контрастну речовину для ультразвуку другого покоління вводять болюсно в вену передпліччя з наступним промиванням фізіологічним розчином. Використовується спеціальна методика безперервного сканування, специфічного для контрасту, з низьким механічним індексом (MI = 0,09-0,13), і простата сканується в трьох площинах протягом 1-2 хвилин після ін’єкції.
Як ТР так і ТА-CEUS можуть застосовуватися для зображення інфарктів простати, при цьому перший підхід пропонує більш високу просторову роздільну і контрастну здатність; однак порівняння цих двох підходів показало незначні відмінності у вимірах інфаркту простати після ЕПА.
Коли вузлики ДГПЗ повністю інфарктовані, вони з’являються як дефекти округлої або овальної форми на CEUS; коли виник неповний інфаркт, дефекти посилення можуть бути неправильної форми. Інфаркт простати може бути виявлений практично відразу після ЕПА; однак він більш чітко окреслений в перші дні після процедури. У наступні тижні інфаркти передміхурової залози поступово зменшуються, і більшість з них зникають через 3-6 місяців після ЕПА (Зобр. 1).
Слід зазначити, що інфаркти, викликані ЕПА, локалізуються виключно в перехідній зоні; периферична зона зберігається, можливо, через відмінності в її кровопостачанні і мікроциркуляції.
Зображення 1: Еволюція результатів сірошкальної УЗД і контрастноїУЗД після емболізації артерії простати. Результати представлені в режимі «розділеного екрану» з не покращенним еталонним зображенням в B-режимі зліва і відповідним ультразвуковим зображенням з контрастним посиленням (CEUS) праворуч. A: Трансабдомінальна УЗД показує ехогенні осередки в обох частках простати (стрілки), що недавно з’явилися. CEUS показує великий двосторонній інфаркт простати; B: через місяць після ЕПА ехогенні осередки зникли, інфаркти простати стали краще окреслені і менше за розміром; C і D: Оцінка через 6 і 12 місяців після ЕПА, відповідно, показує, що інфаркти зменшилися або зникли, і можна оцінити зменшення простати. Зірочки вказують на інфаркт простати на всіх зображеннях CEUS. Всі зображення в аксіальній площині
Об’єм інфаркту простати можна розрахувати за формулою еліпсоїда (так само, як і ОП), і це прийнятний метод для регулярних, круглих або яйцевидних інфарктів. Об’ємна оцінка за допомогою планіметрії і спеціального програмного забезпечення дає чудову точність, особливо в разі множинних інфарктів неправильної форми.
Об’єм інфаркту передміхурової залози ділиться на ОП (розрахований одночасно) і визначається відсоток ішемії передміхурової залози (pІП). pІП сильно корелює з подальшим зменшенням передміхурової залози, (останнє є кінцевим результатом абсорбції інфарктної тканини) і може прогнозувати його. Ступінь інфаркту передміхурової залози, мабуть, є предиктором клінічного успіху ЕПА, по крайній мірі, в підгрупі пацієнтів з ДГПЗ, затримкою сечі і постійним катетером сечового міхура (Зобр 2).
У недавньому дослідженні із систематичною оцінкою CEUS після ЕПА успішне видалення катетера було досягнуто тільки у пацієнтів з pІП> 10%.
Зображення 2: Різна ступінь і поширення інфарктів передміхурової залози у пацієнтів з різними клінічними результатами. A: Трансректальна CEUS 5-денна пост-былатеральна емболізація простатичної артерії у пацієнта з постійним катетером сечового міхура показує обширний інфаркт лівої частки простати і менші інфаркти справа. Через тиждень стало можливим видалення катетера Фолея і спонтанне сечовипускання; B: Трансабдомінальна CEUS через один день після двосторонньої ЕПА показує великий двосторонній інфаркт простати. Пацієнт відчув швидке і стійке поліпшення симптомів; C: CEUS через день після односторонньої (зліва) ЕПА у пацієнта з постійним катетером сечового міхура показує невеликий інфаркт лівої частки. Множинні спроби видалення катетера Фолея у цього пацієнта зазнали невдачі, і в кінцевому підсумку йому була зроблена трансуретральна резекція. Стрілки вказують на ехогенні вогнища, які з’являються в емболізованих частинах простати незабаром після ЕПА. Зверніть увагу, що при невеликому односторонньому інфаркті ехогенних вогнищ не виявлено. Всі зображення в аксіальній площині.
Еластографія
Майже напевно інфаркт, за яким слідує скорочення простати, – не єдиний терапевтичний механізм ЕПА. Фактично, зменшення ОП і полегшення зовнішнього здавлення простатичної уретри зачіпає тільки «статичний» (анатомічний) компонент ДГПЗ. Однак існує також «динамічний» (функціональний) компонент в патофізіології ДГПЗ, пов’язаний з активацією альфа 1 -адренорецепторів простати і пов’язаний зі зниженням еластичності аденоматозної тканини простати.
Вважається, що ЕПА блокує надходження симпатичних медіаторів, які додатково необхідні для активації альфа-1-рецепторів; ЕПА зменшує кількість самих рецепторів, тим самим покращуючи еластичність простати. Цей потенційний механізм підтверджується клінічним наглядом «розм’якшення» простати при пальцевому ректальному дослідженні після успішної ЕПА.
Еластографія також використовувалася для отримання відповідних доказів (Зобр. 3 і 4). Еластографія зсувної хвилі (ЕЗХ) використовує ультразвуковий штовхаючий імпульс для генерації поперечної хвилі в тканинах. На швидкість поперечної хвилі впливає жорсткість тканини (більш висока швидкість в більш жорстких тканинах); швидкість поперечної хвилі може бути розрахована і закодована за кольором для кожного пікселя відповідного УЗД-зображення, таким чином створюючи еластографічну колірну карту, яка накладається на півтонування. Порівнюючи тканину до і після стиснення, ступінь локальної деформації тканини оцінюється в режимі реального часу і відображається на кольоровій карті.
Зображення 3: Еластографія зсувної хвилі простати. A: Рання; B: Через три місяці після двосторонньої емболізації простатичної артерії. Продемонстровано значне зниження (40,5%) модуля пружності (ЕМ) перехідної зони, що вказує на підвищену еластичність тканини простати після ЕПА. Еластографічні зміни супроводжувалися помітним поліпшенням клінічних показників, а також об’єму простати (зменшення на 55%) і залишкового об’єму після сечовипускання (зменшення на 76%). Випадок люб’язно наданий доктором де Ассіс А.М., Відділення інтервенційної радіології, Інститут радіології, Медична школа Університету Сан-Паулу.
Зображення 4: Кореляція результатів ультразвукового дослідження з контрастним посиленням, гістопатологічні і еластографічні дані після односторонньої (правої) емболізації простатичної артерії. A: Зображення трансабдоминального УЗД з контрастним посиленням (CEUS) (аксіальний розріз), отримане через один тиждень після емболізації простатичної артерії, показує обширний інфаркт правого геміпростата (зірочка); B: Гістопатологія (забарвлення гематоксилін-еозином, вихідне збільшення × 40) зразка трансректальной біопсії під контролем УЗД правої перехідної зони підтверджує присутність еозинофільних мікросфер (стрілки) в артеріолах, що оточують ацинус простати. Ця біопсія була проведена через 12 місяців після ЕПА; C: Трансректальні еластографічні зображення деформації (аксіальні зрізи) простати через 13 місяців після ЕПА демонструють підвищену деформацію в правому геміпростаті і в центрі правої перехідної зони (обведені червоною і бірюзовою лініями відповідно) в порівнянні з лівим геміпростатом. І до центру лівої перехідної зони (позначеної зеленою і жовтою лініями відповідно).
Внутрішньопроцедурне УЗД при ЕПА
Деякі дослідники, користуючись перевагами портативності і гнучкості УЗД обладнання, застосували методи УЗД в ангіо- блоці, де виконується ЕПА, для оцінки процедури на місці. При сірошкальній УЗД ехогенні вогнища з’являються в передміхуровій залозі відразу після ЕПА і залишаються видимими протягом декількох днів після процедури. Це відкриття, ймовірно, викликане крихітними бульбашками повітря, захопленими сумішшю контрастної речовини і емболічного матеріалу. Ці механізми аналогічні тим, які викликають «ехогенну відповідь» в пухлинах печінки після трансартеріальної (хіміо) емболізації. Ехогенні осередки більш виражені і численні в простаті з обширним інфарктом після ЕПА.
ТА-CEUS зі стандартним (внутрішньовенним) шляхом введення контрасту також може бути виконано в ангіографічному кабінеті незабаром після ін’єкції емболічного матеріалу, щоб продемонструвати ішемічний ефект. Інфаркт передміхурової залози можна виявити вже через кілька хвилин після емболізації; проте іноді точна оцінка їх ступеня в цей час може бути скомпрометована вищезгаданими ехогенними вогнищами.
Останнє можна відрізнити від мікропухирців контрасту шляхом порівняння (на розділеному екрані пристрою) Не поліпшенне зображення у відтінках сірого з відповідним зображенням CEUS і спостереження, що ехогенні осередки нерухомі, а мікропухирці постійно циркулюють. Ця негайна оцінка ішемічного ефекту може призвести до подальших рішень щодо процедури: якщо CEUS демонструє неадекватний інфаркт, незважаючи на очевидну ангіографічну ознаку стазу кровотоку в ПА, слід розглянути повторну оцінку кровотоку за допомогою ангіографії (після тайм-ауту в кілька хвилин) і пошук додаткових варіантів. (Зобр 5).
Зображення 5: Внутрішньопроцедурна сонографічна оцінка емболізації простатичної артерії за допомогою ультразвукового дослідження з внутрішньовенним контрастуванням. A: Рентгенограма (в передньозадній проекції) відразу після емболізації правої передміхурової артерії показує кінчик мікрокатетора (пунктирна стрілка) в проксимальній (екстрапростатичній) частині правої передміхурової артерії. Об’єднання контрасту емболічної суміші викликало помутніння правого геміпростата (стрілки). «F» позначає балон катетера Фолея; B і C: Трансабдомінальне УЗД з контрастним посиленням (CEUS), аксіальний і правий парасагітальний зріз, відповідно, підтверджує адекватну деваскулярізацію (інфаркт) правого геміпростата (зірочки).
Внутрішньоартеріальний CEUS також використовувався для внутрішньопроцедурного керівництва ЕПА. Цей метод включає сонографію простати з алгоритмом CEUS під час ін’єкції розведеного контрасту через мікрокатетер, розташований в ПА. Одна група використовувала суспензію ліпідних мікросфер перфлютрена (Definity, Lantheus Medical Imaging, North Billerica, MA, США), в розведенні 1:20 в фізіологічному розчині і введену невеликими аліквотами (0,3-0,5 мл); розбавлений SonoVue також може бути використаний для ВА-CEUS, хоча слід визнати, що це буде не за прямим призначенням.
Внутрішньоартеріальне УЗД може бути виконано до емболії, щоб показати частину простати, що живиться обраною артерією (Зобр. 6). Візуалізація сусідніх органів (наприклад, сечового міхура, прямої кишки) також може бути продемонстрована, якщо частини цих органів мають той же артеріальне кровопостачання, що і простата. Таким чином, ВА-CEUS може підтвердити успішний вибір ПА і запобігти деяким випадкам нецільової емболізації.
Внутрішньоартеріальний CEUS може грати роль в управлінні ЕПА, особливо коли КТ-обладнання з конічним пучком недоступно.
Внутрішньопроцедурна сонографія може бути технічно складним завданням, і отримання зображень прийнятної якості не гарантується: сканування має виконуватися трансабдомінально, під стерильними простирадлами; катетеризуваний сечовий міхур зазвичай порожній, і сам катетер Фолея може бути перешкодою для ультразвукового променя.
Зображення 6: Внутрішньопроцедурна сонографічна оцінка емболізації простатичної артерії за допомогою внутрішньоартеріального ультразвукового дослідження з контрастуванням. A: Ангіографічне зображення (в передньозадній проекції) показує праву передміхурову артерію і її гілки; B: Зображення трансабдомінального УЗД з контрастним посиленням через 3 секунди після внутрішньоартеріальної ін’єкції розведеного Sonovue показує швидке, інтенсивне посилення правої частки простати, більш помітне на її периферії (стрілки); C: зображення через 7 секунд показує більш дифузне посилення правої частки і ледь помітне посилення в невеликій області лівої частки (пунктирна стрілка). Ознак екстрапростатичного посилення помічено не було, емболізація проводилася мікросферами (діаметр: 100-300 мкм); D: Не поліпшене УЗД зображення через 10 хвилин після емболізації показує підвищену ехогенність правої частки (зірочка). «F» позначає балон катетера Фолея на всіх зображеннях. Зображення CEUS в аксіальній площині.