Резюме
Передумови
Трансректальна (ТР) біопсія простати під контролем УЗД і трансперінеальна (ТП) біопсія простати під контролем УЗД – два найпоширеніші методи виявлення раку передміхурової залози, причому частота виявлення при цих двох методах біопсії може відрізнятися у пацієнтів з різними клінічними характеристиками. У цьому дослідженні ми мали на меті порівняти частоту виявлення раку передміхурової залози та частоту позитивних біопсійних ядер при ТР і ТП біопсії передміхурової залози у пацієнтів з різними клінічними характеристиками.
Методи
Ми ретроспективно проаналізували та порівняли клінічні дані 452 пацієнтів, яким була виконана ТР або ТП біопсія простати в нашій лікарні з червня 2017 року по вересень 2021 року. Пацієнти були стратифіковані за кількома клінічними характеристиками (рівень ПСА в сироватці крові, об’єм простати, щільність ПСА, стадія Т та ступінь МТУП), частота виявлення раку та частота виявлення позитивних пунктатів порівнювалися в різних стратифікованих групах.
Результати
Не було достовірної різниці у віці, рівні ПСА, об’ємі простати та щільності ПСА між групами ТР і ТП. У групі ТР був вищий загальний рівень виявлення раку та позитивний рівень біопсійних ядер, ніж у групі ТП. Подальший аналіз підгруп показав, що група ТР мала вищий рівень виявлення раку у пацієнтів з об’ємом простати 30-80 мл і що група ТР мала вищий рівень позитивних результатів біопсії серед пацієнтів зі стадіями Т3-Т4, тоді як група ТП мала вищий рівень позитивних результатів біопсії серед пацієнтів зі стадіями Т1-Т2. Не було достовірних відмінностей між групами ТР і ТП для кожної підгрупи при стратифікації за рівнем ПСА, щільністю ПСА і ступенем МТУП.
Висновки
ТР підхід може мати перевагу у пацієнтів з об’ємом простати 30-80 мл і стадіями T3-T4, тоді як ТП підхід може мати перевагу у пацієнтів зі стадіями T1-T2.
Передумови
Рівень діагностики раку передміхурової залози зростає з кожним роком [1]. У 2021 році рак передміхурової залози є першою найпоширенішою злоякісною пухлиною, яку діагностують у чоловіків у всьому світі [2]. При підозрі на рак простати стандартним методом діагностики залишається біопсія простати [3]. Вперше про трансректальну (ТР) біопсію під контролем УЗД повідомили Cooner зі співавт. і в подальшому вдосконалили Hodge зі співавт. [4, 5]. Трансперінеальна (ТП) біопсія простати запропонувала альтернативний підхід, і через десятиліття після опису, ТП біопсія простати набуває все більшого поширення завдяки нижчому ризику інфекційних ускладнень та вищій частоті діагностики раку передміхурової залози [6, 7].
Було проведено кілька досліджень для порівняння частоти виявлення та ускладнень ТР і ТП підходів. По-перше, ТП біопсія значно зменшує кількість інфекційних ускладнень порівняно з ТР біопсією [8,9,10], а також покращує частоту виявлення раку передміхурової залози [11, 12]. Більше того, у більшості досліджень не було виявлено суттєвих відмінностей як у частоті виявлення раку, так і в частоті виявлення ядра раку між ТР і ТП підходами до біопсії передміхурової залози [13,14,15,16]. Однак частота виявлення раку при цих двох методах біопсії може відрізнятися у пацієнтів різного віку, з різним рівнем ПСА та об’ємом простати [17, 18].
Для досягнення балансу між частотою виявлення раку та несприятливими побічними ефектами рекомендовано проводити 12-контактну мультифокальну біопсію [19]. У нашому центрі майже всі біопсії передміхурової залози виконуються за допомогою 12-контактної мультифокальної біопсії плюс 1 пунктування у підозрілій ділянці. Трансректальна біопсія простати була єдиним вибором до травня 2020 року в нашій лікарні, а в травні 2020 року наш центр почав виконувати ТП фрі хенд біопсію простати під ультразвуковим контролем. У цьому дослідженні були ретроспективно проаналізовані клінічні дані 452 пацієнтів нашої лікарні, яким була проведена біопсія простати, щоб порівняти показники виявлення між ТП і ТР підходами. Крім того, порівнюючи показники виявлення пацієнтів з різними клінічними характеристиками, ми мали на меті з’ясувати оптимальний підхід до біопсії у пацієнтів з різними клінічними характеристиками.
Матеріали та методи
Вибірка пацієнтів
У цьому дослідженні взяли участь 452 пацієнти, яким була проведена біопсія простати ТР або ТП у відділенні урології лікарні Чжуннань Університету Ухань з червня 2017 р. по вересень 2021 р. Пацієнти з ПСА ≥ 100 нг/мл були виключені, оскільки частота виявлення раку передміхурової залози у них була близькою до 100%. Всі методи, використані для аналізу в цьому дослідженні, були проведені відповідно до затверджених положень Комітету з медичної етики лікарні Чжуннань Університету Ухань. Показання до біопсії передміхурової залози базуються на “Китайському керівництві з діагностики та лікування урологічних захворювань”, включаючи пацієнтів з: (1) підозрілі ураження, виявлені при цифровому ректальному дослідженні (ЦРД); (2) підозрілі ураження при візуалізації; (3) ПСА > 10 нг/мл; (4) 10 нг/мл ≥ ПСА > 4 нг/мл та аномальне співвідношення вільного/загального ПСА або щільність ПСА.
Біопсія
Майже всі біопсії передміхурової залози (як ТР, так і ТП підходи) в нашій лікарні виконуються з використанням 12-ти контактної мультифокальної біопсії плюс 1 пунктування у підозрілій ділянці. Біопсії виконували “віялоподібно” [20], для отримання зразків використовували одноразовий інструмент для біопсії 18 калібру (Bard Healthcare Science, Shanghai, CO, LTD.). Кожен біопсійний матеріал маркували і упаковували з урахуванням особливостей ділянки та присвоювали окремий бал за шкалою Глісона. Біопсію передміхурової залози в основному виконують д-р І Ло та д-р Чжунхуа Ян, які добре володіють обома методами біопсії. Трансректальна біопсія простати була єдиним вибором до травня 2020 року. З тих пір, як у травні 2020 року в нашій лікарні почали проводити фрі хенд ТП біопсію простати під контролем УЗД. ТП біопсія простати переважно рекомендується пацієнтам через нижчий рівень інфікування згідно з чинними рекомендаціями Європейської асоціації урологів (ЄАУ). А трансректальна біопсія простати, з нижчою вартістю через відсутність потреби в анестезії, була альтернативним підходом, коли пацієнт обирав її.
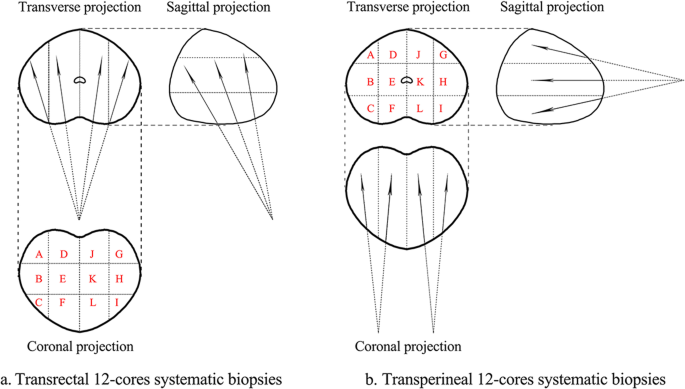
Відповідно до тих же етапів, що описані в літературі [21], пацієнтів, яким виконували трансректальну процедуру, укладали в ліве бічне положення декубітусу. Анестезію не застосовували. Для розміщення голки та наведення використовували трансректальний ультразвуковий датчик (ТУЗД). Стандартна процедура біопсії включала забір зразків парасагітальної середньої лінії та латеральної апікальної, медіальної та базальної ділянок з обох боків, загалом 12 пунктатів, а також додаткові пунктати з підозрілих ділянок (зобр. 1а). Пацієнта, якому виконували трансперінеальну процедуру, розташовували в літотомічному положенні і вводили загальну анестезію. Надлишкове волосся було виголене, а промежина підготовлена за допомогою 1% повідон-йоду. Для візуалізації уретри на ультразвукових зображеннях використовували постійний катетер Фолея. Мошонку піднімали спереду за допомогою хірургічної драпіровки, щоб забезпечити доступ до промежини. Криволінійний ультразвуковий датчик (трансперінеальний ультразвук, ТПУЗД) притискали вертикально до нижньої частини промежини і візуалізували залозу. Голку вводили з верхнього краю датчика в площині з ультразвуковим променем. Простату розділяли на ліву та праву частки. Для кожної частки брали по шість пунктатів з передньої, середньої та задньої зон латеральної та медіальної ділянки, додаткові пунктати брали з підозрілих ділянок (Зобр. 1б).
Зобр. 1
Модельна схема трансректальної та трансперінеальної біопсії передміхурової залози: поперечна, сагітальна та коронарна проекції мультифокальних біопсій ТР (а) та ТП (б) 12-контактних мультифокальних біопсій.
Збір даних
Шляхом ретроспективного аналізу медичної документації було отримано наступні клінічні дані, які порівнювали між двома групами: вік, рівень ПСА в сироватці крові (нг/мл), об’єм простати (мл), частота діагностики раку простати та частота позитивних результатів біопсії, об’єм простати розраховували за формулою: висота × ширина × довжина × 0,52 (в см). Далі пацієнти були стратифіковані за кількома клінічними характеристиками, включаючи: рівень ПСА в сироватці крові, об’єм простати, щільність ПСА, стадію Т і клас МТУП (Міжнародне товариство урологічної патології), частоту виявлення раку і частоту позитивних пунктатів порівнювали в різних стратифікованих групах.
Статистичний аналіз
Постійні змінні були описані як середні значення, діапазони та медіани. Вік порівнювали за допомогою незалежного t-критерію, тоді як рівень ПСА, об’єм простати та щільність ПСА порівнювали за допомогою U-критерію Манна-Уітні, оскільки вони не відповідали нормальному розподілу. Нормальність розподілу кожного набору даних перевіряли за допомогою критерію Колмогорова-Смірнова. Для порівняння частоти діагностики раку передміхурової залози та частоти позитивних результатів біопсійних ядер у різних групах використовували критерій хі-квадрат. Тест Кокрана-Мантеля-Хензеля (КМГ) був проведений для порівняння частоти виявлення раку після контролю спотворювальних змінних, таких як рівень ПСА та щільність ПСА. Результати були виражені як відношення шансів (ВШ) з 95% довірчими інтервалами (ДІ). Для проведення всіх статистичних аналізів використовували SPSS 22.0, а значення p < 0,05 вважалося значущим.
Результати
З 452 пацієнтів, яким було проведено біопсію простати (табл. 1), у 230 (50,9%) випадках було діагностовано рак простати, загальний позитивний показник біоптатів склав 24,6% (1416 з 5759 біоптатів). Середній вік становив 70,1 року, середній рівень ПСА – 22,0 нг/мл, середній об’єм простати – 57,0 мл, середня щільність ПСА – 0,51 нг/мл2. Не було достовірної різниці у віці, рівні ПСА, об’ємі простати та щільності ПСА між двома групами. Загальна частота виявлення в групі ТР виявилася вищою, ніж у групі ТП у нашому дослідженні (56,3% проти 44,4%, ВШ: 1,612, 95% ДІ: 1,111-2,340, р = 0,012). Щоб мінімізувати вплив рівня ПСА та щільності ПСА у двох групах, був проведений КМГ-тест, який показав, що частота виявлення раку в групі ТР все ще була вищою, ніж у групі ТП, як при поправці на рівень ПСА, так і при поправці на щільність ПСА (ВШ: 1. 529, 95% ДІ: 1,036-2,255, р = 0,032), або при поправці на щільність ПСА (ВШ: 1,514, 95% ДІ: 1,030-2,226, р = 0,035). Аналогічно, частота позитивних результатів біопсії була вищою в групі ТР, ніж в групі ТП (27,5% проти 21,0%, ВШ: 1,429, 95% ДІ: 1,264-1,616, р < 0,001).
Таблиця 1 Клінічні характеристики пацієнтів, яким виконали трансректальну або трансперінеальну біопсію простати
| Змінні | Всі пацієнти (n = 452) | Трансректальна біопсія (n = 245) | Трансперінеальна біопсія (n = 207) | p value |
|---|---|---|---|---|
| Вік при біопсії (років) | ||||
| Середнє/медіанне значення | 70.1 ± 8.4/70 | 70.0 ± 8.7/70 | 70.3 ± 8.1/70 | 0.769 |
| Діапазон | 45–88 | 45–88 | 51–88 | |
| ПСА (нг/мл) | ||||
| Середнє/медіанне значення | 22.0 ± 20.6/13.8 | 23.2 ± 21.8/14.1 | 20.6 ± 19.0/13.7 | 0.634 |
| Діапазон | 0.3–99.2 | 0.3–99.2 | 0.8–97.6 | |
| Об’єм простати (мл) | ||||
| Середнє/медіанне значення | 57.0 ± 36.0/49 | 54.4 ± 31.6/46 | 60.0 ± 40.3/52 | 0.151 |
| Діапазон | 10–334 | 11–204 | 10–334 | |
| Щільність ПСА (нг/мл2) | ||||
| Середнє/медіанне значення | 0.51 ± 0.59/0.27 | 0.55 ± 0.64/0.29 | 0.47 ± 0.51/0.26 | 0.181 |
| Діапазон | 0.01–3.63 | 0.01–3.63 | 0.02–2.40 | |
| Рівень діагностики раку передміхурової залози (n, %) | 230/452 (50.9%) | 138/245 (56.3%) | 92/207 (44.4%) | 0.012 |
| Позитивна частота виявлення у біопсійному матеріалі (n, %) | 1416/5759 (24.6%) | 876/3185 (27.5%) | 540/2574 (21.0%) | < 0.001 |
Крім того, для порівняння частоти виявлення раку передміхурової залози при двох методах біопсії у пацієнтів з різними клінічними характеристиками був проведений підгруповий аналіз за рівнем ПСА в сироватці крові, об’ємом простати і щільністю ПСА. Як показано в Таблиці 2, при аналізі підгруп, стратифікованих за рівнем ПСА, не було виявлено достовірних відмінностей у частоті виявлення раку між групами ТР і ТП для кожної підгрупи. При стратифікації за об’ємом простати, група ТР має вищий рівень виявлення раку, ніж група ТП, серед пацієнтів з об’ємом простати 30-80 мл (56,3% проти 40. 5%, ВШ: 1,892, 95% ДІ: 1,165-3,073, р = 0,010), а також у підгрупі з об’ємом простати > 80 мл (36,6% проти 16,3%, ВШ: 2,967, 95% ДІ: 1,060-8,305, р = 0,034). Однак не було виявлено суттєвої різниці між двома підходами до біопсії в частоті виявлення раку серед пацієнтів з об’ємом простати ≤ 30 мл. Аналогічно, показники виявлення раку достовірно не відрізнялися між групами ТР і ТП відповідно до різної щільності ПСА. Для мінімізації впливу рівня ПСА в аналізі підгруп з різним об’ємом простати був проведений КМГ-тест, який показав, що група ТР все ще має вищий рівень виявлення раку, ніж група ТП з об’ємом простати 30-80 мл (ВШ: 1,838, 95% ДІ: 1,086-3,112, р = 0,023), тоді як у підгрупі з об’ємом > 80 мл достовірної різниці у рівні виявлення раку не було (р = 0,087).
Таблиця 2 Порівняння частоти виявлення раку простати за рівнем ПСА, об’ємом простати та щільністю ПСА між трансректальною та трансперінеальною біопсією простати
| Змінні | Всі пацієнти (n, %) | Трансректальна біопсія (n, %) | Трансперінеальна біопсія (n, %) | p value |
|---|---|---|---|---|
| ПСА (нг/мл) | ||||
| ≤ 10 | 63/152 (41.4) | 40/87 (46.0) | 23/65 (35.4) | 0.190 |
| 10–20 | 56/140 (40.0) | 29/63 (46.0) | 27/77 (35.1) | 0.188 |
| 20–100 | 111/160 (69.4) | 69/95 (72.6) | 42/65 (64.6) | 0.280 |
| Об’єм простати (мл) | ||||
| ≤ 30 | 74/96 (77.1) | 38/53 (71.7) | 36/43 (83.7) | 0.163 |
| 30–80 | 134/272 (49.3) | 85/151 (56.3) | 49/121 (40.5) | 0.010 |
| > 80 | 22/84 (26.2) | 15/41 (36.6) | 7/43 (16.3) | 0.034 |
| Щільність простати (нг/мг2) | ||||
| ≤ 0.15 | 23/92 (25.0) | 14/42 (33.3) | 9/50 (18.0) | 0.091 |
| > 0.15 | 207/360 (57.5) | 124/203(61.1) | 83/157 (52.8) | 0.118 |
Серед 230 пацієнтів з діагнозом раку передміхурової залози, встановленим за допомогою біопсії, стадії Т можна було оцінити у 175 пацієнтів (104/138 у групі ТР, 71/92 у групі ТП). Далі ми проаналізували різницю в частоті позитивних результатів у біопсійному матеріалі між двома методами біопсії у пацієнтів з різними Т стадіями. Як показано в таблиці 3, група ТР має вищий показник позитивних результатів біопсії серед пацієнтів зі стадіями Т3 і Т4 (72,4% проти 62,5%, ВШ: 1,573, 95% ДІ: 1,213-2,038, р = 0,001), тоді як група ТП має вищий показник серед пацієнтів зі стадіями Т1 і Т2 (30,6% проти 36,9%, ВШ: 0,754, 95% ДІ: 0,585-0,972, р = 0,029). Крім того, за винятком 1 пацієнта в групі ТР з діагнозом нейроендокринна карцинома, класи МТУП (Міжнародне товариство урологічної патології) були отримані відповідно до найвищого ступеня патології в біоптаті для кожного окремого пацієнта. При стратифікації за ступенем МТУП не було виявлено значущих відмінностей у позитивних результатах біопсії між групами ТР і ТП для кожної підгрупи.
Таблиця 3 Порівняння частоти позитивних результатів біопсії відповідно до стадії Т та класу МТУП між трансректальною та трансперінеальною біопсією передміхурової залози
| Змінні | Всі пацієнти (n, %) | Трансректальна біопсія (n, %) | Трансперінеальна біопсія (n, %) | p value |
|---|---|---|---|---|
| T стадія | ||||
| T1 + T2 | 381/1160 (32.8) | 231/754 (30.6) | 150/406 (36.9) | 0.029 |
| T3 + T4 | 725/1065 (68.1) | 433/598 (72.4) | 292/467 (62.5) | 0.001 |
| МТУП оцінка | ||||
| 1 | 79/542 (14.6) | 49/351 (14.0) | 30/191 (15.7) | 0.582 |
| 2–3 | 369/853 (42.3) | 192/455 (42.2) | 177/398 (44.5) | 0.504 |
| 4–5 | 955/1520 (62.8) | 622/975 (63.8) | 333/545 (61.1) | 0.297 |
Обговорення
З того часу, як біопсія під контролем УЗД була представлена Hodge та співат. [5], вона поступово стала основним методом діагностики раку передміхурової залози в усьому світі. Незважаючи на рутинне застосування антимікробної профілактики, приблизно 3-5% пацієнтів, яким виконується біопсія за допомогою ТУЗД, повторно госпіталізуються з приводу інфекції [22, 23]. Біопсія під контролем УЗД була рекомендована як більш безпечна альтернатива через нижчий рівень інфікування [9, 10]. У нашому дослідженні у 4,1% (10/245) пацієнтів у групі ТР після процедури біопсії розвинулася лихоманка (> 38,0 °C), тоді як у групі ТП лихоманка розвинулася у 1,0% (2/207) пацієнтів. Статистично, у групі ТР пацієнти мали вищий рівень інфікування, ніж у групі ТП (ВШ: 4,362, 95% ДІ: 0,945-20,137, р = 0,040). Через нижчий рівень інфікування при ТП біопсії згідно з чинними рекомендаціями ЄАУ, ТП біопсію переважно рекомендують пацієнтам, відколи її почали виконувати в нашій лікарні в травні 2020 року. І саме тому понад 90% пацієнтів вважали за краще обрати ТП біопсію, коли вона була доступна, тоді як кілька пацієнтів обрали ТР біопсію, яка є дешевшою і не потребує анестезії. За останні десятиліття, з удосконаленням мультипараметричної МРТ (магнітно-резонансної томографії) діагностики, МРТ стає все більш чутливою для виявлення раку передміхурової залози [24]. МР/УЗД у поєднанні з керованою біопсією, (комбінована прицільна біопсія і мультифокальна біопсія), виявила більше випадків раку простати, ніж біопсія, керована ультразвуком, особливо клінічно значущого раку [25, 26]. Однак, через високу вартість МР/УЗД біопсії, системна біопсія під контролем ТУЗД все ще залишається основним методом біопсії передміхурової залози для її легкої популяризації.
Було проведено кілька попередніх досліджень для порівняння частоти виявлення раку передміхурової залози при ТР і ТП підходах, які не виявили суттєвої різниці в загальній частоті виявлення раку між цими двома підходами [13, 14, 27, 28, 29]. Jiang та співавт. [17] повідомили, що частота виявлення при ТР підході була вищою, ніж при ТП підході у пацієнтів з рівнем ПСА 20,1-100,0 нг/мл (80,8% проти 69,1%, р = 0,040). У нашому дослідженні загальна частота виявлення в групі ТР виявилася вищою, ніж у групі ТП (56,3% проти 44,4%, ВШ: 1,612, р = 0,012). Ми припускаємо, що ця різниця може бути пов’язана з тим, що середній рівень ПСА (22,0 ± 20,6 нг/мл) у нашому дослідженні був значно вищим, ніж у більшості раніше опублікованих досліджень[13, 14, 15, 16, 17, 27, 28, 29]. Крім того, оскільки криволінійний ультразвуковий датчик легше отримати, не потрібно проводити підготовку кишечника, і його легше впровадити в лікарнях первинного рівня, біопсію простати ТП в нашому дослідженні проводили вільною рукою і під контролем трансперінеального ультразвукового датчика, що може бути ще однією причиною різної загальної частоти виявлення між групами ТР і ТП в нашому дослідженні. Однак при стратифікації за рівнем ПСА не було виявлено достовірних відмінностей у частоті виявлення раку між групами ТР і ТП для пацієнтів з рівнем ПСА 20-100 нг/мл (72,6 проти 64,6%, р = 0,280), що може бути пов’язано з невеликим розміром вибірки в цій підгрупі.
У Китаї частка вперше діагностованих хворих на рак передміхурової залози з високим ризиком і поширеною стадією раку передміхурової залози вища, ніж у ЄВШопі та США, що більше поширено в бідніших районах [30]. Серед 410 пацієнтів з діагнозом раку передміхурової залози в нашій лікарні (180 пацієнтів, у яких об’єм простати був недоступний, або з ПСА ≥ 100 нг/мл були виключені з дослідження), пацієнти з рівнем ПСА > 20 нг/мл становили 68,3% (280/410), пацієнти з 4-5 класом за МТУП – 66,3% (272/410), а пацієнти зі стадіями Т3 і Т4 – 67,2% (197/293). Відповідно до більш високої діагностичної частоти ТР підходу у пацієнтів з ПСА > 20 нг/мл, про яку повідомляється в літературі [17], група ТР мала вищу частоту позитивних результатів біопсії серед пацієнтів зі стадіями Т3 і Т4 (72,4% проти 62. 5%, ВШ: 1,573, р = 0,001) в нашому дослідженні, що свідчить про те, що ТР підхід може мати перевагу у пацієнтів з ймовірним діагнозом раку передміхурової залози високого ризику (рівень ПСА > 20 нг/мл, стадія пухлини cT3-T4 за даними візуалізації або цифрового ректального дослідження). На противагу цьому, група ТП має вищий відсоток позитивних результатів біопсії серед пацієнтів зі стадіями Т1 і Т2 (30,6% проти 36,9%, ВШ: 0,754, p = 0. 029), а в літературі також повідомляється про перевагу ТП підходу у пацієнтів з рівнем ПСА 4,01-10,00 нг/мл [6, 27], що вказує на те, що ТП підхід може мати перевагу у пацієнтів з раком передміхурової залози низького та проміжного ризику. Вищі показники позитивних результатів при дослідженні біопсійного матеріалу при ТП біопсії на стадіях Т1-Т2 можуть бути результатом переваги ТП біопсії для виявлення раку передньої зони. У той час як при ТП біопсії більша кількість біопсійного матеріалу проникає через обширні ділянки ракових уражень передміхурової залози в периферичній зоні, що може бути причиною її переваги у пацієнтів з Т3 і Т4 стадіями.
За нашими результатами, група ТР мала вищий рівень виявлення раку, ніж група ТП, у пацієнтів з об’ємом простати 30-80 мл (ВШ: 1,838, 95% ДІ: 1,086-3,112, р = 0,023). Як відомо, збільшення об’єму простати відбувалося переважно за рахунок гіперплазії перехідної зони, що призводило до стиснення периферичної зони (зони з високою частотою раку простати) до задньої частини залози. При проведенні ТУЗД-біопсії в гіперплазованій простаті більшість біопсійного матеріалу пройде через периферичну зону, оскільки її голки входять в простату з задньої частини залози. У той час як вентральні голки (A, D, J, G на зобр. 1) при ТП біопсії пропустять периферійну зону в гіперплазованій простаті, оскільки її голки входять в передміхурову залозу з боку верхівки простати. Це може бути причиною вищого рівня виявлення раку в групі ТР у пацієнтів з об’ємом простати 30-80 мл. Koparal та співавт. повідомили, що при ТП біопсії частота виявлення раку була вищою, ніж у групі ТР, у пацієнтів з об’ємом простати > 100 мл (середній рівень ПСА 6,6 нг/мл) [18]. Більше того, при збільшенні об’єму простати до понад 80 мл у нашому дослідженні не було суттєвої різниці у виявленні раку між двома методами біопсії. Ми припускаємо, що причиною такого результату можуть бути обмеження та інтенсивніший біль при трансректальній біопсії у пацієнтів з великим об’ємом простати [31]. Наше дослідження мало певні обмеження. По-перше, це одноцентрове ретроспективне дослідження з низьким рівнем доказовості. Крім того, для деяких пацієнтів у цьому дослідженні була відсутня часткова інформація, наприклад, про Т-стадію. Для подальшої перевірки цих висновків необхідні додаткові дослідження.
Висновки
На основі даних 452 пацієнтів, яким у нашій лікарні була проведена біопсія простати, група ТР мала вищий загальний показник виявлення раку та позитивний показник при дослідженні біопсійного матеріалу, ніж група ТП. Подальший аналіз підгруп показав, що група ТР мала вищий рівень виявлення раку у пацієнтів з об’ємом простати 30-80 мл, і що група ТР мала вищий відсоток позитивних результатів біопсії серед пацієнтів зі стадіями Т3-Т4, тоді як група ТП мала вищий відсоток позитивних результатів біопсії серед пацієнтів зі стадіями Т1-Т2. Не було достовірних відмінностей між групами ТР і ТП для кожної підгрупи при стратифікації за рівнем ПСА, щільністю ПСА і ступенем МТУП.
Абревіатури
ТР: Трансректально
ТП: Трансперінеально
ПСА: Простатспецифічний антиген
ЦРД: Цифрове ректальне дослідження
ТУЗД: Трансректальне УЗД
ТПУЗД: Трансперінеальне УЗД
МТУП: Міжнародне товариство урологічної патології
КМГ: Кокран-Мантел-Гензель
ВШ: Відношення шансів
ДІ: Довірчий інтервал
МРТ: Магнітно-резонансна томографія
Посилання
- Ilic D, Neuberger MM, Djulbegovic M, Dahm P. Screening for prostate cancer. Cochrane Database Syst Rev. 2013;1:CD004720.
- Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2021. CA Cancer J Clin. 2021;71(1):7–33.
- Litwin MS, Tan HJ. The diagnosis and treatment of prostate cancer: a review. JAMA. 2017;317(24):2532–42.
- Cooner WH, Mosley BR, Rutherford CL Jr, Beard JH, Pond HS, Bass RB Jr, et al. Clinical application of transrectal ultrasonography and prostate specific antigen in the search for prostate cancer. J Urol. 1988;139(4):758–61.
- Hodge KK, McNeal JE, Terris MK, Stamey TA. Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate. J Urol. 1989;142(1):71–4.
- Chang DT, Challacombe B, Lawrentschuk N. Transperineal biopsy of the prostate—is this the future? Nat Rev Urol. 2013;10(12):690–702.
- Thomson A, Li M, Grummet J, Sengupta S. Transperineal prostate biopsy: a review of technique. Transl Androl Urol. 2020;9(6):3009–17.
- Pradere B, Veeratterapillay R, Dimitropoulos K, Yuan Y, Omar MI, MacLennan S, et al. Nonantibiotic strategies for the prevention of infectious complications following prostate biopsy: a systematic review and meta-analysis. J Urol. 2021;205(3):653–63.
- Grummet JP, Weerakoon M, Huang S, Lawrentschuk N, Frydenberg M, Moon DA, et al. Sepsis and “superbugs”: should we favour the transperineal over the transrectal approach for prostate biopsy? BJU Int. 2014;114(3):384–8.
- Berry B, Parry MG, Sujenthiran A, Nossiter J, Cowling TE, Aggarwal A, et al. Comparison of complications after transrectal and transperineal prostate biopsy: a national population-based study. BJU Int. 2020;126(1):97–103.
- Stefanova V, Buckley R, Flax S, Spevack L, Hajek D, Tunis A, et al. Transperineal prostate biopsies using local anesthesia: experience with 1,287 patients. prostate cancer detection rate complications and patient tolerability. J Urol. 2019;201(6):1121–6.
- Cowan T, Baker E, McCray G, Reeves F, Houlihan K, Johns-Putra L. Detection of clinically significant cancer in the anterior prostate by transperineal biopsy. BJU Int. 2020;126(Suppl 1):33–7.
- Cerruto MA, Vianello F, D’Elia C, Artibani W, Novella G. Transrectal versus transperineal 14-core prostate biopsy in detection of prostate cancer: a comparative evaluation at the same institution. Arch Ital Urol Androl. 2014;86(4):284–7.
- Shen PF, Zhu YC, Wei WR, Li YZ, Yang J, Li YT, et al. The results of transperineal versus transrectal prostate biopsy: a systematic review and meta-analysis. Asian J Androl. 2012;14(2):310–5.
- Xiang J, Yan H, Li J, Wang X, Chen H, Zheng X. Transperineal versus transrectal prostate biopsy in the diagnosis of prostate cancer: a systematic review and meta-analysis. World J Surg Oncol. 2019;17(1):31.
- Abdollah F, Novara G, Briganti A, Scattoni V, Raber M, Roscigno M, et al. Trans-rectal versus trans-perineal saturation rebiopsy of the prostate: is there a difference in cancer detection rate? Urology. 2011;77(4):921–5.
- Jiang CY, Shen PF, Wang C, Gui HJ, Ruan Y, Zeng H, et al. Comparison of diagnostic efficacy between transrectal and transperineal prostate biopsy: a propensity score-matched study. Asian J Androl. 2019;21(6):612–7.
- Koparal MY, Sözen TS, Karşıyakalı N, Aslan G, Akdoğan B, Şahin B, et al. Comparison of transperineal and transrectal targeted prostate biopsy using Mahalanobis distance matching within propensity score caliper method: a multicenter study of Turkish urooncology association. Prostate. 2022;82(4):425–32.
- Eichler K, Hempel S, Wilby J, Myers L, Bachmann LM, Kleijnen J. Diagnostic value of systematic biopsy methods in the investigation of prostate cancer: a systematic review. J Urol. 2006;175(5):1605–12.
- Emiliozzi P, Longhi S, Scarpone P, Pansadoro A, DePaula F, Pansadoro V. The value of a single biopsy with 12 transperineal cores for detecting prostate cancer in patients with elevated prostate specific antigen. J Urol. 2001;166(3):845–50.
- Guo LH, Wu R, Xu HX, Xu JM, Wu J, Wang S, et al. Comparison between ultrasound guided transperineal and transrectal prostate biopsy: a prospective, randomized, and controlled trial. Sci Rep. 2015;5:16089.
- Wagenlehner FM, van Oostrum E, Tenke P, Tandogdu Z, Çek M, Grabe M, et al. Infective complications after prostate biopsy: outcome of the global prevalence study of infections in urology (GPIU) 2010 and 2011, a prospective multinational multicentre prostate biopsy study. Eur Urol. 2013;63(3):521–7.
- Loeb S. Infection after transrectal ultrasonography-guided prostate biopsy: increased relative risks after recent international travel or antibiotic use. BJU Int. 2012;109(12):1785–6.
- Borofsky S, George AK, Gaur S, Bernardo M, Greer MD, Mertan FV, et al. What are we missing? false-negative cancers at multiparametric MR imaging of the prostate. Radiology. 2018;286(1):186–95.
- Siddiqui MM, Rais-Bahrami S, Turkbey B, George AK, Rothwax J, Shakir N, et al. Comparison of MR/ultrasound fusion-guided biopsy with ultrasound-guided biopsy for the diagnosis of prostate cancer. JAMA. 2015;313(4):390–7.
- Cauni VM, Stanescu D, Tanase F, Mihai B, Persu C. Magnetic resonance/ultrasound fusion targeted biopsy of the prostate can be improved by adding systematic biopsy. Med Ultrason. 2021;23(3):277–82.
- Hara R, Jo Y, Fujii T, Kondo N, Yokoyoma T, Miyaji Y, et al. Optimal approach for prostate cancer detection as initial biopsy: prospective randomized study comparing transperineal versus transrectal systematic 12-core biopsy. Urology. 2008;71(2):191–5.
- Takenaka A, Hara R, Ishimura T, Fujii T, Jo Y, Nagai A, et al. A prospective randomized comparison of diagnostic efficacy between transperineal and transrectal 12-core prostate biopsy. Prostate Cancer Prostatic Dis. 2008;11(2):134–8.
- Lo KL, Chui KL, Leung CH, Ma SF, Lim K, Ng T, et al. Outcomes of transperineal and transrectal ultrasound-guided prostate biopsy. Hong Kong Med J. 2019;25(3):209–15.
- Zhu Y, Mo M, Wei Y, Wu J, Pan J, Freedland SJ, et al. Epidemiology and genomics of prostate cancer in Asian men. Nat Rev Urol. 2021;18(5):282–301.
- Yun TJ, Lee HJ, Kim SH, Lee SE, Byun SS, Hong SK, et al. Prospective analysis on the relation between pain and prostate volume during transrectal prostate biopsy. Korean J Radiol. 2007;8(3):231–5.