Авторы: Hippocrates Moschouris, Andreas Dimakis, Anastasia Anagnostopoulou, Konstantinos Stamatiou, Katerina Malagari
Введение
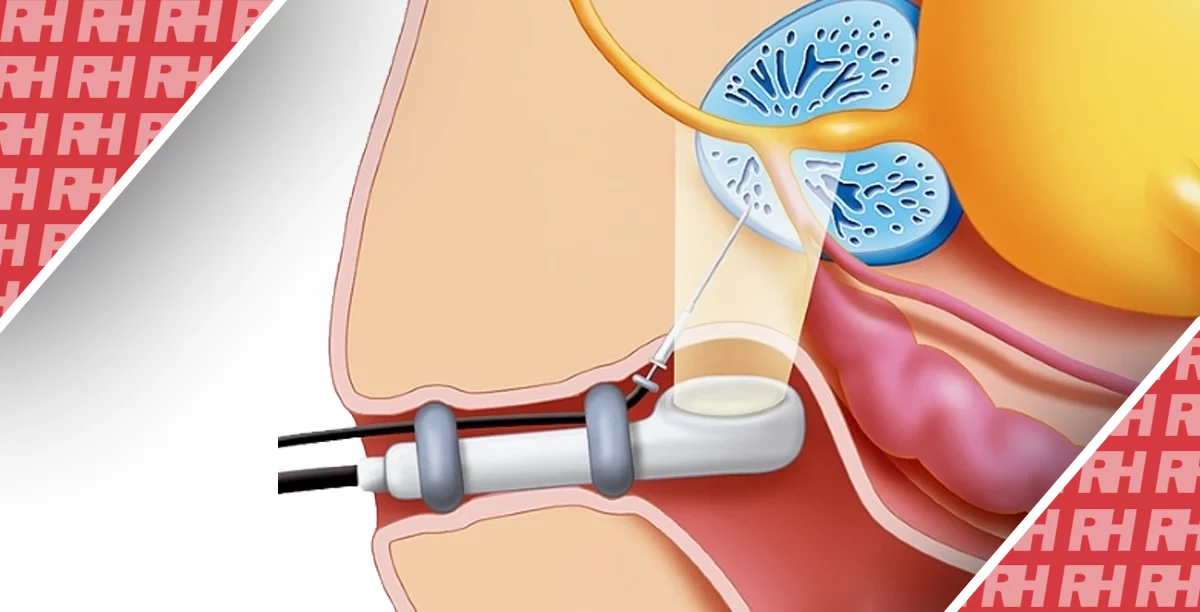
В последние годы эмболизация простатической артерии (ЭПА) стала эффективным, малоинвазивным эндоваскулярным лечением симптоматической доброкачественной гиперплазии предстательной железы (ДГПЖ).
Технически успешная ЭПА предполагает суперселективную катетеризацию и эмболизацию простатических артерий (ПА) по крайней мере одной тазовой стороны микрочастицами (сферическими или не сферическими, диаметром 50-500 мкм). Ишемия, вызванная ЭПА, приводит к уменьшению предстательной железы и функциональным изменениям, которые в конечном итоге приводят к облегчению симптомов ДГПЖ.
Таким образом, характеристика клинического успеха ПАЭ в первую очередь основана на улучшении симптомов. Последнее количественно выражается в снижении показателей согласно Международной шкале симптомов простаты (IPSS), при этом сообщаемые средние показатели снижения после ЭПА составляют 53,9–62,5%.
Тем не менее, роль изображений в оценке терапевтической эффективности PAE также важна. Ожидается, что радиологическая визуализация обеспечит неинвазивную, надежную и воспроизводимую оценку размера предстательной железы, а также морфологических, текстурных и перфузионных изменений, которые происходят в простате после ЭПА. Последующее визуализационное наблюдение также необходимо для оценки стойкости эффектов лечения с течением времени и для диагностики некоторых осложнений.
В настоящее время МРТ считается «золотым стандартом» для визуализации оценки ЭПА. Благодаря превосходному контрастному разрешению мягких тканей, МРТ точно показывает изменения размера и текстуры простаты. Однако затраты на оборудование и обследование могут ограничивать доступность и воспроизводимость МРТ, а методика (или соответствующие контрастные вещества) может быть противопоказана некоторым пациентам.
УЗИ – более доступный, гибкий и широко доступный метод, который также использовался для проведения ЭПА с самого начала применения этого метода лечения. Хотя стандартное УЗИ (серошкальное) ограничивается оценкой размера и формы простаты до и после ЭПА, более продвинутые методы могут значительно увеличить диагностическую ценность УЗИ.
Серошкальное УЗИ
Серошкальное УЗИ обычно используется во многих центрах для расчета объема простаты (PV) до и после ЭПА, а также для оценки уменьшения простаты. Хотя некоторые исследователи предпочитают трансректальное УЗИ (ТР-УЗИ), трансабдоминальное УЗИ (ТА-УЗИ) также приемлемо. В опытных руках ТА-УЗИ измерения объема простаты (ОП) тесно коррелируют с измерениями ТР-УЗИ, и первый метод более удобен для пациента и больше подходит для повторного применения.
Следует отметить, что было продемонстрировано, что вариации объема мочевого пузыря имеют незначительное влияние на трансабдоминальные измерения ОП, если объем мочевого пузыря находится в диапазоне 100-400 мл. При обоих подходах простата сканируется в аксиальной, коронарной и сагиттальной плоскостях, а ОП рассчитывается по формуле эллипсоида (длина × высота × ширина × 0,52). Общепризнанным недостатком этой формулы является ее ограниченная точность при увеличении простаты неправильной формы или асимметрично увеличенной площади.
Трехмерное УЗИ может обеспечить более точную оценку ОП, но, как более сложный и технически требовательный метод, обычно не используется для последующего наблюдения после ЭПА. Уменьшение простаты, вызванное технически успешной ЭПА, незначительно в течение первых дней после процедуры, но становится выраженным через месяц и через 3, 6 и 12 месяцев наблюдения. Сообщенные средние показатели снижения ОП после ЭПА составляют 31,9%, 32,1% и 37,6% через 6, 12 и 24 мес после вмешательства, соответственно.
Внутрипузырное протрузирование предстательной железы (ВПП) представляет собой степень, в которой увеличенная простата (ее срединная доля, боковые доли или и то и другое) выступает в мочевой пузырь. ВПП вызывает закупорку шарового клапана и нарушает воронкообразную форму шейки мочевого пузыря, тем самым способствуя закупорке выходного отверстия мочевого пузыря. ВПП более 10 мм считается значимым и ассоциируется с увеличением ОП и снижением скорости потока мочи. УЗИ является стандартным методом для расчета ВПП, который измеряется в сагиттальной проекции и определяется как наибольшее расстояние по вертикали от кончика предстательной железы до окружности мочевого пузыря. ЭПА доказала свою эффективность в снижении ВПП (зарегистрированные показатели снижения: 14,7% -25%) и этот эффект был связан с клиническим улучшением у пролеченных пациентов.
CEUS
Необратимая ишемия предстательной железы и последующий инфаркт играют центральную роль в терапевтическом действии ЭПА. Эмболизированные инфарктные аденомы постепенно уменьшаются в размерах, уменьшается массовое воздействие на простатическую уретру и улучшаются симптомы, а также мочеиспускание.
В настоящее время наши знания относительно визуализации ишемии предстательной железы после ЭПА получены в основном из исследований МРТ с контрастированием. Тем не менее, УЗИ с контрастным усилением (CEUS), как метод детальной визуализации микро- и макроциркуляции в реальном времени, также дал многообещающие результаты. Фактически, благодаря своему анатомическому расположению, относительно небольшому размеру и неподвижности простата может быть даже более подходящей мишенью для исследования CEUS по сравнению с печенью и другими органами брюшной полости.
Действительно, CEUS пост-ЭПА доказал свою осуществимость, рентабельность и способность детально отображать инфаркты простаты. Подобно другим абдоминальным аппликациям CEUS, контрастное вещество для ультразвука второго поколения вводится болюсно в вену предплечья с последующей промывкой физиологическим раствором. Используется специальная методика непрерывного сканирования, специфичного для контраста, с низким механическим индексом (MI = 0,09-0,13), и простата сканируется в трех плоскостях в течение 1-2 минут после инъекции.
Как ТР так и ТА-CEUS могут применяться для изображения инфарктов простаты, при этом первый подход предлагает более высокое пространственное и контрастное разрешение; однако сравнение этих двух подходов показало незначительные различия в измерениях инфаркта простаты после ЭПА.
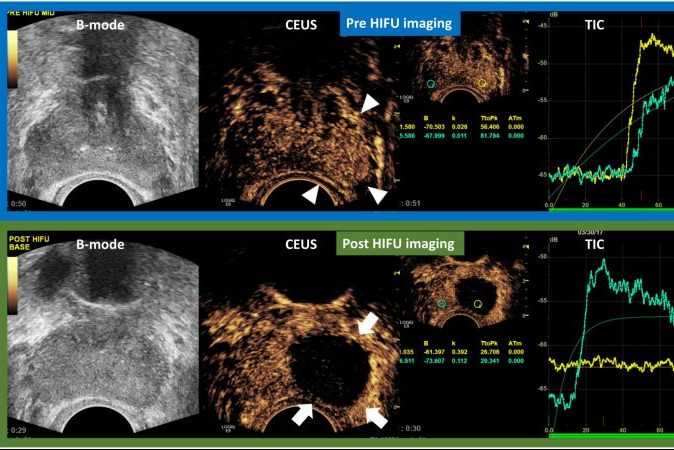
Когда узелки ДГПЖ полностью инфарктированы, они появляются как дефекты округлой или овальной формы на CEUS; когда возник неполный инфаркт, дефекты усиления могут быть неправильной формы. Инфаркт простаты может быть обнаружен практически сразу после ЭПА; однако он более четко очерчен в первые дни после процедуры. В следующие недели инфаркты предстательной железы постепенно уменьшаются, и большинство из них исчезают через 3-6 месяцев после ЭПА (Рисунок. 1).
Следует отметить, что инфаркты, вызванные ЭПА, локализуются исключительно в переходной зоне; периферическая зона сохраняется, возможно, из-за различий в ее кровоснабжении и микроциркуляции.
Рисунок 1: Эволюция результатов серошкального УЗИ и контрастного УЗИ после эмболизации артерии простаты. Результаты представлены в режиме «разделенного экрана» с не лучшенным эталонным изображением в B-режиме слева и соответствующим ультразвуковым изображением с контрастным усилением (CEUS) справа. A: Трансабдоминальное УЗИ показывает недавно появившиеся эхогенные очаги в обеих долях простаты (стрелки). CEUS показывает обширный двусторонний инфаркт простаты; B: через месяц после ЭПА эхогенные очаги исчезли, инфаркты простаты стали лучше очерчены и меньше по размеру; C и D: Оценка через 6 и 12 месяцев после ЭПА, соответственно, показывает, что инфаркты уменьшились или исчезли, и можно оценить уменьшение простаты. Звездочки указывают на инфаркт простаты на всех изображениях CEUS. Все изображения в аксиальной плоскости
Объем инфаркта простаты можно рассчитать по формуле эллипсоида (так же, как и ОП), и это приемлемый метод для регулярных, круглых или яйцевидных инфарктов. Объемная оценка с помощью планиметрии и специального программного обеспечения дает превосходную точность, особенно в случае множественных инфарктов неправильной формы.
Объем инфаркта предстательной железы делится на ОП (рассчитанный одновременно) и определяется процент ишемии предстательной железы (pИП). pИП сильно коррелирует с последующим уменьшением предстательной железы, (последнее является конечным результатом абсорбции инфарктной ткани) и может прогнозировать его. Степень инфаркта предстательной железы, по-видимому, является предиктором клинического успеха ЭПА, по крайней мере, в подгруппе пациентов с ДГПЖ, задержкой мочи и постоянным катетером мочевого пузыря (Рисунок 2).
В недавнем исследовании с систематической оценкой CEUS после ЭПА успешное удаление катетера было достигнуто только у пациентов с pИП> 10%.
Рисунок 2: Различная степень и распространение инфарктов предстательной железы у пациентов с разными клиническими исходами. A: Трансректальная CEUS 5-дневная пост-билатеральная эмболизация простатической артерии у пациента с постоянным катетером мочевого пузыря показывает обширный инфаркт левой доли простаты и меньшие инфаркты справа. Через неделю стало возможным удаление катетера Фолея и спонтанное мочеиспускание; B: Трансабдоминальное CEUS через один день после двусторонней ЭПА показывает обширный двусторонний инфаркт простаты. Пациент испытал быстрое и стойкое улучшение симптомов; C: CEUS через день после односторонней (слева) ЭПА у пациента с постоянным катетером мочевого пузыря показывает небольшой инфаркт левой доли. Множественные попытки удаления катетера Фолея у этого пациента потерпели неудачу, и в конечном итоге ему была сделана трансуретральная резекция. Стрелки указывают на эхогенные очаги, которые появляются в эмболизированных частях простаты вскоре после ЭПА. Обратите внимание, что при небольшом одностороннем инфаркте эхогенных очагов не обнаруживается. Все изображения в аксиальной плоскости.
Эластография
Почти наверняка инфаркт, за которым следует сокращение простаты, – не единственный терапевтический механизм ЭПА. Фактически, уменьшение ОП и облегчение внешнего сдавления простатической уретры затрагивает только «статический» (анатомический) компонент ДГПЖ. Однако существует также «динамический» (функциональный) компонент в патофизиологии ДГПЖ, связанный с активацией альфа1-адренорецепторов простаты и связанный со снижением эластичности аденоматозной ткани простаты.
Считается, что ЭПА блокирует поступление симпатических медиаторов, которые дополнительно необходимы для активации альфа1-рецепторов; ЭПА уменьшает количество самих рецепторов, тем самым улучшая эластичность простаты. Этот потенциальный механизм подтверждается клиническим наблюдением «размягчения» простаты при пальцевом ректальном исследовании после успешной ЭПА.
Эластография также использовалась для получения соответствующих доказательств (Рисунки 3 и 4). Эластография сдвиговой волны (ЭСВ) использует ультразвуковой толкающий импульс для генерации поперечной волны в тканях. На скорость поперечной волны влияет жесткость ткани (более высокая скорость в более жестких тканях); Скорость поперечной волны может быть рассчитана и закодирована по цвету для каждого пикселя соответствующего УЗИ-изображения, таким образом создавая эластографическую цветовую карту, которая накладывается на полутоновое изображение. Сравнивая ткань до и после сжатия, степень локальной деформации ткани оценивается в режиме реального времени и отображается на цветной карте.
Рисунок 3: Эластография сдвиговой волны простаты. A: Раннее; B: Через три месяца после двусторонней эмболизации простатической артерии. Продемонстрировано значительное снижение (40,5%) модуля упругости (ЕМ) переходной зоны, что указывает на повышенную эластичность ткани простаты после ЭПА. Эластографические изменения сопровождались заметным улучшением клинических показателей, а также объема простаты (уменьшение на 55%) и остаточного объема после мочеиспускания (уменьшение на 76%). Случай любезно предоставлен доктором де Ассис А.М., Отделение интервенционной радиологии, Институт радиологии, Медицинская школа Университета Сан-Паулу.
Рисунок 4: Корреляция результатов ультразвукового исследования с контрастным усилением, гистопатологические и эластографические данные после односторонней (правой) эмболизации простатической артерии. A: Изображение трансабдоминального УЗИ с контрастным усилением (CEUS) (аксиальный разрез), полученное через одну неделю после эмболизации простатической артерии, показывает обширный инфаркт правого гемипростата (звездочка); B: Гистопатология (окраска гематоксилин-эозином, исходное увеличение × 40) образца трансректальной биопсии под контролем УЗИ правой переходной зоны подтверждает присутствие эозинофильных микросфер (стрелки) в артериолах, окружающих ацинус простаты. Эта биопсия была проведена через 12 месяцев после ЭПА; C: Трансректальные эластографические изображения деформации (аксиальные срезы) простаты через 13 месяцев после ЭПА демонстрируют повышенную деформацию в правом гемипростате и в центре правой переходной зоны (обведены красной и бирюзовой линиями соответственно) по сравнению с левым гемипростатом. И до центра левой переходной зоны (обозначенной зеленой и желтой линиями соответственно).
Внутрипоцедурное УЗИ при ЭПА
Некоторые исследователи, пользуясь преимуществами портативности и гибкости УЗИ оборудования, применили методы УЗИ в ангио-блоке, где выполняется ЭПА, для оценки процедуры на месте. При серошкальном УЗИ эхогенные очаги появляются в предстательной железе сразу после ЭПА и остаются видимыми в течение нескольких дней после процедуры. Это открытие, вероятно, вызвано крошечными пузырьками воздуха, захваченными смесью контрастного вещества и эмболического материала. Эти механизмы аналогичны тем, которые вызывают «эхогенный ответ» в опухолях печени после трансартериальной (химио) эмболизации. Эхогенные очаги более выражены и многочисленны в простате с обширным инфарктом после ЭПА.
ТА-CEUS со стандартным (внутривенным) путем введения контраста также может быть выполнено в ангиографическом кабинете вскоре после инъекции эмболического материала, чтобы продемонстрировать ишемический эффект. Инфаркт предстательной железы можно обнаружить уже через несколько минут после эмболизации; однако иногда точная оценка их степени в это время может быть скомпрометирована вышеупомянутыми эхогенными очагами.
Последнее можно отличить от микропузырьков контраста путем сравнения (на разделенном экране устройства) не улучшенного изображения в оттенках серого с соответствующим изображением CEUS и наблюдения, что эхогенные очаги неподвижны, а микропузырьки постоянно циркулируют. Эта немедленная оценка ишемического эффекта может привести к дальнейшим решениям относительно процедуры: если CEUS демонстрирует неадекватный инфаркт, несмотря на очевидный ангиографический стаз кровотока в ПА, следует рассмотреть повторную оценку кровотока с помощью ангиографии (после времени ожидания в несколько минут) и поиск дополнительных вариантов. (Рисунок 5).
Рисунок 5: Внутрипроцедурная сонографическая оценка эмболизации простатической артерии с помощью ультразвукового исследования с внутривенным контрастированием. A: Рентгенограмма (переднезадняя проекция) сразу после эмболизации правой предстательной артерии показывает кончик микрокатетера (пунктирная стрелка) в проксимальной (экстрапростатической) части правой предстательной артерии. Объединение контраста эмболической смеси вызвало помутнение правого гемипростата (стрелки). «F» обозначает баллон катетера Фолея; B и C: Трансабдоминальное УЗИ с контрастным усилением (CEUS), аксиальный и правый парасагиттальный срез, соответственно, подтверждает адекватную деваскуляризацию (инфаркт) правого гемипростата (звездочки).
Внутриартериальный CEUS также использовался для внутрипроцедурного руководства ЭПА. Этот метод включает сонографию простаты с алгоритмом CEUS во время инъекции разбавленного контраста через микрокатетер, расположенный в ПА. Одна группа использовала суспензию липидных микросфер перфлютрена (Definity, Lantheus Medical Imaging, North Billerica, MA, США), разведенных 1:20 в физиологическом растворе и вводимых небольшими аликвотами (0,3-0,5 мл); разбавленный SonoVue также может быть использован для ВА-CEUS, хотя следует признать, что это будет не по прямому назначению.
Внутриартериальное УЗИ может быть выполнено до эмболии, чтобы показать часть простаты, питаемую выбранной артерией (Рисунок 6). Визуализация соседних органов (например, мочевого пузыря, прямой кишки) также может быть продемонстрирована, если части этих органов имеют то же артериальное кровоснабжение, что и простата. Таким образом, ВА-CEUS может подтвердить успешный выбор ПА и предотвратить некоторые случаи нецелевой эмболизации.
Внутриартериальный CEUS может играть роль в управлении ЭПА, особенно когда КТ-оборудование с коническим пучком недоступно.
Внутрипроцедурная сонография может быть технически сложной задачей, и получение изображений приемлемого качества не гарантируется: сканирование должно выполняться трансабдоминально, под стерильными простынями; катетеризованный мочевой пузырь обычно пуст, и сам катетер Фолея может быть препятствием для ультразвукового луча.
Рисунок 6: Внутрипроцедурная сонографическая оценка эмболизации простатической артерии с помощью внутриартериального ультразвукового исследования с контрастированием. A: Ангиографическое изображение (переднезадняя проекция) показывает правую предстательную артерию и ее ветви; B: Изображение трансабдоминального УЗИ с контрастным усилением через 3 секунды после внутриартериальной инъекции разбавленного Sonovue показывает быстрое, интенсивное усиление правой доли простаты, более заметное на ее периферии (стрелки); C: изображение через 7 секунд показывает более диффузное усиление правой доли и едва различимое усиление в небольшой области левой доли (пунктирная стрелка). Признаков экстрапростатического усиления замечено не было, эмболизация проводилась микросферами (диаметр: 100-300 мкм); D: Не улучшенное УЗИ изображение через 10 минут после эмболизации показывает повышенную эхогенность правой доли (звездочка). «F» обозначает баллон катетера Фолея на всех изображениях. Изображения CEUS в аксиальной плоскости.