Зміст:
Резюме
Останні досягнення в технології ультразвукового дослідження (УЗД) створили такі методи, як доплерівське УЗД, гістосканування, підсилене контрастом УЗД, еластографія та мікроультразвук. Перші результати цих методів УЗД були багатообіцяючими, хоча існують певні обмеження, зокрема потреба в спеціалізованому обладнанні, непослідовність результатів, відсутність стандартизації та зовнішньої валідації. У цьому огляді ми визначили дослідження, які оцінюють мультипараметричну ультрасонографію (мпУЗД), комбінацію декількох методів УЗД, для діагностики раку передміхурової залози (РПЗ). За останні 5 років зростає кількість досліджень, які показують, що використання мпУЗД призводить до високої ефективності виявлення РПЗ і клінічно значущого раку передміхурової залози (КЗРП), використовуючи гістологію радикальної простатектомії в якості еталонного стандарту.
Нещодавні дослідження продемонстрували роль мпУЗД у покращенні виявлення КЗРП та рекомендацій щодо біопсії та лікування простати. Крім того, деякі аспекти, такі як нижча вартість, візуалізація в реальному часі, застосування для деяких пацієнтів, які мають протипоказання до магнітно-резонансної томографії (МРТ), і доступність в офісних умовах, є явними перевагами мпУЗД. Узгодженість між спостерігачами щодо мпУЗД була загалом низькою; однак це обмеження можна покращити, використовуючи стандартизовані та об’єктивні системи оцінки, такі як модель машинного навчання.
Чи перевершує мпУЗД МРТ, поки що незрозуміло. Необхідно провести багатоцентрові рандомізовані контрольовані дослідження, які б безпосередньо порівнювали мпУЗД та мультипараметричну МРТ.
Ключові слова: мультипараметрична ультразвукова діагностика, біопсія простати, рак простати
Вступ
Рак передміхурової залози (РПЗ) є другою за частотою онкологічною хворобою і п’ятою за частотою причиною смерті від раку серед чоловіків у всьому світі у 2020 році.1 Трансректальна ультразвукова біопсія (ТУЗД) передміхурової залози (ПЗ) є золотим стандартом діагностики РПЗ.2 Хоча ТУЗД має ряд переваг, включаючи доступність, економічну ефективність, знайомство з урологами та можливість надання рекомендацій в режимі реального часу, ТУЗД саме по собі не може надійно виявити ПСА. 3 Таким чином, необхідний більш точний метод діагностики.
Сьогодні магнітно-резонансна томографія (МРТ) дозволяє отримати анатомічну/функціональну візуалізацію передміхурової залози та візуалізувати більшість клінічно значущих форм раку передміхурової залози (РПЗ).4–7 Інтерпретація послідовностей мультипараметричної магнітно-резонансної томографії (мпМРТ) стандартизована Системою звітності та даних про візуалізацію передміхурової залози (PIRADS).8 Використовуючи програмне забезпечення для об’єднання раніше отриманих зображень МРТ та ТУЗД в реальному часі, поєднання БП з МРТ/ТУЗД інтегрує переваги МРТ з її здатністю виявляти ураження та ТУЗД з її наведенням в реальному часі. 6,9 МРТ-візуалізоване ураження може бути точно відібрано за допомогою МРТ/ТУЗД з прицільною БП з і кожна траекторія біопсії з просторовими координатами в передміхуровій залозі реєструється в програмному забезпеченні МРТ/ТУЗД для перегляду. По суті, МРТ/ТУЗД з прицільною пункційною біопсією передміхурової залози набула популярності, і проведення МРТ перед пункцією всім чоловікам з підозрою на РПЗ рекомендовано настановами (наприклад, Європейської асоціації урологів, Американської асоціації урологів та Товариства абдомінальної радіології). Однак мпМРТ має ряд обмежень, включаючи доступність, високу вартість, складність візуалізації в реальному часі і низьку узгодженість між читачами.4,5 Крім того, рух пацієнта/простати, деформація простати і помилка реєстрації між МРТ і ТУЗД зображеннями можуть впливати на виявлення і локалізацію пухлини. 10, 11
Нещодавні досягнення в технології ультразвукового дослідження (УЗД) створили такі методи УЗД, як доплерівське УЗД, гістосканування, ультразвукове дослідження з контрастуванням (УЗДПК), еластографія та мікроультразвукове дослідження (мікро-УЗД). 12–17 Незважаючи на те, що ці нові методи мають деякі обмеження, включаючи потребу в спеціалізованому обладнанні, непослідовні результати, відсутність стандартизації та зовнішньої валідації, перші результати мультипараметричного УЗД є багатообіцяючими (Таблиця 1).18–23 “Мультипараметричне ультразвукове дослідження (мпУЗД)” привертає увагу в галузі урології та радіології. У рекомендаціях Європейської асоціації урологів (ЄАУ) щодо РПЗ згадується мультипараметричне ультразвукове дослідження як перспективний метод візуалізації для діагностики РПЗ, але також зазначається, що його недоліком є недостатня стандартизація та відсутність широкомасштабної оцінки.24 Наразі в рекомендаціях не зазначено, чи має мпУЗД бути додатковим або самостійним методом візуалізації для діагностики РПЗ. У цій статті ми розглядаємо дослідження, присвячені ролі нових методів УЗД і мпУЗД у діагностиці РПЗ, та описуємо майбутні напрямки.
Таблиця 1. Особливості методів УЗД
| Метод | Цільові аспекти | Переваги | Недоліки |
| B-mode | Анатомія | Доступність | Обмежена ефективність при пухлинах TZ |
| Доплер-УЗД | Макровакулярність | Доступність Потенціал для виявлення більш агресивного РПЗ |
Обмежена ефективність при пухлинах TZ Хибнопозитивний результат через простатит |
| HistoScanning | Програмний аналіз радіочастотних даних УЗД | Автоматизований аналіз гетерогенності тканин, клітинної щільності та судинності | Залежить від розміру простати та досвіду оператора для моторизованого ТУЗД |
| УЗДПК | Мікроваскулярність | Можливість відображення площі абляції за допомогою ВТ | Обмежена ефективність при пухлинах PZ Труднощі при скануванні всієї простати Потрібен підсилювач ультразвуку |
| Еластографія | Жорсткість | Економічність Доступність |
Обмежена ефективність при пухлинах PZ Хибнопозитивний результат через простатит Застосування надмірної компресії може хибно збільшити жорсткість тканин |
| Мікро-УЗД | Анатомія | Втричі вища просторова роздільна здатність | Існування кривої навчання |
| мпУЗД | Поєднання використаних методів | Здатність оцінювати комплексні аспекти РПЗ | Складність для стандартизованого оцінювання Тривалий час |
| B-mode, brightness-mode; УЗДПК, УЗД підсилене контрастом; ВТ, Вогнищева терапія; мпУЗД, мультипараметричне УЗД; PCa, рак передміхурової залози; PZ, переферична зона; ТУЗД, Трансректальне УЗД; TZ, Транзитна зона; УЗД, Ультразвукова діагностика. | |||
Ультразвукові методи, що використовуються для діагностики РПЗ
ТУЗД в режимі “brightness”
Звичайні УЗД сканери генерують УЗ-зображення в brightness (В) режимі.25 Характеристика тканин на УЗ-зображеннях в режимі В можлива за допомогою оцінки акустичних параметрів, таких як коефіцієнти ослаблення і зворотного розсіювання, отриманих з радіочастотних (РЧ) ехо-сигналів.26 Зображення УЗД у В-режимі відображають карти амплітуди ехо-сигналу на моніторі з сірою шкалою та значеннями яскравості пікселів, які є функцією відеосигналу. 27 Спочатку датчик випромінює короткий УЗ-імпульс, який проникає глибоко в тканину або, при зіткненні з тканиною з іншим акустичним імпедансом, відбивається у напрямку до датчика. Зображення потім створюються шляхом виявлення цих зворотньо розсіяних ультразвукових хвиль. Довжина ультразвукових хвиль і різні акустичні імпеданси впливають на формування зображення у В-режимі. 28, 29
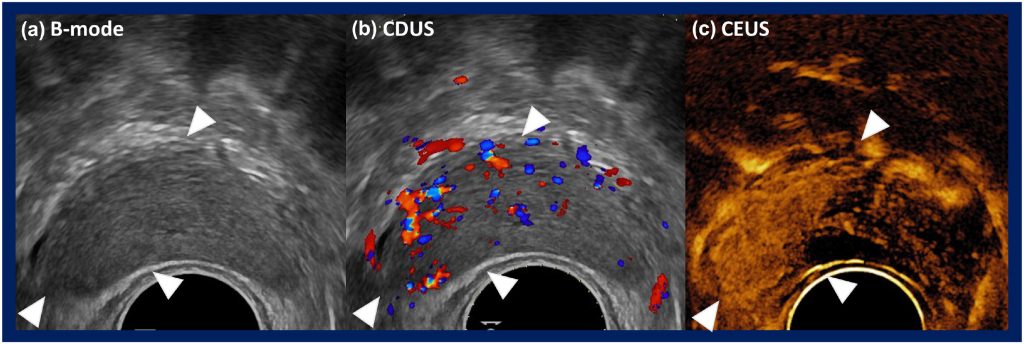
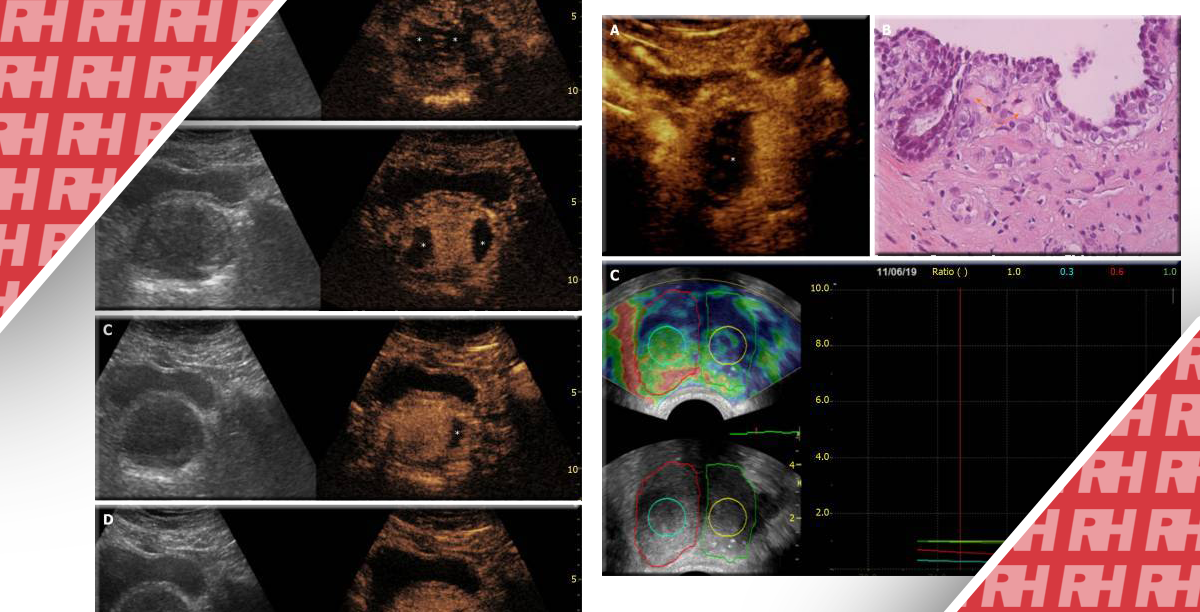
Візуалізація у В-режимі має обмеження у виявленні ПСА, оскільки сигнали зворотного розсіювання від РПЗ та нормальної простати можуть бути схожими (Зображення 1(a)). Сигнали, що генеруються з транзитної зони в цьому режимі сонографії, також мають тенденцію до неоднорідності.30 Крім того, при використанні різних компенсаторних налаштувань для отримання зображень однієї і тієї ж тканини у В-режимі, таких як підсилення і часовоге підсилення, очікується візуалізація різноманітних зображень. Використання однакових налаштувань візуалізації різними операторами може допомогти найбільше пом’якшити цю проблему. 28
Традиційно сонографічна візуалізація у В-режимі використовується як частина первинного методу виявлення РПЗ. Візуалізація у В-режимі ТУЗД була широко вивчена для оцінки її діагностичної спроможності у виявленні РПЗ. Його переваги включають отримання зображень в режимі реального часу і те, що він є найбільш доступним, економічним і найменш шкідливим медичним пристроєм для візуалізації.26 Однак, чутливість і специфічність звичайного УЗД в В-режимі ТУЗД обмежені і становлять від 40 до 50% при виявленні РПЗ за даними більшості досліджень.30 За даними Postema та співавт.,29 чутливість стандартного УЗД в В-режимі ТУЗД у виявленні РПЗ становить лише від 11 до 35%, а позитивний прогноз – від 17 до 57%. Однак корисність УЗД у В-режимі, схоже, була підірвана, згідно з даними Steinkohl та співавт.,31 які показали, що візуалізація передміхурової залози у В-режимі ТУЗД може виявити до 62% уражень, видимих при МРТ, що на сьогоднішній день є найточнішою методикою візуалізації. Крім того, В-режим вважається недостатньо точним для виявлення пухлин, що робить необхідним проведення мультифокальних біопсій під контролем УЗД. Мультифокальна біопсія є широко прийнятою практикою для виявлення РПЗ, при якій зразки із заздалегідь визначених анатомічних зон простати забираються нецільовим способом.26 Однак, враховуючи випадковість такого підходу, він призводить до збільшення частоти хибнонегативних результатів до 35%.31
Доплер-УЗД
Кольорове доплерівське ультразвукове дослідження (КДУЗД) була запропонована як інструмент для підвищення точності ТУЗД з використанням іншого параметра, ніж ехогенність на звичайному УЗД у В-режимі.12 Судинність підозрілої гіпоехогенної ділянки на звичайному УЗД у сірій шкалі В-режимі може бути ідентифікована та охарактеризована за допомогою КДУЗД або потужної ультразвукової доплерографії (ПУД).32 Хоча ПУД є більш чутливою, ніж КДУЗД, у виявленні повільного кровотоку, ПУД не продемонструвала кращого виявлення РПЗ, ніж КДУЗД.32 До того ж, ПУД не показує напрямок руху кровотоку. 22
Ангіогенез є однією з патологічних ознак росту пухлин. Доплерівський зсув визначається як різниця довжин хвиль, спричинена рухом об’єкта. Принцип доплерографії полягає в тому, щоб допомогти ідентифікувати зміни довжини хвилі, що відображають рухомі клітини в кровотоці.33 Таким чином, збільшення кількості зсувів пов’язане з неоваскуляризацією в цій тканині. 22, 17
Доплерівські патерни потоку між злоякісними і доброякісними ураженнями були оцінені Ashi та співавт.12 У цій серії досліджень середня швидкість кровотоку в ураженнях РПЗ становила 1,35 см/с порівняно з медіаною 0,36 см/с для їх доброякісних аналогів. Крім того, потік був безперервним і фазним для злоякісних утворень і нерегулярним для доброякісних. Характеристики кровотоку, які спостерігаються в ділянках РПЗ, можливо, пов’язані з більшою кількістю судин, збільшеним діаметром і зниженим опором кровотоку. Відсутність гладких м’язів у неоваскуляризованих судинах пояснює знижений опір потоку. Крім того, збільшений об’єм клітин у вогнищі ураження може звужувати ці судини, збільшуючи швидкість кровотоку. КДУЗД може виявляти судини розміром до 1 мм, проте мікросудини в злоякісних пухлинах простати мають розмір до 10 мікрон, що становить діагностичну проблему для цього інструменту. Тим не менш, ПУД можна використовувати для підвищення чутливості до менших судин (менше 2 мм). 17, 34
При оцінці ураження РПЗ за допомогою КДУЗД були описані різні картини течії: (1) вогнищева в межах ураження, (2) течія навколо ураження і (3) дифузна течія в межах ураження, причому остання є найбільш поширеною картиною (Figure 1(b)).32
Куліговська та співавт.35 повідомили про діагностичну ефективність КУДВдля виявлення РПЗ у 544 пацієнтів з БП, яким була проведена секстантна біопсія та прицільна біопсія патологічних утворень УЗД. Чутливість/специфічність виявлення РПЗ становила 41%/85% при застосуванні тільки ТУЗД, 43%/66% при застосуванні тільки КДУЗД і 57%/61% при застосуванні комбінації. Існує можливість для подальшого покращення ефективності доплерівського УЗД. Нещодавно Zeng та співавт.36 дослідили діагностичну ефективність тривимірного (3D) потужного доплерівського УЗД (3D-ПУД) для виявлення КЗРП за допомогою методу комп’ютерного аналізу віртуального органу. Загалом 99 учасникам з підозрою на РПЗ проспективно виконали ТУЗД + ПУД+ 3D-ПУД. Використовуючи виявлення КЗРП на БП як референтний стандарт, індекс васкуляризації, визначений за допомогою 3D-ПУД, досяг 86% чутливості та 87% специфічності. Індекс васкуляризації розраховувався за відсотком кольорово-кодованих вокселів в межах суми відсотків. Виявлення КЗРП за допомогою індексу васкуляризації становило 82,1% і було статистично вищим, ніж ТУЗД (69,5%) і ПУД (63,4%).
Чутливість для виявлення РПЗ зростає при використанні КДУЗД, що покращує діагностичні показники ТУЗД. Специфічність, навпаки, знижується. Це можна пояснити тим, що простатит може бути інтерпретований як злоякісне ураження, а також переважною ідентифікацією більших за розміром і більш високого ступеня уражень за допомогою доплерографії, в яких частіше відбувається ангіогенез.37,38 Тому запальні зміни або стани в простаті можна легко сплутати зі злоякісною пухлиною без відповідної клінічної кореляції. КДУЗД також можна використовувати в інших ситуаціях, наприклад, для порівняння повторних біопсій або як маркер нежиттєздатної тканини після місцевого лікування РПЗ шляхом вимірювання відсутності доплерівських сигналів.38 Основними обмеженнями КДУЗД є залежність від оператора і відсутність стандартизації.
Надсучасна мікросудинна візуалізація (НМВ) – це нова технологія, яка візуалізує повільний мікросудинний кровотік.33 У той час як звичайна доплерографія може відображати сигнали завад, спричинені рухом тканин, НМВ пригнічує завади, щоб цілеспрямовано виявити сигнал кровотоку завдяки своєму машинному алгоритму. 39 Порівняно зі звичайною доплерографією, НМВ може візуалізувати повільний кровотік з високою частотою кадрів, високою роздільною здатністю, високою чутливістю та меншою кількістю артефактів руху. Zhu та співавт.33 виявили, що НМВ виявила кровоносні судини у 97,3% пацієнтів з РПЗ, а також позитивну кореляцію між кількістю мікросудин на НМВ та оцінкою біопсії за шкалою Глісона. Цікаво, що Ohashi та співавт. 40 повідомили про випадок, коли повільний кровотік у стромальній саркомі передміхурової залози (ССП) був виявлений за допомогою НМВ. Слід зазначити, що внутрішньопухлинний кровотік не був виявлений за допомогою звичайного КДУЗД. Вони виконали прицільну біопсію в напрямку кровотоку під керівництвом НМВ, і життєздатні пухлинні клітини були успішно відібрані. Вони підкреслили корисність НМВ для націлювання на ураження з внутрішньопухлинним кровотоком, що вказує на життєздатні клітини, оскільки ССП часто включає велику некротичну ділянку. Крім того, деякі дослідники виконували НМВ до і після вогнищевої абляції при локалізованому РПЗ.39,41 Використовуючи НМВ, вони підтверджували наявність пухлинного кровотоку до абляції, а потім підтверджували зникнення кровотоку після абляції для визначення технічного успіху абляції.39,41 Хоча вплив НМВ на онкологічні результати ще не доведений, прицільна БП і вогнищева абляція під керівництвом НМВ видається доцільною.
HistoScanning
HistoScanning – це ультразвукова система візуалізації, яка використовується для підвищення точності виявлення, локалізації, об’єму пухлини та передбачуваних змін РПЗ, що складається зі сканування та послідовної оцінки тканини передміхурової залози за допомогою ректального датчика.13 Ця технологія дозволяє проводити програмний аналіз необроблених 3D-реконструйованих даних УЗД у поєднанні з радіочастотами та їх порівняння з базою даних, попередньо завантаженою в систему.13,42 Програмне забезпечення HistoScanning пропонує три різні алгоритми, пов’язані з неоднорідністю тканин, щільністю клітин та судин, для аналізу сигналів перед виведенням результатів на екран. 43
Технологія HistoScanning виконується в три етапи за порядком. По-перше, датчик ТУЗД, з’єднаний ззовні з двигуном (моторизований ТУЗД), генерує повне 3D-сканування передміхурової залози. По-друге, оператор окреслює зони інтересу (ЗІ) за допомогою програмної платформи HistoScanning. Нарешті, комп’ютеризований алгоритм аналізу в режимі нереального часу показує ділянки з червоним кодом, підозрілі на РПЗ, і відповідний об’єм пухлини.44,45 Однак, у випадках, коли зустрічаються дані візуалізації низької якості, в аналізі відображаються ділянки з фіолетовим кодом. 44, 45
Подібно до методів злиття МРТ-УЗД, справжнє таргетування (true targeting) HistoScanning (HS-TT) дозволяє перетворити результати HistoScanning в мішені ТУЗД в режимі реального часу.13 Після аналізу зображень і алгоритмів додаткова програмна система надає оператору команди про те, як маневрувати зондом ТУЗД, оснащеним направляючою голкою, щоб відібрати зразки ядер з певних, ідентифікованих червоним кодом ділянок. 7, 44, 45.
Крім того, так само, як метод промежинної БП набув популярності, метод промежинної біопсії HistoScanning також еволюціонував. Промежинна біопсія HistoScanning виконується під час дорсальної літотомії пацієнта. Біопсія під контролем промежини виконується за допомогою триплощинного ультразвукового датчика, системи звітів HistoScanning і шаблонної сітки для брахітерапії в якості орієнтира. Таким чином, прицільна біопсія за допомогою шаблону HistoScanning може бути виконана без додаткових процедур. 7
У літературі існують суперечливі дані щодо ефективності HistoScanning при виявленні РПЗ.42,46 Деякі попередні дослідження показують високу точність HistoScanning при виявленні уражень РПЗ об’ємом ⩾0,5 см3 з чутливістю і специфічністю до 100% і 80%, відповідно.47 Незважаючи на ці ранні обнадійливі результати, подальші дослідження дали суперечливі висновки з нижчою чутливістю (37-70,3%) і специфічністю (14,7-73%).42,46,48,49 Аналогічно, дослідження, в якому було виявлено менший об’єм ураження РПЗ ⩾ 0,1 см3, показало ще нижчі результати (60% і 66% відповідно).50 Більше того, кілька досліджень дійшли висновку, що точність HistoScanning визначається об’єктивними факторами, такими як об’єм простати, та суб’єктивними факторами, включаючи досвід оператора у виконанні моторизованої ТУЗД, що має важливе значення для 3D-реконструкції даних поєднання радіочастот та УЗД.13 Таким чином, HistoScanning може бути цінним інструментом для досвідчених операторів.
УЗДПК
Joyner та співавт.,51 у 1967 році описали ультразвукове контрастне дослідження під час виконання ехокардіограми. Введення сольового розчину через внутрішньосерцевий катетер утворювало міні-бульбашки, які під час дослідження сприймалися як хмари ехосигналів. УЗДПК складається з техніки візуалізації, що передбачає внутрішньовенне введення ультразвукових контрастних речовин для покращення візуалізації структур, що становлять інтерес.52 Зокрема, для РПЗ ця стратегія допомагає у виявленні, діагностиці та спостереженні за підозрілими ураженнями при виконанні прицільної БП з ТУЗД.
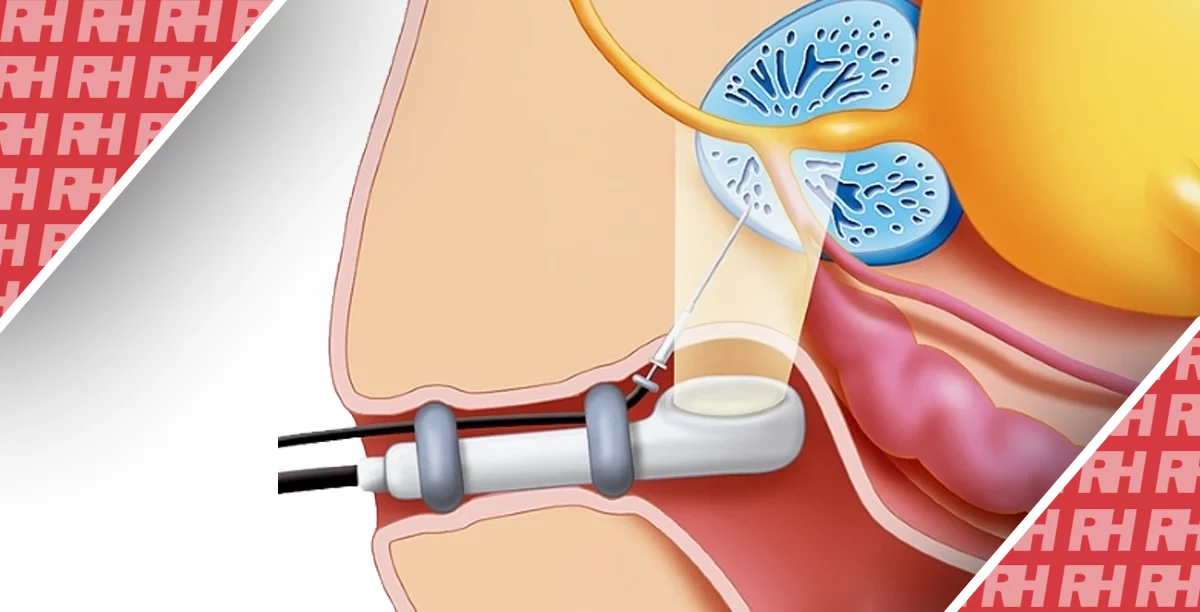
Звичайна сірошкальна ТУЗД обмежується виявленням РПЗ або розрізненням аблятованої передміхурової залози від нормальної з високою точністю. Однак препарати, що містять мікробульбашки, які покращують візуалізацію мікросудин передміхурової залози, збільшують шанси на виявлення злоякісного ураження, оскільки аденокарцинома передміхурової залози характеризується ангіогенезом зі збільшенням щільності мікросудин (Figure 1(c)).53 УЗДПК має кілька потенційних переваг у веденні хворих з РПЗ, включаючи діагностику, полегшення проведення таргетованої БП, оцінку в реальному часі і підтвердження адекватної абляції тканин після вогнищевої терапії (ВТ), а також ідентифікацію рецидиву захворювання в період постабляційного спостереження за допомогою кращої роздільної здатності судинних візуалізацій. 52
Доплерівське ультразвукове дослідження може точно оцінити макросудини, але не судини менше 200 мкм, які зазвичай спостерігаються при ангіогенезі. Ультразвуковий контраст, що містить мікробульбашки розміром 2-6 мкм, є суто внутрішньосудинним, оскільки вони не проникають в інтерстиціальний простір, вони достатньо малі, щоб пройти через легеневий кровообіг і потрапити в системний кровообіг, але достатньо великі, щоб не вийти за межі ендотелію, і чудово дозволяють побачити мікросудини, характерні для аденокарциноми передміхурової залози.54,55 Наступні препарати, що підсилюють ультразвук (ППУ), схвалені до використання: Lumason® (мікросфери з гексафториду сірки ліпідного типу А), SonoVue®, Definity® або Luminity®.56 ППУ не потребують лабораторних досліджень перед процедурою і не мають нефротоксичності, гепатотоксичності або кардіотоксичності. Багатоінституційне дослідження за участю 5576 пацієнтів, яким проводили ехокардіографію з контрастуванням, показало, що частота небажаних явищ становила 0,27%, причому всі небажані явища були легкими і транзиторними.57
За допомогою УЗДПК можна оцінити перфузію в дрібних мікросудинах (40 мкм), що спостерігаються при РПЗ, з позитивним прогностичним значенням до 91,7%, чутливістю до 79,3% і точністю до 83,7%. Додавання прицільної БП під контролем УЗДПК може бути пов’язано зі значним покращенням частоти виявлення раку в порівнянні з 12-контактною Мультифокальною біопсією.14,58,59,60 Крім того, вона забезпечує негайну інтраопераційну візуалізацію абляційної ділянки з чіткими і гострими краями, що підтверджує, що підозріла ділянка дійсно була оброблена, як і планувалося. Слід зазначити, що УЗДПК є переконливою стратегією для оцінки та діагностики інших урологічних злоякісних новоутворень, таких як рак нирки і сечового міхура. 61, 62
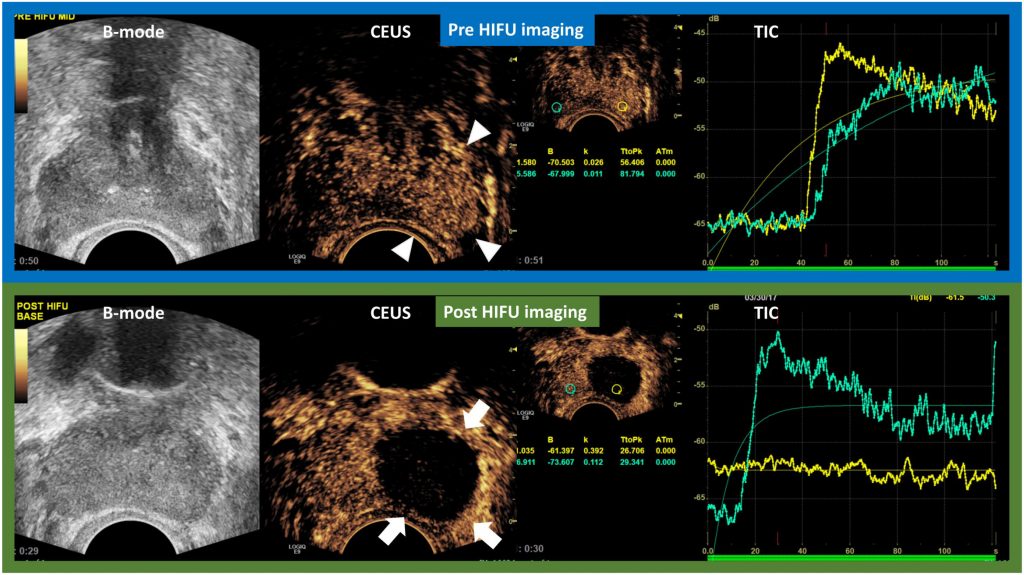
Власне програмне забезпечення може обробляти необроблені дані, отримані УЗДПК.63 Крива часової інтенсивності (КЧІ) зображується програмним забезпеченням, яке відкладає середнє значення ехосигналу в дБ (вісь X) проти часу (вісь Y). З КЧІ можна отримати кількісні параметри, такі як пікова інтенсивність (ПІ), нахил змиву (НЗ) і час до піку (ЧДП). Порівнюючи КЧІ, виділений з підозрілої на рак зони інтересу передміхурової залози і контралатеральної нормальної ЗІ, РПЗ демонструє вищу ПІ, крутіший НЗ і більш ранній ЧДП.64,65 Видалена тканина за допомогою високоінтенсивного сфокусованого ультразвуку (ВІСУ) може бути підтверджена у вигляді плоскої кривої з мінімальним нахилом на КЧІ (Зображення 2).52
Еластографія
Ультразвукова еластографія (Elastography) – метод візуалізації, який виявляє та кількісно оцінює жорсткість тканин – допомагає в діагностиці РПЗ, оскільки злоякісна тканина має більшу жорсткість, ніж доброякісна. Два найпоширеніші види еластографії, що застосовуються для дослідження простати, – це компресійна еластографія (КЕ) та зсувнохвильова еластографія (ЗХЕ).66 КЕ вимірює деформацію, що виникає в тканині під впливом механічного навантаження, спричиненого трансректальним датчиком. Щоб уникнути ризику надмірного стиснення і хибного збільшення жорсткості тканин, для розділення зонда і прямої кишки можна використовувати надутий балон (наприклад, з водою).67 ЗХЕ вимірює поширення механічних хвиль через тканину, яке може змінюватися залежно від її жорсткості. 68
КЕ простати продемонструвала кращу точність, ніж ТУЗД, у виявленні РПЗ. Мета-аналіз за участю 508 пацієнтів, в якому порівнювали КЕ з гістопатологією після радикальної простатектомії (РП), показав чутливість 72% і специфічність 76% для виявлення РПЗ.69 Систематичний огляд, що включав 1840 пацієнтів, показав збільшення на 7-15% загального виявлення РПЗ, коли прицільна біопсія за допомогою ТУЗД-еластографії комбінувалася з системною біопсією, порівняно з однією лише системною біопсією.70 Schiffmann та співавт.71 однак, не повідомляють про подібні результати. Результати дослідження за участю 679 чоловіків і 4074 біоптатів простати з 6 різних ділянок простати продемонстрували, що КЕ-таргетна біопсія має загальне високе значення специфічності (90%) і негативну прогностичну цінність (НПЦ, 87%), а також низьке значення чутливості (19%) і позитивну прогностичну цінність (ППЦ, 25%). Низькі значення чутливості та ППЦ свідчать про те, що КЕ може не виявляти секстанти, які дійсно є ознаками РПЗ.
Систематичний огляд, що включав 2227 пацієнтів з 16 досліджень ЗХЕ, показав багатообіцяючі результати.72 У дев’яти проаналізованих дослідженнях Мультифокальна біопсія була референтним стандартом на рівні кожного зразка (біопсійний матеріал, секстант). Об’єднана чутливість і специфічність становила 85% і 85% відповідно. Коли гістопатологія РП використовувалася як референтний стандарт, об’єднана чутливість і специфічність становили 71% і 74% відповідно. Fu та співавт.73 також продемонстрували позитивні результати у своєму проспективному дослідженні 221 пацієнта, в якому порівнювали ЗХЕ з МРТ простати. Чутливість, специфічність, ППЦ, НПЦ і точність становили 78,97%, 90,67%, 71,30%, 93,66% і 88,03% відповідно. Між ЗХЕ та МРТ не було статистично значущої різниці в діагностиці РПЗ (p = 0,259). Однак діагностична здатність ЗХЕ була дещо кращою, ніж МРТ, для діагностики КЗРП (p = 0,013). Інші результати були отримані Xiang та співавт.74 Було показано, що сама по собі ЗХЕ має нижчу діагностичну цінність, ніж МРТ, але комбінація обох методів візуалізації продемонструвала вищу чутливість, ніж будь-який з методів окремо.
Незважаючи на сприятливі результати, еластографія не позбавлена недоліків. По-перше, ручне стиснення простати оператором КЕ може змінити еластичність тканини, що обмежує точність діагнозу.75,76 Це знижує відтворюваність результатів, оскільки вони залежать від навичок і досвіду лікаря. Крім того, не існує методу рівномірного стиснення простати. По-друге, жорсткі ураження не обов’язково вказують на рак, а ракові ураження не завжди є жорсткими.77 Супутні фактори, такі як збільшення об’єму простати, кальцинати та фіброзна тканина, можуть призвести до хибнопозитивних результатів. Нарешті, значні обмеження включають малий розмір вікна, низьку частоту кадрів і проблеми з проникненням при проведенні ЗХЕ.66
Еластографія передміхурової залози може розглядатися як додатковий метод для виявлення РПЗ та скерування біопсії. ТУЗД-спрямована біопсія з використанням еластографії видається перспективною, але для підтвердження її корисності необхідно провести проспективні багатоцентрові дослідження. Необхідна стандартизація та валідація методу для подальшого порівняння досліджень.
Мікро-УЗД
Звичайне ТУЗД у В-режимі, що виконується на частоті 8-12 МГц, забезпечує достатню глибину проникнення в простату; однак просторова роздільна здатність може бути недостатньою для диференціації фізіологічних залозистих проток, ацинусів простати та злоякісних утворень.78–80 Для покращення обмеженої роздільної здатності звичайної ТУЗД була розроблена мікро-УЗД з використанням датчика з частотою 29 МГц.78,81. У порівнянні зі звичайною ТУЗД, ця більш високочастотна система може візуалізувати простату з втричі вищою просторовою роздільною здатністю (70 мкм).17 Однак існує баланс між просторовою роздільною здатністю і глибиною проникнення, оскільки ослаблення пропорційне частоті.82 Таким чином, глибина проникнення системи мпУЗД зменшена до 50 мм, що все ще охоплює всю простату стандартного розміру.81,83 Сучасна система мікро-УЗД дозволяє отримати зображення тільки в сагітальній площині, що є оптимальним для трансректальної БП. Відсутність аксіальних зображень, однак, робить МРТ-керовану БП недосяжною, хоча МРТ-керовану БП все ще можна виконати. 84
На основі ультрасонографічного вигляду ділянок РПЗ на мікро-УЗД була створена 5-бальна система оцінювання підозрілих уражень, що дозволяє більш послідовно інтерпретувати зображення простати.81 Ця система оцінювання називається PRI-MUS (Prostate Risk Identification using Micro-Ultrasound), яка є аналогом класифікації PIRADS для мпМРТ. PRI-MUS 1 і 2, ймовірно, є доброякісними. PRI-MUS 3 асоціюється з проміжним ризиком розвитку раку і може бути підтверджений прицільною або Мультифокальною біопсією. Ураження PRI-MUS 4 і 5 високо корелюють зі значним захворюванням, і показана прицільна біопсія.81,85 Використовуючи цю систему класифікації, Павлович та співавт.,86 провели багатоінституційне рандомізоване контрольоване дослідження, в якому порівнювали мікро-УЗД першого покоління зі звичайною трансректальною БП під контролем УЗД.86 В якості референтного стандарту використовували результати Мультифокальної 12-контактної трансректальної БП. Дослідження було розділене на навчання до і після інтерпретації зображень. PRI-MUS був розроблений на основі даних групи до навчання, а потім використаний групою після навчання. Було підтверджено покращення чутливості мікро-US у групі після навчання порівняно з групою до навчання (60,8% проти 24,6%, p < 0,01), і чутливість була значно вищою, ніж у звичайному ТУЗД (проти 38,0%, p < 0,001). Більше того, виявлення КЗРП на одного пацієнта, використовуючи мікро-US покращилося на 7%, після навчання (32-39%, p < 0,03). Однак виявлення КЗРП при мікро-US не було кращим, ніж при звичайному ТУЗД (34,6% проти 36,6 для всієї когорти і 39,0% проти 39,0% для когорти після тренінгу).
Після першого пілотного дослідження точності мікро-УЗД,78 кілька досліджень порівнювали мікро-УЗД зі звичайними В-режимом ТУЗД і мпМРТ.16,85–88 Zhang та співавт.89 провели мета-аналіз семи досліджень, що включали 769 пацієнтів, щоб проаналізувати точність мікро-УЗД при БП. Вони виявили, що мікро-УЗД має об’єднану чутливість, специфічність, діагностичне відношення шансів і площу під кривою сумарної робочої характеристики приймача (ROC-крива) 0,91, 0,49, 10 і 0,82, відповідно. Sountoulides та співавт.90 порівняли частоту виявлення РПЗ між мікро-УЗД та БП керованої мпМРТ (ПБ) у своєму мета-аналізі 13 досліджень, що включали 1125 пацієнтів. Коефіцієнт виявлення (КВ) оцінювався як відношення частоти виявлення мікро-УЗД ПБ до частоти виявлення мпМРТ-ПБ. Об’єднаний КВ для групи ступенів (ГО) 1, ⩾1, ⩾2 та ⩾3 РПЗ становив 0,94, 0,99, 1,05 та 1,25 відповідно. Таким чином, Sountoulides та співавт.90 дійшли висновку, що мікро-УЗД та мпМРТ ПБ показали подібні показники виявлення для всіх ступенів РПЗ. Крім того, в іншому мета-аналізі 15 досліджень, що включали 2967 пацієнтів, Dariane та співавт.91 оцінили додаткову цінність БП керованої мікро-УЗД в порівнянні з мультифокальною біопсією (МБ). Вони виявили, що мікро-УЗД ПБ виявила більше КЗРП [КВ= 1,18, 95% довірчий інтервал (ДІ) = 0,83-1,68] і значно менше РПЗ ГО1 (КВ= 0,55, 95% ДІ = 0,41-0,73), ніж МБ. У першому багатоцентровому проспективному дослідженні, що включало 1040 пацієнтів, порівнювали діагностичну ефективність мікро-УЗД та мпМРТ. Мікро-УЗД КБП і МРТ КБП були отримані при ураженні за шкалою PRI-MUS >3 і PIRADS >3. У порівнянні з мпМРТ КБП, мікро-УЗД ПБ показав значно вищу чутливість (94% проти 90%, p = 0,03) і НПЦ (85% проти 77%, p = 0,04) зі схожою специфічністю (22% проти 22%, p = 0,45) і ППЦ (44% проти 43%, p = 0,32) для виявлення КЗРП.92 Результати дослідження OPTIMUM (Optimization of prostate biopsy-Micro-Ultrasound versus МРТ), яке триває з трьома учасниками, визначать, чи можна використовувати мікро-УЗД як альтернативу поєднанню біопсії та МРТ/ТУЗД.93
Мультипараметричне УЗД
Як показано вище, нові методи УЗД продемонстрували багатообіцяючі результати. Однак неясно, чи може один новий метод УЗД забезпечити задовільну діагностичну ефективність при РПЗ. Ці методи візуалізують різні аспекти простати. Концепція мпУЗД подібна до концепції мпМРТ. Тому мпУЗД корисна для визначення об’єму ураження, а також для скеровування для БП і ВТ. Як і динамічна контрастна візуалізація на МРТ, доплерографія та УЗДПК можуть виявити судинну систему в тканинах ПЗ. Еластографія показує жорсткість тканини передміхурової залози, яка може відповідати щільності ракових клітин. Враховуючи успіх мпМРТ для діагностики РПЗ, поєднання декількох методів УЗД також має потенціал для досягнення більш достовірних результатів. Беручи до уваги кілька методів УЗД, які демонструють можливість скеровування при БП і ВТ, мпУЗД також може бути корисним для наведення на БП і ВТ.13,39–41,52
Кілька груп досліджували мпУЗД, визначений як комбінація 3 або більше способів УЗД.18-23 За останні 5 років, однак, мпУЗД набув популярності в урології та радіології..30,94–101
Zhang та співавт.94 оцінювали злоякісні ознаки методів УЗД з використанням 12-контактної мультифокальної БП у 40 пацієнтів з доброякісною гістологією та 38 чоловіків з локалізованим РПЗ як референтного стандарту. Вони демонструють, що при поєднанні режимів УЗД (“⩾3 злоякісних ознаки” при ТУЗД або “асиметричний розподіл” при ЗХЕ або “несинхронне накопичення/вимивання, нерівномірне підсилення та гетерогенний розподіл” при УЗДПК) мпУЗД досягає високих показників виявлення РПЗ [чутливість: 97,4%, специфічність: 77,5%, ППЦ: 80,4%, НПЦ 96,9%, точність: 87,2%, площа під робочою характеристичною кривою приймача (AUROC)]: 0,874], яка була сумісна з МРТ (чутливість: 94,7%, специфічність: 60,0%, ППЦ: 69,2%, НПЦ 92,3%, точність: 76,9%, AUROC: 0,774). Прицільна біопсія, однак, не проводилася, і тому ефективність на одне ураження не оцінювалася. ЗХЕ або УЗДПК зазвичай оцінюються в поєднанні з результатами В-режиму. Оскільки ефективність ЗХЕ або УЗДПК (AUROC: 0,860 і 0,859) була подібною до мпУЗД (AUROC: 0,874), додаткова цінність третьої методики УЗД видається обмеженою.
Mannaerts та співавт.95 проспективно оцінили діагностичну ефективність комбінації трьох методів УЗД (В-режим, ЗХЕ та УЗДПК) у 48 чоловіків, яким виконували РП як референтний стандарт. Унікальним є використання автоматизованого методу гістопатологічної кореляції РП для точної оцінки локалізації ураження КЗРП. Методику УЗД оцінювали троє читачів за 5-бальною шкалою Лайкерта для визначення 12 анатомічних показників ЗІ. При використанні шкали Лайкерта ⩾3 в якості порогового значення чутливість, специфічність, ППЦ і НПЦ для діагностики КЗРП за допомогою мпУЗД становили 74%, 59%, 65% і 70% відповідно. Чутливість була значно вищою, ніж у всіх окремих методик УЗД (В-режим: 55%, ЗХЕ: 55% і УЗДПК: 59%). З іншого боку, специфічність достовірно не відрізнялася від усіх окремих методик УЗД (В-режим: 61%, ЗХЕ: 61% і УЗДПК: 63%). У підгруповому аналізі ефективності мпУЗД специфічна чутливість ЗІ для ураження периферичної зони (PZ) була вищою, ніж для ураження транзитної зони (TZ) (80% проти 67%). У той час як чутливість лише ЗХЕ для виявлення пухлин ПЗ була нижчою, ніж В-режиму або лише УЗДПК, В-режим або УЗДПК виявляють менше пухлин ТЗ, ніж ЗХЕ. Ці результати можуть виправдати концепцію мпУЗД як комбінації цих методів УЗД. Частота виявлення індексного ураження (визначається як найвищий ступінь ураження за Глісоном на гістології ПЗ) ЗІ1 і ЗІ2 була значно вищою при мпУЗД, ніж при всіх окремих методах УЗД (мпУЗД: 88% порівняно з УЗДПК: 73%, B-режимом: 72% або ЗХЕ: 70%). Узгодженість між спостерігачами, оцінена за допомогою критерію Криппендорфа α, була невисокою [мпУЗД (значення відсікання типу Лайкерта ⩾3): 0,33 і мпУЗД (значення відсікання типу Лайкерта ⩾4): 0.48]. На жаль, в цьому дослідженні не проводилося порівняння з результатами МРТ, а розмір вибірки був невеликим. Слід зазначити, що всі учасники мали РПЗ, який в кінцевому підсумку лікували за допомогою РП; отже, ймовірно, існувало популяційне зміщення. Порівняно з окремими методиками УЗД, мпУЗД виявив більше КЗРП як на ПЗ, так і на ТЗ. Це є очевидною перевагою мпУЗД.
Postema та співавт.96 оцінили діагностичну ефективність КЗРП (будь-який ГО⩾3 і ГО2 більше 0,5 ml) B-режиму, УЗДПК, контрастної ультразвукової дисперсійної візуалізації (КУДВ) і мпУЗД (комбінація цих трьох методів УЗД) у 133 чоловіків, які проходили РП, як референтного стандарту. КУДВ, комп’ютерна методика кількісної оцінки, була створена на основі записів УЗДПК. Вірогідність виявлення КЗРП для кожного методу візуалізації (В-режим, УЗДПК і КУДВ) оцінювали п’ять спостерігачів за шкалою Лайкерта від 1 до 5 балів. У багатоцентровому дослідженні чутливість/специфічність/AUROC для діагностики КЗРП становила 81%/64%/0,78 для УЗДПК, 83%/55%/0,79 для КУДВ та 83%/55%/0,78 для мпУЗД. За допомогою зваженої статистики Флейса-Каппа в дослідженні було продемонстровано низьку узгодженість між спостерігачами методів УЗД (УЗДПК: 0,20, КУДВ: 0,18, комбінація: 0,18).
Нещодавно Grey та співавт.102 провели багатоцентрове проспективне парне когортне дослідження для порівняння діагностичної ефективності при КЗРП (будь-яка ділянка з ГО ⩾3 або максимальною довжиною пухлинного вогнища ⩾6 мм) між мпУЗД (B- режим + КДУЗД + еластографія + УЗДПК) порівняно з мпМРТ. Оцінка мпМРТ базувалася на системі Лайкерта замість PIRADS, і кожне УЗД оцінювалося за допомогою стандартизованого методу бальної оцінки за Лайкертом. Загальний бал ураження визначався на розсуд доповідача. Використовуючи БП керовану триядерною мпУЗД або мпМРТ як референтний стандарт, вони виявили КЗРП лише за допомогою мпУЗД, тільки мпМРТ та комбінації мпУЗД і мпМРТ становило 26%, 30% і 32% відповідно. В результаті, 7% КЗРП були виявлені виключно за допомогою тільки мпУЗД, тоді як 20% КЗРП були виявлені виключно за допомогою тільки мпМРТ. Автори дійшли висновку, що мпУЗД може бути альтернативою мпМРТ як діагностичний тест для пацієнтів з високим ризиком розвитку РПЗ, особливо у випадках, коли мпМРТ не може бути виконана.
Така непослідовна ефективність і обмежена узгодженість між спостерігачами мпУЗД може бути пов’язана з відсутністю добре структурованої або стандартизованої системи оцінки. Wildeboer та співавт.97 оцінили ефективність радіомічних ознак РПЗ, отриманих за допомогою В-режиму, ЗХЕ та УЗДПК, для локалізації РПЗ, використовуючи методи машинного навчання (алгоритм класифікації випадкового лісу) в аналізі 48 чоловіків з біопсійно підтвердженим РПЗ. Зразки ПЗ цих 48 пацієнтів були використані в якості референтного стандарту. У той час як найкраща окрема радіомічна ознака, така як швидкість контрастування, досягла регіонального показника AUROC 0,69 для будь-якого РПЗ і 0,76 для КЗРП (визначеного як РПЗ > ГО2), відповідно, мультипараметрична комбінація радіомічних ознак досягла вищого показника AUROC 0,75 для будь-якого РПЗ і 0,90 для КЗРП, відповідно. Радіомічні ознаки, пов’язані з перфузією, дисперсією та еластичністю, найчастіше обиралися як ефективні параметри для класифікації РПЗ за допомогою моделі машинного навчання. Важливо, що вони також показали, що ефективні радіометричні параметри, отримані на основі В-режиму, ЗХЕ та УЗДПК, не корелюють між собою; отже, ці три модальності можуть бути кумулятивними. Оскільки відібрані радіометричні параметри суттєво відрізнялися між ПЗ і ТЗ, вони підкреслили необхідність точної зональної сегментації для оцінки УЗД
Морріс та співавт.98 оцінили можливість використання В-режиму, імпульсної візуалізації сили акустичного випромінювання (ІСАВ), ЗХЕ і кількісного ультразвукового (КУЗД) підбору середнього діапазону (СД) для забезпечення наведення зображення для прицільної БП. ІСАВ – це американський метод оцінки еластичності за допомогою сили акустичного випромінювання. У той час як ЗХЕ забезпечує кількісну жорсткість тканини, ІСАВ відображає відносну жорсткість тканини. Обчислюючи нормалізовані спектри, спектральні методи КУЗД кількісно оцінюють властивості розсіювання тканин. СД є найпоширенішим параметром в КУЗД-аналізі, який генерується за допомогою лінійної підгонки до нормалізованих спектрів зворотного розсіяння. У 35 чоловіків з біопсійно підтвердженим РПЗ були отримані показники В-режиму, ІСАВ, ЗХЕ і СД, які були об’єднані за допомогою методу лінійних опорних векторів (МОВ). МОВ був навчений і валідований на підмножині даних 20 пацієнтів і протестований на даних решти 15 пацієнтів. Всім учасникам після візуалізації виконали простатектомію, гістологічно проаналізували цілісні препарати передміхурової залози і визначили ураження ПЗ на основі 27-зональної моделі в якості референтного стандарту. Вони оцінювали контраст і відношення контраст/шум (ВКШ) як метрики видимості ураження і узагальнене відношення контраст/шум (уВКШ) як метрику для оцінки перекриття в розподілі двох ЗІ. мпУЗД статистично достовірно перевершувала В-режим і ЗХЕ щодо контрасту, ВКШ і уВКШ, СД – щодо контрасту і ВКШ, а ІСАВ – щодо ВКШ. Вони зазначили, що як кальцифікати, так і відстань від УЗД обмежували ефективність мпУЗД.
Майбутні напрямки діяльності
На сьогоднішній день точна діагностика та відповідна стратифікація РПЗ має важливе значення для індивідуального підходу до лікування РПЗ.103 Нещодавні досягнення в технології візуалізації РПЗ, включаючи мпМРТ, дозволили більш точно локалізувати РПЗ. Чи покращують ці нові методи візуалізації клінічні результати, такі як загальна виживаність, ще не визначено.101 Точна візуалізація, якщо вона добре валідизована, може зменшити необхідність в БП і ризик гіпердіагностики та надмірного лікування.104 Очікується, що ВТ, заснована на точній візуалізації в реальному часі, забезпечить кращі онкологічні/функціональні результати.52 Тому важливе значення має встановлення більш точної візуалізації.
Огляд найсучаснішої літератури, присвяченої УЗД для діагностики РПЗ, наведено в (Таблиця 2). Хоча розмір вибірки нещодавніх досліджень мпУЗД все ще невеликий і більшість досліджень були одноцентровими, сукупна ефективність декількох методів УЗД, ймовірно, існує, коли окремі методи комбінуються (тобто В-режим + ЗХЕ + УЗДПК).94,95,97,98,102 Варіації комбінованих методів УЗД на сьогоднішній день обмежені. Включення сучасних методів УЗД, таких як НМВ або мікро-УЗД, може ще більше покращити ефективність мпУЗД.
Таблиця 2. Огляд найсучаснішої літератури про дослідження.
| Головний автор, рік | Структура дослідження | Метод Візуалізації | Кількість пацієнтів | Референтний стандарт | Основні результати | Обмеження |
| Lorusso, 2022105 | Ретроспективне одноцентрове дослідження | B-mode | 64 | Гістологія біопсійного матеріалу виділеного при РП | – Чутливість, специфічність і точність виявлення КЗРП за допомогою аналізу ANNA/C-ТУЗД становили 69%, 77% і 75% відповідно. | – Одноцентрове ретроспективне дослідження з невеликим розміром вибірки. – Гістологія біопсійного матеріалу виділеного при РП як референтний стандарт потенційно призводить до зміщення відбору. |
| Steinkohl, 201831 | Ретроспективне одноцентрове дослідження | B-mode | 142 | МРТ/ТУЗД фюжин-прицільна біопсія | – 92 з 148 мпМРТ уражень (62,2%) були видимими на В-режимі. – Значний вплив на видимість на В-режимі: об’єм простати (малі простати більш видимі). – Не мають суттєвого впливу на видимість на В-режимі: локалізація ураження, оцінка за шкалою PIRADS, розмір ураження. |
– Тільки пацієнти з добре задокументованою МРТ/ТУЗД фюжин-керованою біопсією були ретроспективно включені. – Результати були отримані досвідченим оператором на висококласному ультразвуковому апараті |
| Garcia-Reyes, 2018106 | Ретроспективне одноцентрове дослідження | B-mode | 178 | МРТ/ТУЗД фюжин біопсія (14-контактна МБ + від 2 до 4-контактна ПБ) | – Аналіз на кожну локацію складається з 1331 секстанта. – Частота виявлення КЗРП становила 20,5% лише за допомогою В-режиму та 19,7% лише за допомогою мпМРТ. – Комбінація В-режиму та МРТ показала значно вищу AUC для виявлення КЗРП (0,85), ніж тільки В-режим (0,80, p = 0,001) або тільки МРТ (0,83, p = 0,04). – Чутливість і специфічність В-режиму становила 42,3% і 91,6%. – Чутливість і специфічність МРТ становила 62,2% і 84,1%. |
– Ретроспективно були включені лише пацієнти з принаймні одним видимим ураженням на МРТ. |
| Zeng, 202236 | Проспективне одноцентрове дослідження | 3D-ПУД | 99 | ТУЗД БП (12-контактна МБ + від 1 до 2-контактна ПБ на ураження) | – Площа під кривою для виявлення КЗРП за індексом васкуляризації та індексом васкуляризації/потоку становила 95% та 95%. – Чутливість для індексу васкуляризації та індексу васкуляризації/потоку становила 86% та 94%. – Специфічність для індексу васкуляризації та індексу васкуляризації/потоку становила 87% та 76%. |
– Один фахівець проводить допплерографію. – Відсутність порівняння з гістологією цілої залози. |
| Ashi, 202112 | Проспективне одноцентрове дослідження | КДУЗД | 16 | ТУЗД БП 12–16 контактна | – Середня швидкість мікросудинного кровотоку в злоякісних ураженнях становила 1,25 см/с порівняно з 0,36 см/с у доброякісних ураженнях (p < 0,01). – Медіана індексу пульсації злоякісних утворень становила 1,55 проти 6,38 для доброякісних утворень (p < 0,01). – Медіана резистивного індексу злоякісних утворень становила 0,68 проти 1,0 для доброякісних утворень (p < 0,01). |
– Невеликий розмір зразків. |
| Zhu, 201933 | Проспективне одноцентрове дослідження | КУД Вand НМВ | 119 | ТУЗД БП (10-контактна МБ + від 2 до 3-контактна НМВ-Керована БП) | – НМВ та КУДВ виявляли судини в уражених раком ПЗ у 97,3% проти 90,5% відповідно. – Більша кількість судин, оцінена за допомогою НМВ і КУДВ, достовірно корелювала з вищим показником за шкалою Глісона (коефіцієнт кореляції 0,373 проти 0,286). у біопсійному матеріалі взятому за допомогою НМВ-керованої ПБ достовірно більше РПЗ, ніж у біопсійному матеріалі взятому за допомогою МБ (28,3% проти 6,4%, p < 0,001). |
– У дослідження включали лише пацієнтів з принаймні одним видимим ураженням НМВ. – Мішені НМВ були визначені одним експертом з НМВ. |
| Sarica, 201937 | Ретроспективне одноцентрове дослідження | КДУЗД | 78 | ТУЗД Б | – Комбінація В-режиму, КДУЗД і ДПСА показала найвищу специфічність виявлення РПЗ (80%) порівняно з кожним окремим методом. – Чутливість, позитивна і негативна прогностична цінність комбінації становили 64%, 64% і 80% відповідно. |
– Суб’єктивна оцінка судинності. – Відсутність окремого запису КДУЗД-зображень для кожної біопсійної ділянки. |
| Vezelis Alvydas, 202049 | Проспективне одноцентрове дослідження | HistoScanning | 200 | 20-контактна ТПШК БП | – Чутливість, специфічність та AUC для виявлення КЗРП (ГО∕3 або МДПВ⩾6 мм в одному місці або TCCL ⩾10 мм в усіх місцях) за допомогою HistoScanning ПЗ становили 61,9%, 27,85% та 0,39. – Статистичної різниці в результатах HistoScanning ПЗ між групами з об’ємом передміхурової залози менше 60 см3 та більше 60 см3 не виявлено. |
– Без сліпих випробувань. |
| Glybochko, 201913 | Проспективне одноцентрове дослідження | HistoScanning | 611 | ТУЗД БП (12-контактна МБ + 1 HistoScanning ПБ на ураження) | – При підозрі на РПЗ частота виявлення HistoScanning ПЗ на одного пацієнта становила 87% при HistoScanning ПЗ-ІТ проти 59% при МБ (p < 0,001). – При підозрі на РПЗ частота виявлення HistoScanning ПЗ на одне ураження становила 68% при HistoScanning ПЗ -ІТ порівняно з 25% при МБ (p < 0,001). – При підозрі на РПЗ частота виявлення шостої групи за Глісоном на одного пацієнта за допомогою HistoScanning ПЗ -ІТ була значно нижчою, ніж при МБ (23,4% порівняно з 32,4%, р = 0,002). |
– Вибір місця розташування HistoScanning ПЗ -ІТ залежить від оператора. – Без сліпих випробувань. – Не відповідає вимогам STARD. |
| Simmons, 201846 | Проспективне одноцентрове дослідження | HistoScanning | 330 | ЗДПВ | – Чутливість, специфічність та AUC для КЗРП (МДПВ ⩾6 мм та оцінка за Глісоном ⩾4+3) при виявленні за допомогою HistoScanning ПЗ становили 70,3%, 14,7% та 0,43 відповідно. – Розмір залози та об’єм ураження, оцінені між двома часовими точками за допомогою одного і того ж датчика, не були стабільними. – Погана точність у чоловіків, які потребують подальшої біопсії. |
– Після ТУЗД БП набирали лише чоловіків з клінічною підозрою на пропущений РПЗ або неправильну класифікацію. – Технічні збої з пристроєм HistoScanning ПЗ і, як наслідок, втрата даних для звітності. – Техніка таргетування в режимі реального часу була недоступна. |
| Sharen and Zhang, 2022107 | Ретроспективне одноцентрове дослідження | УЗДПК | 46 | 6-контактна МБ + від 2 до 4-контактна ПБ |
– Чутливість, специфічність і точність виявлення РПЗ становили 66,7%, 60% і 65,2% для УЗДПК і 84,2%, 81,3% і 83,3% для ЗХЕ відповідно. | – Ретроспективна модель дослідження з невеликим розміром вибірки. – Субоптимальний референтний стандарт. – Різниця в кількості взятих біопсійних матеріалів між УЗДПК і ЗХЕ була статистично значущою. |
| Baur, 2018108 | Проспективне одноцентрове дослідження | УЗДПК | 92 | 2-контактна МРТ/УЗД фюжин ПБ | – Час до піку, виміряний під час УЗДПК, показав значні відмінності між доброякісним ураженням і РПЗ в периферичній зоні (AUC 0,65, чутливість 69% і специфічність 63,3% при оптимальному значенні відсікання). | – Усі пацієнти мали принаймні один негативний анамнез БП. – Субоптимальний референтний стандарт. |
| Wildeboer, 201714 | Ретроспективне дослідження | УЗДПК | 19 | Гістологія біопсійного матеріалу виділеного при РП | – Чутливість, специфічність і точність для злоякісних пікселів становили 79%, 80% і 81% для комбінації чотирьох різних параметрів, пов’язаних з перфузією і дисперсією. | – Ретроспективна модель дослідження з невеликим розміром вибірки. – Гістологія біопсійного матеріалу виділеного при РП як референтний стандарт потенційно призводить до упередженості відбору. |
| Eldred-Evans, 2021109 | Проспективне популяційне скринінгове дослідження | Еластографія (ЗХЕ) | 403 | 12-контактна МБ + B-mode/ЗХЕ ПБ + МРТ/ УЗД ПБ |
– Порівняно зі скринінгом ПСА (⩾3 нг/мл), В-режим + ЗХЕ не показав кращої скринінгової ефективності, ніж скринінг тільки ПСА. | – Учасникам без позитивних результатів скринінгу біопсію не проводили. |
| Liang, 2021110 | Одноцентрове ретроспективне дослідження | Еластографія (ЗХЕ) | 112 | 12-контактна МБ + 1–2 B-mode/ЗХЕ ПБ |
– AUC радіомічні ознаки В-режиму, ЗХЕ та комбінації В-режиму і ЗХЕ становили 0,74, 0,80 і 0,85 для виявлення РПЗ відповідно. – Чутливість і специфічність комбінації радіометричних ознак В-режиму і ЗХЕ склали 77% і 80% відповідно. – При поєднанні радіомічної моделі з клінічною (вік і ЩПСА в якості параметрів) AUC зросла до 0,90. |
– Вплив зональної різниці (PZ проти TZ) не враховувався для оцінки ЗХЕ. – Субоптимальний референтний стандарт. |
| Fu, 202073 | Одноцентрове проспективне дослідження | Еластографія (ЗХЕ) | 221 | 12-контактна МБ + ТУЗД або ЗХЕ or МРТ/УЗД-Керована ПБ | – Транзитна зона та центральна зона не були включені. – Субоптимальний еталон. |
|
| Ji, 2019111 | Одноцентрове проспективне дослідження | Еластографія (ЗХЕ) | 215 | 12-контактна МБ + ТУЗД ПБ | – Модуль пружності Юнга (Emax, Emean і Emin) був значно вищим при злоякісному ураженні, ніж при доброякісному. – Чутливість Emax, Emean і Emin становила 77,88%, 81,42% і 60,18% відповідно, а специфічність – 85,33%, 74,51% і 63,73% відповідно. – Як ШГ, так і ПСА продемонстрували позитивну кореляцію з Emax та Emean. |
– Ймовірно, жорсткість передміхурової залози була недооцінена методом. – Субоптимальний референтний стандарт. |
| Xiang, 201974 | Одноцентрове ретроспективне дослідження | Еластографія (ЗХЕ) | 356 | 8–20 контактна ТУЗД- Б | – Чутливість, специфічність і AUC становили 78,3%, 62,4% і 0,7 відповідно для клінічно значущого РПЗ. – ЗХЕ має нижчу діагностичну цінність, ніж МРТ. |
– Клінічно значущий РПЗ з центральної зони не аналізували, оскільки ЗХЕ проводили лише в периферичній зоні. – Для біопсії та оцінки ЗХЕ використовувалося різне обладнання. |
| Ding, 2019112 | Одноцентрове ретроспективне дослідження | Еластографія | 125 | 12-контактна МБ + Еластографія ПБ | – Коли точка відсікання при еластографічному Q-аналізі становила 1,95 для диференціації злоякісних і доброякісних уражень простати, чутливість, специфічність і AUC становили 83,5%, 84,4% і 0,87, відповідно. | – Велика частка двосторонніх або дифузних уражень РПЗ. – Відсутня внутрішня/зовнішня валідація. – Для досягнення хорошої кривої оцінки еластографічного Q-аналізу оператор повинен бути належним чином навчений. |
| Lughezzani, 2021113 | Одноцентрове проспективне дослідження | Мікро-УЗД | 320 | 6–8⩽ контактів МБ + 2⩽ контактів на одне ураження МРТ/УЗД фюжин ПБ + 1⩽ контактів на одне ураження Мікро-УЗД ПБ | – Чутливість та специфічність Мікро-УЗД для виявлення КЗРП на одного пацієнта становила 89,7% та 26,0% відповідно. – 2,6% випадків КЗРП було виявлено лише за допомогою Мікро-УЗД ПБ, тоді як 2,6% випадків КЗРП було виявлено лише за допомогою мпМРТ ПБ. – Зростання показника PRI-MUS було незалежним предиктором КЗРП. |
– Упередженість спостерігача з огляду на те, що всі пацієнти мали підозріле ураження на МРТ (PIRADS ⩾3). – Кількість рандомізованих та керованих біопсій не була стандартизована. – Ідеальний референтний стандарт, такий як трансперінеальна шаблонна картографічна біопсія, не використовувався. |
| Wiemer, 202188 | Одноцентрове проспективне дослідження | Мікро-УЗД | 159 | мпМРТ керована (2–3 контактна) і некерована (8–9⩾ контактна) біопсії | – Чутливість і специфічність Мікро-УЗД для виявлення КЗРП становила 95% і 15% відповідно. – Мікро-УЗД ПБ виявила вищий рівень ГО, ніж у некерованих біопсіях у 26%, порівняно з некерованими та МРТ-керованими біопсіями (16%). Мікро-УЗД таргетування призвело до більшого підвищення на 9,4% рівня GG, ніж мпМРТ таргетування (p = 0,005). |
– Всі учасники мали позитивні результати мпМРТ. – Упередженість зумовлена ефектом кривої навчання. – Більша кількість мішеней і збільшення виявлення раку завдяки включенню всіх пацієнтів з показаннями до біопсії простати, навіть тих, що перебувають на активному спостереженні. |
| Chessa, 2021114 | Одноцентрове проспективне дослідження | Мікро-УЗД | 68 | 3–5 контактна мпМРТ-керована фюжин біопсія | – Чутливість, специфічність та AUC Мікро-УЗД у виявленні КЗРП становили 68%, 73% та 0,71 відповідно. – Чутливість, специфічність та AUC Мікро-УЗД у виявленні КЗРП, розташованих у периферичній зоні, становили 74%, 75% та 0,75 відповідно. |
– До дослідження були включені лише пацієнти з діагнозом РПЗ, встановленим за допомогою МРТ фюжин БП. – Відсутність досвіду роботи з апаратами Мікро-УЗД та протоколом PRI-MUS. – Неоптимальний референтний стандарт. |
| Avolio, 2021115 | Одноцентрове ретроспективне дослідження | Мікро-УЗД | 111 | МРТ/УЗД фюжин керована біопсія | – Чутливість та специфічність Мікро-УЗД у виявленні КЗРП становила 100% та 33,7% відповідно. – Оцінка за шкалою PRI-MUS ⩾3 була незалежним предиктором КЗРП (OR = 4,22, p = 0,001). – Мікро-УЗД потенційно здатна стратифікувати наявність РПЗ у пацієнтів з неоднозначним результатом МРТ. |
– Упередженість операційного відбору, оскільки всі пацієнти мали принаймні одне ураження PIRADS3. – Неоптимальний референтний стандарт. |
| Klotz, 202092 | Проспективне багатоцентрове дослідження | Мікро-УЗД | 1040 | ТУЗД БП (12- to 14-контактна МБ і 2- to 3-контактна з мпМРТ і Мікро-УЗД ПБ) | – Мікро-УЗД має порівнянну або вищу чутливість (94% проти 90%, p = 0,03) для КЗРП порівняно з мпМРТ, зі схожою специфічністю (22% проти 22%, p = 0,45). | – Варіативність кривих навчання між центрами. – Існували значні методологічні відмінності між сайтами. – 7 з 11 центрів МРТ не були “засліпленими” під час проведення оцінки УЗД. |
| Claros, 202084 | Одноцентрове ретроспективне дослідження | Мікро-УЗД | 47 | 12-контактна МБ + 3-контактна ПБ | – У керованих біопсіях при застосуванні Мікро-УЗД було виявлено більше КЗРП, ніж при застосуванні роботизованої МРТ/УЗД фюжини БП (38% проти 23%, р = 0,02). – КЗРП було б пропущено у 2% пацієнтів у групі Мікро-УЗД і 9% у групі роботизованої МРТ/УЗД фюжини БП. |
– Ретроспективний характер і відсутність рандомізації. – Включені лише пацієнти з підозрою на РПЗ на мпМРТ. – Субоптимальний референтний стандарт. |
| Rodriguez Socarrás, 2020116 | Одноцентрове ретроспективне дослідження | Мікро-УЗД | 194 | Ginsburg МБ + 5-контактнаМікро-УЗД ПБ + 5-контактнаМРТ/УЗД фюжин ПБ (якщо PIRADS ⩾3) | – Мікро-УЗД виявила 12/108 (11%) раків передміхурової залози, які були пропущені всіма іншими методами, з яких 11 (92%) були КЗРП. – Чутливість, специфічність, ППЦ та НПЦ Мікро-УЗД ПЗ для виявлення КЗРП на одного пацієнта були рівномірно вищими, ніж мпМРТ (99,7%, 23,1%, 46,0% та 99,2%). – PIRADS та PRI-MUS були сильними предикторами КЗРП у логістичній регресійній моделі. |
– Немає попереднього досвіду застосування Мікро-УЗД. – Упередженість через відсутність рандомізації та контрольної групи. |
| Abouassaly, 2020117 | Одноцентрове дослідження | Мікро-УЗД | 67 | 12-контактна МБ + 2- до 3-контактна мпМРТ ПБ + Мікро-УЗД ПБ | – Мікро-УЗД таргетування значно збільшило середню групу виявленого раку (p < 0,01) порівняно зі звичайним методом. | – Немає попереднього досвіду застосування Мікро-УЗД. – Єдиний центр з відсутністю “сліпого дослідження” та рандомізації. – Неможливість порівняти значення Мікро-УЗД та мпМРТ через малий розмір вибірки. |
| Grey, 2022102 | Багатоцентрове проспективне парне когортне дослідження | мпУЗД (B-mode + КУДВ+ еластографія + УЗДПК) | 306 | 3-контактна мпУЗД ПБ + 3-контактна мпМРТ когнітивно фюжин ПБ на ураження | – Позитивна узгодженість тестів між мпУЗД та мпМРТ становила 73,2% (κ = 0,06). – Виявлення КЗРП лише за допомогою мпУЗД, лише мпМРТ та комбінації мпУЗД та мпМРТ становило 26%, 30% та 32% відповідно. – 7% КЗРП були виявлені виключно за допомогою лише мпУЗД, тоді як 20% КЗРП були виявлені виключно за допомогою мпМРТ. |
– Оцінка мпМРТ базувалася на системі Лайкерта замість PIRADS. – Кожне УЗД оцінювалося за стандартизованою шкалою Лайкерта, але загальний бал ураження виставлявся на розсуд доповідача. |
| Postema, 202096 | Багатоцентрове проспективне дослідження | мпУЗД (B-mode + УЗДПК + КУДВ) | 133 | Гістологія біопсійного матеріалу виділеного при РП | – Чутливість, специфічність та AUC для виявлення КЗРП становили 81%, 64% та 0,78 для УЗДПК, 83%, 56% та 0,79 для КУДВ та 83%, 55% та 0,78 для комбінації відповідно. – Узгодженість між спостерігачами для УЗДПК, КУДВ та комбінації показала зважені значення Fleiss’ kappa 0,20, 0,18 та 0,18 відповідно. |
– Спостерігачі, менш підготовлені до оцінки УЗДПК або КУДВ. – Довільно обрана оцінка за шкалою Лайкерта. – Гістологія біопсійного матеріалу виділеного при РП як референтний стандарт потенційно призводить до упередженості вибору. |
| Wildeboer, 202097 | Одноцентрове ретроспективне дослідження | мпУЗД (B-mode + ЗХЕ + УЗДПК) | 48 | Гістологія біопсійного матеріалу виділеного при РП | – мпУЗД класифікатор для виявлення КЗРП з використанням алгоритму випадкового лісу показав вищу регіональну AUC, ніж найкращий окремий радіомічний параметр УЗД (0,90 проти 0,76). – Ефективні радіомічні ознаки УЗД, отримані з В-режиму, еластографії та УЗДПК, не корелювали між собою, отже, можуть бути кумулятивними. |
– Одноцентрове ретроспективне дослідження з невеликим розміром вибірки. – Гістологія біопсійного матеріалу виділеного при РП як референтний стандарт потенційно призводить до упередженості вибору. |
| Morris, 202098 | Ретроспективне дослідження | мпУЗД (B-mode + ІВСАК + ЗХЕ + QUS) | 35 | Гістологія біопсійного матеріалу виділеного при РП | – мпУЗД, оцінена методом МОВ, достовірно перевершувала В-режим і ЗХЕВ за показниками видимості ураження ПЗ (контраст, ВКШ та уВКШ), а також перевершував СД за показниками контрасту та ВКШ і перевершував ІВСАК за показником ВКШ. | – Одноцентрове ретроспективне дослідження з невеликим розміром вибірки. – Гістологія біопсійного матеріалу, отриманого при РПЗ, як референтний стандарт, потенційно призводить до зміщення відбору. |
| Drudi, 201999 | Проспективне дослідження | мпУЗД (B-mode + КУДВ+ УЗДПК + еластографія) | 82 | МРТ/УЗД фюжин 12контактнаМБ + 2контактнаПБ | – Чутливість, специфічність і точність для виявлення РПЗ становили 56,5%, 61,1% і 58,5% для В-режиму, 43,5%, 38,9% і 41,5% для КДУЗД, 40,0%, 97. 2% і 63,4% для кількісного аналізу УЗДПК, 82,8%, 66,6% і 76,8% для еластографії та 95,6%, 88,9% і 92,7% для мпМРТ відповідно. – Чутливість, специфічність і AUC для виявлення локалізованого РПЗ становили 97,4%, 77,5% і 0,87 для мпУЗД, 83%, 56% і 0,79 для КУДВ і 94,7%, 60% і 0,77 для мпМРТ відповідно. |
– Про ефективність комбінації методів УЗД не повідомлялося. – Субоптимальний референтний стандарт (немає мпУЗД ПБ). |
| Zhang, 201994 | Проспективне порівняльне дослідження між мпУЗД та мпМРТ | мпУЗД (B-mode + КУДВ+ ЗХЕ + УЗДПК) | 78 | 12-контактна МБ | – Чутливість, специфічність і AUC для виявлення локалізованого РПЗ становили 97,4%, 77,5% і 0,87 для мпУЗД, 83%, 56% і 0,79 для КУДВ і 94,7%, 60% і 0,77 для мпМРТ відповідно. | – Неоптимальний еталон (немає керованої БП та шаблонної БП). |
| Mannaerts, 201995 | Одноцентрове проспективне дослідження | мпУЗД (B-mode + ЗХЕ + УЗДПК) | 48 | Гістологія біопсійного матеріалу виділеного при РП | – мпУЗД показала 74% ЗІ-специфічну чутливість і 59% специфічність для виявлення КЗРП. – Чутливість мпУЗД була значно вищою порівняно з будь-яким окремим методом УЗД (В-режим, ЗХЕ або УЗДПК). – Чутливість мпУЗД була вищою для PZ, ніж для TZ (80% проти 67%). – Частота виявлення індексного ураження для мпУЗД становила 88%, тоді як для В-режиму, ЗХЕ та УЗДПК – 72%, 70% та 73% відповідно. – Коефіцієнт α Криппендорфа для мпУЗД становив 0,33 при пороговому балі за шкалою Лайкерта ⩾3 і 0,46 при пороговому балі за шкалою Лайкерта ⩾4. |
– Гістологія біопсійного матеріалу, отриманого під час РП, як референтний стандарт потенційно призводить до похибки відб |
Невідомо, чи мпУЗД навіть перевершує мпМРТ, оскільки до цього часу лише кілька досліджень безпосередньо порівнювали ці методи.94,99,102 Все ще потрібні багатоцентрові та рандомізовані контрольовані дослідження для їх порівняння з великим розміром вибірки. Деякі аспекти, такі як нижча вартість, візуалізація в режимі реального часу, можливість застосування для деяких пацієнтів (наприклад, з клаустрофобією або протезом стегна), які не можуть пройти мпМРТ, а також доступність в офісних умовах, є очевидними перевагами мпУЗД порівняно з мпМРТ.
Як інтегрувати багатофакторні результати кожного методу УЗД може сильно вплинути на ефективність мпУЗД, тому це важливо враховувати. Деякі дослідники просто додавали прицільну біопсію при підозрілому ураження ПЗ до будь-якого методу УЗД.18,19 Ця стратегія підвищує чутливість і НПЦ, в той час як вона знижує специфічність і ППЦ.22 Інші дослідники спочатку сканували простату за допомогою напруженої еластографії для виявлення ЗІ, а потім перевіряли, чи є ЗІ підозрілим на рак на УЗДПК.21 Ця стратегія призводить до підвищення специфічності/ППЦ і зниження чутливості/НПЦ.22 Для оптимізації продуктивності мпУЗД деякі дослідники використовували методи оцінювання типу Лайкерта,95,96,99 а інші оцінювали наявність деяких особливостей зображення.94 Однак, навіть коли використовувалися методи оцінювання типу Лайкерта, відносно низька узгодженість між читачами мпУЗД залишалася недоліком.95,96,118 Це може бути частково пов’язано з нестандартизованим процесом зчитування мпУЗД і відсутністю добре перевіреної та об’єктивної системи оцінювання. В даний час підхід машинного навчання дозволяє автоматизувати розпізнавання зображень і надавати кількісні оцінки великої кількості складних радіографічних характеристик.119 Глибоке навчання, підмножина машинного навчання, вже продемонструвало діагностичну ефективність, еквівалентну ефективності медичних працівників.120 Для досягнення більш точних і відтворюваних ультразвукових оцінок, як показали Wildeboer та співавт.97 and Morris та співавт.98 у своїх дослідженнях, застосування методу машинного навчання на багатофакторних рентгенологічних ознаках мпУЗД є перспективним підходом.119,121 Слід зазначити, що зі збільшенням складності алгоритму машинного навчання, розроблена модель, як правило, збільшує продуктивність, але стає менш зрозумілим алгоритмом. Щоб подолати обмеження методу машинного навчання, процес навчання повинен бути інтерпретований людиною, кількість радіомічних ознак, що підлягають оцінці, повинна бути мінімальною, а також необхідна біологічна інтерпретація/валідація радіомічних ознак.122 Хоча 25% КЗРП можуть бути пропущені мпМРТ,123 мпУЗД виявляє КЗРП, які були пропущені мпМРТ.94 Інтегрована оцінка результатів мпУЗД і мпМРТ може стати захоплюючою концепцією майбутнього (Зображення 3).
Висновок
За останні 5 років мпУЗД експоненціально зросла популярність в урології та радіології. Кілька останніх досліджень показали, що мпУЗД має потенціал для забезпечення більш надійного виявлення КЗРП та скеровування для БП і ВТ. Крім того, деякі аспекти, такі як нижча вартість, візуалізація в реальному часі, застосування для деяких пацієнтів, які мають протипоказання для мпМРТ, і доступність в офісних умовах, є явними перевагами мпУЗД. Підхід на основі машинного навчання та інтеграція радіомічних особливостей можуть покращити діагностичну ефективність мпУЗД. Необхідно провести багатоцентрові рандомізовані контрольовані дослідження для безпосереднього порівняння діагностичної ефективності мпУЗД та мпМРТ.
ORCID iDs
Masatomo Kaneko https://orcid.org/0000-0002-1205-807X
Aref S. Sayegh https://orcid.org/0000-0001-9320-2987
Anibal La Riva Rincon https://orcid.org/0000-0003-2198-833X
Maria Lizana https://orcid.org/0000-0002-0648-6043
Andre Luis Abreu https://orcid.org/0000-0002-9167-2587
Примітки
|
Етичне схвалення та згода на участь |
Не застосовується. |
|
Згода на публікацію |
Від пацієнтів була отримана письмова інформована згода на публікацію. |
|
Внесок авторів |
Masatomo Kaneko: Концептуалізація; Курація даних; Формальний аналіз; Дослідження; Методологія; Ресурси; Візуалізація; Написання – оригінальний проект; Написання – рецензування та редагування. Maria Sarah L. Lenon: Курація даних; Формальний аналіз; Дослідження; Ресурси; Візуалізація; Написання – оригінальний проект; Написання – рецензування та редагування. Lorenzo Storino Ramacciotti: Курація даних; Формальний аналіз; Дослідження; Написання – оригінальний проект; Написання – рецензування та редагування. Luis G. Medina: Курація даних; Формальний аналіз; Дослідження; Написання – оригінальний проект; Написання – рецензування та редагування. Aref S. Sayegh: Курація даних; Формальний аналіз; Дослідження; Написання – оригінальний проект; Написання – рецензування та редагування. Anibal La Riva Rincon: Курація даних; Формальний аналіз; Дослідження; Написання – оригінальний проект; Написання – рецензування та редагування. Laura C. Perez: Курація даних; Формальний аналіз; Дослідження; Написання – оригінальний проект; Написання – рецензування та редагування. Alireza Ghoreifi: Курація даних; Формальний аналіз; Розслідування; Написання – оригінальний проект; Написання – рецензування та редагування Maria Lizana: Курація даних; Формальний аналіз; Дослідження; Написання – оригінальний проект; Написання – рецензування та редагування. Donya S. Jadvar: Написання – рецензування та редагування. Amir H. Lebastchi: Концептуалізація; дослідження; методологія; адміністрування проекту; нагляд; написання – рецензування та редагування. Giovanni E. Cacciamani: Концептуалізація; дослідження; методологія; адміністрування проекту; нагляд; написання – рецензування та редагування. Andre Luis Abreu: Концептуалізація; Курація даних; Формальний аналіз; Дослідження; Методологія; Адміністрування проекту; Ресурси; Нагляд; Візуалізація; Написання – рецензування та редагування. |
|
Фінансування |
Автори не отримували жодної фінансової підтримки для проведення досліджень, написання та/або публікації цієї статті. |
|
Конкуруючі інтереси |
Автори заявили про наступні потенційні конфлікти інтересів, пов’язані з дослідженням, авторством та/або публікацією цієї статті: A.L.A. є лікарем-консультантом Koelis. |
|
Доступність даних та матеріалів |
Не застосовується. |
Список літератури
|
1. |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2021; 71: 209–249. |
|
2. |
Cooperberg MR, Lubeck DP, Meng MV, et al. The changing face of low-risk prostate cancer: trends in clinical presentation and primary management. J Clin Oncol 2004; 22: 2141–2149. |
|
3. |
Smeenge M, Barentsz J, Cosgrove D, et al. Role of transrectal ultrasonography (ТУЗД) in focal therapy of prostate cancer: report from a consensus panel. BJU Int 2012; 110: 942–948. |
|
4. |
Turkbey B, Pinto PA, Choyke PL. Imaging techniques for prostate cancer: implications for focal therapy. Nat Rev Urol 2009; 6: 191–203. |
|
5. |
Stabile A, Giganti F, Rosenkrantz AB, et al. Multiparametric МРТ for prostate cancer diagnosis: current status and future directions. Nat Rev Urol 2020; 17: 41–61. |
|
6. |
Kaneko M, Sugano D, Lebastchi AH, et al. Techniques and outcomes of МРТ-ТУЗД поєднана prostate biopsy. Curr Urol Rep 2021; 22: 27. |
|
7. |
Sugano D, Kaneko M, Yip W, et al. Comparative effectiveness of techniques in керована prostate biopsy. Cancers 2021; 13: 1449. |
|
8. |
Turkbey B, Rosenkrantz AB, Haider MA, et al. Prostate imaging reporting and data system version 2.1: 2019 update of prostate imaging reporting and data system version 2. Eur Urol 2019; 76: 340–351. |
|
9. |
Das CJ, Razik A, Netaji A, et al. Prostate МРТ–ТУЗД поєднана biopsy: a review of the state of the art procedure. Abdom Radiol 2020; 45: 2176–2183. |
|
10. |
Venderink W, de Rooij M, Sedelaar JPM, et al. Elastic versus rigid image registration in magnetic resonance imaging–transrectal ultrasound поєднана prostate biopsy: a systematic review and meta-analysis. Eur Urol Focus 2018; 4: 219–227. |
|
11. |
Hale GR, Czarniecki M, Cheng A, et al. Comparison of elastic and rigid registration during magnetic resonance imaging/ultrasound поєднана-Керована prostate biopsy: a multi-operator phantom study. J Urol 2018; 200: 1114–1121. |
|
12. |
Ashi K, Kirkham B, Chauhan A, et al. Quantitative colour Doppler and greyscale ultrasound for evaluating prostate cancer. Ultrasound 2021; 29: 106–111. |
|
13. |
Glybochko PV, Alyaev YG, Amosov AV, et al. Evaluation of prostate HistoScanning as a method for керована biopsy in routine practice. Eur Urol Focus 2019; 5: 179–185. |
|
14. |
Wildeboer RR, Postema AW, Demi L, et al. Multiparametric dynamic contrast-enhanced ultrasound imaging of prostate cancer. Eur Radiol 2017; 27: 3226–3234. |
|
15. |
Correas JM, Tissier AM, Khairoune A, et al. Prostate cancer: diagnostic performance of real-time shear-wave elastography. Radiology 2015; 275: 280–289. |
|
16. |
Lughezzani G, Saita A, Lazzeri M, et al. Comparison of the diagnostic accuracy of micro-ultrasound and magnetic resonance imaging/ultrasound поєднана керована biopsies for the diagnosis of clinically significant prostate cancer. Eur Urol Oncol 2019; 2: 329–332. |
|
17. |
Dias AB, O’Brien C, Correas J-M, et al. Multiparametric ultrasound and micro-ultrasound in prostate cancer: a comprehensive review. Br J Radiol 2022; 95: 20210633. |
|
18. |
Nelson ED, Slotoroff CB, Gomella LG, et al. Керована biopsy of the prostate: the impact of color Doppler imaging and elastography on prostate cancer detection and Gleason score. Urology 2007; 70: 1136–1140. |
|
19. |
Xie SW, Li HL, Du J, et al. Contrast-enhanced ultrasonography with contrast-tuned imaging technology for the detection of prostate cancer: comparison with conventional ultrasonography. BJU Int 2012; 109: 1620–1626. |
|
20. |
Aigner F, Schäfer G, Steiner E, et al. Value of enhanced transrectal ultrasound керована biopsy for prostate cancer diagnosis: a retrospective data analysis. World J Urol 2012; 30: 341–346. |
|
21. |
Brock M, Eggert T, Palisaar RJ, et al. Multiparametric ultrasound of the prostate: adding contrast enhanced ultrasound to real-time elastography to detect histopathologically confirmed cancer. J Urol 2013; 189: 93–98. |
|
22. |
Postema A, Mischi M, de la Rosette J, et al. Multiparametric ultrasound in the detection of prostate cancer: a systematic review. World J Urol 2015; 33: 1651–1659. |
|
23. |
Grey A, Ahmed HU. Multiparametric ultrasound in the diagnosis of prostate cancer. Curr Opin Urol 2016; 26: 114–119. |
|
24. |
Mottet N, Cornford P, van der Bergh R, et al. EAU-EANM-ESTRO-ESUR-SIOG guidelines on prostate cancer. European Association of Urology, 2022, https://d56bochluxqnz.cloudfront.net/documents/full-guideline/EAU-EANM-ESTRO-ESUR-ISUP_SIOG-Guidelines-on-Prostate-Cancer-2022_2022-04-25-063938_yfos.pdf (accessed 19 October 2022). |
|
25. |
Azizi S, Mousavi P, Yan P, et al. Transfer learning from RF to B-mode temporal enhanced ultrasound features for prostate cancer detection. Int J Comput Assist Radiol Surg 2017; 12: 1111–1121. |
|
26. |
Moradi M, Mousavi P, Abolmaesumi P. Computer-aided diagnosis of prostate cancer with emphasis on ultrasound-based approaches: a review. Ultrasound Med Biol 2007; 33: 1010–1028. |
|
27. |
Porter CR, Wolff EM. Prostate ultrasound volume 22. New York, NY: Springer, 2015. |
|
28. |
Meiburger KM, Acharya UR, Molinari F. Automated localization and segmentation techniques for B-mode ultrasound images: a review. Comput Biol Med 2018; 92: 210–235. |
|
29. |
Postema AW, Scheltema MJV, Mannaerts CK, et al. The prostate cancer detection rates of УЗДПК-керована versus МРТ-керована versus systematic ТУЗД-Керована biopsies in biopsy-naïve men: a prospective, comparative clinical trial using the same patients. BMC Urol 2017; 17: 27. |
|
30. |
Correas JM, Halpern EJ, Barr RG, et al. Advanced ultrasound in the diagnosis of prostate cancer. World J Urol 2021; 39: 661–676. |
|
31. |
Steinkohl F, Luger AK, Pichler R, et al. Visibility of МРТ prostate lesions on B-mode transrectal ultrasound. Med Ultrason 2018; 20: 441–445. |
|
32. |
Chen FK, de Castro Abreu AL, Palmer SL. Utility of ultrasound in the diagnosis, treatment, and follow-up of prostate cancer: state of the art. J Nucl Med 2016; 57(Suppl. 3): 13S–18S. |
|
33. |
Zhu YC, Shan J, Zhang Y, et al. Prostate cancer vascularity: Superb microvascular imaging ultrasonography with histopathology correlation. Med Sci Monit 2019; 25: 8571–8578. |
|
34. |
WestendaРП M, Postema A, de la, Rosette JJ, et al. Advances in ultrasound techniques for the diagnosis and staging of prostate cancer. Elastography, Doppler ultrasound, ultrasound contrast media, ultrasound quantification media and МРТ поєднана. Arch Esp Urol 2015; 68: 307–315. |
|
35. |
Kuligowska E, Barish MA, Fenlon HM, et al. Predictors of prostate carcinoma: accuracy of gray-scale and color Doppler US and serum markers. Radiology 2001; 220: 757–764. |
|
36. |
Zeng S, Wu S, Chen C, et al. Performance characteristics of 3-D power Doppler ultrasound (3-D-PD) with the virtual organ computer-aided analysis (VOCAL) technique in the detection of prostate cancer. Ultrasound Med Biol 2022; 48: 91–97. |
|
37. |
Sarıca Ö. Contribution of color Doppler sonography in the diagnosis of prostatic pathologies. South Clin Istanbul Eurasia 2019; 30: 255–260. |
|
38. |
Ukimura O, de Castro Abreu AL, Gill IS, et al. Image visibility of cancer to enhance targeting precision and spatial mapping biopsy for focal therapy of prostate cancer. BJU Int 2013; 111: E354–E364. |
|
39. |
Matsugasumi T, Iwata T, Yamada Y, et al. Intraoperative ultrasound monitoring with superb microvascular imaging in focal cryotherapy for prostate cancer. J Med Ultrason 2022; 49: 497–498. |
|
40. |
Ohashi M, Shiraishi T, Fujihara A, et al. Detection of relatively poor but definitive blood supply in prostate stromal sarcoma using transrectal ultrasonography with superb microvascular imaging. Int Cancer Conf J 2022; 11: 215–218. |
|
41. |
Boku H, Kaneko M, Yamada Y, et al. Microwave focal therapy of prostate cancer: a non-clinical study and exploratory clinical trial. BJU Int. Epub ahead of ahead of print 26 May 2022. Crossref. |
|
42. |
Morozov A, Kozlov V, Rivas JG, et al. A systematic review and meta-analysis of Histoscanning™ in prostate cancer diagnostics. World J Urol 2021; 39: 3733–3740. |
|
43. |
Braeckman J, Autier P, Garbar C, et al. Computer-aided ultrasonography (HistoScanning): a novel technology for locating and characterizing prostate cancer. BJU Int 2008; 101: 293–298. |
|
44. |
Wysock JS, Xu A, Orczyk C, et al. HistoScanning™ to detect and characterize prostate cancer – a review of existing literature. Curr Urol Rep 2017; 18: 97. |
|
45. |
Scattoni V, Zlotta A, Montironi R, et al. Extended and saturation prostatic biopsy in the diagnosis and characterisation of prostate cancer: a critical analysis of the literature. Eur Urol 2007; 52: 1309–1322. |
|
46. |
Simmons LAM, Kanthabalan A, Arya M, et al. Prostate imaging compared to transperineal ultrasound-Керована biopsy for significant prostate cancer risk evaluation (PICTURE): a prospective cohort validating study assessing prostate HistoScanning. Prostate Cancer Prostatic Dis 2019; 22: 261–267. |
|
47. |
Braeckman J, Autier P, Soviany C, et al. The accuracy of transrectal ultrasonography supplemented with computer-aided ultrasonography for detecting small prostate cancers. BJU Int 2008; 102: 1560–1565. |
|
48. |
Schiffmann J, Tennstedt P, Fischer J, et al. Does HistoScanning™ predict positive results in prostate biopsy? A retrospective analysis of 1,188 sextants of the prostate. World J Urol 2014; 32: 925–930. |
|
49. |
Vezelis Alvydas A, Platkevicius G, Kincius KM, et al. Prostate 3D ultrasound-Керована imaging device (HistoScanning) performance detecting clinically significant prostate cancer. J BUON 2020; 25: 460–463. |
|
50. |
Macek P, Barret E, Sanchez-Salas R, et al. Prostate histoscanning in clinically localized biopsy proven prostate cancer: an accuracy study. J Endourol 2014; 28: 371–376. |
|
51. |
Joyner CRJr, Hey EBJr, Johnson J, et al. Reflected ultrasound in the diagnosis of tricuspid stenosis. Am J Cardiol 1967; 19: 66–73. |
|
52. |
de Castro Abreu AL, Ashrafi AN, Gill IS, et al. Contrast-enhanced transrectal ultrasound for follow-up after focal ВІСУ ablation for prostate cancer. J Ultrasound Med 2019; 38: 811–819. |
|
53. |
Kundavaram CR, Halpern EJ, Trabulsi EJ. Value of contrast-enhanced ultrasonography in prostate cancer. Curr Opin Urol 2012; 22: 303–309. |
|
54. |
Quaia E. Microbubble ultrasound contrast agents: an update. Eur Radiol 2007; 17: 1995–2008. |
|
55. |
Brannigan M, Burns PN, Wilson SR. Blood flow patterns in focal liver lesions at microbubble-enhanced US. Radiographics 2004; 24: 921–935. |
|
56. |
Porter TR, Mulvagh SL, Abdelmoneim SS, et al. Clinical applications of ultrasonic enhancing agents in echocardiography: 2018 American Society of Echocardiography guidelines update. J Am Soc Echocardiogr 2018; 31: 241–274. |
|
57. |
Platts DG, Luis SA, Roper D, et al. The safety profile of perflutren microsphere contrast echocardiography during rest and stress imaging: results from an Australian multicentre cohort. Heart Lung Circ 2013; 22: 996–1002. |
|
58. |
Seitz M, Gratzke C, Schlenker B, et al. Contrast-enhanced transrectal ultrasound (CE-ТУЗД) with cadence-contrast pulse sequence (CPS) technology for the identification of prostate cancer. Urol Oncol 2011; 29: 295–301. |
|
59. |
Aigner F, Pallwein L, Mitterberger M, et al. Contrast-enhanced ultrasonography using cadence-contrast pulse sequencing technology for керована biopsy of the prostate. BJU Int 2009; 103: 458–463. |
|
60. |
Zhao HX, Xia CX, Yin HX, et al. The value and limitations of contrast-enhanced transrectal ultrasonography for the detection of prostate cancer. Eur J Radiol 2013; 82: e641–e647. |
|
61. |
O’Neal D, Cohen T, Peterson C, et al. Contrast-enhanced ultrasound-Керована radiofrequency ablation of renal tumors. J Kidney Cancer VHL 2018; 5: 7–14. |
|
62. |
Guo S, Xu P, Zhou A, et al. Contrast-enhanced ultrasound differentiation between low- and high-grade bladder urothelial carcinomaand correlation with tumor microvessel density. J Ultrasound Med 2017; 36: 2287–2296. |
|
63. |
Ashrafi AN, Nassiri N, Gill IS, et al. Contrast-enhanced transrectal ultrasound in focal therapy for prostate cancer. Curr Urol Rep 2018; 19:87. |
|
64. |
Zhu Y, Chen Y, Jiang J, et al. Contrast-enhanced harmonic ultrasonography for the assessment of prostate cancer aggressiveness: a preliminary study. Korean J Radiol 2010; 11: 75–83. |
|
65. |
Sano F, Uemura H. The utility and limitations of contrast-enhanced ultrasound for the diagnosis and treatment of prostate cancer. Sensors 2015; 15: 4947–4957. |
|
66. |
Barr RG, Cosgrove D, Brock M, et al. WFUMB guidelines and recommendations on the clinical use of ultrasound elastography: part 5. Ultrasound Med Biol 2017; 43: 27–48. |
|
67. |
Tsutsumi M, Miyagawa T, Matsumura T, et al. Real-time balloon inflation elastography for prostate cancer detection and initial evaluation of clinicopathologic analysis. AJR Am J Roentgenol 2010; 194: W471–W476. |
|
68. |
Gennisson JL, Deffieux T, Fink M, et al. Ultrasound elastography: principles and techniques. Diagn Interv Imaging 2013; 94: 487–495. |
|
69. |
Zhang B, Ma X, Zhan W, et al. Real-time elastography in the diagnosis of patients suspected of having prostate cancer: a meta-analysis. Ultrasound Med Biol 2014; 40: 1400–1407. |
|
70. |
van Hove A, Savoie PH, Maurin C, et al. Comparison of image-Керована керована biopsies versus systematic randomized biopsies in the detection of prostate cancer: a systematic literature review of well-designed studies. World J Urol 2014; 32: 847–858. |
|
71. |
Schiffmann J, Grindei M, Tian Z, et al. Limitations of elastography based prostate biopsy. J Urol 2016; 195: 1731–1736. |
|
72. |
Anbarasan T, Wei C, Bamber JC, et al. Characterisation of prostate lesions using transrectal shear wave elastography (ЗХЕ) ultrasound imaging: a systematic review. Cancers 2021; 13: 1–15. |
|
73. |
Fu S, Tang Y, Tan S, et al. Diagnostic value of transrectal shear wave elastography for prostate cancer detection in peripheral zone: comparison with magnetic resonance imaging. J Endourol 2020; 34: 558–566. |
|
74. |
Xiang LH, Fang Y, Wan J, et al. Shear-wave elastography: role in clinically significant prostate cancer with false-negative magnetic resonance imaging. Eur Radiol 2019; 29: 6682–6689. |
|
75. |
Miyagawa T, Tsutsumi M, Matsumura T, et al. Real-time elastography for the diagnosis of prostate cancer: evaluation of elastographic moving images. Jpn J Clin Oncol 2009; 39: 394–398. |
|
76. |
Kanagaraju V, Ashlyin PVK, Elango N, et al. Role of transrectal ultrasound elastography in the diagnosis of prostate carcinoma. J Med Ultrasound 2020; 28: 173–178. |
|
77. |
Correas JM, Tissier AM, Khairoune A, et al. Ultrasound elastography of the prostate: state of the art. Diagn Interv Imaging 2013; 94: 551–560. |
|
78. |
Pavlovich CP, Cornish TC, Mullins JK, et al. High-resolution transrectal ultrasound: pilot study of a novel technique for imaging clinically localized prostate cancer. Urol Oncol 2014; 32: 34.e27–34.e32. |
|
79. |
Harland N, Stenzl A. Micro-ultrasound: a way to bring imaging for prostate cancer back to urology. Prostate Int 2021; 9: 61–65. |
|
80. |
McNeal JE. Normal гістологія of the prostate. Am J Surg Pathol 1988; 12: 619–633. |
|
81. |
Ghai S, Eure G, Fradet V, et al. Assessing cancer risk on novel 29 MHz micro-ultrasound images of the prostate: creation of the micro-ultrasound protocol for prostate risk identification. J Urol 2016; 196: 562–569. |
|
82. |
Feleppa EJ. Basic physics of diagnostic ultrasound. In: Porter CR, Wolff EM (eds) Prostate ultrasound. New York: Springer, 2015, pp. 31–56. |
|
83. |
Terris MK, Stamey TA. Determination of prostate volume by transrectal ultrasound. J Urol 1991; 145: 984–987. |
|
84. |
Claros OR, Tourinho-Barbosa RR, Fregeville A, et al. Comparison of initial experience with transrectal magnetic resonance imaging cognitive Керована micro-ultrasound biopsies versus established transperineal robotic ultrasound magnetic resonance imaging поєднана biopsies for prostate cancer. J Urol 2020; 203: 918–925. |
|
85. |
Eure G, Fanney D, Lin J, et al. Comparison of conventional transrectal ultrasound, magnetic resonance imaging, and micro-ultrasound for visualizing prostate cancer in an active surveillance population: a feasibility study. Can Urol Assoc J 2019; 13: E70–E77. |
|
86. |
Pavlovich CP, Hyndman ME, Eure G, et al. A multi-institutional randomized controlled trial comparing first-generation transrectal high-resolution micro-ultrasound with conventional frequency transrectal ultrasound for prostate biopsy. BJUI Compass 2021; 2: 126–133. |
|
87. |
Cornud F, Lefevre A, Flam T, et al. МРТ-directed high-frequency (29 MHz) ТУЗД-Керована biopsies: initial results of a single-center study. Eur Radiol 2020; 30: 4838–4846. |
|
88. |
Wiemer L, Hollenbach M, Heckmann R, et al. Evolution of керована prostate biopsy by adding micro-ultrasound to the magnetic resonance imaging pathway. Eur Urol Focus 2021; 7: 1292–1299. |
|
89. |
Zhang M, Wang R, Wu Y, et al. Micro-ultrasound imaging for accuracy of diagnosis in clinically significant prostate cancer: a meta-analysis. Front Oncol 2019; 9: 1368–1369. |
|
90. |
Sountoulides P, Pyrgidis N, Polyzos SA, et al. Micro-ultrasound-Керована vs multiparametric magnetic resonance imaging-керована biopsy in the detection of prostate cancer: a systematic review and meta-analysis. J Urol 2021; 205: 1254–1262. |
|
91. |
Dariane C, Ploussard G, Barret E, et al. Micro-ultrasound-Керована biopsies versus systematic biopsies in the detection of prostate cancer: a systematic review and meta-analysis. World J Urol. Epub ahead of print 14 July 2022. Crossref. |
|
92. |
Klotz L, Lughezzani G, Maffei D, et al. Comparison of micro-ultrasound and multiparametric magnetic resonance imaging for prostate cancer: a multicenter, prospective analysis. Can Urol Assoc J 2020; 15: E11–E16. |
|
93. |
Klotz L, Andriole G, Cash H, et al. Optimization of prostate biopsy – micro-ultrasound versus МРТ (OPTIMUM): a 3-arm randomized controlled trial evaluating the role of 29 MHz micro-ultrasound in guiding prostate biopsy in men with clinical suspicion of prostate cancer. Contemp Clin Trials 2022; 112: 106618. |
|
94. |
Zhang M, Tang J, Luo Y, et al. Diagnostic performance of multiparametric transrectal ultrasound in localized prostate cancer: a comparative study with magnetic resonance imaging. J Ultrasound Med 2019; 38: 1823–1830. |
|
95. |
Mannaerts CK, Wildeboer RR, Remmers S, et al. Multiparametric ultrasound for prostate cancer detection and localization: correlation of B-mode, shear wave elastography and contrast enhanced ultrasound with radical prostatectomy specimens. J Urol 2019; 202: 1166–1173. |
|
96. |
Postema AW, Gayet MCW, van Sloun RJG, et al. Contrast-enhanced ultrasound with dispersion analysis for the localization of prostate cancer: correlation with radical prostatectomy specimens. World J Urol 2020; 38: 2811–2818. |
|
97. |
Wildeboer RR, Mannaerts CK, van Sloun RJG, et al. Automated multiparametric localization of prostate cancer based on B-mode, shear-wave elastography, and contrast-enhanced ultrasound radiomics. Eur Radiol 2020; 30: 806–815. |
|
98. |
Morris DC, Chan DY, Lye TH, et al. Multiparametric ultrasound for targeting prostate cancer: combining ARFI, ЗХЕI, QUS and B-Mode. Ultrasound Med Biol 2020; 46: 3426–3439. |
|
99. |
Drudi FM, Cantisani V, Angelini F, et al. Multiparametric МРТ versus multiparametric US in the detection of prostate cancer. Anticancer Res 2019; 39: 3101–3110. |
|
100. |
Pepe P, Pepe L, Panella P, et al. Can multiparametric ultrasound improve cognitive МРТ/ТУЗД поєднана prostate biopsy. Arch Ital Di Urol E Androl 2020; 92: 89–92. |
|
101. |
Fanti S, Minozzi S, Antoch G, et al. Consensus on molecular imaging and theranostics in prostate cancer. Lancet Oncol 2018; 19: e696–e708. |
|
102. |
Grey ADR, Scott R, Shah B, et al. Multiparametric ultrasound versus multiparametric МРТ to diagnose prostate cancer (CADMUS): a prospective, multicentre, paired-cohort, confirmatory study. Lancet Oncol 2022; 23: 428–438. |
|
103. |
Shaeffer EM, Sriniva S, An Y, et al. NCCN guideline prostate cancer version 1.2023, https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf (accessed 19 October 2022). |
|
104. |
Mehralivand S, Shih JH, Rais-Bahrami S, et al. A magnetic resonance imaging–based prediction model for prostate biopsy risk stratification. JAMA Oncol 2018; 4: 678–685. |
|
105. |
Lorusso V, Kabre B, Pignot G, et al. External validation of the computerized analysis of ТУЗД of the prostate with the ANNA/C-ТУЗД system: a potential role of artificial intelligence for improving prostate cancer detection. World J Urol. Epub ahead of print 6 March 2022. Crossref |
|
106. |
Garcia-Reyes K, Nguyen HG, Zagoria RJ, et al. Impact of lesion visibility on transrectal ultrasound on the prediction of clinically significant prostate cancer (Gleason score 3 + 4 or greater) with transrectal ultrasound-magnetic resonance imaging поєднана biopsy. J Urol 2018; 199: 699–705. |
|
107. |
Sharen GW, Zhang J. Application of shear wave elastography and contrast-enhanced ultrasound in transrectal prostate biopsy. Curr Med Sci 2022; 42: 447–452. |
|
108. |
Baur ADJ, Schwabe J, Rogasch J, et al. A direct comparison of contrast-enhanced ultrasound and dynamic contrast-enhanced magnetic resonance imaging for prostate cancer detection and prediction of aggressiveness. Eur Radiol 2018; 28: 1949–1960. |
|
109. |
Eldred-Evans D, Burak P, Connor MJ, et al. Population-based prostate cancer screening with magnetic resonance imaging or ultrasonography: the IP1-PROSTAGRAM study. JAMA Oncol 2021; 7: 395–402. |
|
110. |
Liang L, Zhi X, Sun Y, et al. A nomogram based on a multiparametric ultrasound radiomics model for discrimination between malignant and benign prostate lesions. Front Oncol 2021; 11: 610785–610712. |
|
111. |
Ji Y, Ruan L, Ren W, et al. Stiffness of prostate gland measured by transrectal real-time shear wave elastography for detection of prostate cancer: a feasibility study. Br J Radiol 2019; 92: 20180970. |
|
112. |
Ding Z, Jiao Y, Wu H, et al. Clinical value of the elastographic Q-analysis score in assisting real-time elastography-Керована prostate Biopsy: a retrospective study of 125 patients. J Ultrasound Med 2020; 39: 83–87. |
|
113. |
Lughezzani G, Maffei D, Saita A, et al. Diagnostic accuracy of microultrasound in patients with a suspicion of prostate cancer at magnetic resonance imaging: a single-institutional prospective study. Eur Urol Focus 2021; 7: 1019–1026. |
|
114. |
Chessa F, Schiavina R, Amelio E, et al. Diagnostic accuracy of the novel 29 MHz micro-ultrasound ‘ExactVuTM’ for the detection of clinically significant prostate cancer: a prospective single institutional study. A step forward in the diagnosis of prostate cancer. Arch Ital Di Urol E Androl 2021; 93: 132–138. |
|
115. |
Avolio PP, Lughezzani G, Paciotti M, et al. The use of 29 MHz transrectal micro-ultrasound to stratify the prostate cancer risk in patients with PI-RADS III lesions at multiparametric МРТ: a single institutional analysis. Urol Oncol 2021; 39: 832e1–832.e7. |
|
116. |
Rodríguez Socarrás ME, Gomez Rivas J, Cuadros Rivera V, et al. Prostate mapping for cancer diagnosis: the Madrid protocol. Transperineal prostate biopsies using multiparametric magnetic resonance imaging поєднана and micro-ultrasound Керована biopsies. J Urol 2020; 204: 726–733. |
|
117. |
Abouassaly R, Klein EA, El-Shefai A, et al. Impact of using 29 MHz high-resolution micro-ultrasound in real-time targeting of transrectal prostate biopsies: initial experience. World J Urol 2020; 38: 1201–1206. |
|
118. |
Park KJ, Choi SH, Lee JS, et al. Interreader agreement with prostate imaging reporting and data system version 2 for prostate cancer detection: a systematic review and meta-analysis. J Urol 2020; 204: 661–670. |
|
119. |
Hosny A, Parmar C, Quackenbush J, et al. Artificial intelligence in radiology. Nat Rev Cancer 2018; 18: 500–510. |
|
120. |
Liu X, Faes L, Kale AU, et al. A comparison of deep learning performance against health-care professionals in detecting diseases from medical imaging: a systematic review and meta-analysis. Lancet Digit Health 2019; 1: e271–e297. |
|
121. |
Sugano D, Sanford D, Abreu A, et al. Impact of radiomics on prostate cancer detection: a systematic review of clinical applications. Curr Opin Urol 2020; 30: 754–781. |
|
122. |
Castiglioni I, Rundo L, Codari M, et al. AI applications to medical images: from machine learning to deep learning. Phys Med 2021; 83: 9–24. |
|
123. |
Ahmed HU, El-Shater Bosaily A, Brown LC, et al. Diagnostic accuracy of multi-parametric МРТ and ТУЗД biopsy in prostate cancer (PROMIS): a paired validating confirmatory study. Lancet 2017; 389: 815–822. |