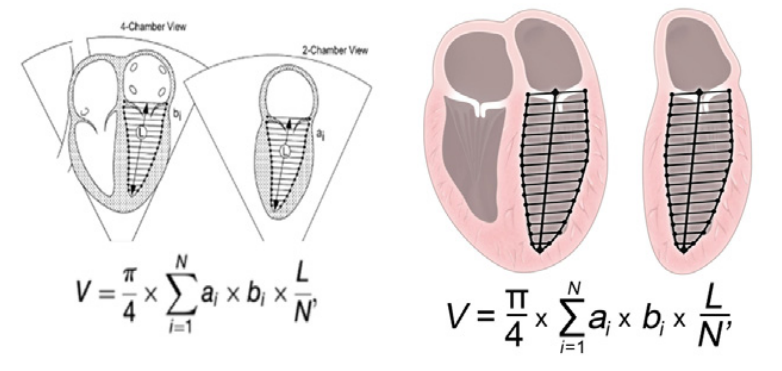
Ключові слова: Пренатальна діагностика, Вроджені вади серця, Аритмія плода, Гідропсія, Кардіоміопатія
Абревіатури
2D = двовимірний
3СТ = Трьохсудинний-трахеальний зріз
3СЗ = Трьохсудинний зріз
ААС = Американська асоціація серця
АІУМ = Американський інститут ультразвуку в медицині
СВКЛА = Синдром відсутності клапана легеневої артерії
АТЕ = Американське товариство ехокардіографії
АВ = Атріовентрикулярний
ВВС = Вроджена вада серця
CW = Безперервно-хвильовий
d-ТМА = D-транспозиція магістральних артерій
ТКД = Тканинна кольорова доплерографія
СГЛВС = Синдром гіпоплазії лівих відділів серця
НПВ = Нижня порожниста вена
l-ТМА = L-транспозиція магістральних артерій
ЛШ = Лівий шлуночок
MI = Механічний індекс
PW = Імпульсно-хвильовий
ПШ = Правий шлуночок
ЄШ = Єдиний шлуночок
ВПВ = Верхня порожниста вена
TI = Тепловий індекс
ТФ = Тетрада Фалло
ТК = Трикуспідальний клапан
ХТК = Хвороба трикуспідального клапана
ДМШП = Дефект міжшлуночкової перегородки
ІШП = Інтеграл лінійної швидкості потоку
I. ВСТУП
У 2004 році Американське товариство ехокардіографії (АТЕ) опублікувало настанови та стандарти виконання ехокардіографії плода.1 Авторська група, створена на замовлення Педіатричної ради АТЕ, провела огляд медичної літератури, а також узагальнила консенсус експертів, щоб створити документ, який був вкрай необхідним і слугував спільноті ехокардіологів плода та дітей протягом майже двох десятиліть. Однак ця галузь продовжує стрімко розвиватися, і з часу цієї публікації з’явилося багато нової інформації.
За останні 5 років кілька професійних груп, включаючи Американську асоціацію серця (ААС)2, Міжнародне товариство ультразвуку в акушерстві та гінекології 3 та Американський інститут ультразвуку в медицині (АІУМ)4, опублікували оновлені настанови та стандартні документи з оцінки стану серця плода. З часу публікації документа АТЕ у 2004 році багато з того, що було вивчено, пояснюється інтенсивним прагненням до міждисциплінарної співпраці, об’єднанням багатоцентрових даних і досвіду вузьких спеціалістів, включаючи дитячих кардіологів, радіологів, акушерів, спеціалістів з медицини матері і плода та лікарів-сонографів, які є важливими учасниками догляду за плодами з серцево-судинними захворюваннями. Постійні дослідження та співпраця підтримують зусилля, спрямовані на краще розуміння фізіології плода, а також процесів розвитку та прогресування захворювань. Це призвело до значних покращень у візуалізації плода, клінічній практиці та результатах лікування пацієнтів.
Враховуючи, що майбутнє фетальної кардіології пов’язане з міждисциплінарною співпрацею 5, з’явилася нова інформація, яку слід узагальнити та викласти у переглянутій заяві AТE, щоб підтримувати найкращі практики з ехокардіографії плода, фетальної та перинатальної серцево-судинної допомоги в різних галузях медицини. Метою цього документу є надання оновлених рекомендацій щодо виконання та інтерпретації ехокардіографії плода при виявленні, класифікації, оцінці ризику та плануванні перинатального догляду за вагітністю, в якій плід має серцево-судинні захворювання. Цей документ замінює згадану вище настанову AТE 2004 року.
II. ПОКАЗАННЯ
Показання до проведення ехокардіографії плода (Таблиця 1), золотого стандартного тесту для діагностики вроджених вад серця (ВВС) у плода, змінювалися протягом багатьох років. Обговорення в цьому розділі стосується якості та чутливості пренатального ультразвукового скринінгу серцевих аномалій, базового або детального акушерського анатомічного ультразвукового дослідження, яке виконується в другому триместрі вагітності. Як і у випадку з більшістю скринінгових тестів, базове або детальне анатомічне УЗД для виявлення вродженої аномалії пропонується популяції здорових людей з низькою ймовірністю захворювання. Однак, на відміну від інших медичних скринінгових тестів, існує величезна регіональна варіабельність результатів акушерського анатомічного УЗД як скринінгового інструменту для виявлення ВВС. Таким чином, рішення про показання для направлення на ехокардіографію плода є складним завданням на рівні населення та політики охорони здоров’я. При обговоренні питань виявлення захворювань в рамках популяційної системи охорони здоров’я корисно розуміти, що рекомендація щодо скерування на остаточне тестування залежить як від рівня захворюваності в популяції, яка підлягає скринінгу, так і від результатів скринінгового тесту.
Достовірно оцінити індивідуальний базовий ризик ВВС на основі факторів у вагітної та/або плода досить складно. У США популяційні оцінки навіть загальної частоти ВВС плода не є чіткими через брак даних про переривання вагітності та загибель плода, а також через відсутність стандартизованої реєстрації даних у пренатальному періоді. Таким чином, більшість популяційних оцінок ВВС ґрунтуються на записах про народження і є оцінками поширеності, які коливаються від 0,3% до 1,2%.13 У більшості ситуацій скерування на ехокардіографію плода рекомендується тоді, коли ймовірність ВВС плода перевищує приблизно в 3 рази фоновий популяційний ризик, або >1%. Пацієнти з ймовірністю захворювання нижче фонового рівня після нормальних результатів скринінгового ультразвукового дослідження не потребують додаткового обстеження з використанням ехокардіографії плода, але постскринінгова ймовірність залежить як від дотестової ймовірності ВВС плода, так і від чутливості та специфічності застосованого методу скринінгу (Зображення 1). Якщо скринінг вказує на серцеву аномалію, існує висока ймовірність того, що результати ехокардіографії плода будуть ненормальними, а отже, ехокардіографію плода необхідно виконати для підтвердження та уточнення діагнозу. Однак, де встановити поріг для скерування на ехокардіографію плода, незважаючи на нормальні результати скринінгу, залежить від того, наскільки добре виконується скринінгове ультразвукове дослідження в конкретній громаді та від толерантності до пропущених діагнозів. За останнє десятиліття стандартні акушерські рекомендації з кардіологічного скринінгу розширилися з чотирьохкамерного зображення до зображення обох шляхів відтоку 3 , а також трьохсудинного зрізу (3СЗ) і трьохсудинно-трахеального зрізу (3СТ), коли це технічно можливо. 15 Отримання додаткових видів збільшує чутливість акушерського кардіоскринінгу,16 але місцева практика і досвід впливають на ступінь покращення. Наявність певних факторів ризику (материнських, плодових та/або сімейних) може підвищити дотестову ймовірність ВВС у нащадків настільки, що ехокардіографія плода рекомендується незалежно від нормальних результатів акушерського ультразвукового дослідження. Практичні схеми можуть відрізнятися залежно від регіональних оцінок чутливості та специфічності виявлення ВВС за допомогою акушерського ультразвуку в конкретному регіоні чи громаді, а також від міркувань економічної ефективності та розподілу ресурсів, як описано нижче. Додатковими важливими факторами можуть бути система охорони здоров’я, проблеми зі страхуванням та наявні ресурси, які можуть посилити існуючі диспропорції в охороні здоров’я та доступ до медичної допомоги, а також навички операторів скринінгу, вимоги до безперервної освіти та оцінки навичок, а також доступ до них. У ситуаціях, коли ехокардіографія плода є обмеженим ресурсом або існує підвищений ризик, пов’язаний з поїздкою пацієнта для проведення ехокардіографії плода, можна використовувати систему сортування, яка враховує місцеві показники виявлення скринінгу, наприклад, описану в настановах AТE щодо коронавірусної хвороби 2019 року 17. Якщо є можливість, слід розглянути використання телемедицини.
Таблиця 1 Потенційні показання для проведення ехокардіографії плода
| Джерело | Рекомендація AТE 2023 | Рекомендація АІУМ 20204 | Рекомендація ААС 20142* |
| Материнські фактори (абсолютний ризик) | |||
| Цукровий діабет до вагітності (3%-5%) | Вказано | Вказано | І (вказано) |
| Цукровий діабет, виявлений після другого триместру (<1%) | Не вказано | Не вказано | III (немає користі) |
| Фенілкетонурія (12%-14%) | Вказано | Вказано | І (вказано) |
| Аутоімунне Захворювання: SSA/SSB Позитивне (1%-5%)‡ | Вказано | Вказано | ІІа (мабуть вказано) |
| Екстракорпоральне запліднення (1.1%-3.3%) | Може бути розглянуто§ | Вказано | ІІа (мабуть вказано) |
| Материнська інфекція: краснуха (3%-4%) | Вказано | Вказано | І (вказано) |
|
Сімейний анамнез ВВС: родич першого ступеня спорідненості (3%-20%){ |
Вказано | Вказано | І (вказано) |
|
Сімейний анамнез ВВС: родич другого ступеня споріднення або більш далекий родич (<2%)k |
Не вказано | Може бути вказано | ІІb (можливо вказано) |
| Ожиріння (ІМТ > 30 кг/м²) (1-2%) | Не вказано | Не вказано | — |
| Ретиноїди (8%-20%) | Вказано | Вказано | І (вказано) |
| Інгібітори АПФ (3%) | Може бути розглянуто§ | Може бути вказано | ІІа (мабуть вказано) |
| Пароксетин (3%) | Може бути розглянуто§ | Може бути вказано | ІІb (можливо вказано) |
| Інші вибіркові інгібітори зворотного захоплення серотоніну (1%-2%)6,7 | Не вказано | Не вказано | III (немає користі) |
| Протиепілептичні препарати (1%-2%) | Не вказано | Може бути вказано | ІІb (можливо вказано) |
| Літій (1%-2%) | Не вказано | Може бути вказано | ІІb (можливо вказано) |
| Варфарин (<1%)8 | Не вказано | Не вказано | III (немає користі) |
| Фетальні фактори, виявлені під час скринінгу (абсолютний ризик) | |||
| Фетальний гідропс (15%-20%)9 | Вказано | Вказано | І (вказано) |
| Позасерцева аномалія (20%-45%)10,11 | Вказано | Вказано | І (вказано) |
| Хромосомні аномалії (10%-90%) | Вказано | Вказано | І (вказано) |
| Монохоріонічна двійня (2%-10%) | Вказано | Вказано | І (вказано) |
| Потилична прозорість плода 3.0-3.4 мм (3%) | Може бути розглянуто§ | Може бути вказано | ІІа (мабуть вказано) |
| Потилична прозорість плода ≥3.5 мм (6%-60%) | Вказано | Вказано | І (вказано) |
| Єдина пупкова артерія в ізоляції (1.2%-1.8%)12 | Не вказано | Не вказано | ІІb (можливо вказано) |
АПФ – ангіотензинперетворювальний фермент; ІМТ – індекс маси тіла.
Ехокардіографія плода показана у випадку аномальних результатів скринінгового ультразвукового дослідження серця незалежно від додаткових факторів ризику; нижче наведені рекомендовані показання до проведення ехокардіографії плода на основі апріорного ризику з раніше опублікованих настанов та цього документу. У рекомендаціях “AТE 2023” (даний документ) класифікація “не показано” передбачає нормальний результат кардіоскринінгу при акушерському анатомічному скануванні у другому триместрі вагітності. Якщо не зазначено інше, довідкові дані наведені в роботі Donofrio та співавт. 2.
*Використовуючи “класифікацію рекомендацій “2 : I = процедуру слід виконати; IIa = процедуру доцільно виконати; IIb = процедуру можна розглянути; III = шкода/відсутність користі.
† ‘”Абсолютний ризик”: базова оцінка ризику ВВС незалежно від результатів УЗД.
‡ Раніше хворіла дитина з повною серцевою блокадою, ризик зростає до 11%-19%.
- Рішення про направлення на ехокардіографію плода, незважаючи на негативні результати скринінгового УЗД, повинно ґрунтуватися на чутливості та специфічності виявлення ВВС у місцевих скринінгових практиках.
{ Може становити до 50% при генетичних порушеннях з менделівським успадкуванням.
k Не показаний, якщо немає генетичного захворювання з менделівським типом успадкування.
Зображення 1 До- та післятестова ймовірність ВВС плода при нормальних результатах скринінгового ультразвукового дослідження. Імовірність ВВС плода на рівні ≤1% (фоновий ризик) після скринінгового УЗД залежить від дотестової ймовірності ВВС плода та чутливості і специфічності методу скринінгу, що використовується. При використанні тривимірного методу скринінгу (пунктирні лінії) дотестова ймовірність ВВС плода повинна становити ≤2%, щоб після проведення скринінгового УЗД ймовірність ВВС плода знизилась до 1% (пунктирна зелена лінія). При використанні методу п’ятиосьового скринінгу (суцільні лінії), попередня ймовірність ВВС плода повинна становити ≤3%, щоб після скринінгу ймовірність ВВС плода знизилась до 1% (суцільна синя лінія). При дотестовій ймовірності ВВС плода 5% жоден з методів не призводить до постскринінгової ультразвукової ймовірності ВВС плода <1% (червоні лінії). Розрахунки негативного відношення правдоподібності базуються на чутливості та специфічності, про які повідомляють Bak та співавт. 14
Витрати, пов’язані з ехокардіографією плода за різними показаннями, також є критично важливими як для пацієнта, так і для системи охорони здоров’я. Витрати та економічна ефективність пренатального скринінгу ВВС значно відрізняються залежно від стратегії, що використовується. Опубліковані аналізи економічної ефективності ВВС плода зосереджені, в основному, на стратегіях скринінгу станів високого ризику, таких як прегестаційний діабет і екстракорпоральне запліднення. Деякі з них дійшли висновку, що добре виконане акушерське сканування є економічно ефективнішим порівняно зі скеруванням таких вагітних з високим ризиком безпосередньо на ехокардіографію плода. Однак цей висновок значною мірою залежить від якості скринінгового ультразвукового дослідження та його інтерпретації, а співвідношення вартості та ефективності скринінгу пов’язане з чутливістю, специфічністю та посттестовою вірогідністю, як описано вище.18,19 І навпаки, при розгляді популяції низького ризику численні дослідження показали, що високоякісне скринінгове ультразвукове дослідження, яке виконується в загальній акушерській практиці, є найбільш економічно ефективним, в той час як використання універсальної ехокардіографії плода – не є таким. Включення додаткових видів, як показано в недавньому аналізі скринінгового підходу з п’ятьма видами 14 , також є економічно ефективним, оскільки підвищує чутливість за дуже невеликі додаткові витрати. Таким чином, оптимальна стратегія скринінгу та скерування залежить від готовності суспільства платити за підвищену ефективність. ВВС є більш поширеною і летальною, ніж трисомія 21,13, для якої програми пренатального скринінгу в середньому коштують від $27 000 до $78 000 за один виявлений дефект.20,21
Для порівняння, витрати на одну виявлену ВВС в середньому становлять лише $38,000-47,000 при застосуванні сучасного ультразвукового скринінгу в другому триместрі 22 , хоча це призводить до виявлення лише 50%-70% випадків ВВС. Розуміння компромісу між вартістю та ефективністю скринінгу ВВС у групах низького та високого ризику та вдосконалення акушерського скринінгу може надати додаткові докази для проведення ехокардіографії плода, розгляду альтернативних стратегій та/або зосередження зусиль для ефективного впровадження на практиці. Короткий огляд ключових досліджень у цій галузі наведено в Таблиці 2.
Таблиця 2 Узагальнення основних досліджень економічної ефективності щодо скринінгу на ВВС в умовах стандартного ризику та певних станів високого або проміжного ризику
| Автор та рік | Популяція | Порівняні стратегії | Показник ефективності | Висновки | Міркування |
| Odibo та співавт. (2006)18 | Прегестаційний діабет | 1. Без ЕКГП | QALYs | Селективна ЕКГП після патологічного сканування найбільш економічно ефективна Модель припускає детальну анатомічну діагностику чутливість сканування 61% і специфічність 99% Ймовірність переривання 50% Проведено аналіз чутливості | |
| Chung та співавт. (2021)23 | Екстракорпоральне запліднення | 1. Селективна ЕКГП після аномального сканування 2. ЕКГП тільки для ІКСІ 3. ЕКГП для всіх ЕКЗ | QALYs |
Тільки селективна ЕКГП після аномального сканування була економічно ефективною Ті ж самі припущення щодо УЗД вище Чутливість ЕКГП припускається 88%. |
ICER для (2) та (3) від $2 млн до $5 млн за QALY |
| NHS (2008)24 | Вагітності зі стандартним ризиком | 1. Стандартний чотирикамерний зріз 2. Чотирикамерний зріз + вид на відтік | QALYs |
На 33% більше ВВС виявлено $24 000 на QALY для відтоку Припускається 36% виявлених з d-ТМА |
|
| Pinto та співавт. (2014)22 | Вагітності зі стандартним ризиком | 1. Стандартний чотирикамерний зріз 2. Чотирикамерний зріз + вид на відтік 3. Ярусна з ППП 4. Чотирикамерна + вид на відтік, виконаний ММП 5. Універсальний ЕКГП | ВВС виявлено |
Чотирикамерний + відтік з направленням до ММП є найбільш економічно ефективним Для додаткових $580 за виявлений ВВС, чотирикамерний + відтік з направленням до кардіології збільшив виявлення ВВС на 13%. |
Передбачувана АК чутливість 67% Скринінг ММП 77% ЕКГП ММП 80% Кардіологічна ЕКГП 94% |
| Bak та співавт. (2020)14 | Вагітності зі стандартним ризиком | 1. Три серцевих зрізи 2. П’ять зрізів 3. Шість зрізів 4. П’ять аксіальних зрізів | QALYs |
ICER для п’яти осьових видів порівняно з трьома видами становив 35 000 на QALY Модель припустила витрати на додатковий вид $10 Чутливість Три зрізи: 44% П’ять зрізів: 55% Шість зрізів: 67% П’ять осьових зрізів: 66% |
ЕКГП: 94% |
ЕКГП, ехокардіографія плода; ICER, інкрементне співвідношення витрат та ефективності; Hgb A1c, глікований гемоглобін; ІКСІ, інтрацитоплазматична ін’єкція сперматозоїдів; ЕКЗ, екстракорпоральне запліднення; ММП, спеціаліст з медицини матері та плода; ППП, потилична прозорість плода в 10-14 тижнів; АК, акушерський; QALY, кількість якісних років життя.
На основі цієї інформації фактори ризику матері та плода з супутнім абсолютним ризиком ВВС у плода представлені в Таблиці 1; також включені консенсусні рекомендації щодо направлення на ехокардіографію плода, а також порівняння з опублікованими рекомендаціями інших організацій, включаючи АІУМ 4 та ААС.2 Знову ж таки, ехокардіографія плода показана, якщо результати скринінгового УЗД серця є аномальними, незалежно від додаткових факторів ризику, оскільки ризик істинної ВВС наближається до 40% до 70% у цих випадках.25
Ключові моменти
- Ехокардіографія плода показана при отриманні аномальних результатів скринінгового УЗД серця незалежно від наявності або відсутності додаткових факторів ризику.
- Існує широка варіабельність у виконанні акушерського ультразвукового дослідження в середньому терміні вагітності. Таким чином, доцільно продовжувати поточну стратегію включення як материнських, так і плодових факторів ризику в рішення про направлення на ехокардіографію плода, навіть якщо базове або детальне акушерсько-анатомічне сканування виглядає нормальним.
- У ситуаціях, коли ехокардіографія плода є обмеженим ресурсом або проведення дослідження пов’язане з підвищеним ризиком, може бути розглянута система сортування, яка враховує місцеві показники виявлення скринінгу та можливість використання телемедицини.
III. ЕХОКАРДІОГРАФІЧНЕ ДОСЛІДЖЕННЯ ПЛОДА
Конкретні вимоги до навчання та підтримання компетентності виходять за рамки цього документа. Однак, настанови були розроблені Американським коледжем кардіологів спільно з ААС та AТE і схвалені нашою групою.1 ААС 2 рекомендує, щоб “тільки добре підготовлені або досвідчені дитячі кардіологи, спеціалісти з медицини матері та плоду, акушери або радіологи, які набули відповідної бази знань та навичок, могли контролювати та виконувати ехокардіограми плода”, а також щоб постійні зусилля з покращення якості були задокументовані.
A. Час обстеження, обладнання та зберігання зображень
Час. Оптимальним терміном для проведення комплексної трансабдомінальної ехокардіографії плода є 18-22 тижні гестації. Досягнення в ультразвукових технологіях дозволили проводити оцінку серця плода вже на 12-14 тижні вагітності.26 Такі ранні дослідження особливо підходять для плодів з високим ризиком розвитку серцевих аномалій. Раннє сканування слід повторити пізніше в другому триместрі, навіть якщо початкові результати візуалізації є нормальними.27 Серійна оцінка аномалій серця зазвичай проводиться з інтервалом від 2 до 8 тижнів (залежно від ураження та клінічних проблем) приблизно до 34-36 тижнів вагітності. Оцінка серця плода ближче до терміну вагітності призначена для ситуацій, в яких результати можуть вплинути на негайне постнатальне ведення, наприклад, оцінка обмеження передсердь при d-транспозиції магістральних артерій (d-ТМА) або синдромі гіпоплазії лівих відділів серця (СГЛВС). Якщо результати ехокардіографії плода в середньому триместрі є нормальними, подальша оцінка, як правило, не потрібна, проте рекомендується проводити її з інтервалом до 2-4 тижнів, якщо є занепокоєння щодо розвитку прогресуючого ураження серця, такого як кардіоміопатія, обструкція лівих відділів серця або значний стеноз клапана чи регургітація. Точний інтервал спостереження повинен визначатися командою кардіологів та акушерів, які ведуть пацієнтку, оскільки прогресування захворювання може вплинути на внутрішньоутробний догляд, терміни пологів та післяпологове ведення пацієнтки.
Обладнання. Ультразвукові системи, що використовуються для ехокардіографії плода, повинні мати високу просторову та часову роздільну здатність, враховуючи малий розмір серця плода, що швидко б’ється. Трансабдомінальне сканування є стандартом, за винятком дуже ранніх термінів вагітності. Криволінійні датчики є найбільш часто використовуваним типом датчиків з огляду на широкий огляд ближнього поля і майже паралельні ультразвукові пучки; ці датчики спеціально розроблені для трансабдомінального сканування і є кращими для дослідження серця плода, хоча можуть використовуватися лінійні і секторні датчики. Частотний діапазон датчика повинен становити 2-7 МГц для сканування наприкінці другого та третього триместру, в той час як для сканування наприкінці першого та на початку другого триместру може бути корисним датчик з частотним діапазоном 5-12 МГц. Технологічні можливості повинні включати двовимірний (2D; В-режим), М-режим, кольоровий потік та імпульсно-хвильовий (PW) доплерівський ультразвук як мінімальні вимоги. Безперервно-хвильовий (CW) доплерівський ультразвук може бути використаний для характеристики високих швидкостей потоку, якщо він доступний. Такі параметри, як частота, гармоніки, ширина сектора і глибина, повинні регулюватися для максимізації частоти кадрів і поперечної роздільної здатності на необхідній глибині.
Зберігання. Нижче наведено адаптовану версію практичних параметрів АІУМ щодо документування ультразвукового дослідження28 та стандартів і рекомендацій Міжсуспільної акредитаційної комісії з акредитації дитячої ехокардіографії. (published June 1, 2017, revised April 27,2018;https://intersocietal.org/wp-content/uploads/2021/10/IAC PediatricEchocardiographyStandards2017.pdf).
Ехокардіографічні дослідження плода повинні включати як нерухомі, так і рухомі зображення, що супроводжуються структурованим звітом. Необхідні відеозаписи включають, але не обмежуються наступним:
- Осьова розгортка від шлунка до верхнього середостіння, включаючи зріз чотирьох камер, артеріальних шляхів відтоку, а також зріз магістральних судин і дуги.
- Чотирикамерний зріз: 2D і кольорове доплерівське ультразвукове дослідження
- Вигляд вихідного тракту лівого шлуночка (ЛШ): 2D та кольорове доплерівське ультразвукове дослідження
- Вигляд вивідного тракту правого шлуночка (ПШ): 2D та кольорове доплерівське ультразвукове дослідження
- 3СЗ та 3СТ зрізи: 2D та кольорове доплерівське ультразвукове дослідження
- Сагітальний зріз дуг аорти та протоки: 2D та кольорове доплерівське ультразвукове дослідження
Зображення слід зберігати в захищеному цифровому архіві, щоб їх можна було знайти та переглянути за потреби. Рекомендації щодо змісту збережених зображень були надані АІУМ.28 Важливим є дотримання місцевих законодавчих вимог щодо тривалості зберігання. Наведена нижче мінімальна інформація повинна міститися в метаданих і бути доступною для читання/відображення під час перегляду збережених зображень (для аналогових записів ідентифікатори повинні бути присутніми на зображенні):
- Ім’я пацієнта та інша ідентифікаційна інформація
- Ідентифікаційна інформація закладу
- Дата та час проведення ультразвукового дослідження
- Стандарт відображення результатів (тепловий індекс [TI] та механічний індекс [MI])
- Позначення анатомічної локалізації та латеральності, за необхідності
- Орієнтація зображення, за необхідності
B. Безпека
Інфекційний контроль. Фетальні ехокардіографи повинні дотримуватися всіх чинних інституційних та національних рекомендацій щодо інфекційного контролю, які стосуються обладнання, вагітних та медичних працівників. Конкретні рекомендації можуть бути адаптовані відповідно до обставин, таких як пандемія коронавірусної хвороби 2019 року.29
Акустичні біоефекти. На сьогоднішній день не було підтверджено жодних шкідливих наслідків, пов’язаних з ультразвуковим дослідженням серця плода.30 Однак при ехокардіографічному дослідженні плода використовуються різні ультразвукові методи, включаючи 2D-візуалізацію, PW і CW доплер, кольорову доплерографію та тканинний кольоровий доплер (ТКД), які випромінюють енергію. Отже, фетальні ехокардіографи повинні усвідомлювати, що існують теоретичні міркування щодо безпеки застосування ультразвуку до плоду, який розвивається. Ефекти діагностичного ультразвуку можна розділити на теплові (пов’язані з підвищенням температури в області інсоляції) і механічні (наприклад, кавітація від розширення і стиснення або колапс бульбашок через акустичний тиск ультразвукового променя). Зважаючи на ці потенційні біоефекти, ультразвукові системи мають стандарти відображення вихідних даних – TI та MI – для того, щоб забезпечити керівництво для лікарів, які сканують плоди. Особи, які проводять ехокардіографію плода, повинні знати про ТІ та МІ і повинні обмежити вихідну потужність та час експозиції до рівня, необхідного для завершення дослідження. Всі ехокардіографічні дослідження плода повинні керуватися принципом “настільки низького рівня, наскільки це можливо”, який впливає на способи ультразвукового дослідження та тривалість дослідження.31 Різні ультразвукові системи, навіть від одного виробника, можуть відрізнятися щодо виявлення МІ та ТІ.32
C. Техніка обстеження
Під час підготовки до дослідження пацієнта зазвичай кладуть в положення лежачи на спині з м’якою подушкою під головою і з невеликим нахилом верхньої частини тулуба для підвищення комфорту. Ультразвукова система повинна бути розташована таким чином, щоб мінімізувати напруження і повторювані навантаження на руку оператора, що сканує, і верхню частину тулуба. Якщо габітус тіла матері, а також положення та рухи плода обмежують проведення дослідження, пацієнтці можна запропонувати повторне обстеження в інший час, про що слід чітко зазначити у звіті. Після встановлення положення плода та його правої/лівої і передньої/задньої орієнтації, проводиться первинний огляд плода для визначення приблизного терміну вагітності, а також для встановлення положення органів черевної порожнини та серцевого передлежання. Слід звернути увагу на наявність або відсутність рідини в перикардіальному, плевральному та перитонеальному просторах. Масу плода можна оцінити під час ехокардіографії плода, на розсуд клінічної бригади.
D. Оптимізація зображення
Для оптимізації якості зображення та візуалізації анатомії серця плода під час дослідження можна використовувати декілька методів. Застосування адекватного тиску датчика та зміна положення матері – це методи, які можуть покращити позиціонування плода та якість зображення, особливо у пацієнток з ожирінням та надмірним черевним панікулусом. У таких пацієнток може бути корисним сканування нижче рівня панікулуса або через пупок. Налаштування системи повинні бути відрегульовані для підтримки високої частоти кадрів (наприклад, звуження сектору або поля зору, використання відповідної глибини візуалізації та звуження області кольорового доплера, що цікавить). Оскільки частота серцевих скорочень плода зазвичай коливається від 120 до 160 уд/хв, для оптимізації часової та просторової роздільної здатності рекомендується підтримувати частоту кадрів сканування >30-40 Гц. Крім того, для перегляду важливих подій, що відбуваються при ЧСС >140 уд/хв, або для отримання функціональної інформації про серце за допомогою спекл-трекінгу, може знадобитися ще вища частота кадрів від 80 до 100 Гц (тобто близько 40 кадрів на один серцевий цикл).33 Збільшення зображення слід встановити таким чином, щоб серце займало приблизно третину екрану, а фокусна зона зображення повинна бути належним чином встановлена на рівні бажаної області, що цікавить, для досягнення найкращої можливої бічної роздільної здатності. Серцеві перегородки слід візуалізувати в ортогональних проекціях, при цьому площини перегородок повинні бути перпендикулярні до площини візуалізації. Кольорове та спектральне доплерівське дослідження внутрішньосерцевих шунтів, а також клапанної та судинної гемодинаміки необхідно проводити під кутами, коаксіальними до кровотоку, для оптимізації точності. Ультразвукова доплерографія може бути особливо корисною для отримання більш детальної картини кровотоку, пов’язаного з дрібними судинними структурами і дефектами міжпередсердної перегородки серця. Якщо, незважаючи на оптимізацію, візуалізація залишається недіагностичною, пацієнту може бути запропоновано повторне обстеження в інший час, а обмеження повинні бути чітко зазначені у звіті.
E. Стандартні зрізи та площини візуалізації
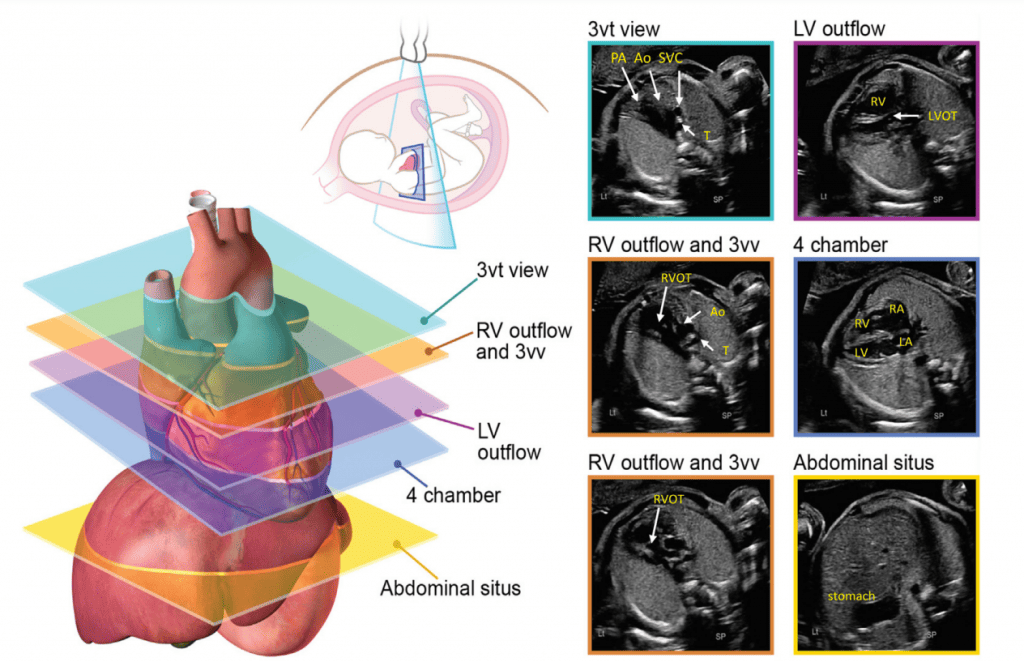
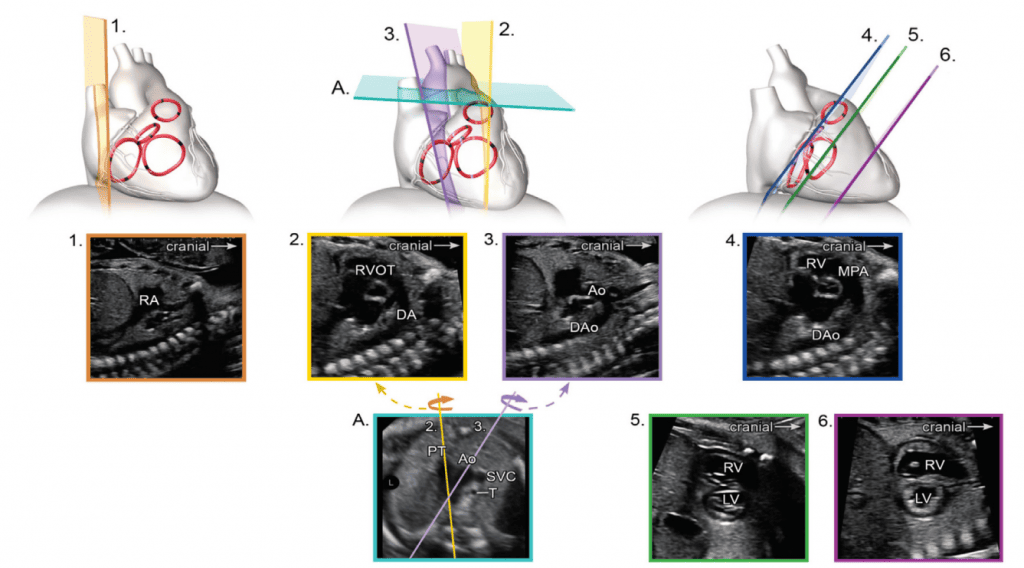
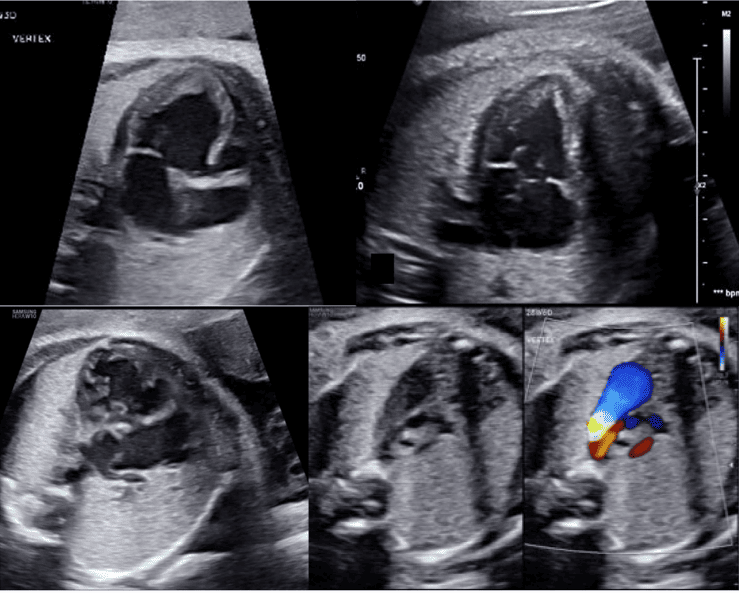
Для адекватної візуалізації серця плода необхідно використовувати декілька позицій сканування та розгорток. Сучасні суспільні рекомендації рекомендують поєднувати комплексну оцінку в аксіальній площині з сагітальною та парасагітальною візуалізацією цільових структур.4 На Зображеннях 2 та 3 показано анатомічні кореляти з площинами томографічного зображення, які слід використовувати для оцінки анатомії та функції серця. Детальний перелік структурних елементів для повного ехокардіографічного дослідження плода представлений в Таблиці 3, а ілюстративні приклади наведені на Зображеннях 4-9.
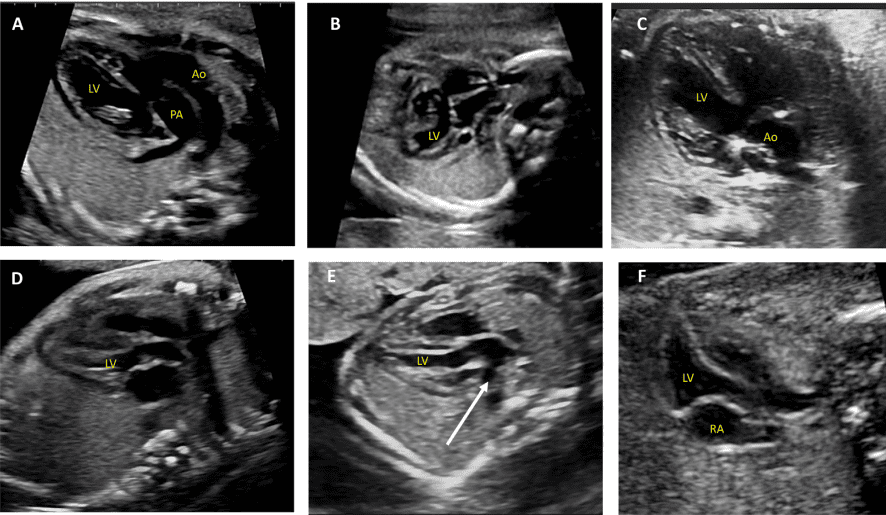
Зображення 2 Аксіальні площини, запропоновані для скринінгу серця плода під час акушерського анатомічного дослідження та як початкова серія, отримана під час ехокардіографії плода. Зверніть увагу, що на зображеннях показано плід у головному передлежанні; тазове передлежання призведе до дзеркальної зміни зображення, ніж показано тут. Ао – аорта; DA – артеріальна протока; LV – лівий шлуночок; LVOT – вихідний тракт лівого шлуночка; PA – легенева артерія; RV – правий шлуночок; RVOT – вихідний тракт правого шлуночка; T – трахея. Перемальовано та адаптовано з дозволу Yagel та співавт. 34
Зображення 3 Сагітальна та парасагітальна площини для ехокардіографічної оцінки плода. Ао – аорта; DA – артеріальна протока; DAo – низхідна аорта; LA – ліве передсердя; LV – лівий шлуночок; MPA – головна легенева артерія; RA – праве передсердя; RV – правий шлуночок; RVOT – вихідний тракт правого шлуночка.
Таблиця 3 Рекомендовані основні та факультативні компоненти ехокардіографічної 2D візуалізації плода з використанням 2D та кольорового доплера
| Компонент | 2D | Кольоровий доплер | Інше |
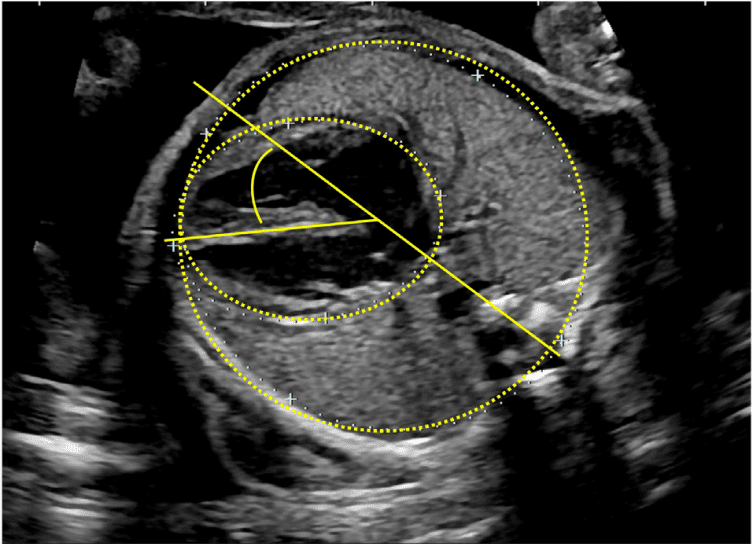
| Розмір серця | Обов’язково | Немає | Обов’язково: вимірювання співвідношення серцево-грудної площі (норма <0.34) |
| Серцева вісь (верхівка ліворуч, праворуч, попереду) | Обов’язково | Може бути корисним у разі складного зображення | Необов’язково: вимірювання вісі (норма 35-65) |
| Положення серця в грудній клітці (правостороннє, лівостороннє) | Обов’язково | Немає | |
| Визначення внутрішніх і атріальних сітусів | Обов’язково | Необов’язково | |
| Анатомія/з’єднання системних вен | Обов’язково | Обов’язково | |
| Анатомія/з’єднання легеневих вен | Обов’язково | Обов’язково | Принаймні з обох боків |
| Якісний розмір передсердь і морфологія міжпередсердної перегородки | Обов’язково | Обов’язково | |
| АВ-з’єднання | Обов’язково | Обов’язково | |
| Морфологія і розмір трикуспідального та мітрального клапанів (з порівнянням правого та лівого) | Обов’язково | Може бути корисним у разі складного зображення | Обов’язково: вимірювання анулусів трикуспідального та мітрального клапанів |
| Морфологія шлуночків, визначення петель, розміри (з порівнянням правого та лівого) | Обов’язково | Немає | Необов’язково: вимірювання максимальної довжини та ширини |
| Морфологія міжшлуночкової перегородки з виключенням/локалізацією дефекту, якщо присутній | Обов’язково | Обов’язково | Необов’язково: вимірювання товщини стінки |
| Шлуночково-артеріальні з’єднання | Обов’язково | Обов’язково | |
| Морфологія та розміри легеневого та аортального клапанів (з порівнянням правого та лівого) | Обов’язково | Обов’язково | Обов’язково: вимірювання розмірів аортального та легеневого клапанів |
| Взаємозв’язок та розмір магістральної артерії (з порівнянням правої та лівої) | Обов’язково | Може бути корисним у разі складного зображення | Необов’язково: вимірювання висхідної аорти та головної легеневої артерії |
| Морфологія та розміри аорти та дуги протоки (з порівнянням правої та лівої сторони) | Обов’язково | Обов’язково | Необов’язково: вимірювання протоки та аортального перешийка |
| Співвідношення аорти/протоки відносно трахеї | Обов’язково | Обов’язково | Необов’язково: кольорова доплерографія для аберантної підключичної артерії |
| Проксимальні гілки правої та лівої легеневих артерій (розгалуження) | Обов’язково | Обов’язково | Необов’язково: вимірювання діаметрів гілок |
| Оцінка перикардіальних чи плевральних випотів | Обов’язково | Немає |
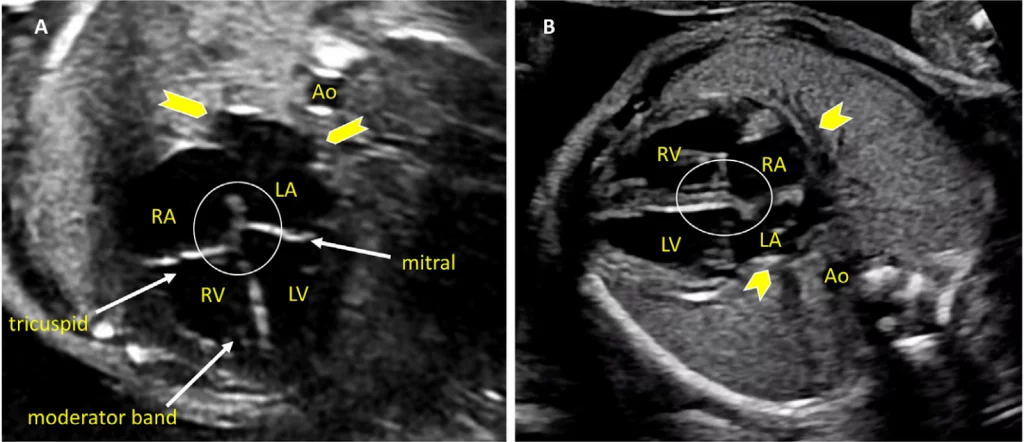
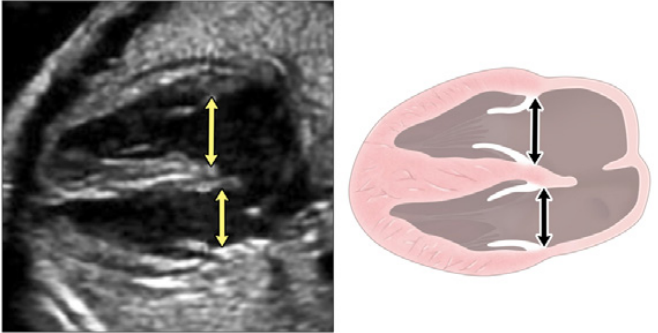
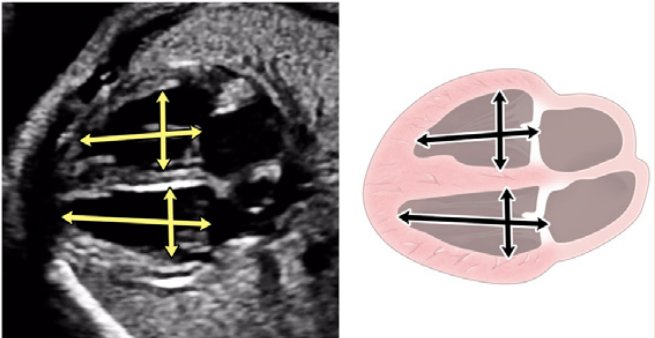
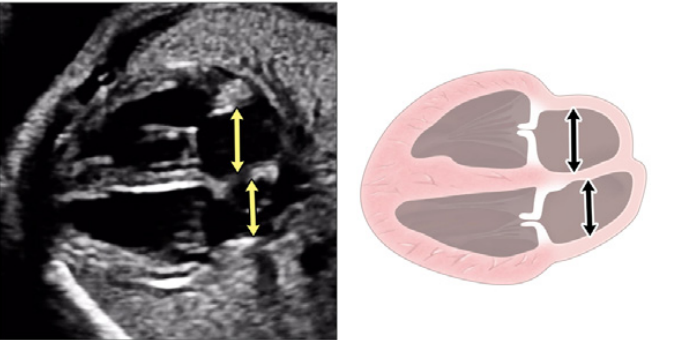
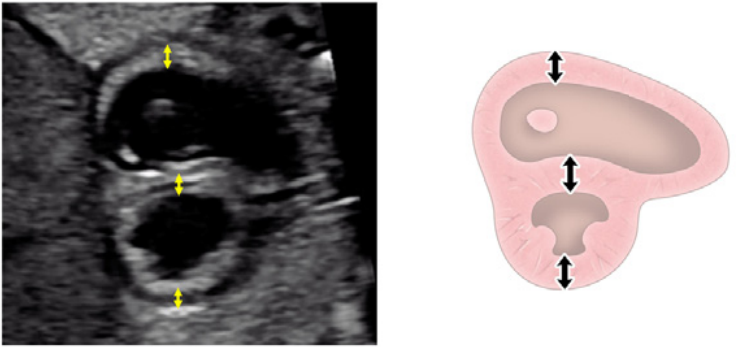
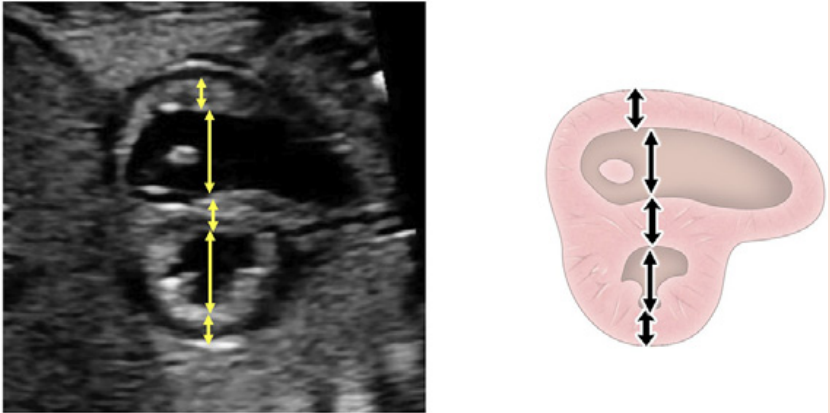
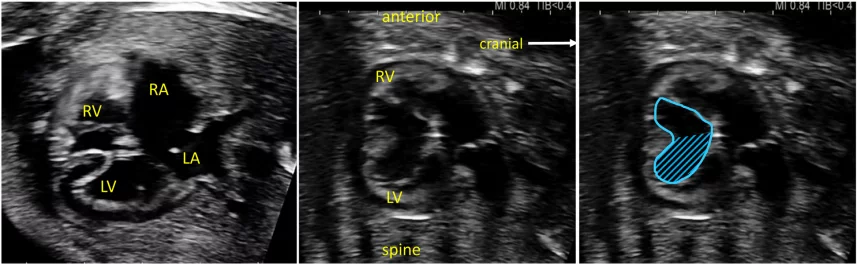
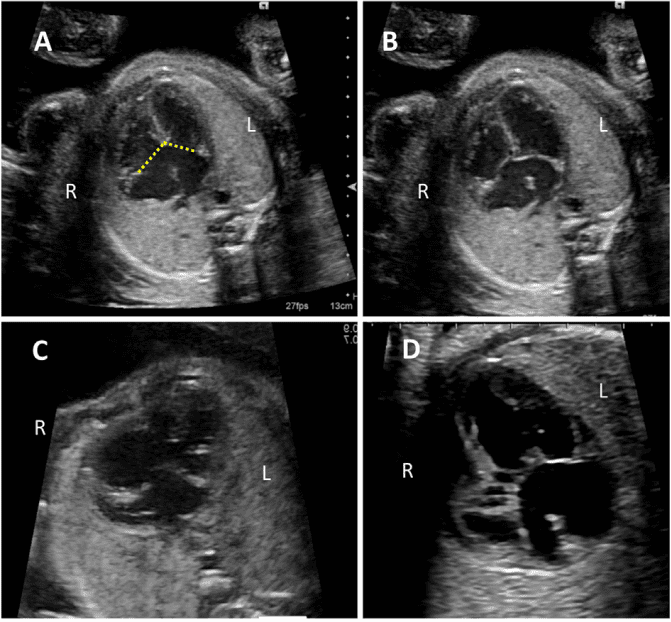
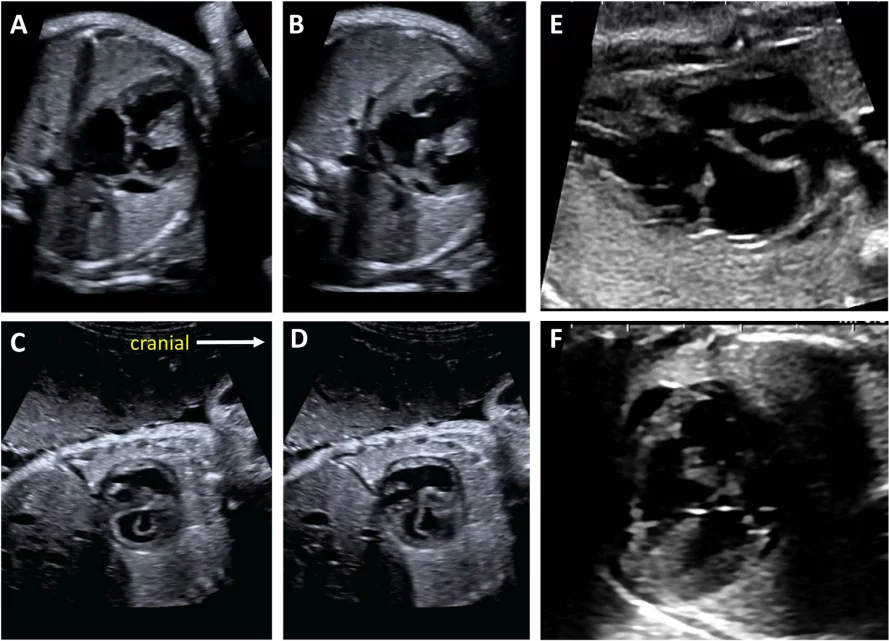
Зображення 4 Чотирикамерні аксіальні зображення в ортогональних площинах. Серце плода слід досліджувати щонайменше з двох ортогональних площин, залежно від розміру, товщини та орієнтації структури до інсонуючого променя. На (А) добре видно хрест серця (коло), тристулковий і мітральний клапани, але передсердно-шлуночкові перегородки найкраще видно на (В), де більш чітко видно стулку овального отвору (овал). Зверніть увагу, що окрім “чотирьох камер” видно й інші структури, зокрема легеневі вени (стрілки), низхідну аорту (Ао) та серединну смугу. LA, ліве передсердя; LV, лівий шлуночок; RA, праве передсердя; RV, правий шлуночок.
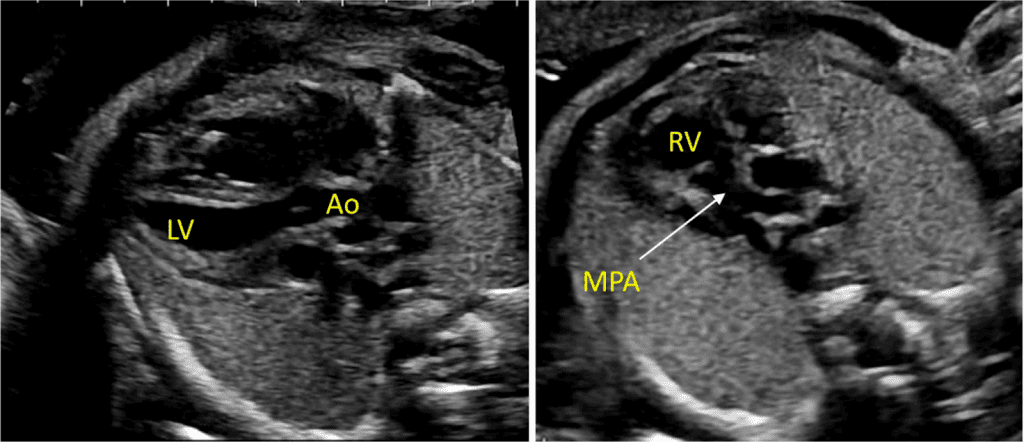
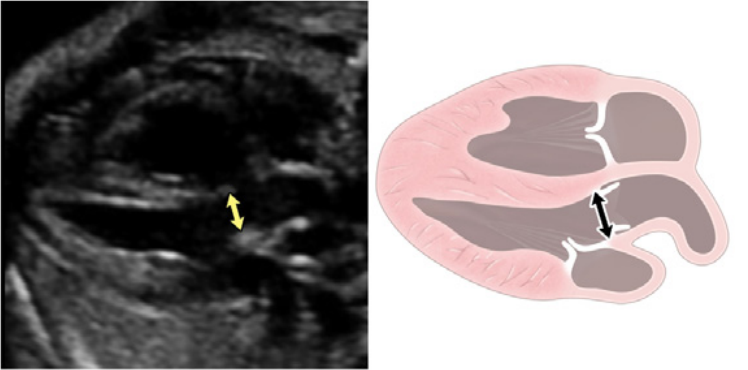
Зображення 5 Детальна візуалізація вихідного тракту лівого (left) та правого (right) шлуночків. Шлуночкова перегородка інтактна на ділянці від лівого шлуночка (LV) до висхідної аорти (Ao) у вихідному тракті лівого шлуночка, або “поздовжньому” зрізі, та відтік ПШ, легеневий клапан і біфуркація гілки легеневої артерії дистальніше головної легеневої артерії детально візуалізуються на цьому зрізі. Аортальний та легеневий клапани видно у закритому положенні як тонкі, недиспластичні структури.
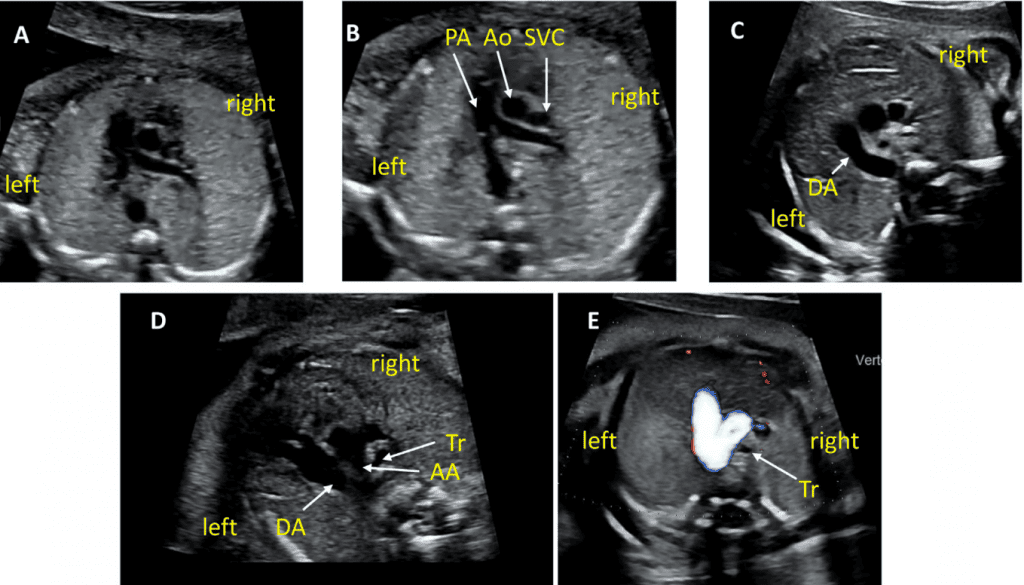
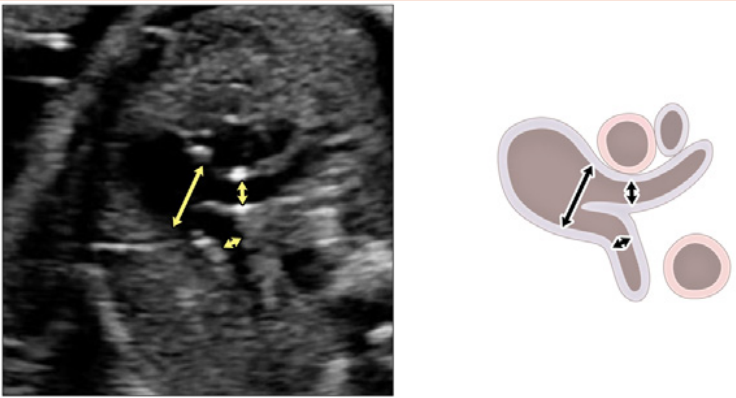
Зображення 6 Трьохсудинний зріз і 3СТ. Дуже незначний рух датчика при візуалізації верхнього середостіння в аксіальній площині може створити ці зрізи. (А) – (С) є прийнятними варіантами 3СЗ, причому (А) демонструє більшу частину вихідного тракту ПШ (ВТПШ) і легеневого клапана, (В) демонструє головну легеневу артерію і гілки легеневих артерій, а (С) візуалізує дугу протоки і вже не в площині, яка показує гілки легеневих артерій. (D) і (E) – трохи більш краніальні і трохи косі, щоб показати дуги протоки і аорти та їх нормальне відношення до трахеї. Коли умови візуалізації менш оптимальні або на ранніх термінах вагітності, додавання кольорового або енергетичного доплера може полегшити візуалізацію 3СТ зрізу (E). AA – дуга аорти; Ao – аорта; DA – дуга протоки; PA – легенева артерія; Tr – трахея.
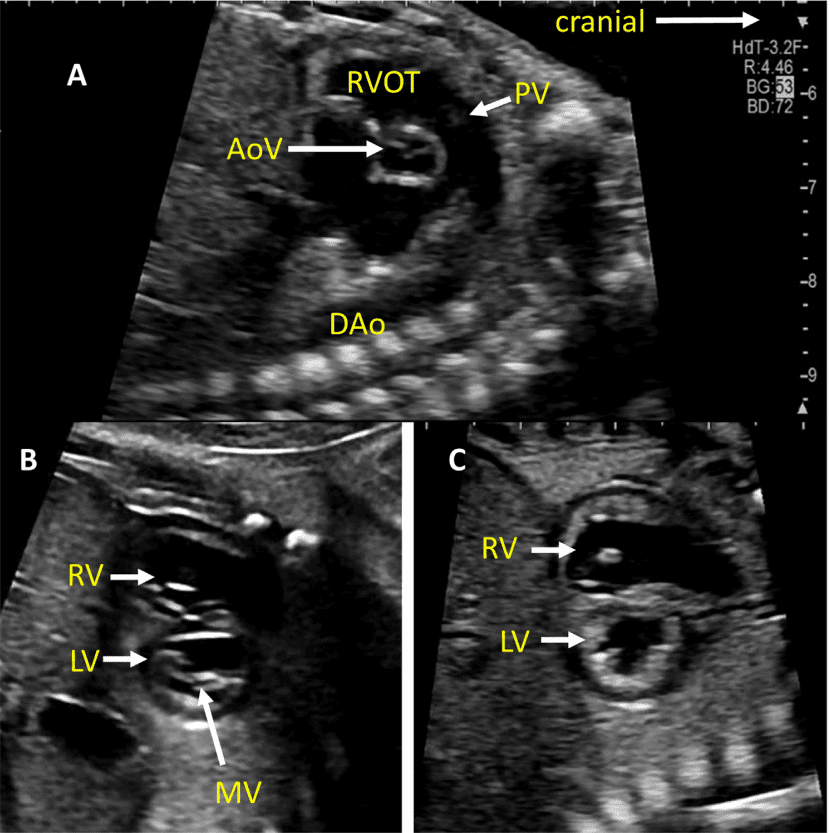
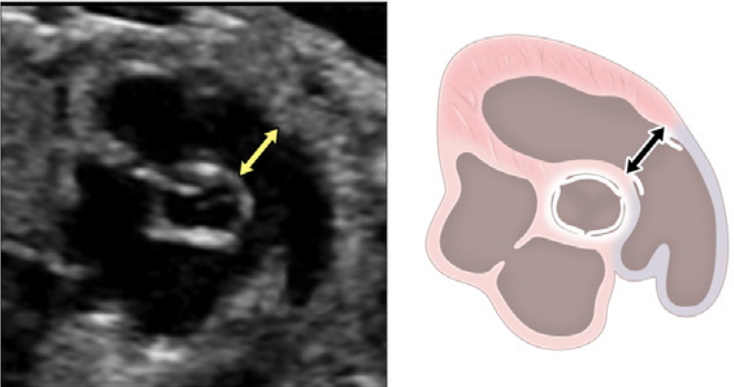
Зображення 7 Короткоосьові зрізи серця плода. (А) показує високу коротку вісь біля основи, показуючи аортальний клапан (AoV) і легеневий клапан (PV), орієнтовані ортогонально один до одного, TV в нормальному положенні, IVC, що входить в праве передсердя, і ліве передсердя, розташоване більш позаду. (B) і (C) отримані шляхом невеликого зсуву до верхівки серця. На зображенні (В) чітко видно мітральний клапан (MV) з двома правильно розташованими папілярними м’язами і нормальною передньою стулкою. На (С) добре видно тіла обох шлуночків і можна виміряти стінки шлуночків та міжшлуночкову перегородку. Візуалізація на цьому рівні дозволяє оцінити функцію та розрахувати фракційне вкорочення LV.
Зображення 8 Сагітальне (А, С) та парасагітальне (В) зображення бікавального зрізу, а також дуги аорти та протоки легеневої артерії. Зверніть увагу на сплощену дугу, характерну для артеріальної протоки (С), та вищу дугу аорти (В) з видимими судинами голови та верхніх кінцівок. DAo – низхідна аорта; RA – праве передсердя; RVOT – вихідний тракт правого шлуночка.
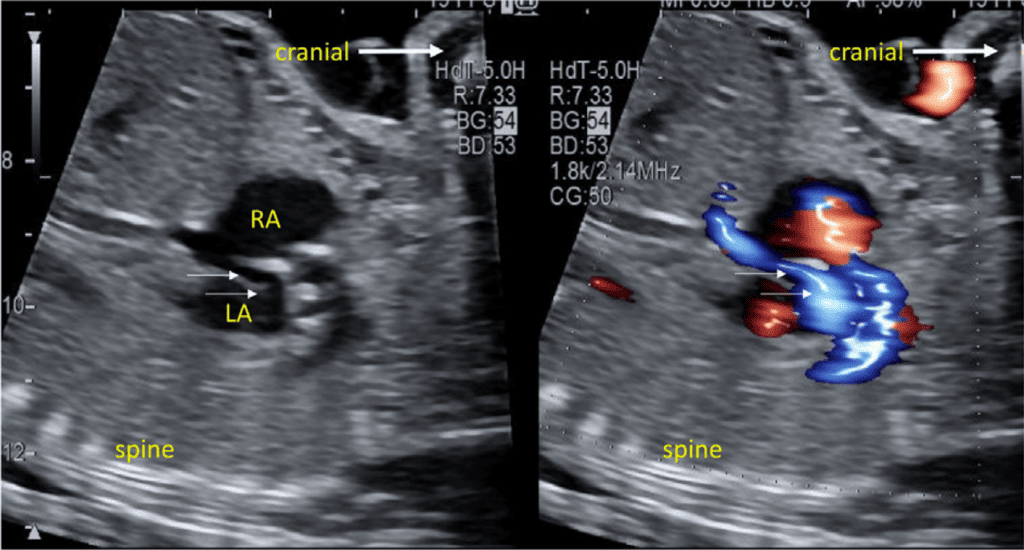
Зображення 9 Сагітальний кавальний зріз у 2D і з кольоровою доплерографією показує рух передсердного потоку справа наліво (синій) через овальний отвір (стрілки). LA – ліве передсердя; RA – праве передсердя.
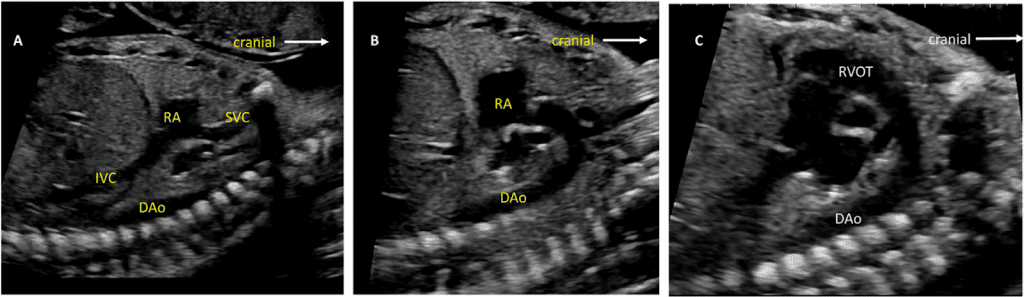
- Абдомінальне положення: При визначенні абдомінального положення плода необхідно звернути особливу увагу на положення плода та орієнтацію датчика (виїмка ліворуч або виїмка праворуч), а також орієнтацію дисплея. Поперечний вид верхньої частини живота плода (Зображення 2, внизу праворуч), на якому видно шлунок, печінку, низхідну аорту та системні венозні структури, оцінюють для визначення положення плода (як правило, з міткою). На цьому зображенні зазвичай видно лівий шлунок і праву частку печінки та жовчний міхур. Коли площина сканування переміщується головою до грудної клітки і створюється чотирикамерний зріз, можна візуалізувати печінкові вени та їхні з’єднання.
- Чотирикамерний зріз: Площина інсоляції, що знаходиться безпосередньо біля діафрагми плода, дозволяє побачити “чотирикамерний” зріз серця, включаючи передсердя та шлуночки (Зображення 2, праворуч посередині, та Зображення 4). Окрім положення серця та розмірів передсердь і шлуночків, можна розрізнити анатомію передсердно-шлуночкової перегородки, морфологію атріовентрикулярного (АВ) клапана та легеневі венозні зв’язки. Кольоровий доплер слід використовувати для оцінки регургітації АВ-клапана, напрямку потоку в овальному отворі, цілісності міжшлуночкової перегородки та легеневих венозних з’єднань.
iii. Вихідний тракт ЛШ: цей вид виконується шляхом переміщення площини інсоляції злегка краніально від чотирикамерного зрізу (Зображення 2, праворуч вгорі, та Зображення 5). У нормальному серці можна візуалізувати субаортальну ділянку, аортальний клапан, надклапанну ділянку та висхідну аорту. Для оцінки наявності регургітації аортального клапана або обструкції відтоку слід використовувати кольорову доплерографію.
- Вихідний тракт ПШ: Коли розгортка продовжується краніально від вихідного тракту ЛШ, в поле зору потрапляє вихідний тракт ПШ. У нормальному серці цей вид демонструє субпульмональну ділянку, легеневий клапан і проксимальну головну легеневу артерію, а також може включати біфуркацію легеневої артерії (Зображення 2 і 6А). За допомогою кольорової та PW доплерографії можна виявити стеноз легеневого клапана або регургітацію.
- 3СЗ: Відходячи від вихідного тракту ПШ, отримують 3СЗ (Зображення 2, зліва внизу і посередині, та Зображення 6А-С). У цій площині в нормальному серці зліва направо видно головну легеневу артерію, висхідну аорту в поперечному перерізі та верхню порожнисту вену (ВПВ) в поперечному перерізі. Одна або обидві легеневі артерії також можуть бути включені. Слід звернути увагу на аномалії кількості, розміру, вирівнювання та розташування судин.
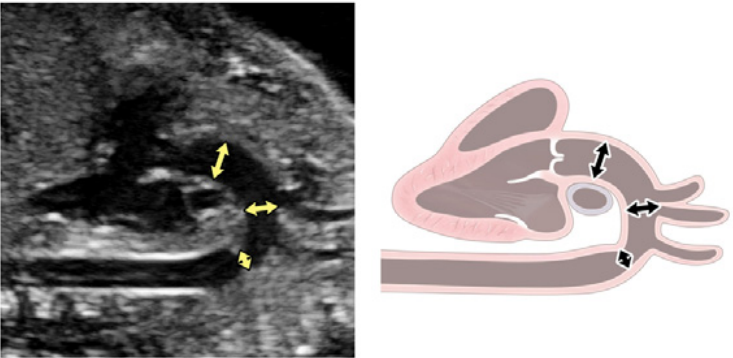
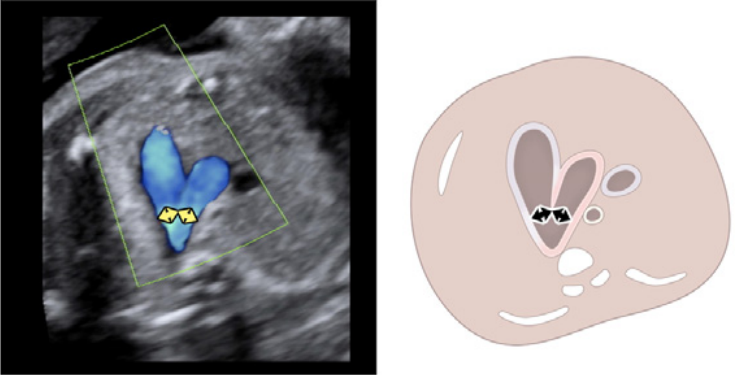
- 3СТ: На основі 3СЗ отримують 3СТ. У нормальному серці дуги аорти і протоки можна побачити у вигляді довгої осі поперечних сегментів, які розташовані зліва від трахеї і сходяться, утворюючи проксимальний низхідний відділ грудної аорти (Зображення 2, верхня ліва панель, і Зображення 6, нижня панель). Для демонстрації прохідності та напрямку потоку в обох дугах слід використовувати кольорову доплерографію.
vii. Бікавальний вид: Бікавальне зображення отримують при сагітальній візуалізації грудної клітки та живота плода (Зображення 3, панель 1, та Зображення 8А). Цей вид дозволяє підтвердити, чи нижня порожниста вена (НПВ) інтактна, а не перервана, і чи ВПВ знаходиться на тому ж боці, що й НПВ. Цей вид також використовується для оцінки анатомії міжпередсердної перегородки, прохідності та напрямку потоку через овальний отвір за допомогою кольорової доплерографії (Зображення 9).
viii. Поздовжній зріз дуги аорти: Парасагітальна візуалізація грудної клітки плода (Зображення 3, панель 3 та Зображення 8B) необхідна для повної візуалізації дуги аорти. Дугу слід оцінювати для визначення безперервності між висхідною та низхідною аортою та гіпоплазії окремих сегментів (висхідного, поперечного, перешийка). Для оцінки кровотоку слід використовувати кольорову доплерографію. Нормальний потік повинен бути антеградним, у напрямку до низхідної аорти, з мінімальним прямим потоком під час діастоли.
- Поздовжній зріз дуги протоки: Дугу протоки зазвичай отримують при прямому сагітальному зрізі грудної клітки плода, переміщуючи площину інсоляції трохи лівіше середньої лінії (Зображення 3, панель 2, та Зображення 8C). Слід оцінити артеріальну протоку на предмет її звуження як в аорті, так і в головній легеневій артерії, визначаючи швидкість кровотоку в систолу та діастолу за допомогою кольорової та/або спектральної доплерографії. Також слід зазначити напрямок потоку.
- Короткоосьові зрізи: Зображення площини серця по короткій осі корисне для оцінки міжшлуночкової перегородки, серцевої функції, анатомії АВ-клапанів та шлуночково-артеріальних взаємовідносин. Високий короткоосьовий зріз в основі серця (Зображення 3, панель 4 і Зображення 7A) демонструє аортальний клапан, оточений вихідним трактом ПШ і легеневою артерією, що огинає його спереду. Зазвичай добре видно біфуркацію легеневої артерії та тристулковий клапан (ТК), а також перетинчасту та вихідну шлуночкові перегородки. Регургітація ТК та цілісність міжшлуночкової перегородки також можна оцінити за допомогою кольорової доплерографії.
Низький короткоосьовий зріз у напрямку до верхівки шлуночка (Зображення 3, панелі 5 і 6, а також Зображення 7B і C) використовується для оцінки функції шлуночків і виявлення м’язових дефектів міжшлуночкової перегородки (ДМШП) із застосуванням кольорового доплеру. При невеликому нахилі плану сканування до основи серця можна оцінити морфологію АВ-клапанів (Зображення 7B).
F. Біометрія серця та дані вимірювань
Серцеві структури, які слід вимірювати при всіх дослідженнях плода, включають кільця аортального та легеневого клапанів у систолу, а також мітральне та ТК кільця в діастолу (Таблиця 4). Частота та ритм серцевих скорочень плода повинні бути задокументовані для всіх досліджень. Додаткові вимірювання серця та судин слід проводити при специфічних структурних вадах (Таблиця 4).
Як правило, індексація вимірювань передбачає перетворення в Z-оцінку, або кількість СВ від середнього значення, яке представляє спостережуване значення.35 Опубліковано кілька рівнянь Z-оцінки для вимірювань з поправкою на гестаційний вік, хоча існують альтернативні формули, що використовують біпарієтальний діаметр і довжину стегнової кістки 36(Таблиця 5).
G. Доплерографія
Доплерівське дослідження є невід’ємним компонентом повного ехокардіографічного обстеження плода. Детальна оцінка серцевих структур, яка дозволить виявити основну серцеву патологію, повинна бути першочерговим завданням цього дослідження. Додаткове використання доплерографії надає додаткову інформацію щодо нормального та аномального кровотоку, а також серцевої функції, ритму та провідності, яка не може бути отримана лише за допомогою зображення у відтінках сірого.
Кольорова та енергетична доплерографія. Цінність кольорової доплерографії в оцінці нормальної та аномальної анатомії серця плода та кровотоку визнається вже більше трьох десятиліть.42 Використання цього методу візуалізації починається з визначення межі Найквіста для демонстрації швидкості кровотоку, що становить інтерес, та виключення стенозу клапанів і аномального кровотоку. Під час дослідження необхідно також відрегулювати посилення та стійкість кольору, щоб колір заповнював камеру або кровоносну судину, не затуляючи морфологію тканин у градаціях сірого. Модальність енергетичного доплера аналізує амплітуду доплерівських сигналів замість частотних зсувів 43; інші модальності, такі як спрямований енергетичний доплер, поєднують амплітуду і частотні зсуви, що дозволяє двонаправлену візуалізацію потоку.44 Використання енергетичного доплера як доповнення до кольорового доплера може додатково окреслити і визначити менші судинні структури і низькі швидкості кровотоку, наприклад, в легеневих і системних венах.
Таблиця 4 Рекомендовані серцеві біометричні показники
СВОДШ, синдром вродженої обструкції верхніх дихальних шляхів; ВЛДШ, вроджена вада легеневих дихальних шляхів; ЧСС, частота серцевих скорочень; ККТ, крижово-куприкова тератома; ФФТС, фето-фетальний трансфузійний синдром; ІШП, інтеграл лінійної швидкості потоку. Вимірювання для всіх досліджень плода, для порівняння з опублікованими або внутрішніми нормальними значеннями, включають частоту і ритм серцевих скорочень, аортальний і легеневий клапани в систолу, а також мітральне і ТК кільця в діастолу. Додаткові вимірювання, особливо якщо відзначаються відхилення від норми, включають, але не обмежуються тими, що перераховані в таблиці.
Таблиця 5 Опубліковані рівняння Z-оцінки
| Автор | Рік | Діапазон ГВ | n | Тип | Моделі | Незалежна змінна | Переваги | Недоліки |
| Schneider та співавт. | 2005 | 15-39 | 130 | Z-оцінка | Лінійна регресія | Довжина стегна, біпарієтальний діаметр, місячний вік | Досліджено 17 показників | Невеликий обсяг вибірки |
| Lee та співавт. | 2010 | 20-40 | 2,735 | Z-оцінка | Лінійна регресія | Довжина стегна, біпарієтальний діаметр, місячний вік | Опубліковано формулу СВ, великий обсяг вибірки | Досліджено лише аортальний і легеневий клапани, розміри короткої осі шлуночків та окружність серця |
| Colan | 2016 | 16-40 | 104 | Z-оцінка | Лінійна регресія | ГВ | В багатьох системах ультразвуку досліджено 17 показників | Методи не опубліковані, невеликий обсяг вибірки |
| Krishnan та співавт. | 2016 | 12-39 | 296-414 | Z-оцінка | Поліноміальна регресія | Довжина стегна, біпарієтальний діаметр, ГВ | Досліджено 13 показників | Не ефективно при екстремальних значеннях ГВ та вимірювання |
| Gu та співавт. | 2018 | 17-39 | 6,343 | q рахунок | Квантильна регресія | ГВ | Краще враховують нелінійні зміни з часом, великий обсяг вибірки | Клінікам менше відомо, важко швидко розрахувати |
| Vigneswaran та співавт. | 2018 | 13-36 | 7,945 | Z-оцінка | Поліноміальна регресія | ГВ | Великий розмір вибірки | Повідомлялося лише про аортальний та легеневий клапани, артеріальну протоку, дистальну поперечну дугу |
ГВ, гестаційний вік на основі дати першого триместру.
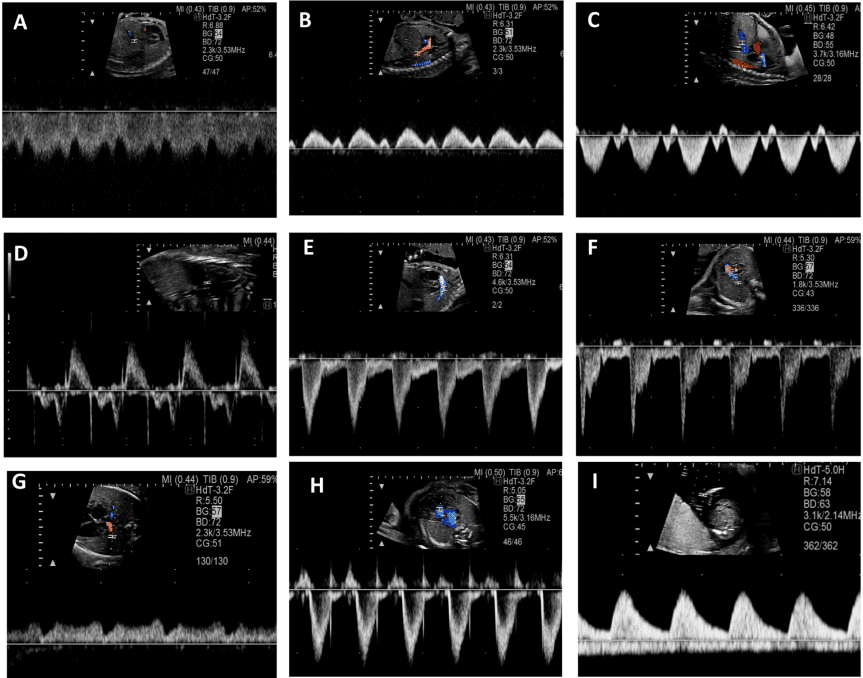
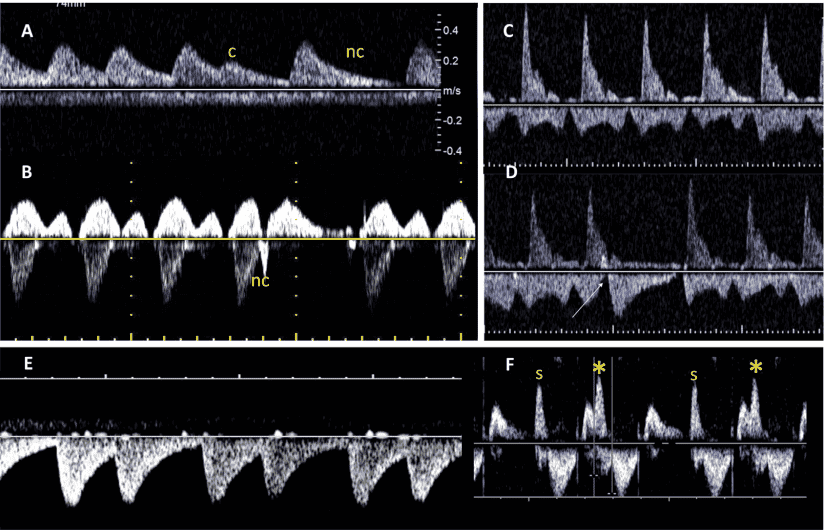
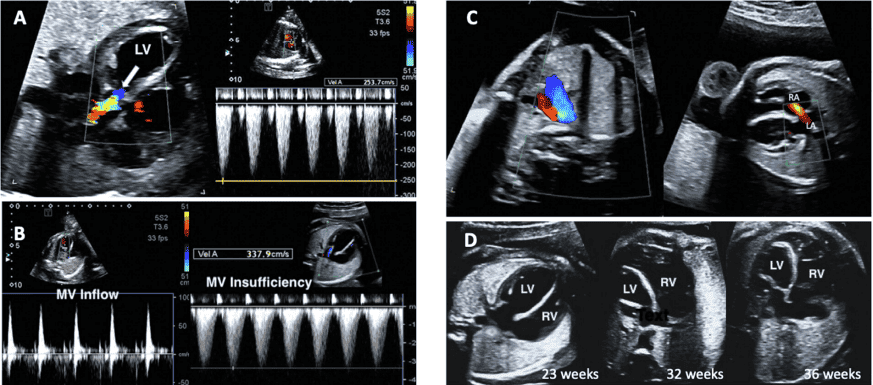
PW доплерографія. PW доплер надає додаткові дані щодо профілю та напрямку кровотоку. Точна оцінка швидкості вимагає, щоб лінія дослідження була коаксіальною до потоку (або під кутом <20). Мінімізація воріт об’єму зразка зменшує ризик небажаного одночасного дослідження декількох ділянок серця плода. Опубліковані нормальні значення для притоків і відтоків шлуночків, а також для овального отвору, легеневих вен і потоків НПВ.45-49 PW доплер слід використовувати рутинно для оцінки, як мінімум, структури потоку у притоках, відтоках шлуночків, дугах, легеневих венах, боталовій протоці та пупкових судинах (Таблиця 6, Зображення 10). Оцінка швидкості кровотоку в пупковій артерії (вільно плаваючої петлі пуповини) та середній мозковій артерії, включаючи вимірювання пульсації та/або індексів резистентності, може надати додаткову інформацію щодо стану плаценти та змін церебрального опору, що є поширеним явищем при деяких ВВС.50
CW доплерівське УЗД. CW доплер не потрібен для візуалізації нормального серця плода, але може знадобитися для оцінки серцевих і позасерцевих патологій, які сприяють аномальному кровотоку і тиску в шлуночках. Як і у випадку доплерографії в прямій проекції, вирівнювання доплерівського курсору коаксіально до потоку є критично важливим для точної оцінки швидкості і розрахунку градієнта. При оцінці стенозу клапана розрахунок CW доплерівського градієнта дає уявлення про ступінь тяжкості обструкції. Додаткові дані можна отримати, оцінивши тиск у правому або ЛШ за допомогою дослідження відповідного струменя регургітанта АВ-клапана.51
H. Повна кардіологічна оцінка плода з використанням сегментарного аналізу
Сегментарний аналіз серця плода пропонується в Таблиці 7, що включає всі необхідні ракурси та доплерівську інформацію. Іноді не всі стандартні площини візуалізації можуть бути отримані, хоча всі серцево-судинні структури повинні бути адекватно візуалізовані певним чином, щоб дослідження вважалося завершеним, за винятком випадків, коли структура дійсно відсутня. Порядок отримання зображень може бути різним.
Таблиця 6 Рекомендовані компоненти PW доплерографії при повному ехокардіографічному обстеженні плода (обов’язкові та факультативні)
| Компонент | Обов’язковий/Необов’язковий |
| Пупкова вена | Обов’язково* |
| Венозна протока | Обов’язково |
| Вени печінки | Необов’язково |
| ВПВ та НПВ | Необов’язково |
| Легеневі вени (щонайменше по одній правій та лівій) | Обов’язково |
| ТК і мітральний (припливний) клапан | Обов’язково |
| Аортальний та легеневий (півмісяцевий, відпливний) клапани | Обов’язково |
| Великі артерії та дуги (поперечна аорта, перешийок) | Необов’язково |
| Артеріальна протока (дистальний відділ, біля входу в аорту) | Обов’язково* |
| Гілки легеневих артерій | Необов’язково |
| Пупкова артерія | Обов’язково* |
| Середня мозкова артерія | Необов’язково |
| Приплив-витік ЛШ (ЧІВР) | Необов’язково |
| Тканинна доплерографія трикуспідального/мітрального латерального кільця | Необов’язково |
ЧІВР, час ізоволюмічної релаксації.
*Це є консенсусною зміною порівняно з попередніми документами.
Зображення 10 PW доплерографія. Цей метод слід використовувати рутинно для оцінки, як мінімум, структури потоку в шлуночкових притоках, відтоках, дугах, легеневих і системних венах, венозній протоці та пуповинних судинах. Репрезентативні форми хвиль включають. (A) Венозна протока, (B) НПВ, (C) печінкова вена, (D) приплив-витік ЛШ, (E) артеріальна протока, (F) гілка легеневої артерії, (G) легенева вена, (H) легеневий клапан та (I) пупкова артерія і вена.
Таблиця 7 Сегментарний аналіз серця плода з рекомендованими та необов’язковими компонентами ехокардіографії плода
| Для демонстрації/встановлення | Рекомендований зріз | Додаткові зрізи |
|
Положення плода в матці та анатомічний огляд Номер і положення плода в матці Положення живота та абдомінальний ситус Серцева позиція Пуповина |
Однократне осьове сканування від живота до голови (або від голови до живота) Пуповина по короткій осі або сечовий міхур плода з кольоровою доплерографією для демонстрації кількості пуповинних судин PW ПА, ПВ, венозна протока +- печінкова вена, +- НПВ |
Метод Кордеса для визначення односторонності 52 |
| Системні венозні з’єднання | 3СЗ сагітальний “бікавальний” зріз | Осьова розгортка живота від введення пуповини до діафрагми, 2D та кольорова |
| Легеневі венозні з’єднання | Чотирикамерний зріз: 2D. Чотирикамерний з кольором (низький Nyquist), PW доплер (дві вени, одна ліва і одна права) | Додаткові легеневі вени з правої та лівої легені |
|
Анатомія передсердь та АВ-взаємозв’язок Морфологія та функція АВ-клапана Морфологія та функція шлуночків |
Чотирикамерний зріз. 2D, кольорова доплерографія АВ-клапанів та міжпередсердно-шлуночкової перегородки, PW трикуспідального та мітрального притоку, притоку-витоку ЛШ, латерального трикуспідального кільця ТКД. Коротка вісь шлуночків: 2D, колір |
Ортогональна площина, чотирикамерна 2D, кольорова міжпередсердна та міжшлуночкова перегородки, PW потік овального отвору Вимірювання трикуспідального та мітрального клапанів в діастолу |
| Шлуночково-артеріальні взаємовідносини, аортальний та легеневий клапани |
Подовжня вісь ЛШ, 2D колір Розгортка краніально до ВТПШ, 2D та колір Висока база короткої осі 2D, колір, PW головної легеневої артерії Апікальна чотирикамерна розгортка, PW ВТЛШ |
Виміряйте аортальний та легеневий клапани в систолу |
| Дуга аорти |
Сагітальне зображення дуги, 2D та колірне, PW. 3СЗ, почати з біфуркації легеневої артерії і розгорнути до 3СТ з 2D і кольором |
Виміряйте розмір протоки та перешийка аорти на 2D в сагітальній проекції або 3СТ |
| Дуга протоки | Сагітальний зріз дуги, 2D та колір, PW 3СЗ, почніть з біфуркації легеневої артерії та розгорніть до 3СТ з 2D та кольором. | Короткоосьова основа, поверніть, щоб показати протоку, 2D і колір |
| Гілки легеневих артерій | 3СЗ, показати біфуркаційний зріз | Короткоосьова база, 2D. Чотирикамерний, кутовий краніальний, PW вимірює діаметри гілок, коли кожна гілка ЛА входить в легеню (гілум) |
ВТЛШ, вихідний тракт ЛШ; ЛА, легенева артерія; ВТПШ, вихідний тракт ПШ; ПА, пупкова артерія; ПВ, пупкова вена.
I. Альтернативні методи УЗД
Для візуалізації серцево-судинної структури та фізіології плода можуть бути використані інші ультразвукові технології. Просторово-часова кореляція зображень фіксує статичний або динамічний тривимірний об’ємний набір даних за допомогою спеціально розробленого ультразвукового датчика та програмного забезпечення для аналізу.53 Тривимірна ехокардіографічна візуалізація в реальному часі за допомогою цього методу може бути використана для покращення виявлення анатомічних дефектів та кількісної оцінки гемодинаміки, наприклад, функції шлуночків та серцевого викиду,54 хоча просторово-часова кореляція зображень не була валідована для клінічного застосування. ТКД і візуалізація деформації міокарда були широко досліджені в постнатальній популяції і можуть забезпечити більш ретельну оцінку механіки міокарда плода.55 Для виявлення субклінічної серцевої дисфункції може бути використаний онлайн або офлайн аналіз серцевої функції з 2D деформацією (спекл-трекінг).56 Те, як найкраще застосовувати ці методи під час вагітності, потребує подальшого дослідження.
J. Ехокардіографія плода на ранніх термінах вагітності (<15 тижнів)
Вперше про діагностику ВВС в терміні <15 тижнів було повідомлено на початку 1990-х років, невдовзі після впровадження ендовагінальних датчиків в акушерську практику.57 Рання діагностика має багато переваг, включаючи більше часу для прийняття рішення та виключення супутніх патологій, можливість більш раннього переривання вагітності та розуміння розвитку ВВС з більш ранніх термінів гестації.58 На сьогоднішній день в терміні <15 тижнів діагностується широкий спектр структурних та міокардіальних хвороб і аритмій. Чутливість та специфічність ранньої ехокардіографії плода становить 78,6% та 98,9% відповідно,57 а в досвідчених руках чутливість 89% та специфічність 100% є можливими для базової кардіологічної діагностики.59,60
Таблиця 8 містить огляд підходу до ранньої ехокардіографії плода, включаючи його переваги та обмеження, а також важливі міркування в порівнянні з ехокардіографією плода в другому та третьому триместрах.
Таблиця 8 Ехокардіографія плода на ранніх термінах (<15 тижнів): рекомендації, унікальні елементи, переваги та обмеження
| Елемент | Рекомендації та завдання | Сильні сторони, обмеження, примітки |
| Час |
>10 тижнів для ЕВ-візуалізації >12 тижнів для трансабдомінальної візуалізації (в ідеалі 13-15 тижнів) |
Залежить від часу направлення, рівня комфорту сонографа та доступності ЕВ-зображень |
| Показання | Найбільш вигідні індикації (див. Таблицю 1) |
Збільшення ППП: 3-3.5 мм (95-й перцентиль) 3% ризик, ≥3.5 мм (99-й перцентиль) 6% ризик, 6 мм 24% ризик, та >8.5 мм >60% ризик Голосистолічна ТР, ВП реверсія А-хвилі |
| Візуалізація | Дотримуйтесь принципу ALARA 61,62 |
ТІ та МІ на рівні ≤1,0 ТІм <10 тижнів та ТІк ≥10 тижнів Обмежене використання доплерівських режимів Вузький сектор та збільшення |
| Високочастотний датчик (> 8 МГц) | Малі серцеві структури | |
| Має бути якомога ближче до серця плода | При <12 тижнів <4 см від серця плода передбачається 63 | |
| ЕВ візуалізація | Може знадобитися лише до 12 тижнів 63 | |
| Очікування від кардіологічного обстеження 63 | Через 11 тижнів чотирикамерний ~100% |
Симетричні чотири камери Серцева вісь змінюється з 8-14 тижнів |
| В 11 тижнів >90% великих артерій та дуг | Очікуються симетричні великі артерії та дуги | |
| Використання кольорового відображення потоку, коли 2D обмежений | Допомагає підтвердити наявність і прохідність чотирьох камер, відтоків і дуг | |
| Оцінка легеневих та системних вен обмежена | Найскладніший аспект обстеження на ранніх термінах вагітності | |
| Визначення положення | Може бути легше виконати трансабдомінально, а не через ЕВ | |
| Патологія серця | Загальна чутливість та специфічність хороші | 78,6% та 98,9% відповідно 57 |
| Основна структурна хвороба серця, схожа за зовнішнім виглядом на пізні терміни вагітності |
Більшість можна виявити на 10-14 тижні Складно виявити тонкі дефекти, включаючи ураження клапанів через неоптимальну роздільну здатність |
|
| Основні обмеження пов’язані з роздільною здатністю (потенційно можуть бути подолані за допомогою технологічного прогресу) та термінами | Якщо неясно або підозріло, запропонуйте повернутися протягом 1-2 тижнів, враховуючи експоненціальний ріст серця на цій стадії | |
| Консультування та звітність | Інтегруюча роль генетичного скринінгу та тестування, обмеження обстеження | Потенціал для пропущених діагнозів та прогресуючих уражень |
| Додаткові міркування | Вищі показники переривання вагітності 64 | Деякі захворювання, особливо з асоційованою анеуплоїдією, можуть протікати важче, ніж на пізніх термінах вагітності, що в анамнезі призводить до втрати вагітності |
| Хоча і детальне, але вважається скринінговим обстеженням | Рекомендується переоцінка на 18-20 тижні |
ALARA – настільки низький, наскільки це можливо; ВП – венозна протока; ЕВ – ендовагінальний; МІ – механічний індекс; ППП – потилична прозорість плода; ТІ – тепловий індекс; ТІк – тепловий індекс для кісток; ТІм – тепловий індекс для м’яких тканин.
Ключові моменти
- Ехокардіографію плода необхідно проводити з використанням відповідного обладнання та з дотриманням принципу “настільки низького рівня, наскільки це можливо”.
- Необхідно дотримуватися існуючих рекомендацій щодо зберігання та документації.
- Слід використовувати двовимірну, спектральну доплерівську та кольорову доплерівську ехокардіографію, а налаштування візуалізації оптимізувати спеціально для дослідження серця плода.
- Слід використовувати стандартні види та площини візуалізації.
- Необхідно дотримуватись мінімальних стандартів для 2D, спектрального доплеру та кольорового доплеру статичних та динамічних зображень, включаючи позицію плода, структуру та функцію серця, а також біометрію серця.
- Ехокардіографія плода може бути виконана раніше 18 тижнів і повинна бути розглянута для пацієнток, які звернулися в кінці першого триместру з підозрою на серцеву аномалію, залежно від місцевих ресурсів та досвіду.
- Немає достатніх доказів, щоб рекомендувати проведення ехокардіографії плода на ранніх термінах (<16 тижнів) при вагітності з низьким ризиком, але було доведено, що вона є доцільною і може використовуватися при вагітності з високим ризиком або з відомими аномальними результатами скринінгових досліджень.
IV. КЕРІВНИЦТВО З ЕХОКАРДІОГРАФІЧНОЇ ОЦІНКИ АНАТОМІЧНИХ, ФІЗІОЛОГІЧНИХ ТА ФУНКЦІОНАЛЬНИХ ОСОБЛИВОСТЕЙ ПЛОДА ПРИ КОНКРЕТНОМУ ЗАХВОРЮВАННІ
A. Порушення ритму та інструменти для оцінки
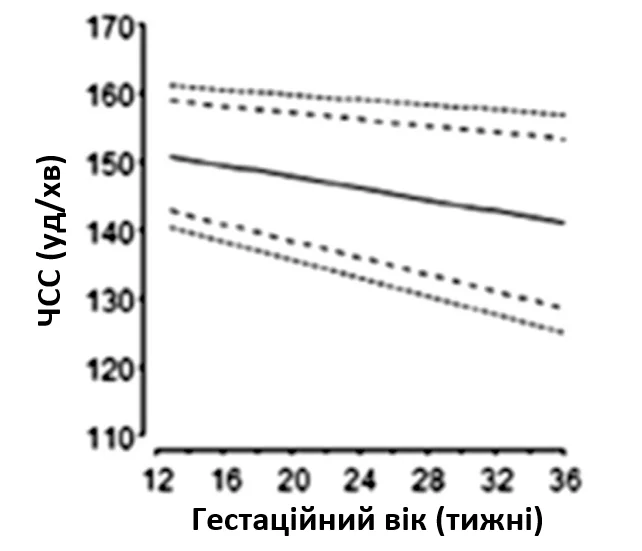
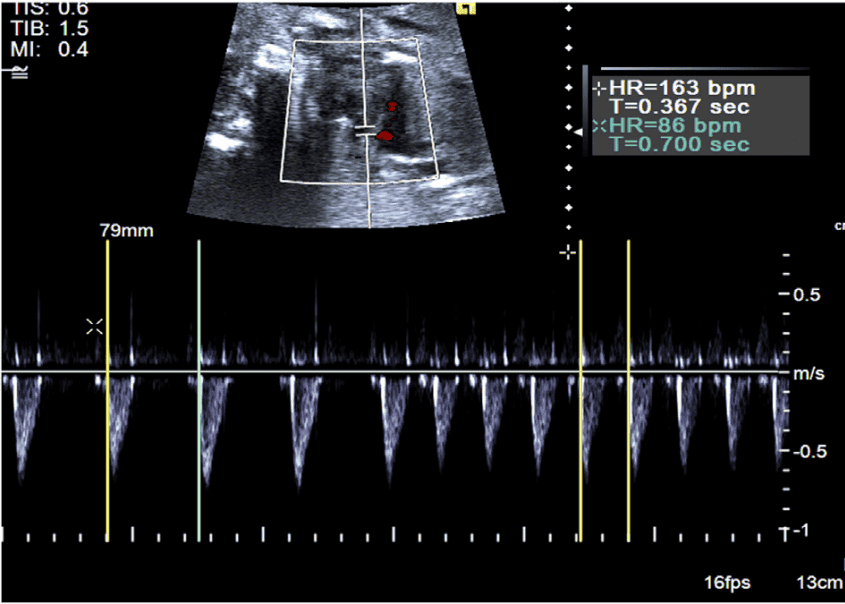
Для ехокардіографічної оцінки серцевого ритму плода використовують 2D, М-режим, PW-доплер та тканинний доплер (Зображення 11). Оцінка типу та механізму аритмії має важливе значення для планування лікування та прогнозування. Нормальна частота серцевих скорочень плода залежить від терміну вагітності, і були опубліковані нормальні референтні діапазони (Зображення 12).65,66 На будь-якому терміні вагітності стійка частота серцевих скорочень >160-180 уд/хв або <120 уд/хв є аномалією.
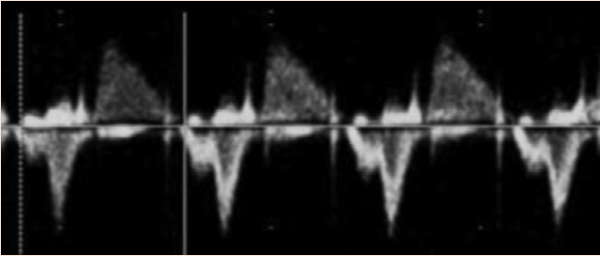
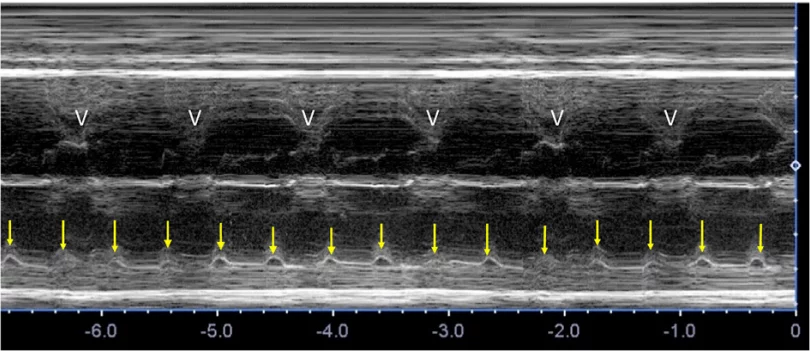
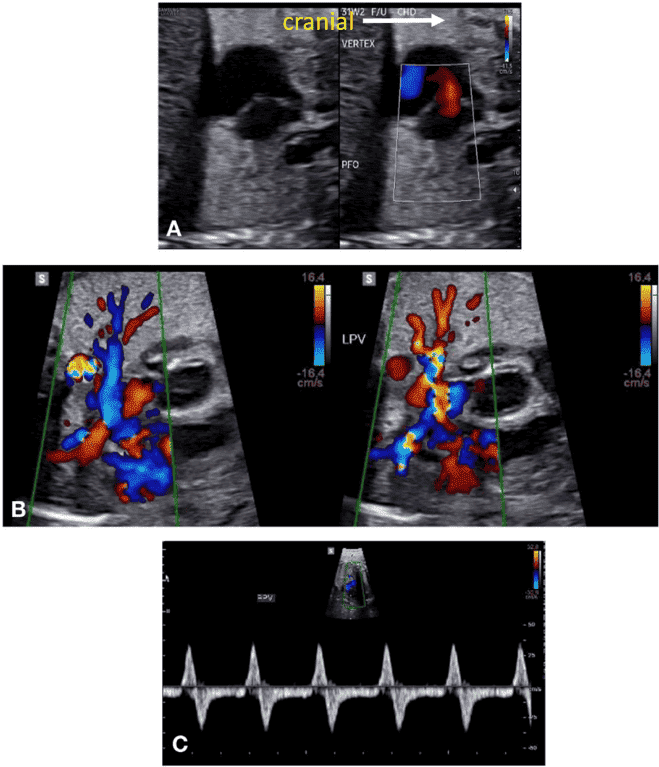
Зображення 11 Ультразвукові інструменти для оцінки частоти серцевих скорочень, ритму та АВ-провідності плода. (А) ВПВ-доплер висхідної аорти (Ао). (B) Доплерографія притоку-витоку ЛШ, отримана за допомогою широкодіапазонного датчика з одночасним скануванням мітрального притоку на передній стулці та аортального відтоку трохи нижче аортального клапана. (С) Одночасне дослідження легеневої артерії та легеневої вени. (D) Тканинна доплерографія латерального трикуспідального кільця. (E) Доплер венозної протоки. (F) М-режим з курсором, розміщеним через стінку передсердя та вільну стінку правого або лівого шлуночка. Частота та ритм серцевих скорочень плода є нормальними на всіх вищезазначених трасуваннях. a – скорочення передсердь; v – скорочення шлуночків.
Зображення 12 Частота серцевих скорочень плода (ЧСС), виміряна за допомогою ехокардіографії, відповідно до терміну вагітності. Позначено перший, п’ятий, 50-й, 95-й та 99-й процентилі. Адаптовано з дозволу Zidere та співавт. 65
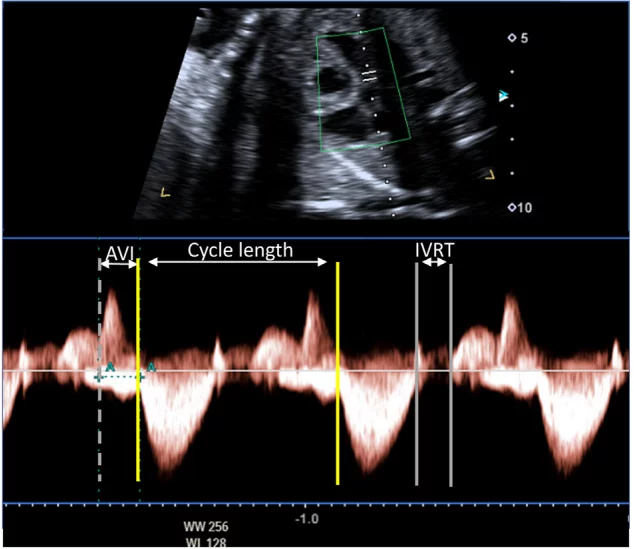
Ехокардіографія в М-режимі для оцінки ритму плода використовує переваги високої часової роздільної здатності для дослідження точного часу скорочення міокарда передсердь і шлуночків, які зазвичай оцінюються одночасно. Для визначення часу скорочення передсердь і шлуночків можна використовувати доплерівську ехокардіографію одночасного притоку мітрального клапана/відтоку аорти, легеневої вени/гілки легеневої артерії або ВПВ/аортального кровотоку. PW тканинний доплер може бути використаний для вимірювання швидкостей і часових інтервалів міокарда передсердь і шлуночків шляхом дослідження латерального мітрального або ТК кільця. Доплерівські методи оцінки ритму дозволяють кількісно оцінити частоту серцевих скорочень плода, взаємозв’язок між скороченням передсердь і шлуночків, а також оцінити інтервали часу проведення, такі як механічний інтервал PR (АВ-інтервал). У вагітних, які, як відомо, є носіями анти-Ro/La антитіл, вимірювання механічного інтервалу PR плода може бути виконано для оцінки порушень АВ-провідності, хоча ще немає чітких доказів ефективності рутинного спостереження для зниження частоти виникнення більш високих ступенів АВ-блокади.67 Вимірювання доплерівських ізоволюмічних часових інтервалів (Зображення 13) може допомогти в діагностиці вродженого синдрому подовженого інтервалу QT плода 68 або у розрізненні складних ритмів, таких як блокада передсердної миготливої аритмії та АВ-блокада 2:1.69.
Найпоширеніші аритмії та їх діагностична оцінка за допомогою ехокардіографії представлені в Таблиці 9 та на Зображеннях 14-17. Якщо результати ехокардіографії неоднозначні, для безпосередньої оцінки електричного сигналу серця плода можна використовувати магнітокардіографію та електрокардіографію плода, але на даний момент вони мають обмеження для широкого клінічного використання. Магнітокардіографія плода може точно охарактеризувати серцевий ритм плода, а також властивості провідності та реполяризації.70
Зображення 13 Доплерівське дослідження плода з підозрою на синдром подовженого інтервалу QT. Доплерівський курсор розміщений між притоком через мітральний клапан (вище базової лінії) та аортальним потоком (нижче базової лінії). Тривалість циклу становить 560 мсек (ЧСС 110 уд/хв). АВ-інтервал (AVI) в нормі і є АВ-конкордантність, за виключенням АВ-блокади. Час між закриттям аортального клапана і початком потоку через мітральний клапан (час ізоволюмічного розслаблення [IVRT]) становить 100 мсек. IVRT, виражений у відсотках від тривалості циклу, становить 17%, що значно перевищує нормальний діапазон для вагітності, що узгоджується з діагнозом синдрому подовженого інтервалу QT.
Таблиця 9 Рекомендації щодо оцінки порушень частоти та ритму серцевих скорочень плода
| Порушення | Діагноз | Оцінка | Примітки |
| Нерегулярні серцеві ритми з нормальною загальною частотою | Атріальні ектопічні скорочення (>95%) Вентрикулярні ектопічні скорочення набагато рідше (<5%) | Будь-який доступний інструмент: a-a та V-V інтервали часу продемонструють скидання передсердного ритму при ПСП (з “неповною компенсаторною паузою”), в той час як ПСШ не змінюють передсердний інтервал a-a | Подальший моніторинг частоти серцевих скорочень до вирішення проблеми |
| Тахікардія | Синусова тахікардія | М-режим або артеріальний/венозний доплер; довготривала ША тахікардія з регулярним ритмом, зазвичай <200 ударів/хв | |
| НШТ | М-режим або артеріальний/венозний доплер; співвідношення між скороченнями передсердь і шлуночків 1:1 (Зображення 14); найчастіше ортодромна реципрокна (шлях опосередкований), коротка ША тахікардія | Оцінка мітрального клапана/ аортального потоку не рекомендується через злиття моделей притоку, що не дозволяє виміряти час скорочення передсердь | |
| Ектопічна передсердна тахікардія або ПШРТ | М-режим або артеріальна/венозна доплерографія; тахікардія зі співвідношенням А/В 1:1, але типу “довгий ША”, може мати варіабельний інтервал V-V | Ехокардіографічне визначення механізму є важливим для вибору лікування аритмії | |
| Тріпотіння передсердь | М-режим, 2D, доплер; надзвичайно швидка частота передсердь з характерним “пилкоподібним” патерном на М-режимі (Зображення 14); частота передсердь > 400 уд/хв, асоціюється з різним ступенем АВ-блокади (найчастіше 2:1, 3:1). | Передсердя часто розширені з асоційованою АВ-регургітацією та порушенням функції шлуночків | |
| Шлуночкова тахікардія | М-режим або артеріальний/венозний доплер; тахікардія з дисоціацією А/В, регулярна частота передсердь з (зазвичай) уповільненою частотою шлуночків, можуть бути варіабельні інтервали V-V | ||
| Брадикардія | Синусова брадикардія | Будь-яка модальність, що демонструє одночасне скорочення передсердь і шлуночків; більшість синусових брадикардій мають ЧСС >90-100 уд/хв; ехокардіографічні дані у плода з синусовою брадикардією, зумовленою синдромом подовженого інтервалу QT, наведені на Зображенні 13, з використанням доплерографії для вимірювання ЧІВР в цьому контексті | ТКД на латеральному тристулковому кільці може бути корисною |
| Повна блокада серця | Будь-яка модальність, що демонструє одночасне скорочення передсердь і шлуночків; при повній блокаді серця частота скорочень передсердь і шлуночків повністю дисоційована (Зображення 15), а частота шлуночків, як правило, знаходиться в діапазоні 50-80 уд/хв. | ||
| Множинні блоковані ектопічні скорочення передсердь, бігемінія передсердь та блокована передсердна бігемінія на фоні АВ-блокади другого або третього ступеня | Множинні блоковані передсердні ектопічні скорочення можуть призвести до субнормальної або нерегулярної частоти шлуночків, яку необхідно відрізняти від АВ-блокади другого або третього ступеня; ехокардіографічний підхід до ектопічних скорочень показаний на Зображеннях 17 і 18 і використовує будь-яку доступну модальність | Підтвердити за допомогою УЗД, оскільки зовнішній моніторинг плода не може відрізнити брадикардію від дистресу плода (М-режим може бути кращим за доплерівські методи, якщо синусектопічні інтервали довгі). |
ЧІВР – час ізоволюмічного розслаблення; ПСП – передчасне скорочення передсердь; ПШРТ – постійна шлуночкова реципрокна тахікардія; ПСШ – передчасне скорочення шлуночків; НШТ – надшлуночкова тахікардія; ША – шлуночково-артеріальна.
Зображення 14 Діагностика тахіаритмії плода за допомогою М-режиму. (А) Тріпотіння передсердь. Скорочення передсердь демонструють типовий “пилкоподібний” патерн тріпотіння передсердь (відкрита стрілка [^]). Поперемінні хвилі тріпотіння проводяться до шлуночків (V), створюючи блок 2:1. Частота передсердь становила 474 уд/хв. (В) Реципрокна (шляхово-опосередкована) надшлуночкова тахікардія. Частота передсердних (a) і шлуночкових (v) скорочень однакова (240 уд/хв), ритм регулярний.
Зображення 15 М-режим трасування повної серцевої блокади. Частота скорочень передсердь (стрілки) є нормальною при 120 уд/хв. Частота скорочень шлуночків (V) значно повільніша – 55 уд/хв, без взаємозв’язку між скороченнями передсердь і шлуночків (АВ-дисоціація). У цьому прикладі структура серця була нормальною, а серцева блокада була викликана материнськими анти-Ro антитілами.
Зображення 16 Нерегулярний ритм через проведені та непроведені передчасні скорочення передсердь (ПСП). (А) Доплерографія пупкової артерії/вени, що демонструє проведені (c) та непроведені (nc) ПСП у одного і того ж пацієнта. Якщо АВ-провідність є нормальною, передчасна передсердна подія супроводжується пов’язаною з нею передчасною шлуночковою подією. Якщо ж ПСП є достатньо передчасним, щоб не провести через рефрактерний АВ-вузол, активації шлуночків не відбувається. (В) Доплерівські записи з ВПВ та аорти у плода з ПСП. Трасування показує нормальний венозний потік вище вихідного рівня з одним непроведеним передчасним скороченням передсердь (nc), що призводить до тимчасової реверсії потоку в кінці систоли; потік реверсує через скорочення передсердь на фоні закритої ТК. Виникає тривала пауза через відсутність провідності, оскільки імпульс блокується у АВ-вузлі. (C, D) Легеневий венозний приплив – відтік легеневої артерії. Потік легеневої артерії вище базової лінії та венозний потік нижче базової лінії, відібрані одночасно через їх близькість у грудній клітці, демонструють нормальний ритм (C) та єдиний непровідний ПСП, позначений стрілкою (D). (E, F) Часті ПСП. Доплерографія пупкової артерії (E) демонструє нерегулярний ритм із середньою частотою близько 120 уд/хв. За допомогою доплерографії притоку-витоку ЛШ чітко видно, що причиною нерегулярності є часті передчасні скорочення передсердь (зірочка), які чергуються з нормальними синусовими скороченнями за типом бігемінії.
Зображення 17 Частота серцевих скорочень плода, що чергується з частими ПСП за схемою блокованої передсердної бігемінії та нормального синусового ритму, що не слід плутати з АВ-блокадою другого ступеню. Через неповну компенсаторну паузу після екстрасистолічного скорочення передсердь попередній інтервал V-V вкорочений, тому видима частота шлуночків (86 уд/хв) становить більше половини частоти, яка спостерігається в наступному періоді синусового ритму (163 уд/хв), що відрізняє повільніший ритм від інтермітуючої АВ-блокади другого ступеня і занадто швидкий для типової АВ-блокади третього ступеня.
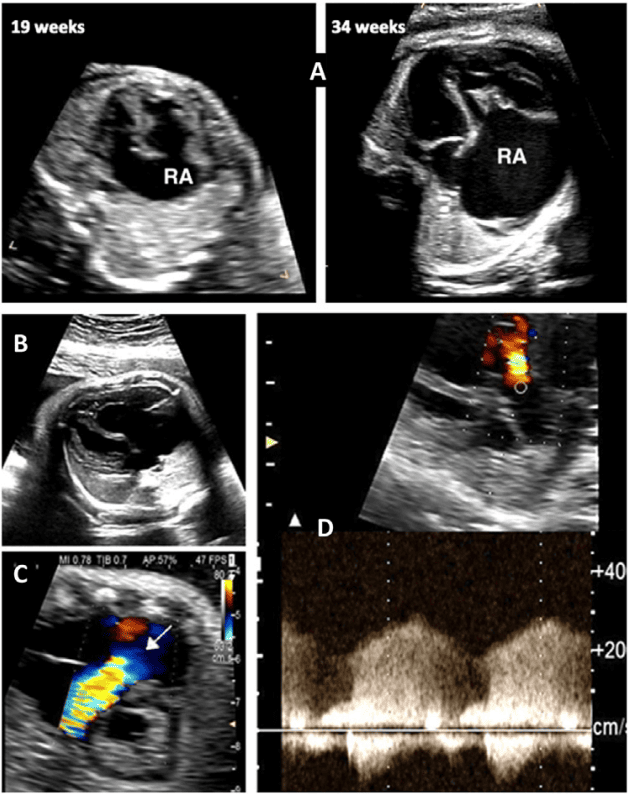
Оцінка гемодинамічного компромісу внаслідок аритмії. Тривалі аритмії плода можуть призвести до застійної серцевої недостатності плода та неімунної водянки плода, що збільшує ризик загибелі плода.71,72 Ретельна оцінка серцево-судинного статусу та самопочуття плода має вирішальне значення для визначення тактики лікування. Серцево-судинний статус плода визначається шляхом вимірювання співвідношення серцево-грудної площі (Зображення 18), відмічаючи наявність регургітації АВ-клапана та/або дисфункції шлуночків, а також відмічаючи результати, що вказують на багатоводдя. Доплерометричні показники, особливо збільшення венозної протоки та пульсації пупкової вени, можуть бути важко інтерпретовані, якщо вони є аномальними на фоні ектопічних скорочень передсердь плода, тахікардії або повної серцевої блокади. Аномальний серцевий ритм плода порушує нормальну послідовність електричних подій у серцевому циклі, тому реверс А-хвилі у венозній протоці або пуповинна венозна насічка можуть свідчити про аритмію плода, а не про порушення серцевої функції або затримку розвитку плода.
Ключові моменти
- Частота та ритм серцевих скорочень плода повинні бути задокументовані в рамках ехокардіографічного дослідження плода.
- Якщо серцевий ритм нерегулярний, або якщо спостерігається брадикардія чи тахікардія, слід задокументувати механізм за допомогою М-режиму, PW-доплерографії, тканинної доплерографії або комбінації цих методів.
- Ехокардіографічне вимірювання часових інтервалів у плода в певних ситуаціях (анти-Ro/La позитивність матері, підозра або підтвердження генетичного синдрому подовженого інтервалу QT) може бути корисним.
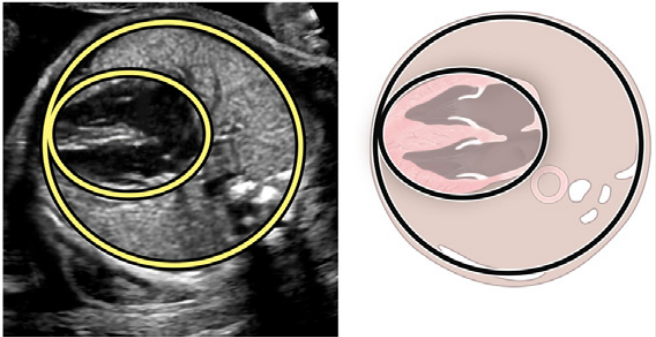
Зображення 18 Стандартні біометричні вимірювання з аксіального зображення на рівні чотирикамерного зрізу. Кардіоторакальний коефіцієнт розраховується на основі вимірювання внутрішньої окружності (або площі) грудної клітки та епікардіальної поверхні серця, як показано жовтими пунктирними лініями. Серцевий кут визначається шляхом бісектриси грудної клітки; лінією від грудини до хребта і вимірювання кута, під яким міжшлуночкова перегородка перетинає лінію (жовті суцільні лінії).
B. Оцінка функціональних порушень серця плода
Двовимірна та доплерівська ехокардіографія є важливими інструментами в оцінці серцевої функції плода. Для оцінки серцево-судинної функції (Таблиця 10) у плода із серцевими та несерцевими станами з ризиком розвитку серцевої дисфункції та компрометації плода можуть бути використані різні методи (Таблиця 11). Виявлення серцевої дисфункції плода є важливим для визначення необхідності та часу потенційного втручання при станах, які можна лікувати пренатально. Характеристика серцевої дисфункції плода може надати клініцистам засоби для кращого відбору пацієнтів для втручання, прогнозування результатів та проведення подальшого спостереження після інтервенційних процедур у плода. Оцінка серцевої функції також важлива для планування та визначення часу пологів, навіть у тих випадках, коли втручання в організм плода не є можливим.
Таблиця 10 Рекомендації щодо компонентів комплексної оцінки функціонального стану серця плода
| Функціональний індекс | Модальність | |
| Систолічна функція |
|
|
| Діастолічна функція |
|
|
| Функція клапана |
|
|
| Серцевий викид |
|
|
| Оцінка серцево-судинного профілю (див. Таблицю 13) |
|
|
DFTc – час діастолічного наповнення, скоригований на тривалість серцевого циклу; ПМП – передбачувана маса плода; MAPSE – систолічна екскурсія мітрального кільця в площині; TAPSE – систолічна екскурсія трикуспідального кільця в площині.
Таблиця 11 Типи гемодинамічних порушень, спричинених станом плода
| Порушення гемодинаміки | Стан плода | Поширені відхилення, що виявляються за допомогою ехокардіографії |
| Ураження з високим серцевим викидом 73-75 |
|
|
| Збільшене попереднє навантаження (об’ємне перевантаження)76-77 |
|
|
| Підвищені післянавантажувальні пошкодження 78-79 |
|
|
| Компресія серця (зменшення переднавантаження)75,80-82 |
|
|
ДАВП, дефект атріовентрикулярної перегородки, КІСВ, комбінований індекс серцевого викиду, ВДГ, вроджена діафрагмальна грижа, СВОДШ, синдром вродженої обструкції верхніх дихальних шляхів; ВЛДШ, вроджена вада легеневих дихальних шляхів; CTAR, співвідношення серцево-грудної площі; ІПМ, індекс продуктивності міокарда; ЗАПБ, зворотна артеріальна перфузія близнюків; ФФТС, фето-фетальний трансфузійний синдром.
i. Візуалізаційні інструменти для оцінки серцевої функції плода. Компоненти комплексної функціональної оцінки серцевої діяльності наведені в Таблиці 10. При первинній візуалізації плода з підозрою на серцеву дисфункцію важливо оцінити наявність водянки плода та/або її компонентів. Загальний розмір серця, визначений за співвідношенням серцево-грудної площі, може бути ознакою зміненої гемодинаміки у плода.83 Слід провести двовимірну та/або М-режимну ехокардіографічну оцінку розміру камер серця та функції шлуночків. Доплерівська картина потоку АВ-клапана 65 може вказувати на діастолічну дисфункцію, а регургітація АВ-клапана, візуалізована за допомогою кольорової доплерографії або PW-доплерографії, може вказувати на систолічну дисфункцію. Доплерівський індекс продуктивності міокарда оцінює глобальну функцію шлуночків, враховуючи як систолічний, так і діастолічний часові інтервали (Зображення 19). Венозний доплерівський кровотік демонструє збільшення швидкості ретроградного кровотоку під час скорочення передсердь, оскільки функція серця плода погіршується (Зображення 20). На величину реверсії А-хвилі також впливає розмір судин, чистий пупковий кровотік через судини та адренергічний стан плода. Венозний доплерівський аналіз реверсії А-хвилі є ненадійним при інших ритмах, окрім синусового ритму.
Зображення 19 Індекс продуктивності міокарда (MPI) та час діастолічного наповнення (DFT) в нормі та при відхиленнях від норми. (А) PW доплерівське відстеження притоку-витоку ЛШ, що демонструє розрахунок доплерівського індексу продуктивності міокарда. MPI виражається як сумарний час ізоволюмічного розслаблення (IRT) та ізоволюмічного скорочення (ICT), поділений на час викиду (інтервал B) або (інтервал A – інтервал B)/інтервал B. Зверніть увагу на клацання клапанів (білі стрілки), які використовуються для позначення початку і кінця IRT і ICT. Також проілюстровано DFT від початку зубця Е до кінця зубця А. (В) Зміни індексу продуктивності міокарда при захворюваннях плода. На верхній панелі показано нормальний MPI. Середня та нижня панелі є прикладами погіршення MPI у близнюка-реципієнта при монохоріальній/діамніотичній двійні з гестацією з синдромом трансфузії між двійнею та близнюками. (C) Час діастолічного наповнення, скоригований на частоту серцевих скорочень (DFTc). DFTc розраховується як загальна тривалість спектрального доплерівського відстеження притоку, поділена на тривалість серцевого циклу. При погіршенні діастолічної функції нормальний DFTc прогресивно скорочується і приплив стає монофазним.
Зображення 20 Венозна доплерографія змінюється зі збільшенням центрального венозного тиску (ЦВТ). При підвищенні ЦВТ (біла стрілка) спостерігаються репрезентативні зміни в IVC, печінкових венах (HV), венозній протоці (DV) та пупковій вені (UV).
PW доплерографію можна використовувати для кількісного визначення ударного об’єму ПШ та ЛШ, що дає додаткове уявлення про кровообіг плода людини.84,85 Ударний об’єм розраховується за допомогою діаметра півмісяцевого кільця клапана та доплерівського інтегралу лінійної швидкості потоку (ІШП) за наступною формулою:
Ходовий об’єм = [(0,785 * кільцевий діаметр2 ) * ІШП].
Враховуючи, що кровообіг плода відбувається паралельно, часто використовується комбінований серцевий викид з обох шлуночків. Нормальний комбінований серцевий викид у плода становить 425 мл/хв/кг і коливається від 225 до 625 мл/хв/кг.85 Нормативні дані для гестаційного віку були опубліковані 85 і використовувалися для прогнозування результатів у станах з високим викидом.73
ТКД. Хоча немає доказів, які б свідчили про користь рутинного застосування ТКД під час візуалізації плода, вона може бути корисною для оцінки серцевої функції та ритму плода. Опубліковані нормативні дані для швидкостей ТКД e0, a0 і s0, часових інтервалів ізоволюмічного розслаблення і скорочення, а також індексів ПШ і ЛШ Tei і співвідношення E/e`.86,87
Оцінка серцево-судинного профілю. Оцінка серцево-судинного профілю є глобальною мірою серцево-судинного статусу і включає в себе декілька серцево-судинних досліджень плода, виражаючи їх у вигляді кумулятивного балу, де найкращий показник дорівнює 10, а найгірший – 0 (Таблиця 12). Цей показник використовується для опису ступеня серцево-судинного компромісу плода при деяких захворюваннях 89, включаючи синдром фето-фетальної трансфузії 90, стани високого серцевого викиду плода,73,74 затримку росту плода,88 та неімунну водянку плода.75,83 Цей показник може бути корисним для опису та відстеження поздовжніх змін у ступені серцевого компромісу плода.
Таблиця 12 Оцінка серцево-судинного профілю*
| Бали субшкали | |||
| Категорія | 2 | 1 | 0 |
| Гідропс | Немає | Асцит або плевральний чи перикардіальний випіт | Набряк шкіри |
| Розмір серця (співвідношення СД/ГД) | 0.20-0.35 | 0.35-0.50 | >0.50 or <0.20 |
| Серцева функція | Нормальний двофазний приплив АВ, ФВ ЛШ та ПШ > 0,28 | Голосистолічний ТР або ФВ ПШ/ЛШ < 0,28 | Голосистолічний МР або ТР dP/dt < 400 або монофазний АВ-приплив |
| Венозний доплер | Непульсуюча ПВ та нормальна ВП | Непульсуюча ПВ та від’ємна хвиля А у ВП | Пульсуюча ПВ |
| Артеріальна доплерографія | Прямий діастолічний потік в ПА | Відсутній кінцевий діастолічний потік в ПА | Ретроградний кінцевий діастолічний потік в ПА |
СД – серцева ділянка; ВП – венозна протока; МР – мітральна регургітація; ФВ – фракція вкорочення; ГД – грудна ділянка; ТР – трикуспідальна регургітація; ПА – пупкова артерія; ПВ – пупкова вена.
Адаптовано з дозволу Makikallio € та співавт. 88
*Сума балів у всіх п’яти категоріях = оцінка; “10” – найкраще, “0” – найгірше.
ii. Специфічні типи серцево-судинних порушень у плода. Розглядаючи аномалії розвитку плода, які можуть спричинити серцево-судинний компроміс, корисно розглянути, про який тип гемодинамічних порушень йдеться в першу чергу, і як серце плода адаптується до цих змін. Хоча всі плоди з ризиком серцевої дисфункції повинні проходити повну оцінку систолічної та діастолічної функції, розуміння гемодинамічних порушень, характерних для певного стану, дозволяє клініцистам “націлитися” на те, який параметр серцевої функції плода може бути найбільш корисним для оцінки ступеня гемодинамічних порушень. Хоча повне обговорення конкретних ехокардіографічних результатів при кожному стані плода виходить за рамки цієї настанови, важливим є розуміння та документування результатів, які є прогностично важливими для кожного стану, як показано в Таблиці 11.
iii. Додаткова візуалізація: Екстракардіальна доплерографія та допоміжні/прогресивні методи. Повна оцінка стану серцево-судинної системи у скомпрометованого плода повинна включати PW доплерометричну оцінку кровотоку в артеріях пуповини та середньої мозкової артерії, хоча це можна зробити як під час акушерського сканування, так і під час ехокардіографії плода. Було показано, що у плода з серцево-судинним компромісом перерозподіл серцевого викиду – так званий “щадний мозок” – відбувається як компенсаторна реакція, що супроводжується очевидним зниженням церебрального опору. Це явище було продемонстровано при затримці росту плода,76 станах високого серцевого викиду,91 та синдромі фето-фетальної трансфузії.78 Ці зміни можуть передувати змінам венозного кровотоку, а отже, можуть бути важливою ранньою ознакою серцевого компромісу плода. Також слід провести вимірювання пікової систолічної швидкості в середній мозковій артерії та порівняти її з нормальними значеннями для гестаційного віку при серцевій дисфункції, щоб виключити анемію плода.92 Описані й інші сучасні методи, такі як ТКД та напруження міокарда. Корисність цих методів в оцінці функції та прогнозуванні наслідків менш зрозуміла, і їх використання здебільшого обмежується дослідницькими цілями.
Ключові моменти
- Якісна оцінка систолічної та діастолічної функції серця повинна бути частиною ехокардіографічного дослідження плода. Це включає 2D-візуалізацію, кольорову та PW-доплерографію притоку та регургітації АВ-клапану (за наявності), а також PW-доплерографію венозної протоки.
- Кількісні вимірювання слід проводити при підозрі на порушення серцевої функції або серцевого викиду на підставі екстракардіального діагнозу або при загрозі для плода (наприклад, випоти, аномалії у двовимірному зображенні, аномалії венозної доплерографії); також можуть бути показані серійні вимірювання.
- Оцінка серцево-судинного профілю може бути корисною для опису та документування поздовжніх змін у ступені серцевого компромісу.
C. Структурні захворювання серця
i. Єдині шлуночки. ВВС єдиного шлуночка (ЄШ) часто виявляють під час рутинного ультразвукового скринінгу через наявність аномалії на чотирикамерному зрізі; більшості пацієнтів діагноз ставлять ще до народження.93 Найпоширенішою формою ЄШ ВВС є СГЛВС, частота якої становить 0,26 на 1 000 живонароджених.13 Інші форми ЄШ ВВС включають гіпопластичний синдром правих відділів серця (0. 22 на 1000 живонароджених) та одновузлове АВ-з’єднання, яке описує групу серцевих вад, при яких АВ-з’єднання повністю або переважно з’єднується з однією камерою шлуночка і включає двостулковий лівий шлуночок, одностулковий (з атрезією лівого або правого АВ-клапана) та спільний вхід (дефект АВ-перегородки із спільним шлуночком). ЄШ форми ВВС є одними з найскладніших форм ВВС, кожна з яких вимагає серії паліативних операцій, що в кінцевому підсумку завершуються повним кавапульмональним аностомозом (“Фонтан”) кровообігу. У цьому розділі ми розглянемо загальні підходи до візуалізації всіх форм ЄШ ВВС, необхідні для консультування сімей щодо діагнозу і прогнозу, а також те, яка візуалізаційна інформація необхідна для ведення пологів і неонатального менеджменту.
Загальний підхід до візуалізації. Як і при ехокардіографії плода у структурно нормальних серцях, слід оцінити вісцероатріальний ситус, системні венозні зв’язки, АВ-з’єднання, морфологію і функцію ЄШ, а також частоту і ритм серцевих скорочень плода. Рекомендується сегментарний підхід до ехокардіографічної візуалізації ЄШ ВВС плода для виявлення важливих асоційованих знахідок.
Венозні з’єднання. Слід оцінити системні та легеневі венозні з’єднання, а також положення/морфологію передсердь, оскільки аномалії можуть мати значення для консультування щодо наслідків та хірургічного підходу до паліації ЄШ. Для системних вен слід виконати оцінку НПВ на предмет внутрішньопечінкового переривання (при з’єднанні печінкової вени безпосередньо з передсердям) та наявності білатеральної ВПВ. Слід оцінити легеневі венозні з’єднання, оскільки аномальний дренаж суттєво впливає на хірургічний підхід та результати.94 При СГЛВС для виявлення гіпертензії лівого передсердя використовують доплерографію легеневої вени та співвідношення прямого/зворотного ІШП (Зображення 21). У деяких центрах для оцінки легеневої судинної реактивності у третьому триместрі у плода з СГЛВС застосовують тестування материнської гіпоксії для підвищення специфічності та чутливості прогнозування потреби в ургентному втручанні. Дослідження показали, що недостатня легенева вазореактивність (зниження індексу пульсації легеневої артерії <10%)95 асоціюється з неонатальною гемодинамічною нестабільністю та необхідністю термінового втручання для відкриття міжпередсердної перегородки після народження.
Зображення 21 Повна ехокардіографічна оцінка ступеня обмеження міжпередсердної перегородки у плода з обструкцією лівих відділів серця. (А) Показано потік зліва направо через міжпередсердну перегородку. (В) Продемонстровано розширення легеневої вени і потік зліва направо. (С) PW доплерографія демонструє аномальну картину прямого/зворотного потоку, що відповідає помірно підвищеному тиску в лівому передсерді.
АВ-апоневрози. ЄШ ВВС може мати гіпопластичні або атретичні трикуспідальний чи мітральний клапани або загальний АВ-клапан, який є незбалансованим (переважно обмежений одним шлуночком; Зображення 22). Слід виміряти розмір АВ-клапана (див. Таблицю 13) та оцінити ступінь клапанної регургітації за допомогою кольорової доплерографії. Наявність значної регургітації АВ-клапана може вплинути як на благополуччя плода, так і на постнатальний результат хірургічного паліативного лікування ЄШ.99
Зображення 22 Приклади уражень серця при ЄШ на чотирикамерному зрізі та 3СТ з кольоровим доплерівським дослідженням та без нього.
Таблиця 13 Настанови щодо анатомічної, фізіологічної та функціональної оцінки анатомічних, фізіологічних та функціональних особливостей при найпоширеніших ураженнях ВВС плода, пов’язаних з конкретним захворюванням
| Категорія | Запідозрили, коли | |||||
| ЄШ і шлуночкова диспропорція | Аксіальний знімок грудної клітки показує асиметричні камери шлуночків | |||||
| Пошкодження | Ключові спостереження | Поширені венозні варіації | Специфічні проблеми з АВ-клапаном | Візуалізація відтоку | Додаткові вимірювання | Інші ключові моменти |
| Незбалансований ДАВП (права або ліва домінанта) | Наявність ДАВП з одним АВ-клапаном, первинним ДМПП або вихідним ДМШП | Перебіг ВПВ та НПВ, примітивні азиготні системи, роздільні печінкові з’єднання, TAPVR |
Регургітація загального клапана; може бути прогресуючою Необхідна фронтальна візуалізація АВ-з’єднання |
Визначити вентрикулоартеріальні з’єднання; оцінити вихідний тракт шлуночка на наявність стенозу або атрезії. | Виміряйте розмір правого та лівого АВ-клапана (Зображення 23), індекс Коена, ІАВК, кут притоку ПШ/ЛШ | Оцініть збалансованість АВ-клапану в розділі “Загальний АВ-клапан”; розгляньте ізомерію/гетеротаксис передсердь |
| Атрезія трикуспідального клапана | Відсутнє АВ-з’єднання, малий правий шлуночок, ДМШП |
Двосторонні ВПВ Доброякісна реверсія А-хвилі при ВП |
Пролапс, дилатація або регургітація мітрального клапана | Визначити вентрикулоартеріальні з’єднання; можуть бути транспоновані. Оцінити стеноз відтоку ПШ; перевірити кровотік дуги на залежність від протоки | Може вимірювати розміри ДМШП у двох ортогональних площинах | Прогресуюча обструкція ДМШП порушує кровотік у вихідному тракті ПШ (що призводить до легеневого стенозу, коарктації) |
| СГЛВС | Малий лівий шлуночок з мітральним/аортальним стенозом або атрезією на чотирикамерному зрізі | Двосторонні ВПВ | ТР з дисфункцією ПШ може підвищувати ризик внутрішньоутробної загибелі плода та постнатальної хвороби/смерті |
Оцініть аортальний клапан, розмір висхідної аорти та поперечної дуги. Проведіть доплерографію легеневого клапана. Перевірте напрямок потоку в поперечній дузі |
Визначте діаметр висхідної аорти, прогнозуючи результати після процедури Норвуда | Оцініть наявність обмеження міжпередсердної перегородки: доплерівський коефіцієнт ІШП легеневої вени < 3 свідчить про недостатній вихід лівого передсердя, що підвищує ймовірність неонатальної септопластики передсердь |
| Складна аномалія АВ-з’єднання | Аксіальний чотирикамерний зріз не має чіткого розділення АВ-клапана в основі | |||||
| Лівий шлуночок з подвійним входом | Обидва АВ-клапани ЛШ з “великою” ДМШП або відсутньою перегородкою на чотирикамерному зрізі | Двосторонні ВПВ |
Оцінити розмір кожного АВ-клапана (один клапан може бути стенозованим або атретичним), а також ступінь клапанної регургітації АВ-клапан може проникати у вихідну камеру |
Визначте АВ-та вентрикулоартеріальні з’єднання (можуть бути D- або L-подібні шлуночки, ДСПШ) Оцініть прохідність вихідного тракту, з’єднаного з морфологічним ПШ, на предмет підклапанної або клапанної обструкції |
При ризику повної блокади серця з L-подібними шлуночками, якщо лівий АВ-клапан гіпопластичний або атретичний, оцініть адекватність дефекту міжпередсердної перегородки | |
| Загальний АВ-клапан, ДАВП | Відсутність зміщених або АВ-клапанів на одному рівні, велике передсердя або ДМШП | Двостороння ВПВ, перервана НПВ, TAPVR | Морфологія, баланс, регургітація; конфігурація сосочкових м’язів | Нормально пов’язані або транспоновані, підклапанна обструкція або гіпоплазія клапана, зворотний потік в протоці або дузі аорти |
Індекс Коена ІАВК Кут притоку ПШ/ЛШ |
Додаткові ДМШП можуть бути пропущені, якщо не шукати їх спеціально |
| Перехресні серця | Неправильне розташування АВ-клапана плутає підрахунок шлуночків (перекошені ПШ або ЛШ) | Аномалії вісцероатріального положення двосторонніх ВПВ | ТР або МР, комбінування, перевизначення | Ретельно визначте з’єднання, можуть бути ДСПШ/d-ТМА, l-ТМА при наявності L-подібної форми, обструкції вихідних трактів | Розміри кільця АВ-клапана | Постнатальну фізіологію важко передбачити, якщо візуалізація не спрямована на визначення зв’язків, а не взаємовідносин |
| Проміжні клапани | Чотирикамерний зріз показує ДМШП або перекриваючу аорту | Двосторонні ВПВ | Розмір, регургітація, ступінь розтягнутості клапана та розподіл хорд | D- чи L-подібні шлуночки та ризик серцевої блокади, підклапанної та клапанної обструкції, неправильного розташування аорти | Якщо лівий АВ-клапан гіпопластичний, є ризик розвитку гіпертензії лівого передсердя | |
| Мітральний стеноз: парашутоподібний, гіпоплазія | Асиметрія ПШ > ЛШ |
ЛВПВ Аортальний стеноз, коарктація |
Морфологія, папілярні м’язи; вимірювання Z-оцінки | Розгляньте ДСПШ при наявності ДМШП і нормальних розмірах висхідної аорти та її кровотоку | Розмір овального отвору; Співвідношення прямої/зворотної легеневої вени | Напрямок потоку через овальний отвір має вирішальне значення для визначення адекватності мітрального клапана |
| Ураження шляхів відтоку з нормальним 4-ch | Аномальна вісь, відтік ЛШ або недосяжні 3СЗ | |||||
| ТФ | Аномальна вісь або відтік ЛШ з ДМШП і перекриваючою судиною |
Двосторонні ВПВ, ретроаортальна непарна вена Права дуга аорти Судинні кільця Аортолегеневе вікно |
Рідкісні мітральні або трикуспідальні вади та зв’язок з ДАВП | 3СЗ: мала легенева артерія. Вигляд трахеї: наявність протоки, напрямок течії, відсутність артеріальної протоки. Безперервність гілок легеневих артерій | Оцініть гілки легеневих артерій, кільце ПШ, воронку послідовно та основні колатеральні судини | Напрямок протоки у 28 тижнів прогнозує потребу у неонатальному втручанні. Співвідношення Ao/ЛК < 0,6 та показник ЛК Z < 5 прогнозують потребу у втручанні |
| Загальний артеріальний стовбур | Двосторонні ВПВ Права дуга аорти, судинне кільце Ретроаортальна непарна вена | ТР, МР | Аортальна чи легенева домінанта, одна чи дві дуги чи переривання аорти (тип) походження ЛА | Швидкість проходження, регургітація Розміри проксимальної гілки ЛА | Права дуга аорти асоціюється з >50% ризиком del22q11 | |
| ДСПШ | Двосторонні ВПВ | Оцініть розмір, регургітацію, розшарування мітрального клапана, розшарування ТК, ДАВП АВ-клапана | Нормально пов’язані або транспоновані, оцінити обструкцію/гіпоплазію, потік протоки/дуги аорти, вікно AP, прохідність легеневої артерії | Відношення ДМШП до судин: Визначити ЛШ-аортальний шлях, оцінити розмір ДМШП, прикріплення АВ-клапана | Шлуночкові петлі, взаємозв’язок та гіпоплазія | |
| d-ТМА | Аномальний 3СЗ, вигляд відтоку з ЛШ аномальний, паралельні відтоки | Немає | d-ТМА при ДМШП ± легеневий стеноз може мати аномальний МК: розщеплений МК | Аортальний та легеневий клапани в нормі; гіпоплазія аорти пов’язана з гіпоплазією ТК, ЛК, можливо, двостулковий |
Розмір овального отвору Індекс екскурсії перегородки |
Зазвичай аортальний клапан має більші розміри, ніж у нормі |
| l-ТМА | Немає | Аномальний хрест на чотирикамерному зрізі; зміщення ТК, загальна ТР та вплив на прогноз |
Оцінка легеневої або сублегеневої обструкції Оцінка гіпоплазії дуги |
АВ-інтервали Наявність і розмір ДМШП |
Може мати аномальну вісь, мезо- або декстропозицію Серійний моніторинг для виявлення серцевої блокади |
|
| Прогресуюча обструкція півмісяцевого клапана | 3СЗ ненормальний; чотирикамерна асиметрія | |||||
| Стеноз аорти | Потовщений клапан ЛШ, розширена аорта на 3СЗ, гіпертрофія/дисфункція ЛШ на чотирикамерному зрізі | Доплерографія легеневої вени з реверсією в систолу передсердь | Аномалії мітрального клапана: гіпоплазія, аркадна МР-швидкість для функції ЛШ | Реверсія потоку поперечної дуги прогнозує тяжку обструкцію; доплерографія може недооцінювати тяжкість при дисфункції ЛШ |
Дуга та перешийок аорти (ризик коарктації) Тривалість мітрального притоку Тривалість пікової швидкості МР (за наявності) |
Задокументуйте напрямок потоку через овальний отвір. Оцініть, чи підвищений тиск у ЛШ внаслідок обмеження міжпередсердної перегородки |
| Стеноз легеневої артерії | Аномалія чотирикамерного: Збільшення РА, ПШ < ЛШ, гіпертрофія; інверсія кольору в 3СЗ | Підвищений реверс А-хвилі в системних венах є поширеним явищем | Розмір трикуспідального кільця, тривалість притоку PW ТР. Помірна ТР пов’язана з низьким синусоїдним ризиком | Анатомія проток: Стеноз лівої ЛА, проблеми з відтоком. Реверс потоку вказує на протокову залежність |
Розміри гілки ЛА ТР пікова швидкість (якщо присутня) |
Оцініть коронарно-камерні нориці (“синусоїди”) за допомогою низькошвидкісної кольорової доплерографії |
| Аномалія Ебштейна та дисплазія ТК | Збільшення ПП, кардіомегалія, диспластичні ТК-стулки; кільцевий потік туди-сюди | Підвищений реверс А-хвилі при НПВ, а також пульсації венозної протоки та ПВ | Розмір трикуспідального кільця та пікова швидкість трискупідальної регургітації прогнозують прогресування | Стеноз або атрезія ЛА, функціональна атрезія; PR Гіпоплазія гілок ЛА Напрямок протокового шунта Рідкісні асоціації з коарктацією | Серійне вимірювання: ТК кільце, пікова швидкість ТР, легеневий потік, PR, функція ЛШ, доплерографія ПА та СМА | |
| СВКЛА | Асоційовані з ТФ або ізольовані: Гіпоплазія ЛВ, дилатація ЛА, збільшення ПП/ПШ | Реверсія А-хвилі в НПВ і венозній протоці сигналізує про підвищення тиску ПП | Оцініть ТР за допомогою PW і CW доплерографії для визначення систолічного тиску/функції ПШ | Артеріальна протока, як правило, відсутня, але її наявність слід оцінювати, оскільки вона впливає на прогноз | Серійне вимірювання розміру гілок ЛА, бівентрикулярної функції, CTR ПА та доплерографія СМА | |
| Аномалії дуги | 3СЗ або 3СТ аномалія | |||||
| Коарктація | ПШ>ЛШ, висхідна Ао менша за ВПВ, малий поперечний та низхідний/перешийок | ЛВПВ до коронарного синусу | Анатомія мітрального отвору, напрямок потоку через міжпередсердну перегородку | Стеноз аортального клапана, двостулковий аортальний клапан | Перешийок аорти | Рівень хибнопозитивних та хибнонегативних результатів є значним |
| Судинні кільця | 3СТ утворює U-подібну форму навколо стравоходу і трахеї | Немає | Немає | Виключити аберантні підключичні артерії, подвійну дугу аорти | За потреби | Підвищений ризик розвитку аномалій трахеї, трахеальних кілець |
| Аневризма протоки | На пізніх термінах вагітності аномальна 3СЗ, 3СТ або сагітальна дуга виглядає звивистою | Немає | Немає | Перешийок аорти Діаметр артеріальної протоки в найширшому місці | Загалом нормальний варіант, без клінічної кореляції у новонароджених |
Ао – аорта; ДАВП – дефект атріовентрикулярної перегородки; ІАВК – індекс АВ-клапана; CTR – співвідношення серцево-грудної площі; ДСПШ – двостулковий правий шлуночок; ВП – венозна протока; ЛП, ліве передсердя; ЛВПВ, ліва ВПВ; СМА, середня мозкова артерія; ЛА, легенева артерія; ЛК, легеневий клапан; ПП, праве передсердя; TAPVR, тотальне аномальне легенево-венозне повернення. Ця загальна інформація не є вичерпною і не замінює спеціальну літературу щодо анатомії та фізіології серця плода при ВВС.
Шлуночково-артеріальне з’єднання. Ураження ЄШ можуть мати різноманітні шлуночково-артеріальні зв’язки та варіації обструкції легеневого або системного кровотоку. Тому у плода з ЄШ ВВС необхідно ретельно візуалізувати відтік(токи), включаючи орієнтацію (нормальна, транспонована, неправильна), прохідність, розмір та напрямок кровотоку. У пацієнтів зі стенозом або атрезією аорти слід виміряти діаметр висхідної аорти. Кольорова доплерографія дуг у 3СЗ, 3СТ та сагітальній площинах є ключовою, оскільки ретроградний потік в дузі аорти або протоки є чи не найпотужнішим показником необхідності інфузії простагландинів після народження.100 У плодів з гіпоплазією аортального або легеневого клапана стеноз клапана може прогресувати під час гестації, тому слід проводити серійну оцінку гемодинаміки клапанів та великих артерій (Таблиці 13 і 14).
Таблиця 14 Механізми та закономірності прогресування ВВС плода
| Розвиток/прогрес | Захворювання серця, пов’язані з еволюцією | Еволюція/прогрес |
| АВ та напівмісяцевий клапан/перешкода відтоку |
|
|
| АВ і напівмісяцева регургітація клапана |
|
|
| Шлуночок, клапан, велика артерія, гілка ЛА, гіпоплазія дуги |
|
|
| Звуження овального отвору |
|
|
| Звуження протоки або утворення аневризми |
|
|
| Регресія/прогресування пухлини |
|
|
| Розширення камер |
|
|
| Шлуночкова дисфункція |
|
|
| Серцева недостатність |
|
|
| Аритмії при ВВС плода |
|
|
| Зменшення розміру ДМШП |
|
|
ПБС – передсердна балонна септостомія; ВУЗП – внутрішньоутробна загибель плода; ЛА – легенева артерія; ПЛГН – персистуюча легенева гіпертензія новонародженого; ТМА – транспозиція магістральних артерій.
Ритм, функція та морфологія. У клінічній практиці функція оцінюється якісно, хоча повідомлялося про кількісні показники, включаючи фракційне вкорочення, екскурсію трикуспідального та мітрального кільця та індекс сферичності.104 Методи візуалізації міокарда, такі як деформація та швидкість деформації, можуть надати більш кількісну картину функції шлуночків, але в даний час не використовуються в клінічній практиці.105 Брадиаритмії (наприклад, повна блокада серця або дисфункція синусового вузла) асоціюються з ізомерією лівого передсердя та дискордантними АВ-зв’язками. Ця комбінація має поганий прогноз і високий ризик внутрішньоутробної смертності.106
Ключові моменти
- При підозрі на ВВС необхідно провести повне ехокардіографічне дослідження плода, перш ніж можна буде зробити обґрунтований прогноз.
- Необхідно продемонструвати напрямок потоку та будь-які обмеження на міжпередсердній перегородці, артеріальній протоці (за наявності) та перешийку аорти (за наявності).
- Для консультування та планування постнатального ведення слід виконати візуалізацію системної та легеневої венозної анатомії.
- Слід виміряти діаметр або площу АВ-клапана та оцінити ступінь регургітації АВ-клапана за допомогою кольорової доплерографії.
- У плодів з СГЛВС (та варіантами з відсутністю виходу з лівого передсердя) слід вимірювати співвідношення прямого/зворотного легеневого кровотоку для визначення ризику постнатального ургентного втручання при кожній ехокардіографічній оцінці плода, з останнім вимірюванням у найближчі терміни.
- Для ВВС з СГЛВС (та варіантами з відсутністю виходу з лівого передсердя) в окремих випадках для оцінки легеневої судинної реактивності може розглядатися проведення тесту на гіпероксигенацію матері наприкінці третього триместру.
ii. Складні АВ-з’єднання. Ураження АВ-з’єднання можуть бути ізольованими (хоча часто пов’язані з анеуплоїдією, включаючи трисомію 21) або можуть бути надзвичайно складними і виявлятися в поєднанні з декількома супутніми вадами.107 Область АВ-з’єднання називається “хрестом” серця і є анатомічною точкою з’єднання передсердної камери (камер) з шлуночками. У нормі лівий мітральний клапан – це двостулковий клапан з хордовим прикріпленням до двох окремих папілярних м’язів на вільній стінці лівого шлуночка. Правобічний ТК дещо більше зміщений апікально з трьома стулками і хордовими прикріпленнями, розподіленими по всьому тілу правого шлуночка, включаючи поверхню міжшлуночкової перегородки. Хоча чотирикамерний зріз дозволяє оптимально візуалізувати морфологію серцевого м’яза і АВ-клапана, а також наявність ДМШП і аномалій вихідного тракту, при підозрі на аномалію необхідна додаткова візуалізація. ВВС з аномальними або неправильно сформованими АВ-клапанами мають високу частоту диспропорції шлуночків, асоційованих дефектів міжшлуночкової перегородки та недорозвинення відтоків і великих артерій, що може призвести до необхідності паліативного хірургічного підходу до ЄШ.
Загальний підхід до візуалізації. При наявності аномалій АВ-клапану важливе значення має оцінка загальних структур серця плода, включаючи розмір і функцію шлуночків, а також АВ-баланс над шлуночками, є важливим. Після первинного визначення положення плода, оптимальною відправною точкою для оцінки цих вад є чотирикамерний зріз. У цьому зрізі слід подбати про вирівнювання АВ-перегородки у більш перпендикулярній площині, щоб чітко визначити морфологію АВ-клапана і точки вставки стулок, а також хордовий розподіл і вставку. Визначаються шлуночкові петлі та вирівнювання. Кільцеві розміри АВ-клапана слід вимірювати в ранній діастолі в точках шарнірів клапана. Оскільки в цій групі аномалій часто зустрічаються аномалії шляхів відтоку та великих артерій, обов’язковим є отримання краніальних розгорток для визначення анатомії, розміру та прохідності як вихідного тракту, так і великих артерій. Сагітальна проекція грудної клітки плода найкраще забезпечує короткоосьову візуалізацію морфології АВ-клапана, хордових прикріплень, а також розташування та морфологію папілярних м’язів (Зображення 23). Аномальний приплив через АВ-клапан або регургітацію слід оцінювати за допомогою кольорової доплерографії. PW доплерографічна оцінка структури притоку є дуже важливою.
Зображення 23 Кількісна оцінка ступеня дисбалансу при дефекті міжпередсердної перегородки. З парасагітальної проекції в діастолу можна виміряти площу спільного АВ-клапана, розподілену на кожен шлуночок, і розрахувати індекс АВ-клапана (ІАВК). Залежно від рівняння, яке використовується, співвідношення приблизно 2:1 або вище вказує на необхідність паліації ЄШ. LA – ліве передсердя; LV – лівий шлуночок; RA – праве передсердя; RV – правий шлуночок.
Дефекти АВ-перегородки. Загальне АВ-з’єднання або дефект АВ-перегородки візуалізується на чотирикамерному зображенні, при цьому відзначається аномальна серцевина, в якій стулка правостороннього АВ-клапана знаходиться на тому ж рівні, що й передня стулка лівого АВ-клапана в закритому стані (Зображення 23 і 24). Цей результат повинен спонукати до оцінки лівого АВ-клапана на предмет наявності щілини або загального отвору, міжпередсердної перегородки на предмет первинних дефектів та вхідної перегородки шлуночків. Якщо за даними 2D або кольорової потокової візуалізації клапан переважно прилягає до одного з шлуночків з диспропорцією розмірів шлуночків або без неї, площу спільного АВ-клапану, розподілену на кожен шлуночок, можна виміряти в парасагітальній проекції в діастолу (Зображення 23), а індекс АВ-клапану можна розрахувати як площу лівої/правої стулок 108 або виміряти кут притоку ПШ/ЛШ в апікальній проекції чотирикамерного зрізу (Зображення 24). Слід оцінити шляхи відтоку, щоб визначити наявність обструкції з боку конусної перегородки, підклапанної фіброзної тканини, АВ-клапана або допоміжних тканин.
Зображення 24 Збалансованого (A, B) та незбалансованого праводомінантного (C) та ліводомінантного (D) дефекту міжпередсердної АВ-перегородки у чотирикамерному аксіальному зрізі. Ступінь дисбалансу можна кількісно оцінити за допомогою вимірювання кута нахилу стулок (А, пунктирна лінія), причому менший кут асоціюється зі збільшенням дисбалансу.
Вроджені вади мітрального клапана. Аномалії мітрального клапана можуть призвести до зменшення потоку через ліві відділи серця та реверсії потоку в овальному отворі. Слід виконати двовимірну візуалізацію та кольорову доплерографію мітрального клапана та міжпередсердної перегородки, а також PW доплерографію легеневих вен для оцінки підвищеного тиску в лівому передсерді. Ізольована дисплазія мітрального клапана та “аркада” мітрального клапана 109,110 є аномаліями, які викликають значну мітральну регургітацію, хоча будь-який ступінь регургітації мітрального клапана є аномальним. При наявності мітральної регургітації слід враховувати супутні обструктивні ураження відтоку ЛШ.111
Комбіновані/перекриваючі АВ-клапани та перехресне серце. “Перекриваючий АВ-клапан” – це термін, який застосовується, коли хордальний апарат проходить через ДМШП і прикріплюється до стінки або папілярно-м’язової структури протилежного шлуночка. Перекриваючий АВ-клапан характеризується клапанним кільцем, яке анатомічно розташоване над міжшлуночковою перегородкою і відкривається в обидва шлуночки.112 При перехресних АВ-зв’язках або “скручених” АВ-зв’язках апарат кожного з двох АВ-клапанів перетинається один над одним, зазвичай так, що передсердя з правого боку відкривається в лівий шлуночок, а передсердя з лівого боку відкривається в правий шлуночок. Крім того, шлуночкова петля може бути такою, що має місце АВ-конкордантність або АВ-дискордантність.113 При АВ-дискордантності майже завжди спостерігається ДМШП з високою частотою АВ-клапана, що проходить через ваду. Ретельна візуалізація клапанів, включаючи розміри, функцію та прикріплення, з використанням комбінації 2D, кольорової доплерографії та PW доплерографії з різних зрізів (Зображення 25), повинна супроводжувати діагностику. За наявності пролабіруючих або перекриваючих АВ-клапанів відновлення шляхом хірургічного закриття ДМШП може бути неможливим і потребувати паліативного хірургічного підходу до ЄШ.
Ключові моменти
- При наявності аномалій АВ-клапана слід оцінити всі серцеві структури плода, включаючи оцінку розміру і функції шлуночків, а також баланс АВ-клапана.
- У плода з підозрою на аномалію АВ-з’єднання слід використовувати нестандартні площини та анфас для детальної оцінки анатомії клапанів, хорд та їх вставок.
- Повне доплерівське дослідження серця плода, включаючи оцінку АВ-клапана (клапанів) на предмет стенозу, регургітації та напрямку потоку на міжпередсердній перегородці та артеріальній протоці, повинно проводитись при кожному обстеженні.
- Додаткові ураження, які можуть вплинути на хірургічний підхід, повинні бути окреслені для визначення остаточної хірургічної стратегії паліації (паліація ЄШ чи бівентрикулярна пластика).
Зображення 25 Пролабування лівого АВ-клапана, що ускладнює або унеможливлює стратегію бівентрикулярної пластики. (A-D) d-ТМА з ДМШП. Плід з атиповою щілиною мітрального клапана і перехрещенням хорд мітрального клапана через вихідний отвір ДМШП. (А) і (В) показують аксіальну площину з аномальним відкриттям мітрального клапана в бік перегородки, тоді як анатомію клапана краще видно на (С) і (D), де парасагітальна площина демонструє вигляд мітрального клапана анфас у двох різних діастолічних кадрах. На практиці цю анатомію краще демонструвати за допомогою відеокліпів та сканування в реальному часі. (E, F) Двостулковий правий шлуночок з підлегеневим ДМШП і пролабуванням мітрального клапана, що робить неонатальну процедуру Damus-Kaye-Stansel більш доцільною, ніж операцію артеріального переключення.
iii. “Схожі” ураження вихідних шляхів. Ураження, що стосуються шляхів відтоку, виявляються під час акушерського анатомічного ультразвукового скринінгу з використанням зрізів вихідних шляхів, 3СЗ і 3СТ. Часто при аномаліях вихідних шляхів є мінімальні аномалії, що відзначаються на чотирикамерному зрізі. Хоча багато з цих вад можуть виглядати схожими при ультразвуковому скринінгу, повне ехокардіографічне дослідження плода надає детальну інформацію, яка потім впливає на перинатальне планування, втручання, необхідні при народженні, а також на довгострокове ведення і прогноз, що залежить від точного фізіологічного та анатомічного діагнозу.
Загальний підхід до візуалізації. ВВС, що зачіпають шляхи відтоку, часто асоціюються з іншими аномаліями, включаючи аномалії системних або легеневих венозних зв’язків, АВ-клапану, міжпередсердної або міжшлуночкової перегородки, гілок легеневих артерій та дуги аорти. Як і при інших ВВС, слід ретельно оцінити вісцероатріальне положення, системні венозні зв’язки, АВ-з’єднання, морфологію і функцію шлуночків, а також частоту і ритм серцевих скорочень. Візуалізаційні зображення та розгортки від чотирикамерного зрізу до зрізів вихідного відтоку, 3СЗ та 3СТ дозволять деталізувати сегментарну анатомію, включаючи АВ та вентрикулоартеріальні з’єднання, а також взаємовідношення магістральних артерій. Короткоосьові та коронарні зображення можуть бути використані для локалізації будь-яких дефектів міжшлуночкової перегородки та визначення взаємовідношення магістральних артерій між собою та зі шлуночками.
Ураження з ДМШП та розширення магістральної судини. Диференціальна діагностика при картині з боку вихідного тракту, яка включає ДМШП і розширення магістральної судини включає тетраду Фалло (ТФ) і атрезію легеневої артерії з ДМШП, двостулковим правим шлуночком і загальним артеріальним стовбуром (Зображення 26). ТФ характеризується переважанням аорти та різним ступенем обструкції підлегеневого та легеневого клапанів, що варіює від легкого легеневого стенозу до легеневої атрезії або дилатації за наявності синдрому відсутності легеневого клапана (СВЛК). ТФ також може спостерігатися в поєднанні з дефектом міжпередсердної перегородки.114 Гілки легеневих артерій повинні бути ідентифіковані в місці їхнього походження, оскільки переривання, сегментарний стеноз і основні аорто-легеневі колатералі можуть співіснувати з очевидно справними вихідними шляхами і/або артеріальною протокою і мати наслідки для лікування і довгострокового результату 115-119 (Таблиця 13). Візуалізація асоційованих аномалій дуги та тимуса дозволяє проводити індивідуальне консультування щодо ризику делеції 22q11.120 При ТФ з відсутнім легеневим клапаном дисфункція шлуночків прогнозує ембріональну та перинатальну захворюваність і смертність.121
При двостулковому правому шлуночку ДМШП може бути субаортальним, субпульмональним, подвійним або віддаленим, тому необхідно визначити орієнтацію і відносні розміри аорти і легеневої артерії при виході з шлуночка, а також їх відношення до ДМШП. Якщо ДМШП знаходиться під легеневою артерією, передня аорта може бути обтяжена в субаортальній ділянці, що вимагає ретельної візуалізації дуги аорти за допомогою двовимірної та кольорової доплерографії, оскільки коарктація часто супроводжує цю ситуацію. Якщо ДМШП є субаортальною, анатомія та постнатальна фізіологія можуть бути подібними до ТФ.
Загальний артеріальний стовбур, характеризується єдиним артеріальним стовбуром, який дає початок безпосередньо коронарним артеріям, аорті та одній або обом легеневим артеріям. Функція стовбурового клапана, особливо значна регургітація, може впливати на внутрішньоутробне виживання.77 Існує значна анатомічна варіабельність з домінуючою прихильністю до легеневого кровообігу (відгалуження легеневих артерій від загального стовбура, менша перегородка аорти з перериванням дуги або без нього) або до аортального кровообігу (домінуюча висхідна аорта з відгалуженнями легеневих артерій, що виходять разом або окремо від загального стовбура). 122 Хоча артеріальна протока часто відсутня, вона може бути присутня у всіх формах загального артеріального стовбура, причому більш легенево-домінантні варіанти та стовбур з перерваною дугою аорти повністю залежать від прохідності артеріальної протоки для перфузії нижньої частини тіла. Ці плоди залежать від ініціації простагландину Е1 при народженні.
Зображення 26 Аномалії, що виявляються при оцінці вихідного тракту лівого шлуночка (ВТЛШ), які можуть бути невидимими на чотирикамерному зрізі. Зображення (А) показує задню судину, яка дає початок легеневій артерії, з підлегеневою ДМШП та аортою, розташованою спереду (аномалія Тауссіг-Бінга). Зображення (B) – плід зі спільним артеріальним стовбуром, (C) – плід з ТФ, (D) – d-ТМА з паралельними шляхами відтоку. (E) демонструє судину, яка рано відходить від гілок ВТЛШ (стрілка) і, таким чином, є легеневою артерією, що також дозволяє діагностувати d-ТМА. (F) l-ТМА, показує, що праве передсердя (з візуалізацією ВПВ) з’єднане з лівим шлуночком, а ВТЛШ дає початок задній легеневій артерії. Ао – аорта; LV – лівий шлуночок; PA – легенева артерія; RA – праве передсердя.
Ураження з відтоком крові з ЛШ, що призводить до формування задньої легеневої артерії. Як d-ТМА, так і l-транспозиція магістральних артерій (l-ТМА) демонструють схожу задню легеневу артерію, що виходить з вихідного тракту ЛШ (Зображення 26). Діагноз d-ТМА повинен спонукати до проведення візуалізації міжпередсердної перегородки на пізніх термінах вагітності, а також до розродження в умовах, які дозволяють збільшити дефект міжпередсердної перегородки, якщо шунтування не є адекватним. l-ТМА може бути ідентифікована на чотирикамерному зрізі шляхом візуалізації аномальної серцевини та середньої смуги у верхівці лівостороннього правого шлуночка. Поєднання АВ і вентрикулоартеріальної дискордантності призводить до фізіологічно скоригованого кровотоку. Частота ДМШП при l-ТМА може становити від 60% до 70%, хоча тип і локалізація ДМШП варіабельні.123 Дисплазія ТК і мальформація Ебштейна можуть бути пов’язані з l-ТМА, як і коарктація аорти. Порушення ритму і вроджена блокада серця можуть виявлятися під час внутрішньоутробного життя і впливати на виживання, тому показане серійне обстеження.124
Ключові моменти
- Підозри на аномалії шляхів відтоку слід оцінювати за допомогою ехокардіографії плода, перш ніж обговорювати з пацієнткою прогноз, супутні аномалії та додаткове обстеження (в тому числі генетичне).
- При підозрі на аномалії шляхів відтоку повне обстеження включає візуалізацію гілок легеневих артерій біля їх витоків. Переривання, сегментарний стеноз та основні аорто-легеневі колатералі можуть співіснувати з очевидно нормальним шляхом відтоку та/або артеріальною протокою; напрямок потоку в протоці за допомогою доплерографії повинен бути задокументованим.
- Латеральність дуги аорти повинна бути задокументована принаймні один раз під час гестації, а також зроблена спроба окреслити схему розгалуження, особливо якщо дуга аорти та протока знаходяться по різні боки трахеї.
- Дуга аорти знаходиться в зоні ризику при будь-якому ураженні з субаортальною обструкцією або підлегеневою ДМШП; дугу слід візуалізувати за допомогою двовимірної та доплерівської ехокардіографії в аксіальній та сагітальній площинах для оцінки прохідності та розмірів.
- Будь-якому плоду з ДАВП слід провести оцінку прохідності овального отвору на пізніх термінах гестації.
- При вагітності з діагнозом l-ТМА плода слід запропонувати серійну ехокардіографічну оцінку плода для виявлення прогресуючої регургітації АВ-клапана та порушень ритму, включаючи повну блокаду серця.
iv. Прогресуючі ураження, обструктивні та регургітаційні. Те, що спочатку виглядає як легка вада серця плода, може еволюціонувати в більш тяжку структурну та функціональну хворобу (Таблиці 13 і 14). До уражень з найбільшим потенціалом прогресування в утробі матері відносяться напівмісяцева клапанна обструкція при інтактній міжшлуночковій перегородці та ураження, пов’язані зі значною клапанною регургітацією. Ехокардіографічна оцінка таких уражень плода вимагає всебічного визначення сегментарної та клапанної анатомії, а також функції бівентрикулярного та АВ-клапанів, а з огляду на їх прогресуючий характер, важливим є проведення серійних досліджень. При прогресуванні ці ураження можуть призвести до серцево-судинної компрометації, тому рутинне доплерографічне дослідження системного венозного кровотоку, венозної протоки, артеріальної та венозної артерії пуповини, а також артеріального кровотоку середньої мозкової артерії є надзвичайно важливим.
Напівмісяцева клапанна обструкція при інтактній міжшлуночковій перегородці. Стенози аортального та легеневого клапанів плода мають широкий спектр тяжкості. Більш тяжка обструкція, особливо на ранніх термінах гестації, може призвести до прогресуючої гіпоплазії шлуночків 125,126 або спричинити водянку плода, якщо є порушення наповнення контралатерального шлуночка.127 Оцінка морфології півмісяцевого клапана, його розміру, прохідності та функціональності, включаючи використання кольорового, PW та CW доплера, є важливою для постановки діагнозу та визначення ступеня тяжкості ураження (Зображення 27). Ріст великої артерії нижче за течією від обструкції може бути порушений, що призводить до дилатації або гіпоплазії при тривалій обструкції, що потребує повторних вимірювань. Ретроградний потік в іпсилатеральній дузі свідчить про критичну обструкцію півмісяцевого клапана на будь-якому терміні вагітності 100 і його слід шукати повторно протягом вагітності, якщо він не був виявлений при первинному обстеженні (Зображення 28). Тяжкість стенозу, ймовірність прогресуючої гіпоплазії клапана та показання до пренатального втручання можна визначити шляхом оцінки розмірів шлуночків (кінцевий діастолічний діаметр та довжина), визначення верхівкового шлуночка, а також наявності гіпертрофії та/або фіброеластозу ендокарда,128 та оцінки систолічної та діастолічної функції іпсилатерального шлуночка.128-131 CW доплерографія мітральної та ТК регургітації дає ключову гемодинамічну інформацію про тяжкість аортального та легеневого стенозу відповідно, а також про функцію шлуночків, причому вищі швидкості при більш тяжкому захворюванні свідчать про збережену функцію шлуночків. І навпаки, низька швидкість регургітаційного струменя може свідчити про менш виражену обструкцію, важку дисфункцію міокарда або вказувати на те, що первинне ураження є міокардіальним або пов’язане з вираженою регургітацією АВ-клапана (див. нижче), а не з обструкцією відтоку. Оцінка функції контралатерального шлуночка та АВ-клапана має вирішальне значення для прогнозування потенційної можливості серцево-судинного компрометації.
Окрім спільних рис, існують унікальні аспекти обструкції аортального та легеневого клапанів плода. При аортальному стенозі слід оцінити розмір овального отвору та потік через нього. Високий тиск наповнення лівого передсердя та ЛШ при більш тяжкій обструкції призводить до шунтування лівого передсердя на праве і може призвести до обмеження передсердь з гіпертензією лівого передсердя, що в кінцевому підсумку впливає на доплерівську картину потоку легеневої вени.132 При критичній обструкції легеневого відтоку, особливо при клапанній атрезії або близькій до неї атрезії з малим правим шлуночком, можуть бути присутніми фістули коронарної артерії, які можна запідозрити за наявністю потоку “туди-сюди” на вільній стінці ЛШ та міжпередсердній перегородці.133
Ключові моменти
- При підозрі на стеноз клапана слід провести серійне дослідження серця, включаючи оцінку розміру та функції шлуночків, а також наявність фіброеластозу ендокарда.
- Напрямок потоку в протоці та дузі аорти повинен бути задокументований при кожному обстеженні; аномальний напрямок потоку є передвісником критичної постнатальної обструкції.
- Доплерівські градієнти тиску можуть бути виміряні та зареєстровані, але не обов’язково вказують на вираженість стенозу.
- Напрямок потоку через міжпередсердну перегородку повинен бути задокументований при кожному обстеженні.
- При стенозі аортального та легеневого клапанів рекомендується оцінка бівентрикулярної функції, включаючи, але не обмежуючись цим, доплерівську картину венозного та шлуночкового притоку, часові інтервали, наявність клапанної регургітації, зміну площі фракцій, фракційне вкорочення та серцево-грудний коефіцієнт.
Зображення 27 Прогресування аортального стенозу. Виражений аортальний стеноз у 23-тижневого плода з розширеним і гіпокінетичним лівим шлуночком (LV) з фіброеластозом ендокарда. (А) За допомогою кольорової доплерографії демонструється аліація, що починається на аортальному клапані (стрілка) (ліворуч) з градієнтом спектральної доплерографії 25 мм рт.ст. (праворуч). (B) Приплив через мітральний клапан (MV) однофазний і короткочасний (ліворуч), а струмінь мітральної регургітації свідчить про високий систолічний тиск LV (градієнт тиску 46 мм рт.ст. плюс тиск у лівому передсерді; права панель). (С) Наявність ретроградного потоку дуги аорти (червоний, ліворуч) та потоку зліва направо через передсердя (червоний, праворуч) є додатковими ознаками, які прогнозують прогресуючу гіпоплазію лівих відділів серця, що розвивається під час гестації через зменшення кровотоку через ліві відділи серця. (D) LV стає поступово більш кулястим і зменшується в довжину, а до 36 тижнів більше не має верхівки. RV, Правий шлуночок.
Зображення 28 Ретроградний потік в дузі іпсилатерально від обструкції півмісяцевого клапана. (Верхня панель) Тяжка обструкція вихідного тракту ПШ, при якій 3СТ виглядає дещо нормальним, але кольорова доплерографія показує ретроградний потік в артеріальній протоці (синій колір). (Нижня панель) Сагітальний вигляд дуги аорти виглядає нормальним на 2D зображенні, але кольорова доплерографія виявляє ретроградний (синій) систолічний потік у поперечній дузі.
Тяжка атріовентрикулярна та напівмісяцева клапанна регургітація. Значна АВ або напівмісяцева клапанна регургітація асоціюється зі збільшенням об’ємного навантаження, що проявляється прогресуючою кардіомегалією, і погано переноситься кровообігом плода. Об’ємне навантаження і, як наслідок, бівентрикулярна дисфункція можуть призвести до неможливості перерозподілу переднавантаження серця, що призводить до гемодинамічної нестабільності, підвищення тиску наповнення і багатоводдя.121,128 Хвороба ТК плода (ХТК) та СВКЛА є найпоширенішими ураженнями з такою патофізіологією, хоча звичайна регургітація АВ-клапана (розглянута в попередніх розділах) також може прогресувати і впливати на прогноз, особливо у пацієнтів з ізомерією лівого або правого передсердь (гетеротаксис).
Загальний підхід до візуалізації. Першою ознакою наявності ХТК, як і при аномалії Ебштейна та дисплазії ТК, є значна дилатація правого передсердя з дилатацією ПШ або без неї. Оцінка анатомії ТК у чотирикамерному та короткоосьовому зрізах прояснює основний діагноз (Таблиця 13). Вираженість регургітації ТК можна оцінити за допомогою вимірювання ширини вени контрактури відносно кільця клапана. Доплерівське дослідження (PW і CW) недостатньої швидкості струменя має вирішальне значення для виключення первинної легеневої обструкції (високі швидкості) і для визначення здатності правого шлуночка генерувати систолічний тиск. Оцінка потоку та прохідності легеневого клапана є важливою, оскільки це ураження може бути пов’язане з анатомічною або псевдолегеневою атрезією, при якій легеневий клапан не відкривається, оскільки тиск у ПШ не може перевищувати системний тиск (Зображення 29). Структурна або функціональна атрезія легеневої артерії при тяжкій ХТК завжди пов’язана з ретроградним протоковим потоком, який може розвинутися в будь-який момент гестації, тому напрямок потоку в артеріальній протоці повинен бути задокументований послідовно протягом усього терміну гестації. Гіпоплазія легеневого клапана та головної легеневої артерії є поширеним явищем через зменшення відтоку з ПШ. Гілки легеневих артерій слід візуалізувати та вимірювати, оскільки артеріальна гіпоплазія корелює з асоційованою гіпоплазією легень.129 Слід оцінити морфологію ЛШ (ексцентриситет, наявність або відсутність неущільнення), розмір та функцію ЛШ, оскільки дисфункція ЛШ при ХТК може призвести до серцево-судинного компромісу.128,130
Відсутність збільшеного радіального зміщення, зменшена окружна деформація та наявність дисинхронії ЛШ також є ключовими ознаками тяжкої ХТК, які, ймовірно, відображають неоптимальну шлуночково-шлуночкову взаємодію,128 хоча ці модальності все ще вважаються досліджуваними. Слід оцінити серцевий ритм, щоб виключити ектопію передсердь та надшлуночкові тахіаритмії, які часто зустрічаються.131 Нарешті, важливо оцінити наявність інших структурних вад, включаючи коарктацію аорти та ДМШП.
СВКЛА найчастіше асоціюється з ТФ з субаортальною ДМШП, але може виникати і при інтактній міжшлуночковій перегородці. Враховуючи наслідки для хірургічного лікування, а також асоційовану делецію 22q11.2, диференціація між цими двома станами є критично важливою. Прогресуюча дисфункція ПШ є предиктором перинатальної смертності.121 На додаток до оцінки розмірів гілок легеневої артерії та співвідношення серцево-грудної площі, оцінка положення серця є важливою, оскільки зміна СВКЛА вказує на наявність обструкції дихальних шляхів з гіперінфляцією легені іпсилатерально від обструкції дихальних шляхів.121,134 Боталова протока зустрічається рідко, але може бути виявлена в асоціації з переривчастими легеневими артеріями або у плодів без ДМШП. Слід оцінити анатомію лівих відділів серця та функцію ЛШ, оскільки було показано, що дисфункція ЛШ незалежно прогнозує загибель плода.121 Оцінка положення дуги аорти при ТФ або СВКЛА є важливою, оскільки це може сприяти компресії дихальних шляхів, якщо гілка легеневої артерії іпсилатерально від дуги є аневризматичною.
Ключові моменти
- Слід проводити серійну оцінку клапанної регургітації, оскільки вона може погіршуватися з прогресуванням вагітності.
- Прогресуюча кардіомегалія є поширеною ознакою вади серця плода, що асоціюється зі значною АВ та напівмісяцевою клапанною регургітацією.
- При тяжкій аномалії Ебштейна або тяжкій дисплазії ТК слід проводити PW та/або CW доплерографічне дослідження трикуспідального струменя регургітації як показник функції ЛШ, оскільки він може бути використаний для прогнозування клінічного результату.
- Оцінка положення серця при ТФ з СВКЛА повинна виконуватися, враховуючи, що аномальна вісь внаслідок сегментарного защемлення легеневої рідини може бути пов’язана зі значною обструкцією дихальних шляхів після народження і може бути використана для прогнозування результату.
Зображення 29 Аномалія Ебштейна та дисплазія ТК у плода. (А) У цього плода виражена трикуспідальна регургітація асоціюється з прогресуючою кардіомегалією, особливо дилатацією правого передсердя (RA), як показано на цих серійних зображеннях у 19, а потім 34 тижні, і може бути пов’язана з розвитком серцевої недостатності/гідропсії. (B-D) Зображення плода з тяжкою аномалією Ебштейна, що демонструє виражену кардіомегалію на чотирикамерному зрізі. (С) Широкий струмінь трикуспідальної регургітації (стрілка) у сагітальній проекції, причому струмінь регургітації починається значно нижче кільця ТК і навіть у напрямку до вихідного тракту RV через зміщення стулок перегородки. Також спостерігалась безперервна легенева регургітація за даними кольорової та CW доплерографії. (D) Останнє свідчить про те, що правий шлуночок не здатен генерувати достатній тиск для відкриття легеневого клапана.
V. Ізольовані аномалії дуги. З введенням 3СЗ та 3СТ зрізів в акушерсько-анатомічні ультразвукові протоколи за останні 10 років збільшилась кількість направлень з підозрою на аномалії магістральної артерії та дуги, незважаючи на те, що в інших випадках чотирикамерна оцінка та оцінка вихідного тракту виглядають нормально.135 Зокрема, 3СТ зріз має характерний вигляд з двома однаковими за розміром дугами, що утворюють літеру “V” зліва від трахеї (Зображення 6D і E). Невідповідність розмірів, аномальний напрямок кровотоку, U-подібна форма та розділення ВПВ і трахеї однією або двома проміжними дугами вкажуть експерту на такі патології, як коарктація, аневризма протоки, права дуга аорти та судинні кільця, включаючи подвійну дугу аорти та праву дугу аорти з лівою артеріальною протокою з аберантною підключичною артерією або без неї (Зображення 30).
Зображення 30 Ізольовані аномалії дуги. (А) Нормальне серце у віці 13 тижнів, з 2D зображенням (праворуч) та додатковим значенням силової доплерографії (ліворуч) для візуалізації “V” зліва від ВПВ та трахеї. (B) Права дуга аорти з лівою артеріальною протокою. (С) Ізольована аберантна права підключична артерія, що проходить позаду стравоходу, більш чітко видно при кольоровій доплерографії. (D) Ізольовану коарктацію запідозрили, коли поперечна аорта виявилася меншою за дугу протоки. (E) Аневризма протоки (зірочка) в третьому триместрі. (F) Подвійна дуга аорти з трьома “дугами”, які візуалізуються у трьох дещо різних площинах: дуга протоки (DA), дуга лівої аорти (LAA) та дуга правої аорти (RAA). Права дуга аорти є домінуючою. (G) Ще один приклад подвійної дуги аорти з кольоровою доплерографією, що показує дві дуги аорти, які оточують трахею та стравохід (стрілка), а також потік у непарній вені червоного кольору, який проходить попереду обох дуг у напрямку до ВПВ праворуч.
Загальний підхід до візуалізації. Припускаючи, що внутрішньосерцеві аномалії виключені, візуалізація є простою. Поєднання аксіальної, сагітальної та парасагітальної візуалізації з 2D і кольоровим доплерівським скануванням для відстеження ходу дуги протоки та аорти з увагою до витоків судин голови та верхніх кінцівок дозволить поставити правильний діагноз. Використання кольорового та енергетичного доплера в 3СТ зрізі допомагає виявити аберантну підключичну артерію, ретроградний потік в судинах або антеградний потік в меншій з двох дуг при подвійній аортальній дузі. На цьому зрізі також можна розпізнати перев’язку легеневої артерії; хоча перев’язка не є судинним кільцем, у таких пацієнтів можуть бути аномалії дихальних шляхів, включаючи кільця трахеї, і розродження повинно відбуватися у відповідних умовах, щоб забезпечити можливість проведення допоміжної вентиляції, якщо це буде необхідно.
Ключові моменти
- Латеральність (однобічність) дуги аорти та протоки повинна бути задокументована в рамках кожного ехокардіографічного дослідження плода.
- Судинну анатомію слід оцінювати у 3СТ зрізі, враховуючи, що судинні кільця, перев’язки та права дуга аорти легко виявляються під час ехокардіографії плода.
- Слід спробувати діагностувати аберантне походження підключичної артерії, особливо якщо є підозра на аномалію латеральної дуги аорти.
D. Оцінка ризику на основі візуалізації та планування розродження при вагітності з вадами серця плода
Ехокардіографічна діагностика плода займає центральне місце в наданні допомоги плодам з ВВС, порушеннями серцевого ритму або функції, оскільки вона дає можливість провести повне пренатальне консультування сім’ї, організувати психосоціальну підтримку, надати комплексну перинатальну допомогу та координувати планування пологів. Після встановлення діагнозу ВВС фетальний кардіолог повинен співпрацювати з акушером(ами) для визначення наслідків для плода та вагітної протягом решти терміну вагітності та необхідності подальших візитів, а також очікуваного рівня неонатального догляду.136 Залежно від типу та тяжкості серцевої патології плода може бути доцільним проведення серійних ехокардіографічних досліджень плода з метою оцінки змін у стані плода та надання рекомендацій щодо передбачуваного постнатального ведення.137,138 У Таблицях 14 та 15 детально описані різні ситуації, в яких рекомендується проведення серійних ехокардіографічних досліджень плода через ризик прогресування ВВС. Існують певні форми критичних ВВС, які потребують кардіологічного втручання одразу після народження, щоб зменшити ризик неонатальної смерті та/або тяжких ускладнень. Для кращого інформування медичної бригади про рівень ризику та координації належного та швидкого післяпологового догляду за такими пацієнтами рекомендується використовувати системи стратифікації ризику на основі зображень у поєднанні з планами надання допомоги при пренатально діагностованій ВВС.2 Хоча встановлення детального пренатального діагнозу є ключовим, саме скоординований перинатальний план лікування має найбільший потенціал впливу на результати лікування цих пацієнтів. Залишаються прогалини у здатності ехокардіографії плода прогнозувати необхідність негайного постнатального втручання при таких ураженнях, як d-ТМА з рестриктивною міжпередсердною перегородкою.139,140 Вивчалося додаткове використання тестування материнської гіпоксії для моделювання постнатальної фізіології, однак дані поки що є неповними. Магнітно-резонансну томографію плода можна проводити для вимірювання об’ємів легень або затримки рідини при ТФ з відсутнім легеневим клапаном, або для оцінки ознак лімфангіоектазів при СГЛВС з рестриктивною або інтактною міжпередсердною перегородкою або утрудненим тотальним аномальним легеневим венозним поверненням. Це може бути корисним для прогнозування результату та планування.141,142
Ключові моменти
- Після встановлення діагнозу ВВС плода медичні працівники, які надають допомогу матері, плоду та новонародженому, повинні працювати разом, щоб визначити наслідки для плода та вагітної протягом решти вагітності та перинатального/неонатального періоду.
- Серійне ехокардіографічне спостереження за станом плода для оцінки змін у стані плода та рекомендацій щодо очікуваного постнатального ведення показане при певних кардіологічних діагнозах, пов’язаних з ризиком постнатального гемодинамічної компрометації.
- Стратифікація ризику на основі ехокардіографії плода може бути використана для полегшення комунікації та стандартизації клінічного підходу до перинатального ведення вагітної та плода.
Таблиця 15 Рекомендації щодо оцінки ризику на основі візуалізації та подальшої візуалізації при конкретних діагнозах ВВС.
| Показання до проведення ехокардіографії плода | Запропонований моніторинг | Ключові результати ехокардіографічної візуалізації плода для оцінки | Приклад діагнозу |
| ВВС плода в групі ризику ЗСН | Кожні 2-4 тижні | Комплексна оцінка серцевої функції* | СГЛВС з МР, тетрада з відсутнім легеневим клапаном, аномалія Ебштейна, ДАВП з АВ-клапанною регургітацією, пухлини серця |
| ВВС плода з ризиком аритмії | Кожні 2-4 тижні | Документування темпу та ритму | Синдром подовженого інтервалу QT, l-ТМА, ІЛП |
| Екстракардіальна аномалія плода в групі ризику при гідропсії | Кожні 2-4 тижні | Комплексна оцінка серцевої функції* | ВЛДШ, ККТ, ФФТС, артеріовенозна мальформація ЗАПБ, анемія |
| Плід у групі ризику постнатального ціанозу | Кожні 4-8 тижні + кінець третього триместру | Екскурсія міжпередсердної перегородки та відкриття передсердно-шлуночкового отвору, картина шунтування проток, розглянути можливість проведення тесту на гіпоксію матері | d-ТМА/IVS, d-ТМА, ДМШП, ДСПШ з субпульмональним ДМШП, ТФ |
| Плід з ризиком постнатальної легеневої венозної обструкції | Кожні 4-8 тижні + кінець третього триместру | Доплерівське співвідношення прямого/зворотного ІШП; положення та товщина міжпередсердної перегородки, пікова швидкість та форма хвилі доплерографії вертикальної вени, розглянути можливість проведення тесту на гіпоксію у матері. | СГЛВС/РПП, обструкція TAPVR, трьохпередсердне серце |
| Тахікардія плода | Кожні 2 тижні, якщо немає належного контролю | Оцініть частоту та ритм серцевих скорочень, розмір серця, гідропсії, ЗСН | Тріпотіння передсердь, НШТ |
| Плід піддається ризику постнатального респіраторного компромісу | Кожні 4-8 тижні + кінець третього триместру | Зсув середостіння, співвідношення серцево-грудної площі, функція ПШ та ЛШ, Розгляньте МРТ плода для оцінки легень | Тетрада з відсутнім легеневим клапаном, аномалією Ебштейна, СГЛВС/РПП |
| Ризик АВ-блокади плода (l-ТМА, ІЛП, інше) | Кожні 2-4 тижні | Оцінити АВ-інтервал плода, частоту серцевих скорочень плода (передсердь та шлуночків), гідропсію, екстракардіальну доплерографію | АВ-блокада першого ступеня; АВ-блокада другого та третього ступеня |
| Пост-КВП при АС плода | Третій триместр, кожні 4 тижні | Оцінити аортальний відтік, напрямок потоку дуги, швидкість і напрямок потоку міжпередсердної перегородки, розмір і функцію лівого шлуночка, мітральну регургітацію, яскравість ендокардіальної ехокардіограми | Тяжкий АС з прогресуючим перебігом СГЛВС |
| Пост-КВП для СГЛВС/РПП | Третій триместр, кожні 4 тижні | Оцінити прохідність передсердно-шлуночкового сполучення, доплерографія легеневої вени пряма/зворотна ІШП | СГЛВС/РПП |
АС, аортальний стеноз; ДАВП, дефект атріовентрикулярної перегородки; ВЛДШ, вроджена вада легеневих дихальних шляхів; ЗСН, застійна серцева недостатність; ДСПШ, двостулковий правий шлуночок; КВП, кардіохірургічне втручання у плода; ІЛП, ізомерія лівого передсердя; МР, мітральна регургітація; РПП, рестриктивна міжпередсердна перегородка; ККТ, крижово-куприкова тератома; НШТ, надшлуночкова тахікардія; TAPVR, тотальне аномальне легенево-венозне повернення; ФФТС, фето-фетальний трансфузійний синдром; ЗАПБ, зворотна артеріальна перфузія близнюків; ІШП, інтеграл лінійної швидкості потоку.
*Детальніше див. розділ “Оцінка функціональних порушень серця плода”.
V. ПІДСУМОК ТА ВИСНОВКИ
Ехокардіографія плода розвивалася протягом останніх чотирьох десятиліть і стала високочутливим і специфічним неінвазивним інструментом для виявлення, класифікації та оцінки ризику серцево-судинних захворювань плода. Стандарти візуалізації, звітності та передачі результатів тесту також еволюціонували. Цей документ містить доказові та консенсусні рекомендації щодо проведення ехокардіографії плода як у нормальному, так і в аномальному серці плода, а також для детальної оцінки структурних, функціональних та пов’язаних з ритмом аномалій. Хоча цей документ далеко не вичерпний, авторський колектив представив тут загальні рекомендації щодо того, що являє собою повне ехокардіографічне обстеження плода при наявності аномалій, які можуть бути використані як для студентів, так і для досвідчених лікарів-практиків.
ПОСИЛАННЯ НА ДЖЕРЕЛА
- Rychik J, Ayres N, Cuneo B, et al. American Society of Echocardiography guidelines and standards for performance of the fetal echocardiogram. J Am Soc Echocardiogr 2004;17:803-10.
- Donofrio MT, Moon-Grady AJ, Hornberger LK, et al. Diagnosis and treatment of fetal cardiac disease: a scientific statement from the American Heart Association. Circulation 2014;129:2183-242.
- International Society of Ultrasound in Obstetrics and Gynecology, Carvalho JS, Allan LD, Chaoui R, et al. ISUOG Practice Guidelines (updated): sonographic screening examination of the fetal heart. Ultrasound Obstet Gynecol 2013;41:348-59.
- AIUM practice parameter for the performance of fetal echocardiography. J Ultrasound Med 2020;39:E5-16.
- Pinto NM, Morris SA, Moon-Grady AJ, et al. Prenatal cardiac care: goals, priorities & gaps in knowledge in fetal cardiovascular disease: perspectives of the Fetal Heart Society. Prog Pediatr Cardiol 2020; 59:101312.
- Wang S, Yang L, Wang L, et al. Selective serotonin reuptake inhibitors (SSRIs) and the risk of congenital heart defects: a meta-analysis of prospective cohort studies. J Am Heart Assoc 2015;4:e001681.
- Melov SJ, Shetty PS, Pasupathy D, et al. Selective serotonin reuptake inhibitor or serotonin-norepinephrine reuptake inhibitors and epidemiological characteristics associated with prenatal diagnosis of congenital heart disease. Prenat Diagn 2021;41:35-42.
- Schaefer C, Hannemann D, Meister R, et al. Vitamin K antagonists and pregnancy outcome. A multi-centre prospective study. Thromb Haemost 2006;95:949-57.
- Society for Maternal-Fetal Medicine (SMFM), Norton ME, Chauhan SP, Dashe JS. Society for maternal-fetal medicine (SMFM) clinical guideline #7: nonimmune hydrops fetalis. Am J Obstet Gynecol 2015;212:127-39.
- Barris DM, Brailovschi Y, Shah A, et al. The role of fetal echocardiogram after detection of extracardiac anomalies in utero (fetal echocardiogram for extracardiac malformations). Prenat Diagn 2021;41:1134-9.
- Ghimire LV, Chou FS, Moon-Grady AJ. Risk of congenital heart disease is increased among newborns with non-cardiac congenital anomalies: survey-based analysis using 2016 Kids’ Inpatient Database. Ultrasound Obstet Gynecol 2021;57:841-2.
- Tai C, Conner T, Pevyandi S, et al. Prevalence of congenital heart disease in an isolated single umbilical artery is low at a tertiary referral center. J Ultrasound Med 2021;40:1729-30.
- Hoffman JIE, Kaplan S. The incidence of congenital heart disease. J Am Coll Cardiol 2002;39:1890-900.
- Bak GS, Shaffer BL, Madriago E, et al. Detection of fetal cardiac anomalies: cost-effectiveness of increased number of cardiac views. Ultrasound Obstet Gynecol 2020;55:758-67.
- AIUM practice parameter for the performance of detailed second- and third-trimester diagnostic obstetric ultrasound examinations. J Ultrasound Med 2019;38:3093-100.
- Li Y, Hua Y, Fang J, et al. Performance of different scan protocols of fetal echocardiography in the diagnosis of fetal congenital heart disease: a systematic review and meta-analysis. PLoS One 2013;8:e65484.
- Barker PCA, Lewin MB, Donofrio MT, et al. Specific considerations for pediatric, fetal, and congenital heart disease patients and echocardiography service providers during the 2019 Novel Coronavirus outbreak: Council on Pediatric and Congenital Heart Disease. J Am Soc Echocardiogr 2020;33:658-65.
- Odibo AO, Coassolo KM, Stamilio DM, et al. Should all pregnant diabetic women undergo a fetal echocardiography? A cost-effectiveness analysis comparing four screening strategies. Prenat Diagn 2006 Jan;26:39-44.
- Bernard LS, Ramos GA, Fines V, et al. Reducing the cost of detection of congenital heart disease in fetuses of women with pregestational diabetes mellitus. Ultrasound Obstet Gynecol 2009;33:676-82.
- Gekas J, Gagne G, Bujold E, et al. Comparison of different strategies in prenatal screening for Down’s syndrome: cost effectiveness analysis of computer simulation. BMJ 2009;338:b138.
- Cunningham GC, Tompkinison DG. Cost and effectiveness of the California triple marker prenatal screening program. Genet Med 1999;1: 199-206.
- Pinto NM, Nelson R, Puchalski M, et al. Cost-effectiveness of prenatal screening strategies for congenital heart disease. Ultrasound Obstet Gynecol 2014;44:50-7.
- Chung EH, Lim SL, Havrilesky LJ, et al. Cost-effectiveness of prenatal screening methods for congenital heart defects in pregnancies conceived by in-vitro fertilization. Ultrasound Obstet Gynecol 2021; 57:979-86.
- National Collaborating Centre for Women’s and Children’s Health (UK). Antenatal Care: Routine care for the healthy pregnant woman. London: RCOG Press; 2008.
- Simpson LL. Indications for fetal echocardiography from a tertiary-care obstetric sonography practice. J Clin Ultrasound 2004;32:123-8.
- Huggon IC, Ghi T, Cook AC, et al. Fetal cardiac abnormalities identified prior to 14 weeks’ gestation. Ultrasound Obstet Gynecol 2002;20:22-9.
- Zidere V, Bellsham-Revell H, Persico N, et al. Comparison of echocardiographic findings in fetuses at less than 15 weeks’ gestation with later cardiac evaluation. Ultrasound Obstet Gynecol 2013;42:679-86.
- AIUM practice parameter for documentation of an ultrasound examination. J Ultrasound Med 2020;39:E1-4.
- Abramowicz JS, Basseal JM, Brezinka C, et al. ISUOG Safety Committee Position Statement on use of personal protective equipment and hazard mitigation in relation to SARS-CoV-2 for practitioners undertaking obstetric and gynecological ultrasound. Ultrasound Obstet Gynecol 2020;55:886-91.
- Torloni MR, Vedmedovska N, Merialdi M, et al. Safety of ultrasonography in pregnancy: WHO systematic review of the literature and metaanalysis. Ultrasound Obstet Gynecol 2009 May;33:599-608.
- American Institute of Ultrasound in Medicine. Prudent use and safety of diagnostic ultrasound in pregnancy; 2020. Available at: https://www. aium.org/officialStatements/79. Accessed November 19, 2022.
- Nemescu D, Berescu A, Onofriescu M, et al. Safety indices during fetal echocardiography at the time of first-trimester scan are machine dependent. PLoS One 2015;10:e0127570.
- Semmler J, Day TG, Georgiopoulos G, et al. Fetal speckle-tracking: impact of angle of insonation and frame rate on global longitudinal strain. J Am Soc Echocardiogr 2020;33:1141-6.e2.
- Yagel S, Cohen SM, Achiron R. Examination of the fetal heart by five short-axis views: a proposed screening method for comprehensive cardiac evaluation. Ultrasound Obstet Gynecol 2001;17:367-9.
- DeVore GR. Computing the Z Score and centiles for cross-sectional analysis: a practical approach. J Ultrasound Med 2017;36:459-73.
- Lee W, Riggs T, Amula V, et al. Fetal echocardiography: z-score reference ranges for a large patient population. Ultrasound Obstet Gynecol 2010; 35:28-34.
- Schneider C, McCrindle BW, Carvalho JS, et al. Development of Z -scores for fetal cardiac dimensions from echocardiography. Ultrasound Obstet Gynecol 2005;26:599-605.
- McElhinney DB, Marshall AC, Wilkins-Haug LE, et al. Predictors of technical success and postnatal biventricular outcome after in utero aortic valvuloplasty for aortic stenosis with evolving hypoplastic left heart syndrome. Circulation 2009;120:1482-90.
- Krishnan A, Pike JI, McCarter R, et al. Predictive models for normal fetal cardiac structures. J Am Soc Echocardiogr 2016;29:1197-206.
- Gu X, Zhu H, Zhang Y, et al. Quantile score: a new reference system for quantitative fetal echocardiography based on a large multicenter study. J Am Soc Echocardiogr 2019;32:296-302.e5.
- Vigneswaran TV, Akolekar R, Syngelaki A, et al. Reference ranges for the size of the fetal cardiac outflow tracts from 13 to 36 weeks gestation: a single-center study of over 7000 cases. Circ Cardiovasc Imaging 2018; 11:e007575.
- Chiba Y, Kanzaki T, Kobayashi H, et al. Evaluation of fetal structural heart disease using color flow mapping. Ultrasound Med Biol 1990;16:221-9.
- Abuhamad A, Chaoui R. A Practical Guide to Fetal Echocardiography: Normal and Abnormal Hearts. Fourth Edition. Philadelphia: Lippincott-Williams & Wilkins; 2016.
- Heling KS, Chaoui R, Bollmann R. Advanced dynamic flow – a new method of vascular imaging in prenatal medicine. A pilot study of its applicability. Ultraschall Med 2004;25:280-4.
- Huisman TW, Stewart PA, Wladimiroff JW, et al. Flow velocity waveforms in the ductus venosus, umbilical vein and inferior vena cava in normal human fetuses at 12-15 weeks of gestation. Ultrasound Med Biol 1993;19:441-5.
- Carceller-Blanchard AM, Fouron JC. Determinants of the Doppler flow velocity profile through the mitral valve of the human fetus. Br Heart J 1993;70:457-60.
- Paladini D, Palmieri S, Celentano E, et al. Pulmonary venous blood flow in the human fetus. Ultrasound Obstet Gynecol 1997;10:27-31.
- Mielke G, Benda N. Blood flow velocity waveforms of the fetal pulmonary artery and the ductus arteriosus: reference ranges from 13 weeks to term. Ultrasound Obstet Gynecol 2000;15:213-8.
- Fouron JC. The unrecognized physiological and clinical significance of the fetal aortic isthmus. Ultrasound Obstet Gynecol 2003;22:441-7.
- Bhide A, Acharya G, Baschat A, et al. ISUOG Practice Guidelines (updated): use of Doppler velocimetry in obstetrics. Ultrasound Obstet Gynecol 2021;58:331-9.
- Yamamoto Y, Hornberger LK. Progression of outflow tract obstruction in the fetus. Early Hum Dev 2012;88:279-85.
- Cordes TM, O’Leary PW, Seward JB, et al. Distinguishing right from left: a standardized technique for fetal echocardiography. J Am Soc Echocardiogr 1994;7:47-53.
- Gonc¸alves LF, Lee W, Chaiworapongsa T, et al. Four-dimensional ultrasonography of the fetal heart with spatiotemporal image correlation. Am J Obstet Gynecol 2003;189:1792-802.
- Wang Y, Fan M, Siddiqui FA, et al. Strategies for accurate diagnosis of fetal aortic arch anomalies: benefits of three-dimensional sonography with spatiotemporal image correlation and a novel algorithm for volume analysis. J Am Soc Echocardiogr 2018;31:1238-51.
- Patey O, Carvalho JS, Thilaganathan B. Intervendor discordance of fetal and neonatal myocardial tissue Doppler and speckle-tracking measurements. J Am Soc Echocardiogr 2019;32:1339-49.e23.
- DeVore GR, Polanco B, Satou G, et al. Two-dimensional speckle tracking of the fetal heart: a practical step-by-step approach for the fetal sonologist. J Ultrasound Med 2016;35:1765-81.
- Clur SAB, Bilardo CM. Early detection of fetal cardiac abnormalities: how effective is it and how should we manage these patients? Prenat Diagn 2014;34:1235-45.
- McBrien A, Hornberger LK. Early fetal echocardiography. Birth Defects Res 2019;111:370-9.
- Wiechec M, Knafel A, Nocun A. Prenatal detection of congenital heart defects at the 11- to 13-week scan using a simple color Doppler protocol including the 4-chamber and 3-vessel and trachea views. J Ultrasound Med 2015;34:585-94.
- Quarello E, Lafouge A, Fries N, et al. Basic heart examination: feasibility study of first-trimester systematic simplified fetal echocardiography. Ultrasound Obstet Gynecol 2017;49:224-30.
- American Institute of Ultrasound in Medicine. Medical Ultrasound Safety. Laurel, Maryland; 2020. Available at: http://aium.s3.amazonaws.com/ resourceLibrary/mus4.pdf. Accessed November 17, 2022.
- Salvesen K, Lees C, Abramowicz J, et al. ISUOG statement on the safe use of Doppler in the 11 to 13 +6-week fetal ultrasound examination. Ultrasound Obstet Gynecol 2011;37:628.
- Hutchinson D, McBrien A, Howley L, et al. First-trimester fetal echocardiography: identification of cardiac structures for screening from 6 to 13 Weeks’ gestational age. J Am Soc Echocardiogr 2017;30:763-72.
- Carvalho JS, Moscoso G, Tekay A, et al. Clinical impact of first and early second trimester fetal echocardiography on high risk pregnancies. Heart 2004;90:921-6.
- Zidere V, Vigneswaran TV, Syngelaki A, et al. Reference ranges for pulsedwave Doppler of the fetal cardiac inflow and outflow tracts from 13 to 36 weeks’ gestation. J Am Soc Echocardiogr 2021;34:1007-16.e10.
- Mitchell JL, Cuneo BF, Etheridge SP, et al. Fetal heart rate predictors of long QT syndrome. Circulation 2012;126:2688-95.
- Friedman DM, Kim MY, Copel JA, et al. Utility of cardiac monitoring in fetuses at risk for congenital heart block: the PR Interval and Dexamethasone Evaluation (PRIDE) prospective study. Circulation 2008;117:485-93.
- Clur SAB, Vink AS, Etheridge SP, et al. Left ventricular isovolumetric relaxation time is prolonged in fetal Long-QT Syndrome. Circ Arrhythm Electrophysiol 2018;11:e005797.
- Sonesson SE, Eliasson H, Conner P, et al. Doppler echocardiographic isovolumetric time intervals in diagnosis of fetal blocked atrial bigeminy and 2:1 atrioventricular block. Ultrasound Obstet Gynecol 2014;44: 171-5.
- Cuneo BF, Strasburger JF, Yu S, et al. In utero diagnosis of long QT syndrome by magnetocardiography. Circulation 2013;128:2183-91.
- Jaeggi ET, Carvalho JS, De Groot E, et al. Comparison of transplacental treatment of fetal supraventricular tachyarrhythmias with digoxin, flecainide, and sotalol: results of a nonrandomized multicenter study. Circulation 2011;124:1747-54.
- Krapp M, Kohl T, Simpson JM, et al. Review of diagnosis, treatment, and outcome of fetal atrial flutter compared with supraventricular tachycardia. Heart 2003;89:913-7.
- Byrne FA, Lee H, Kipps AK, et al. Echocardiographic risk stratification of fetuses with sacrococcygeal teratoma and twin-reversed arterial perfusion. Fetal Diagn Ther 2011;30:280-8.
- Statile CJ, Cnota JF, Gomien S, et al. Estimated cardiac output and cardiovascular profile score in fetuses with high cardiac output lesions. Ultrasound Obstet Gynecol 2013;41:54-8.
- Derderian SC, Jeanty C, Fleck SR, et al. The many faces of hydrops. J Pediatr Surg 2015;50:50-4; discussion 54.
- Flood K, Unterscheider J, Daly S, et al. The role of brain sparing in the prediction of adverse outcomes in intrauterine growth restriction: results of the multicenter PORTO Study. Am J Obstet Gynecol 2014;211: 288.e1-5.
- Duke C, Sharland GK, Jones AM, et al. Echocardiographic features and outcome of truncus arteriosus diagnosed during fetal life. Am J Cardiol 2001;88:1379-84.
- Votava-Smith JK, Habli M, Cnota JF, et al. Diastolic dysfunction and cerebrovascular redistribution precede overt recipient twin cardiomyopathy in early-stage twin-twin transfusion syndrome. J Am Soc Echocardiogr 2015;28:533-40.
- Moon-Grady AJ, Rand L, Gallardo S, et al. Diastolic cardiac pathology and clinical twin-twin transfusion syndrome in monochorionic/diamniotic twins. Am J Obstet Gynecol 2011;205:279.e1-11.
- Mahle WT, Rychik J, Tian ZY, et al. Echocardiographic evaluation of the fetus with congenital cystic adenomatoid malformation. Ultrasound Obstet Gynecol 2000;16:620-4.
- Vogel M, McElhinney DB, Marcus E, et al. Significance and outcome of left heart hypoplasia in fetal congenital diaphragmatic hernia. Ultrasound Obstet Gynecol 2010;35:310-7.
- Byrne FA, Keller RL, Meadows J, et al. Severe left diaphragmatic hernia limits size of fetal left heart more than does right diaphragmatic hernia. Ultrasound Obstet Gynecol 2015;46:688-94.
- Hofstaetter C, Hansmann M, Eik-Nes SH, et al. A cardiovascular profile score in the surveillance of fetal hydrops. J Matern Fetal Neonatal Med 2006;19:407-13.
- Rasanen J, Wood DC, Weiner S, et al. Role of the pulmonary circulation in the distribution of human fetal cardiac output during the second half of pregnancy. Circulation 1996;94:1068-73.
- Mielke G, Benda N. Cardiac output and central distribution of blood flow in the human fetus. Circulation 2001;103:1662-8.
- Harada K, Tsuda A, Orino T, et al. Tissue Doppler imaging in the normal fetus. Int J Cardiol 1999;71:227-34.
- Chan LY, Fok WY, Wong JT, et al. Reference charts of gestation-specific tissue Doppler imaging indices of systolic and diastolic functions in the normal fetal heart. Am Heart J 2005;150:750-5.
- M€akikallio K, R€as€anen J, M€akikallio T, et al. Human fetal cardiovascular profile score and neonatal outcome in intrauterine growth restriction. Ultrasound Obstet Gynecol 2008;31:48-54.
- Huhta JC. Fetal congestive heart failure. Semin Fetal Neonatal Med 2005;10:542-52.
- Shah AD, Border WL, Crombleholme TM, et al. Initial fetal cardiovascular profile score predicts recipient twin outcome in twin-twin transfusion syndrome. J Am Soc Echocardiogr 2008;21:1105-8.
- Peyvandi S, Feldstein VA, Hirose S, et al. Twin-reversed arterial perfusion sequence associated with decreased fetal cerebral vascular impedance. Ultrasound Obstet Gynecol 2015;45:447-51.
- Mari G, Adrignolo A, Abuhamad AZ, et al. Diagnosis of fetal anemia with Doppler ultrasound in the pregnancy complicated by maternal blood group immunization. Ultrasound Obstet Gynecol 1995;5: 400-5.
- Krishnan A, Jacobs MB, Morris SA, et al. Impact of socioeconomic status, race and ethnicity, and geography on prenatal detection of hypoplastic left heart syndrome and transposition of the great arteries. Circulation 2021;143:2049-60.
- Hancock HS, Romano JC, Armstrong A, et al. Single ventricle and total anomalous pulmonary venous connection: implications of prenatal diagnosis. World J Pediatr Congenit Heart Surg 2018;9:434-9.
- Szwast A, Tian Z, McCann M, et al. Vasoreactive response to maternal hyperoxygenation in the fetus with hypoplastic left heart syndrome. Circ Cardiovasc Imaging 2010;3:172-8.
- Cohen MS, Jegatheeswaran A, Baffa JM, et al. Echocardiographic features defining right dominant unbalanced atrioventricular septal defect: a multi-institutional Congenital Heart Surgeons’ Society study. Circ Cardiovasc Imaging 2013;6:508-13.
- Carvajal HG, Canter MW, Abarbanell AM, et al. Does ascending aorta size affect Norwood outcomes in hypoplastic left heart with aortic atresia? Ann Thorac Surg 2020;110:1651-8.
- Divanovic A, Hor K, Cnota J, et al. Prediction and perinatal management of severely restrictive atrial septum in fetuses with critical left heart obstruction: clinical experience using pulmonary venous Doppler analysis. J Thorac Cardiovasc Surg 2011;141:988-94.
- Shamszad P, Gospin TA, Hong BJ, et al. Impact of preoperative risk factors on outcomes after Norwood palliation for hypoplastic left heart syndrome. J Thorac Cardiovasc Surg 2014;147:897-901.
- Berning RA, Silverman NH, Villegas M, et al. Reversed shunting across the ductus arteriosus or atrial septum in utero heralds severe congenital heart disease. J Am Coll Cardiol 1996;27:481-6.
- Dyamenahalli U, Smallhorn JF, Geva T, et al. Isolated ductus arteriosus aneurysm in the fetus and infant: a multi-institutional experience. J Am Coll Cardiol 2000;36:262-9.
- Paladini D, Palmieri S, Lamberti A, et al. Characterization and natural history of ventricular septal defects in the fetus. Ultrasound Obstet Gynecol 2000;16:118-22.
- Axt-Fliedner R, Schwarze A, Smrcek J, et al. Isolated ventricular septal defects detected by color Doppler imaging: evolution during fetal and first year of postnatal life. Ultrasound Obstet Gynecol 2006;27:266-73.
- Peixoto AB, Bravo-Valenzuela NJ, Martins WP, et al. Reference ranges for the fetal mitral, tricuspid, and interventricular septum annular plane systolic excursions (mitral annular plane systolic excursion, tricuspid annular plane systolic excursion, and septum annular plane systolic excursion) between 20 and 36 + 6 weeks of gestation. J Perinat Med 2020;48: 601-8.
- Crispi F, Sepulveda-Swatson E, Cruz-Lemini M, et al. Feasibility and reproducibility of a standard protocol for 2D speckle tracking and tissue Doppler-based strain and strain rate analysis of the fetal heart. Fetal Diagn Ther 2012;32:96-108.
- Friedberg MK, Ursell PC, Silverman NH. Isomerism of the left atrial appendage associated with ventricular noncompaction. Am J Cardiol 2005;96:985-90.
- Huggon IC, Cook AC, Smeeton NC, et al. Atrioventricular septal defects diagnosed in fetal life: associated cardiac and extra-cardiac abnormalities and outcome. J Am Coll Cardiol 2000;36:593-601.
- Szwast AL, Marino BS, Rychik J, et al. Usefulness of left ventricular inflow index to predict successful biventricular repair in right-dominant unbalanced atrioventricular canal. Am J Cardiol 2011;107:103-9.
- Losada E, Moon-Grady AJ, Strohsnitter WC, et al. Anomalous mitral arcade in twin-twin transfusion syndrome. Circulation 2010;122: 1456-63.
- Layman TE, Edwards JE. Anomalous mitral arcade. A type of congenital mitral insufficiency. Circulation 1967;35:389-95.
- Pluchinotta FR, Teot LA, Sanders SP. Left ventricular aneurysm, aortic stenosis, and arcade mitral valve: coexistence of three rare congenital heart defects. Pediatr Cardiol 2012;33:1206-9.
- Bevilacqua M, Sanders SP, Van Praagh S, et al. Double-inlet single left ventricle: echocardiographic anatomy with emphasis on the morphology of the atrioventricular valves and ventricular septal defect. J Am Coll Cardiol 1991;18:559-68.
- Yang YL, Wang XF, Cheng TO, et al. Echocardiographic characteristics of the criss-cross heart. Int J Cardiol 2010;140:133-7.
- Apitz C, Webb GD, Redington AN. Tetralogy of Fallot. Lancet 2009;374: 1462-71.
- Rodenbarger A, Thorsson T, Stiver C, et al. Third trimester predictors of interventional timing and accuracy of fetal anticipatory guidance in tetralogy of Fallot: a multi-center study. Prenat Diagn 2020;40:870-7.
- Arya B, Levasseur SM, Woldu K, et al. Fetal echocardiographic measurements and the need for neonatal surgical intervention in Tetralogy of Fallot. Pediatr Cardiol 2014;35:810-6.
- Arunamata A, Balasubramanian S, Punn R, et al. Impact of fetal somatic growth on pulmonary valve annulus Z-Scores during gestation and through birth in patients with Tetralogy of Fallot. Pediatr Cardiol 2018;39:1181-7.
- Kwon EN, Parness IA, Srivastava S, et al. Subpulmonary stenosis assessed in midtrimester fetuses with tetralogy of Fallot: a novel method for predicting postnatal clinical outcome. Pediatr Cardiol 2013;34: 1314-20.
- Friedman K, Balasubramanian S, Tworetzky W. Midgestation fetal pulmonary annulus size is predictive of outcome in tetralogy of Fallot. Congenit Heart Dis 2014;9:187-93.
- Goldmuntz E. 22q11.2 deletion syndrome and congenital heart disease. Am J Med Genet C Semin Med Genet 2020;184:64-72.
- Chelliah A, Moon-Grady AJ, Peyvandi S, et al. Contemporary outcomes in tetralogy of Fallot with absent pulmonary valve after fetal diagnosis. J Am Heart Assoc 2021;10:e019713.
- Russell HM, Jacobs ML, Anderson RH, et al. A simplified categorization for common arterial trunk. J Thorac Cardiovasc Surg 2011;141:645-53.
- Krummholz A, Gottschalk I, Geipel A, et al. Prenatal diagnosis, associated findings and postnatal outcome in fetuses with congenitally corrected transposition of the great arteries. Arch Gynecol Obstet 2021;303:1469-81.
- Vorisek CN, Enzensberger C, Willomeit S, et al. Prenatal diagnosis and outcome of congenital corrected transposition of the great arteries – a multicenter report of 69 cases. Ultraschall Med 2021;42:291-6.
- Hornberger LK, Sanders SP, Rein AJ, et al. Left heart obstructive lesions and left ventricular growth in the midtrimester fetus. A longitudinal study. Circulation 1995;92:1531-8.
- Gardiner HM, Kovacevic A, Tulzer G, et al. Natural history of 107 cases of fetal aortic stenosis from a European multicenter retrospective study. Ultrasound Obstet Gynecol 2016;48:373-81.
- Vogel M, McElhinney DB, Wilkins-Haug LE, et al. Aortic stenosis and severe mitral regurgitation in the fetus resulting in giant left atrium and hydrops: pathophysiology, outcomes, and preliminary experience with pre-natal cardiac intervention. J Am Coll Cardiol 2011;57: 348-55.
- Eckersley LG, Howley LW, van der Velde ME, et al. Quantitative assessment of left ventricular dysfunction in fetal Ebstein’s anomaly and tricuspid valve dysplasia. J Am Soc Echocardiogr 2019;32:1598-607.
- Nathan AT, Marino BS, Dominguez T, et al. Tricuspid valve dysplasia with severe tricuspid regurgitation: fetal pulmonary artery size predicts lung viability in the presence of small lung volumes. Fetal Diagn Ther 2010;27:101-5.
- Selamet Tierney ES, McElhinney DB, Freud LR, et al. Assessment of progressive pathophysiology after early prenatal diagnosis of the Ebstein anomaly or tricuspid valve dysplasia. Am J Cardiol 2017; 119:106-11.
- Hornberger LK, Sahn DJ, Kleinman CS, et al. Tricuspid valve disease with significant tricuspid insufficiency in the fetus: diagnosis and outcome. J Am Coll Cardiol 1991;17:167-73.
- Taketazu M, Barrea C, Smallhorn JF, et al. Intrauterine pulmonary venous flow and restrictive foramen ovale in fetal hypoplastic left heart syndrome. J Am Coll Cardiol 2004;43:1902-7.
- Maeno YV, Boutin C, Hornberger LK, et al. Prenatal diagnosis of right ventricular outflow tract obstruction with intact ventricular septum, and detection of ventriculocoronary connections. Heart 1999;81:661-8.
- Sun HY, Boe J, Rubesova E, et al. Fetal MRI correlates with postnatal CT angiogram assessment of pulmonary anatomy in tetralogy of Fallot with absent pulmonary valve. Congenit Heart Dis 2014;9:E105-9.
- Jain S, Kleiner B, Moon-Grady A, et al. Prenatal diagnosis of vascular rings. J Ultrasound Med 2010;29:287-94.
- American Academy of Pediatrics Committee on Fetus And Newborn. Levels of neonatal care. Pediatrics 2012;130:587-97.
- Donofrio MT, Skurow-Todd K, Berger JT, et al. Risk-stratified postnatal care of newborns with congenital heart disease determined by fetal echocardiography. J Am Soc Echocardiogr 2015;28:1339-49.
- Sanapo L, Pruetz JD, S1odki M, et al. Fetal echocardiography for planning perinatal and delivery room care of neonates with congenital heart disease. Echocardiography 2017;34:1804-21.
- Patey O, Carvalho JS, Thilaganathan B. Urgent neonatal balloon atrial septostomy in simple transposition of the great arteries: predictive value of fetal cardiac parameters. Ultrasound Obstet Gynecol 2021;57:756-68.
- Punn R, Silverman NH. Fetal predictors of urgent balloon atrial septostomy in neonates with complete transposition. J Am Soc Echocardiogr 2011;24:425-30.
- Chelliah A, Berger JT, Blask A, et al. Clinical utility of fetal magnetic resonance imaging in tetralogy of Fallot with absent pulmonary valve. Circulation 2013;127:757-9. \
- Barrera CA, Johnson AM, Rychik J, et al. Prognostic value of the nutmeg lung pattern/lymphangiectasia on fetal magnetic resonance imaging. Pediatr Radiol 2021;51:1809-17.
- Mekjarasnapha M, Traisrisilp K, Luewan S, et al. Reference ranges for fetal septum primum excursion from 14 to 40 weeks’ gestation. J Ultrasound Med 2013;32:1729-34.