Автори: Hideyuki Shiomi, Arata Sakai, Ryota Nakano, Shogo Ota, Takashi Kobayashi, Atsuhiro Masuda, Hiroko Iijima
Зміст:
- ВСТУП
- СИНДРОМ ПРИВІДНОЇ ПЕТЛІ
- Показання до ЕУЗД-ГЕС у пацієнтів із СПП
- Техніка ЕУЗД-ГЕС при СПП
- Клінічні результати ЕУЗД-ГЕС у пацієнтів із СПП
- Порівняння з іншими менш інвазивними паліативними методами лікування
- ВИСНОВКИ
ВСТУП
Синдром привідної петлі (СПП) є пізнім ускладненням процедур Більрот II та інших гастроеюноанастомозів і визначається як механічна обструкція привідних петель.
Він може бути класифікований як доброякісний чи злоякісний залежно від причини непрохідності. Захворюваність на доброякісний СПП, мабуть, знизилася з досягненнями в хірургії, тоді як захворюваність на злоякісний збільшилася, незважаючи на досягнення в хіміотерапії. Можуть виникнути холангіт, панкреатит та перфорація через підвищений внутрішньопросвітний тиск, що призводять до швидко прогресуючого та тяжкого захворювання, що потребує негайного лікування. Широко застосовується хірургічне лікування; тим не менш, воно здається небажаним для пацієнтів із занедбаними онкологічними захворюваннями, оскільки може викликати подальшу захворюваність та смертність через затримку або переривання онкологічного лікування.
Таким чином, пацієнти з поганим станом та обмеженим прогнозом, як правило, віддають перевагу менш інвазивним методам лікування. У недавніх дослідженнях повідомлялося про ефективність ендоскопічного ентерального саморозширюваного металевого стента (SEMS) як альтернативу хірургічному лікуванню. Однак, потенційні обмеження включають відносно високу частоту повторних втручань і складне розміщення SEMS у випадках довгих стриктур або кутовидних аферентних петель.
Останнім часом були розроблені різні методи терапевтичного ендоскопічного ультразвуку (ЕУЗД), які зробили значний внесок у лікування панкреатобіліарних захворювань. Гастроентеростомія під контролем ЕУЗД (ЕУЗД-ГЕС), терапевтична модальність ЕУЗД, привернула увагу як мінімально інвазивний метод лікування вихідної обструкції шлунка. Це інноваційна техніка шунтування, яка включає розгортання металевого стента без проходження через стриктуру кишечника з використанням металевого стенту, що збігається з просвітом (LAMS), що ще більше підвищило ефективність і безпеку. Однак дані про ЕУЗД-ГЕС при СПП залишаються обмеженими. У цій оглядовій статті ми представляємо огляд ЕУЗД-ГЕС на лікування СПП, особливо злоякісного.
СИНДРОМ ПРИВІДНОЇ ПЕТЛІ
Привідна петля являє собою сегмент тонкої кишки, розташований проксимальніше місця гастроєюноанастомоза або єюноєюноанастомоза після гастректомії з реконструкцією по Більрот II або Roux-en-Y та операцією Віппла; він складається з дистального відділу дванадцятипалої кишки або проксимального відділу худої кишки, також відомого як аферентна петля.
СПП визначається як механічна обструкція аферентної петлі. Етіологія механічної непрохідності наступна:
- післяопераційні спайки, внутрішні грижі, заворот та інвагінація,
- стеноз через виразку в місці гастроеюноанастомозу
- радіаційний ентерит петлі
- місцево-регіонарний рецидив раку
- ентероліти, безоари та сторонні тіла, що потрапили в аферентну петлю
Симптоми СПП пов’язані з підвищенням внутрішньопросвітного тиску через накопичення жовчних, панкреатичних та ентеральних секретів у замкнутому контурі після часткової та повної обструкції аферентних петель. Основними симптомами є здуття живота, біль у верхній частині живота, нудота та блювання через дилатацію. Крім того, порушується відтік панкреатичного соку та жовчі, що призводить до розвитку панкреатиту та висхідного холангіту.
Повідомлялося, що пацієнти, які перенесли операцію Віппла, більш сприйнятливі до панкреатобіліарних симптомів через втрату папілярної функції. У важких випадках здуття кишечника та ішемія можуть призвести до некрозу кишечника, перфорації та перитоніту, що в подальшому призводить до розвитку сепсису через транслокацію бактерій, що розрослися, в системний кровотік. Тому необхідна рання діагностика та лікування до того, як захворювання стане тяжким.
Частота розвитку СПП після дистальної гастректомії з реконструкцією за Більротом II або Roux-en-Y коливається від 0,2% до 1,0%.
Лікування синдрому аферентної петлі:
- Черезшкірний дренаж
- Прямий черезшкірний дренаж
- Черезшкірний черезстравохідний жовчний дренаж
- Ендоскопічний дренаж
- Ендоскопічна балонна дилатація
- Ендоскопічна ентеральна установка пластикового стенту
- Ендоскопічна ентеральна установка металевого стенту
- Ендоскопічний дренаж під ультразвуковим контролем
- Ендоскопічна гастроентеростомія під ультразвуковим контролем
- Ендоскопічний біліарний дренаж під ультразвуковим контролем
Лікування СПП залежить від того, чи є причина обструкції доброякісною чи злоякісною. Якщо доброякісні ураження викликають СПП, хірургічне втручання вибирається як перший вибір для радикального лікування.
Якщо злоякісні новоутворення викликають СПП, як паліативний підхід вибирають дренування, оскільки радикальне хірургічне лікування неможливе, а стан хворого часто незадовільний. Черезшкірний черезпечінковий/транслюмінальний дренаж є основним методом лікування злоякісного СПП. Варіанти лікування включають черезшкірне черезпечінкове біліарне дренування (ЧЧБД) та пряме черезшкірне транслюмінальне дренування розширених аферентних петель. Ці методи лікування є мінімально інвазивними та підходять для лікування злоякісного СПП. Однак до недоліків можна віднести зниження якості життя через наявність зовнішньої нориці та ризик розвитку серйозних ускладнень, таких як бактеріємія на тлі висхідного холангіту, гемобілія, внутрішньочеревна кровотеча, біліарний перитоніт.
Нещодавні досягнення в галузі ендоскопічних втручань надали нові альтернативні терапевтичні можливості. Ендоскопічні підходи включають ентеральне розміщення подвійного пігтейлу чи металевого стенту або балонну дилатацію. У ретроспективному дослідженні Pannala et al., 15 з 24 (62%) хворих на злоякісне СПП після операції Уіппла з приводу раку підшлункової залози зазнали ендоскопічного втручання. Серед цих пацієнтів 11 (73%) мали успішні клінічні результати. Проте рецидив виник у 75% пацієнтів, яким було встановлено пластиковий стент, що зажадало ЧЧБД або черезшкірного біліарного стентування. Таким чином, при злоякісному СПП установка металевого стента краще, ніж балонна дилатація та встановлення пластикового стента, щоб уникнути рецидиву.
Нещодавно став доступний балонний ендоскоп (БЕ) з робочим каналом 3,2 мм, який дозволяє проводити ентеральне введення SEMS (саморозкривний металевий стент) з використанням ендоскопічного методу. Цей тип БЕ корисний для ентеральної установки SEMS, якщо звичайний ендоскоп не може досягти місця стенозу. Крім того, у разі оклюзії SEMS може бути додаткове розміщення SEMS. Таким чином, ентеральне розміщення SEMS з використанням БЕ з великим робочим каналом є ефективним, менш інвазивним та перспективним методом лікування злоякісного СПП і може стати першим вибором лікування. Тим не менш, ендоскопічне ентеральне розміщення SEMS через стриктуру іноді утруднене через довгий кишковий сегмент, довгий сегмент стриктури і гострий кут нахилу петлі. Потім для подолання цих обмежень необхідний альтернативний підхід до лікування злоякісного СПП.
Показання до ЕУЗД-ГЕС у пацієнтів із СПП
ЕУЗД-ГЕС включає створення обхідного шляху шляхом анастомозування шлунка та кишкових стінок з використанням стенту під контролем УЗД. Це може бути вигідно при лікуванні пацієнтів із злоякісним СПП, оскільки стент не проходить через ентеральну стриктуру.
Раніше виконувалася ЕУЗД-ГЕС із розміщенням стенту у вигляді косички; однак цей метод може супроводжуватися ускладненнями, такими як інтраопераційна та післяопераційна неспроможність. Тим не менш, нещодавня поява LAMS, що складаеться з повністю закритого металевого стента з двосторонніми фіксуючими фланцями, сприяла подальшому розвитку ЕУЗД-ГЕС, щоб стати безпечнішою та ефективнішою процедурою при СПП, з потенційно високим рівнем успіху та зниженим ризиком міграції стенту.
ЕУЗД-ГЕС можна виконувати, якщо відстань від датчика ЕУЗД до аферентних петель не перевищує 1 см. Однак він не показаний пацієнтам, які піддаються ендоскопічним процедурам, за наявності коагулопатії, проміжних судин та нестабільних станів. При асциті ЕУЗД-ГЕС може бути виконана у випадках з невеликою кількістю рідини, але її слід уникати при масивному асциті через погане формування свища, що може призвести до перитоніту та інфекції.
Техніка ЕУЗД-ГЕС при СПП
Для успішної ЕУЗД-ГЕС важливо точно оцінити розташування шлунка та аферентних петель, використовуючи аксіальні та корональні КТ зображення як орієнтири. Крім того, щоб уникнути ускладнень, слід перевірити колатеральні судини та асцит.
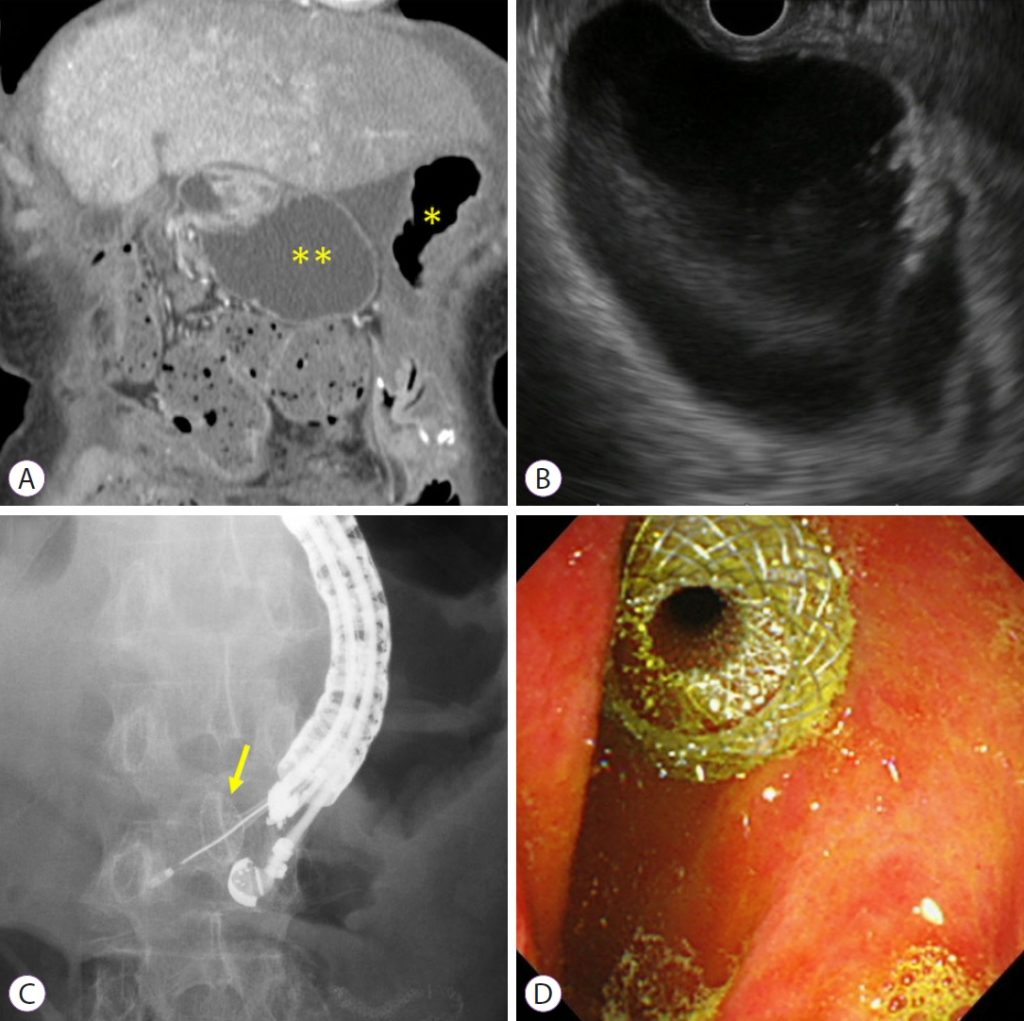
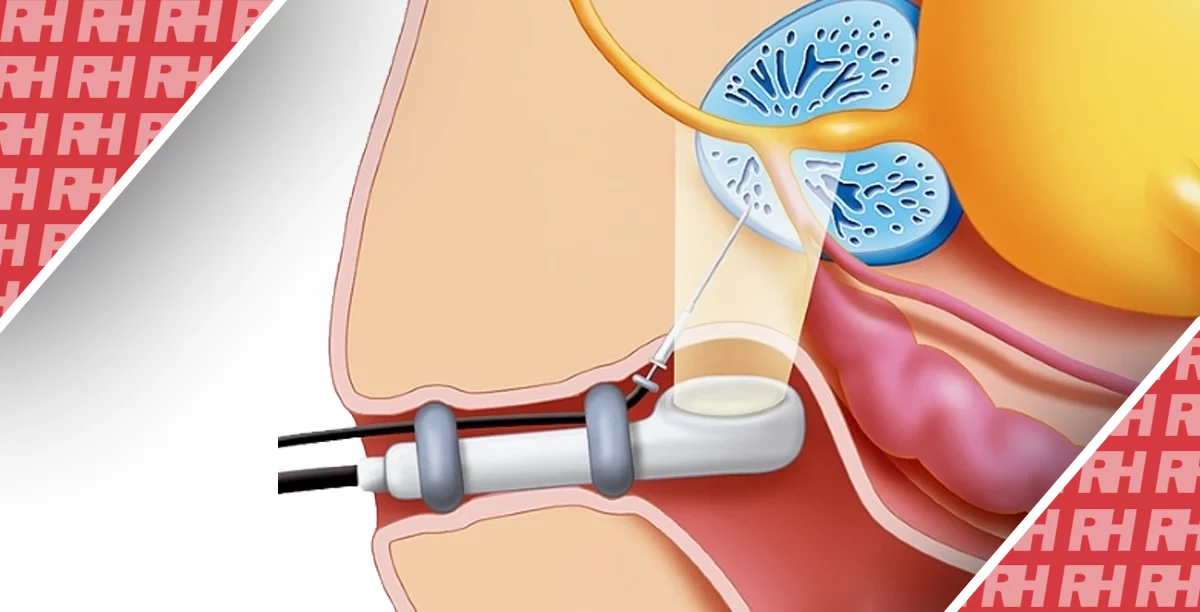
Під контролем ЕУЗД розширені аферентні петлі ідентифікуються зі шлунка. Якщо відстань від шлунка до аферентних петель оцінюється більш ніж на 1 см, процедуру слід припинити або перейти на альтернативне лікування, таке як ендоскопічне ентеральне стентування. Розширені аферентні петлі проколюють за допомогою голки 19-G. Контрастну речовину вводять через голку після аспірації вмісту. Потім у розширені привідні петлі, вводять жорсткий провідник діаметром 0,025 або 0,035 дюйма і фістулу розширюють за допомогою балонного катетера, механічних або електрокаутерних розширювачів. Нарешті LAMS розгортається від розширених аферентних петель до шлунка. Цей метод широко використовується як класична багатокрокова процедура. Нещодавно була розроблена LAMS з електрокаутерним посиленням (EC-LAMS), яка включає приєднання до припікаючого дроту на кінчику системи доставки. Він дозволяє виконувати пункцію, дилатацію та розгортання стенту за один крок, полегшуючи процедуру, скорочуючи її час та знижуючи ризики (зобр. 1).
Зображення 1: Ендоскопічна гастроентеростомія під ультразвуковим контролем. (A) Комп’ютерна томографія з контрастним посиленням показує, що розширення аферентних петель пов’язане з рецидивом раку підшлункової залози (*, шлунок; **, розширені аферентні петлі). (B) ЕУЗД показує розширення аферентних петель від шлунка. (C) Розширені аферентні петлі проколюються за допомогою EC-LAMS, а дистальний кінець потім розгортається під контролем ЕУЗД (жовта стрілка: дистальний кінець). (D) Проксимальний кінець розгорнутий під ендоскопічним зображенням. EC-LAMS, металевий стент, що примикає до просвіту за допомогою електрокоагуляції.
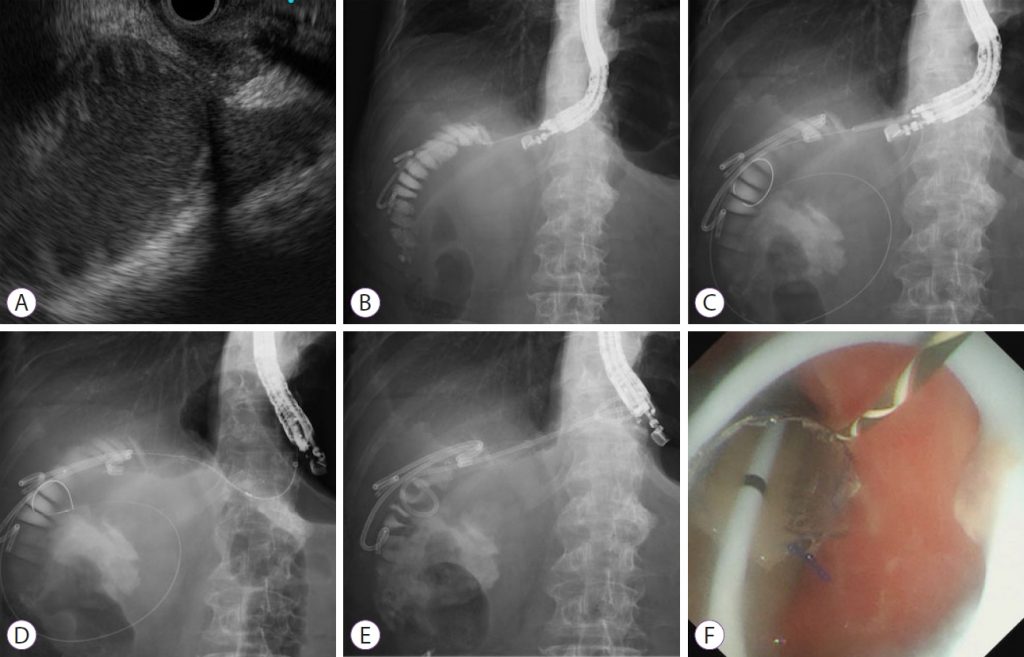
Перевага LAMS полягає у запобіганні міграції стенту та витоку рідини. Однак вони недоступні в багатьох країнах і коштують дорожче, ніж звичайні повністю покриті металеві стенти (FCSEMS), що саморозширюються. Шиомі та ін. розробили модифіковану стент-систему для запобігання міграції стенту та витоку рідини, аналогічну LAMS. Цей метод передбачає розгортання FCSEMS із функціями антиміграції; він складається з пластикового стенту з подвійною косичкою з великою петлею всередині FCSEMS (зобр. 2).
Зображення 2: Ендоскопічна гастроентеростомія під ультразвуковим контролем з використанням повністю закритого металевого стента, що саморозширюється, у поєднанні з великим петльовим стентом з подвійною косою. (A) На ендоскопічному ультразвуковому зображенні розширені аферентні петлі можна візуалізувати зі шлунка. (B) Розширені аферентні петлі проколюються за допомогою голки 19-G і вводиться контрастна речовина. (C) Провідник вводиться в аферентні петлі, і фістула розширюється балонним катетером. (D) Повністю покритий металевий стент, що саморозширюється, розгортається для дотику приводящих петель і шлунка. (E, F) Через повністю закритий металевий стент, що саморозширюється, вводять великий пластиковий стент з подвійною косою.
Клінічні результати ЕУЗД-ГЕС у пацієнтів із СПП
Звіти були знайдені в базі даних PubMed для англомовних досліджень з використанням наступних ключових слів: «синдром привідної петлі» і «ендоскопічна гастроентеростомія під ультразвуковим контролем»/«ендоскопічна гастроентеростомія під ультразвуковим контролем»/«ентероентеростомія під ендоскопічним ультразвуковим контролем».
Ми розглянули клінічні дані 35 пацієнтів, отримані з дев’яти тематичних досліджень та двох ретроспективних досліджень. Загальний технічний та клінічний успіх становив 100%. Частота небажаних явищ становила 11,4% (n=4), і чотири пацієнта відчували біль у животі (легка, n=3, помірна, n=1). Серйозних небажаних явищ, таких як кровотеча, перітоніт або перфорація, не спостерігалося. 32 з 35 пацієнтів лікувалися з установкою LAMS. З них 21 зазнали одноетапного розгортання EC-LAMS. Ці результати показують, що ЕУЗД-ГЕС може бути ефективним та безпечним методом лікування СПП. Однак можлива упередженість публікації, оскільки кількість випадків була невеликою, а процедури виконували лише експерти. Тому потрібні подальші випробування за участю більшої кількості пацієнтів.
Порівняння з іншими менш інвазивними паліативними методами лікування
Декілька попередніх досліджень порівнювали ЕУЗД-ГЕС з іншими менш інвазивними методами лікування, включаючи PTD та ендоскопічне ентеральне стентування.
Брюер та ін. повідомили про результати свого ретроспективного порівняльного дослідження ЕУЗД-ГЕС та ендоскопічного ентерального стентування у пацієнтів із злоякісним СПП. Вони опосередковано порівняли багатоцентрові дані пацієнтів, які отримували ЕУЗД-ГЕС (n=18), з одноцентровими даними пацієнтів, пролікованих ендоскопічним ентеральним стентуванням (n=17). Повідомлялося, що частота клінічно успішних результатів була значно вищою у пацієнтів, які перенесли ЕУЗД-ГЕС, ніж у тих, хто переніс ендоскопічне ентеральне стентування з точки зору повного зникнення симптомів (88,9% проти 5,9%; P<0,001). Не було суттєвої різниці в частоті технічного успіху (100% проти 88,2%; P = 0,23), частоті небажаних явищ (16,7% проти 5,9%; P = 0,67) або часу процедури (29, 7 проти 41,6 хвилини, P =0,13) між двома групами.
Однак частота необхідності повторного втручання була значно нижчою у групі ЕУЗД-ГЕС, ніж у групі ендоскопічного ентерального стентування (16,7% проти 76,5%; P<0,001). Ці результати показали, що ЕУЗД-ГЕС має більш високий рівень клінічного успіху та нижчу частоту повторних втручань, ніж ендоскопічне ентеральне стентування. Оскільки ЕУЗД-ГЕС має потенційну перевагу дренування без перетину стріктур привідних петель, вона може дати більш сприятливий результат, ніж ендоскопічне ентеральне стентування.
ВИСНОВКИ
Хоча дані залишаються обмеженими, ЕУЗД-ГЕС є перспективним варіантом мінімально інвазивного лікування СПП, особливо злоякісного. Крім того, доступність EC-LAMS зробила ЕУЗД-ГЕС більш простою та безпечною процедурою.
ЕУЗД-ГЕС можна розглядати як терапію першої лінії у пацієнтів із СПП, оскільки вона дає кращі клінічні результати, ніж інші менш інвазивні методи лікування, такі як ендоскопічна ентеральна установка SEMS. На сьогоднішній день опубліковано кілька звітів про клінічні випадки та обмежену кількість ретроспективних досліджень; проте, проспективні дослідження не проводилися. Таким чином, необхідні подальші перевірені проспективні рандомізовані контрольовані дослідження, щоб встановити ЕУЗД-ГЕС як стандартне лікування СПП.