Авторы: Christoph F. Dietrich, Christian Jenssen
Введение: чем меньше поражение, тем лучше прогноз
Симптоматическая аденокарцинома протоков поджелудочной железы (АППЖ), которая является наиболее часто диагностируемой солидной злокачественной опухолью поджелудочной железы, обычно диагностируется на поздних стадиях с метастазами или без них.
Большинство международно признанных руководств рекомендуют радикальные операции при всех небольших солидных образованиях поджелудочной железы (СОПЖ), если нет подозрений на этиологию другого образования или отсутствуют противопоказания.
Ранняя диагностика этой опухоли в бессимптомных стадиях имеет решающее значение для улучшения ее прогноза. Данные из японского реестра рака поджелудочной железы показывают, что чем меньше поражение во время диагностики, тем дольше ожидаемая 5-летняя выживаемость.
Точность традиционных методов визуализации, включая ультразвуковое исследование (УЗИ), компьютерную томографию (КТ) и магнитно-резонансную томографию (МРТ), в дифференциальной диагностике образований поджелудочной железы оказалась не утешительной.
КТ была рекомендованным методом диагностики для постановки стадии рака ПЖ, но показала неудовлетворительные результаты для выявления небольших солидных образований (<20 мм).
Эндоскопическая ультрасонография (ЭУЗИ) считается методом визуализации, исключающим АППЖ. На основании 22 исследований, включающих 1170 случаев, суммарная чувствительность ЭУЗИ для выявления солидных образований составила 94%, что заметно выше, чем сообщаемые результаты для мультидетекторной КТ, МРТ и трансабдоминальной УЗИ. Кроме того, ЭУЗИ предоставляет возможность обнаружить бессимптомные варианты АППЖ.
Методы визуализации с контрастом позволяют улучшить видимость характеристик опухоли перед радикальной операцией, а биопсия тонкой иглой успешно позволяет проводить предоперационную дифференциальную диагностику во многих случаях.
CEUS или C-EUS
Применение контрастной ЭУЗД (C-EUS) улучшило производительность эндоскопической визуализации. Многоцентровое исследование поджелудочной железы в США с участием более 1000 пациентов и другие исследования, использующие УЗИ с контрастным усилением (CEUS) и C-EUS, показали улучшенную диагностическую точность для характеристики очаговых образований поджелудочной железы.
Только 146 из 394 небольших солидных новообразований (37%) были окончательно диагностированы как АППЖ. В подгруппе солидных образований размером 15 мм (n = 83) 51 поражение оказалось АППЖ (62%).
Наиболее важным дифференциальным диагнозом АППЖ является нейроэндокринные опухоли. Третьей по частоте этиологии были метастазы в поджелудочной железе (n = 28,7%). Другие дифференциальные диагнозы включали нередко гиперваскулярную серозную микроцистную цистаденому, солидную псевдопапиллярную опухоль, неходжкинскую лимфому, очаговый панкреатит, внутрипанкреатическую добавочную селезенку и гамартому.
Можно сделать вывод, что чем меньше солидное новообразование, тем менее вероятен диагноз АППЖ и тем чаще диагностируется нейроэндокринные опухоли.
CEUS и/или C-EUS были выполнены у 219 из 394 пациентов с использованием внутривенной инъекции SonoVue 2,4 мл (CEUS) или 4,8 мл (C-EUS) в соответствии с рекомендациями Европейской федерации ультразвука в медицине и биологии.
Изо-, гипер- или гипо-усиление по сравнению с окружающей паренхимой поджелудочной железы были задокументированы: у 57 из 62 пациентов (92%) АППЖ демонстрировала гипоусиление, в то время как у пациентов без АППЖ наблюдалось изо- или гиперусиление по сравнению с окружающей паренхимой. Кроме того, 91 из 102 нейроэндокринных опухолей (89%) имели гипер- или изоусиление, что привело к правильной дифференциальной диагностике.
Результаты с использованием CEUS были достовернее по сравнению с КТ; КТ не очертила очаговое поражение поджелудочной железы у 14 из 38 пациентов (средний диаметр 8 мм [диапазон от 4 до 12 мм) ])
В соответствии с опубликованной литературой, CEUS и C-EUS позволяют проводить дифференциальную диагностику солидных опухолей поджелудочной железы примерно в 90% случаев.
ЭУЗИ против УЗИ
УЗИ проводилась до ЭУЗИ у 45 пациентов (средний возраст: 59 лет; диапазон от 18 до 81 года; 20 мужчин и 25 женщин) с 25 (56%) злокачественными и 20 (44%) доброкачественными солидными образованиями.
У 5 из 45 пациентов (11%) солидные опухоли не были обнаружены во время УЗИ. У 6 из 45 пациентов (13%) выявление поражения при УЗИ и CEUS было возможно только при знании результатов ЭУЗИ. У 34 из 45 пациентов (76%) солидные опухоли были обнаружены во время УЗИ до обследования ЭУЗИ.
Мы пришли к выводу, что большинство солидных образований может быть обнаружено с помощью УЗИ, а оценка CEUS возможна для дальнейшей характеристики (рис. 1, 2).
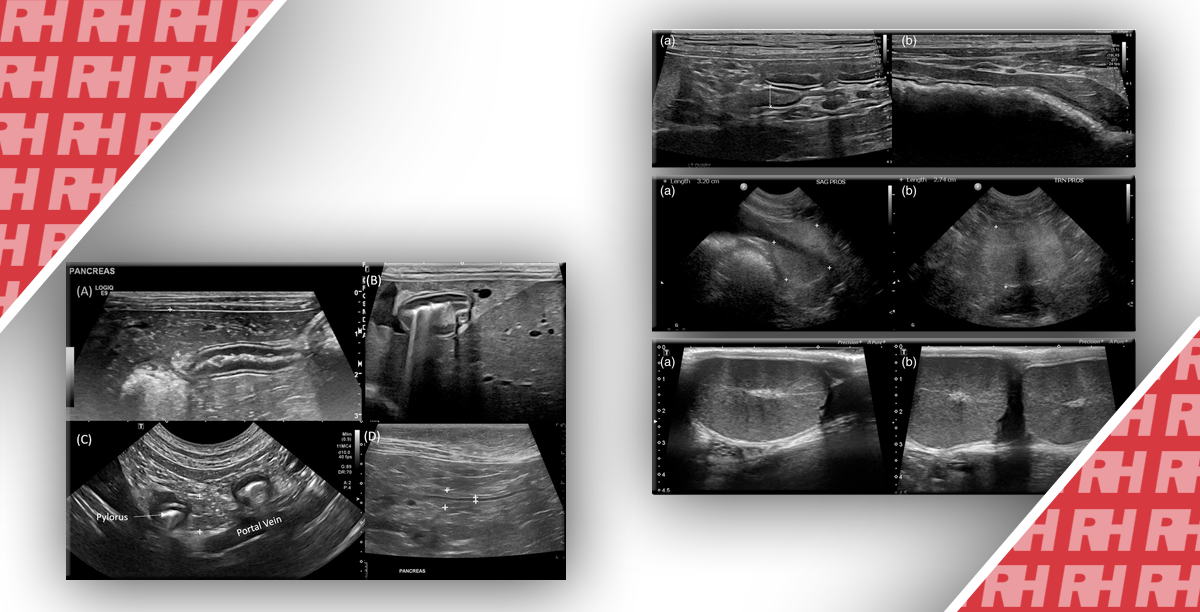
Рисунок 1: Нейроэндокринная неоплазия.
A, B. Показаны очаговые поражения поджелудочной железы, которые были гиперцентричными при использовании методов визуализации с контрастным усилением (7 × 6 мм, между маркерами) с использованием эндоскопической ультрасонографии (A) и чрескожной контрастной ультрасонографии (B). C. Также показано мягкое эластографическое изображение, указывающее на доброкачественное поражение.
Рисунок 2: Нейроэндокринная смешанная солидно-кистозная неоплазия.
Показаны солидно-кистозные очаговые поражения поджелудочной железы (отмечены стрелками) с использованием B-режима (A), которые были гиперцентричными при эндоскопической ультрасонографии с контрастом (B) и B-режиме (C) и ультрасонографии с контрастом (D). Нейроэндокринная неоплазия была диагностирована с помощью биопсии и гистопатологической оценки.
Ультразвуковая эластография
Ультразвуковая эластография позволяет оценить жесткость ткани путем виртуальной пальпации. Для оценки небольших очаговых поражений поджелудочной железы была разработана ультразвуковая тензометрическая эластография с использованием ЭУЗИ.
Мягкие небольшие солидные образования обычно доброкачественные, тогда как более жесткие (более твердые) в паренхиме поджелудочной железы – злокачественные.
Можно сказать, что, особенно у пациентов с небольшими поражениями поджелудочной железы, ЭУЗИ-эластография может исключать злокачественные новообразования с высокой степенью достоверности, если поражение отображается как мягкое. В более крупных (> 30 мм) результаты менее убедительны, главным образом, из-за гетерогенности поражений, но также из-за сопутствующих изменений окружающей паренхимы поджелудочной железы.
Эластография не способна окончательно дифференцировать очаговый панкреатит от АППЖ, поскольку хронический очаговый панкреатит также может быть более жестким, чем в остальном здоровая паренхима поджелудочной железы. Туберкулез поджелудочной железы также жестче, чем окружающая паренхима, но применение и правильная интерпретация эластографии при хроническом панкреатите являются более сложными.
Вывод
У пациентов с солидными опухолями этиологическая дифференциация необходима для принятия обоснованных решений о дальнейшем лечении:
- радикальное хирургическое вмешательство у пациентов с резектабельным АППЖ
- онкологическое лечение у пациентов с неоперабельным злокачественным новообразованием
- стратегии сохранения панкреатической паренхимы или наблюдение при доброкачественной нейроэндокринной неоплазии
- последующее наблюдение при небольших доброкачественных поражениях (рис. 3).
Рисунок 3: Алгоритм диагностики.
На основании паттерна улучшения результатов CEUS и эластографии возможна дальнейшая характеристика солидных новообразований. Гиповаскулярность наблюдается примерно в 90% случаев АППЖ. Мягкие солидные опухоли являются доброкачественными, за очень немногими исключениями.
Таким образом, у пациентов с гиперваскулярными и/или мягкими образованиями, биопсия ткани рекомендуется до принятия решения о лечении, поскольку радикальная операция может быть нецелесообразной.
Пациентам с серозной цистаденомой, мезенхимальными поражениями, и нефункциональными нейроэндокринными опухолями <10 мм с индексом Ki67 <3% можно рекомендовать последующее наблюдение, тогда как НЭО> 10 мм с индексом Ki67> 3% часто требуют наблюдения из-за их злокачественного потенциала.