Резюме
ПРЕДУСЛОВИЯ: Контролируемый параметр затухания (КПЗ) – это недавно разработанный ультразвуковой метод измерения стеатоза печени, который часто встречается у пациентов с метаболическим синдромом (МС). Для оценки стеатоза печени часто используют алгоритмический метод – жировой индекс печени (ЖИП). В этом исследовании оценивали, как ЖИП и КПЗ соотносятся с ранней стадией МС и их способность идентифицировать ее.
МАТЕРИАЛЫ И МЕТОДЫ: Всего было обследовано 170 человек, проживающих в громаде. Собирали демографическую информацию, индекс массы тела, окружность талии и артериальное давление. КПЗ оценивали с помощью аппарата FibroScan. Измеряли уровень глюкозы натощак, липидограммы и γ-глутамилтрансферазы. Результаты КПЗ и ЖИП были распределены на квартили, а стадии МС были основными результатами. Отношение шансов (ОШ) результатов рассчитывали с помощью логистической регрессии. Для определения стадии МС использовали площадь под кривой в анализе эксплуатационных характеристик приемника (AUC-ROC). Приведены чувствительность, специфичность и соответствующие отсечения на основе ROC-анализа.
РЕЗУЛЬТАТЫ: Чем выше категория ЖИП или КПЗ, тем ниже доля не-МС и выше доля умеренного МС. Каждое одноквартильное увеличение ЖИП и КПЗ ассоциировалось с увеличением вероятности достижения высших стадий МС – ЖИП: скорректированное ОШ 3,1 (2,23-4,32); КПЗ: скорректированное ОШ 1,96 (1,48-2,59). В ROC-анализе ЖИП имел более высокую AUC-ROC, чем КПЗ, в разграничении стадий МС, хотя результаты были достоверными (P<0,001). ЖИП в выявлении стадий от легкой до тяжелой по сравнению с не-МС показал хорошие результаты (AUC-ROC [95% доверительный интервал]: 0,79 [0,72-0,87]), с высокой чувствительностью (0,86), но низкой специфичностью (0,62).
ЗАКЛЮЧЕНИЕ: ЖИП и КПЗ положительно ассоциируются со стадией МС и ее компонентами, что позволяет предположить, что они могут быть использованы как инструмент скрининга МС в исследованиях сообществ.
КЛЮЧЕВЫЕ СЛОВА: метаболический синдром, жировая дистрофия печени, общественные службы здравоохранения
Предусловия
Метаболический синдром (МС) – это состояние, характеризующееся группой факторов риска, которые повышают риск многостадийного поражения органов, включая сердечно-сосудистые заболевания (ССЗ), сахарный диабет и неалкогольную жировую болезнь печени [1]. Рекомендуемое ведение МС базируется на 4-ступенчатой системе (стадии A-D), при этом рекомендуемая терапия зависит от стадии заболевания [2].
Накопление липидов в гепатоцитах вызывает стеатоз печени, который является первой стадией неалкогольной жировой болезни печени (НАЖБП). НАЖБП является печеночным проявлением МС, который характеризуется ожирением [3]. Это спектр заболеваний, включающий различной степени простой стеатоз, неалкогольный стеатогепатит (НАСГ) и цирроз печени [4]. Будучи самым распространенным хроническим заболеванием печени, НАЖБП становится важной проблемой здравоохранения во всем мире [5]. На основе растущего количества доказательств НАЖБП следует рассматривать как системное заболевание, которое может влиять на внепеченочные органы, включая метаболические нарушения, ССЗ, хронические заболевания почек и злокачественные новообразования, а не как специфическое для печени заболевание [6]. Поскольку биопсия печени является критериальным стандартом для диагностики НАЖБП, необходимы неинвазивные методы диагностики, которые можно сравнить с гистологическими результатами биопсии. Новые неинвазивные методы оценки стеатоза печени включают жировой индекс печени (ЖИП) [7] и контролируемый параметр затухания (КПЗ) [8]. В общей корейской популяции НАЖБП, определенная с помощью ЖИП, хорошо коррелировала со стеатозом печени, диагностированным с помощью абдоминального ультразвукового исследования [9], а КПЗ является полезным для градации НАЖБП в общей популяции [10].
Кроме диагностического потенциала при НАЖБП, КПЗ и ЖИП ассоциируются с диагнозом МС. Hu и соавт. сообщили, что доля людей с МС растет с повышением категории КПЗ [11]. Аналогично, в исследованиях из Австралии [12] и Тайваня [13] сообщается, что КПЗ ассоциируется с МС и что КПЗ является хорошим предиктором диагноза МС соответственно.
Однако лишь в ограниченном количестве исследований изучалась связь ЖИП и КПЗ с моделью стадирования МС по Sperling [2].Большинство исследований определяли МС как имеющий 3 из 5 факторов риска, не учитывая современные рекомендации по стадийности МС. Без предоставления информации о стадии при диагностике МС метаболические нарушения на ранних стадиях могут быть пропущены. В этом исследовании мы использовали сообщество тайванцев, чтобы оценить связь и возможности выявления стадий ЖИП, КПЗ и МС в общей популяции.
Материалы и методы
ИССЛЕДУЕМАЯ ПОПУЛЯЦИЯ:
Исследуемая популяция была частью проспективного когортного исследования на уровне общины, которое изучало сердечно-сосудистые и цереброваскулярные факторы риска у жителей 6 сел Шилинского района [14]. Исследование продолжалось между 2005 и 2006 годами, с последующим наблюдением в течение более 10 лет. Это исследование было лишь частично реализовано в 1 волне и представляет собой субисследование этой когорты. Критериями включения в него были (1) возраст ≥50 лет; (2) отсутствие инсульта, инфаркта миокарда или рака в анамнезе; (3) отсутствие инфекции гепатита В и С; (4) отсутствие пропусков в показателях окружности талии (ОТ), артериального давления, уровня глюкозы в плазме крови натощак, гликированного гемоглобина (HbA1C), триглицеридов (ТГ), холестерина липопротеидов высокой плотности (ЛПВП), которые были необходимы для выявления МС; (5) отсутствие пропусков в показателях аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ) и общего анализа крови, которые использовались для определения индекса фиброза-4 (FIB-4); и (6) заполненные анкеты во время пятого визита каждого участника, который состоялся в период с 2017 по 2019 год [15].
Участников, которые соответствовали критериям, пригласили на обследование FibroScan. В целом 178 участников прошли оценивание. Однако во время очистки данных были удалены отсутствующие и сомнительные данные, в результате чего в окончательный анализ было включено 170 участников (Рис. 1). Это исследование было проведено в соответствии с рекомендациями Хельсинкской декларации и каждый участник предоставил письменное информированное согласие перед включением в исследование.
ДЕМОГРАФИЧЕСКИЕ И ЛАБОРАТОРНЫЕ ДАННЫЕ:
Для того, чтобы завершить опрос, каждый участник был опрошен лично профессиональным интервьюером. Были собраны демографические данные, включая возраст, пол и параметры образа жизни. Образцы крови натощак в течение 8 часов были получены с помощью FibroScan, собраны в сыворотке, плазме с ЭДТА и плазме с фторидом натрия (для определения глюкозы), а затем хранились при 80°C. С помощью физического обследования оценивали антропометрические и биохимические показатели. Антропометрические измерения включали рост, вес, индекс массы тела (ИМТ), ОТ, систолическое артериальное давление (САД) и диастолическое артериальное давление (ДАД). ИМТ рассчитывается путем деления массы тела (кг) на рост в квадрате (м2). Для измерения САД и ДАД мы использовали автоматический тонометр. Артериальное давление каждого участника измеряли 2 раза, один раз сидя и один раз после 5-минутного перерыва. Затем эти 2 показателя усреднялись. Автоанализатор (Beckman, Пало-Альто, Калифорния) использовался для оценки биомаркеров крови, таких как ГПН, ТГ, ЛПВП, холестерин липопротеидов низкой плотности (ХС ЛПНП), общий холестерин, АСТ, АЛТ и гамма-глутамилтрансфераза (ГГТ). Для измерения глюкозы использовали глюкозооксидазный метод, а для измерения HbA1C – метод высокоэффективной жидкостной хроматографии. Подсчитывали количество тромбоцитов на микролитр крови.
ЖИП, КПЗ, УЗИ И FIB-4:
ЖИП рассчитывали по формуле Bedogni и соавт., которая включает 4 переменные (ИМТ, ОТ, сывороточный ТГ и сывороточная ГГТ). Риск жировой дистрофии печени низкий при ЖИП <30, неопределенный при ЖИП 30-60 и высокий при ЖИП ≥60 [7]. Измерение КПЗ проводилось с помощью аппарата FibroScan опытным гепатологом. Принцип КПЗ был описан ранее [16]. Таким образом, КПЗ измеряет затухание ультразвука на частоте 3,5 МГц. Правую долю печени участника сканировали через межреберные промежутки в положении лежа на спине с максимально отведенной правой рукой.
Для дальнейшего анализа КПЗ и ЖИП были распределены на квартили (Q). ЖИП было классифицировано на Q1: ≤7,6, Q2: 7,7-15,1, Q3: 15,2-30 и Q4: >30, тогда как КПЗ классифицировали на Q1: ≤231 дБ/м, Q2: 232-277 дБ/м, Q3: 278-306 дБ/м и Q4: >306 дБ/м. Эти классификации сравнивали с клинически используемыми классификациями КПЗ для диагностики стеатоза, которые были разработаны на основе процентного содержания жира в гепатоцитах [17]. Категории: S0: ≤10% (≤215 дБ/м), S1: 11-33% (>215 дБ/м), S2: 34-66% (>252 дБ/м) и S3 ≥67% (>296 дБ/м) [18].
Ультразвуковое исследование выполняли 3 гепатолога нашего отделения на аппарате Xario SSA-660A (TOSHIBA, Япония). Для определения степени выраженности стеатоза печени использовали заранее определенные критерии. Они включали повышенный гепаторенальный контраст или наличие ярких эхосигналов для стеатоза 1 степени (S1) (легкий стеатоз); наличие как повышенного гепаторенального контраста, так и ярких эхосигналов, а также размытие сосудов для стеатоза 2 степени (S2) (умеренный стеатоз); и наличие ослабления заднего луча и невизуализации диафрагмы, в дополнение к критериям для S2, для стеатоза 3 степени (S3) (тяжелый стеатоз). Изображение печени оценивали как нормальное, если текстура была гомогенной, наблюдались мелкодисперсные эхосигналы, зона увеличения была изоэхогенной по сравнению с корой почек, а печеночные сосуды и диафрагма были адекватно визуализированы [стеатоз 0 степени (S0)][19].
Индекс FIB-4 – это тест, который используется для оценки фиброза при заболеваниях печени и рассчитывается с использованием нескольких параметров, таких как возраст, АСТ, АЛТ и количество тромбоцитов [20,21].
СТАДИИ МЕТАБОЛИЧЕСКОГО СИНДРОМА:
МС определялся с использованием 5 стандартных факторов риска: (1) повышенный ОТ (≥90 см для азиатских мужчин или ≥80 см для азиатских женщин), (2) повышенный уровень ТГ (≥150 мг/дл или медикаментозное лечение ТГ), (3) сниженный уровень ЛПВП (≤40 мг/дл для мужчин или ≤50 мг/дл для женщин или медикаментозное лечение снижения ЛПВП), (4) повышенное систолическое/диастолическое АД (≥130/85 мм рт. ст. или лечение гипертензии) и (5) повышенный уровень ГПН (≥100 мг/дл или лечение повышенного уровня глюкозы). ст. или лечение гипертензии) и (5) повышенный уровень ГПН (≥100 мг/дл или лечение повышенного уровня глюкозы) [1].
Стадии МС, разработанные в этом исследовании, базируются на стадиях, разработанных во время заседания Кардиометаболического аналитического центра в 2014 году [2],который признает, что МС является патофизиологическим состоянием, которое включает факторы риска, поддающиеся и не поддающиеся измерению в клинике, и что существует несколько подтипов МС, которые приводят к различным типам поражения конечных органов. Стадия А определяется как отсутствие ни одного из 5 факторов риска МС (не МС); стадия В – наличие 1-2 из 5 факторов риска (легкий МС); стадия С – наличие 3 из 5 факторов риска, но без поражения конечных органов (умеренный МС); стадия D – наличие поражения конечных органов (например, ССЗ, диабет, НАЖБП) (тяжелый МС). В этом исследовании участники с диабетом (ГПН ≥126 мг/дл или HbA1C ≥6,5%) или жировой болезнью печени (ЖБП ≥60) считались имеющими поражение конечных органов. Выбранное значение ЖИП для жировой болезни печени основывалось на предыдущей публикации [5].
СТАТИСТИЧЕСКИЕ АНАЛИЗЫ:
Статистический анализ проводился с помощью программы STATA (версия 14). Характеристики участников представлены в виде пропорций на основе их метаболических состояний здоровья. Для непрерывных переменных использовали t-критерий или критерий ранговой суммы Уилкоксона для проверки различий в исходных и последующих характеристиках между группами. Для дихотомических (категориальных) переменных использовали критерий хи-квадрат или точный критерий Фишера.
Был проведен упорядоченный логистический регрессионный анализ с использованием самого низкого квартиля ЖИП и КПЗ для расчета отношения шансов (ОШ) и 95% доверительного интервала (95% ДИ) результатов. Сначала были рассчитаны грубые ОШ. Затем модель была скорректирована на пол (категориальная) и возраст (непрерывная) (модель 1). Индекс FIB-4 (непрерывный) был использован для получения модели 2. Также был проведен тест Бранта на предположение о пропорциональных шансах, чтобы определить, целесообразно ли использовать упорядоченный логистический регрессионный анализ [22].
Для расчета площади под кривой рабочей характеристики приемника (AU-ROC) в логистической модели был проведен ROC-анализ. Мы разработали 2 условия как результат: (1) наличие МС (стадия B или C или D) по сравнению с отсутствием МС (стадия A) и (2) умеренно-тяжелый МС (стадия C или D) по сравнению с легким или отсутствием МС (стадия A или B). Эмпирические значения отсечения были рассчитаны с помощью индекса Юдена. Чувствительность и специфичность каждого результата были рассчитаны в соответствии с его точкой отсечения.
Результаты
ИЗУЧЕНИЕ ДЕМОГРАФИЧЕСКИХ ПОКАЗАТЕЛЕЙ НАСЕЛЕНИЯ И ХАРАКТЕРИСТИК ЗАБОЛЕВАНИЙ:
Как показано в Таблице 1, всего в анализ было включено 170 пациентов. Стратификация участников по полу показала, что большинство составляли женщины (60% [102/170]). Средний возраст женщин и мужчин составил 63,3 и 64,4 года (P=0,48) соответственно, что свидетельствует об отсутствии существенной разницы в возрасте участников по полу. Средний показатель ИМТ также существенно не отличался между женщинами и мужчинами (23,8 кг/м2 против 24,8 кг/м2; P=0,069), соответственно.
На начальном этапе 3 из 5 компонентов ИМТ достоверно отличались между полами. Женщины имели меньший ОТ (78,5 см против 85,6 см, P<0,001), более высокий уровень ЛПВП (56,8 мг/дл против 50,7 мг/дл, P=0,003), более низкое АД (САД: 116,8 мм рт. ст. против 125,3 мм рт. ст., P=0,004; ДАТ: 71. 6 мм рт.ст. против 75,5 мм рт.ст., р=0,015), ниже уровень АЛТ (16,5 против 21,2, р=0,001) и ниже уровень ГГТ (16,6 против 22,3, р=0,004), что свидетельствует о том, что женщины были здоровыми. Все остальные маркеры были сходными между полами.
Результаты диагностического теста показали, что ЖИП был значительно ниже у женщин (17,2 против 30,9, P<0,001). Более низкий ЖИП у женщин можно объяснить более низкими значениями 4 переменных, на основе которых рассчитывается ЖИП. Не было достоверной разницы между полами для FIB-4 и КПЗ (P>0,05).
ЖИП И КПЗ КОРРЕЛИРУЮТ С ФАКТОРАМИ РИСКА МС И 5 МС:
Коэффициент корреляции КПЗ и ЖИП составил 0,504 (P<0,000). Категории ЖИП и КПЗ участников были определены на основе квартилей, описанных в разделе “Методы”, и коррелировали со стадиями МС и 5 факторами риска МС (Табл. 2). За исключением сниженного уровня ЛПВП, все метаболические факторы риска положительно коррелировали с каждым увеличением квартиля ЖИП. Для КПЗ и клинически рутинного КПЗ все метаболические факторы риска положительно коррелировали с каждым увеличением квартиля КПЗ. Эти результаты согласовывались с результатами ультразвукового исследования (УЗИ).
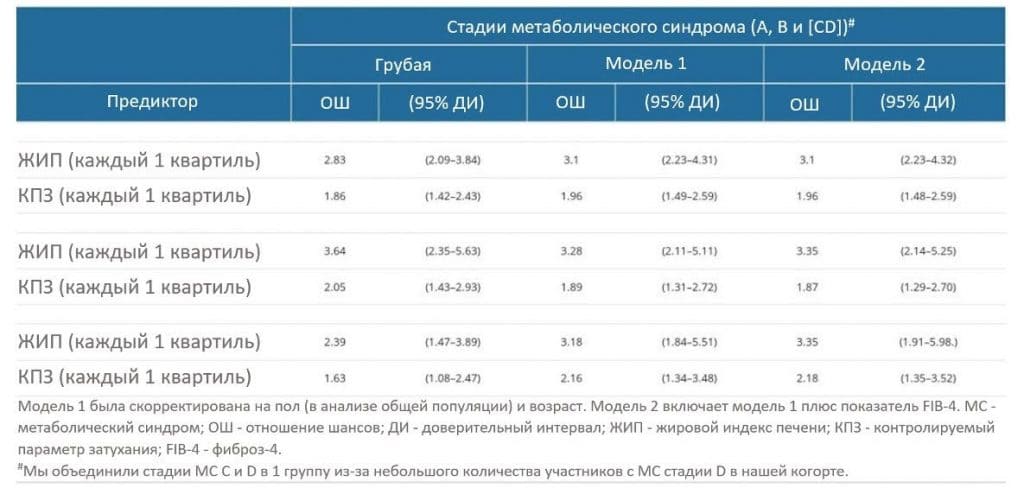
Рост квартиля для каждого ЖИП ассоциировался с повышенной вероятностью оказаться на более высокой стадии МС. В этом анализе “результатом” была либо только стадия С (при этом референтной категорией была комбинация стадий А и В), либо комбинация стадий В и С (при этом референтной категорией была стадия А). С помощью упорядоченного логистического регрессионного анализа было определено одноквартильное увеличение ЖИП (Q1 до Q2, Q2 до Q3 или Q3 до Q4), которое показало, что вероятность оказаться на высшей стадии МС примерно в 3 раза выше (ОШ: 2,83, 95% ДИ: 2,09-3,84) (Табл. 3). После корректировки ковариатов связь между ЖИП и стадией МС сохранялась в модели 1 со скорректированным ОШ (СОШ) 3,1 (95% ДИ: 2,23-4,31) и модели 2 с СОШ 3,1 (95% ДИ: 2,23-4,32) (Табл. 3). Аналогично, была выявлена значительная связь между КПЗ и стадиями МС. Увеличение КПЗ на один квартиль увеличивало вероятность пребывания на высшей стадии МС в 1,86 раза (грубое ОШ: 1,86, 95% ДИ: 1,42-2,43), что также сохранялось после корректировки ковариатов в Модели 1 (ОШ: 1,96; 95% ДИ: 1,49-2,59) и Модели 2 (ОШ: 1,96, 95% ДИ: 1,48-2,59).
В анализе, стратифицированном по полу, более высокие ЖИП и КПЗ также ассоциировались с более высокой стадией МС, что согласуется с результатами анализа общей популяции (Табл. 3). Даже после контроля по ковариантам связь ЖИП и КПЗ с высшей стадией МС оставалась значимой.
ЭФФЕКТИВНОСТЬ МОДЕЛЕЙ ЖИП И КПЗ ПО ОПРЕДЕЛЕНИЮ СТАДИЙ МС:
Для оценки эффективности моделей был проведен анализ AU-ROC. ЖИП имеет более высокую AUC-ROC, чем КПЗ, несмотря на схожие характеристики (Рис. 2). Это указывает на то, что ЖИП является более точным в прогнозировании стадий МС, чем КПЗ. ЖИП в результате 1 (МС от легкой до тяжелой степени против не-МС) имел AU-ROC 0,79 (95% ДИ: 0,72-0,87), с высокой чувствительностью (0,86), но низкой специфичностью (0,62). ЖИП для результата 2 (умеренный и тяжелый МС по сравнению с легким и без МС) имел аналогичный показатель AU-ROC 0,80 (95% ДИ: 0,71-0,87), с низкой чувствительностью (0,62), но высокой специфичностью (0,87). Эмпирические точки отсечения составляли 7,95 и 28,49 соответственно. Несмотря на более низкую AU-ROC, КПЗ имел высокую специфичность (0,84) с точкой отсечения 305, когда мы проводили скрининг нашей исследуемой популяции на рискованные стадии МС (стадии C или D).
Обсуждение
В этом перекрестном исследовании взрослых тайваньцев наблюдали значительные корреляции между стадиями МС и КПЗ, а также между стадиями МС и ЖИП. Эти ассоциации не зависели от возраста, пола и показателя FIB-4. Полученные данные свидетельствуют о том, что как ЖИП, так и КПЗ являются полезными для определения стадии МС у взрослых тайваньцев. Кроме того, мы представили эмпирическую оптимальную точку отсечения ЖИП и КПЗ для диагностики МС.
С увеличением распространенности МС даже среди лиц с нормальным весом возрастает потребность в раннем вмешательстве [23,24]. Было разработано несколько инструментов прогнозирования МС для немедленного скрининга или прогнозирования будущих рисков, но инструментов для прогнозирования стадии МС недостаточно [25]. Согласно нашим текущим данным, AU-ROC КПЗ и ЖИП в прогнозировании стадии МС составляет 0,66-0,80, что означает, что они могут играть определенную роль в раннем выявлении МС и предупреждать клиницистов о необходимости вмешательства у таких пациентов с высоким риском.
Известно, что ЖИП ассоциируется со смертностью, связанной с поражением печени, а ее связь со смертностью от всех причин, ССЗ и рака, как предполагают, зависит от инсулинорезистентности [26]. Поскольку инсулинорезистентность тесно связана с МС [27], вероятно, что значительная корреляция между стадиями ЖИП и МС, которая наблюдается в нашем исследовании, обусловлена основной связью ЖИП и МС с инсулинорезистентностью. Мета-анализ показал, что корреляция между КПЗ и гистологически определенным стеатозом является сильной [28], а КПЗ коррелирует с МС [11]. Результаты оценки КПЗ положительно коррелируют с количеством компонентов МС и распространенностью МС у пациентов с хроническими заболеваниями печени [10]. Кроме того, значения КПЗ могут быть полезными для мониторинга прогрессирования МС. Эти выводы согласуются с корреляциями КПЗ и МС в нашем исследовании, где повышенные уровни ТГ, ОТ и ГПН были выше у участников с более высокими квартилями КПЗ. Однако корреляция между КПЗ и стадией МС была слабее, чем корреляция между ЖИП и стадией МС в нашем исследовании. ЖИП содержит ОТ и ТГ, которые являются компонентами МС, а также ИМТ и ГГТ, которые являются независимыми факторами риска МС. Кроме того, определение стадии МС в нашем исследовании включало ЖИП (стадия D МС: ЖИП ≥60). Следовательно, более сильная корреляционная связь между ЖИП и стадией МС не является неожиданной.
КПЗ лучше отличает S0 от аномальных состояний (а не диагностирует стеатоз) и позволяет проводить мониторинг, если пациент нуждается в дальнейших обследованиях [29]. КПЗ оценивает жировую дистрофию печени с помощью FibroScan, но это трудоемкая работа, которая требует хорошо подготовленного врача. Поэтому ее применение в эпидемиологических исследованиях может быть ограничено. ЖИП является относительно дешевым и базируется на более традиционных, широкодоступных компонентах, но ЖИП требует забора крови, тогда как КПЗ не требует.
Оценки КПЗ и ЖИП имеют свои преимущества и недостатки. В нашем исследовании, как и в исследовании Carvalhana [30], КПЗ имеет большую чувствительность и более высокую коррекцию, чем ЖИП. В анализе NHANES коэффициент корреляции ЖИП и КПЗ составил 0,645 [31];он не является совершенным, что свидетельствует о потенциальной разнице между этими двумя показателями. Решение о выборе КПЗ или ЖИП следует принимать осторожно из-за их уникальных последствий. Польза от обеих процедур может быть максимизирована, если всегда помнить о МС. ЖИП использует физикальное обследование и анализы крови. Аналогично, традиционные процедуры подтверждения МС зависят от анализа крови, который является инвазивной и длительной процедурой, что может вызвать у субъектов сопротивление этим процедурам во время скрининга в общинах. Зато оценка с помощью КПЗ является неинвазивной, безопасной, быстрой (примерно 5-10 мин для применения), удобной, портативной, имеет высокую воспроизводимость и высокую точность в оценке стеатоза печени. КПЗ может быть применен для пациентов, которые были устойчивыми к неудобствам, связанным с ночным голоданием или болезненным анализом крови. Наши результаты показывают, что КПЗ имеет положительную независимую связь со стадиями МС у взрослых тайваньцев. Если во время процедуры FibroScan обнаружено высокое значение КПЗ, гастроэнтеролог может знать, что, при отсутствии результатов анализа крови, существует повышенная вероятность того, что пациент находится на высшей стадии МС.
В результате мы определили достаточную мощность на основе наблюдения за ОШ (в Таблице 3) и AUC-ROC (на Рисунке 2). Выборка размером 170 пациентов достигает 100% и 98% мощности, соответственно, для выявления ОШ 2,83 у ЖИП и 1,86 у КПЗ с помощью двустороннего биномиального теста, альфа 0,05 и базовой пропорции 0,282. Эта оценка мощности базируется на результатах стадий МС C и D по сравнению с A и B. Мощность обнаружения AUC-ROC также является отличной. Используя 2-сторонний z-тест с альфа 0,05, наши данные в целом имели мощность от 93% до 100% для выявления разницы AUC в ЖИП и КПЗ до стадии МС. Кроме того, используя 2-сторонний биномиальный тест с альфа 0,05 и результаты стадий МС B-D против A, наши результаты ЖИП и КПЗ имели низкую мощность специфичности, но почти 100% мощность для выявления изменения чувствительности. Подобно этому, 100% мощность также может выявить специфичность, когда результат стадирования МС является C-D против A-B, хотя чувствительность обнаружения ограничена. Важно знать, является ли целевой объект включением или исключением, в зависимости от того, насколько ранние стадии МС могут быть распознаны.
Избыточный вес, нарушение обмена веществ и жировая болезнь печени взаимосвязаны и являются симптомами друг друга. Избыточный вес может быть самым первым симптомом. Согласно данным Всемирной организации здравоохранения, идеальным весом для азиатов является ИМТ 18,5-22,9, что является скорректированным на азиатский диапазон здорового ИМТ, тогда как ИМТ более 23 определяется как избыточный вес. В этом исследовании мы изучили связь между стадиями ЖИП, КПЗ и МС в общей популяции взрослых жителей Тайваня (азиатской этнической принадлежности). Как показано в Таблице 1, средний ИМТ достоверно не отличался между женщинами и мужчинами (23,8 кг/м2 против 24,8 кг/м2; P=0,069), но оба средние ИМТ были больше 23. У наших субъектов распространенность ИМТ более 23 (избыточный вес, скорректированный на азиатские показатели) составляла 60,6% (103/170), а распространенность ИМТ более 25 составляла 37,7% (64/170).
По данным предыдущего исследования, афроамериканцы с НАЖБП имели более низкий ИМТ и меньшую окружность талии, чем не испаноязычные белые с НАЖБП [32]. Другое исследование показало, что факторами, которые достоверно ассоциируются с повышенным уровнем КПЗ, являются ИМТ (25-30) кг/м2, ИМТ >30 кг/м2, метаболический синдром, употребление алкоголя >14 напитков в неделю и жесткость печени >6 кПа [33]. Исходя из приведенных выше данных, мы предполагаем, что наши результаты применимы к лицам с ожирением.
Наше исследование имеет определенные ограничения. Во-первых, кросс-секционный дизайн исследования ограничивает интерпретацию результатов, поскольку причинно-следственную связь между ЖИП, КПЗ и МС установить не удалось. Однако, с патофизиологической точки зрения, вполне вероятно, что жировая дистрофия печени, выявленная с помощью ЖИП или КПЗ, способствовала развитию МС. Во-вторых, существовали различия в нескольких ключевых метаболических биомаркерах между мужчинами и женщинами. Таким образом, для прогнозирования МС на основе ЖИП и КПЗ может потребоваться полово-специфическое отсечение. Дальнейшие полово-специфические анализы могут изменить эффективность модели, выраженную AU-ROC. Наконец, участники нашего исследования были ограничены 1 районом города Тайбэй, представляющим пожилых людей, проживающих в городских районах. Таким образом, последствия полученных результатов должны быть исследованы на предмет их уместности и применимости в других условиях. Несмотря на эти ограничения, наше исследование имеет некоторые сильные стороны. Наши участники были взяты из общины, а не из больничной популяции, что делает наши выводы применимыми к относительно здоровой популяции. Кроме того, мы использовали систему стадийности МС, которая помогла нам выявить пациентов с ранними стадиями МС.
Заключение
Наше исследование продемонстрировало, что как ЖИП, так и КПЗ имеют положительную независимую связь со стадиями МС у взрослых тайваньцев, что позволяет предположить, что оценка здоровья печени с помощью ЖИП или КПЗ может быть полезной для выявления лиц с метаболическими нарушениями. Необходимы дальнейшие проспективные когортные исследования с большими размерами выборок, чтобы определить, могут ли ЖИП и КПЗ прогнозировать будущие стадии МС.
Рисунки
Рисунок 1. Блок-схема участников, включенных в это исследование.
Рисунок 2. Площадь под кривой рабочей характеристики приемника (AU-ROC) ЖИП и КПЗ в прогнозировании результата (А) легкого и тяжелого МС по сравнению с не-МС и (Б) среднего и тяжелого МС по сравнению с легким и не-МС. МС – метаболический синдром; ЖИП – жировой индекс печени; КПЗ – контролируемый параметр затухания.
Таблицы
Таблица 1.Клинико-биохимические характеристики исследуемых лиц, стратифицированные по полу.
Таблица 2. Показатели распространенности компонентов метаболического синдрома с распределением по категориям ЖИП и КПЗ.
Таблица 3. Связь жирового индекса печени и параметров контролируемой аттенуации со стадией метаболического синдрома с помощью упорядоченной логистической регрессии.
Ссылки на источники
- Alberti KG, Eckel RH, Grundy SM, Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention. National Heart, Lung, and Blood Institute, American Heart Association, World Heart Federation. International Atherosclerosis Society, and International Association for the Study of Obesity: Circulation, 2009; 120; 1640-45
- Sperling LS, Mechanick JI, Neeland IJ, The CardioMetabolic Health Alliance: Working toward a new care model for the metabolic Syndrome: J Am Coll Cardiol, 2015; 66; 1050-67
- Vanni E, Bugianesi E, Kotronen A, De Minicis S, From the metabolic syndrome to NAFLD or vice versa?: Dig Liver Dis, 2010; 42; 320-30
- Neuschwander-Tetri BA, Caldwell SH, Nonalcoholic steatohepatitis: Summary of an AASLD Single Topic Conference: Hepatology, 2003; 37; 1202-19
- Khang AR, Lee HW, Yi D, The fatty liver index, a simple and useful predictor of metabolic syndrome: Analysis of the Korea National Health and Nutrition Examination Survey 2010–2011: Diabetes Metab Syndr Obes, 2019; 12; 181-90
- Angulo P, Kleiner DE, Dam-Larsen S, Liver fibrosis, but no other histologic features, is associated with long-term outcomes of patients with nonalcoholic fatty liver disease: Gastroenterology, 2015; 149; 389-97e310
- Bedogni G, Bellentani S, Miglioli L, The Fatty Liver Index: A simple and accurate predictor of hepatic steatosis in the general population: BMC Gastroenterol, 2006; 6; 33-35
- Yen YH, Chen JF, Wu CK, The correlation of controlled attenuation parameter results with ultrasound-identified steatosis in real-world clinical practice: J Formos Med Assoc, 2017; 116; 852-61
- Kim JH, Kwon SY, Lee SW, Lee CH, Validation of fatty liver index and lipid accumulation product for predicting fatty liver in Korean population: Liver Int, 2011; 31; 1600-601
- de Ledinghen V, Vergniol J, Capdepont M, Controlled attenuation parameter (CAP) for the diagnosis of steatosis: A prospective study of 5323 examinations: J Hepatol, 2014; 60; 1026-31
- Hu YY, Dong NL, Qu Q, The correlation between controlled attenuation parameter and metabolic syndrome and its components in middle-aged and elderly nonalcoholic fatty liver disease patients: Medicine (Baltimore), 2018; 97; e12931
- Patel PJ, Hossain F, Horsfall LU, Controlled attenuation parameter in NAFLD identifies risk of suboptimal glycaemic and metabolic control: J Diabetes Complications, 2018; 32; 799-804
- Lin YJ, Lin CH, Wang ST, Noninvasive and convenient screening of metabolic syndrome using the controlled attenuation parameter technology: An evaluation based on self-paid health examination participants: J Clin Med, 2019; 8; 1775
- Hsieh YC, Hung CT, Lien LM, A significant decrease in blood pressure through a family-based nutrition health education programme among community residents in Taiwan: Public Health Nutr, 2009; 12; 570-77
- Alizargar J, Bai CH, Factors associated with carotid Intima media thickness and carotid plaque score in community-dwelling and non-diabetic individuals: BMC Cardiovasc Disord, 2018; 18; 21-26
- Sasso M, Beaugrand M, de Ledinghen V, Controlled attenuation parameter (CAP): A novel VCTE guided ultrasonic attenuation measurement for the evaluation of hepatic steatosis: Preliminary study and validation in a cohort of patients with chronic liver disease from various causes: Ultrasound Med Biol, 2010; 36; 1825-35
- Sirli R, Sporea I, Controlled attenuation parameter for quantification of steatosis: which cut-offs to use?: Can J Gastroenterol Hepatol, 2021; 2021; 6662760
- de Lédinghen V, Vergniol J, Foucher J, Non-invasive diagnosis of liver steatosis using controlled attenuation parameter (CAP) and transient elastography: Liver Int, 2012; 32; 911-18
- Dasarathy S, Dasarathy J, Khiyami A, Validity of real time ultrasound in the diagnosis of hepatic steatosis: A prospective study: J Hepatol, 2009; 51; 1061-67
- Sterling RK, Lissen E, Clumeck N, Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection: Hepatology, 2006; 43; 1317-25
- Dyson JK, Anstee QM, McPherson S, Non-alcoholic fatty liver disease: A practical approach to diagnosis and staging: Frontline Gastroenterol, 2014; 5; 211-18
- Long JSF: Regression models for categorical dependent variables using stata, 2014, Texas, Stata Press
- Saklayen MG, The global epidemic of the metabolic syndrome: Curr Hypertens Rep, 2018; 20; 12
- Bintoro BS, Fan YC, Chou CC, Metabolic unhealthiness increases the likelihood of having metabolic syndrome components in normoweight young adults: Int J Environ Res Public Health, 2019; 16; 3258
- Zhang H, Shao J, Chen D, Reporting and methods in developing prognostic prediction models for metabolic syndrome: A systematic review and critical appraisal: Diabetes Metab Syndr Obes, 2020; 13; 4981-92
- Calori G, Lattuada G, Ragogna F: Hepatology, 2011; 54; 145-52
- Reaven GM, Banting lecture 1988. Role of insulin resistance in human disease: Diabetes, 1988; 37; 1595-607
- Karlas T, Petroff D, Sasso M, Individual patient data meta-analysis of controlled attenuation parameter (CAP) technology for assessing steatosis: J Hepatol, 2017; 66; 1022-30
- Pu K, Wang Y, Bai S, Diagnostic accuracy of controlled attenuation parameter (CAP) as a non-invasive test for steatosis in suspected non-alcoholic fatty liver disease: A systematic review and meta-analysis: BMC Gastroenterol, 2019; 19; 51
- Carvalhana S, Leitão J, Alves AC, How good is controlled attenuation parameter and fatty liver index for assessing liver steatosis in general population: correlation with ultrasound: Liver Int, 2014; 34(6); e111-17
- Sourianarayanane A, McCullough AJ, Accuracy of steatosis and fibrosis NAFLD scores in relation to vibration controlled transient elastography: An NHANES analysis: Clin Res Hepatol Gastroenterol, 2022; 46(7); 101997
- Golabi P, Paik J, Hwang JP, Prevalence and outcomes of non-alcoholic fatty liver disease (NAFLD) among Asian American adults in the United States: Liver Int, 2019; 39(4); 748-57
- de Ledinghen V, Vergniol J, Capdepont M, Controlled attenuation parameter (CAP) for the diagnosis of steatosis: A prospective study of 5323 examinations: J Hepatol, 2014; 60(5); 1026-31