Резюме
Сегодня комбинированные оральные контрацептивы (КОК) успешно применяются для лечения эндометриоза (ЭНД) и аденомиоза (АД) у значительной части пациенток. Однако литературы, посвященной клиническому и сонографическому ответу на лечение при долгосрочном наблюдении за пациентками с глубоким эндометриозом (ГЭ) и АД, недостаточно. Целью этого исследования было оценить изменения в симптоматике и сонографических исследованиях через 12 и 24 месяца наблюдения у пациенток, получавших гибкий расширенный режим терапии КОК, содержащий 2 мг диеногеста/30 мкг этинилэстрадиола. В это проспективное, лонгитюдное, обсервационное исследование были включены женщины с диагнозом ГЭ и АД, которые не имели хирургических показаний и были кандидатами на лечение КОК. Наличие и выраженность дисменореи, неменструальной тазовой боли, глубокой диспареунии, диспепсии и дизурии оценивали с помощью числовой рейтинговой шкалы (ЧРШ) на начальном этапе, а также через 12 и 24 месяца лечения. В этих контрольных точках также проводили трансвагинальное ультразвуковое исследование для выявления критериев АД и определения размеров узлов ГЭ и эндометриом яичников (ЭЯ). Было включено 64 пациентки. Во время наблюдения было зафиксировано значительное уменьшение количества пациенток с тяжелой дисменореей и неменструальной тазовой болью. Средний балл по шкале ЧРШ для дисменореи, неменструальной тазовой боли, глубокой диспареунии, диспепсии и дизурии также был значительно ниже во время наблюдения. Во время наблюдения после лечения наблюдалось значительное уменьшение количества сонографических критериев и типа АД. Аналогично, достоверное уменьшение размеров ЭЯ и вовлечение прямокишечно-маточной связки связки при ДЭ наблюдалось при 12-месячном наблюдении с последующим, хотя и не статистически достоверным, уменьшением в течение 12-24-месячного наблюдения. Кроме того, тора и ректосигмоидный ГЭ уменьшились в размерах, хотя это уменьшение не было статистически значимым ни в одной точке исследования. Это проспективное исследование свидетельствует о клиническом и сонографическом улучшении после гибкого расширенного режима КОК у пациентов с ГЭ и АД, которое было значимым через 12 месяцев наблюдения. Улучшение было более очевидным при АД и ЭЯ по сравнению с ГЭ. Необходимы дальнейшие исследования с более длительным наблюдением, большим размером выборки и сравнением с другими методами лечения.
Вступ
Эндометриоз (ЭНД) и аденомиоз (АД) являются доброкачественными, эстрогензависимыми, хроническими гинекологическими заболеваниями, которые сосуществуют примерно у 35% пациенток, имея общие механизмы этиопатогенеза, клинические симптомы и лечение 1.
Лечение пациенток с ЭНД и/или АД включает как хирургическое, так и медикаментозное лечение 2. Фармакологический подход направлен на подавление овуляции и менструации с помощью гормонального лечения, при этом комбинированные оральные контрацептивы (КОК) с низкими дозами эстрогена рассматриваются как терапия первой линии, среди других методов лечения 3,4,5. КОКи могут применяться в обычном, непрерывном или гибком пролонгированном режиме 3. Пролонгированные схемы подавляют функцию яичников более надежно, чем 28-дневные циклические схемы, с большим прогрессированием симптомов, связанных с менструацией 6,7. В повседневной практике применение гибкого пролонгированного режима, состоящего из циклов по 120 дней подряд с активными таблетками с последующим 4-дневным интервалом без таблеток или через 120 дней, или через 3 дня подряд, когда наблюдаются кровянистые выделения 8, оказалось полезным благодаря меньшей частоте кровянистых выделений и высокому уровню удовлетворенности пациенток 7.
Большинство исследований анализировали влияние КОК на болевые симптомы у пациенток с различными типами ЭНД после хирургических вмешательств 9,10,11,12,13. Однако существует мало данных о клинических и сонографических эффектах КОК у пациенток с глубоким эндометриозом (ГЭ), который индуцирует высокий уровень боли 14, или у пациенток без предварительного хирургического вмешательства или с сопутствующей АД 15,16,17,18. Кроме того, немногочисленные исследования, в которых сообщается о сонографических эффектах этих методов лечения, касаются изолированных пациентов с ЭНД, преимущественно с эндометриомами яичников (ЭЯ), и с периодами наблюдения менее 12 месяцев 18,19,20. Насколько нам известно, ранее не было сообщений о сонографических изменениях после гормонального лечения у пациенток с ГЭ и АД. Эта информация важна для адекватного лечения и планирования дальнейшего наблюдения за этими очень распространенными подгруппами пациентов.
Исходя из этого сценария, целью этого проспективного наблюдения было оценить изменения, происходящие в симптоматике и сонографическом исследовании, о которых сообщали через 12 и 24 месяца наблюдения пациенты с ГЭ и АГ, которые получали гибкий расширенный режим приема КОК.
Материалы и методы
Структура исследования
Проспективное, одноцентровое, обсервационное исследование проводилось в отделении гинекологии Клинической больницы Барселоны, высшей университетской больницы в Испании и референтного центра по диагностике и лечению ЭНД и АГ. Исследование было одобрено местным Этическим комитетом (Comité Ético de Investigación con medicamentos del Hospital Clínic de Barcelona) в соответствии с действующими правилами (EMA/CHMP/ICH/135/1995). От всех участников было получено письменное информированное согласие. Все исследования были проведены согласно соответствующим нормативным документам и Хельсинской декларации.
Пациентов, которые не были кандидатами на хирургическое вмешательство, набирали в амбулатории нашего центра и предлагали начать лечение КОК (2 мг диеногеста/30 мкг этинилэстрадиола) по гибкому расширенному режиму. Ни одна из пациенток не имела противопоказаний или предыдущих побочных эффектов для такого типа лечения. При консультировании пациенток по выбору между гормональным лечением или хирургическим лечением боли, связанной с эндометриозом, применялся общий подход к принятию решений с учетом индивидуальных предпочтений, побочных эффектов, индивидуальной эффективности, стоимости и доступности 21.
Конечными точками этого исследования было, во-первых, изучение изменений в симптомах, о которых сообщали пациенты. Для оценки боли использовалась числовая рейтинговая шкала (ЧРШ) (1 – отсутствие боли, 10 – наивысший уровень боли). Оценивались различные типы боли: дисменорея, неменструальная тазовая боль, глубокая диспареуния, Дисхезия и дизурия, которые определялись на начальном этапе, а также через 12 и 24 месяца наблюдения. Тяжелые симптомы рассматривались при баллах по ЧРШ≥ 7 22.
Второй конечной точкой было сообщение о сонографических изменениях в установленных контрольных точках. Изменения регистрировались в соответствии с консенсусными рекомендациями международной группы по проведению трансвагинальной сонографии с высоким разрешением (ТВС) 23,24,25,26.
Влияние лечения измеряли, оценивая изменения в ЧРШ для оцениваемых параметров боли, а также изменения в размерах поражения ГЭ и ЭЯ, когда это было уместно, и в количестве и типе сонографических критериев АД, имеющихся на начальном этапе, а также через 12 и 24 месяца наблюдения.
Участники
Пациенты с недавно диагностированным ГЭ и АГ, которые не были кандидатами на хирургическое лечение (например, стеноз мочеточника), были отобраны в период с января 2019 года по январь 2020 года. Диагноз был подтвержден специализированным сонографическим обследованием.
Пациентки должны были быть старше 18 лет, женщины в пременопаузе с ГЭ и АГ и быть кандидатами на лечение с использованием гибкого расширенного режима приема КОК, состоящего из циклов по 120 дней подряд с активными таблетками с последующим 4-дневным интервалом без таблеток либо через 120 дней, либо через 3 дня подряд после прекращения приема таблеток. Они также должны были согласиться на клиническое и сонографическое обследование на начальном этапе, а также через 12 и 24 месяца наблюдения.
Критерии исключения для всех участниц предусматривали противопоказания к эстрогенам и прогестагенам, психические расстройства, злоупотребление психоактивными веществами в анамнезе, применение аналогов гонадотропин-рилизинг-гормона или другого гормонального лечения в течение последних 6 и 3 месяцев соответственно, наличие других заболеваний матки (миомы, полипов и гиперплазии эндометрия), новообразований, а также наличие других хронических заболеваний, таких как сердечные заболевания и/или сахарный диабет. Пациентки с хирургическими критериями или пациентки, у которых проведение ТВС было невозможным (например, девственницы пациентки), были исключены 25. Было набрано 64 пациента, которые соответствовали критериям участия в исследовании (рис.1).
Блок-схема включения и исключения пациентов.
Методика проведения исследования
Всем пациенткам проводили 2D-3D ТВС высокого разрешения с использованием эндовагинального датчика (тип RIC5-9, Voluson V730 Expert, GE Healthcare, Milwaukee, WI, США) и выполняли подготовку кишечника для улучшения идентификации и измерения ГЭ, как описано ранее, согласно протоколу нашего центра 25. Обследование проводилось двумя экспертами-сонографистами (К.Р. и М.Р.), которые не знали об участии пациентки в исследовании, а диагнозы АД и ЭНД были установлены в соответствии с консенсусом группы Морфологической сонографической оценки матки (Morphological Uterus Sonographic Assessment MUSA) 23 для АД и консенсуса международной группы анализа эндометриоза (International Deep Endometriosis Analysis IDEA) для ЭНД 24. Что касается АД, по одному баллу начисляли за наличие каждого из 6 критериев МСОМ: интрамиометриальные кисты, гиперэхогенные островки, веерообразное затенение, асимметричное утолщение, трансректальная васкуляризация и прерванная зона соединения 23, что требует наличия как минимум двух критериев для установления диагноза АД 23,27. Переменными, которые изучались относительно ЭНД, были наличие и размер (среднее значение обоих максимальных диаметров, выраженное в миллиметрах) ЭЯ и глубоких ректосигмоидных эндометриозов, ГЭ прямокишечно-маточных связок (ПМС), торусных, вагинальных, мочеточниковых и пузырно-пузырчатых ГЭ 24.
Статистический анализ
Размер выборки оценивали на основе предыдущих исследований, анализировавших влияние КОК на болевые симптомы 15,16,17,18 и сонографические изменения 18,19,20. Минимальное количество пациентов, необходимое для получения α-погрешности 0,05 и β-погрешности 0,20, составляло 52. Дополнительно было учтено 15% возможных отсевов. Категориальные переменные выражены в виде количества и процентов, а непрерывные переменные – в виде среднего значения и стандартного отклонения. Распределение категориальных переменных сравнивали с помощью теста хи-квадрат, а количественных переменных – с помощью теста ANOVA. Статистическая значимость устанавливалась на уровне p < 0,05. Статистический анализ проводился с помощью программного обеспечения Statistical Package for the Social Sciences, версия 25.0 для Windows (SPSS, Чикаго, Иллинойс, США).
Этическое одобрение и согласие на участие
Исследование было одобрено местным этическим комитетом в соответствии с действующими нормами. От всех участников было получено письменное информированное согласие.
Результаты
Характеристики пациентов
Базовые клинические характеристики и типы ЭНД, выявленные при сонографическом исследовании, приведены в таблице 1. Ни у одного пациента не было пузырного, вагинального или мочеточникового ГЭ. Аденомиом не выявлено.
Таблица 1 Клинические характеристики участников исследования на начальном этапе.
| Переменные | |
|---|---|
| Возраст | 38.5 ± 4.8 |
| ИМТ | 22.3 ± 1.7 |
| Курильщики | 10 (15.6%) |
| Не рожала или не вынашивала ребенка ранее | 45 (70.3%) |
| Бесплодие | 32 (50%) |
| Аденомиоз | 63 (100%) |
| Эндометриомы яичников | 40 (63.5%) |
| Ретросигмоидный ГЭ | 30 (47.6%) |
| Торус ГЭ | 36 (57.1%) |
| ГЭ ПМС | 24 (38.1%) |
- Результаты выражены в виде количества и процентов или среднего значения ± стандартное отклонение.
- ГЭ глубокий эндометриоз, ИМТ индекс массы тела, ПМС прямокишечно-маточные связки.
После 12-месячного наблюдения 63/64 пациентки продолжали лечение, и единственный случай отсева был связан с желанием пациентки забеременеть. Пятьдесят три пациентки завершили 24-месячное лечение. Причиной досрочного прекращения лечения у 10 пациенток было желание забеременеть (n = 5), персистирующие кровянистые выделения (n = 3) и потеря возможности дальнейшего наблюдения (n = 2) (рис. 1). В течение периода исследования не было зарегистрировано никаких серьезных нежелательных явлений. Несерьезные побочные эффекты включали головную боль и напряжение молочных желез (которые не требовали прекращения лечения). Ни одна из пациенток не нуждалась в хирургическом вмешательстве в течение периода исследования.
Влияние КОК в клиническом исследовании
Как и ожидалось, количество пациенток с тяжелой дисменореей (n = 52 (82,5%) по сравнению с n = 4 (6,3%) по сравнению с n = 0 (0%) [p <0,001]) и неменструальной тазовой болью (n = 20 (31,7%) по сравнению с n = 0 (0%), по сравнению с n = 0 (0%) [p <0,001]) уменьшилась от начального уровня до 12- и 24-месячных наблюдений. Средний показатель ЧРШ для дисменореи, неменструальной тазовой боли, глубокой диспареунии, диспепсии и дизурии также уменьшился в 12- и 24-месячных наблюдениях (табл. 2).
Таблица 2 Влияние КОК на оценку симптомов на начальном этапе и через 12 и 24 месяца наблюдения у пациенток с эндометриозом и аденомиозом.
| Переменные | Начальный этап N = 64 | 12-месячное наблюдение N = 63 | 24-месячное наблюдение N = 53 | p-value |
|---|---|---|---|---|
| Выраженная дисменорея* | 52 (82.5%)a | 4(6.3%)b | 0 (0%)c | a-bp < 0.001;b-c НЗ |
| a-cp < 0.001 | ||||
| Сильная не менструальная тазовая боль* | 20 (31.7%)a | 0 (0%)b | 0 (0%)c | a-b p < 0.001;b-c НЗ |
| a-cp < 0.001 | ||||
| Дисменорея** | 8.05 ± 1.61a | 3.76 ± 2.19b | 1.51 ± 1.60c | a-b, b-c, a-cp < 0.001 |
| Неменструальная тазовая боль** | 5.95 ± 1.52a | 2.08 ± 1.65b | 0.79 ± 1.17c | a-b, b-c, a-c p < 0.001 |
| Диспареуния** | 3.70 ± 3.59a | 0.81 ± 1.85b | 0.70 ± 1.65c | a-b, a-cp < 0.001 |
| b-cНЗ | ||||
| Дисхезия** | 1.98 ± 3.41a | 0.44 ± 1.39b | 0.45 ± 1.42c | a-b, a-cp < 0.001 |
| b-cНЗ | ||||
| Дизурия** | 0.43 ± 1.68a | 0.11 ± 0.63b | 0.13 ± 0.68c | a-b, b-c, a-cp = НЗ |
- Результаты выражены в виде количества и процентов или среднего значения ± стандартное отклонение.
- НЗ не значимы.
*Числовая рейтинговая шкала (ЧРШ) ≥ 7.
**Среднее значение ЧРШ.
Влияние КОК на сонографическую выраженность аденомиоза
При сравнении исходных результатов с результатами 12- и 24-месячного наблюдения наблюдалось достоверное уменьшение сонографической выраженности АД с уменьшением количества пациентов, которые соответствовали этому диагнозу (n = 63 (100%) против n = 42 (66,7%) против n = 32 (60,4%) соответственно (p < 0,001)). Кроме того, количество пациентов, которые соответствовали 4 и 3 критериям, уменьшилось через 12 и 24 месяца (p < 0,0001) (табл. 3).
Таблица 3 Количество сонографических критериев диагностики аденомиоза на начальном этапе и через 12 и 24 месяца наблюдения.
| Начальный этапа N = 64 | 12-месячное наблюдениеb N = 63 | 24-месячное наблюдениеc N = 53 | p-value | |
|---|---|---|---|---|
| > 2 критериев | 63 (100%)a | 42 (66.7%)b | 32 (60.4%)c | a-b, a-c p < 0.001 |
| b-c НЗ | ||||
| > 3 критериев | 58 (92.1%)a | 33 (52.4%)b | 23 (36.5%)c | a-b, a-c p < 0.001 |
| b-c p = НЗ | ||||
| > 4 критериев | 48 (76.2%)a | 18 (27.5%)b | 13 (20.7%)c | a-b, a-c p < 0.001 |
| b-c p = НЗ |
- Результаты выражены в виде количества и процентов или среднего значения ± стандартное отклонение.
- НЗ не значимы.
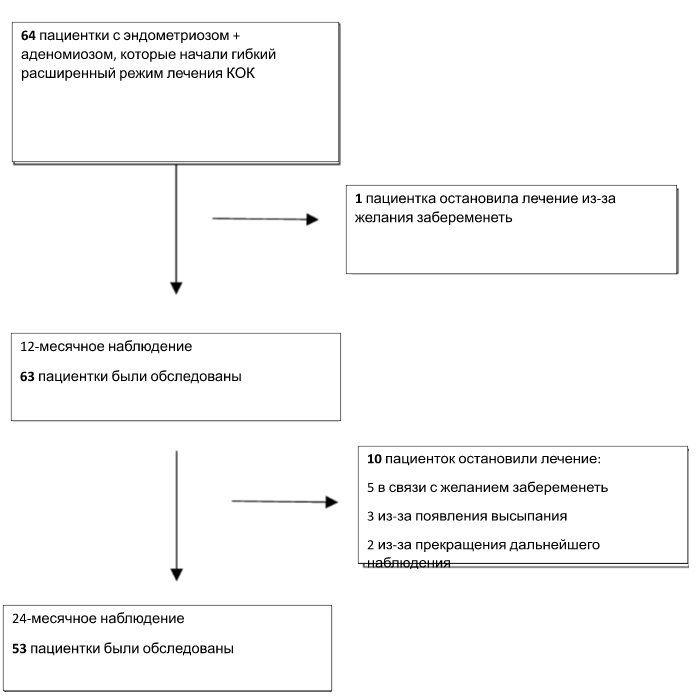
Гиперэхогенные островки и прерывистая зона соединения эндометрия и миометрия были наиболее частыми критериями АД, выявленными как на начальном этапе, так и в последующих точках исследования. Все критерии уменьшились во время наблюдения, причем уменьшение между начальным этапом и 12-месячным наблюдением было статистически значимым (табл. 4, рис.2).
Таблица 4 Сонографические критерии диагностики аденомиоза на начальном этапе и через 12 и 24 месяца наблюдения.
Рисунок 2
| Начальный этапa N = 64 | 12-месячное наблюдениеb
N = 63 |
24-месячное наблюдениеc
N = 53 |
p-value | |
|---|---|---|---|---|
| Жесткие критерии | ||||
| Интрамиометриальные кисты | 22 (34.4%)a | 10 (15.9%)b | 7 (13.2%)c | a-b, a-cp < 0.0001 |
| b-cp = НЗ | ||||
| Гиперэхогенные островки | 62 (96.9%)a | 38 (60.3%)b | 29 (54.7%)c | a-b, a-cp < 0.0001 |
| b-cНЗ | ||||
| Мягкие критерии | ||||
| Веерообразное затенение | 44 (68.7%)a | 23 (36.5%)b | 17 (32.1%)c | a-bp = 0.0004 |
| a-cp < 0.0001 | ||||
| b-cp = НЗ | ||||
| Асимметричное утолщение | 45 (70.3%)a | 22 (34.9%)b | 18 (33.4%)c | a-b, a-cp < 0.0001 |
| b-cp = НЗ | ||||
| Васкуляризация вдоль поражения | 30 (46.9%)a | 11 (17.5%)b | 6 (11.3%)c | a-bp = 0.0006 |
| a-cp < 0.0001 | ||||
| b-cНЗ | ||||
| Прерывистая зона соединения | 57 (89.1%)a | 36 (57.1%)b | 25 (47.2%)c | a-b, a-cp < 0.0001 |
| b-cp = НЗ | ||||
- Результаты выражены в количестве и процентах.
- НЗ не значимы.
Сонографическая эволюция аденомиоза на начальном этапе и через 12 и 24 месяца наблюдения. (A и B) Первое УЗИ с наличием 5 критериев аденомиоза; (A) гиперэхогенные островки, веерообразное затенение, асимметричное утолщение стенки матки, прерывистая зона соединения миометрия и эндометрия и (B) васкуляризация вдоль поражения; (C) 12-месячное наблюдение с гиперэхогенными островками и асимметричным утолщением стенки матки как легкими признаками аденомиоза. (D) 24-месячное наблюдение без признаков аденомиоза.
Влияние КОК на сонографическую выраженность эндометриоза
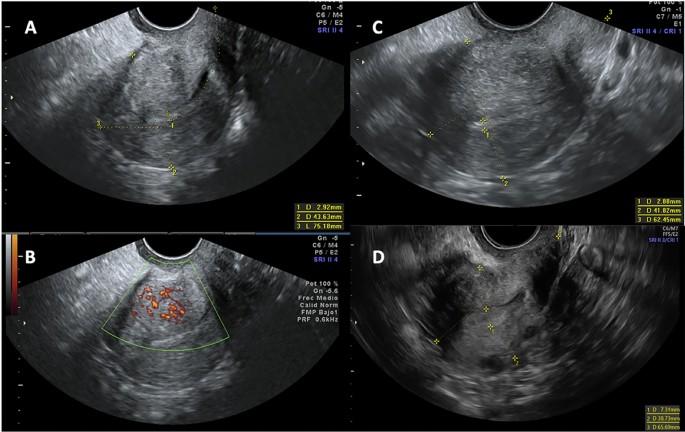
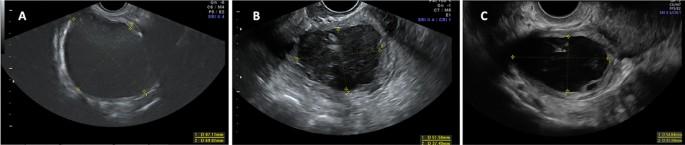
Мы обнаружили достоверное уменьшение размеров ЭЯ при сравнении исходного уровня с 12- и 24-месячными наблюдениями (33,45 ± 16,83 мм против 22,67 ± 4,02 [p < 0,02] против 18,62 ± 13,48 мм [p < 0,01] соответственно) (табл. 5, рис. 3). Наблюдалось уменьшение количества пациентов с торусным ГЭ, ГЭ ПМС и ректосигмоидным ГЭ через 12 и 24 месяца, хотя оно не было статистически значимым. Размер ПМС достоверно уменьшился от исходного уровня к 12 и 24 месяцам наблюдения (20,91 ± 8,75 мм; против 15,48 ± 6,07 [p < 0,03]; против 13,13 ± 4,48 мм [p < 0,004], соответственно) (табл. 5, рис. 4).
Таблица 5 Влияние КОК на сонографическую выраженность эндометриоза на начальном этапе и через 12 и 24 месяца наблюдения.
| Измерение | Начальный уровеньa N = 64 | 12-месячное наблюдениеb N = 63 | 24-месячное наблюдениеc N = 53 | p-value |
|---|---|---|---|---|
| Эндометриома яичников | 33.45 ± 16.83a | 22.67 ± 14.02b | 18.62 ± 13.48c | a-bp < 0.02 |
| b-cp = НЗ | ||||
| a-c p < 0.01 | ||||
| ГЭ Торуса | 25.78 ± 12.98a | 20.64 ± 8.35b | 19.53 ± 8.62c | a-b; b-c, a-cp = НЗ |
| ГЭ ПМС | 20.91 ± 8.75a | 15.48 ± 6.07b | 13.13 ± 4.48c | a-bp < 0.03;b-c p = НЗ |
| a-cp < 0.004 | ||||
| Ретросигмоидный ГЭ | 24.33 ± 10.23a | 22.22 ± 8.39b | 20.96 ± 8.77c | a-b; b-c, a-cp = НЗ |
- Результаты представлены как среднее ± стандартное отклонение.
- Измерения выражены в миллиметрах.
- ПМС прямокишечно-маточные связи, ГЭ глубокий эндометриоз, НЗ не значимый.
Рисунок 3
Сонографическая эволюция эндометриомы яичников на начальном этапе и через 12 и 24 месяца наблюдения. (А) Большая эндометриома со средним размером 78,0 мм, которая уменьшилась до 44,5 мм через 12 месяцев наблюдения на изображении (В) и до 43,1 мм через 24 месяца наблюдения на изображении (С).
Рисунок 4
Сонографическая эволюция прямокишечно-маточного глубокого эндометриоза на начальном этапе и через 12 и 24 месяца наблюдения. Изображение (А) прямокишечно-маточный глубокий инфильтрирующий узелок со средним размером 15,0 мм, который уменьшился до 10,0 мм при 12-месячном наблюдении на изображении (В) и до 8,3 мм при 24-месячном наблюдении на изображении (С).
Обсуждение
Лечение ЭНД и АД является сложной задачей для гинекологов, учитывая, что терапевтическая стратегия должна быть модулированной и адаптированной к особенностям пациентки. Наше исследование предоставляет ценную информацию о клинических и сонографических изменениях поражения ГЭ и критерии АД у пациенток с обоими образованиями. Стоит отметить, что у высокого процента пациентов ГЭ ассоциируется с АД, а потому важно знать, является ли гормональное лечение эффективным у пациентов с обоими образованиями в долгосрочной перспективе, чтобы лучше планировать визиты и радиологическое наблюдение. Фармакологическое лечение, такое как КОК, может быть целесообразным вариантом для большого количества таких пациентов 15,16,17,18. КОК применяются для лечения тазовой боли у пациентов с ЭНД уже более 50 лет и, как сообщалось, уменьшают или устраняют боль примерно у 90% пациентов 2. В этом исследовании вместо традиционной схемы применяли гибкую расширенную схему приема КОК, поскольку предыдущие исследования и наш большой институциональный опыт показали, что такая схема обеспечивает лучший контроль болевых симптомов, а пациентки лучше контролируют точечные кровотечения 5. Однако самая эффективная комбинация эстропрогестагенов неизвестна. Относительно прогестагенов, содержащихся в КОК, исследования доказали пользу для здоровья прогестагенов четвертого поколения, таких как дроспиренон и диеногест 28. Мы использовали комбинацию 2 мг диеногеста и 30 мкг этинилэстрадиола из-за ее низкой стоимости, а также из-за того, что этот прогестаген хорошо переносится и имеет мало побочных эффектов у большинства пациенток.
Основной целью этого исследования было оценить влияние расширенной длительной схемы приема КОК на различные болевые симптомы, о которых часто сообщают пациентки с ЭНД и/или АГ, и мы наблюдали уменьшение количества пациенток с тяжелой дисменореей и неменструальной тазовой болью во время наблюдения. Средний показатель ЧРШ для дисменореи, неменструальной тазовой боли, глубокой диспареунии, диспепсии и дизурии также был ниже в 12- и 24-месячных наблюдениях. Эти результаты согласуются с ранее опубликованными исследованиями 3,5,9,10,11,12,13,15,16, хотя наше исследование предполагает один из самых длительных периодов наблюдения.
Нашей целью также было исследовать влияние КОК на особенности ГЭ и АД при ТВС обследовании в течение как минимум двух лет наблюдения. Наблюдалось уменьшение сонографической выраженности как ЭНД, так и АД. Важно подчеркнуть, что при сравнении исходных значений с 12-месячным наблюдением было отмечено достоверное уменьшение размеров ПМС, причем это уменьшение демонстрировало тенденцию к еще большему увеличению через 24 месяца. Кроме того, поражения торуса и ректосигмоидного ГЭ показали уменьшение, хотя и не статистически значимое, в размерах. Уменьшение размеров ЭЯ было достоверным и более заметным по сравнению с поражениями ГЭ, а также было достоверным только в первой точке исследования через год после начала лечения. Преобладание фиброза и наличие меньшего количества эндометриальных желез при ГЭ поражениях может быть причиной меньшего сонографического ответа при некоторых типах ГЭ поражений по сравнению с другими типами ЭНД, такими как ЭЯ 29,30,31. Эти результаты исследования с помощью ТВС также согласуются с предыдущими сообщениями. Другие авторы описали статистически значимое уменьшение объема ЭЯ после различных видов гормонального лечения, таких как диеногест 17,18,19,20 или КОК 3,5,32. Немногочисленные исследования, оценивающие сонографические изменения изолированных ГЭ ректосигмоидных эндометриоидных узлов после нескольких видов гормонального лечения 33,34,35,36 , наблюдали значительное уменьшение ректосигмоидных узлов эндометриоза через 6 и 12 месяцев наблюдения. Насколько нам известно, этот вопрос ранее не анализировался при более длительном наблюдении. Кроме того, ни одно предыдущее исследование не оценивало сонографическое влияние КОК на АД. Стоит отметить, что наблюдалось значительное уменьшение количества критериев АД в 12- и 24-месячных наблюдениях, а также то, что почти 40% пациенток, которые имели АД в начале исследования, не имели никаких признаков АД в 24-месячном наблюдении, что свидетельствует о полном сонографическом ответе на гормональную терапию. Подобно ГЭ ПМС и ЭЯ, наблюдалось значительное снижение всех сонографических критериев АД через 12 месяцев наблюдения и тенденция к снижению к 24 месяцам наблюдения. Кроме того, предыдущие исследования предположили, что эндометриоз – это заболевание, которое, вероятно, прогрессирует от подросткового до зрелого возраста 37,38 , тогда как самая высокая распространенность глубоких инфильтративных поражений наблюдается после 26 лет и, как представляется, возрастает от подросткового возраста до четвертого десятилетия. Поэтому эти авторы предположили, что политика по профилактике и ранней диагностике эндометриоза должна быть направлена на женщин моложе 25 лет, и подчеркнули, что прогрессирование эндометриоза у старших пациенток, которые все еще находятся в фертильном периоде, могло прекратиться 37, 38. Это могло произойти у определенного процента пациенток со средним возрастом 38,5 ± 4,8 лет в нашем исследовании, но этот вопрос не мог быть выяснен в нашем исследовании, поскольку контрольная группа без лечения не была включена, и дальнейшие исследования оправданы для выяснения этого 37, 38.
Сильными сторонами этого исследования являются строгие критерии включения и исключения, а продолжительность наблюдения была одной из самых длительных в литературе. Другими сильными сторонами были оценка клинических проявлений ЭНД во всех его формах (дисменорея, неменструальная тазовая боль, глубокая диспареуния, дисхезия и дизурия), оценка как АД, так и ГЭ и их сонографическое выражение, а также использование одного и того же КОК у всех пациенток.
Для интерпретации данных следует учитывать несколько ограничений нашего исследования: во-первых, мы привлекли относительно небольшое количество пациентов, хотя по размеру выборки она была сопоставима или даже превосходила другие ранее опубликованные исследования 17,19,32,33,34,35,36. Во-вторых, мы оценивали пациентов в двух произвольных точках исследования, через 12 и 24 месяца наблюдения, но поскольку самые важные изменения наблюдались через год наблюдения, было бы интересно оценить изменения до этой точки исследования и позже, чем через 24 месяца, чтобы повторно оценить улучшения при более коротком и более длинном наблюдении. В-третьих, в нашей исследуемой популяции не были описаны все локализации ГЭ, но были самые распространенные, а следовательно, ГЭ везикулярного, вагинального или эндометриоза мочеточника следует оценивать в другой пораженной популяции. Наконец, мы не сравнивали результаты различных схем КОК, других гормональных методов лечения или применения анальгетиков. Что касается последнего вопроса, хотя мы не имеем точной информации о дозировке сопутствующих анальгетиков, которые применяли пациентки во время диагностики и наблюдения, уменьшение болевых симптомов через 12 и 24 месяца позволяет предположить уменьшение потребления обезболивающих средств.
Исходя из этого сценария, в будущих исследованиях следует рассмотреть возможность проведения рандомизированных контролируемых исследований в большой популяции с более длительным наблюдением и большим количеством точек исследования. Кроме того, следует проанализировать сравнение различных доз и типов гормонов .
Вывод
Итак, это проспективное исследование свидетельствует о значительном уменьшении болевых симптомов и сонографической выраженности ЭНД и АД после применения гибкого расширенного режима приема КОК через 12 месяцев наблюдения, с тенденцией к улучшению в период между 12 и 24 месяцами наблюдения. Улучшение было более очевидным при АД, ГЭ ПМС и ЭЯ по сравнению с ГЭ торуса и ректосигмоидным ГЭ. Необходимы дальнейшие исследования с более длительным наблюдением, большим размером выборки и сравнением с другими методами лечения.
Ссылки
- Leyendecker, G. et al. Adenomyosis and endometriosis. Re-visiting their association and further insights into the mechanisms of auto-traumatisation. An MRI study. Arch. Gynecol. Obstet. 291(4), 917–32 (2015).
- Vercellini, P., Viganò, P., Somigliana, E. & Fedele, L. Endometriosis: Pathogenesis and treatment. Nat. Rev. Endocrinol. 10(5), 261–275 (2014).
- Harada, T. et al. Ethinylestradiol 20 μg/drospirenone 3 mg in a flexible extended regimen for the management of endometriosis-associated pelvic pain: A randomized controlled trial. Fertil. Steril. 108(5), 798–805 (2017).
- Ferrero, S., Evangelisti, G. & Barra, F. Current and emerging treatment options for endometriosis. Expert Opin. Pharmacother. 19, 1109–25 (2018).
- Jensen, J. T., Schlaff, W. & Gordon, K. Use of combined hormonal contraceptives for the treatment of endometriosis-related pain: A systematic review of the evidence. Fertil. Steril. 110(1), 137-152.e1 (2018).
- Birtch, R. L., Olatunbosun, O. A. & Pierson, R. A. Ovarian follicular dynamics during conventional vs. continuous oral contraceptive use. Contraception 73(3), 235–43 (2006).
- Wiegratz, I. & Kuhl, H. Long-cycle treatment with oral contraceptives. Drugs 64(21), 2447–2462 (2004).
- Klipping, C. et al. Contraceptive efficacy and tolerability of ethinylestradiol 20 μg/drospirenone 3 mg in a flexible extended regimen: An open-label, multicentre, randomised, controlled study. J. Fam. Plan. Reprod. Health Care 38(2), 73–83 (2012).
- Vercellini, P. et al. Cyproterone acetate versus a continuous monophasic oral contraceptive in the treatment of recurrent pelvic pain after conservative surgery for symptomatic endometriosis. Fertil. Steril. 77(1), 52–61 (2002).
- Guzick, D. S., Huang, L. S., Broadman, B. A., Nealon, M. & Hornstein, M. D. Randomized trial of leuprolide versus continuous oral contraceptives in the treatment of endometriosis-associated pelvic pain. Fertil. Steril. 95(5), 1568–1573 (2011).
- Razzi, S. et al. Efficacy of vaginal danazol treatment in women with recurrent deeply infiltrating endometriosis. Fertil. Steril. 88(4), 789–794 (2007).
- Strowitzki, T., Faustmann, T., Gerlinger, C. & Seitz, C. Dienogest in the treatment of endometriosis-associated pelvic pain: A 12-week, randomized, double-blind, placebo-controlled study. Eur. J. Obstet. Gynecol. Reprod. Biol. 151(2), 193–198 (2010).
- Harada, T. et al. Dienogest is as effective as intranasal buserelin acetate for the relief of pain symptoms associated with endometriosis-a randomized, double-blind, multicenter, controlled trial. Fertil. Steril. 91(3), 675–681 (2009).
- Fauconnier, A. & Chapron, C. Endometriosis and pelvic pain: Epidemiological evidence of the relationship and implications. Hum. Reprod. Update 11(6), 595–606 (2005).
- Momoeda, M. et al. Long-term use of dienogest for the treatment of endometriosis. J. Obstet. Gynaecol. Res. 35(6), 1069–1076 (2009).
- Sugimoto, K., Nagata, C., Hayashi, H., Yanagida, S. & Okamoto, A. Use of dienogest over 53 weeks for the treatment of endometriosis. J. Obstet. Gynaecol. Res. 41(12), 1921–1926 (2015).
- Angioni, S. et al. Is dienogest the best medical treatment for ovarian endometriomas? Results of a multicentric case control study. Gynecol. Endocrinol. 36(1), 84–86 (2020).
- Muzii, L. et al. Medical treatment of ovarian endometriomas: A prospective evaluation of the effect of dienogest on ovarian reserve, cyst diameter, and associated pain. Gynecol. Endocrinol. 36(1), 81–83 (2020).
- Vignali, M. et al. Effect of dienogest therapy on the size of the endometrioma. Gynecol. Endocrinol. 36(8), 723–7 (2020).
- del Forno, S. et al. Dienogest or norethindrone acetate for the treatment of ovarian endometriomas: Can we avoid surgery?. Eur. J. Obstet. Gynecol. Reprod. Biol. 1(238), 120–124 (2019).
- Becker, C. M. et al. ESHRE guideline: Endometriosis. Hum. Reprod. Open 2, hoac009 (2022).
- Bourdel, N. et al. Systematic review of endometriosis pain assessment: How to choose a scale?. Hum. Reprod. Update 21(1), 136–152 (2015).
- van den Bosch, T. et al. Terms, definitions and measurements to describe sonographic features of myometrium and uterine masses: A consensus opinion from the Morphological Uterus Sonographic Assessment (MUSA) group. Ultrasound Obstet. Gynecol. 46(3), 284–298 (2015).
- Guerriero, S. et al. Systematic approach to sonographic evaluation of the pelvis in women with suspected endometriosis, including terms, definitions and measurements: A consensus opinion from the International Deep Endometriosis Analysis (IDEA) group. Ultrasound Obstet. Gynecol. 48(3), 318–332 (2016).
- Ros, C. et al. Bowel preparation improves the accuracy of transvaginal ultrasound in the diagnosis of rectosigmoid deep infiltrating endometriosis: A prospective study. J. Minim. Invasive Gynecol. 24(7), 1145–1151 (2017).
- Ros, C. et al. Bowel preparation prior to transvaginal ultrasound improves detection of rectosigmoid deep infiltrating endometriosis and is well tolerated: Prospective study of women with suspected endometriosis without surgical criteria. Ultrasound Obstet. Gynecol. 57(2), 335–341 (2021).
- van den Bosch, T. & van Schoubroeck, D. Ultrasound diagnosis of endometriosis and adenomyosis: State of the art. Best Pract. Res. 51, 16–24 (2018).
- Regidor, P. A. & Schindler, A. E. Antiandrogenic and antimineralocorticoid health benefits of КОК containing newer progestogens: Dienogest and drospirenone. Oncotarget 8(47), 83334–42 (2017).
- Burney, R. O. & Giudice, L. C. Pathogenesis and pathophysiology of endometriosis. Fertil. Steril. 98(3), 511–519 (2012).
- Vigano, P. et al. Time to redefine endometriosis including its pro-fibrotic nature. Hum. Reprod. 33(3), 347–352 (2018).
- Patel, B. G. et al. Pathogenesis of endometriosis: Interaction between endocrine and inflammatory pathways. Best Pract. Res. Clin. Obstet. Gynaecol. 50, 50–60 (2018).
- Harada, T., Momoeda, M., Taketani, Y., Hoshiai, H. & Terakawa, N. Low-dose oral contraceptive pill for dysmenorrhea associated with endometriosis: A placebo-controlled, double-blind, randomized trial. Fertil. Steril. 90(5), 1583–1588 (2008).
- Ferrero, S., Venturini, P. L. & Remorgida, V. Changes in the size of rectovaginal endometriotic nodules infiltrating the rectum during hormonal therapies. Fertil. Steril. 94(4), S39 (2010).
- Vercellini, P. et al. Treatment of symptomatic rectovaginal endometriosis with an estrogen-progestogen combination versus low-dose norethindrone acetate. Fertil. Steril. 84(5), 1375–1387 (2005).
- Fedele, L., Bianchi, S., Zanconato, G., Tozzi, L. & Raffaelli, R. Gonadotropin-releasing hormone agonist treatment for endometriosis of the rectovaginal septum. Am J Obstet Gynecol. 75(3), 485–488 (2001).
- Fedele, L., Bianchi, S., Zanconato, G., Portuese, A. & Raffaelli, R. Use of a levonorgestrel-releasing intrauterine device in the treatment of rectovaginal endometriosis. Am. J. Obstet. Gynecol. 75(3), 485–488 (2001).
- Stochino-Loi, E. et al. Relationship between patient age and disease features in a prospective cohort of 1560 women affected by endometriosis. J. Minim. Invasive Gynecol. 27(5), 1158–1166 (2020).
- Netter, A. et al. Progression of deep infiltrating rectosigmoid endometriotic nodules. Hum. Reprod. 34(11), 2144–2152 (2019).