Резюме
Сьогодні комбіновані оральні контрацептиви (КОК) успішно застосовуються для лікування ендометріозу (ЕНД) та аденоміозу (АД) у значної частини пацієнток. Однак літератури, присвяченої клінічній та сонографічній відповіді на лікування при довгостроковому спостереженні за пацієнтками з глибоким ендометріозом (ГЕ) та АД, недостатньо. Метою цього дослідження було оцінити зміни в симптоматиці та сонографічних дослідженнях через 12 і 24 місяці спостереження у пацієнток, які отримували гнучкий розширений режим терапії КОК, що містить 2 мг дієногесту/30 мкг етинілестрадіолу. У це проспективне, лонгітюдне, обсерваційне дослідження були включені жінки з діагнозом ГЕ та АД, які не мали хірургічних показань і були кандидатами на лікування КОК. Наявність і вираженість дисменореї, неменструального тазового болю, глибокої диспареунії, диспепсії та дизурії оцінювали за допомогою числової рейтингової шкали (ЧРШ) на початковому етапі, а також через 12 і 24 місяці лікування. У цих контрольних точках також проводили трансвагінальне ультразвукове дослідження для виявлення критеріїв АД та визначення розмірів вузлів ГЕ та ендометріом яєчників (ЕЯ). Було включено 64 пацієнтки. Під час спостереження було зафіксовано значне зменшення кількості пацієнток з тяжкою дисменореєю та неменструальним тазовим болем. Середній бал за шкалою ЧРШ для дисменореї, неменструального тазового болю, глибокої диспареунії, диспепсії та дизурії також був значно нижчим під час спостереження. Під час спостереження після лікування спостерігалося значне зменшення кількості сонографічних критеріїв та типу АД. Аналогічно, достовірне зменшення розмірів ЕЯ і залучення прямокишково-маткової зв’язки зв’язки при ДЕ спостерігалося при 12-місячному спостереженні з подальшим, хоча і не статистично достовірним, зменшенням протягом 12-24-місячного спостереження. Крім того, тора і ректосигмоїдний ГЕ зменшилися в розмірах, хоча це зменшення не було статистично значущим в жодній точці дослідження. Це проспективне дослідження свідчить про клінічне та сонографічне покращення після гнучкого розширеного режиму КОК у пацієнтів з ГЕ та АД, яке було значущим через 12 місяців спостереження. Покращення було більш очевидним при АД та ЕЯ порівняно з ГЕ. Необхідні подальші дослідження з більш тривалим спостереженням, більшим розміром вибірки і порівнянням з іншими методами лікування.
Вступ
Ендометріоз (ЕНД) та аденоміоз (АД) є доброякісними, естрогензалежними, хронічними гінекологічними захворюваннями, які співіснують приблизно у 35% пацієнток, маючи спільні механізми етіопатогенезу, клінічні симптоми та лікування 1.
Лікування пацієнток з ЕНД та/або АД включає як хірургічне, так і медикаментозне лікування 2. Фармакологічний підхід спрямований на пригнічення овуляції та менструації за допомогою гормонального лікування, при цьому комбіновані оральні контрацептиви (КОК) з низькими дозами естрогену розглядаються як терапія першої лінії, серед інших методів лікування 3,4,5. КОКи можуть застосовуватися у звичайному, безперервному або гнучкому пролонгованому режимі3. Пролонговані схеми пригнічують функцію яєчників більш надійно, ніж 28-денні циклічні схеми, з більшим прогресуванням симптомів, пов’язаних з менструацією 6,7. У повсякденній практиці застосування гнучкого пролонгованого режиму, що складається з циклів по 120 днів поспіль з активними таблетками з наступним 4-денним інтервалом без таблеток або через 120 днів, або через 3 дні поспіль, коли спостерігаються кров’янисті виділення 8, виявилося корисним завдяки меншій частоті кров’янистих виділень і високому рівню задоволеності пацієнток 7.
Більшість досліджень аналізували вплив КОК на больові симптоми у пацієнток з різними типами ЕНД після хірургічних втручань 9,10,11,12,13. Однак існує мало даних про клінічні та сонографічні ефекти КОК у пацієнток з глибоким ендометріозом (ГЕ), який індукує вищий рівень болю 14, або у пацієнток без попереднього хірургічного втручання чи з супутньою АД 15,16,17,18. Крім того, нечисленні дослідження, в яких повідомляється про сонографічні ефекти цих методів лікування, стосуються ізольованих пацієнтів з ЕНД, переважно з ендометріомами яєчників (ЕЯ), і з періодами спостереження менше 12 місяців 18,19,20. Наскільки нам відомо, раніше не було повідомлень про сонографічні зміни після гормонального лікування у пацієнток з ГЕ та АД. Ця інформація є важливою для адекватного лікування та планування подальшого спостереження за цими дуже поширеними підгрупами пацієнтів.
Виходячи з цього сценарію, метою цього проспективного спостереження було оцінити зміни, що відбуваються в симптоматиці та сонографічному дослідженні, про які повідомляли через 12 та 24 місяці спостереження пацієнти з ГЕ та АГ, які отримували гнучкий розширений режим прийому КОК.
Матеріали та методи
Структура дослідження
Проспективне, одноцентрове, обсерваційне дослідження проводилося у відділенні гінекології Клінічної лікарні Барселони, вищої університетської лікарні в Іспанії та референтного центру з діагностики та лікування ЕНД та АГ. Дослідження було схвалено місцевим Етичним комітетом (Comité Ético de Investigación con medicamentos del Hospital Clínic de Barcelona) відповідно до чинних правил (EMA/CHMP/ICH/135/1995). Від усіх учасників було отримано письмову інформовану згоду. Всі дослідження були проведені згідно з відповідними нормативними документами та Гельсінською декларацією.
Пацієнтів, які не були кандидатами на хірургічне втручання, набирали в амбулаторії нашого центру і пропонували розпочати лікування КОК(2 мг дієногесту/30 мкг етинілестрадіолу) за гнучким розширеним режимом. Жодна з пацієнток не мала протипоказань або попередніх побічних ефектів для такого типу лікування. При консультуванні пацієнток щодо вибору між гормональним лікуванням або хірургічним лікуванням болю, пов’язаного з ендометріозом, застосовувався спільний підхід до прийняття рішень з урахуванням індивідуальних переваг, побічних ефектів, індивідуальної ефективності, вартості та доступності 21.
Кінцевими точками цього дослідження було, по-перше, вивчення змін у симптомах, про які повідомляли пацієнти. Для оцінки болю використовували числову рейтингову шкалу (ЧРШ) (1 – відсутність болю, 10 – найвищий рівень болю). Оцінювалися різні типи болю: дисменорея, неменструальний тазовий біль, глибока диспареунія, дишезія і дизурія, які визначалися на початковому етапі, а також через 12 і 24 місяці спостереження. Тяжкі симптоми розглядалися при балах за ЧРШ≥ 7 22.
Другою кінцевою точкою було повідомлення про сонографічні зміни у встановлених контрольних точках. Зміни реєструвалися відповідно до консенсусних рекомендацій міжнародної групи з проведення трансвагінальної сонографії з високою роздільною здатністю (ТВС) 23,24,25,26.
Вплив лікування вимірювали, оцінюючи зміни в ЧРШ для оцінюваних параметрів болю, а також зміни в розмірах ураження ГЕ та ЕЯ, коли це було доречно, і в кількості та типі сонографічних критеріїв АД, наявних на початковому етапі, а також через 12 і 24 місяці спостереження.
Учасники
Пацієнти з нещодавно діагностованим ГЕ та АГ, які не були кандидатами на хірургічне лікування (наприклад, стеноз сечоводу), були відібрані в період з січня 2019 року по січень 2020 року. Діагноз був підтверджений спеціалізованим сонографічним обстеженням.
Пацієнтки повинні були бути старше 18 років, жінки в пременопаузі з ГЕ та АГ і бути кандидатами на лікування з використанням гнучкого розширеного режиму прийому КОК, що складається з циклів по 120 днів поспіль з активними таблетками з наступним 4-денним інтервалом без таблеток або через 120 днів, або через 3 дні поспіль після припинення прийому таблеток. Вони також повинні були погодитися на клінічне та сонографічне обстеження на початковому етапі, а також через 12 і 24 місяці спостереження.
Критерії виключення для всіх учасниць передбачали протипоказання до естрогенів і прогестагенів, психічні розлади, зловживання психоактивними речовинами в анамнезі, застосування аналогів гонадотропін-рилізинг-гормону або іншого гормонального лікування протягом останніх 6 і 3 місяців відповідно, наявність інших захворювань матки (міоми, поліпів і гіперплазії ендометрія), новоутворень, а також наявність інших хронічних захворювань, таких як серцеві захворювання та/або цукровий діабет. Пацієнтки з хірургічними критеріями або пацієнтки, у яких проведення ТВС було неможливим (наприклад, незаймані пацієнтки), були виключені 25. Було набрано 64 пацієнти, які відповідали критеріям участі в дослідженні (зобр. 1).
Блок-схема включення та виключення пацієнтів.
Методика проведення дослідження
Усім пацієнткам проводили 2D-3D ТВC високої роздільної здатності з використанням ендовагінального датчика (тип RIC5-9, Voluson V730 Expert, GE Healthcare, Milwaukee, WI, США) і виконували підготовку кишечника для покращення ідентифікації та вимірювання ГЕ, як описано раніше, згідно з протоколом нашого центру 25. Обстеження проводилося двома експертами-сонографістами (К.Р. і М.Р.), які не знали про участь пацієнтки в дослідженні, а діагнози АД і ЕНД були встановлені відповідно до консенсусу групи Морфологічної сонографічної оцінки матки (Morphological Uterus Sonographic Assessment MUSA) 23 для АД і консенсусу міжнародної групи аналізу ендометріозу (International Deep Endometriosis Analysis IDEA) для ЕНД 24. Щодо АД, по одному балу нараховували за наявність кожного з 6 критеріїв МСОМ: інтраміометріальні кісти, гіперехогенні острівці, віялоподібне затінення, асиметричне потовщення, трансректальна васкуляризація та перервана зона з’єднання 23, що вимагає наявності щонайменше двох критеріїв для встановлення діагнозу АД 23,27. Змінними, які вивчалися щодо ЕНД, були наявність і розмір (середнє значення обох максимальних діаметрів, виражене в міліметрах) ЕЯ і глибоких ректосигмоїдних ендометріозів, ГЕ прямокишково-маткових зв’язок (ПМЗ), торусних, вагінальних, сечовідних і міхурово-міхурцевих ГЕ 24.
Статистичний аналіз
Розмір вибірки оцінювали на основі попередніх досліджень, що аналізували вплив КОК на больові симптоми 15,16,17,18 та сонографічні зміни 18,19,20. Мінімальна кількість пацієнтів, необхідна для отримання α-похибки 0,05 і β-похибки 0,20, становила 52. Додатково було враховано 15% можливих відсівів. Категоріальні змінні виражені у вигляді кількості та відсотків, а неперервні змінні – у вигляді середнього значення та стандартного відхилення. Розподіл категоріальних змінних порівнювали за допомогою тесту хі-квадрат, а кількісних змінних – за допомогою тесту ANOVA. Статистична значущість встановлювалася на рівні p < 0,05. Статистичний аналіз проводився за допомогою програмного забезпечення Statistical Package for the Social Sciences, версія 25.0 для Windows (SPSS, Чикаго, Іллінойс, США).
Етичне схвалення та згода на участь
Дослідження було схвалено місцевим етичним комітетом відповідно до чинних норм. Від усіх учасників було отримано письмову інформовану згоду.
Результати
Характеристики пацієнтів
Базові клінічні характеристики та типи ЕНД, виявлені при сонографічному дослідженні, наведені в таблиці 1. У жодного пацієнта не було міхурового, вагінального або сечовідного ГЕ. Аденоміом не виявлено.
Таблиця 1 Клінічні характеристики учасників дослідження на початковому етапі.
| Змінні | |
|---|---|
| Вік | 38.5 ± 4.8 |
| ІМТ | 22.3 ± 1.7 |
| Курці | 10 (15.6%) |
| Не народжувала або не виношувала дитину раніше | 45 (70.3%) |
| Безпліддя | 32 (50%) |
| Аденоміоз | 63 (100%) |
| Ендометріоми яєчників | 40 (63.5%) |
| Ретросигмоїдний ГЕ | 30 (47.6%) |
| Торус ГЕ | 36 (57.1%) |
| ГЕ ПМЗ | 24 (38.1%) |
- Результати виражені у вигляді кількості та відсотків або середнього значення ± стандартне відхилення.
- ГЕ глибокий ендометріоз, ІМТ індекс маси тіла, ПМЗ прямокишково-маткові зв’язки.
Після 12-місячного спостереження 63/64 пацієнтки продовжували лікування, і єдиний випадок відсіву був пов’язаний з бажанням пацієнтки завагітніти. П’ятдесят три пацієнтки завершили 24-місячне лікування. Причиною дострокового припинення лікування у 10 пацієнток було бажання завагітніти (n = 5), персистуючі кров’янисті виділення (n = 3) та втрата можливості подальшого спостереження (n = 2) (зобр. 1). Протягом періоду дослідження не було зареєстровано жодних серйозних небажаних явищ. Несерйозні побічні ефекти включали головний біль і напруження молочних залоз (які не потребували припинення лікування). Жодна з пацієнток не потребувала хірургічного втручання протягом періоду дослідження.
Вплив КОК у клінічному дослідженні
Як і очікувалося, кількість пацієнток з тяжкою дисменореєю (n = 52 (82,5%); порівняно з n = 4 (6,3%); порівняно з n = 0 (0%) [p < 0,001]) та неменструальним тазовим болем (n = 20 (31,7%); порівняно з n = 0 (0%), порівняно з n = 0 (0%) [p < 0,001]) зменшилася від початкового рівня до 12- та 24-місячних спостережень. Середній показник ЧРШ для дисменореї, неменструального тазового болю, глибокої диспареунії, диспепсії та дизурії також зменшився у 12- та 24-місячних спостереженнях (табл. 2).
Таблиця 2 Вплив КОК на оцінку симптомів на початковому етапі та через 12 і 24 місяці спостереження у пацієнток з ендометріозом та аденоміозом.
| Змінні | Початковий етапa N = 64 | 12-місячне спостереження N = 63 | 24-місячне спостереження N = 53 | p-value |
|---|---|---|---|---|
| Виражена дисменорея* | 52 (82.5%)a | 4(6.3%)b | 0 (0%)c | a-bp < 0.001;b-c НЗ |
| a-cp < 0.001 | ||||
| Сильний не менструальний тазовий біль* | 20 (31.7%)a | 0 (0%)b | 0 (0%)c | a-b p < 0.001;b-c НЗ |
| a-cp < 0.001 | ||||
| Дисменорея** | 8.05 ± 1.61a | 3.76 ± 2.19b | 1.51 ± 1.60c | a-b, b-c, a-cp < 0.001 |
| Неменструальний тазовий біль** | 5.95 ± 1.52a | 2.08 ± 1.65b | 0.79 ± 1.17c | a-b, b-c, a-c p < 0.001 |
| Диспареунія** | 3.70 ± 3.59a | 0.81 ± 1.85b | 0.70 ± 1.65c | a-b, a-cp < 0.001 |
| b-cНЗ | ||||
| Дишезія** | 1.98 ± 3.41a | 0.44 ± 1.39b | 0.45 ± 1.42c | a-b, a-cp < 0.001 |
| b-cНЗ | ||||
| Дизурія** | 0.43 ± 1.68a | 0.11 ± 0.63b | 0.13 ± 0.68c | a-b, b-c, a-cp = НЗ |
- Результати виражені у вигляді кількості та відсотків або середнього значення ± стандартне відхилення.
- НЗ не значущі.
- *Числова рейтингова шкала (ЧРШ) ≥ 7.
- **Середнє значення ЧРШ.
Вплив КОК на сонографічну вираженість аденоміозу
При порівнянні вихідних результатів з результатами 12- та 24-місячного спостереження спостерігалося достовірне зменшення сонографічної вираженості АД зі зменшенням кількості пацієнтів, які відповідали цьому діагнозу (n = 63 (100%) проти n = 42 (66,7%) проти n = 32 (60,4%) відповідно (p < 0,001)). Крім того, кількість пацієнтів, які відповідали 4 і 3 критеріям, зменшилася через 12 і 24 місяці (p < 0,0001) (табл. 3).
Таблиця 3 Кількість сонографічних критеріїв діагностики аденоміозу на початковому етапі та через 12 і 24 місяці спостереження.
| Початковий етапa N = 64 | 12-місячне спостереженняb N = 63 | 24-місячне спостереження c N = 53 | p-value | |
|---|---|---|---|---|
| > 2 критеріїв | 63 (100%)a | 42 (66.7%)b | 32 (60.4%)c | a-b, a-c p < 0.001 |
| b-c НЗ | ||||
| > 3 критеріїв | 58 (92.1%)a | 33 (52.4%)b | 23 (36.5%)c | a-b, a-c p < 0.001 |
| b-c p = НЗ | ||||
| > 4 критеріїв | 48 (76.2%)a | 18 (27.5%)b | 13 (20.7%)c | a-b, a-c p < 0.001 |
| b-c p = НЗ |
- Результати виражені у вигляді кількості та відсотків або середнього значення ± стандартне відхилення.
- НЗ не значущі.
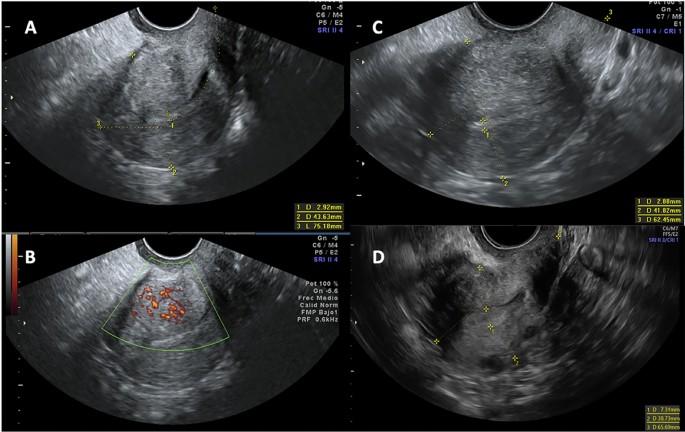
Гіперехогенні острівці та переривчаста зона з’єднання ендометрію та міометрію були найчастішими критеріями АД, виявленими як на початковому етапі, так і в наступних точках дослідження. Усі критерії зменшилися під час спостереження, причому зменшення між початковим етапом та 12-місячним спостереженням було статистично значущим (табл. 4, зобр. 2).
Таблиця 4 Сонографічні критерії діагностики аденоміозу на початковому етапі та через 12 і 24 місяці спостереження.
Зображення 2
| Початковий рівеньa N = 64 | 12-місячне спостереження b N = 63 | 24-місячне спостереження c N = 53 | p-value | |
|---|---|---|---|---|
| Жорсткі критерії | ||||
| Інтраміометріальні кісти | 22 (34.4%)a | 10 (15.9%)b | 7 (13.2%)c | a-b, a-cp < 0.0001 |
| b-cp = НЗ | ||||
| Гіперехогенні острівці | 62 (96.9%)a | 38 (60.3%)b | 29 (54.7%)c | a-b, a-cp < 0.0001 |
| b-cНЗ | ||||
| М’які критерії | ||||
| Віялоподібне затінення | 44 (68.7%)a | 23 (36.5%)b | 17 (32.1%)c | a-bp = 0.0004 |
| a-cp < 0.0001 | ||||
| b-cp = НЗ | ||||
| Асиметричне потовщення | 45 (70.3%)a | 22 (34.9%)b | 18 (33.4%)c | a-b, a-cp < 0.0001 |
| b-cp = НЗ | ||||
| Васкуляризація вздовж ураження | 30 (46.9%)a | 11 (17.5%)b | 6 (11.3%)c | a-bp = 0.0006 |
| a-cp < 0.0001 | ||||
| b-cНЗ | ||||
| Переривчаста зона з’єднання | 57 (89.1%)a | 36 (57.1%)b | 25 (47.2%)c | a-b, a-cp < 0.0001 |
| b-cp = НЗ | ||||
- Результати виражені у кількості та відсотках.
- НЗ не значущі.
Сонографічна еволюція аденоміозу на початковому етапі та через 12 і 24 місяці спостереження. (A і B) Перше УЗД з наявністю 5 критеріїв аденоміозу; (A) Гіперехогенні острівці, віялоподібне затінення, асиметричне потовщення стінки матки, переривчаста зона з’єднання міометрію та ендометрію і (B) васкуляризація вздовж ураження; (C) 12-місячне спостереження з гіперехогенними острівцями і асиметричним потовщенням стінки матки як легкими ознаками аденоміозу. (D) 24-місячне спостереження без ознак аденоміозу.
Вплив КОК на сонографічну вираженість ендометріозу
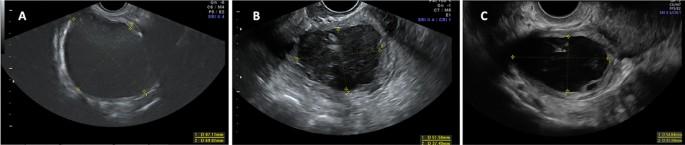
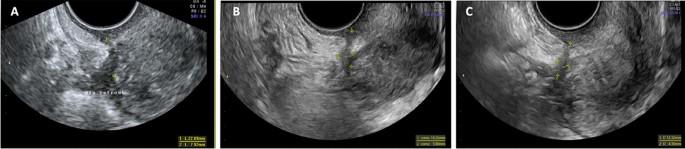
Ми виявили достовірне зменшення розмірів ЕЯ при порівнянні вихідного рівня з 12- і 24-місячними спостереженнями (33,45 ± 16,83 мм проти 22,67 ± 4,02 [p < 0,02] проти 18,62 ± 13,48 мм [p < 0,01] відповідно) (табл. 5, зобр. 3). Спостерігалося зменшення кількості пацієнтів з торусним ГЕ, ГЕ ПМЗ та ректосигмоїдним ГЕ через 12 та 24 місяці, хоча воно не було статистично значущим. Розмір ПМЗ достовірно зменшився від вихідного рівня до 12 і 24 місяців спостереження (20,91 ± 8,75 мм; проти 15,48 ± 6,07 [p < 0,03]; проти 13,13 ± 4,48 мм [p < 0,004], відповідно) (табл. 5, зобр. 4).
Таблиця 5 Вплив КОК на сонографічну вираженість ендометріозу на початковому етапі та через 12 і 24 місяці спостереження.
| Вимірювання | Початковий рівеньa N = 64 | 12-місячне спостереженняb N = 63 | 24- місячне спостереженняc N = 53 | p-value |
|---|---|---|---|---|
| Ендометріома яєчників | 33.45 ± 16.83a | 22.67 ± 14.02b | 18.62 ± 13.48c | a-bp < 0.02 |
| b-cp = НЗ | ||||
| a-c p < 0.01 | ||||
| ГЕ Торуса | 25.78 ± 12.98a | 20.64 ± 8.35b | 19.53 ± 8.62c | a-b; b-c, a-cp = НЗ |
| ГЕ ПМЗ | 20.91 ± 8.75a | 15.48 ± 6.07b | 13.13 ± 4.48c | a-bp < 0.03;b-c p = НЗ |
| a-cp < 0.004 | ||||
| Ретросигмоїдний ГЕ | 24.33 ± 10.23a | 22.22 ± 8.39b | 20.96 ± 8.77c | a-b; b-c, a-cp = НЗ |
- Результати представлені як середнє ± стандартне відхилення.
- Вимірювання виражено в міліметрах.
- ПМЗ прямокишково-маткові зв’язки, ГЕ глибокий ендометріоз, НЗ не значущий.
Зображення 3
Сонографічна еволюція ендометріоми яєчників на початковому етапі та через 12 і 24 місяці спостереження. (А) Велика ендометріома із середнім розміром 78,0 мм, яка зменшилася до 44,5 мм через 12 місяців спостереження на зображенні (В) і до 43,1 мм через 24 місяці спостереження на зображенні (С).
Зображення 4
Сонографічна еволюція прямокишково-маткового глибокого ендометріозу на початковому етапі та через 12 і 24 місяці спостереження. Зображення (А) прямокишково-матковий глибокий інфільтруючий вузлик із середнім розміром 15,0 мм, який зменшився до 10,0 мм при 12-місячному спостереженні на зображенні (В) і до 8,3 мм при 24-місячному спостереженні на зображенні (С).
Обговорення
Лікування ЕНД та АД є складним завданням для гінекологів, враховуючи, що терапевтична стратегія повинна бути модульованою та адаптованою до особливостей пацієнтки. Наше дослідження надає цінну інформацію про клінічні та сонографічні зміни ураження ГЕ та критерії АД у пацієнток з обома утвореннями. Варто зазначити, що у високого відсотка пацієнтів ГЕ асоціюється з АД, а тому важливо знати, чи є гормональне лікування ефективним у пацієнтів з обома утвореннями в довгостроковій перспективі, щоб краще планувати візити та радіологічне спостереження. Фармакологічне лікування, таке як КОК, може бути доцільним варіантом для великої кількості таких пацієнтів 15,16,17,18. КОК застосовуються для лікування тазового болю у пацієнтів з ЕНД вже понад 50 років і, як повідомлялося, зменшують або усувають біль приблизно у 90% пацієнтів 2. У цьому дослідженні замість традиційної схеми застосовували гнучку розширену схему прийому КОК, оскільки попередні дослідження та наш великий інституційний досвід показали, що така схема забезпечує кращий контроль больових симптомів, а пацієнтки краще контролюють точкові кровотечі 5. Однак найефективніша комбінація естропрогестагенів невідома. Щодо прогестагенів, які містяться в КОК, дослідження довели користь для здоров’я прогестагенів четвертого покоління, таких як дроспіренон і дієногест 28. Ми використовували комбінацію 2 мг дієногесту та 30 мкг етинілестрадіолу через її низьку вартість, а також через те, що цей прогестаген добре переноситься та має мало побічних ефектів у більшості пацієнток. Основною метою цього дослідження було оцінити вплив розширеної довготривалої схеми прийому КОК на різні больові симптоми, про які часто повідомляють пацієнтки з ЕНД та/або АГ, і ми спостерігали зменшення кількості пацієнток з тяжкою дисменореєю та неменструальним тазовим болем під час спостереження. Середній показник ЧРШ для дисменореї, неменструального тазового болю, глибокої диспареунії, диспепсії та дизурії також був нижчим у 12- та 24-місячних спостереженнях. Ці результати узгоджуються з раніше опублікованими дослідженнями 3,5,9,10,11,12,13,15,16, хоча наше дослідження передбачає один з найтриваліших періодів спостереження.
Нашою метою також було дослідити вплив КОК на особливості ГЕ та АТ при ТВС обстеженні впродовж щонайменше двох років спостереження. Спостерігалося зменшення сонографічної вираженості як ЕНД, так і АД. Важливо підкреслити, що при порівнянні вихідних значень з 12-місячним спостереженням було відзначено достовірне зменшення розмірів ПМЗ, причому це зменшення демонструвало тенденцію до ще більшого збільшення через 24 місяці. Крім того, ураження торуса і ректосигмоїдного ГЕ показали зменшення, хоча і не статистично значуще, в розмірах. Зменшення розмірів ЕЯ було достовірним і більш помітним порівняно з ураженнями ГЕ, а також було достовірним лише в першій точці дослідження через рік після початку лікування. Переважання фіброзу і наявність меншої кількості ендометріальних залоз при ГЕ ураженнях може бути причиною меншої сонографічної відповіді при деяких типах ГЕ уражень порівняно з іншими типами ЕНД, такими як ЕЯ 29,30,31. Ці результати дослідження за допомогою ТВС також узгоджуються з попередніми повідомленнями. Інші автори описали статистично значуще зменшення об’єму ЕЯ після різних видів гормонального лікування, таких як дієногест 17,18,19,20 або КОК 3,5,32. Нечисленні дослідження, що оцінювали сонографічні зміни ізольованих ГЕ ректосигмоїдних ендометріоїдних вузлів після декількох видів гормонального лікування 33,34,35,36 , спостерігали значне зменшення ректосигмоїдних вузлів ендометріозу через 6 і 12 місяців спостереження. Наскільки нам відомо, це питання раніше не аналізувалося при більш тривалому спостереженні. Крім того, жодне попереднє дослідження не оцінювало сонографічний вплив КОК на АД. Варто зазначити, що спостерігалося значне зменшення кількості критеріїв АД у 12- та 24-місячних спостереженнях, а також те, що майже 40% пацієнток, які мали АД на початку дослідження, не мали жодних ознак АД у 24-місячному спостереженні, що свідчить про повну сонографічну відповідь на гормональну терапію. Подібно до ГЕ ПМЗ та ЕЯ, спостерігалося значне зниження всіх сонографічних критеріїв АД через 12 місяців спостереження і тенденція до зниження до 24 місяців спостереження. Крім того, попередні дослідження припустили, що ендометріоз – це захворювання, яке, ймовірно, прогресує від підліткового до зрілого віку 37,38 , тоді як найвища поширеність глибоких інфільтративних уражень спостерігається після 26 років і, як видається, зростає від підліткового віку до четвертого десятиліття. Тому ці автори припустили, що політика щодо профілактики та ранньої діагностики ендометріозу повинна бути спрямована на жінок молодше 25 років, і підкреслили, що прогресування ендометріозу у старших пацієнток, які все ще перебувають у фертильному періоді, могло припинитися 37, 38. Це могло статися у певного відсотка пацієнток із середнім віком 38,5 ± 4,8 років у нашому дослідженні, але це питання не могло бути з’ясоване в нашому дослідженні, оскільки контрольна група без лікування не була включена, і подальші дослідження є виправданими для з’ясування цього 37, 38.
Сильними сторонами цього дослідження є суворі критерії включення та виключення, а тривалість спостереження була однією з найтриваліших у літературі. Іншими сильними сторонами були оцінка клінічних проявів ЕНД у всіх його формах (дисменорея, неменструальний тазовий біль, глибока диспареунія, дишезія і дизурія), оцінка як АТ, так і ГЕ та їх сонографічне вираження, а також використання одного і того ж КОК у всіх пацієнток.
Для інтерпретації даних слід враховувати кілька обмежень нашого дослідження: по-перше, ми залучили відносно невелику кількість пацієнтів, хоча за розміром вибірки вона була порівнянна або навіть перевершувала інші раніше опубліковані дослідження 17,19,32,33,34,35,36. По-друге, ми оцінювали пацієнтів у двох довільних точках дослідження, через 12 і 24 місяці спостереження, але оскільки найважливіші зміни спостерігалися через рік спостереження, було б цікаво оцінити зміни до цієї точки дослідження і пізніше, ніж через 24 місяці, щоб повторно оцінити поліпшення при коротшому і довшому спостереженні. По-третє, в нашій досліджуваній популяції не було описано всіх локалізацій ГЕ, але були найпоширеніші, а отже, ГЕ везикулярного, вагінального або сечовідного ендометріозу слід оцінювати в іншій ураженій популяції. Нарешті, ми не порівнювали результати різних схем КОК, інших гормональних методів лікування або застосування анальгетиків. Щодо останнього питання, хоча ми не маємо точної інформації про дозування супутніх анальгетиків, які застосовували пацієнтки під час діагностики та спостереження, зменшення больових симптомів через 12 та 24 місяці дозволяє припустити зменшення споживання знеболювальних засобів.
Виходячи з цього сценарію, в майбутніх дослідженнях слід розглянути можливість проведення рандомізованих контрольованих досліджень у великій популяції з більш тривалим спостереженням і більшою кількістю точок дослідження. Крім того, слід проаналізувати порівняння різних доз і типів гормонів.
Висновок
Отже, це проспективне дослідження свідчить про значне зменшення больових симптомів та сонографічної вираженості ЕНД та АД після застосування гнучкого розширеного режиму прийому КОК через 12 місяців спостереження, з тенденцією до покращення в період між 12 та 24 місяцями спостереження. Покращення було більш очевидним при АД, ГЕ ПМЗ та ЕЯ порівняно з ГЕ торуса та ректосигмоїдним ГЕ. Необхідні подальші дослідження з більш тривалим спостереженням, більшим розміром вибірки і порівнянням з іншими методами лікування.
Посилання
- Leyendecker, G. et al. Adenomyosis and endometriosis. Re-visiting their association and further insights into the mechanisms of auto-traumatisation. An MRI study. Arch. Gynecol. Obstet. 291(4), 917–32 (2015).
- Vercellini, P., Viganò, P., Somigliana, E. & Fedele, L. Endometriosis: Pathogenesis and treatment. Nat. Rev. Endocrinol. 10(5), 261–275 (2014).
- Harada, T. et al. Ethinylestradiol 20 μg/drospirenone 3 mg in a flexible extended regimen for the management of endometriosis-associated pelvic pain: A randomized controlled trial. Fertil. Steril. 108(5), 798–805 (2017).
- Ferrero, S., Evangelisti, G. & Barra, F. Current and emerging treatment options for endometriosis. Expert Opin. Pharmacother. 19, 1109–25 (2018).
- Jensen, J. T., Schlaff, W. & Gordon, K. Use of combined hormonal contraceptives for the treatment of endometriosis-related pain: A systematic review of the evidence. Fertil. Steril. 110(1), 137-152.e1 (2018).
- Birtch, R. L., Olatunbosun, O. A. & Pierson, R. A. Ovarian follicular dynamics during conventional vs. continuous oral contraceptive use. Contraception 73(3), 235–43 (2006).
- Wiegratz, I. & Kuhl, H. Long-cycle treatment with oral contraceptives. Drugs 64(21), 2447–2462 (2004).
- Klipping, C. et al. Contraceptive efficacy and tolerability of ethinylestradiol 20 μg/drospirenone 3 mg in a flexible extended regimen: An open-label, multicentre, randomised, controlled study. J. Fam. Plan. Reprod. Health Care 38(2), 73–83 (2012).
- Vercellini, P. et al. Cyproterone acetate versus a continuous monophasic oral contraceptive in the treatment of recurrent pelvic pain after conservative surgery for symptomatic endometriosis. Fertil. Steril. 77(1), 52–61 (2002).
- Guzick, D. S., Huang, L. S., Broadman, B. A., Nealon, M. & Hornstein, M. D. Randomized trial of leuprolide versus continuous oral contraceptives in the treatment of endometriosis-associated pelvic pain. Fertil. Steril. 95(5), 1568–1573 (2011).
- Razzi, S. et al. Efficacy of vaginal danazol treatment in women with recurrent deeply infiltrating endometriosis. Fertil. Steril. 88(4), 789–794 (2007).
- Strowitzki, T., Faustmann, T., Gerlinger, C. & Seitz, C. Dienogest in the treatment of endometriosis-associated pelvic pain: A 12-week, randomized, double-blind, placebo-controlled study. Eur. J. Obstet. Gynecol. Reprod. Biol. 151(2), 193–198 (2010).
- Harada, T. et al. Dienogest is as effective as intranasal buserelin acetate for the relief of pain symptoms associated with endometriosis-a randomized, double-blind, multicenter, controlled trial. Fertil. Steril. 91(3), 675–681 (2009).
- Fauconnier, A. & Chapron, C. Endometriosis and pelvic pain: Epidemiological evidence of the relationship and implications. Hum. Reprod. Update 11(6), 595–606 (2005).
- Momoeda, M. et al. Long-term use of dienogest for the treatment of endometriosis. J. Obstet. Gynaecol. Res. 35(6), 1069–1076 (2009).
- Sugimoto, K., Nagata, C., Hayashi, H., Yanagida, S. & Okamoto, A. Use of dienogest over 53 weeks for the treatment of endometriosis. J. Obstet. Gynaecol. Res. 41(12), 1921–1926 (2015).
- Angioni, S. et al. Is dienogest the best medical treatment for ovarian endometriomas? Results of a multicentric case control study. Gynecol. Endocrinol. 36(1), 84–86 (2020).
- Muzii, L. et al. Medical treatment of ovarian endometriomas: A prospective evaluation of the effect of dienogest on ovarian reserve, cyst diameter, and associated pain. Gynecol. Endocrinol. 36(1), 81–83 (2020).
- Vignali, M. et al. Effect of dienogest therapy on the size of the endometrioma. Gynecol. Endocrinol. 36(8), 723–7 (2020).
- del Forno, S. et al. Dienogest or norethindrone acetate for the treatment of ovarian endometriomas: Can we avoid surgery?. Eur. J. Obstet. Gynecol. Reprod. Biol. 1(238), 120–124 (2019).
- Becker, C. M. et al. ESHRE guideline: Endometriosis. Hum. Reprod. Open 2, hoac009 (2022).
- Bourdel, N. et al. Systematic review of endometriosis pain assessment: How to choose a scale?. Hum. Reprod. Update 21(1), 136–152 (2015).
- van den Bosch, T. et al. Terms, definitions and measurements to describe sonographic features of myometrium and uterine masses: A consensus opinion from the Morphological Uterus Sonographic Assessment (MUSA) group. Ultrasound Obstet. Gynecol. 46(3), 284–298 (2015).
- Guerriero, S. et al. Systematic approach to sonographic evaluation of the pelvis in women with suspected endometriosis, including terms, definitions and measurements: A consensus opinion from the International Deep Endometriosis Analysis (IDEA) group. Ultrasound Obstet. Gynecol. 48(3), 318–332 (2016).
- Ros, C. et al. Bowel preparation improves the accuracy of transvaginal ultrasound in the diagnosis of rectosigmoid deep infiltrating endometriosis: A prospective study. J. Minim. Invasive Gynecol. 24(7), 1145–1151 (2017).
- Ros, C. et al. Bowel preparation prior to transvaginal ultrasound improves detection of rectosigmoid deep infiltrating endometriosis and is well tolerated: Prospective study of women with suspected endometriosis without surgical criteria. Ultrasound Obstet. Gynecol. 57(2), 335–341 (2021).
- van den Bosch, T. & van Schoubroeck, D. Ultrasound diagnosis of endometriosis and adenomyosis: State of the art. Best Pract. Res. 51, 16–24 (2018).
- Regidor, P. A. & Schindler, A. E. Antiandrogenic and antimineralocorticoid health benefits of КОК containing newer progestogens: Dienogest and drospirenone. Oncotarget 8(47), 83334–42 (2017).
- Burney, R. O. & Giudice, L. C. Pathogenesis and pathophysiology of endometriosis. Fertil. Steril. 98(3), 511–519 (2012).
- Vigano, P. et al. Time to redefine endometriosis including its pro-fibrotic nature. Hum. Reprod. 33(3), 347–352 (2018).
- Patel, B. G. et al. Pathogenesis of endometriosis: Interaction between endocrine and inflammatory pathways. Best Pract. Res. Clin. Obstet. Gynaecol. 50, 50–60 (2018).
- Harada, T., Momoeda, M., Taketani, Y., Hoshiai, H. & Terakawa, N. Low-dose oral contraceptive pill for dysmenorrhea associated with endometriosis: A placebo-controlled, double-blind, randomized trial. Fertil. Steril. 90(5), 1583–1588 (2008).
- Ferrero, S., Venturini, P. L. & Remorgida, V. Changes in the size of rectovaginal endometriotic nodules infiltrating the rectum during hormonal therapies. Fertil. Steril. 94(4), S39 (2010).
- Vercellini, P. et al. Treatment of symptomatic rectovaginal endometriosis with an estrogen-progestogen combination versus low-dose norethindrone acetate. Fertil. Steril. 84(5), 1375–1387 (2005).
- Fedele, L., Bianchi, S., Zanconato, G., Tozzi, L. & Raffaelli, R. Gonadotropin-releasing hormone agonist treatment for endometriosis of the rectovaginal septum. Am J Obstet Gynecol. 75(3), 485–488 (2001).
- Fedele, L., Bianchi, S., Zanconato, G., Portuese, A. & Raffaelli, R. Use of a levonorgestrel-releasing intrauterine device in the treatment of rectovaginal endometriosis. Am. J. Obstet. Gynecol. 75(3), 485–488 (2001).
- Stochino-Loi, E. et al. Relationship between patient age and disease features in a prospective cohort of 1560 women affected by endometriosis. J. Minim. Invasive Gynecol. 27(5), 1158–1166 (2020).
- Netter, A. et al. Progression of deep infiltrating rectosigmoid endometriotic nodules. Hum. Reprod. 34(11), 2144–2152 (2019).