Резюме
Предпосылки
В 2018 году в Японии у 8000 женщин был впервые диагностирован рак шейки матки. Политика медицинского страхования в Японии позволяет врачам проводить цитологическое исследование свода влагалища и измерения сывороточных биомаркеров во время каждого визита, а также визуализационные исследования через определенные промежутки времени с целью скрининга рецидивов после первичного лечения. Однако основные руководства по надзору, опубликованные в США и европейских странах, рекомендуют сосредоточиться на осмотре органов малого таза и оценке симптомов, чтобы избежать ненужных тестов. Это исследование имело целью переоценить преимущества стандартных методов наблюдения, принятых в этом исследовании, путем ретроспективного анализа.
Методы
С января 2009 года по декабрь 2015 года для этого исследования были собраны медицинские карты пациенток с рецидивом, у которых изначально был диагностирован рак шейки матки I-III стадии по классификации Международной федерации гинекологии и акушерства. Клинико-патологические данные были статистически проанализированы для выявления значимых факторов. В течение первых 2 лет пациентки проходили регулярное наблюдение, включавшее гинекологическое обследование, анализ сыворотки крови на онкомаркеры, цитологическое исследование свода влагалища каждые 1-3 месяца и визуализационные методы диагностики с интервалом от 6 до 12 месяцев. В течение следующих 2 лет пациентки проходили регулярное обследование теми же методами каждые 4 месяца и ежегодные визуализационные исследования. После этого пациенты проходили регулярный скрининг каждые 6-12 месяцев.
Результаты
За период исследования у 84 из 981 пациента возникли рецидивы, причем у 88,1% из них рецидивы были бессимптомными. В одномерном анализе первичное лечение, локализация рецидива и метод диагностики были значимыми факторами для результатов выживания. В противоположность этому, многофакторный анализ показал, что только первичное лечение было значимым фактором. У пациентов с местным рецидивом многофакторный анализ продемонстрировал, что лучевая терапия как спасительная является независимым прогностическим фактором общей выживаемости после рецидива.
Выводы
В этом ретроспективном исследовании рутинная визуализация поражений и измерение сывороточных биомаркеров не повлияли на прогноз пациентки после рецидива. В противоположность этому, цитология свода влагалища может улучшить выживаемость после рецидива у некоторых пациенток. Персонализированные методы наблюдения, основанные на индивидуальных особенностях заболевания и способах лечения, могут улучшить результаты выживания после рецидива.
Вступление
Количество больных раком шейки матки постепенно растет в Японии с 2000 года. Примерно у 8000 пациенток был впервые диагностирован рак шейки матки в 2018 году [1]. Кроме того, за последнее десятилетие пик заболеваемости раком шейки матки, скорректированный по возрасту, сместился к более молодому возрасту – примерно 40 лет. Поскольку примерно 75% пациенток имеют I и II стадию рака шейки матки, ожидается, что большинство пациенток будут иметь благоприятный прогноз. Однако некоторые женщины, особенно на поздних стадиях, остаются в группе риска рецидива опухоли. Предполагается, что наблюдение после первичного лечения позволяет выявить ранний рецидив, что может привести к удлинению выживаемости и улучшению качества жизни благодаря применению адекватной спасительной терапии и поддерживающего ухода. Однако различные учреждения и страны имеют разные протоколы наблюдения из-за отсутствия достоверных доказательств относительно методов наблюдения и интервалов между наблюдениями.
В отличие от отдаленного метастазирования и метастазирования в ткани боковой стенки малого таза, местный рецидив поддается лечебной терапии [2, 3]. Для выявления местного рецидива используют цервиковагинальную цитологию [4], но частота его обнаружения низкая [5, 6]. Поэтому Общество гинекологической онкологии (ОГО) рекомендует ограничить цитологические исследования до одного раза в год [7]. Пациентки также могут захотеть пройти визуализационные исследования, включая компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ) и позитронно-эмиссионную томографию (ПЭТ), чтобы проверить наличие бессимптомного рецидива. Однако, с точки зрения соотношения затрат и результатов, ни одно исследование не показало, что регулярное наблюдение с анализом изображений не улучшает выживаемость после рецидива, поскольку потенциально излечимым является только местный рецидив. Таким образом, руководства ОГО и Европейского общества медицинской онкологии (ЕОМО) не рекомендуют рутинное наблюдение с помощью визуализационных методов, за исключением ограниченных случаев [7, 8]. Для оценки стадии заболевания, ответа на терапию и рецидива опухоли также используют сывороточный уровень антигена плоскоклеточного рака (SCC) для плоскоклеточных опухолей и уровень ракового антигена 125 (CA125) для аденокарциномы при раке шейки матки. Повышение уровней SCC и CA125 в сыворотке крови может свидетельствовать о рецидиве плоскоклеточных опухолей и аденокарциномы до появления клинических симптомов [9, 10]. Однако бессимптомный рецидив, диагностированный по повышенным уровням SCC и CA125 в сыворотке крови, не способствует улучшению результатов выживания [11].
В Японии почти все пациентки охвачены государственным медицинским страхованием, которое покрывает большинство медицинских расходов, что позволяет врачам проводить интенсивное наблюдение за пациентками с раком шейки матки, даже при отсутствии симптомов, с помощью гинекологического обследования, мазка Папаниколау, измерения уровня опухолевого антигена в сыворотке крови во время каждого визита и периодического анализа изображений, включая КТ, МРТ и ПЭТ-сканирование, даже при отсутствии каких-либо симптомов.
Как отмечалось выше, руководства, опубликованные в США и европейских странах, рекомендуют сосредоточиться на признаках и симптомах, чтобы уменьшить количество ненужных обследований и сэкономить средства. Однако остаются споры относительно рутинного надзора с использованием цитологии влагалищного свода и анализа изображений. В этом исследовании мы впервые оценили протокол интенсивного наблюдения, принятый в Японии, путем ретроспективного анализа данных, включая методы наблюдения для выявления рецидива, места рецидива и периоды выживания после рецидива. Мы также хотели исследовать факторы, которые положительно влияют на выживаемость после рецидива. В конце концов, мы намерены пересмотреть метод наблюдения для рутинного наблюдения на основе результатов этого исследования.
Методы
Структура исследования
Базовая структура исследования была опубликована в нашем предыдущем наблюдательном исследовании рака эндометрия [12]. Медицинские записи были получены для пациенток с раком шейки матки, впервые диагностированным согласно Международной федерации гинекологии и акушерства (FIGO 2018) стадией 1-3c2 в период с 2009 по 2015 год.
В первые 2 года пациентки проходили регулярное наблюдение, включавшее осмотр органов малого таза, мазок Папаниколау и анализ сывороточных биомаркеров (SCC или CA125) каждые 1-3 месяца, а визуальную диагностику с интервалом от 6 до 12 месяцев. В течение следующих 2 лет регулярное наблюдение проводилось каждые 4 месяца с ежегодной визуальной диагностикой. После этого пациенты проходили стандартное наблюдение каждые 6-12 месяцев. Медицинские карты пациентов, у которых развились рецидивные опухоли, были собраны из трех учреждений и проанализированы для этого ретроспективного исследования. Все пациенты с рецидивом на стадии I-3c2 по FIGO были включены в исследование.
Статистический анализ
Демографические данные, стадия по FIGO, гистология, первичное лечение, метод диагностики рецидива опухоли, терапия после рецидива и период выживания после рецидива были включены в статистический анализ, поскольку эти факторы потенциально вовлечены в оценку значимости методов наблюдения и результатов выживания. Интервалы между визитами до установления диагноза рецидива были стратифицированы на 1, 2 и > 3 месяцев для проверки сдвига времени ожидания после рецидива. Для всех пациентов после рецидива был проведен одномерный и многомерный анализ (Таблица 2). Одномерный и многомерный анализы также были проведены для пациентов с местным рецидивом (табл. 3), поскольку эти пациенты имели лучшую общую выживаемость после рецидива (рис. 2А). Время от рецидива до смерти было проанализировано с помощью модели пропорциональных рисков Кокса для расчета отношений рисков (ОР) и 95% доверительных интервалов (95% ДИ) после проведения теста пропорциональных рисков. Факторами, которые были включены, были стадия по FIGO, гистология, первичное лечение, место рецидива и метод диагностики при рецидиве в Таблице 1; метод диагностики, первичное лечение и восстановительная терапия после рецидива в Таблице 2; и метод диагностики при рецидиве, первичное лечение и восстановительная терапия после рецидива в Таблице 3. После оценки мультиколлинеарности с помощью коэффициента инфляции дисперсии был проведен регрессионный анализ Кокса в многомерном анализе с использованием метода пошагового отбора переменных для факторов, которые показали статистически значимые различия в одномерном анализе (табл. 2 и 3). Интервал отсутствия заболевания после первичного лечения и кривые выживаемости для общей послерецидивной выживаемости в зависимости от места рецидива, метода диагностики или локального рецидива рассчитывали с помощью метода Каплана-Мейера и лог-рангового теста. Статистическая значимость была установлена на уровне p < 0,05; все тесты были двусторонними. Весь статистический анализ проводили с помощью программы EZR версии 1.55 [13].
Таблица 1 Характеристика пациентов при первичном лечении и рецидиве
| Параметры | Нет | % |
| Начальная стадия рака | ||
| Возраст | 26–83 (52)a | |
| Стадия по FIGO | ||
| 1a | 3 | (3.6) |
| 1b1 | 12 | (14.3) |
| 1b2 | 4 | (4.7) |
| 1b3 | 4 | (4.7) |
| 2a1 | 5 | (6.0) |
| 2a2 | 2 | (2.4) |
| 2b | 10 | (11.9) |
| 3a | 2 | (2.4) |
| 3b | 3 | (3.6) |
| 3c1 | 34 | (40.4) |
| 3c2 | 5 | (6.0) |
| Гистология | ||
| плоскоклеточный | 49 | (58.3) |
| адено | 24 | (28.6) |
| аденосквамозный | 5 | (6.0) |
| Другие | 6 | (7.1) |
| Первичное лечение | ||
| Опе | 15 | (17.9) |
| Опе+Лт | 6 | (7.1) |
| Опе+ СХЛТ | 16 | (19.0) |
| Опе+Химо | 13 | (15.5) |
| ЛТ | 9 | (10.7) |
| СХЛТ | 25 | (29.8) |
| В случае рецидива | ||
| Интервал наблюдения | ||
| 1 месяц | 46 | (54.7) |
| 2 месяц | 24 | (28.6) |
| 3 > месяц | 14 | (16.7) |
| Место рецидива | ||
| Локально | 19 | (22.6) |
| Тазовые Лу | 9 | (10.7) |
| Дистальные Лу | 14 | (16.7) |
| Отдаленные метастазы | 27 | (32.1) |
| Множественное метастазирование | 15 | (17.9) |
| Методы диагностики | ||
| Симтомы | 10 | (11.9) |
| Мазок Папаниколау | 13 | (15.5) |
| Маркеры опухолей | 19 | (22.6) |
| Визуализация | 42 | (50.0) |
- aДиапазон (медиана)
- Опе Операция, ЛТ Лучевая терапия, СХЛТ Сопутствующая химиолучевая терапия, Химо Химиотерапия, ЛУ Лимфатический узел
Таблица 2 Одномерный и многомерный анализ результатов выживания после рецидива
| Одномерный | Многомерный | |||
| Отношение рисков [95% ДИ] | p-value* | Отношение рисков [95% ДИ] | p-value* | |
| Стадия по FIGO | ||||
| I | ref | |||
| II | 1.63 [0.76–3.48] | 0.211 | ||
| IIIa та IIIb | 1.44 [0.41–5.08] | 0.571 | ||
| IIIc1 та IIIc2 | 1.76 [0.94–3.31] | 0.080 | ||
| Гистология | 0.270 | |||
| Плоскоклеточный | ref | |||
| Адено | 0.84 [0.47–1.48] | 0.540 | ||
| Другой | 1.59 [0.78–3.21] | 0.200 | ||
| Первичное лечение | ||||
| Опе | ref | ref | ||
| Опе+Химо | 4.09 [1.46–11.4] | 0.007 | 3.14 [1.05–9.42] | 0.041 |
| Опе+ЛТ или СХЛТ | 4.83 [1.86–12.55] | 0.001 | 4.81 [1.60–14.45] | 0.005 |
| ЛТ или СХЛТ | 4.23 [1.70–10.73] | 0.002 | 4.62 [1.57–13.60] | 0.005 |
| Место рецидива | ||||
| Местно | ref | Учтено, но не является значимым в окончательном многомерном анализе | ||
| Тазовые ЛУ | 2.83 [1.07–7.52] | 0.036 | ||
| Дистальные ЛУ | 1.51 [0.63–3.60] | 0.353 | ||
| Отдаленные метастазы | 2.68 [1.24–5.81] | 0.012 | ||
| Множественные метастазы | 4.70 [1.99–11.07] | < 0.001 | ||
| Метод диагностики при рецидиве | ||||
| Мазок Папаниколау | ref | Учтено, но не является значимым в окончательном многомерном анализе | ||
| Симптомы | 12.43 [3.73–41.46] | < 0.001 | ||
| Маркеры опухолей | 4.13 [1.47–11.58] | 0.007 | ||
| Визуализация | 2.94 [1.14–7.55] | 0.025 | ||
- * Использован регрессионный анализ Кокса
- Опе Операция, ЛТ Лучевая терапия, СХЛТ Сопутствующая химиолучевая терапия, Химо Химиотерапия, ЛУ Лимфатический узел
Таблица 3 Одномерный и многомерный анализ результатов выживания после рецидива у пациентов с местным рецидивом
| Одномерный | Многомерный | ||||
| Отношение рисков [95% ДИ] | p-value* | Отношение рисков [95% ДИ] | p-value* | ||
| Метод диагностики при рецидиве | |||||
| Мазок Папаниколау | ref | Учтено, но не является значимым в окончательном многомерном анализе | |||
| Симптомы | 19.10 [1.99–183.40] | 0.011 | |||
| Маркеры опухолей | 12.03 [0.91–159.10] | 0.059 | |||
| Визуализация | 5.69 [1.09–29.77] | 0.039 | |||
| Первичное лечение | |||||
| Опе, Опе+Химо | ref | Учтено, но не является значимым в окончательном многомерном анализе | |||
| Опе+ЛТ или СХЛТ, ЛТ, СХЛТ | 5.84 [1.16–29.38] | 0.030 | |||
| Спасительная терапия после рецидива | |||||
| ЛТ | ref | ref | |||
| Химиотерапия | 18.52 [2.15–160] | 0.008 | 18.52 [2.15–160] | 0.008 | |
- * Использован регрессионный анализ Кокса
- Опе Операция, ЛТ Лучевая терапия, СХЛТ Сопутствующая химиолучевая терапия, Хемо Химиотерапия, ЛУ Лимфатический узел
Результаты
С января 2009 года по декабрь 2015 года 981 пациентка прошла лечение рака шейки матки в трех учреждениях, которые участвовали в этом исследовании. Для этого исследования были собраны медицинские карты 84 пациенток с рецидивами опухолей. Рецидив развился у 56% и 79% пациенток в течение 1 и 2 лет соответственно. В целом рецидив возник у 8,6% пациентов. Риск рецидива для каждой стадии составлял 1,1%, 7,0%, 9,4% и 17,5% на стадиях Ia, Ib, II и III соответственно. Основные характеристики пациентов с рецидивом заболевания приведены в таблице 1.
При первичной диагностике у 44 (52,4%) пациенток был диагностирован рак шейки матки III стадии, а у 49 (58,3%) – плоскоклеточный рак шейки матки. Во время первичного лечения 35 из 50 пациенток, которым было выполнено хирургическое вмешательство, прошли адъювантную терапию лучевой и сопутствующей химиолучевой терапией или химиотерапией. У 46 (54,7%) пациентов был диагностирован рецидив с интервалом наблюдения в 1 месяц. У 19 (22,6%) пациентов был местный рецидив; только у 10 (11,9%) пациентов был симптоматический рецидив.
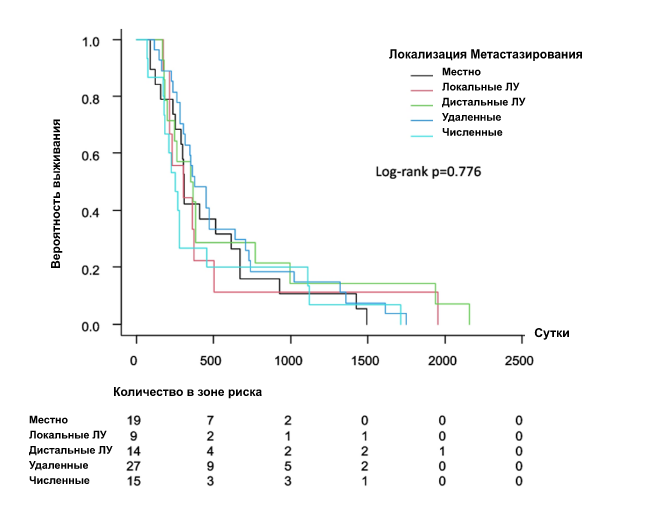
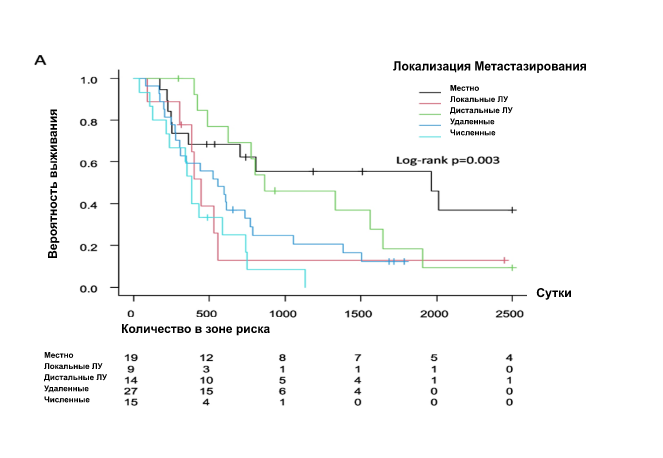
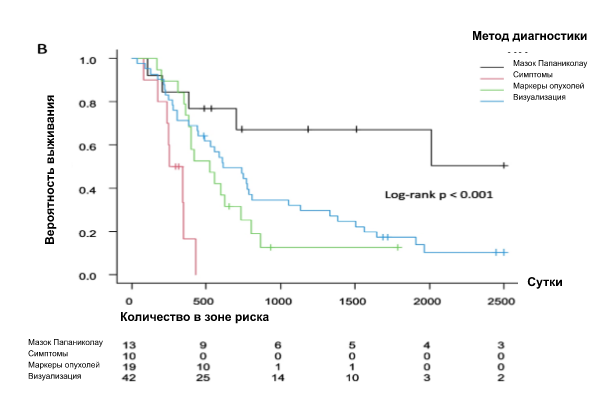
Кривая Каплана-Мейера показала интервал безрецидивного периода после первичного лечения (рис. 1). Не было выявлено достоверной разницы по месту рецидива (p = 0776). Пациентки с местным рецидивом (рис. 2А) (р = 0,003) или с диагнозом рецидива с помощью мазка Папаниколау (рис. 2Б) (р < 0,001) имели лучшую общую выживаемость после рецидива, чем пациентки с другими локализациями или с диагнозом, установленным другими методами. ОР и 95% ДИ для выживаемости после рецидива были рассчитаны с помощью регрессионного анализа Кокса (табл. 2), который не выявил значимых различий в зависимости от стадии FIGO и гистологии. Однако первичное лечение, место рецидива и метод диагностики были значимыми факторами. Что касается первичного лечения, то пациенты, которым было выполнено хирургическое вмешательство, имели значительно лучший прогноз, чем те, которым были применены другие методы лечения. Пациенты с местным рецидивом имели лучшие результаты выживания, чем пациенты с метастазами в тазовые ЛУ, отдаленными метастазами или множественными метастазами. Симптомы, а также опухолевые маркеры и анализ изображений для диагностики рецидива имели худшие показатели выживаемости по сравнению с мазком Папаниколау. Многофакторный анализ показал, что единственным прогностическим фактором было первичное лечение.
Рис 1. Интервал без заболевания после первичного лечения
Рис 2. Общая выживаемость после рецидива. А Место метастазирования, (B) метод диагностики
Поскольку пациенты с местным рецидивом имели лучшие результаты после рецидива, вероятность выживания сравнивали с помощью кривой Каплана-Мейера (рис. 3), демонстрируя, что пациенты, которые проходили лучевую терапию, имели значительно лучший прогноз, чем те, кто лечился химиотерапией (p < 0,001). Далее мы исследовали факторы, влияющие на выживаемость после рецидива (табл. 3). В диагностическом методе при рецидиве мазок Папаниколау показал лучшие результаты выживания по сравнению с симптомами и анализом изображений. Пациенты, которые не проходили лучевую терапию при первичном лечении и получали лучевую терапию в рамках спасительной терапии имели лучшие прогнозы по сравнению с другими в однофакторном анализе; лучевая терапия после рецидива была единственным прогностическим фактором в многомерном анализе.
Рис 3. Общая выживаемость после локального рецидива при проведении спасительной терапии
Обсуждение
В этом ретроспективном многоцентровом исследовании мы показали, что пациенты с местными рецидивами, которые не получали лучевую терапию при первичном лечении, имели лучшую общую выживаемость. Для этих пациентов мазок Папаниколау был эффективным методом выявления рецидивирующих опухолей. Кроме того, пациенты с местным рецидивом, которые могли получить лучевую терапию в качестве терапии спасения, имели шанс на полное выздоровление.
Большинство пациенток с рецидивирующим раком шейки матки имеют неблагоприятный прогноз, хотя некоторые пациентки демонстрируют длительную выживаемость после рецидива. Пациентки ожидают, что наблюдение после лечения позволит выявить рецидив на достаточно ранней стадии, которая поддается лечению. Однако методы и концепции наблюдения различаются в разных странах и учреждениях и даже среди врачей одной больницы из-за отсутствия окончательных доказательств. В этом исследовании проанализированы наиболее интенсивные методы наблюдения, принятые в повседневной клинической практике в рамках государственного медицинского страхования Японии.
Концепция интенсивного наблюдения приводит к улучшению выживаемости и качества жизни даже после рецидива. В этом исследовании почти все пациентки наблюдались гинекологами-онкологами в течение периода наблюдения. Согласно протоколу интенсивного надзора, проанализированным в этом исследовании, рецидивы через 1 и 2 года были диагностированы у 56 и 79% соответственно, что согласуется с предыдущими сообщениями [5, 14, 15]; не было выявлено разницы в интервале безрецидивного периода в зависимости от локализации метастазов (рис.1). Фактически, 54,7% рецидивов было диагностировано в пределах 1-месячного интервала наблюдения. Более того, только 16,7% пациентов имели более чем 3-месячный интервал наблюдения, а 90,5% имели бессимптомный рецидив (табл. 1). Насколько нам известно, этот показатель является самым высоким для выявления бессимптомного рецидива, общей выживаемости после рецидива, бессимптомного рецидива и симптоматического рецидива (ОР 4,28; 95% ДИ 1,87-9,78; р <0,001). Недавнее исследование с участием большой когорты из 4343 пациенток с РШМ I и II стадии продемонстрировало, что бессимптомный рецидив является значимым фактором выживаемости после рецидива [16]. В противоположность этому, обзор 17 ретроспективных исследований, в которых интервалы контрольных визитов составляли каждые 3-4 месяца в течение первых 2 лет, не показал никаких преимуществ в выявлении бессимптомного рецидива [17]. Лучшего прогноза можно достичь с помощью смещения времени опережения. Однако в нашем исследовании нельзя исключить влияние продолжительности лечения на лучшую выживаемость после рецидива при бессимптомном рецидиве, поскольку большинство пациентов были диагностированы с интервалом между визитами 1-2 месяца.
Для выявления бессимптомного рецидива в рамках рутинного наблюдения использовали методы визуальной диагностики, включая КТ, МРТ и ПЭТ. В этом исследовании у 42 (50,0%) пациентов был диагностирован рецидив опухоли с помощью визуализационных методов (табл. 1). Среди этих пациентов 27 имели отдаленные метастазы, а трое с одиночными метастазами в легких были полностью вылечены хирургическим путем. Другие исследования также сообщают об успешном лечении изолированного легочного рецидива [6, 18]. Итальянское многоцентровое ретроспективное исследование продемонстрировало, что 80-90% отдаленных метастазов и метастазов в лимфатические узлы были диагностированы с помощью анализа изображений [19], что означает, что визуальная диагностика является более чувствительной для выявления отдаленных метастазов. Хотя некоторым пациентам, включая наших, рутинная визуальная диагностика помогает выявить бессимптомный рецидив в отдаленных регионах, ОГО не рекомендует проводить рутинное визуальное диагностирование как учитывая соотношение затрат и результатов, так и учитывая низкую результативность в диагностике бессимптомного рецидива [20]. Кроме того, ежегодное проведение КТ может увеличить риск рака, связанный с лучевой нагрузкой [21]. Таким образом, без четких показаний следует избегать радиологических методов исследования.
Сывороточные биомаркеры, такие как SCC и CA-125, используются для оценки ответа опухоли на лечение [22] и выявление рецидива путем рутинного наблюдения [23]. В более раннем отчете было показано, что сывороточный SCC имеет 79% чувствительность для выявления рецидива [24]. В этом исследовании у 22,6% пациентов был диагностирован рецидив опухоли по повышенным уровням онкомаркеров (табл. 1), но это не способствовало улучшению выживаемости после рецидива (рис. 2Б). В соответствии с нашим исследованием, голландское исследование продемонстрировало, что повышенный уровень SCC в сыворотке крови предшествует появлению клинических симптомов, в результате чего не имеет корреляции с результатами выживания [9]. В целом, из-за отсутствия доказательств в пользу измерения биомаркеров в сыворотке крови, рутинное наблюдение может не включать измерение биомаркеров в сыворотке крови, если это не является полезным для оценки ответа на лечение против опухолей первичным лечением.
Согласно предыдущим публикациям, это исследование показало, что местный рецидив имеет лучший прогноз, чем метастазы в местные лимфатические узлы, дистальные лимфатические узлы или отдаленные метастазы (рис. 2А). Даже в этом исследовании у семи пациентов с множественными метастазами был обнаружен местный рецидив. Хотя ни один из наших пациентов, у которых диагностирован только местный рецидив, не подвергся тазовой экзентерации для спасительной терапии, в литературе описано, что в трети случаев тазовая экзентерация при лапаротомии была противопоказана из-за непредсказуемой опухолеподобной диссеминации [25]. Таким образом, перед принятием решения о методе лечения следует тщательно оценить состояние опухоли, поскольку агрессивное хирургическое вмешательство может ухудшить качество жизни пациентки.
Для рутинного наблюдения проводят осмотр органов малого таза и цитологическое исследование влагалищного свода. Системный обзор показал, что частота выявления бессимптомного рецидива с помощью мазка Папаниколау чрезвычайно низкая (6% от медианы частоты выявления) [17], а физикальное обследование выявляет местный рецидив чаще, чем цитологическое исследование [6]. Более того, низкокачественные результаты мазка Папаниколау с последующей кольпоскопией продемонстрировали меньшую эффективность в выявлении рецидива [20]. Однако в нашем исследовании однофакторный анализ показал, что Пап-мазок в диагностическом методе был значимым фактором выживания после рецидива (табл. 2 и рис. 2Б). Интрофлексионный шов мог бы облегчить проведение мазка Папаниколау для выявления рецидива опухоли. Однако метод наложения швов не помог выявить местный рецидив, поскольку во всех случаях гистерэктомии в нашем исследовании было подтверждено, что пациенткам накладывали экстрофлексионные швы. Лучевая терапия может вызвать фиброзные изменения слизистой оболочки влагалища, что, возможно, приводит к увеличению частоты аномальных результатов мазка Папаниколау [26]. В текущем исследовании семь из девяти пациенток с местным рецидивом, диагностированным с помощью мазка Папаниколау, не получали лучевую терапию во время начального лечения, что, возможно, объясняет, почему мазок Папаниколау способствовал точному диагностированию рецидива.
Как и в других исследованиях [27, 28], лучевая терапия в анамнезе как первичное лечение в однофакторном анализе и лучевая терапия как спасительная терапия в многофакторном анализе являются важными факторами выживания после местного рецидива (табл. 3). Варианты спасительной терапии варьируют среди пациентов в зависимости от гистологии опухоли, места рецидива и состояния пациента. В другой группе пациенток с изолированными опухолями малого таза, которые ранее проходили лучевую терапию, не было выявлено статистической разницы в кумулятивном отдаленном метастазировании и общей выживаемости между химиотерапией и хирургическим вмешательством, включая радикальную гистерэктомию и экзентерацию малого таза в рамках спасительной терапии [29]. В противоположность этому, экзентерация таза может иметь прогностический эффект у пациенток, которым противопоказана лучевая терапия, с 5-летней выживаемостью от 30 до 40% [30, 31]. Как наблюдалось в данном исследовании, пациенты, которые проходили спасительную терапию в виде химиотерапии, имели неудовлетворительные результаты (рис. 3). Таким образом, агрессивное хирургическое вмешательство рассматривается для пациентов с непосильными рисками, связанными с повторной лучевой терапией. Однако сложность предоперационной оценки резектабельности и относительно высокая периоперационная заболеваемость и смертность сдерживают от выполнения радикального хирургического вмешательства.
Прогностические факторы местного рецидива, связанные с выживанием после спасительного облучения, включают интервал без заболевания, гистологию, место рецидива (например, вокруг верхушки влагалища или боковой стенки таза) и размер опухоли. Среди этих факторов размер и локализация опухоли с высокой вероятностью прогнозируют эффективность лечения [32, 33]. В этом исследовании результаты пациентов, получивших лучевую терапию по поводу местного рецидива, были достаточно благоприятны, что подтверждается тем фактом, что медиана общей выживаемости не была достигнута на момент фиксации данных (рис. 3). Основной целью интенсивного наблюдения является выявление опухолей на ранней стадии рецидива, когда они поддаются лечебной терапии. В связи с этим мазок Папаниколау, который эффективно выявляет бессимптомный рецидив у пациентов без облучения в анамнезе, может играть важнейшую роль среди методов интенсивного наблюдения, что в конечном итоге может принести пользу пациентам, позволив назначить излечимую лучевую терапию вместо агрессивного хирургического вмешательства. Более того, раннее выявление бессимптомного рецидива с помощью интенсивного наблюдения может обеспечить пострадавшим психологическую поддержку и эффективный контроль симптомов.
Это исследование было проведено с использованием многоцентровых данных, чтобы уменьшить предвзятость отбора пациентов. Однако это исследование имеет некоторые ограничения, включая небольшой размер выборки и то, что ретроспективный характер исследования может вызвать предвзятость. Хотя это исследование демонстрирует статистическую значимость, учитывая размер выборки, большие исследовательские когорты могут предоставить более точные данные и меньшие доверительные интервалы. Клинические результаты после агрессивных хирургических вмешательств не оценивались, поскольку ни один из пациентов не подвергался таким операциям в течение периода исследования. Результаты нашего исследования требуют дальнейшей проверки в будущих исследованиях с большими когортами и рандомизированными контролируемыми исследованиями.
Выводы
Результаты этого исследования подтверждают, что рутинный анализ изображений и измерение биомаркеров не влияют на прогноз пациента после рецидива. Однако мазок Папаниколау может улучшить выживаемость после рецидива в некоторых группах пациентов. Дальнейшее развитие диагностических методов поможет адаптировать методы наблюдения для отдельных пациентов.
Аббревиатуры
Анализ мазка Папаниколау:
Мазок по Папаниколау
ОГО:
Общество гинекологической онкологии
КТ:
Компьютерная томография
МРТ:
Магнитно-резонансная томография
ПЭТ:
Позитронно-эмиссионная томография
ЕОМО:
Европейское общество медицинской онкологии
FIGO:
Международная федерация гинекологии и акушерства
Ссылки на источники
- Yoshino K, Kurita T, Takahashi F, Nagase S. Board members of the Committee on Gynecologic Oncology of the Japan Society of O, Gynecology: Annual report of the committee on gynecologic oncology, the Japan Society of Obstetrics and Gynecology: Annual patient report for 2019 and annual treatment report for 2014. J Obstet Gynaecol Res. 2022;48(7):1570–9.
- Krebs HB, Helmkamp BF, Sevin BU, Poliakoff SR, Nadji M, Averette HE. Recurrent cancer of the cervix following radical hysterectomy and pelvic node dissection. Obstet Gynecol. 1982;59(4):422–7.
- Potter ME, Alvarez RD, Gay FL, Shingleton HM, Soong SJ, Hatch KD. Optimal therapy for pelvic recurrence after radical hysterectomy for early-stage cervical cancer. Gynecol Oncol. 1990;37(1):74–7.
- Koh WJ, Greer BE, Abu-Rustum NR, Apte SM, Campos SM, Cho KR, Chu C, Cohn D, Crispens MA, Dorigo O, et al. Cervical Cancer, Version 2.2015. J Natl Compr Canc Netw. 2015;13(4):395–404 quiz 404.
- Bodurka-Bevers D, Morris M, Eifel PJ, Levenback C, Bevers MW, Lucas KR, Wharton JT. Posttherapy surveillance of women with cervical cancer: an outcomes analysis. Gynecol Oncol. 2000;78(2):187–93.
- Elit L, Fyles AW, Oliver TK, Devries-Aboud MC, Fung-Kee-Fung M. members of the Gynecology Cancer Disease Site Group of Cancer Care Ontario’s Program in Evidence-Based C: Follow-up for women after treatment for cervical cancer. Curr Oncol. 2010;17(3):65–9.
- Salani R, Khanna N, Frimer M, Bristow RE, Chen LM. An update on posttreatment surveillance and diagnosis of recurrence in women with gynecologic malignancies: Society of Gynecologic Oncology (SGO) recommendations. Gynecol Oncol. 2017;146(1):3–10.
- Marth C, Landoni F, Mahner S, McCormack M, Gonzalez-Martin A, Colombo N, Committee EG. Cervical cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28(suppl_4):iv72–83.
- Esajas MD, Duk JM, de Bruijn HW, Aalders JG, Willemse PH, Sluiter W, Pras B, ten Hoor K, Hollema H, van der Zee AG. Clinical value of routine serum squamous cell carcinoma antigen in follow-up of patients with early-stage cervical cancer. J Clin Oncol. 2001;19(19):3960–6.
- Tabata T, Takeshima N, Tanaka N, Hirai Y, Hasumi K. Clinical value of tumor markers for early detection of recurrence in patients with cervical adenocarcinoma and adenosquamous carcinoma. Tumour Biol. 2000;21(6):375–80.
- Salvatici M, Achilarre MT, Sandri MT, Boveri S, Vanna Z, Landoni F. Squamous cell carcinoma antigen (SCC-Ag) during follow-up of cervical cancer patients: Role in the early diagnosis of recurrence. Gynecol Oncol. 2016;142(1):115–9.
- Nakamura K, Kitahara Y, Yamashita S, Kigure K, Ito I, Nishimura T, Azuma A, Kanuma T. Reassessment of intensive surveillance practices adopted for endometrial cancer survivors. BMC Womens Health. 2022;22(1):355.
- Kanda Y. Investigation of the freely available easy-to-use software ‘EZR’ for medical statistics. Bone Marrow Transplant. 2013;48(3):452–8.
- Hillesheim I, Limone GA, Klimann L, Monego H, Appel M, de Souza A, Dos Reis R. Cervical Cancer Posttreatment Follow-up: Critical Analysis. Int J Gynecol Cancer. 2017;27(8):1747–52.
- Taarnhoj GA, Christensen IJ, Lajer H, Fuglsang K, Jeppesen MM, Kahr HS, Hogdall C. Risk of recurrence, prognosis, and follow-up for Danish women with cervical cancer in 2005–2013: A national cohort study. Cancer. 2018;124(5):943–51.
- Cibula D, Dostalek L, Jarkovsky J, Mom CH, Lopez A, Falconer H, Scambia G, Ayhan A, Kim SH, Isla Ortiz D, et al. Post-recurrence survival in patients with cervical cancer. Gynecol Oncol. 2022;164(2):362–9.
- Elit L, Fyles AW, Devries MC, Oliver TK, Fung-Kee-Fung M. Gynecology Cancer Disease Site G: Follow-up for women after treatment for cervical cancer: a systematic review. Gynecol Oncol. 2009;114(3):528–35.
- Samlal RA, Van Der Velden J, Van Eerden T, Schilthuis MS, Gonzalez Gonzalez D, Lammes FB. Recurrent cervical carcinoma after radical hysterectomy: an analysis of clinical aspects and prognosis. Int J Gynecol Cancer. 1998;8(1):78–84.
- Zola P, Fuso L, Mazzola S, Piovano E, Perotto S, Gadducci A, Galletto L, Landoni F, Maggino T, Raspagliesi F, et al. Could follow-up different modalities play a role in asymptomatic cervical cancer relapses diagnosis? An Italian multicenter retrospective analysis. Gynecol Oncol. 2007;107(1 Suppl 1):S150-154.
- Rimel BJ, Burke WM, Higgins RV, Lee PS, Lutman CV, Parker L. Improving quality and decreasing cost in gynecologic oncology care. Society of gynecologic oncology recommendations for clinical practice. Gynecol Oncol. 2015;137(2):280–4.
- Wen JC, Sai V, Straatsma BR, McCannel TA. Radiation-related cancer risk associated with surveillance imaging for metastasis from choroidal melanoma. JAMA Ophthalmol. 2013;131(1):56–61.
- Yoon SM, Shin KH, Kim JY, Seo SS, Park SY, Kang S, Cho KH. The clinical values of squamous cell carcinoma antigen and carcinoembryonic antigen in patients with cervical cancer treated with concurrent chemoradiotherapy. Int J Gynecol Cancer. 2007;17(4):872–8.
- Jeong BK, Huh SJ, Choi DH, Park W, Bae DS, Kim BG. Prognostic value of different patterns of squamous cell carcinoma antigen level for the recurrent cervical cancer. Cancer Res Treat. 2013;45(1):48–54.
- Forni F, Ferrandina G, Deodato F, Macchia G, Morganti AG, Smaniotto D, Luzi S, D’Agostino G, Valentini V, Cellini N, et al. Squamous cell carcinoma antigen in follow-up of cervical cancer treated with radiotherapy: evaluation of cost-effectiveness. Int J Radiat Oncol Biol Phys. 2007;69(4):1145–9.
- Estape R, Angioli R. Surgical management of advanced and recurrent cervical cancer. Semin Surg Oncol. 1999;16(3):236–41.
- Rimel BJ, Ferda A, Erwin J, Dewdney SB, Seamon L, Gao F, DeSimone C, Cotney KK, Huh W, Massad LS. Cervicovaginal cytology in the detection of recurrence after cervical cancer treatment. Obstet Gynecol. 2011;118(3):548–53.
- Qiu JT, Abdullah NA, Chou HH, Lin CT, Jung SM, Wang CC, Chen MY, Huang KG, Chang TC, Lai CH. Outcomes and prognosis of patients with recurrent cervical cancer after radical hysterectomy. Gynecol Oncol. 2012;127(3):472–7.
- Yoshida K, Kajiyama H, Utsumi F, Niimi K, Sakata J, Suzuki S, Shibata K, Kikkawa F. A post-recurrence survival-predicting indicator for cervical cancer from the analysis of 165 patients who developed recurrence. Mol Clin Oncol. 2018;8(2):281–5.
- Lin AJ, Ma S, Markovina S, Schwarz J, Mutch DG, Powell MA, Grigsby PW. Clinical outcomes after isolated pelvic failure in cervical cancer patients treated with definitive radiation. Gynecol Oncol. 2019;153(3):530–4.
- Schmidt AM, Imesch P, Fink D, Egger H. Indications and long-term clinical outcomes in 282 patients with pelvic exenteration for advanced or recurrent cervical cancer. Gynecol Oncol. 2012;125(3):604–9.
- Chiantera V, Rossi M, De Iaco P, Koehler C, Marnitz S, Ferrandina G, Legge F, Parazzini F, Scambia G, Schneider A, et al. Survival after curative pelvic exenteration for primary or recurrent cervical cancer: a retrospective multicentric study of 167 patients. Int J Gynecol Cancer. 2014;24(5):916–22.
- Ito H, Shigematsu N, Kawada T, Kubo A, Isobe K, Hara R, Yasuda S, Aruga T, Ogata H. Radiotherapy for centrally recurrent cervical cancer of the vaginal stump following hysterectomy. Gynecol Oncol. 1997;67(2):154–61.
- Ijaz T, Eifel PJ, Burke T, Oswald MJ. Radiation therapy of pelvic recurrence after radical hysterectomy for cervical carcinoma. Gynecol Oncol. 1998;70(2):241–6.