Резюме
Предусловия
“Мягкие маркеры” являются распространенными пренатальными ультразвуковыми находками, которые указывают на повышенный риск анеуплоидии плода. Однако связь между мягкими маркерами и патогенными/вероятно патогенными вариациями числа копий генов (ПВЧК) все еще остается невыясненной, клиницисты непоследовательны в определении плодов, у которых мягкие маркеры необходимы для инвазивной пренатальной диагностики.
Цель
Целью исследования было предоставление рекомендаций по заказу пренатального генетического тестирования плодов с различными мягкими маркерами и выяснение ассоциации определенных типов хромосомных аномалий с конкретными ультрасонографическими мягкими маркерами.
Структура исследования
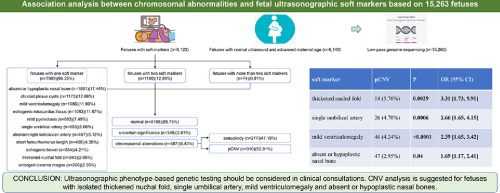
Низкочастотное секвенирование генома было выполнено на 15 263 плодах, включая мягкие ультразвуковые маркеры (n=9 123) и обычную ультразвуковую диагностику (n=6 140). Выход ПВЧК при использовании различных мягких ультразвуковых маркеров сравнивали с выходом у плодов с нормальной ультразвуковой диагностикой. Связь между мягкими маркерами и анеуплоидией/ПВЧК определяли с помощью точного критерия Фишера с поправкой Бонферрони.
Результаты
Частота выявления анеуплоидии и ПВЧК составляла 3,04% (277/9 123) и 3,40% (310/9 123) у плодов с ультрасонографическими мягкими маркерами соответственно. Отсутствующая или гипопластическая носовая кость была самым частым мягким маркером во втором триместре с самым высоким диагностическим выходом анеуплоидии 5,22% (83/1 591) среди всех выделенных групп. Четыре типа изолированных мягких ультразвуковых маркеров имели более высокую частоту выявления ПВЧК (P<0,05, ОШ=1,69-3,31), включая утолщенную шейную складку, единственную пуповинную артерию, легкую вентрикуломегалию и отсутствие или гипопластичность носовой кости. Кроме того, это исследование выявило, что делеция 22q11.2 ассоциируется с аберрантной правой подключичной артерией, тогда как делеция 16p13.11, делеция 10q26.13-q26.3 и делеция 8p23.3-p23.1 ассоциируются с утолщенной шейной складкой, а делеция 16p11.2 и делеция 17p11.2 ассоциируются с умеренной вентрикуломегалией (P<0.05).
Заключение
Во время клинических консультаций следует рассмотреть возможность проведения генетического ультразвукового фенотипического тестирования. Анализ на ВЧК рекомендуется проводить у плодов с изолированной утолщенной шейной складкой, единственной пупочной артерией, легкой вентрикуломегалией и отсутствием или гипопластичностью носовой кости. Всестороннее определение генотип-фенотипических корреляций при анеуплоидии/ПВЧК может предоставить лучшую информацию для генетического консультирования.
Графический рисунок
Ключевые слова
Анеуплоидия
низкочастотное секвенирование генома
патогенные/вероятно патогенные вариации числа копий
пренатальная диагностика
мягкий маркер
ВСТУПЛЕНИЕ
Мягкие маркеры являются распространенными ультразвуковыми находками при пренатальном рутинном обследовании, которые обнаруживаются по меньшей мере у 10% нормальных плодов 1. Мягкие маркеры – это неспецифические и часто транзиторные незначительные анатомические вариации, указывающие на несколько повышенный риск анеуплоидии плода 2, 3. Однако, с широким распространением неинвазивного пренатального скрининга, важность ультразвуковых мягких маркеров меняется. Когда риск анеуплоидии больше не является основным вопросом, который следует рассматривать для плодов с мягкими маркерами, клиницистов больше беспокоит ассоциация мягких маркеров с другими хромосомными аномалиями, такими как патогенные/вероятные патогенные вариации числа копий (ПВЧК), которые ассоциируются с болезнями или имеют высокую вероятность вызвать заболевания. Выявление ПВЧК имеет большое значение для оценки результатов беременности и прогноза для плодов с аномальными результатами ультразвукового исследования, особенно в отношении возможности интеллектуальной неполноценности 4.
Предыдущие исследования показали, что ПВЧК часто проявляется специфическими мягкими маркерами, такими как утолщение шейной складки (ШС) и вентрикуломегалия 5–8. Инкрементный выход для выявления ПВЧК у плодов с изолированной утолщенной ШС и нормальным кариотипом составлял около 3,9-5,0% 5, 9, 10. Выход ПВЧК у плодов с изолированной легкой вентрикуломегалией составлял 5,1% 11. Общество медицины матери и плода (ОММП) уже рекомендовало хромосомное микрочипирование (ХМЧ) для плодов с вентрикуломегалией в 2018 году 12. Однако из-за отсутствия масштабных исследований (2466 плодов или менее 8) и сравнений с плодами с нормальной ультразвуковой диагностикой связь между большинством мягких маркеров и ПВЧК до сих пор не выяснена. Клиницисты все еще стоят перед дилеммой, решая, проводить ли генетическое тестирование плодов с различными мягкими ультразвуковыми маркерами или нет.
Недавно низкочастотное секвенирование генома (низкочастотное СГ) с улучшенным разрешением и высокой пропускной способностью появилось как альтернативный генетический тест для ХМЧ 13, 14. Его преимущества включают более короткое время выполнения, меньшее количество ДНК, более низкую техническую частоту повторения и более низкую стоимость 15. В этом исследовании мы всесторонне проанализировали частоту выявления анеуплоидии и ПВЧК с 11 типами мягких ультразвуковых маркеров на основе большой когорты из 15 263 плодов, обследованных с помощью низкочастотного ГС, чтобы дать рекомендации по заказу пренатального генетического тестирования для плодов с различными мягкими маркерами. Кроме того, сосредоточившись на каждой анеуплоидии/ПВЧК, мы сравнили ультрасонографические характеристики плодов с контрольной группой, чтобы выяснить связь конкретных типов хромосомных аномалий с конкретными ультрасонографическими мягкими маркерами.
МАТЕРИАЛЫ И МЕТОДЫ
Отбор образцов и этическое одобрение
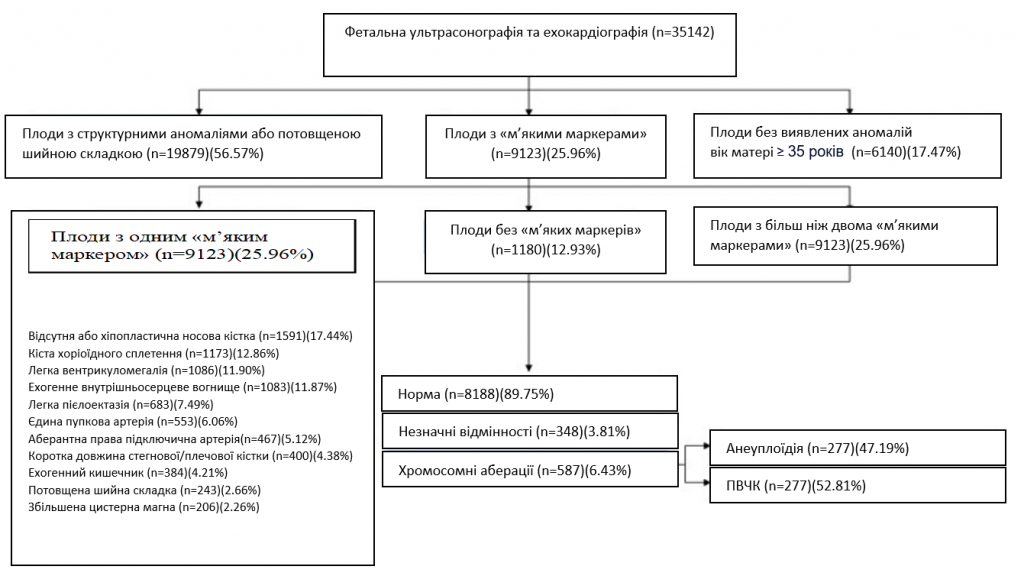
Беременные с одноплодной беременностью были отобраны из нескольких центров амниоцентеза или чрескожного забора пуповинной крови в Китае в период с января 2016 года по октябрь 2020 года. Каждой участнице было проведено низкочастотную ГС и ультрасонографию. Всем плодам проводили рутинное УЗИ во втором триместре. Детальное анатомическое исследование плода во втором триместре проводили квалифицированные врачи-ультрасонографы в сроке 18-27 + 6 недель в соответствии с рекомендациями Международного общества ультразвукового акушерства и гинекологии 16. Плоды с утолщением шейной складки (ШС≥95-й процентиль), структурными аномалиями, задержкой роста или положительными результатами неинвазивного пренатального скрининга на анеуплоидию были исключены из нашего исследования. 9123 плодов было идентифицировано с помощью мягких маркеров, включая кисты хориоидного сплетения, отсутствие или гипопластичность носовой кости (отсутствует или длина < 2,5 мм), эхографические признаки, эхогенный внутрисердечный очаг, легкая вентрикуломегалия (≥ 10 мм и < 15 мм), единственная пупочная артерия, легкие пиелектазы (≥ 4 мм и < 10 мм), аберрантная правая подключичная артерия, эхогенный кишечник (эхогенность кишечника плода равна или превышает эхогенность костей плода, которые окружают его), короткая длина бедренной/плечевой кости (ниже 5-го перцентиля для гестационного возраста), утолщенная шейная складка (≥ 6 мм между 18 и 24 неделями) или увеличенная цистерна магна (≥ 10 мм). Учитывая, что частота возникновения ПВЧК не связана с возрастом матери 17, 6140 плодов у матерей старшего возраста (женщины в возрасте ≥35 лет), с нормальными результатами ультразвукового исследования, нормальными результатами неинвазивного пренатального скрининга, нормальными результатами биохимического скрининга на синдром Дауна и отсутствием в семейном/личном анамнезе хромосомных аномалий было определено как контрольную группу (рис. 1). Что касается этнической принадлежности, 83,44% были китайскими ханьцами, остальные были представителями китайских меньшинств. Плоды без визуализационных аномалий были отобраны по показаниям для инвазивного тестирования, включая старший возраст матери. Следует учитывать риск потери беременности или других пост-амниоцентезных осложнений, в настоящее время риск, связанный с амниоцентезом, составляет примерно 0,1% 18. Это исследование было одобрено Комитетом по вопросам этики Центра медицинской генетики Центрального Южного университета, Хунань, Китай. Этические референтные номера 2015031002 (дата одобрения: 2016.1-2019.12) и 2019-1-23 (дата одобрения: 2019.05-2024.05). Все субъекты подписали письменное информированное согласие на генетическое исследование беременности. В дальнейшем анализе учитывали только анеуплоидию зародышевой линии и ПВЧК.
Рисунок 1 – Отбор и привлечение участников исследования.
Низкочастотное секвенирование генома
Геномную ДНК выделяли из амниотической жидкости или пуповинной крови в соответствии с протоколом производителя. Для проверки контаминации материнской ДНК во время процедуры использовали полуколичественный ПЦР-анализ на основе КТП. Образцы с загрязнением >10% были исключены из исследования. Наконец, 200 нг геномной ДНК было случайным образом фрагментировано, и библиотеки ДНК были сконструированы с помощью конечной репарации, А-хвостовой и адаптерной лигации.19
Низкочастотную ГС проводили, как описано ранее 19–21, что соответствует среднему покрытию 0,06 × .Картированные считывания распределяли на бины размером 20 килобаз (кб) с раздвижением 5 кб для идентификации ВЧК. Профили ВЧК каждой хромосомы были представлены как log2 средних считываний секвенирования каждого бина секвенирования вдоль хромосомы. Любые два ВЧК с ≥60% взаимным перекрытием были идентифицированы как одинаковые. Для поиска референтных DGV использовали общедоступные геномные базы данных, включающие 1000 геномов, DGV (http://dgv.tcag.ca/dgv/app/home), OMIM (https://www.omim.org/), DECIPHER (https://decipher.sanger.ac.uk/), ClinVar (https://www.ncbi.nlm.nih.gov/clinvar/), UCSC (http://genome.ucsc.edu/) и PubMed (https://pubmed.ncbi.nlm.nih.gov/). Патогенность идентифицированных ВЧК оценивали в соответствии с рекомендациями Американского колледжа медицинской генетики (АКМГ)22.
Статистический анализ
Результаты и графики были выполнены с использованием программного обеспечения R (версия 4.0.2). Количество ПВЧК у плодов с мягкими ультразвуковыми маркерами сравнивали с контрольной группой. Связь между ультрасонографическими мягкими маркерами и анеуплоидией/ПВЧК определяли с помощью точного критерия Фишера с поправкой Бонферрони. Статистически значимым считали Р<0,05.
РЕЗУЛЬТАТЫ
Демографические данные плодов
Всего в это исследование было включено 9123 плодов с ультрасонографическими мягкими маркерами, протестированными с помощью низкочастотного ГС из 29 провинций Китая. Средний возраст матери составлял 29,8 лет ±5,0 лет, а средний срок беременности (на момент проведения низкочастотного ГС) составлял 24,4 ±3,6 недель. Отсутствующая или гипопластическая носовая кость является самым распространенным изолированным ультразвуковым мягким маркером во втором триместре (17,44%, 1 591/9 123), далее следуют кисты хориоидального сплетения (12,86%, 1 173/9 123), легкая вентрикуломегалия (11,90%, 1 086/9 123), эхогенный внутрисердечный очаг (11,87%, 1 083/9 123), легкие пиелоэктазы (7. 49%, 683/9,123), единственная пупочная артерия (6,06%, 553/9,123), аберрантная правая подключичная артерия (5,12%, 467/9,123), короткая длина бедренной/плечевой костей (4. 38%, 400/9 123), эхогенный кишечник (4,21%, 384/9 123), утолщенная шейная складка (2,66%, 243/9 123) и увеличенная цистерна магна (2,26%, 206/9 123) (Рис. 1).
Частота хромосомных аномалий
В общем, анеуплоидии и ПВЧК встречались у 3,04% (277/9 123) и 3,40% (310/9 123) плодов с мягкими маркерами, соответственно. Самой распространенной анеуплоидией была трисомия 21 (1,99%, 182/9 123), за которой следовали трисомия 18 (0,54%, 49/9 123) и синдром XXY (0,21%, 19/9 123), что составило 90,25% (250/277) всех анеуплоидий. Самой распространенной ПВЧК была делеция Xp22.31 (0,26%, 24/9,123), за которой следовали делеция 15q11.2 (0,24%, 22/9,123) и делеция 16p13.11 (0,16%, 15/9,123). Частота анеуплоидии и ПВЧК у плодов с нормальным ультразвуковым исследованием (старший возраст матери) составляла 2,31% и 1,82% (табл. 1).
Таблица 1 Результаты хромосомных находок при секвенировании низкочастотного генома в исследовании.
| Мягкие маркеры | Количество | Анеуплоидия | Патогенная ВЧК | Вероятно патогенная ВЧК | Неопределенное значение ВЧК | Вероятно доброкачественная ВЧК | Доброкачественная ВЧК | |
| 1 | отсутствуют или гипоплазия носовой кости | 1,591 (17.44%) | 83 (5.22%) | 29 (1.82%) | 18 (1.13%) | 56 (3.52%) | 43 (2.70%) | 122 (7.67%) |
| кисты хориоидного сплетения | 1,173 (12.86%) | 39 (3.32%) | 14 (1.19%) | 14 (1.19%) | 46 (3.92%) | 24 (2.05%) | 72 (6.14%) | |
| легкая вентрикуломегалия | 1,086 (11.90%) | 28 (2.58%) | 29 (2.67%) | 17 (1.57%) | 38 (3.50%) | 37 (3.41%) | 104 (9.58%) | |
| эхогенный внутрисердечный очаг | 1,083 (11.87%) | 22 (2.03%) | 18 (1.66%) | 9 (0.83%) | 50 (4.62%) | 24 (2.22%) | 76 (7.02%) | |
| легкая пиелоэктазия | 683 (7.49%) | 8 (1.17%) | 15 (2.20%) | 3 (0.44%) | 29 (4.25%) | 25 (3.66%) | 57 (8.35%) | |
| единственная пупочная артерия | 553 (6.06%) | 13 (2.35%) | 22 (3.98%) | 4 (0.72%) | 22 (3.98%) | 11 (1.99%) | 37 (6.69%) | |
| аберрантная правая подключичная артерия | 467 (5.12%) | 5 (1.07%) | 9 (1.93%) | 9 (1.93%) | 10 (2.14%) | 17 (3.64%) | 38 (8.14%) | |
| короткая длина бедренной/плечевой кости | 400 (4.38%) | 9 (2.25%) | 14 (3.50%) | 2 (0.50%) | 15 (3.75%) | 8 (2.00%) | 28 (7.00%) | |
| эхогенный кишечник | 384 (4.21%) | 3 (0.78%) | 9 (2.34%) | 1 (0.26%) | 16 (4.17%) | 8 (2.08%) | 33 (8.59%) | |
| утолщенная шейная складка | 243 (2.66%) | 7 (2.88%) | 10 (4.12%) | 4 (1.65%) | 11 (4.53%) | 3 (1.23%) | 15 (6.17%) | |
| увеличенная цистерна магна | 206 (2.26%) | 1 (0.49%) | 3 (1.46%) | 2 (0.97%) | 9 (4.37%) | 6 (2.91%) | 26 (12.62%) | |
| В целом | 7,869 (86.25%) | 218 (2.77%) | 172 (2.19%) | 83 (1.05%) | 302 (3.84%) | 206 (2.62%) | 608 (7.73%) | |
| 2 | 1,180 (12.93%) | 55 (4.66%) | 36 (3.05%) | 13 (1.10%) | 45 (3.81%) | 27 (2.29%) | 93 (7.88%) | |
| ≥ 3 | 74 (0.81%) | 4 (5.41%) | 5 (6.76%) | 1 (1.35%) | 1 (1.35%) | 4 (5.41%) | 9 (12.16%) | |
| Все плоды с мягкими маркерами | 9,123 (100.00%) | 277 (3.04%) | 213 (2.33%) | 97 (1.06%) | 348 (3.81%) | 237 (2.60%) | 710 (7.78%) | |
| Плоды без идентифицированных аномалий и возраст матери ≥ 35 лет | 6,140 | 142 (2.31%) | 69 (1.12%) | 43 (0.70%) | 221 (3.60%) | 127 (2.07%) | 374 (6.09%) | |
Мягкие маркеры были разделены на три группы: 1 (плоды с одним мягким маркером), 2 (плоды с двумя мягкими маркерами) и ≥ 3 (плоды с более чем двумя мягкими маркерами). Для группы 1 мягкие маркеры были дополнительно разделены на 11 изолированных мягких маркеров. ВЧК: вариации числа копий. Патогенность ВЧК оценивали на основе рекомендаций Американского колледжа медицинской генетики (АКМГ)22.
Частота анеуплоидии по разным типам мягких маркеров
Среди всех изолированных мягких маркеров отсутствие или гипоплазия носовой кости имела самый высокий показатель анеуплоидии (5,22%, 83/1 591), за ней следовали кисты хориоидного сплетения (3,32%, 39/1 173) и утолщенная шейная складка (2,88%, 7/243). У плодов с изолированной отсутствующей или гипопластической носовой костью было обнаружено 83 анеуплоидии, из которых 72 были трисомией 21. Мы наблюдали, что частота выявления анеуплоидий возрастала с увеличением количества мягких маркеров. При наличии у плодов двух мягких ультразвуковых маркеров частота анеуплоидии возросла с 2,77% (218/7,869) до 4,66% (55/1,180). В частности, частота анеуплоидий у плодов с кистами хориоидного сплетения и единственной пуповинной артерией достигала 26,47% (9/34), и все эти анеуплоидии были трисомией по 18-й хромосоме. У плодов с тремя и более мягкими маркерами частота анеуплоидии достигала 5,41% (4/74) (Таблица 2).
Таблица 2 Частота ПВЧК при низкочастотном секвенировании у плодов с мягкими маркерами.
| Мягкие маркеры | Количество | ПВЧК | P | ОШ (95% ДИ) | |
| 1 | отсутствуют или гипопластическая носовая кость | 1,591 (17.44%) | 47 (2.95%) | 0.04 | 1.69 [1.17, 2.41] |
| кисты хориоидного сплетения | 1,173 (12.86%) | 28 (2.39%) | 1.00 | 1.33 [0.84, 2.04] | |
| легкая вентрикуломегалия | 1,086 (11.90%) | 46 (4.24%) | < 0.0001 | 2.39 [1.65, 3.42] | |
| эхогенный внутрисердечный очаг | 1,083 (11.87%) | 27 (2.49%) | 1.00 | 1.37 [0.86, 2.12] | |
| легкая пиелоэктазия | 683 (7.49%) | 18 (2.64%) | 1.00 | 1.44 [0.82, 2.40] | |
| единственная пупочная артерия | 553 (6.06%) | 26 (4.70%) | 0.0006 | 2.66 [1.65, 4.15] | |
| аберрантная правая подключичная артерия | 467 (5.12%) | 18 (3.85%) | 0.061 | 2.13 [1.21, 3.56] | |
| короткая длина бедренной/плечевой кости | 400 (4.38%) | 16 (4.00%) | 0.082 | 2.24 [1.23, 3.85] | |
| эхогенный кишечник | 384 (4.21%) | 10 (2.60%) | 1.00 | 1.42 [0.66, 2.73] | |
| утолщенная шейная складка | 243 (2.66%) | 14 (5.76%) | 0.0029 | 3.31 [1.73, 5.91] | |
| увеличенная цистерна магна | 206 (2.26%) | 5 (2.43%) | 1.00 | 1.31 [0.41, 3.21] | |
| В целом | 7,869 (86.25%) | 255 (3.24%) | < 0.0001 | 1.81 [1.44, 2.29] | |
| 2 | 1,180 (12.93%) | 49 (4.15%) | < 0.0001 | 2.39 [1.66, 3.40] | |
| ≥ 3 | 74 (0.81%) | 6 (8.11%) | 0.0023 | 4.92 [1.71, 11.65] | |
| Все плоды с мягкими маркерами | 9,123 (100.00%) | 310 (3.40%) | < 0.0001 | 1.91 [1.53, 2.40] | |
| Плоды без идентифицированных аномалий и возраст матери ≥ 35 лет | 6,140 | 112 (1.82%) | 1.00 | 1 [0.76, 1.31] | |
Мягкие маркеры были разделены на три группы: 1 (плоды с одним мягким маркером), 2 (плоды с двумя мягкими маркерами) и ≥ 3 (плоды с более чем двумя мягкими маркерами). Для группы 1 мягкие маркеры были дополнительно разделены на 11 изолированных мягких маркеров. Частоту ПВЧК в каждой группе сравнивали с показателями плодов без идентифицированных аномалий и возрастом матери ≥ 35 лет с помощью точного критерия Фишера с поправкой Бонферрони. Жирным шрифтом выделены статистически значимые различия на уровне P < 0,05. ПВЧК: патогенные/вероятно патогенные вариации числа копий. ОШ: отношение шансов; ДИ: доверительный интервал.
Частота ПВЧК при различных типах мягких маркеров и сравнение с контрольной группой
Выход ПВЧК среди различных изолированных мягких маркеров колебался от 2,39% до 5,76%, из которых четыре типа мягких маркеров были выше, чем в контрольной группе (P<0,05, ОШ=1,69-3,31), включая утолщенную шейную складку, единственную пуповинную артерию, легкую вентрикуломегалию и отсутствие или гипопластичность носовой кости. Утолщенная шейная складка давала самый высокий показатель ПВЧК – 5,76% (P=0,0029, ОШ=3,31, 95% ДИ [1,73, 5,91]), за ней следовала единственная пупочная артерия (4,70%, P=0,0006, ОШ=2,66, 95% ДИ [1. 65, 4.15]), легкая вентрикуломегалия (4.24%, P<0.0001, ОШ=2.39, 95% ДИ [1.65, 3.42]) и отсутствие или гипоплазия костей носа (2.95%, P=0.04, ОШ=1.69, 95% ДИ [1.17, 2.41]) (Таблица 2). В то время как по остальным семи мягким маркерам достоверной разницы не наблюдалось (P>0,05, ОШ=1,31-2,24). Подобно анеуплоидии, частота ПВЧК увеличивалась с увеличением количества мягких маркеров. Когда плоды имели два мягких маркера, частота ПВЧК возросла с 3,24% (255/7,869) до 4,15% (49/1,180). Частота ПВЧК у плодов с одной пуповинной артерией и утолщенной шейной складкой была выше чем в контрольной группе (37,50%, P = 0,019, ОШ = 31,43, 95% ДИ [4,82, 163,9]). У плодов с тремя и более аномалиями частота ПВЧК составляла до 8,11% (6/74) (Таблица 2).
Корреляция между анеуплоидией/ПВЧК и ультрасонографическими мягкими маркерами
Как и ожидалось, отсутствие или гипопластичность носовой кости и утолщенная шейная складка ассоциировались с трисомией 21. Кроме того, утолщенная шейная складка также ассоциировалась с синдромом 45,Х. Кисты хориоидного сплетения и единственная пупочная артерия были ассоциированы с трисомией 18. Синдромы 47,XXY и 47,XYY не показали значимой ассоциации ни с одним из мягких маркеров.
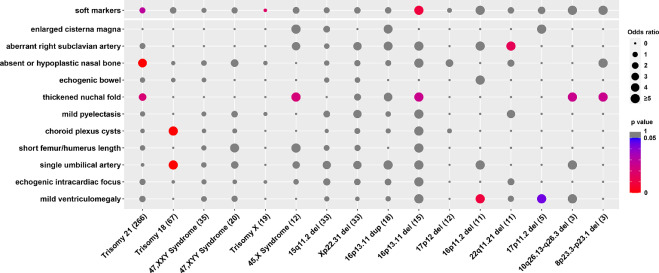
Три типа мягких маркеров были связаны с определенными ПВЧК. Аберрантная правая подключичная артерия ассоциировалась с делецией 22q11.2, о чем сообщалось в нескольких исследованиях 8. В то же время мы наблюдали, что делеция 16p11.2 и 17p11.2 ассоциируется с легкой вентрикуломегалией 23–25. Кроме того, мы обнаружили, что делеция 16p13.11, делеция 10q26.13-q26.3 и делеция 8p23.3-p23.1 ассоциируются с утолщением шейной складки, о чем впервые было сообщено в нашем исследовании (Рис. 2).
Рисунок 2 – Ассоциативный анализ между анеуплоидией/ПВЧК и ультрасонографическими мягкими маркерами.
Распространенность каждой анеуплоидии/ПВЧК в группе мягких маркеров и контрольной группе сравнивали с помощью точного критерия Фишера с поправкой Бонферрони. Значения в скобках указывают на количество образцов с анеуплоидией/ПВЧК. Размер круга отражает значение отношения шансов. Разными цветами обозначены P-значения. Серым цветом обозначено P-value≥0.05. Статистически значимым было значение P<0,05. Показаны все анеуплоидии и ПВЧК с пятью наибольшими размерами выборок или значимой связью.
ОБСУЖДЕНИЕ
Основные результаты
В общем, анеуплоидия и ПВЧК встречались у 3,04% и 3,40% плодов с мягкими маркерами во втором триместре соответственно. Частота анеуплоидии и ПВЧК возрастала с увеличением количества мягких маркеров. Диагноз анеуплоидии и ПВЧК устанавливался примерно в 2 и 2,5 раза чаще у плодов с тремя и более мягкими маркерами, чем у плодов с изолированными мягкими маркерами, соответственно (5,41% против 2,77%), (8,11% против 3,24%). Частота ПВЧК среди различных изолированных мягких маркеров колебался от 2,39% до 5,76%, из которых четыре типа мягких маркеров были более значительными, чем в контрольной группе. Кроме того, четыре типа мягких маркеров были ассоциированы с определенной анеуплоидией, тогда как три типа мягких маркеров были ассоциированы с определенными ПВЧК.
Результаты в контексте и клинические последствия
Частота выявления анеуплоидии и ПВЧК соответствовала частоте 2,88%-2,93% 26, 27 и 2,58%-3,29% 8, 26, о которой сообщалось в предыдущих исследованиях ХМЧ. Мягкие маркеры-это незначительные ультразвуковые признаки, выявленные во втором триместре, связанные с повышенным риском анеуплоидии. Как известно, отсутствие или гипоплазия носовой кости и утолщенная шейная складка были чувствительными мягкими маркерами в среднем триместре для скрининга плодов на трисомию 21 28–30, тогда как кисты хориоидного сплетения были связаны с трисомией 18 31. Наши результаты дополнительно подтвердили эти ассоциации. В частности, у 26,47% (95% ДИ [14,60%, 43,12%]) плодов с кистами хориоидного сплетения в сочетании с единственной пупочной артерией была диагностирована трисомия 18, поэтому клиницисты должны быть внимательными к возможности трисомии 18 у плодов с обоими этими мягкими маркерами. Интересно, что мы обнаружили, что частота обнаружения анеуплоидии у плодов с изолированным эхогенным кишечником и увеличенной цистерной магной была чрезвычайно низкой (<1,0%), что указывает на то, что анеуплоидия может не быть основной генетической причиной этих двух мягких маркеров.
Мы предлагаем проводить анализ ВЧК для четырех изолированных мягких маркеров, включая утолщенную носовую складку, единственную пуповинную артерию, легкую вентрикуломегалию и отсутствие или гипопластичность носовой кости. Хотя ОММП рекомендовало, что кариотипирование или анализ ВЧК для плодов с утолщенной шейной складкой и отсутствующей или гипопластической носовой костью должно основываться на клинических условиях и пожеланиях пациентов 32, 33, наши результаты показали, что стоит проводить анализ ВЧК, поскольку плоды с утолщенной шейной складкой и отсутствующей или гипопластической носовой костью имели более высокий выход ПВЧК, чем в контрольной группе. Интересно, что мы обнаружили, что единственная пупочная артерия ассоциируется с ПВЧК, в отличие от предыдущего исследования 126 плодов 8. Эту разницу можно объяснить размером выборки, и, конечно, у нас есть основания полагать, что наше исследование, основанное на самой большой на сегодняшний день выборке, может предоставить точные данные для предтестового консультирования. Кроме того, ОММП рекомендует проводить ХМЧ плодам с изолированной вентрикуломегалией во втором триместре, и наши результаты дополнительно подтверждают эту рекомендацию 12.
Однако мы не смогли воспроизвести предыдущие ассоциации между аберрантной правой подключичной артерией и короткой длиной бедренной/плечевой кости и ПВЧК 8. Сообщалось, что выход ПВЧК у плодов с аберрантной правой подключичной артерией и короткой длиной бедренной/плечевой кости составлял 5,26% и 5,19% соответственно. Однако выход ПВЧК по этим двум мягким маркерам в наших когортах был несколько выше (но не статистически значимым) по сравнению с контрольной группой. Учитывая эти различия в результатах, мы рекомендуем тщательно подходить к принятию пренатальных решений в отношении плодов с этими двумя мягкими маркерами. Поскольку выход ПВЧК у плодов с кистами хориоидального сплетения, эхогенным внутрисердечным очагом, легким пиелектазом, эхогенным кишечником и увеличенной цистерной магной в нашем исследовании достоверно не отличался от контрольной группы, пренатальное ведение плодов с этими изолированными мягкими маркерами можно отнести к беременности со зрелым материнским возрастом.
Ранее описанные фенотипы у плодов с ПВЧК в основном были сосредоточены на структурных аномалиях. Мы обнаружили, что некоторые мягкие маркеры встречаются чаще при определенных ПВЧК. Хотя связь между аберрантной правой подключичной артерией и делецией 22q11.2 была противоречивой, Sagi-Dain и соавт. не обнаружили ни одного случая делеции 22q11.2 в 246 изолированных аберрантных правых подключичных артерий 34, тогда как Hu и соавт. сообщили о трех делециях 22q11.2 в 133 плодов с аберрантной правой подключичной артерией 8. В нашем исследовании было выявлено три случая делеции 22q11.2 в 467 плодов с изолированной аберрантной правой подключичной артерией. Более того, мы обнаружили связь между аберрантной правой подключичной артерией и делецией 22q11.2 по сравнению с контрольной группой. Наше исследование показало, что легкая вентрикуломегалия ассоциируется с делецией 16p11.2, которая была описана только в двух случаях 25, 35. Распространенным антенатальным фенотипом делеции 16p11.2, о котором сообщалось в предыдущих исследованиях, были деформации позвоночника 25, 36. Умеренная вентрикуломегалия является самой распространенной находкой головного мозга у пациентов с делецией 17p11.237, наше исследование дополнительно подтвердило эту ассоциацию у плодов. Кроме того, мы впервые сообщили, что делеция 16p13.11, делеция 10q26.13-q26.3 и делеция 8p23.3-p23.1 ассоциируются с утолщенной затылочной складкой, что еще больше расширяет фенотипический спектр этих ПВЧК.
Сильные стороны и ограничения
Наше исследование провело один из крупнейших анализов связи между анеуплоидией/ПВЧК и ультрасонографическими мягкими маркерами. Однако наше исследование имело определенные ограничения. Отсутствуют данные дальнейшего ультразвукового наблюдения и постнатальных результатов, что могло бы переоценить вклад хромосомных аномалий у плодов с нормальной ультразвуковой диагностикой. Поскольку некоторые аномалии могут быть пропущены во время ультразвукового исследования или проявиться позже. Кроме того, это исследование рассматривало только вариации на хромосомном уровне, и неясно, влияют ли дополнительные генетические вариации, не обнаруженные низкочастотным ГС, на фенотипический спектр. Мы ожидаем, что будущие исследования смогут совместить секвенирование всего экзома для улучшения идентификации генетических нарушений у плодов с результатами ультразвукового исследования 38–40. Независимо от размера выборки, наши результаты должны быть воспроизведены, прежде чем они будут использованы в консультировании или на практике.
Заключения
Наши результаты могут служить надежной основой для проведения соответствующего генетического тестирования плодов с различными мягкими маркерами. Мы предлагаем проводить анализ на ВЧК у плодов со специфическими ультразвуковыми мягкими маркерами, такими как утолщенная шейная складка, единая пупочная артерия, легкая вентрикуломегалия и отсутствие или гипоплазия носовой кости. В то же время, наше исследование всесторонне определило генотип-фенотипическую корреляцию анеуплоидии/ПВЧК, чтобы предоставить лучшую информацию для генетического консультирования. Кроме того, мы ожидаем, что эти большие данные могут быть использованы для построения модели прогнозирования на основе машинного обучения для принятия решений по генетическому тестированию в будущем.
Ссылки на источники
- Dashe JS. Aneuploidy Screening in Pregnancy. Obstet Gynecol. Jul 2016;128(1):181-194.
- Reddy UM, Abuhamad AZ, Levine D, Saade GR, Fetal Imaging Workshop Invited P. Fetal imaging: Executive summary of a Joint Eunice Kennedy Shriver National Institute of Child Health and Human Development, Society for Maternal-Fetal Medicine, American Institute of Ultrasound in Medicine, American College of Obstetricians and Gynecologists, American College of Radiology, Society for Pediatric Radiology, and Society of Radiologists in Ultrasound Fetal Imaging Workshop. Am J Obstet Gynecol. May 2014;210(5):387-397.
- Getz L, Kirkengen AL. Ultrasound screening in pregnancy: advancing technology, soft markers for fetal chromosomal aberrations, and unacknowledged ethical dilemmas. Soc Sci Med. May 2003;56(10):2045-2057.
- Cooper GM, Coe BP, Girirajan S, et al. A copy number variation morbidity map of developmental delay. Nat Genet. Aug 14 2011;43(9):838-846.
- Grande M, Jansen FA, Blumenfeld YJ, et al. Genomic microarray in fetuses with increased nuchal translucency and normal karyotype: a systematic review and meta-analysis. Ultrasound Obstet Gynecol. Dec 2015;46(6):650-658.
- Egloff M, Herve B, Quibel T, et al. Diagnostic yield of chromosomal microarray analysis in fetuses with isolated increased nuchal translucency: a French multicenter study. Ultrasound Obstet Gynecol. Dec 2018;52(6):715-721.
- Chang Q, Yang Y, Peng Y, et al. Prenatal detection of chromosomal abnormalities and copy number variants in fetuses with ventriculomegaly. Eur J Paediatr Neurol. Mar 2020;25:106-112.
- Hu T, Tian T, Zhang Z, et al. Prenatal chromosomal microarray analysis in 2466 fetuses with ultrasonographic soft markers: a prospective cohort study. Am J Obstet Gynecol. May 2021;224(5):516 e511-516 e516.
- Maya I, Yacobson S, Kahana S, et al. Cut-off value of nuchal translucency as indication for chromosomal microarray analysis. Ultrasound Obstet Gynecol. Sep 2017;50(3):332-335.
- Sagi-Dain L, Singer A, Ben Shachar S, et al. Risk of Clinically Significant Chromosomal Microarray Analysis Findings in Fetuses With Nuchal Translucency From 3.0 mm Through 3.4 mm. Obstet Gynecol. Jan 1 2021;137(1):126-131.
- Shaffer LG, Rosenfeld JA, Dabell MP, et al. Detection rates of clinically significant genomic alterations by microarray analysis for specific anomalies detected by ultrasound. Prenat Diagn. Oct 2012;32(10):986-995.
- Society for Maternal-Fetal M, Electronic address pso, Fox NS, et al. Mild fetal ventriculomegaly: diagnosis, evaluation, and management. Am J Obstet Gynecol. Jul 2018;219(1):B2-B9.
- Wang H, Dong Z, Zhang R, et al. Low-pass genome sequencing versus chromosomal microarray analysis: implementation in prenatal diagnosis. Genet Med. Mar 2020;22(3):500-510.
- Martin AR, Atkinson EG, Chapman SB, et al. Low-coverage sequencing cost-effectively detects known and novel variation in underrepresented populations. Am J Hum Genet. Apr 1 2021;108(4):656-668.
- Dong Z, Zhang J, Hu P, et al. Low-pass whole-genome sequencing in clinical cytogenetics: a validated approach. Genet Med. Sep 2016;18(9):940-948.
- Salomon LJ, Alfirevic Z, Berghella V, et al. Practice guidelines for performance of the routine mid-trimester fetal ultrasound scan. Ultrasound Obstet Gynecol. Jan 2011;37(1):116-126.
- Grati FR, Molina Gomes D, Ferreira JC, et al. Prevalence of recurrent pathogenic microdeletions and microduplications in over 9500 pregnancies. Prenat Diagn. Aug 2015;35(8):801-809.
- Wulff CB, Gerds TA, Rode L, et al. Risk of fetal loss associated with invasive testing following combined first-trimester screening for Down syndrome: a national cohort of 147,987 singleton pregnancies. Ultrasound Obstet Gynecol. Jan 2016;47(1):38-44.
- Zhou X, Chen X, Jiang Y, et al. A Rapid PCR-Free Next-Generation Sequencing Method for the Detection of Copy Number Variations in Prenatal Samples. Life (Basel). Jan 28 2021;11(2).
- Wang J, Chen L, Zhou C, et al. Prospective chromosome analysis of 3429 amniocentesis samples in China using copy number variation sequencing. Am J Obstet Gynecol. Sep 2018;219(3):287 e281-287 e218.
- Liang D, Peng Y, Lv W, et al. Copy number variation sequencing for comprehensive diagnosis of chromosome disease syndromes. J Mol Diagn. Sep 2014;16(5):519-526.
- Riggs ER, Andersen EF, Cherry AM, et al. Technical standards for the interpretation and reporting of constitutional copy-number variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics (ACMG) and the Clinical Genome Resource (ClinGen). Genet Med. Feb 2020;22(2):245-257.
- Lei TY, Li R, Fu F, et al. Prenatal diagnosis of Smith-Magenis syndrome in two fetuses with increased nuchal translucency, mild lateral ventriculomegaly, and congenital heart defects. Taiwan J Obstet Gynecol. Dec 2016;55(6):886-890.
- Zhang P, Sun Y, Tian H, et al. Prenatal diagnosis and neonatal phenotype of a de novo microdeletion of 17p11.2p12 associated with Smith-Magenis syndrome and external genital defects. J Genet. 2020;99.
- Liu N, Li H, Li M, Gao Y, Yan H. Prenatally diagnosed 16p11.2 copy number variations by SNP Array: A retrospective case series. Clin Chim Acta. Jan 1 2023;538:15-21.
- Cai M, Lin N, Chen X, et al. Evaluation of chromosomal abnormalities and copy number variations in fetuses with ultrasonic soft markers. BMC Med Genomics. Jan 12 2021;14(1):19.
- Sagi-Dain L, Cohen Vig L, Kahana S, et al. Chromosomal microarray vs. NIPS: analysis of 5541 low-risk pregnancies. Genet Med. Nov 2019;21(11):2462-2467.
- Agathokleous M, Chaveeva P, Poon LC, Kosinski P, Nicolaides KH. Meta-analysis of second-trimester markers for trisomy 21. Ultrasound Obstet Gynecol. Mar 2013;41(3):247-261.
- Nyberg DA, Souter VL, El-Bastawissi A, Young S, Luthhardt F, Luthy DA. Isolated sonographic markers for detection of fetal Down syndrome in the second trimester of pregnancy. J Ultrasound Med. Oct 2001;20(10):1053-1063.
- Smith-Bindman R, Hosmer W, Feldstein VA, Deeks JJ, Goldberg JD. Second-trimester ultrasound to detect fetuses with Down syndrome: a meta-analysis. JAMA. Feb 28 2001;285(8):1044-1055.
- Snijders RJ, Shawa L, Nicolaides KH. Fetal choroid plexus cysts and trisomy 18: assessment of risk based on ultrasound findings and maternal age. Prenat Diagn. Dec 1994;14(12):1119-1127.
- Society for Maternal-Fetal Medicine . Electronic address pso, Prabhu M, Kuller JA, Biggio JR. Society for Maternal-Fetal Medicine Consult Series #57: Evaluation and management of isolated soft ultrasound markers for aneuploidy in the second trimester: (Replaces Consults #10, Single umbilical artery, October 2010; #16, Isolated echogenic bowel diagnosed on second-trimester ultrasound, August 2011; #17, Evaluation and management of isolated renal pelviectasis on second-trimester ultrasound, December 2011; #25, Isolated fetal choroid plexus cysts, April 2013; #27, Isolated echogenic intracardiac focus, August 2013). Am J Obstet Gynecol. Oct 2021;225(4):B2-B15.
- Society for Maternal-Fetal M, Stone JE, Kuller JA, Norton ME, Abuhamad A. The Society for Maternal-Fetal Medicine (SMFM) Fetal Anomalies Consult Series. Am J Obstet Gynecol. Nov 2019;221(5):B2-B24.
- Sagi-Dain L, Singer A, Josefsberg S, et al. Microarray analysis has no additional value in fetal aberrant right subclavian artery: description of 268 pregnancies and systematic literature review. Ultrasound Obstet Gynecol. Jun 2019;53(6):810-815.
- Cai M, Huang H, Lin N, et al. [Prenatal ultrasonographic manifestations and genetic analysis of eight fetuses with 16p11.2 microdeletions]. Zhonghua Yi Xue Yi Chuan Xue Za Zhi. Feb 10 2022;39(2):227-230.
- Lin S, Shi S, Zhou Y, et al. Intrauterine phenotypic features associated with 16p11.2 recurrent microdeletions. Prenat Diagn. May 2018;38(6):381-389.
- Greenberg F, Lewis RA, Potocki L, et al. Multi-disciplinary clinical study of Smith-Magenis syndrome (deletion 17p11.2). Am J Med Genet. Mar 29 1996;62(3):247-254.
- Talkowski ME, Rehm HL. Introduction of genomics into prenatal diagnostics. Lancet. Feb 23 2019;393(10173):719-721.
- Lord J, McMullan DJ, Eberhardt RY, et al. Prenatal exome sequencing analysis in fetal structural anomalies detected by ultrasonography (PAGE): a cohort study. Lancet. Feb 23 2019;393(10173):747-757.
- Petrovski S, Aggarwal V, Giordano JL, et al. Whole-exome sequencing in the evaluation of fetal structural anomalies: a prospective cohort study. Lancet. Feb 23 2019;393(10173):758-767.