Резюме
Передумови
“М’які маркери” є поширеними пренатальними ультразвуковими знахідками, які вказують на підвищений ризик анеуплоїдії плода. Однак зв’язок між м’якими маркерами та патогенними/вірогідно патогенними варіаціями числа копій генів (ПВЧК) все ще залишається нез’ясованим, клініцисти непослідовні у визначенні плодів, у яких м’які маркери необхідні для інвазивної пренатальної діагностики.
Мета
Метою дослідження було надання рекомендацій щодо замовлення пренатального генетичного тестування плодів з різними м’якими маркерами та з’ясування асоціації певних типів хромосомних аномалій з конкретними ультрасонографічними м’якими маркерами.
Структура дослідження
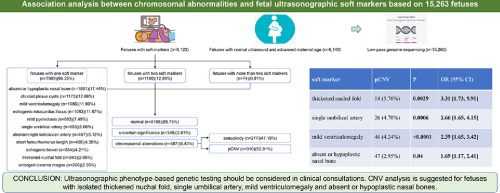
Низькочастотне секвенування геному було виконано на 15 263 плодах, включаючи м’які ультразвукові маркери (n=9 123) та звичайну ультразвукову діагностику (n=6 140). Вихід ПВЧК при використанні різних м’яких ультразвукових маркерів порівнювали з виходом у плодів з нормальною ультразвуковою діагностикою. Зв’язок між м’якими маркерами та анеуплоїдією/ПВЧК визначали за допомогою точного критерію Фішера з поправкою Бонферроні.
Результати
Частота виявлення анеуплоїдії та ПВЧК становила 3,04% (277/9 123) та 3,40% (310/9 123) у плодів з ультрасонографічними м’якими маркерами відповідно. Відсутня або гіпопластична носова кістка була найчастішим м’яким маркером у другому триместрі з найвищим діагностичним виходом анеуплоїдії 5,22% (83/1 591) серед усіх виділених груп. Чотири типи ізольованих м’яких ультразвукових маркерів мали вищу частоту виявлення ПВЧК (P<0,05, ВШ=1,69-3,31), включаючи потовщену шийну складку, єдину пуповинну артерію, легку вентрикуломегалію та відсутність або гіпопластичність носової кістки. Крім того, це дослідження виявило, що делеція 22q11.2 асоціюється з аберантною правою підключичною артерією, тоді як делеція 16p13.11, делеція 10q26.13-q26.3 і делеція 8p23.3-p23.1 асоціюються з потовщеною шийною складкою, а делеція 16p11.2 і делеція 17p11.2 асоціюються з помірною вентрикуломегалією (P<0.05).
Висновок
Під час клінічних консультацій слід розглянути можливість проведення генетичного ультразвукового фенотипового тестування. Аналіз на ВЧК рекомендується проводити у плодів з ізольованою потовщеною шийною складкою, єдиною пупковою артерією, легкою вентрикуломегалією та відсутністю або гіпопластичністю носової кістки. Всебічне визначення генотип-фенотипових кореляцій при анеуплоїдії/ПВЧК може надати кращу інформацію для генетичного консультування.
Графічне резюме
Ключові слова
- Анеуплоїдія
- низькочастотне секвенування геному
- патогенні/вірогідно патогенні варіації числа копій
- пренатальна діагностика
- м’який маркер
ВСТУП
М’які маркери є поширеними ультразвуковими знахідками при пренатальному рутинному обстеженні, які виявляються щонайменше у 10% нормальних плодів 1. М’які маркери – це неспецифічні і часто транзиторні незначні анатомічні варіації, що вказують на дещо підвищений ризик анеуплоїдії плода 2, 3. Однак, з широким розповсюдженням неінвазивного пренатального скринінгу, важливість ультразвукових м’яких маркерів змінюється. Коли ризик анеуплоїдії більше не є основним питанням, яке слід розглядати для плодів з м’якими маркерами, клініцистів більше турбує асоціація м’яких маркерів з іншими хромосомними аномаліями, такими як патогенні/вірогідні патогенні варіації числа копій (ПВЧК), які асоціюються з хворобами або мають високу ймовірність викликати захворювання. Виявлення ПВЧК має велике значення для оцінки результатів вагітності та прогнозу для плодів з аномальними результатами ультразвукового дослідження, особливо щодо можливості інтелектуальної неповноцінності 4.
Попередні дослідження продемонстрували, що ПВЧК часто проявляється специфічними м’якими маркерами, такими як потовщення шийної складки (ШС) та вентрикуломегалія 5–8. Інкрементний вихід для виявлення ПВЧК у плодів з ізольованою потовщеною ШС і нормальним каріотипом становив близько 3,9-5,0% 5, 9, 10. Вихід ПВЧК у плодів з ізольованою легкою вентрикуломегалією становив 5,1% 11. Товариство медицини матері та плода (ТММП) вже рекомендувало хромосомне мікрочипування (ХМЧ) для плодів з вентрикуломегалією у 2018 році 12. Однак через відсутність масштабних досліджень (2466 плодів або менше 8) і порівнянь з плодами з нормальною ультразвуковою діагностикою зв’язок між більшістю м’яких маркерів і ПВЧК досі не з’ясований. Клініцисти все ще стоять перед дилемою, вирішуючи, чи проводити генетичне тестування плодів з різними м’якими ультразвуковими маркерами, чи ні.
Нещодавно низькочастотне секвенування геному (низькочастотне СГ) з покращеною роздільною здатністю та високою пропускною здатністю з’явилося як альтернативний генетичний тест для ХМЧ 13, 14. Його переваги включають коротший час виконання, меншу кількість ДНК, нижчу технічну частоту повторення та нижчу вартість 15. У цьому дослідженні ми всебічно проаналізували частоту виявлення анеуплоїдії та ПВЧК з 11 типами м’яких ультразвукових маркерів на основі великої когорти з 15 263 плодів, обстежених за допомогою низькочастотного ГС, щоб надати рекомендації щодо замовлення пренатального генетичного тестування для плодів з різними м’якими маркерами. Крім того, зосередившись на кожній анеуплоїдії/ПВЧК, ми порівняли ультрасонографічні характеристики плодів з контрольною групою, щоб з’ясувати зв’язок конкретних типів хромосомних аномалій з конкретними ультрасонографічними м’якими маркерами.
МАТЕРІАЛИ ТА МЕТОДИ
Відбір зразків та етичне схвалення
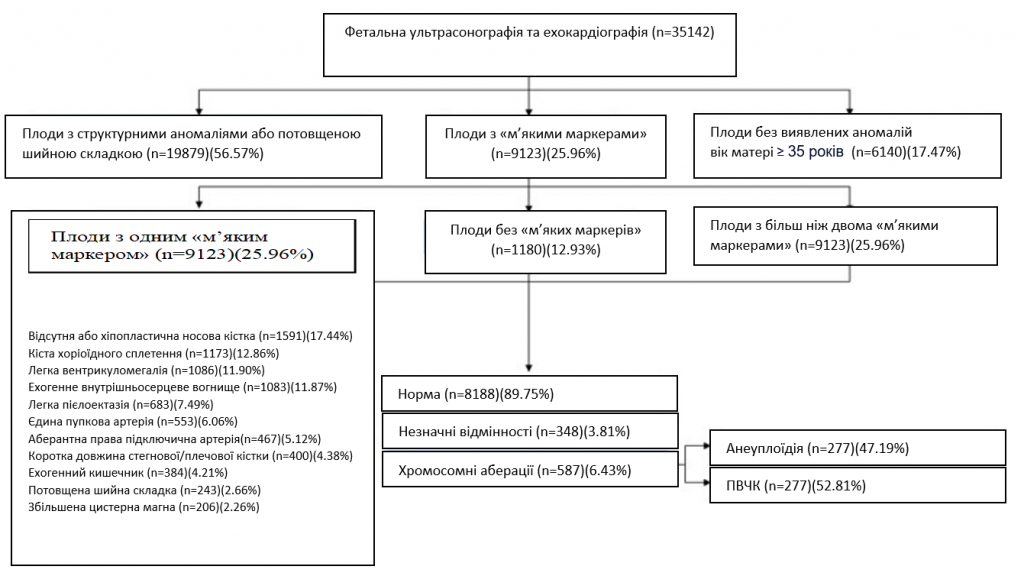
Вагітні з одноплідною вагітністю були відібрані з декількох центрів амніоцентезу або черезшкірного забору пуповинної крові в Китаї в період з січня 2016 року по жовтень 2020 року. Кожній учасниці було проведено низькочастотну ГС та ультрасонографію. Усім плодам проводили рутинне УЗД у другому триместрі. Детальне анатомічне дослідження плода в другому триместрі проводили кваліфіковані лікарі-ультрасонографи в терміні 18-27+6 тижнів відповідно до рекомендацій Міжнародного товариства ультразвукового акушерства та гінекології 16. Плоди з потовщенням шийної складки (ШС≥95-й процентиль), структурними аномаліями, затримкою росту або позитивними результатами неінвазивного пренатального скринінгу на анеуплоїдію були виключені з нашого дослідження. 9123 плодів було ідентифіковано за допомогою м’яких маркерів, включаючи кісти хоріоїдного сплетіння, відсутність або гіпопластичність носової кістки (відсутня або довжина < 2,5 мм), ехографічні ознаки, ехогенне внутрішньосерцеве вогнище, легка вентрикуломегалія (≥ 10 мм і < 15 мм), єдина пупкова артерія, легкі пієлектази (≥ 4 мм і < 10 мм), аберантна права підключична артерія, ехогенний кишечник (ехогенність кишечника плода дорівнює або перевищує ехогенність кісток плода, які оточують його), коротка довжина стегнової/плечової кістки (нижче 5-го перцентиля для гестаційного віку), потовщена шийна складка (≥ 6 мм між 18 і 24 тижнями) або збільшена цистерна магна (≥ 10 мм). Враховуючи, що частота виникнення ПВЧК не пов’язана з віком матері 17, 6140 плодів у матерів старшого віку (жінки віком ≥35 років), з нормальними результатами ультразвукового дослідження, нормальними результатами неінвазивного пренатального скринінгу, нормальними результатами біохімічного скринінгу на синдром Дауна та відсутністю в сімейному/особистому анамнезі хромосомних аномалій було визначено як контрольну групу (зобр. 1). Що стосується етнічної приналежності, 83,44% були китайськими ханьцями, решта були представниками китайських меншин. Плоди без візуалізаційних аномалій були відібрані за показаннями для інвазивного тестування, включаючи старший вік матері. Слід враховувати ризик втрати вагітності або інших пост-амніоцентезних ускладнень, в даний час ризик, пов’язаний з амніоцентезом, становить приблизно 0,1% 18. Це дослідження було схвалено Комітетом з питань етики Центру медичної генетики Центрального Південного університету, Хунань, Китай. Етичні референтні номери 2015031002 (дата схвалення: 2016.1-2019.12) та 2019-1-23 (дата схвалення: 2019.05-2024.05). Всі суб’єкти підписали письмову інформовану згоду на генетичне дослідження вагітності. У подальшому аналізі враховували лише анеуплоїдію зародкової лінії та ПВЧК.
Зображення 1 – Відбір та залучення учасників дослідження.
Низькочастотне секвенування геному
Геномну ДНК виділяли з амніотичної рідини або пуповинної крові відповідно до протоколу виробника. Для перевірки контамінації материнської ДНК під час процедури використовували напівкількісний ПЛР-аналіз на основі КТП. Зразки із забрудненням >10% були виключені з дослідження. Нарешті, 200 нг геномної ДНК було випадковим чином фрагментовано, і бібліотеки ДНК були сконструйовані за допомогою кінцевої репарації, А-хвостової та адаптерної лігації.19
Низькочастотну ГС проводили, як описано раніше 19–21, що відповідає середньому покриттю 0,06 × .Картовані зчитування розподіляли на біни розміром 20 кілобаз (кб) з розсуненням 5 кб для ідентифікації ВЧК. Профілі ВЧК кожної хромосоми були представлені як log2 середніх зчитувань секвенування кожного біна секвенування вздовж хромосоми. Будь-які два ВЧК з ≥60% взаємним перекриттям були ідентифіковані як однакові. Для пошуку референтних DGV використовували загальнодоступні геномні бази даних, що включають 1000 геномів, DGV (http://dgv.tcag.ca/dgv/app/home), OMIM (https://www.omim.org/), DECIPHER (https://decipher.sanger.ac.uk/), ClinVar (https://www.ncbi.nlm.nih.gov/clinvar/), UCSC (http://genome.ucsc.edu/) та PubMed (https://pubmed.ncbi.nlm.nih.gov/). Патогенність ідентифікованих ВЧК оцінювали відповідно до рекомендацій Американського коледжу медичної генетики (АКМГ)22.
Статистичний аналіз
Результати та графіки були виконані з використанням програмного забезпечення R (версія 4.0.2). Кількість ПВЧК у плодів з м’якими ультразвуковими маркерами порівнювали з контрольною групою. Зв’язок між ультрасонографічними м’якими маркерами та анеуплоїдією/ПВЧК визначали за допомогою точного критерію Фішера з поправкою Бонферроні. Статистично значущим вважали Р<0,05.
РЕЗУЛЬТАТИ
Демографічні дані плодів
Усього в це дослідження було включено 9123 плодів з ультрасонографічними м’якими маркерами, протестованими за допомогою низькочастотного ГС з 29 провінцій Китаю. Середній вік матері становив 29,8 років ±5,0 років, а середній термін вагітності (на момент проведення низькочастотного ГС) становив 24,4 ±3,6 тижнів. Відсутня або гіпопластична носова кістка є найпоширенішим ізольованим ультразвуковим м’яким маркером у другому триместрі (17,44%, 1 591/9 123), далі йдуть кісти хоріоїдального сплетення (12,86%, 1 173/9 123), легка вентрикуломегалія (11,90%, 1 086/9 123), ехогенне внутрішньосерцеве вогнище (11,87%, 1 083/9 123), легкі пієлоектази (7. 49%, 683/9,123), єдина пупкова артерія (6,06%, 553/9,123), аберантна права підключична артерія (5,12%, 467/9,123), коротка довжина стегнової/плечової кісток (4. 38%, 400/9 123), ехогенний кишечник (4,21%, 384/9 123), потовщена шийна складка (2,66%, 243/9 123) та збільшена цистерна магна (2,26%, 206/9 123) (Зобр. 1).
Частота хромосомних аномалій
Загалом, анеуплоїдії та ПВЧК зустрічалися у 3,04% (277/9 123) та 3,40% (310/9 123) плодів з м’якими маркерами, відповідно. Найпоширенішою анеуплоїдією була трисомія 21 (1,99%, 182/9 123), за якою слідували трисомія 18 (0,54%, 49/9 123) і синдром XXY (0,21%, 19/9 123), що становило 90,25% (250/277) всіх анеуплоїдій. Найпоширенішою ПВЧК була делеція Xp22.31 (0,26%, 24/9,123), за якою слідували делеція 15q11.2 (0,24%, 22/9,123) та делеція 16p13.11 (0,16%, 15/9,123). Частота анеуплоїдії та ПВЧК у плодів з нормальним ультразвуковим дослідженням (старший вік матері) становила 2,31% та 1,82% (табл. 1).
Таблиця 1 Результати хромосомних знахідок при секвенуванні низькочастотного геному в дослідженні.
| М’які маркери | Кількість | Анеуплоїдія | Патогенна ВЧК | Ймовірно патогенна ВЧК | Невизначене значення ВЧК | Ймовірно доброякісна ВЧК | Доброякісна ВЧК | |
| 1 | відсутні або гіпоплазія носової кістки | 1,591 (17.44%) | 83 (5.22%) | 29 (1.82%) | 18 (1.13%) | 56 (3.52%) | 43 (2.70%) | 122 (7.67%) |
| кісти хоріоїдного сплетіння | 1,173 (12.86%) | 39 (3.32%) | 14 (1.19%) | 14 (1.19%) | 46 (3.92%) | 24 (2.05%) | 72 (6.14%) | |
| легка вентрикуломегалія | 1,086 (11.90%) | 28 (2.58%) | 29 (2.67%) | 17 (1.57%) | 38 (3.50%) | 37 (3.41%) | 104 (9.58%) | |
| ехогенне внутрішньосерцеве вогнище | 1,083 (11.87%) | 22 (2.03%) | 18 (1.66%) | 9 (0.83%) | 50 (4.62%) | 24 (2.22%) | 76 (7.02%) | |
| легка пієлоектазія | 683 (7.49%) | 8 (1.17%) | 15 (2.20%) | 3 (0.44%) | 29 (4.25%) | 25 (3.66%) | 57 (8.35%) | |
| єдина пупкова артерія | 553 (6.06%) | 13 (2.35%) | 22 (3.98%) | 4 (0.72%) | 22 (3.98%) | 11 (1.99%) | 37 (6.69%) | |
| аберантна права підключична артерія | 467 (5.12%) | 5 (1.07%) | 9 (1.93%) | 9 (1.93%) | 10 (2.14%) | 17 (3.64%) | 38 (8.14%) | |
| коротка довжина стегнової/плечової кістки | 400 (4.38%) | 9 (2.25%) | 14 (3.50%) | 2 (0.50%) | 15 (3.75%) | 8 (2.00%) | 28 (7.00%) | |
| ехогенний кишечник | 384 (4.21%) | 3 (0.78%) | 9 (2.34%) | 1 (0.26%) | 16 (4.17%) | 8 (2.08%) | 33 (8.59%) | |
| потовщена шийна складка | 243 (2.66%) | 7 (2.88%) | 10 (4.12%) | 4 (1.65%) | 11 (4.53%) | 3 (1.23%) | 15 (6.17%) | |
| збільшена цистерна магна | 206 (2.26%) | 1 (0.49%) | 3 (1.46%) | 2 (0.97%) | 9 (4.37%) | 6 (2.91%) | 26 (12.62%) | |
| Загалом | 7,869 (86.25%) | 218 (2.77%) | 172 (2.19%) | 83 (1.05%) | 302 (3.84%) | 206 (2.62%) | 608 (7.73%) | |
| 2 | 1,180 (12.93%) | 55 (4.66%) | 36 (3.05%) | 13 (1.10%) | 45 (3.81%) | 27 (2.29%) | 93 (7.88%) | |
| ≥ 3 | 74 (0.81%) | 4 (5.41%) | 5 (6.76%) | 1 (1.35%) | 1 (1.35%) | 4 (5.41%) | 9 (12.16%) | |
| Всі плоди з м’якими маркерами | 9,123 (100.00%) | 277 (3.04%) | 213 (2.33%) | 97 (1.06%) | 348 (3.81%) | 237 (2.60%) | 710 (7.78%) | |
| Плоди без ідентифікованих аномалій та вік матері ≥ 35 років | 6,140 | 142 (2.31%) | 69 (1.12%) | 43 (0.70%) | 221 (3.60%) | 127 (2.07%) | 374 (6.09%) | |
М’які маркери були розділені на три групи: 1 (плоди з одним м’яким маркером), 2 (плоди з двома м’якими маркерами) і ≥ 3 (плоди з більш ніж двома м’якими маркерами). Для групи 1 м’які маркери були додатково розділені на 11 ізольованих м’яких маркерів. ВЧК: варіації числа копій. Патогенність ВЧК оцінювали на основі рекомендацій Американського коледжу медичної генетики (АКМГ)22.
Частота анеуплоїдії за різними типами м’яких маркерів
Серед усіх ізольованих м’яких маркерів відсутність або гіпоплазія носової кістки мала найвищий показник анеуплоїдії (5,22%, 83/1 591), за нею йшли кісти хоріоїдного сплетіння (3,32%, 39/1 173) та потовщена шийна складка (2,88%, 7/243). У плодів з ізольованою відсутньою або гіпопластичною носовою кісткою було виявлено 83 анеуплоїдії, з яких 72 були трисомією 21. Ми спостерігали, що частота виявлення анеуплоїдій зростала зі збільшенням кількості м’яких маркерів. При наявності у плодів двох м’яких ультразвукових маркерів частота анеуплоїдії зросла з 2,77% (218/7,869) до 4,66% (55/1,180). Зокрема, частота анеуплоїдій у плодів з кістами хоріоїдного сплетіння і єдиною пуповинною артерією досягала 26,47% (9/34), і всі ці анеуплоїдії були трисомією за 18-ю хромосомою. У плодів з трьома і більше м’якими маркерами частота анеуплоїдії досягала 5,41% (4/74) (Таблиця 2).
Таблиця 2 Частота ПВЧК при низькочастотному секвенуванні у плодів з м’якими маркерами.
| М’які маркери | Кількість | ПВЧК | P | ВШ(95% ДІ) | |
| 1 | відсутні або гіпопластична носова кістка | 1,591 (17.44%) | 47 (2.95%) | 0.04 | 1.69 [1.17, 2.41] |
| кісти хоріоїдного сплетіння | 1,173 (12.86%) | 28 (2.39%) | 1.00 | 1.33 [0.84, 2.04] | |
| легка вентрикуломегалія | 1,086 (11.90%) | 46 (4.24%) | < 0.0001 | 2.39 [1.65, 3.42] | |
| ехогенне внутрішньосерцеве вогнище | 1,083 (11.87%) | 27 (2.49%) | 1.00 | 1.37 [0.86, 2.12] | |
| легка пієлоектазія | 683 (7.49%) | 18 (2.64%) | 1.00 | 1.44 [0.82, 2.40] | |
| єдина пупкова артерія | 553 (6.06%) | 26 (4.70%) | 0.0006 | 2.66 [1.65, 4.15] | |
| аберантна права підключична артерія | 467 (5.12%) | 18 (3.85%) | 0.061 | 2.13 [1.21, 3.56] | |
| коротка довжина стегнової/плечової кістки | 400 (4.38%) | 16 (4.00%) | 0.082 | 2.24 [1.23, 3.85] | |
| ехогенний кишечник | 384 (4.21%) | 10 (2.60%) | 1.00 | 1.42 [0.66, 2.73] | |
| потовщена шийна складка | 243 (2.66%) | 14 (5.76%) | 0.0029 | 3.31 [1.73, 5.91] | |
| збільшена цистерна магна | 206 (2.26%) | 5 (2.43%) | 1.00 | 1.31 [0.41, 3.21] | |
| Загалом | 7,869 (86.25%) | 255 (3.24%) | < 0.0001 | 1.81 [1.44, 2.29] | |
| 2 | 1,180 (12.93%) | 49 (4.15%) | < 0.0001 | 2.39 [1.66, 3.40] | |
| ≥ 3 | 74 (0.81%) | 6 (8.11%) | 0.0023 | 4.92 [1.71, 11.65] | |
| Всі плоди з м’якими маркерами | 9,123 (100.00%) | 310 (3.40%) | < 0.0001 | 1.91 [1.53, 2.40] | |
| Плоди без ідентифікованих аномалій та вік матері ≥ 35 років | 6,140 | 112 (1.82%) | 1.00 | 1 [0.76, 1.31] | |
М’які маркери були розділені на три групи: 1 (плоди з одним м’яким маркером), 2 (плоди з двома м’якими маркерами) і ≥ 3 (плоди з більш ніж двома м’якими маркерами). Для групи 1 м’які маркери були додатково розділені на 11 ізольованих м’яких маркерів. Частоту ПВЧК у кожній групі порівнювали з показниками плодів без ідентифікованих аномалій та віком матері ≥ 35 років за допомогою точного критерію Фішера з поправкою Бонферроні. Жирним шрифтом виділено статистично значущі відмінності на рівні P < 0,05. ПВЧК: патогенні/вірогідно патогенні варіації числа копій. ВШ: відношення шансів; ДІ: довірчий інтервал.
Частота ПВЧК при різних типах м’яких маркерів та порівняння з контрольною групою
Вихід ПВЧК серед різних ізольованих м’яких маркерів коливався від 2,39% до 5,76%, з яких чотири типи м’яких маркерів були вищими, ніж у контрольній групі (P<0,05, ВШ =1,69-3,31), включаючи потовщену шийну складку, єдину пуповинну артерію, легку вентрикуломегалію та відсутність або гіпопластичність носової кістки. Потовщена шийна складка давала найвищий показник ПВЧК – 5,76% (P=0,0029, ВШ=3,31, 95% ДІ [1,73, 5,91]), за нею слідувала єдина пупкова артерія (4,70%, P=0,0006, ВШ=2,66, 95% ДІ [1. 65, 4.15]), легка вентрикуломегалія (4.24%, P<0.0001, ВШ =2.39, 95% ДІ [1.65, 3.42]) та відсутність або гіпоплазія кісток носа (2.95%, P=0.04, ВШ=1.69, 95% ДІ [1.17, 2.41]) (Таблиця 2). У той час як за іншими сімома м’якими маркерами достовірної різниці не спостерігалося (P>0,05, ВШ=1,31-2,24). Подібно до анеуплоїдії, частота ПВЧК збільшувалася зі збільшенням кількості м’яких маркерів. Коли плоди мали два м’яких маркера, частота ПВЧК зросла з 3,24% (255/7,869) до 4,15% (49/1,180). Частота ПВЧК у плодів з однією пуповинною артерією і потовщеною шийною складкою була вища ніж у контрольній групі (37,50%, P=0,019, ВШ=31,43, 95% ДІ [4,82, 163,9]). У плодів з трьома і більше аномаліями частота ПВЧК становила до 8,11% (6/74) (Таблиця 2).
Кореляція між анеуплоїдією/ПВЧК та ультрасонографічними м’якими маркерами
Як і очікувалося, відсутність або гіпопластичність носової кістки та потовщена шийна складка асоціювалися з трисомією 21. Крім того, потовщена шийна складка також асоціювалася з синдромом 45,Х. Кісти хоріоїдного сплетіння та єдина пупкова артерія були асоційовані з трисомією 18. Синдроми 47,XXY та 47,XYY не показали значущої асоціації з жодним з м’яких маркерів.
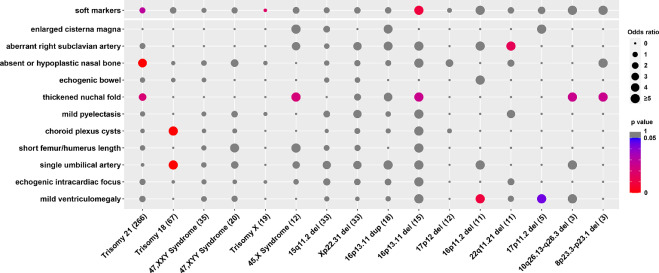
Три типи м’яких маркерів були пов’язані з певними ПВЧК. Аберантна права підключична артерія асоціювалася з делецією 22q11.2, про що повідомлялося в кількох дослідженнях 8. Водночас ми спостерігали, що делеція 16p11.2 та 17p11.2 асоціюється з легкою вентрикуломегалією 23–25. Крім того, ми виявили, що делеція 16p13.11, делеція 10q26.13-q26.3 і делеція 8p23.3-p23.1 асоціюються з потовщенням шийної складки, про що вперше було повідомлено в нашому дослідженні (Зобр. 2).
Зображення 2 – Асоціативний аналіз між анеуплоїдією/ПВЧК та ультрасонографічними м’якими маркерами.
Поширеність кожної анеуплоїдії/ПВЧК у групі м’яких маркерів та контрольній групі порівнювали за допомогою точного критерію Фішера з поправкою Бонферроні. Значення в дужках вказують на кількість зразків з анеуплоїдією/ПВЧК. Розмір кола відображає значення відношення шансів. Різними кольорами позначено P-значення. Сірим кольором позначено P-value≥0.05. Статистично значущим було значення P<0,05. Показані всі анеуплоїдії та ПВЧК з п’ятьма найбільшими розмірами вибірок або значущим зв’язком.
ОБГОВОРЕННЯ
Основні результати
Загалом, анеуплоїдія та ПВЧК зустрічалися у 3,04% та 3,40% плодів з м’якими маркерами у другому триместрі відповідно. Частота анеуплоїдії та ПВЧК зростала зі збільшенням кількості м’яких маркерів. Діагноз анеуплоїдії та ПВЧК встановлювався приблизно в 2 і 2,5 рази частіше у плодів з трьома і більше м’якими маркерами, ніж у плодів з ізольованими м’якими маркерами, відповідно (5,41% проти 2,77%), (8,11% проти 3,24%). Частота ПВЧК серед різних ізольованих м’яких маркерів коливався від 2,39% до 5,76%, з яких чотири типи м’яких маркерів були значнішими, ніж у контрольній групі. Крім того, чотири типи м’яких маркерів були асоційовані з певною анеуплоїдією, тоді як три типи м’яких маркерів були асоційовані з певними ПВЧК.
Результати в контексті та клінічні наслідки
Частота виявлення анеуплоїдії та ПВЧК відповідала частоті 2,88%-2,93% 26, 27 та 2,58%-3,29% 8, 26, про яку повідомлялося в попередніх дослідженнях ХМЧ. М’які маркери – це незначні ультразвукові ознаки, виявлені у другому триместрі, пов’язані з підвищеним ризиком анеуплоїдії. Як відомо, відсутність або гіпоплазія носової кістки та потовщена шийна складка були чутливими м’якими маркерами в середньому триместрі для скринінгу плодів на трисомію 21 28–30, тоді як кісти хоріоїдного сплетіння були пов’язані з трисомією 18 31. Наші результати додатково підтвердили ці асоціації. Зокрема, у 26,47% (95% ДІ [14,60%, 43,12%]) плодів з кістами хоріоїдного сплетіння в поєднанні з єдиною пупковою артерією була діагностована трисомія 18, тому клініцисти повинні бути уважними до можливості трисомії 18 у плодів з обома цими м’якими маркерами. Цікаво, що ми виявили, що частота виявлення анеуплоїдії у плодів з ізольованим ехогенним кишечником і збільшеною цистерною магною була надзвичайно низькою (<1,0%), що вказує на те, що анеуплоїдія може не бути основною генетичною причиною цих двох м’яких маркерів.
Ми пропонуємо проводити аналіз ВЧК для чотирьох ізольованих м’яких маркерів, включаючи потовщену носову складку, єдину пуповинну артерію, легку вентрикуломегалію та відсутність або гіпопластичність носової кістки. Хоча ТММП рекомендувало, що каріотипування або аналіз ВЧК для плодів з потовщеною шийною складкою та відсутньою або гіпопластичною носовою кісткою має ґрунтуватися на клінічних умовах та побажаннях пацієнтів 32, 33, наші результати показали, що варто проводити аналіз ВЧК , оскільки плоди з потовщеною шийною складкою та відсутньою або гіпопластичною носовою кісткою мали вищий вихід ПВЧК, ніж у контрольній групі. Цікаво, що ми виявили, що єдина пупкова артерія асоціюється з ПВЧК, на відміну від попереднього дослідження 126 плодів 8. Цю різницю можна пояснити розміром вибірки, і, звичайно, у нас є підстави вважати, що наше дослідження, засноване на найбільшій на сьогоднішній день вибірці, може надати точні дані для передтестового консультування. Крім того, ТММП рекомендує проводити ХМЧ плодам з ізольованою вентрикуломегалією у другому триместрі, і наші результати додатково підтверджують цю рекомендацію 12.
Однак ми не змогли відтворити попередні асоціації між аберантною правою підключичною артерією та короткою довжиною стегнової/плечової кістки і ПВЧК 8. Повідомлялося, що вихід ПВЧК у плодів з аберантною правою підключичною артерією та короткою довжиною стегнової/плечової кістки становив 5,26% та 5,19% відповідно. Однак вихід ПВЧК за цими двома м’якими маркерами в наших когортах був дещо вищим (але не статистично значущим) порівняно з контрольною групою. Враховуючи ці розбіжності в результатах, ми рекомендуємо ретельно підходити до прийняття пренатальних рішень щодо плодів з цими двома м’якими маркерами. Оскільки вихід ПВЧК у плодів з кістами хоріоїдального сплетення, ехогенним внутрішньосерцевим вогнищем, легким пієлектазом, ехогенним кишечником і збільшеною цистерною магною в нашому дослідженні достовірно не відрізнявся від контрольної групи, пренатальне ведення плодів з цими ізольованими м’якими маркерами можна віднести до вагітності зі зрілим материнським віком.
Раніше описані фенотипи у плодів з ПВЧК здебільшого були зосереджені на структурних аномаліях. Ми виявили, що деякі м’які маркери зустрічаються частіше при певних ПВЧК. Хоча зв’язок між аберантною правою підключичною артерією та делецією 22q11.2 був суперечливим, Sagi-Dain та співавт. не виявили жодного випадку делеції 22q11.2 у 246 ізольованих аберантних правих підключичних артерій 34, тоді як Hu та співавт. повідомили про три делеції 22q11.2 у 133 плодів з аберантною правою підключичною артерією 8. У нашому дослідженні було виявлено три випадки делеції 22q11.2 у 467 плодів з ізольованою аберантною правою підключичною артерією. Більше того, ми виявили зв’язок між аберантною правою підключичною артерією та делецією 22q11.2 порівняно з контрольною групою. Наше дослідження виявило, що легка вентрикуломегалія асоціюється з делецією 16p11.2, яка була описана лише у двох випадках 25, 35. Поширеним антенатальним фенотипом делеції 16p11.2, про який повідомлялося в попередніх дослідженнях, були деформації хребта 25, 36. Помірна вентрикуломегалія є найпоширенішою знахідкою головного мозку у пацієнтів з делецією 17p11.237, наше дослідження додатково підтвердило цю асоціацію у плодів. Крім того, ми вперше повідомили, що делеція 16p13.11, делеція 10q26.13-q26.3 та делеція 8p23.3-p23.1 асоціюються з потовщеною потиличною складкою, що ще більше розширює фенотиповий спектр цих ПВЧК.
Сильні сторони та обмеження
Наше дослідження провело один з найбільших аналізів зв’язку між анеуплоїдією/ПВЧК та ультрасонографічними м’якими маркерами. Однак наше дослідження мало певні обмеження. Відсутні дані подальшого ультразвукового спостереження та постнатальних результатів, що могло б переоцінити внесок хромосомних аномалій у плодів з нормальною ультразвуковою діагностикою. Оскільки деякі аномалії можуть бути пропущені під час ультразвукового дослідження або проявитися пізніше. Крім того, це дослідження розглядало лише варіації на хромосомному рівні, і неясно, чи додаткові генетичні варіації, не виявлені низькочастотним ГС, впливають на фенотипічний спектр. Ми очікуємо, що майбутні дослідження зможуть поєднати секвенування всього екзома для покращення ідентифікації генетичних порушень у плодів з результатами ультразвукового дослідження 38–40. Незалежно від розміру вибірки, наші результати повинні бути відтворені, перш ніж вони будуть використані в консультуванні або на практиці.
Висновки
Наші результати можуть слугувати надійною основою для проведення відповідного генетичного тестування плодів з різними м’якими маркерами. Ми пропонуємо проводити аналіз на ВЧК у плодів зі специфічними ультразвуковими м’якими маркерами, такими як потовщена шийна складка, єдина пупкова артерія, легка вентрикуломегалія та відсутність або гіпоплазія носової кістки. Водночас, наше дослідження всебічно визначило генотип-фенотипову кореляцію анеуплоїдії/ПВЧК, щоб надати кращу інформацію для генетичного консультування. Крім того, ми очікуємо, що ці великі дані можуть бути використані для побудови моделі прогнозування на основі машинного навчання для прийняття рішень щодо генетичного тестування в майбутньому.
Посилання на джерела
- Dashe JS. Aneuploidy Screening in Pregnancy. Obstet Gynecol. Jul 2016;128(1):181-194.
- Reddy UM, Abuhamad AZ, Levine D, Saade GR, Fetal Imaging Workshop Invited P. Fetal imaging: Executive summary of a Joint Eunice Kennedy Shriver National Institute of Child Health and Human Development, Society for Maternal-Fetal Medicine, American Institute of Ultrasound in Medicine, American College of Obstetricians and Gynecologists, American College of Radiology, Society for Pediatric Radiology, and Society of Radiologists in Ultrasound Fetal Imaging Workshop. Am J Obstet Gynecol. May 2014;210(5):387-397.
- Getz L, Kirkengen AL. Ultrasound screening in pregnancy: advancing technology, soft markers for fetal chromosomal aberrations, and unacknowledged ethical dilemmas. Soc Sci Med. May 2003;56(10):2045-2057.
- Cooper GM, Coe BP, Girirajan S, et al. A copy number variation morbidity map of developmental delay. Nat Genet. Aug 14 2011;43(9):838-846.
- Grande M, Jansen FA, Blumenfeld YJ, et al. Genomic microarray in fetuses with increased nuchal translucency and normal karyotype: a systematic review and meta-analysis. Ultrasound Obstet Gynecol. Dec 2015;46(6):650-658.
- Egloff M, Herve B, Quibel T, et al. Diagnostic yield of chromosomal microarray analysis in fetuses with isolated increased nuchal translucency: a French multicenter study. Ultrasound Obstet Gynecol. Dec 2018;52(6):715-721.
- Chang Q, Yang Y, Peng Y, et al. Prenatal detection of chromosomal abnormalities and copy number variants in fetuses with ventriculomegaly. Eur J Paediatr Neurol. Mar 2020;25:106-112.
- Hu T, Tian T, Zhang Z, et al. Prenatal chromosomal microarray analysis in 2466 fetuses with ultrasonographic soft markers: a prospective cohort study. Am J Obstet Gynecol. May 2021;224(5):516 e511-516 e516.
- Maya I, Yacobson S, Kahana S, et al. Cut-off value of nuchal translucency as indication for chromosomal microarray analysis. Ultrasound Obstet Gynecol. Sep 2017;50(3):332-335.
- Sagi-Dain L, Singer A, Ben Shachar S, et al. Risk of Clinically Significant Chromosomal Microarray Analysis Findings in Fetuses With Nuchal Translucency From 3.0 mm Through 3.4 mm. Obstet Gynecol. Jan 1 2021;137(1):126-131.
- Shaffer LG, Rosenfeld JA, Dabell MP, et al. Detection rates of clinically significant genomic alterations by microarray analysis for specific anomalies detected by ultrasound. Prenat Diagn. Oct 2012;32(10):986-995.
- Society for Maternal-Fetal M, Electronic address pso, Fox NS, et al. Mild fetal ventriculomegaly: diagnosis, evaluation, and management. Am J Obstet Gynecol. Jul 2018;219(1):B2-B9.
- Wang H, Dong Z, Zhang R, et al. Low-pass genome sequencing versus chromosomal microarray analysis: implementation in prenatal diagnosis. Genet Med. Mar 2020;22(3):500-510.
- Martin AR, Atkinson EG, Chapman SB, et al. Low-coverage sequencing cost-effectively detects known and novel variation in underrepresented populations. Am J Hum Genet. Apr 1 2021;108(4):656-668.
- Dong Z, Zhang J, Hu P, et al. Low-pass whole-genome sequencing in clinical cytogenetics: a validated approach. Genet Med. Sep 2016;18(9):940-948.
- Salomon LJ, Alfirevic Z, Berghella V, et al. Practice guidelines for performance of the routine mid-trimester fetal ultrasound scan. Ultrasound Obstet Gynecol. Jan 2011;37(1):116-126.
- Grati FR, Molina Gomes D, Ferreira JC, et al. Prevalence of recurrent pathogenic microdeletions and microduplications in over 9500 pregnancies. Prenat Diagn. Aug 2015;35(8):801-809.
- Wulff CB, Gerds TA, Rode L, et al. Risk of fetal loss associated with invasive testing following combined first-trimester screening for Down syndrome: a national cohort of 147,987 singleton pregnancies. Ultrasound Obstet Gynecol. Jan 2016;47(1):38-44.
- Zhou X, Chen X, Jiang Y, et al. A Rapid PCR-Free Next-Generation Sequencing Method for the Detection of Copy Number Variations in Prenatal Samples. Life (Basel). Jan 28 2021;11(2).
- Wang J, Chen L, Zhou C, et al. Prospective chromosome analysis of 3429 amniocentesis samples in China using copy number variation sequencing. Am J Obstet Gynecol. Sep 2018;219(3):287 e281-287 e218.
- Liang D, Peng Y, Lv W, et al. Copy number variation sequencing for comprehensive diagnosis of chromosome disease syndromes. J Mol Diagn. Sep 2014;16(5):519-526.
- Riggs ER, Andersen EF, Cherry AM, et al. Technical standards for the interpretation and reporting of constitutional copy-number variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics (ACMG) and the Clinical Genome Resource (ClinGen). Genet Med. Feb 2020;22(2):245-257.
- Lei TY, Li R, Fu F, et al. Prenatal diagnosis of Smith-Magenis syndrome in two fetuses with increased nuchal translucency, mild lateral ventriculomegaly, and congenital heart defects. Taiwan J Obstet Gynecol. Dec 2016;55(6):886-890.
- Zhang P, Sun Y, Tian H, et al. Prenatal diagnosis and neonatal phenotype of a de novo microdeletion of 17p11.2p12 associated with Smith-Magenis syndrome and external genital defects. J Genet. 2020;99.
- Liu N, Li H, Li M, Gao Y, Yan H. Prenatally diagnosed 16p11.2 copy number variations by SNP Array: A retrospective case series. Clin Chim Acta. Jan 1 2023;538:15-21.
- Cai M, Lin N, Chen X, et al. Evaluation of chromosomal abnormalities and copy number variations in fetuses with ultrasonic soft markers. BMC Med Genomics. Jan 12 2021;14(1):19.
- Sagi-Dain L, Cohen Vig L, Kahana S, et al. Chromosomal microarray vs. NIPS: analysis of 5541 low-risk pregnancies. Genet Med. Nov 2019;21(11):2462-2467.
- Agathokleous M, Chaveeva P, Poon LC, Kosinski P, Nicolaides KH. Meta-analysis of second-trimester markers for trisomy 21. Ultrasound Obstet Gynecol. Mar 2013;41(3):247-261.
- Nyberg DA, Souter VL, El-Bastawissi A, Young S, Luthhardt F, Luthy DA. Isolated sonographic markers for detection of fetal Down syndrome in the second trimester of pregnancy. J Ultrasound Med. Oct 2001;20(10):1053-1063.
- Smith-Bindman R, Hosmer W, Feldstein VA, Deeks JJ, Goldberg JD. Second-trimester ultrasound to detect fetuses with Down syndrome: a meta-analysis. JAMA. Feb 28 2001;285(8):1044-1055.
- Snijders RJ, Shawa L, Nicolaides KH. Fetal choroid plexus cysts and trisomy 18: assessment of risk based on ultrasound findings and maternal age. Prenat Diagn. Dec 1994;14(12):1119-1127.
- Society for Maternal-Fetal Medicine . Electronic address pso, Prabhu M, Kuller JA, Biggio JR. Society for Maternal-Fetal Medicine Consult Series #57: Evaluation and management of isolated soft ultrasound markers for aneuploidy in the second trimester: (Replaces Consults #10, Single umbilical artery, October 2010; #16, Isolated echogenic bowel diagnosed on second-trimester ultrasound, August 2011; #17, Evaluation and management of isolated renal pelviectasis on second-trimester ultrasound, December 2011; #25, Isolated fetal choroid plexus cysts, April 2013; #27, Isolated echogenic intracardiac focus, August 2013). Am J Obstet Gynecol. Oct 2021;225(4):B2-B15.
- Society for Maternal-Fetal M, Stone JE, Kuller JA, Norton ME, Abuhamad A. The Society for Maternal-Fetal Medicine (SMFM) Fetal Anomalies Consult Series. Am J Obstet Gynecol. Nov 2019;221(5):B2-B24.
- Sagi-Dain L, Singer A, Josefsberg S, et al. Microarray analysis has no additional value in fetal aberrant right subclavian artery: description of 268 pregnancies and systematic literature review. Ultrasound Obstet Gynecol. Jun 2019;53(6):810-815.
- Cai M, Huang H, Lin N, et al. [Prenatal ultrasonographic manifestations and genetic analysis of eight fetuses with 16p11.2 microdeletions]. Zhonghua Yi Xue Yi Chuan Xue Za Zhi. Feb 10 2022;39(2):227-230.
- Lin S, Shi S, Zhou Y, et al. Intrauterine phenotypic features associated with 16p11.2 recurrent microdeletions. Prenat Diagn. May 2018;38(6):381-389.
- Greenberg F, Lewis RA, Potocki L, et al. Multi-disciplinary clinical study of Smith-Magenis syndrome (deletion 17p11.2). Am J Med Genet. Mar 29 1996;62(3):247-254.
- Talkowski ME, Rehm HL. Introduction of genomics into prenatal diagnostics. Lancet. Feb 23 2019;393(10173):719-721.
- Lord J, McMullan DJ, Eberhardt RY, et al. Prenatal exome sequencing analysis in fetal structural anomalies detected by ultrasonography (PAGE): a cohort study. Lancet. Feb 23 2019;393(10173):747-757.
- Petrovski S, Aggarwal V, Giordano JL, et al. Whole-exome sequencing in the evaluation of fetal structural anomalies: a prospective cohort study. Lancet. Feb 23 2019;393(10173):758-767.