Резюме
ПЕРЕДУМОВИ: Контрольований параметр загасання (КПЗ) – це нещодавно розроблений ультразвуковий метод вимірювання стеатозу печінки, який часто зустрічається у пацієнтів з метаболічним синдромом (МС). Для оцінки стеатозу печінки часто використовують алгоритмічний метод – жировий індекс печінки (ЖІП). У цьому дослідженні оцінювали, як ЖІП та КПЗ співвідносяться з ранньою стадією МС та їхню здатність ідентифікувати її.
МАТЕРІАЛИ І МЕТОДИ: Загалом було обстежено 170 осіб, які проживають у громаді. Збирали демографічну інформацію, індекс маси тіла, окружність талії та артеріальний тиск. КПЗ оцінювали за допомогою апарату FibroScan. Вимірювали рівень глюкози натще, ліпідограми та γ-глутамілтрансферази. Результати КПЗ та ЖІП були розподілені на квартилі, а стадії МС були основними результатами. Відношення шансів (ВШ) результатів розраховували за допомогою логістичної регресії. Для визначення стадії МС використовували площу під кривою в аналізі експлуатаційних характеристик приймача (AUC-ROC). Наведено чутливість, специфічність та відповідні відсікання на основі ROC-аналізу.
РЕЗУЛЬТАТИ: Чим вища категорія ЖІП або КПЗ, тим нижча частка не-МС і вища частка помірного МС. Кожне одноквартильне збільшення ЖІП та КПЗ асоціювалося зі збільшенням ймовірності досягнення вищих стадій МС – ЖІП: скориговане ВШ 3,1 (2,23-4,32); КПЗ: скориговане ВШ 1,96 (1,48-2,59). У ROC-аналізі ЖІП мав вищу AUC-ROC, ніж КПЗ, у розмежуванні стадій МС, хоча результати були достовірними (P<0,001). ЖІП у виявленні стадій від легкої до важкої порівняно з не-МС показав хороші результати (AUC-ROC [95% довірчий інтервал]: 0,79 [0,72-0,87]), з високою чутливістю (0,86), але низькою специфічністю (0,62).
ВИСНОВКИ: ЖІП та КПЗ позитивно асоціюються зі стадією МС та її компонентами, що дозволяє припустити, що вони можуть бути використані як інструмент скринінгу МС у дослідженнях спільнот.
КЛЮЧОВІ СЛОВА: метаболічний синдром, жирова дистрофія печінки, громадські служби охорони здоров’я
Передумови
Метаболічний синдром (МС) – це стан, що характеризується групою факторів ризику, які підвищують ризик багатостадійного ураження органів, включаючи серцево-судинні захворювання (ССЗ), цукровий діабет та неалкогольну жирову хворобу печінки [1]. Рекомендоване ведення МС базується на 4-ступеневій системі (стадії A-D), при цьому рекомендована терапія залежить від стадії захворювання [2].
Накопичення ліпідів у гепатоцитах спричиняє стеатоз печінки, який є першою стадією неалкогольної жирової хвороби печінки (НАЖХП). НАЖХП є печінковим проявом МС, який характеризується ожирінням [3]. Це спектр захворювань, що включає різного ступеня простий стеатоз, неалкогольний стеатогепатит (НАСГ) та цироз печінки [4]. Будучи найпоширенішим хронічним захворюванням печінки, НАЖХП стає важливою проблемою охорони здоров’я в усьому світі [5]. На основі зростаючої кількості доказів НАЖХП слід розглядати як системне захворювання, яке може впливати на позапечінкові органи, включаючи метаболічні порушення, ССЗ, хронічні захворювання нирок і злоякісні новоутворення, а не як специфічне для печінки захворювання [6]. Оскільки біопсія печінки є критеріальним стандартом для діагностики НАЖХП, необхідні неінвазивні методи діагностики, які можна порівняти з гістологічними результатами біопсії. Нові неінвазивні методи оцінки стеатозу печінки включають жировий індекс печінки (ЖІП) [7] та контрольований параметр загасання (КПЗ) [8]. У загальній корейській популяції НАЖХП, визначена за допомогою ЖІП, добре корелювала зі стеатозом печінки, діагностованим за допомогою абдомінального ультразвукового дослідження [9], а КПЗ є корисним для градації НАЖХП у загальній популяції [10].
Окрім діагностичного потенціалу при НАЖХП, КПЗ та ЖІП асоціюються з діагнозом МС. Hu та співавт. повідомили, що частка людей з МС зростає з підвищенням категорії КПЗ [11]. Аналогічно, в дослідженнях з Австралії [12] і Тайваню [13] повідомляється, що КПЗ асоціюється з МС і що КПЗ є добрим предиктором діагнозу МС відповідно.
Однак лише в обмеженій кількості досліджень вивчався зв’язок ЖІП та КПЗ з моделлю стадіювання МС за Sperling [2]. Більшість досліджень визначали МС як такий, що має 3 з 5 факторів ризику, не враховуючи сучасні рекомендації щодо стадійності МС. Без надання інформації про стадію при діагностиці МС метаболічні порушення на ранніх стадіях можуть бути пропущені. У цьому дослідженні ми використали спільноту тайванців, щоб оцінити зв’язок та можливості виявлення стадій ЖІП, КПЗ та МС у загальній популяції.
Матеріали та методи
ДОСЛІДЖУВАНА ПОПУЛЯЦІЯ:
Досліджувана популяція була частиною проспективного когортного дослідження на рівні громади, яке вивчало серцево-судинні та цереброваскулярні фактори ризику у мешканців 6 сіл Шилінського району [14]. Дослідження тривало між 2005 і 2006 роками, з подальшим спостереженням протягом більше 10 років. Це дослідження було лише частково реалізовано в 1 хвилі і являє собою субдослідження цієї когорти. Критеріями включення в нього були (1) вік ≥50 років; (2) відсутність інсульту, інфаркту міокарда або раку в анамнезі; (3) відсутність інфекції гепатиту В і С; (4) відсутність пропусків у показниках окружності талії (ОТ), артеріального тиску, рівня глюкози в плазмі крові натще, глікованого гемоглобіну (HbA1C), тригліцеридів (ТГ), холестерину ліпопротеїдів високої щільності (ЛПВЩ), що були необхідні для виявлення МС; (5) відсутність пропусків у показниках аспартатамінотрансферази (АСТ), аланінамінотрансферази (АЛТ) та загального аналізу крові, які використовувалися для визначення індексу фіброзу-4 (FIB-4); та (6) заповнені анкети під час п’ятого візиту кожного учасника, який відбувся в період з 2017 по 2019 рік [15].
Учасників, які відповідали критеріям, запросили на обстеження FibroScan. Загалом 178 учасників пройшли оцінювання. Однак під час очищення даних були видалені відсутні та сумнівні дані, в результаті чого до остаточного аналізу було включено 170 учасників (Зобр. 1). Це дослідження було проведено відповідно до рекомендацій Гельсінської декларації і кожен учасник надав письмову інформовану згоду перед включенням до дослідження.
ДЕМОГРАФІЧНІ ТА ЛАБОРАТОРНІ ДАНІ:
Для того, щоб завершити опитування, кожен учасник був опитаний особисто професійним інтерв’юером. Були зібрані демографічні дані, включаючи вік, стать і параметри способу життя. Зразки крові натще протягом 8 годин були отримані за допомогою FibroScan, зібрані в сироватці, плазмі з ЕДТА і плазмі з фторидом натрію (для визначення глюкози), а потім зберігалися при 80°C. За допомогою фізичного обстеження оцінювали антропометричні та біохімічні показники. Антропометричні вимірювання включали зріст, вагу, індекс маси тіла (ІМТ), ОТ, систолічний артеріальний тиск (САТ) та діастолічний артеріальний тиск (ДАТ). ІМТ розраховується шляхом ділення маси тіла (кг) на ріст в квадраті (м2). Для вимірювання САТ і ДАТ ми використовували автоматичний тонометр. Артеріальний тиск кожного учасника вимірювали 2 рази, один раз сидячи і один раз після 5-хвилинної перерви. Потім ці 2 показники усереднювалися. Автоаналізатор (Beckman, Пало-Альто, Каліфорнія) використовувався для оцінки біомаркерів крові, таких як ГПН, ТГ, ЛПВЩ, холестерин ліпопротеїдів низької щільності (ХС ЛПНЩ), загальний холестерин, АСТ, АЛТ і гама-глутамілтрансфераза (ГГТ). Для вимірювання глюкози використовували глюкозооксидазний метод, а для вимірювання HbA1C – метод високоефективної рідинної хроматографії. Підраховували кількість тромбоцитів на мікролітр крові.
ЖІП, КПЗ, УЗД ТА FIB-4:
ЖІП розраховували за формулою Bedogni та співавт., яка включає 4 змінні (ІМТ, ОТ, сироватковий ТГ та сироваткова ГГТ). Ризик жирової дистрофії печінки низький при ЖІП <30, невизначений при ЖІП 30-60 і високий при ЖІП ≥60 [7]. Вимірювання КПЗ проводилося за допомогою апарату FibroScan досвідченим гепатологом. Принцип КПЗ був описаний раніше [16]. Таким чином, КПЗ вимірює загасання ультразвуку на частоті 3,5 МГц. Праву частку печінки учасника сканували через міжреберні проміжки в положенні лежачи на спині з максимально відведеною правою рукою.
Для подальшого аналізу КПЗ та ЖІП були розподілені на квартилі (Q). ЖІП було класифіковано на Q1: ≤7,6, Q2: 7,7-15,1, Q3: 15,2-30 та Q4: >30, тоді як КПЗ класифікували на Q1: ≤231 дБ/м, Q2: 232-277 дБ/м, Q3: 278-306 дБ/м та Q4: >306 дБ/м. Ці класифікації порівнювали з клінічно використовуваними класифікаціями КПЗ для діагностики стеатозу, які були розроблені на основі відсоткового вмісту жиру в гепатоцитах [17]. Категорії: S0: ≤10% (≤215 дБ/м), S1: 11-33% (>215 дБ/м), S2: 34-66% (>252 дБ/м) і S3 ≥67% (>296 дБ/м) [18].
Ультразвукове дослідження виконували 3 гепатологи нашого відділення на апараті Xario SSA-660A (TOSHIBA, Японія). Для визначення ступеня вираженості стеатозу печінки використовували заздалегідь визначені критерії. Вони включали підвищений гепаторенальний контраст або наявність яскравих ехосигналів для стеатозу 1 ступеня (S1) (легкий стеатоз); наявність як підвищеного гепаторенального контрасту, так і яскравих ехосигналів, а також розмиття судин для стеатозу 2 ступеня (S2) (помірний стеатоз); і наявність ослаблення заднього променя і невізуалізації діафрагми, на додаток до критеріїв для S2, для стеатозу 3 ступеня (S3) (важкий стеатоз). Зображення печінки оцінювали як нормальне, якщо текстура була гомогенною, спостерігалися дрібнодисперсні ехосигнали, зона збільшення була ізоехогенною порівняно з корою нирок, а печінкові судини і діафрагма були адекватно візуалізовані [стеатоз 0 ступеня (S0)][19].
Індекс FIB-4 – це тест, який використовується для оцінки фіброзу при захворюваннях печінки і розраховується з використанням декількох параметрів, таких як вік, АСТ, АЛТ і кількість тромбоцитів [20,21].
СТАДІЇ МЕТАБОЛІЧНОГО СИНДРОМУ:
МС визначався з використанням 5 стандартних факторів ризику: (1) підвищений ОТ (≥90 см для азіатських чоловіків або ≥80 см для азіатських жінок), (2) підвищений рівень ТГ (≥150 мг/дл або медикаментозне лікування ТГ), (3) знижений рівень ЛПВЩ (≤40 мг/дл для чоловіків або ≤50 мг/дл для жінок або медикаментозне лікування зниження ЛПВЩ), (4) підвищений систолічний/діастолічний АТ (≥130/85 мм рт.ст. або лікування гіпертензії) та (5) підвищений рівень ГПН (≥100 мг/дл або лікування підвищеного рівня глюкози) [1].
Стадії МС, розроблені в цьому дослідженні, базуються на стадіях, розроблених під час засідання Кардіометаболічного аналітичного центру в 2014 році [2], який визнає, що МС є патофізіологічним станом, який включає фактори ризику, що піддаються і не піддаються вимірюванню в клініці, і що існує кілька підтипів МС, які призводять до різних типів ураження кінцевих органів. Стадія А визначається як відсутність жодного з 5 факторів ризику МС (не МС); стадія В – наявність 1-2 з 5 факторів ризику (легкий МС); стадія С – наявність 3 з 5 факторів ризику, але без ураження кінцевих органів (помірний МС); стадія D – наявність ураження кінцевих органів (наприклад, ССЗ, діабет, НАЖХП) (важкий МС). У цьому дослідженні учасники з діабетом (ГПН ≥126 мг/дл або HbA1C ≥6,5%) або жировою хворобою печінки (ЖХП ≥60) вважалися такими, що мають ураження кінцевих органів. Вибране значення ЖІП для жирової хвороби печінки ґрунтувалося на попередній публікації [5].
СТАТИСТИЧНІ АНАЛІЗИ:
Статистичний аналіз проводився за допомогою програми STATA (версія 14). Характеристики учасників представлені у вигляді пропорцій на основі їхніх метаболічних станів здоров’я. Для безперервних змінних використовували t-критерій або критерій рангової суми Вілкоксона для перевірки відмінностей у вихідних та подальших характеристиках між групами. Для дихотомічних (категоріальних) змінних використовували критерій хі-квадрат або точний критерій Фішера.
Було проведено впорядкований логістичний регресійний аналіз з використанням найнижчого квартилю ЖІП та КПЗ для розрахунку відношення шансів (ВШ) та 95% довірчого інтервалу (95% ДІ) результатів. Спочатку були розраховані грубі ВШ. Потім модель була скоригована на стать (категоріальна) і вік (безперервна) (модель 1). Індекс FIB-4 (безперервний) був використаний для отримання моделі 2. Також був проведений тест Бранта на припущення про пропорційні шанси, щоб визначити, чи доцільно використовувати впорядкований логістичний регресійний аналіз [22].
Для розрахунку площі під кривою робочої характеристики приймача (AU-ROC) в логістичній моделі було проведено ROC-аналіз. Ми розробили 2 умови як результат: (1) наявність МС (стадія B або C або D) у порівнянні з відсутністю МС (стадія A) і (2) помірно-тяжкий МС (стадія C або D) у порівнянні з легким або відсутністю МС (стадія A або B). Емпіричні значення відсікання були розраховані за допомогою індексу Юдена. Чутливість і специфічність кожного результату були розраховані відповідно до його точки відсікання.
Результати
ВИВЧЕННЯ ДЕМОГРАФІЧНИХ ПОКАЗНИКІВ НАСЕЛЕННЯ ТА ХАРАКТЕРИСТИК ЗАХВОРЮВАНЬ:
Як показано в Таблиці 1, загалом до аналізу було включено 170 пацієнтів. Стратифікація учасників за статтю показала, що більшість становили жінки (60% [102/170]). Середній вік жінок і чоловіків становив 63,3 і 64,4 року (P=0,48) відповідно, що свідчить про відсутність суттєвої різниці у віці учасників за статтю. Середній показник ІМТ також суттєво не відрізнявся між жінками та чоловіками (23,8 кг/м2 проти 24,8 кг/м2; P=0,069), відповідно.
На початковому етапі 3 з 5 компонентів ІМТ вірогідно відрізнялися між статями. Жінки мали меншу ОТ (78,5 см проти 85,6 см, P<0,001), вищий рівень ЛПВЩ (56,8 мг/дл проти 50,7 мг/дл, P=0,003), нижчий АТ (САТ: 116,8 мм рт. ст. проти 125,3 мм рт. ст., P=0,004; ДАТ: 71. 6 мм рт.ст. проти 75,5 мм рт.ст., р=0,015), нижчий рівень АЛТ (16,5 проти 21,2, р=0,001) та нижчий рівень ГГТ (16,6 проти 22,3, р=0,004), що свідчить про те, що жінки були здоровішими. Всі інші маркери були подібними між статями.
Результати діагностичного тесту показали, що ЖІП був значно нижчим у жінок (17,2 проти 30,9, P<0,001). Нижчий ЖІП у жінок можна пояснити нижчими значеннями 4 змінних, на основі яких розраховується ЖІП. Не було достовірної різниці між статями для FIB-4 та КПЗ (P>0,05).
ЖІП ТА КПЗ КОРЕЛЮЮТЬ З ФАКТОРАМИ РИЗИКУ МС ТА 5 МС:
Коефіцієнт кореляції КПЗ та ЖІП становив 0,504 (P<0,000). Категорії ЖІП та КПЗ учасників були визначені на основі квартилів, описаних у розділі “Методи”, і корелювали зі стадіями МС та 5 факторами ризику МС (Табл. 2). За винятком зниженого рівня ЛПВЩ, усі метаболічні фактори ризику позитивно корелювали з кожним збільшенням квартилю ЖІП. Для КПЗ і клінічно рутинного КПЗ усі метаболічні фактори ризику позитивно корелювали з кожним збільшенням квартилю КПЗ. Ці результати узгоджувалися з результатами ультразвукового дослідження (УЗД).
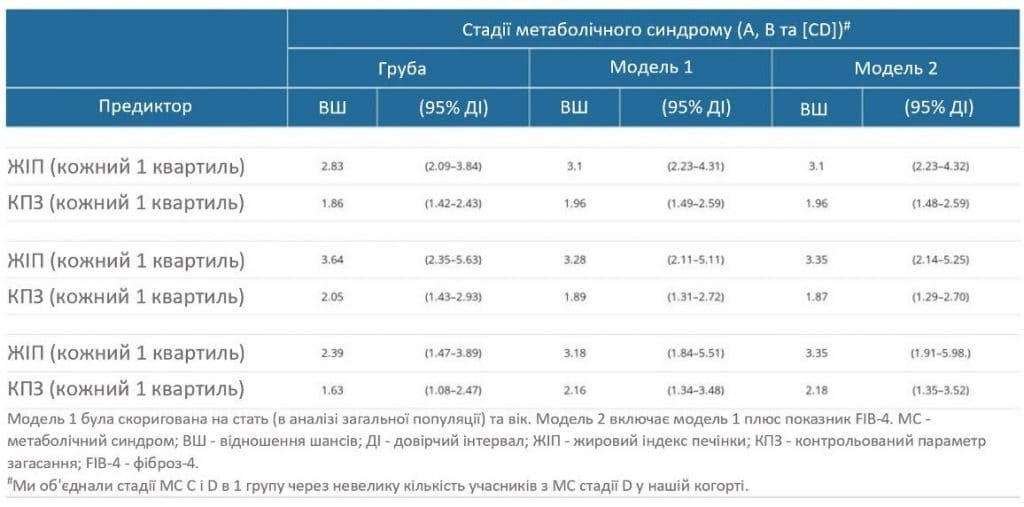
Зростання квартилю для кожного ЖІП асоціювалося з підвищеною ймовірністю опинитися на вищій стадії МС. У цьому аналізі “результатом” була або тільки стадія С (при цьому референтною категорією була комбінація стадій А і В), або комбінація стадій В і С (при цьому референтною категорією була стадія А). За допомогою впорядкованого логістичного регресійного аналізу було визначено одноквартильне збільшення ЖІП (Q1 до Q2, Q2 до Q3 або Q3 до Q4), яке показало, що ймовірність опинитися на вищій стадії МС приблизно в 3 рази вища (ВШ: 2,83, 95% ДІ: 2,09-3,84) (Табл. 3). Після коригування коваріатів зв’язок між ЖІП та стадією МС зберігався в моделі 1 зі скоригованим ВШ (СВШ) 3,1 (95% ДІ: 2,23-4,31) та моделі 2 зі СВШ 3,1 (95% ДІ: 2,23-4,32) (Табл. 3). Аналогічно, було виявлено значний зв’язок між КПЗ і стадіями МС. Збільшення КПЗ на один квартиль збільшувало ймовірність перебування на вищій стадії МС в 1,86 раза (грубе ВШ: 1,86, 95% ДІ: 1,42-2,43), що також зберігалося після коригування коваріатів у Моделі 1 (СВШ: 1,96; 95% ДІ: 1,49-2,59) і Моделі 2 (СВШ: 1,96, 95% ДІ: 1,48-2,59).
В аналізі, стратифікованому за статтю, вищі ЖІП та КПЗ також асоціювалися з вищою стадією МС, що узгоджується з результатами аналізу загальної популяції (Табл. 3). Навіть після контролю за коваріантами зв’язок ЖІП та КПЗ з вищою стадією МС залишався значущим.
ЕФЕКТИВНІСТЬ МОДЕЛЕЙ ЖІП ТА КПЗ ЩОДО ВИЗНАЧЕННЯ СТАДІЙ МС:
Для оцінки ефективності моделей було проведено аналіз AU-ROC. ЖІП має вищу AUC-ROC, ніж КПЗ, незважаючи на схожі характеристики (Зобр. 2). Це вказує на те, що ЖІП є більш точним у прогнозуванні стадій МС, ніж КПЗ. ЖІП в результаті 1 (МС від легкого до важкого ступеня проти не-МС) мав AU-ROC 0,79 (95% ДІ: 0,72-0,87), з високою чутливістю (0,86), але низькою специфічністю (0,62). ЖІП для результату 2 (помірний та тяжкий МС порівняно з легким та без МС) мав аналогічний показник AU-ROC 0,80 (95% ДІ: 0,71-0,87), з низькою чутливістю (0,62), але високою специфічністю (0,87). Емпіричні точки відсікання становили 7,95 та 28,49 відповідно. Незважаючи на нижчу AU-ROC, КПЗ мав високу специфічність (0,84) з точкою відсікання 305, коли ми проводили скринінг нашої досліджуваної популяції на ризиковані стадії МС (стадії C або D).
Обговорення
У цьому перехресному дослідженні дорослих тайванців спостерігали значні кореляції між стадіями МС і КПЗ, а також між стадіями МС і ЖІП. Ці асоціації не залежали від віку, статі та показника FIB-4. Отримані дані свідчать про те, що як ЖІП, так і КПЗ є корисними для визначення стадії МС у дорослих тайванців. Крім того, ми представили емпіричну оптимальну точку відсікання ЖІП і КПЗ для діагностики МС.
Зі збільшенням поширеності МС навіть серед осіб з нормальною вагою зростає потреба у ранньому втручанні [23,24]. Було розроблено кілька інструментів прогнозування МС для негайного скринінгу або прогнозування майбутніх ризиків, але інструментів для прогнозування стадії МС недостатньо [25]. Згідно з нашими поточними даними, AU-ROC КПЗ і ЖІП у прогнозуванні стадії МС становить 0,66-0,80, що означає, що вони можуть відігравати певну роль у ранньому виявленні МС і попереджати клініцистів про необхідність втручання у таких пацієнтів з високим ризиком.
Відомо, що ЖІП асоціюється зі смертністю, пов’язаною з ураженням печінки, а її зв’язок із смертністю від усіх причин, ССЗ та раку, як припускають, залежить від інсулінорезистентності [26]. Оскільки інсулінорезистентність тісно пов’язана з МС [27], ймовірно, що значна кореляція між стадіями ЖІП та МС, яка спостерігається в нашому дослідженні, зумовлена основним зв’язком ЖІП та МС з інсулінорезистентністю. Метааналіз показав, що кореляція між КПЗ і гістологічно визначеним стеатозом є сильною [28], а КПЗ корелює з МС [11]. Результати оцінки КПЗ позитивно корелюють з кількістю компонентів МС та поширеністю МС у пацієнтів з хронічними захворюваннями печінки [10]. Крім того, значення КПЗ можуть бути корисними для моніторингу прогресування МС. Ці висновки узгоджуються з кореляціями КПЗ та МС у нашому дослідженні, де підвищені рівні ТГ, ОТ та ГПН були вищими в учасників з вищими квартилями КПЗ. Однак кореляція між КПЗ і стадією МС була слабшою, ніж кореляція між ЖІП і стадією МС у нашому дослідженні. ЖІП містить ОТ і ТГ, які є компонентами МС, а також ІМТ і ГГТ, які є незалежними факторами ризику МС. Крім того, визначення стадії МС у нашому дослідженні включало ЖІП (стадія D МС: ЖІП ≥60). Отже, сильніший кореляційний зв’язок між ЖІП та стадією МС не є несподіваним.
КПЗ краще відрізняє S0 від аномальних станів (а не діагностує стеатоз) і дозволяє проводити моніторинг, якщо пацієнт потребує подальших обстежень [29]. КПЗ оцінює жирову дистрофію печінки за допомогою FibroScan, але це трудомістка робота, яка вимагає добре підготовленого лікаря. Тому її застосування в епідеміологічних дослідженнях може бути обмеженим. ЖІП є відносно дешевим і базується на більш традиційних, широкодоступних компонентах, але ЖІП вимагає забору крові, тоді як КПЗ не вимагає.
Оцінки КПЗ та ЖІП мають свої переваги та недоліки. У нашому дослідженні, як і в дослідженні Carvalhana [30], КПЗ має більшу чутливість і вищу корекцію, ніж ЖІП. В аналізі NHANES коефіцієнт кореляції ЖІП і КПЗ становив 0,645 [31]; він не є досконалим, що свідчить про потенційну різницю між цими двома показниками. Рішення про вибір КПЗ або ЖІП слід приймати обережно через їх унікальні наслідки. Користь від обох процедур можна максимізувати, якщо завжди пам’ятати про МС. ЖІП використовує фізикальне обстеження та аналізи крові. Аналогічно, традиційні процедури підтвердження МС залежать від аналізу крові, який є інвазивною і тривалою процедурою, що може викликати у суб’єктів спротив цим процедурам під час скринінгу в громадах. Натомість оцінка за допомогою КПЗ є неінвазивною, безпечною, швидкою (приблизно 5-10 хв для застосування), зручною, портативною, має високу відтворюваність і високу точність в оцінці стеатозу печінки. КПЗ може бути застосований для пацієнтів, які були стійкими до незручностей, пов’язаних з нічним голодуванням або болючим аналізом крові. Наші результати показують, що КПЗ має позитивний незалежний зв’язок зі стадіями МС у дорослих тайванців. Якщо під час процедури FibroScan виявлено високе значення КПЗ, гастроентеролог може знати, що, за відсутності результатів аналізу крові, існує підвищена ймовірність того, що пацієнт перебуває на вищій стадії МС.
В результаті ми визначили достатню потужність на основі спостереження за ВШ (у Таблиці 3) та AUC-ROC (на Зображенні 2). Вибірка розміром 170 пацієнтів досягає 100% і 98% потужності, відповідно, для виявлення ВШ 2,83 у ЖІП і 1,86 у КПЗ за допомогою двостороннього біноміального тесту, альфа 0,05 і базової пропорції 0,282. Ця оцінка потужності базується на результатах стадій МС C і D порівняно з A і B. Потужність виявлення AUC-ROC також є відмінною. Використовуючи 2-сторонній z-тест з альфа 0,05, наші дані загалом мали потужність від 93% до 100% для виявлення різниці AUC у ЖІП та КПЗ до стадії МС. Крім того, використовуючи 2-сторонній біноміальний тест з альфа 0,05 та результати стадій МС B-D проти A, наші результати ЖІП та КПЗ мали низьку потужність специфічності, але майже 100% потужність для виявлення зміни чутливості. Подібно до цього, 100% потужність також може виявити специфічність, коли результат стадіювання МС є C-D проти A-B, хоча чутливість виявлення обмежена. Важливо знати, чи є цільовим об’єктом включення або виключення, залежно від того, наскільки ранні стадії МС можна розпізнати.
Надмірна вага, порушення обміну речовин і жирова хвороба печінки взаємопов’язані і є симптомами один одного. Надмірна вага може бути найпершим симптомом. Згідно з даними Всесвітньої організації охорони здоров’я, ідеальною вагою для азіатів є ІМТ 18,5-22,9, що є скоригованим на азійський діапазон здорового ІМТ, тоді як ІМТ понад 23 визначається як надлишкова вага. У цьому дослідженні ми вивчили зв’язок між стадіями ЖІП, КПЗ та МС у загальній популяції дорослих мешканців Тайваню (азійської етнічної приналежності). Як показано в Таблиці 1, середній ІМТ достовірно не відрізнявся між жінками та чоловіками (23,8 кг/м2 проти 24,8 кг/м2; P=0,069), але обидва середні ІМТ були більшими за 23. У наших суб’єктів поширеність ІМТ понад 23 (надмірна вага, скоригована на азійські показники) становила 60,6% (103/170), а поширеність ІМТ понад 25 становила 37,7% (64/170).
За даними попереднього дослідження, афроамериканці з НАЖХП мали нижчий ІМТ та меншу окружність талії, ніж не іспаномовні білі з НАЖХП [32]. Інше дослідження показало, що факторами, які достовірно асоціюються з підвищеним рівнем КПЗ, є ІМТ (25-30) кг/м2, ІМТ >30 кг/м2, метаболічний синдром, вживання алкоголю >14 напоїв на тиждень та жорсткість печінки >6 кПа [33]. Виходячи з наведених вище даних, ми припускаємо, що наші результати можуть бути застосовані до осіб з ожирінням.
Наше дослідження має певні обмеження. По-перше, крос-секційний дизайн дослідження обмежує інтерпретацію результатів, оскільки причинно-наслідковий зв’язок між ЖІП, КПЗ та МС встановити не вдалося. Однак, з патофізіологічної точки зору, цілком ймовірно, що жирова дистрофія печінки, виявлена за допомогою ЖІП або КПЗ, сприяла розвитку МС. По-друге, існували відмінності в декількох ключових метаболічних біомаркерах між чоловіками та жінками. Таким чином, для прогнозування МС на основі ЖІП та КПЗ може знадобитися статево-специфічне відсікання. Подальші статево-специфічні аналізи можуть змінити ефективність моделі, виражену AU-ROC. Нарешті, учасники нашого дослідження були обмежені 1 районом міста Тайбей, що представляє літніх людей, які проживають у міських районах. Таким чином, наслідки отриманих результатів повинні бути досліджені на предмет їх доречності та застосовності в інших умовах. Незважаючи на ці обмеження, наше дослідження має деякі сильні сторони. Наші учасники були взяті з громади, а не з лікарняної популяції, що робить наші висновки застосовними до відносно здорової популяції. Крім того, ми використовували систему стадійності МС, яка допомогла нам виявити пацієнтів з ранніми стадіями МС.
Заключення
Наше дослідження продемонструвало, що як ЖІП, так і КПЗ мають позитивний незалежний зв’язок зі стадіями МС у дорослих тайванців, що дозволяє припустити, що оцінка здоров’я печінки за допомогою ЖІП або КПЗ може бути корисною для виявлення осіб з метаболічними порушеннями. Необхідні подальші проспективні когортні дослідження з більшими розмірами вибірок, щоб визначити, чи можуть ЖІП і КПЗ прогнозувати майбутні стадії МС.
Зображення
Зображення 1. Блок-схема учасників, включених у це дослідження.
Зображення 2. Площа під кривою робочої характеристики приймача (AU-ROC) ЖІП та КПЗ у прогнозуванні результату (А) легкого та важкого МС порівняно з не-МС та (Б) середнього та важкого МС порівняно з легким та не-МС. МС – метаболічний синдром; ЖІП – жировий індекс печінки; КПЗ – контрольований параметр загасання.
Таблиці
Таблиця 1. Клініко-біохімічні характеристики досліджуваних осіб, стратифіковані за статтю.
Таблиця 2. Показники поширеності компонентів метаболічного синдрому з розподілом за категоріями ЖІП та КПЗ.
Таблиця 3. Зв’язок жирового індексу печінки та параметрів контрольованої атенуації зі стадією метаболічного синдрому за допомогою впорядкованої логістичної регресії.
Посилання на джерела
- Alberti KG, Eckel RH, Grundy SM, Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention. National Heart, Lung, and Blood Institute, American Heart Association, World Heart Federation. International Atherosclerosis Society, and International Association for the Study of Obesity: Circulation, 2009; 120; 1640-45
- Sperling LS, Mechanick JI, Neeland IJ, The CardioMetabolic Health Alliance: Working toward a new care model for the metabolic Syndrome: J Am Coll Cardiol, 2015; 66; 1050-67
- Vanni E, Bugianesi E, Kotronen A, De Minicis S, From the metabolic syndrome to NAFLD or vice versa?: Dig Liver Dis, 2010; 42; 320-30
- Neuschwander-Tetri BA, Caldwell SH, Nonalcoholic steatohepatitis: Summary of an AASLD Single Topic Conference: Hepatology, 2003; 37; 1202-19
- Khang AR, Lee HW, Yi D, The fatty liver index, a simple and useful predictor of metabolic syndrome: Analysis of the Korea National Health and Nutrition Examination Survey 2010–2011: Diabetes Metab Syndr Obes, 2019; 12; 181-90
- Angulo P, Kleiner DE, Dam-Larsen S, Liver fibrosis, but no other histologic features, is associated with long-term outcomes of patients with nonalcoholic fatty liver disease: Gastroenterology, 2015; 149; 389-97e310
- Bedogni G, Bellentani S, Miglioli L, The Fatty Liver Index: A simple and accurate predictor of hepatic steatosis in the general population: BMC Gastroenterol, 2006; 6; 33-35
- Yen YH, Chen JF, Wu CK, The correlation of controlled attenuation parameter results with ultrasound-identified steatosis in real-world clinical practice: J Formos Med Assoc, 2017; 116; 852-61
- Kim JH, Kwon SY, Lee SW, Lee CH, Validation of fatty liver index and lipid accumulation product for predicting fatty liver in Korean population: Liver Int, 2011; 31; 1600-601
- de Ledinghen V, Vergniol J, Capdepont M, Controlled attenuation parameter (CAP) for the diagnosis of steatosis: A prospective study of 5323 examinations: J Hepatol, 2014; 60; 1026-31
- Hu YY, Dong NL, Qu Q, The correlation between controlled attenuation parameter and metabolic syndrome and its components in middle-aged and elderly nonalcoholic fatty liver disease patients: Medicine (Baltimore), 2018; 97; e12931
- Patel PJ, Hossain F, Horsfall LU, Controlled attenuation parameter in NAFLD identifies risk of suboptimal glycaemic and metabolic control: J Diabetes Complications, 2018; 32; 799-804
- Lin YJ, Lin CH, Wang ST, Noninvasive and convenient screening of metabolic syndrome using the controlled attenuation parameter technology: An evaluation based on self-paid health examination participants: J Clin Med, 2019; 8; 1775
- Hsieh YC, Hung CT, Lien LM, A significant decrease in blood pressure through a family-based nutrition health education programme among community residents in Taiwan: Public Health Nutr, 2009; 12; 570-77
- Alizargar J, Bai CH, Factors associated with carotid Intima media thickness and carotid plaque score in community-dwelling and non-diabetic individuals: BMC Cardiovasc Disord, 2018; 18; 21-26
- Sasso M, Beaugrand M, de Ledinghen V, Controlled attenuation parameter (CAP): A novel VCTE guided ultrasonic attenuation measurement for the evaluation of hepatic steatosis: Preliminary study and validation in a cohort of patients with chronic liver disease from various causes: Ultrasound Med Biol, 2010; 36; 1825-35
- Sirli R, Sporea I, Controlled attenuation parameter for quantification of steatosis: which cut-offs to use?: Can J Gastroenterol Hepatol, 2021; 2021; 6662760
- de Lédinghen V, Vergniol J, Foucher J, Non-invasive diagnosis of liver steatosis using controlled attenuation parameter (CAP) and transient elastography: Liver Int, 2012; 32; 911-18
- Dasarathy S, Dasarathy J, Khiyami A, Validity of real time ultrasound in the diagnosis of hepatic steatosis: A prospective study: J Hepatol, 2009; 51; 1061-67
- Sterling RK, Lissen E, Clumeck N, Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection: Hepatology, 2006; 43; 1317-25
- Dyson JK, Anstee QM, McPherson S, Non-alcoholic fatty liver disease: A practical approach to diagnosis and staging: Frontline Gastroenterol, 2014; 5; 211-18
- Long JSF: Regression models for categorical dependent variables using stata, 2014, Texas, Stata Press
- Saklayen MG, The global epidemic of the metabolic syndrome: Curr Hypertens Rep, 2018; 20; 12
- Bintoro BS, Fan YC, Chou CC, Metabolic unhealthiness increases the likelihood of having metabolic syndrome components in normoweight young adults: Int J Environ Res Public Health, 2019; 16; 3258
- Zhang H, Shao J, Chen D, Reporting and methods in developing prognostic prediction models for metabolic syndrome: A systematic review and critical appraisal: Diabetes Metab Syndr Obes, 2020; 13; 4981-92
- Calori G, Lattuada G, Ragogna F: Hepatology, 2011; 54; 145-52
- Reaven GM, Banting lecture 1988. Role of insulin resistance in human disease: Diabetes, 1988; 37; 1595-607
- Karlas T, Petroff D, Sasso M, Individual patient data meta-analysis of controlled attenuation parameter (CAP) technology for assessing steatosis: J Hepatol, 2017; 66; 1022-30
- Pu K, Wang Y, Bai S, Diagnostic accuracy of controlled attenuation parameter (CAP) as a non-invasive test for steatosis in suspected non-alcoholic fatty liver disease: A systematic review and meta-analysis: BMC Gastroenterol, 2019; 19; 51
- Carvalhana S, Leitão J, Alves AC, How good is controlled attenuation parameter and fatty liver index for assessing liver steatosis in general population: correlation with ultrasound: Liver Int, 2014; 34(6); e111-17
- Sourianarayanane A, McCullough AJ, Accuracy of steatosis and fibrosis NAFLD scores in relation to vibration controlled transient elastography: An NHANES analysis: Clin Res Hepatol Gastroenterol, 2022; 46(7); 101997
- Golabi P, Paik J, Hwang JP, Prevalence and outcomes of non-alcoholic fatty liver disease (NAFLD) among Asian American adults in the United States: Liver Int, 2019; 39(4); 748-57
- de Ledinghen V, Vergniol J, Capdepont M, Controlled attenuation parameter (CAP) for the diagnosis of steatosis: A prospective study of 5323 examinations: J Hepatol, 2014; 60(5); 1026-31