Резюме
Передумови
Визначити, чи пов’язані трансректальне ультразвукове дослідження та вправи на м’язи тазового дна під керівництвом уролога з відновленням здатності до негайного, раннього та довготривалого утримання сечопуску після радикальної простатектомії.
Матеріали та методи
У ретроспективне дослідження були включені дані 114 пацієнтів з локалізованим раком передміхурової залози (РПЗ), які пройшли РП в Онкологічному госпіталі Хенань з листопада 2018 року по квітень 2021 року. З 114 пацієнтів 50 пацієнтам з групи спостереження проводили трансректальне ультразвукове дослідження та вправи для м’язів тазового дна ВМТД під подвійним керівництвом уролога, а 64 пацієнтам з контрольної групи проводили ВМТД під вербальним керівництвом уролога. У групі спостереження оцінювали скоротливу функцію зовнішнього сфінктера уретри. В обох групах оцінювали показники здатності до негайного, раннього та довготривалого утримання сечі, а також аналізували фактори, що впливають на нетримання сечі.
Результати
Частота здатності пацієнтів до утримання сечопуску через 2 тижні та 1, 3, 6 і 12 місяців у групі спостереження після РП була достовірно вищою, ніж у контрольній групі (52,0% проти 29,7%, 70,0% проти 39,1%, 82% проти 57,8, 88% проти 70,3%, 98,0 проти 84,4%, р < 0,05). Скоротлива функція зовнішнього сфінктера уретри чітко корелювала з покращенням здатності утримання сечовипускання під час багаторазових візитів після РП, за винятком візиту через 12 місяців. За допомогою логістичного регресійного аналізу було підтверджено, что трансректальне ультразвукове дослідження та ВМТД під подвійним контролем уролога є незалежним позитивним фактором для покращення можливості утримання сечовипускання через 2 тижні, 1, 3, 6 та 12 місяців. Однак ТУРП була негативним фактором для післяопераційного нетримання сечі в різні періоди часу.
Висновки
Трансректальне ультразвукове дослідження та ВМТД під подвійним контролем уролога відігравали значну роль у покращенні здатності до негайного, раннього та довготривалого утримання сечопуску після РП і діяли як незалежний прогностичний фактор.
Вступ
Рак передміхурової залози (РПЗ), одне з найпоширеніших онкологічних захворювань у чоловіків, демонструє зростання захворюваності в усьому світі, що частково пов’язано зі старінням населення [1]. Хоча існує багато методів лікування, таких як зовнішня променева терапія (ЗПТ) з андрогенною депривацією (АД) та низькодозова брахітерапія (БТ) для локалізованого РПЗ, радикальна простатектомія (РП) все ще залишається найпоширенішим варіантом через її хороший вплив на контроль над пухлиною [2]. Однак пацієнти, які перенесли РП, можуть зіткнутися з різними ускладненнями, включаючи нетримання сечі, еректильну дисфункцію, кров’янисті випорожнення, ніктурію, тривогу і депресію, а також загальну психічну і фізичну дисфункцію, серед яких післяопераційне нетримання сечі серйозно впливає на якість життя і психологічну витривалість пацієнтів [3,4,5]. З часом можливість утримання сечопуску поступово відновлюється. Більшість пацієнтів відновлюють можливість утримання сечопуску через 12 місяців після РП, тоді як лише меншість пацієнтів досягають задовільної негайної та ранньої можливості утримання сечопуску [6, 7]. Тому раннє відновлення післяопераційного нетримання сечі має бути питанням першочергової важливості.
Ряд передопераційних, інтраопераційних та післяопераційних факторів пов’язані з нетриманням сечі після РП. Було продемонстровано, що більша функціональна і перетинчаста частини сечівника та збереження судинно-нервового пучка сприяють більш ранньому відновленню можливості утримання сечопуску [8,9,10]. Однак з розвитком хірургічних технологій та роботизованої лапароскопічної радикальної простатектомії вплив самого хірургічного втручання на нетримання сечі зменшився [5]. Однак деякі передопераційні фактори, такі як ожиріння та супутні захворювання, неможливо змінити за короткий час, і тому вони не повинні бути пріоритетними у відновленні післяопераційної здатності утримання сечопуску [11]. Таким чином, відновлення післяопераційної можливості утримання сечопуску в основному залежить від післяопераційного лікування, включаючи модифікацію дієти, тренування сечового міхура, вправи для м’язів тазового дна (ВМТД), біологічний зворотний зв’язок та функціональну електростимуляцію [12, 13]. Як показало попереднє дослідження, вправи для м’язів тазового дна, проведені перед РП, можуть мати позитивний вплив на швидкість відновлення можливості утримання сечопуску через 3 місяці після операції [14].
Повідомлялося, що нетримання сечі у чоловіків в основному пов’язане з дієздатністю сфінктера, а також до- і післяопераційною функцією сечового міхура [15]. Приблизно дві третини випадків післяопераційного нетримання сечі пов’язані з дисфункцією сфінктерів уретри, а інша третина – з одночасною дисфункцією сечового міхура і сфінктерів уретри. Є два сфінктери на виході з сечового міхура зовнішній та внутрішній уретральні сфінктери, які зазвичай видаляються під час РП. Тому стан зовнішнього уретрального сфінктера, який часто є дисфункціональним через пряму травму або пошкодження нерва, тісно пов’язаний з післяопераційним відновленням можливості утримання сечі [16]. Відновлення функції зовнішнього уретрального сфінктера є ключовим кроком у відновленні можливості утримання сечі після РП. Як неінвазивний метод лікування, ВМТД є першим вибором для покращення можливості утримання сечі після РП без жодних побічних ефектів [17]. Однак значення ВМТД для покращення можливості утримання сечі після РП все ще залишається суперечливим. Однією з поширених проблем є те, що принципи ВМТД, які застосовуються у чоловіків, ґрунтуються на принципах, розроблених для жінок, що видається проблематичним через відмінності в анатомії [12]. Крім того, наразі не існує жодних індексів для оцінки ефекту ВМТД.
Тому в даному дослідженні ми мали на меті оцінити значення трансректальної УЗД та ВМТД у покращенні можливості утримання сечі після РП та оцінити роль післяопераційного стану зовнішнього уретрального сфінктера як біомаркеру в прогнозуванні нетримання сечі.
Матеріали та методи
Учасники та структура дослідження
У цьому ретроспективному дослідженні було проаналізовано 114 пацієнтів з локалізованим РПЗ, які пройшли РП в Онкологічній лікарні Хенань з листопада 2018 року по квітень 2021 року. Кандидатами були пацієнти, які перенесли лапароскопічну або роботизовану радикальну простатектомію, за винятком тих, хто мав до операції нетримання сечі, симптоми захворювань нижніх сечових шляхів, нейрогенний сечовий міхур і мовний бар’єр, що спричиняв нездатність точно висловити свою думку і пройти подальше спостереження. Усім пацієнтам під час операції виконували однакову хірургічну процедуру. Всі пацієнти були ознайомлені з дослідженням і підписали інформовану згоду. Усіх учасників спостерігали через 2 тижні, а також через 1, 3, 6 і 12 місяців після РП. Нетримання сечі оцінювали за допомогою усного опитувальника, як описано раніше [18]. “Відсутність використання прокладок або підтікання сечі після видалення катетера” розглядалося як відновлення нетримання сечі. Це дослідження було схвалено Комітетом з питань етики при Хенаньській онкологічній лікарні.
114 пацієнтів були розподілені на групи спостереження та контрольну групу. Пацієнтам основної та контрольної груп ВМТД розпочинали до та після РП відповідно. Післяопераційні ВМТД проводили на 6-й день після РП, а катетер видаляли через 2 тижні після РП. Перед ВМТД 64 пацієнти контрольної групи отримали усні рекомендації урологів, тоді як інші 50 пацієнтів групи спостереження отримали подвійні настанови за допомогою трансректального ультразвукового дослідження та від урологів. Демографічні змінні та інші клініко-патологічні характеристики наведено в таблиці 1.
Таблиця 1 Демографічні та клініко-патологічні показники пацієнтів групи спостереження та контрольної групи
| Змінні | Група спостереження (N = 50) | Контрольна група (N = 64) | P value |
| Вік (років) | 67.5 ± 7.1 | 68.1 ± 5.7 | 0.665 |
| ІМТ (кг/м2) | 23.9 ± 2.4 | 24.2 ± 2.8 | 0.558 |
| ПСА (нг/мл) | 4.2 ± 7.4 | 5.9 ± 7.8 | 0.243 |
| Холестенон (ммоль/л) | 4.5 ± 1.1 | 4.6 ± 0.8 | 0.641 |
| Час виконання РП (хв) | 226.9 ± 91.2 | 243.6 ± 86.1 | 0.319 |
| Інтраопераційна кровотеча (мл) | 186.2 ± 104.1 | 196.6 ± 159.7 | 0.693 |
| Перебування в лікарні (дні) | 16.8 ± 7.7 | 18.3 ± 6.6 | 0.274 |
| Система оцінювання за Глісоном | |||
| ≤ 7 | 24 | 29 | 0.775 |
| ≧8 | 26 | 35 | |
| Неад’ювантна терапія | 0.413 | ||
| Ні | 10 | 17 | |
| Так | 40 | 47 | |
| ТУРП | |||
| Ні | 39 | 49 | 0.856 |
| Так | 11 | 15 | |
| Гіпертензія | |||
| Ні | 32 | 39 | 0.738 |
| Так | 18 | 25 | |
| Діабет | |||
| Ні | 37 | 50 | 0.607 |
| Так | 13 | 14 | |
| Операція | 0.433 | ||
| ЛРП | 31 | 35 | |
| РАРП | 19 | 29 | |
| Розсічення лімфовузлів | 0.369 | ||
| Ні | 18 | 18 | |
| Так | 32 | 46 | |
- Дані вимірювань виражені за допомогою середнього значення ± СВ та проаналізовані за допомогою t-критерію Стьюдента. Категоріальні змінні визначали за допомогою критерію Хі-квадрат
- ІМТ індекс маси тіла, ПСА простатспецифічний антиген, ТУРП трансуретральна резекція простати, ЛРП лапароскопічна радикальна простатектомія, РАРП роботоасистована радикальна простатектомія
Трансректальне УЗД та ВМТД під подвійним контролем уролога
Після підписання письмової згоди кандидати в групі спостереження були ознайомлені з програмою трансректального ультразвукового дослідження (ТУЗД) та ВМТД під подвійним контролем уролога. Процедура полягала в наступному: спочатку трансректальне УЗД використовувалося для визначення локалізації зовнішнього уретрального сфінктера (ЗУС). Коли пацієнтам виконували ВМТД, за скороченням ЗУС могли спостерігати урологи та пацієнти через систему візуалізації. Потім урологи проводили пальцеве ректальне обстеження, щоб відчути скорочення ЗУС і визначити максимальне скорочення ЗОУ, індуковане ВМТД. Нарешті, пацієнти повинні були запам’ятати стан і продовжувати тренування з використанням керованої ВМТД. Таким чином, пацієнти досягали правильного виконання ВМТД.
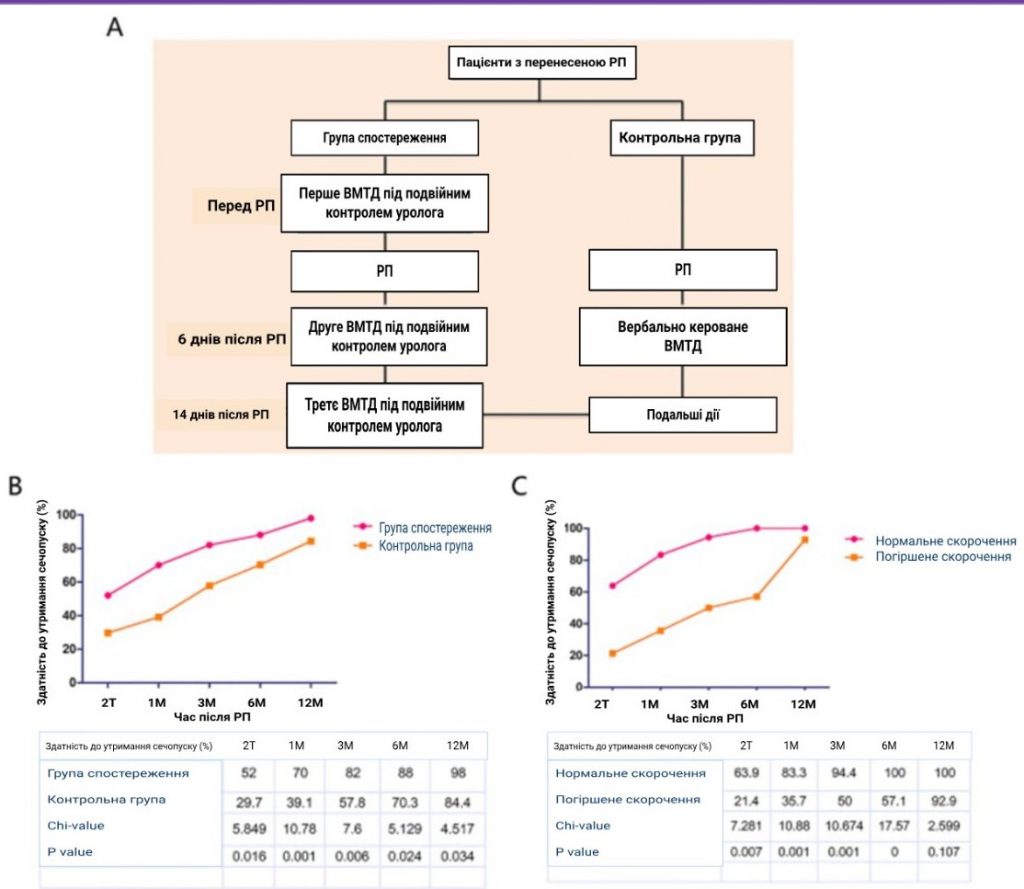
Структурна схема ВМТД під подвійним контролем уролога та вербально керованої ВМТД наведена на зображення 1А. Перед РП пацієнтам групи спостереження проводили перший сеанс ВМТД під подвійним контролем уролога. Через шість днів після РП був проведений другий сеанс ВМТД під подвійним контролем уролога, і пацієнти повинні були розпочати виконання ВМТД. Третій сеанс ВМТД під подвійним контролем уролога проводився після видалення катетера на 14-й день. Пацієнти контрольної групи почали виконувати ВМТД на 6-й день після операції, отримуючи лише усні вказівки.
Зображення 1
A: Було представлено структурну схему ВМТД під подвійним керівництвом уролога та вербально керованої ВМТД. Б: Ми оцінювали частоту нетримання сечі в 5 часових точках, включаючи 2 тижні та 1, 3, 6 і 12 місяців після РП відповідно. В обох групах частота нетримання сечі з часом зростала. В: 2-тижневий та 1-, 3-, 6- і 12-місячний показники нетримання сечі в групі зі зниженим рівнем були очевидно нижчими, ніж у групі з нормальним рівнем (21,4% проти 63,9%, 35,7% проти 83,3, 50% проти 94,4%, 57,1% проти 100%, 92,9 проти 100%).
Оцінка скоротливої функції ЗУС
У трьох трансректальних ультразвукових дослідженнях оцінювали амплітуду скорочення ЗУС, методика оцінки описана нижче: 1. діаметр уретри в ділянці під ЗУС визначався в розслабленому стані і записувався як d1, d2 і d3. 2. Пацієнтів попросили виконати ВМТД, після чого зафіксували діаметр уретри (d1′, d2′ та d3′). 3. Різниця між двома вимірами (△1 = d1-d1′, △2 = d2-d2′, △3 = d3-d3′) використовувалася для відображення амплітуди скорочення ЗУС. Скоротливу функцію ЗУС оцінювали за співвідношенням △3 до △1 і визначали як знижену, якщо співвідношення було менше 0,8, і нормальну, якщо співвідношення було більше 0,8.
Статистичний аналіз
Для аналізу даних використовували SPSS 19.0 (SPSS Inc., Чикаго, Іллінойс, США) та GraphPad (Prism 5.0). Демографічні та клініко-патологічні змінні аналізували за допомогою t-критерію Стьюдента та критерію хі-квадрат. Зв’язок між характеристиками пацієнтів з нетриманням сечі аналізували за допомогою критерію Хі-квадрат. Логістичний регресійний аналіз використовували для аналізу прогностичних факторів щодо післяопераційного нетримання сечі. Значущим вважали P < 0,05.
Результати
У цьому дослідженні ми оцінювали частоту нетримання сечі в 5 часових точках, включаючи 2 тижні та 1, 3, 6 і 12 місяців після РП. В обох групах частота нетримання сечі з часом зростала (зображення 1B). Статистичний аналіз показав, що через 2 тижні, а також через 1, 3, 6 і 12 місяців частота нетримання сечі в групі спостереження становила 52,0%, 70,0%, 82,0%, 88,0% і 98,0% відповідно, що було значно вище, ніж у контрольній групі (29,7%, 39,1%, 57,8%, 70,3% і 84,4% відповідно; всі р < 0,05). Наші дані продемонстрували, що ВМТД під подвійним контролем уролога сприяла появі негайної, ранньої та довготривалої можливості утримання сечопуску після РП.
Далі ми проаналізували взаємозв’язок між скоротливою функцією ЗУС та нетриманням сечі в групі спостереження. Як показано на зображенні 1С, 2-тижневі та 1-, 3-, 6- і 12-місячні показники можливості утримання сечі в групі зі зниженою функцією були очевидно нижчими, ніж у групі з нормальною функцією (21,4% проти 63,9%, 35,7% проти 83,3, 50% проти 94,4%, 57,1% проти 100%, 92,9 проти 100%, відповідно). Статистичний аналіз виявив достовірну кореляцію між скороченням зовнішнього уретрального сфінктера та післяопераційним нетриманням сечопуску у всіх часових точках, окрім 12 місяців.
Нарешті, ми намагалися визначити фактори, які впливають на здатність до утримання сечопуску після РП. Однофакторний логістичний регресійний аналіз показав, що трансуретральна резекція простати (ТУРП) та ВМТД під подвійним контролем уролога були взаємопов’язаними факторами, що впливають на Здатність до утримання сечопуску через 2 тижні після РП (таблиця 2). Вік, ІМТ та інші змінні не мали значущого зв’язку з можливість утримання сечопуску на другому тижні. Згодом ми проаналізували вік, ІМТ, ПСА, холестенон, ТУРП і ВМТД під подвійним контролем уролога за допомогою багатофакторної логістичної регресійної моделі. Багатофакторний аналіз показав, що ТУРП і ВМТД під подвійним контролем уролога були незалежними негативними і позитивними незалежними факторами для здатності до утримання сечопуску на 2 тижні відповідно (таблиця 2), а також для здатності до утримання сечопуску через 1, 3, 6 і 12 місяці (таблиця 3). Ці дані продемонстрували, що ВМТД під подвійним контролем уролога може бути позитивним прогностичним фактором для негайної, ранньої та довготривалої можливості утримання сечопуску.
Таблиця 2 Логістичний регресійний аналіз для можливості до утримання сечопуску сечі через 2 тижні після РП
| Фактори | Однофакторний аналіз | Мультифакторний аналіз | |||
| ВШ (95% ДІ) | P value | ВШ (95% ДІ) | P value | ||
| Вік (років) | 0.970 (0.914–1.030) | 0.327 | 0.956 (0.894–1.021) | 0.179 | |
| ІМТ (кг/м2) | 0.986 (0.835–1.139) | 0.844 | 0.984 (0.841–1.151) | 0.840 | |
| ПСА (нг/мл) | 0.967 (0.915–1.022) | 0.237 | 0.965 (0.906–1.027) | 0.265 | |
| Холестенон (ммоль/л) | 1.357 (0.907–2.031) | 0.138 | 1.437 (0.934–2.211) | 0.099 | |
| Час виконання РП (хв) | 0.999 (0.995–1.003) | 0.659 | |||
| Інтраопераційна кровотеча (мл) | 1.000 (0.997–1.003) | 0.906 | |||
| Перебування в лікарні | 0.950 (0.894–1.010) | 0.101 | |||
| Оцінка за шкалою Глісона | ≦7 проти ≧8 | 0.736 (0.346–1.564) | 0.425 | 0.732 (0.324–1.652) | 0.453 |
| Неоад’ювантна терапія | Ні проти так | 1.144 (0.469–2.789) | 0.767 | ||
| ТУРП | Ні проти так | 0.377 (0.138–1.029) | 0.057 | 0.293 (0.099–0.876) | 0.027 |
| Гіпертензія | Ні проти так | 0.858 (0.394–1.870) | 0.700 | ||
| Діабет | Ні проти так | 0.569 (0.225–1.441) | 0.234 | ||
| Операція | ЛРП проти РАРП | 1.008 (0.471–2.156) | 0.984 | ||
| Висічення лімфатичних вузлів | Ні проти так | 1.036 (0.461–2.328) | 0.931 | ||
| Настанови | Ні проти так | 2.566 (1.186–5.550) | 0.017 | 2.538 (1.124–5.732) | 0.025 |
Таблиця 3 Множинна логістична регресія для можливості утримання сечопуску через 1, 3, 6 та 12 місяців після РП
| Фактори | Однофакторний аналіз | Мультифакторний аналіз | |||
| ВШ (95% ДІ) | P value | ВШ (95% ДІ) | P value | ||
| Через 1 місяць | |||||
| ТУРП | Ні проти так | 0.384 (0.154–0.956) | 0.04 | 0.301 (0.110–0.823) | 0.019 |
| Настанови | Ні проти так | 3.640 (1.658–7.989) | 0.001 | 3.872 (1.681–8.920) | 0.001 |
| Через 3 місяці | |||||
| Турп | Ні проти так | 0.286 (0.115–0.710) | 0.007 | 0.212 (0.075–0.596) | 0.003 |
| Настанови | Ні проти так | 3.324 (1.385–7.979) | 0.007 | 3.560 (1.364–9.290) | 0.009 |
| Через 6 місяців | |||||
| Турп | Ні проти так | 0.329 (0.125–0.864) | 0.024 | 0.283 (0.099–0.807) | 0.018 |
| Настанови | Ні проти так | 3.096 (1.131–8.484) | 0.028 | 3.406 (1.158–10.019) | 0.026 |
| Через 12 місяців | |||||
| Турп | Ні проти так | 0.129 (0.034–0.487) | 0.002 | 0.087 (0.015–0.496) | 0.006 |
| Настанови | Ні проти так | 9.074 (1.120–73.487) | 0.039 | 17.186 (1.580–186.95) | 0.020 |
Обговорення
Нетримання сечі після РП є поширеним ускладненням, яке має значний негативний вплив на якість життя пацієнтів і вимагає більш ретельного догляду [19]. Вчені постійно намагаються знайти надійний спосіб зменшити частоту виникнення нетримання сечі після РП. Для лікування післяопераційного нетримання сечі було прийнято ряд стратегій, включаючи ВМТД та хірургічні втручання [20]. Численні дослідження продемонстрували, що ВМТД є найбільш поширеним консервативним методом лікування післяопераційного нетримання сечі [13,21,22,23]. Хоча прийнято вважати, що скорочення МТД можна досягти після усних або письмових інструкцій щодо проведення ВМТД, до 50% пацієнтів не досягають ефективних скорочень після виконання базових інструкцій [24]. Тому існує нагальна потреба у підвищенні ефективності ВМТД та стандартизації інструкцій.
У даному дослідженні, заснованому на дослідженнях і практиці, пацієнти в групі ВМТД, під подвійним контролем уролога, досягли кращого безперервного сечовипускання, ніж пацієнти в контрольній групі. З 50 пацієнтів групи спостереження 26 пацієнтів (52,0%) досягли можливості утримання сечопуску після видалення катетера (через 2 тижні після РП), що було значно вище, ніж у контрольній групі (29,7%). Крім того, показники здатності до утримання счопуску через 1, 3, 6 і 12 місяців після РП у групі спостереження були вищими, ніж у контрольній групі. Хоча в попередніх дослідженнях повідомлялося про суперечливий вплив ВМТД на поліпшення післяопераційної здатності до утримання сечопуску [24], наші дані продемонстрували ефективний вплив ВМТД під подвійним контролем уролога на негайне, раннє і довгострокове відновлення можливості утримання сечопуску після РП. Для покращення післяопераційного відновлення здатності утримання сечопуску застосовували модифіковану ВМТД. Centemero, A зі співавт. ініціювали ВМТД перед РП і спостерігали покращення здатності до утримання сечопуску порівняно з післяопераційною ВМТД [25]. Seong J. та співавт. розробили серію номограм для прогнозування відновлення можливості утримання сечопуску після РП і досягли значного поліпшення [26]. Повідомлялося, що ВМТД під контролем УЗД покращує не тільки раннє відновлення можливості утримання сечопуску з частотою 52,8% протягом 30 днів після РП, але й тривале нетримання сечі, що виникає через > 1 року [27, 28]. Порівняно з цими дослідженнями, наше дослідження виявило хороші показники негайного та раннього відновлення можливості утримання сечовипускання при післяопераційній ВМТД під подвійним контролем уролога, а також пізнього відновлення сечовипускання. За допомогою трансректального ультразвуку ми чітко спостерігали скорочення ЗУС і тренували пацієнта максимально скорочувати зовнішній сфінктер уретри за допомогою цифрового ректального дослідження під час ВМТД, що свідчить про те, що правильне виконання ВМТД є надзвичайно важливим для відновлення можливості утримувати сечовипускання після РП. Крім того, правильна ВМТД забезпечить довготривалий ефект збереження здатності до утримання сечопуску. Однак у цьому ретроспективному дослідженні існувала значна розбіжність у часі навчання ВМТД у двох групах, і роль ВМТД під подвійним контролем уролога у покращенні відновлення утримання сечопуску після РП все ще потребує подальшої перевірки в проспективному дослідженні, в якому було б необхідним проведення синхронного виконання ВМТД.
Під час трансректального ультразвукового дослідження вимірювали максимальне скорочення ЗУС. Згідно зі сформульованими нами алгоритмами, скоротлива функція ЗУС після ВМТД була поділена на знижену та нормальну. У когорті трансректального УЗД та ВМТД під подвійним контролем уролога, 2-тижневі, 1-місячні, 3-місячні, 6-місячні та 12-місячні показники можливості утримання сечовипускання в групі зі зниженою функцією були очевидно нижчими, ніж у групі з нормальною функцією, що свідчить про те, що амплітуда скорочення ЗУС є багатообіцяючим показником для прогнозування післяопераційного нетримання сечі після РП. Stéphanie J. та співавт. повідомили, що товщина, площа поперечного перерізу та об’єм сфінктера уретри були збільшені у жінок після 12-тижневї групової реабілітації МТД [29], що було схоже на наше дослідження. Повідомляється, що > 90% пацієнтів з довготривалим нетриманням сечі мають порушення ЗУС [30]. Таким чином, зменшення скорочення після точної ВМТД відображало можливість ураження ЗУС, що може потребувати інших методів лікування. За допомогою трансректального УЗД виявити скорочення ЗУС було легко. Водночас, порівняно з визначенням довжини перетинчастого відділу уретри за допомогою МРТ, визначення скорочення ЗУС за допомогою УЗД вимагало менших витрат. Крім того, із застосуванням мікроультразвуку в урології оцінка скорочення ЗУС в майбутньому буде більш точною і легкою [31]. Однак, через обмежений розмір вибірки в цьому дослідженні, цей метод оцінки скорочення ЗУС потребує більшого розміру вибірки для подальшої верифікації.
Нарешті, ми провели аналіз факторів, що впливають на безпосереднє, раннє та довготривале нетримання сечі після РП. Наші дані показали, що ТУРП і ВМТД під подвійним контролем уролога були взаємопов’язаними факторами, що впливають на можливість утримання сечопуску через 2 тижні, а також через 1, 3, 6 і 12 місяців після РП. Попередні дослідження підтвердили, що ТУРП має негативний вплив на можливість утримання сечопуску, можливо, через фіброз периуретральних тканин, який може пригнічувати функцію ЗУС [32]. Тому підтримка цілісності ЗУС і посилення тренувань ЗУС є життєво важливими в періопераційному періоді. Було підтверджено, що ВМТД під подвійним контролем уролога є незалежним фактором прогнозування негайного, раннього та довготривалого покращення здатності до утримання сечопуску, що частково пояснюється швидким та правильним відновленням функції ЗУС при сучасній моделі ВМТД.
Таким чином, наші дані підтвердили ефективність ВМТД під подвійним контролем уролога у покращенні здатності до утримання сечопуску після РП та можливість використання скорочення ЗУС для прогнозування утримання сечовипускання. Крім того, в даній моделі не використовувалися допоміжні пристрої, а тренування без обладнання проводилося до видалення сечового катетера, що дозволило поліпшити показник контролю сечовипускання після видалення сечового катетера.
У цьому дослідженні все ж були деякі недоліки. По-перше, це було лише ретроспективне одноцентрове дослідження з невеликим розміром вибірки. Для подальшої перевірки ефективності сучасної моделі ВМТД необхідні багатоцентрові, широкомасштабні та проспективні дослідження. По-друге, це дослідження було зосереджено лише на відновленні організму пацієнта і не включало оцінку психологічного статусу, який необхідно оцінити в майбутньому.
Висновки
Трансректальне ультразвукове дослідження та ВМТД під подвійним контролем уролога відігравали значну роль у покращенні негайної, ранньої та довготривалої можливості утримання сечовипускання після РП, а також виступали незалежним прогностичним фактором.
Абревіатури
АД:
Андрогенна депривація
БТ:
Низько-дозова брахітерапія
ЗПТ:
Зовнішня променева терапія
ЗУС:
Зовнішній уретральний сфінктер
РП:
Рак простати
ВМТД:
Вправи для м’язів тазового дна
РП:
Радикальна простатектомія
Посилання на джерела
- Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022. CA Cancer J Clin. 2022;72:7–33.
- Sandhu S, Moore CM, Chiong E, Beltran H, Bristow RG, Williams SG. Prostate cancer. Lancet. 2021;398:1075–90.
- Lane JA, Donovan JL, Young GJ, et al. Functional and quality of life outcomes of localised prostate cancer treatments (prostate testing for cancer and treatment [ProtecT] study). Bju Int. 2022. https://doi.org/10.1111/bju.15739.
- Lane A, Metcalfe C, Young GJ, et al. Patient-reported outcomes in the ProtecT randomized trial of clinically localized prostate cancer treatments: Study design, and baseline urinary, bowel and sexual function and quality of life. Bju Int. 2016;118:869–79.
- Wallerstedt A, Nyberg T, Carlsson S, et al. Quality of life after open radical prostatectomy compared with robot-assisted radical prostatectomy. Eur Urol Focus. 2019;5:389–98.
- Rajih E, Meskawi M, Alenizi AM, et al. Perioperative predictors for post-prostatectomy urinary incontinence in prostate cancer patients following robotic-assisted radical prostatectomy: long-term results of a Canadian prospective cohort. Can Urol Assoc J. 2019;13:E125–31.
- Li X, Zhang H, Jia Z, et al. Urinary continence outcomes of four years of follow-up and predictors of early and late urinary continence in patients undergoing robot-assisted radical prostatectomy. Bmc Urol. 2020;20:29.
- Cameron AP, Suskind AM, Neer C, et al. Functional and anatomical differences between continent and incontinent men post radical prostatectomy on urodynamics and 3T MRI: a pilot study. Neurourol Urodyn. 2015;34:527–32.
- Mendoza PJ, Stern JM, Li AY, et al. Pelvic anatomy on preoperative magnetic resonance imaging can predict early continence after robot-assisted radical prostatectomy. J Endourol. 2011;25:51–5.
- Nguyen L, Jhaveri J, Tewari A. Surgical technique to overcome anatomical shortcoming: balancing post-prostatectomy continence outcomes of urethral sphincter lengths on preoperative magnetic resonance imaging. J Urol. 2008;179:1907–11.
- Kretschmer A, Hubner W, Sandhu JS, Bauer RM. Evaluation and management of postprostatectomy incontinence: a systematic review of current literature. Eur Urol Focus. 2016;2:245–59.
- Hodges PW, Stafford RE, Hall L, et al. Reconsideration of pelvic floor muscle training to prevent and treat incontinence after radical prostatectomy. Urol Oncol. 2020;38:354–71.
- Goode PS, Burgio KL, Johnson TN, et al. Behavioral therapy with or without biofeedback and pelvic floor electrical stimulation for persistent postprostatectomy incontinence: a randomized controlled trial. JAMA. 2011;305:151–9.
- Chang JI, Lam V, Patel MI. Preoperative pelvic floor muscle exercise and postprostatectomy incontinence: a systematic review and meta-analysis. Eur Urol. 2016;69:460–7.
- Radadia KD, Farber NJ, Shinder B, Polotti CF, Milas LJ, Tunuguntla H. Management of postradical prostatectomy urinary incontinence: a review. Urology. 2018;113:13–9.
- van der Poel HG, de Blok W, Joshi N, van Muilekom E. Preservation of lateral prostatic fascia is associated with urine continence after robotic-assisted prostatectomy. Eur Urol. 2009;55:892–900.
- Aydin SA, Ozbas A. The effect of pelvic floor muscle training on incontinence problems after radical prostatectomy. Am J Mens Health. 2018;12:1007–15.
- Kitamura K, China T, Kanayama M, et al. Significant association between urethral length measured by magnetic resonance imaging and urinary continence recovery after robot-assisted radical prostatectomy. Prostate Int. 2019;7:54–9.
- Chien GW, Slezak JM, Harrison TN, et al. Health-related quality of life outcomes from a contemporary prostate cancer registry in a large diverse population. Bju Int. 2017;120:520–9.
- Del GF, Huang J, Li S, et al. Contemporary trends in the surgical management of urinary incontinence after radical prostatectomy in the United States. Prostate Cancer Prostatic Dis. 2022. https://doi.org/10.1038/s41391-022-00558-x.
- Parekh AR, Feng MI, Kirages D, Bremner H, Kaswick J, Aboseif S. The role of pelvic floor exercises on post-prostatectomy incontinence. J Urol. 2003;170:130–3.
- Pedriali FR, Gomes CS, Soares L, et al. Is pilates as effective as conventional pelvic floor muscle exercises in the conservative treatment of post-prostatectomy urinary incontinence? A randomised controlled trial. Neurourol Urodyn. 2016;35:615–21.
- Wu ML, Wang CS, Xiao Q, Peng CH, Zeng TY. The therapeutic effect of pelvic floor muscle exercise on urinary incontinence after radical prostatectomy: a meta-analysis. Asian J Androl. 2019;21:170–6.
- Hall LM, Aljuraifani R, Hodges PW. Design of programs to train pelvic floor muscles in men with urinary dysfunction: systematic review. Neurourol Urodyn. 2018;37:2053–87.
- Centemero A, Rigatti L, Giraudo D, et al. Preoperative pelvic floor muscle exercise for early continence after radical prostatectomy: a randomised controlled study. Eur Urol. 2010;57:1039–43.
- Jeong SJ, Yeon JS, Lee JK, et al. Development and validation of nomograms to predict the recovery of urinary continence after radical prostatectomy: comparisons between immediate, early, and late continence. World J Urol. 2014;32:437–44.
- Yoshida M, Matsunaga A, Igawa Y, et al. May perioperative ultrasound-guided pelvic floor muscle training promote early recovery of urinary continence after robot-assisted radical prostatectomy? Neurourol Urodyn. 2019;38:158–64.
- Matsunaga A, Yoshida M, Shinoda Y, et al. Effectiveness of ultrasound-guided pelvic floor muscle training in improving prolonged urinary incontinence after robot-assisted radical prostatectomy. Drug Discov Ther. 2022;16:37–42.
- Madill SJ, Pontbriand-Drolet S, Tang A, Dumoulin C. Changes in urethral sphincter size following rehabilitation in older women with stress urinary incontinence. Int Urogynecol J. 2015;26:277–83.
- Majoros A, Bach D, Keszthelyi A, Hamvas A, Romics I. Urinary incontinence and voiding dysfunction after radical retropubic prostatectomy (prospective urodynamic study). Neurourol Urodyn. 2006;25:2–7.
- Calace FP, Napolitano L, Arcaniolo D, et al. Micro-ultrasound in the diagnosis and staging of prostate and bladder cancer: a comprehensive review. Medicina. 2022. https://doi.org/10.3390/medicina58111624.
- Tuygun C, Imamoglu A, Keyik B, Alisir I, Yorubulut M. Significance of fibrosis around and/or at external urinary sphincter on pelvic magnetic resonance imaging in patients with postprostatectomy incontinence. Urology. 2006;68:1308–12.