Резюме
Предусловия
Определить, связаны ли трансректальное ультразвуковое исследование и упражнения на мышцы тазового дна под руководством уролога с восстановлением способности к немедленному, раннему и длительному удержанию мочеиспускания после радикальной простатэктомии.
Материалы и методы
В ретроспективное исследование были включены данные 114 пациентов с локализованным раком предстательной железы (РПЖ), которые прошли РП в Онкологическом госпитале Хэнань с ноября 2018 года по апрель 2021 года. Из 114 пациентов 50 пациентам из группы наблюдения проводили трансректальное ультразвуковое исследование и упражнения для мышц тазового дна УМТД под двойным руководством уролога, а 64 пациентам из контрольной группы проводили УМТД под вербальным руководством уролога. В группе наблюдения оценивали сократительную функцию наружного сфинктера уретры. В обеих группах оценивали показатели способности к немедленному, раннему и длительному удержанию мочи, а также анализировали факторы, влияющие на недержание мочи.
Результаты
Частота способности пациентов к удержанию мочеиспускания через 2 недели и 1, 3, 6 и 12 месяцев в группе наблюдения после РП была достоверно выше, чем в контрольной группе (52,0% против 29,7%, 70,0% против 39,1%, 82% против 57,8, 88% против 70,3%, 98,0 против 84,4%, р < 0,05). Сократительная функция наружного сфинктера уретры четко коррелировала с улучшением способности удержания мочеиспускания во время многократных визитов после РП, за исключением визита через 12 месяцев. С помощью логистического регрессионного анализа было подтверждено, что трансректальное ультразвуковое исследование и УМТД под двойным контролем уролога является независимым положительным фактором для улучшения возможности удержания мочеиспускания через 2 недели, 1, 3, 6 и 12 месяцев. Однако ТУРП была негативным фактором для послеоперационного недержания мочи в разные периоды времени.
Заключение
Трансректальное ультразвуковое исследование и УМТД под двойным контролем уролога играли значительную роль в улучшении способности к немедленному, раннему и длительному удержанию мочеиспускания после РП и действовали как независимый прогностический фактор.
Вступление
Рак предстательной железы (РПЖ), одно из самых распространенных онкологических заболеваний у мужчин, демонстрирует рост заболеваемости во всем мире, что частично связано со старением населения [1]. Хотя существует много методов лечения, таких как внешняя лучевая терапия (ВЛТ) с андрогенной депривацией (АД) и низкодозная брахитерапия (БТ) для локализованного РПЖ, радикальная простатэктомия (РП) все еще остается самым распространенным вариантом из-за ее хорошего влияния на контроль над опухолью [2]. Однако пациенты, перенесшие РП, могут столкнуться с различными осложнениями, включая недержание мочи, эректильную дисфункцию, кровянистый стул, никтурию, тревогу и депрессию, а также общую психическую и физическую дисфункцию, среди которых послеоперационное недержание мочи серьезно влияет на качество жизни и психологическую выносливость пациентов [3,4,5]. Со временем возможность удержания мочеиспускания постепенно восстанавливается. Большинство пациентов восстанавливают возможность удержания мочеиспускания через 12 месяцев после РП, тогда как лишь меньшинство пациентов достигают удовлетворительной немедленной и ранней возможности удержания мочеиспускания [6, 7]. Поэтому раннее восстановление послеоперационного недержания мочи должно быть вопросом первоочередной важности.
Ряд предоперационных, интраоперационных и послеоперационных факторов связаны с недержанием мочи после РП. Было продемонстрировано, что большая функциональная и перепончатая части мочеиспускательного канала и сохранение сосудисто-нервного пучка способствуют более раннему восстановлению возможности удержания мочеиспускания [8,9,10]. Однако с развитием хирургических технологий и роботизированной лапароскопической радикальной простатэктомии влияние самого хирургического вмешательства на недержание мочи уменьшилось [5]. Однако некоторые предоперационные факторы, такие как ожирение и сопутствующие заболевания, невозможно изменить за короткое время, и поэтому они не должны быть приоритетными в восстановлении послеоперационной способности удержания мочеиспускания [11]. Таким образом, восстановление послеоперационной возможности удержания мочеиспускания в основном зависит от послеоперационного лечения, включая модификацию диеты, тренировку мочевого пузыря, упражнения для мышц тазового дна (УМТД), биологическую обратную связь и функциональную электростимуляцию [12, 13]. Как показало предыдущее исследование, упражнения для мышц тазового дна, проведенные перед РП, могут иметь положительное влияние на скорость восстановления возможности удержания мочеиспускания через 3 месяца после операции [14].
Сообщалось, что недержание мочи у мужчин в основном связано с дееспособностью сфинктера, а также до- и послеоперационной функцией мочевого пузыря [15]. Примерно две трети случаев послеоперационного недержания мочи связаны с дисфункцией сфинктеров уретры, а другая треть – с одновременной дисфункцией мочевого пузыря и сфинктеров уретры. Есть два сфинктера на выходе из мочевого пузыря внешний и внутренний уретральные сфинктеры, которые обычно удаляются во время РП. Поэтому состояние наружного уретрального сфинктера, который часто является дисфункциональным из-за прямой травмы или повреждения нерва, тесно связано с послеоперационным восстановлением возможности удержания мочи [16]. Восстановление функции наружного уретрального сфинктера является ключевым шагом в восстановлении возможности удержания мочи после РП. Как неинвазивный метод лечения, УМТД является первым выбором для улучшения возможности удержания мочи после РП без побочных эффектов [17]. Однако значение УМТД для улучшения возможности удержания мочи после РП все еще остается противоречивым. Одной из распространенных проблем является то, что принципы УМТД, применяемые у мужчин, основываются на принципах, разработанных для женщин, что представляется проблематичным из-за различий в анатомии [12]. Кроме того, пока не существует никаких индексов для оценки эффекта УМТД.
Поэтому в данном исследовании мы имели целью оценить значение трансректального УЗИ и УМТД в улучшении возможности удержания мочи после РП и оценить роль послеоперационного состояния наружного уретрального сфинктера как биомаркера в прогнозировании недержания мочи.
Материалы и методы
Участники и структура исследования
В этом ретроспективном исследовании было проанализировано 114 пациентов с локализованным РПЖ, которые прошли РП в Онкологической больнице Хэнань с ноября 2018 года по апрель 2021 года. Кандидатами были пациенты, перенесшие лапароскопическую или роботизированную радикальную простатэктомию, за исключением тех, кто имел до операции недержание мочи, симптомы заболеваний нижних мочевых путей, нейрогенный мочевой пузырь и языковой барьер, вызывающий неспособность точно выразить свое мнение и пройти дальнейшее наблюдение. Всем пациентам во время операции выполняли одинаковую хирургическую процедуру. Все пациенты были ознакомлены с исследованием и подписали информированное согласие. Всех участников наблюдали через 2 недели, а также через 1, 3, 6 и 12 месяцев после РП. Недержание мочи оценивали с помощью устного опросника, как описано ранее [18]. “Отсутствие использования прокладок или подтекания мочи после удаления катетера” рассматривалось как восстановление недержания мочи. Это исследование было одобрено Комитетом по вопросам этики при Хэнаньской онкологической больнице.
114 пациентов были распределены на группы наблюдения и контрольную группу. Пациентам основной и контрольной групп УМТД начинали до и после РП соответственно. Послеоперационные УМТД проводили на 6-й день после РП, а катетер удаляли через 2 недели после РП. Перед УМТД 64 пациента контрольной группы получили устные рекомендации урологов, тогда как другие 50 пациентов группы наблюдения получили двойные указания с помощью трансректального ультразвукового исследования и от урологов. Демографические переменные и другие клинико-патологические характеристики приведены в таблице 1.
Таблица 1 Демографические и клинико-патологические показатели пациентов группы наблюдения и контрольной группы
| Переменные | Группа наблюдения (N = 50) | Контрольная группа (N = 64) | P value |
| Возраст (лет) | 67.5 ± 7.1 | 68.1 ± 5.7 | 0.665 |
| ИМТ (кг/м2) | 23.9 ± 2.4 | 24.2 ± 2.8 | 0.558 |
| ПСА (нг/мл) | 4.2 ± 7.4 | 5.9 ± 7.8 | 0.243 |
| Холестенон (ммоль/л) | 4.5 ± 1.1 | 4.6 ± 0.8 | 0.641 |
| Время выполнения РП (мин) | 226.9 ± 91.2 | 243.6 ± 86.1 | 0.319 |
| Интраоперационное кровотечение (мл) | 186.2 ± 104.1 | 196.6 ± 159.7 | 0.693 |
| Пребывание в больнице (дни) | 16.8 ± 7.7 | 18.3 ± 6.6 | 0.274 |
| Система оценивания по Глисону | |||
| ≤ 7 | 24 | 29 | 0.775 |
| ≧8 | 26 | 35 | |
| Неадъювантная терапия | 0.413 | ||
| Нет | 10 | 17 | |
| Да | 40 | 47 | |
| ТУРП | |||
| Нет | 39 | 49 | 0.856 |
| Да | 11 | 15 | |
| Гипертензия | |||
| Нет | 32 | 39 | 0.738 |
| Да | 18 | 25 | |
| Диабет | |||
| Нет | 37 | 50 | 0.607 |
| Да | 13 | 14 | |
| Операция | 0.433 | ||
| ЛРП | 31 | 35 | |
| РАРП | 19 | 29 | |
| Рассечение лимфоузлов | 0.369 | ||
| Нет | 18 | 18 | |
| Да | 32 | 46 | |
- Данные измерений выражены с помощью среднего значения ± СО и проанализированы с помощью t-критерия Стьюдента. Категориальные переменные определяли с помощью критерия Хи-квадрат
- ИМТ индекс массы тела, ПСА простатспецифический антиген, ТУРП трансуретральная резекция простаты, ЛРП лапароскопическая радикальная простатэктомия, РАРП робот-ассистированная радикальная простатэктомия
Трансректальное УЗИ и УМТД под двойным контролем уролога
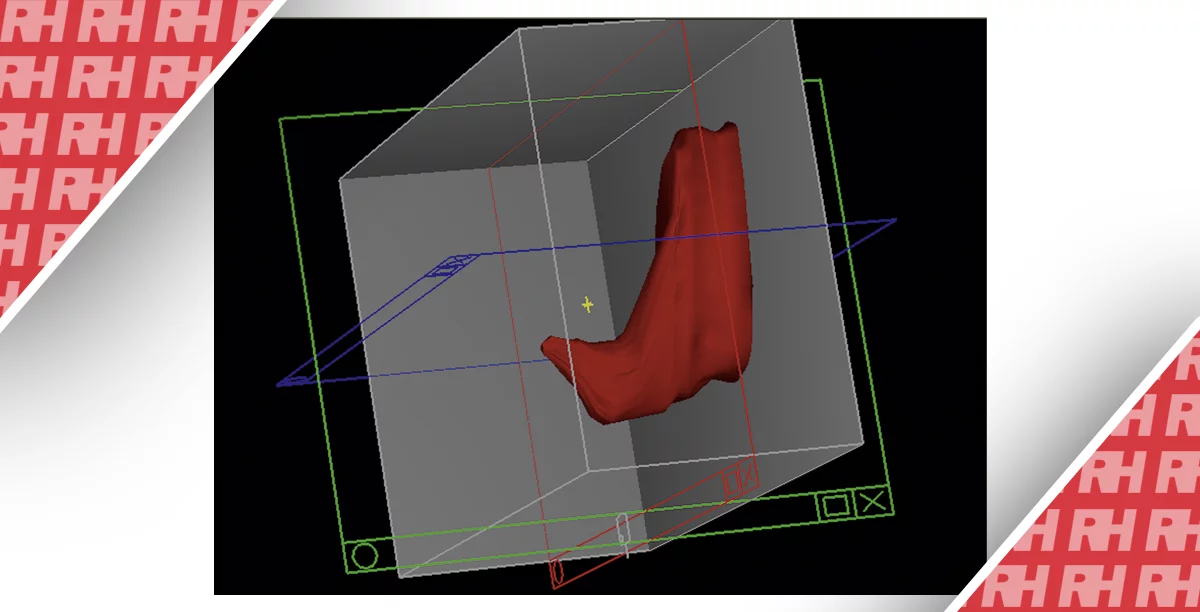
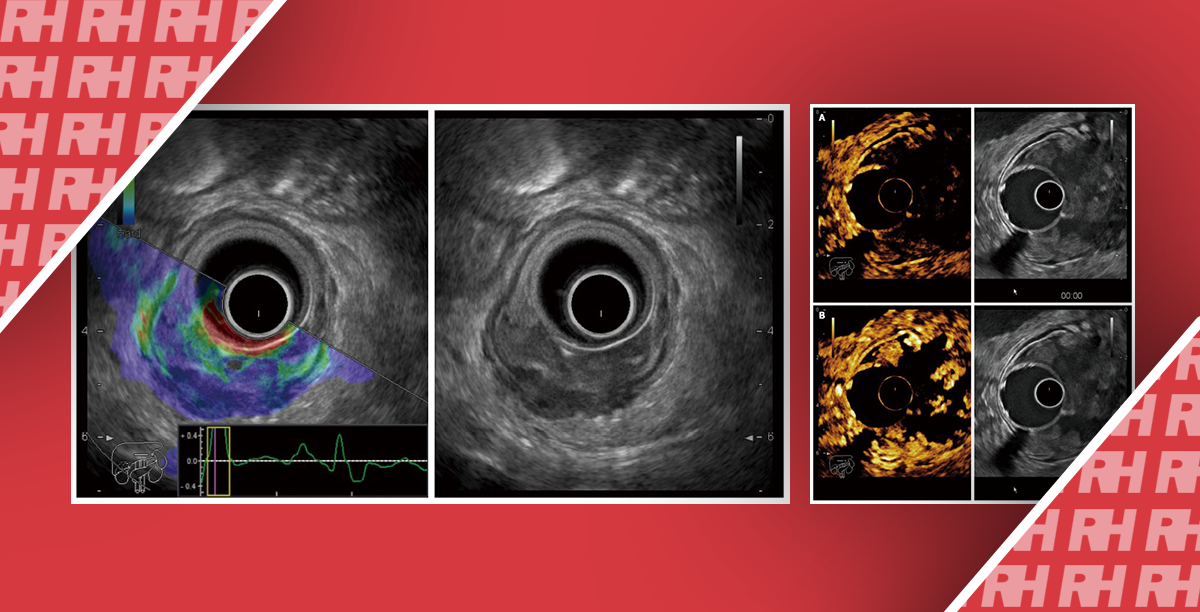
После подписания письменного согласия кандидаты в группе наблюдения были ознакомлены с программой трансректального ультразвукового исследования (ТУЗИ) и УМТД под двойным контролем уролога. Процедура заключалась в следующем: сначала трансректальное УЗИ использовалось для определения локализации наружного уретрального сфинктера (НУС). Когда пациентам выполняли УМТД, за сокращением НУС могли наблюдать урологи и пациенты через систему визуализации. Затем урологи проводили пальцевое ректальное обследование, чтобы почувствовать сокращение НУС и определить максимальное сокращение НУС, индуцированное УМТД. Наконец, пациенты должны были запомнить состояние и продолжать тренировку с использованием управляемой УМТД. Таким образом, пациенты достигали правильного выполнения УМТД.
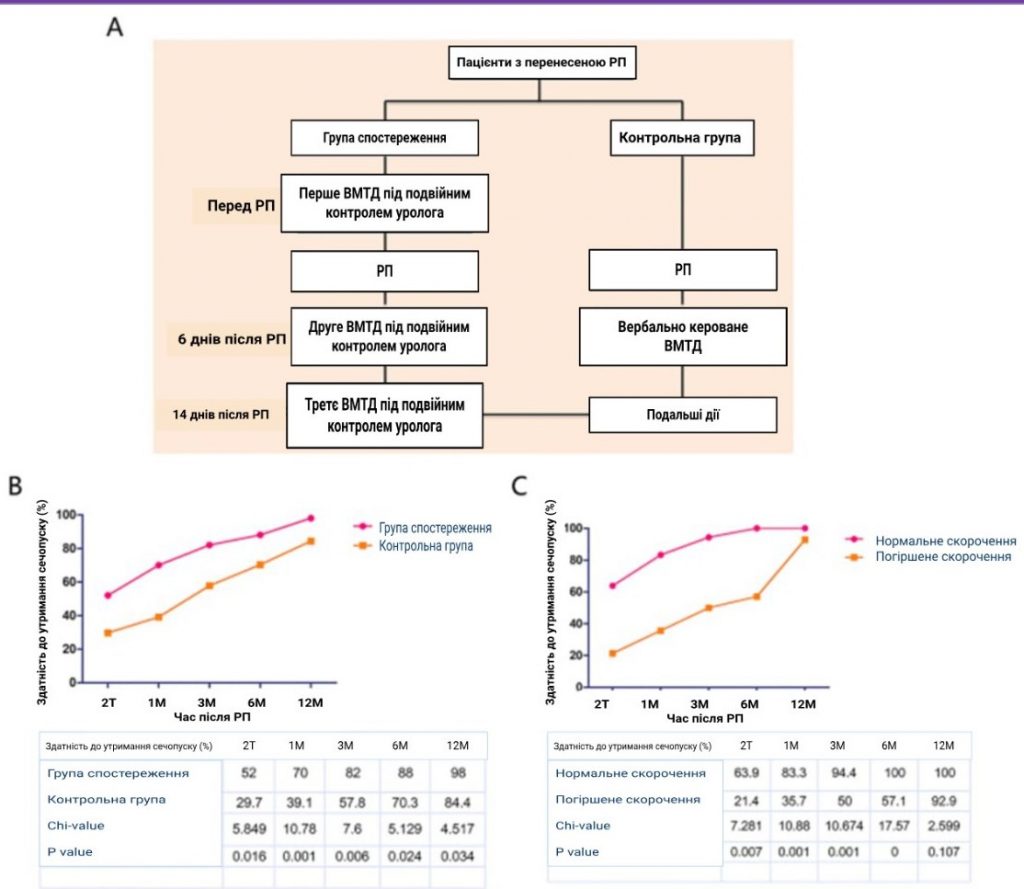
Структурная схема УМТД под двойным контролем уролога и вербально управляемой УМТД приведена на рисунке 1А. Перед РП пациентам группы наблюдения проводили первый сеанс УМТД под двойным контролем уролога. Через шесть дней после РП был проведен второй сеанс УМТД под двойным контролем уролога, и пациенты должны были начать выполнение УМТД. Третий сеанс УМТД под двойным контролем уролога проводился после удаления катетера на 14-й день. Пациенты контрольной группы начали выполнять УМТД на 6-й день после операции, получая только устные указания.
Рисунок 1
А: Была представлена структурная схема УМТД под двойным руководством уролога и вербально управляемой УМТД. Б: Мы оценивали частоту недержания мочи в 5 временных точках, включая 2 недели и 1, 3, 6 и 12 месяцев после РП соответственно. В обеих группах частота недержания мочи со временем возрастала. В: 2-недельный и 1-, 3-, 6- и 12-месячный показатели недержания мочи в группе с пониженным уровнем были очевидно ниже, чем в группе с нормальным уровнем (21,4% против 63,9%, 35,7% против 83,3, 50% против 94,4%, 57,1% против 100%, 92,9 против 100%).
Оценка сократительной функции НУС
В трех трансректальных ультразвуковых исследованиях оценивали амплитуду сокращения НУС, методика оценки описана ниже: 1. диаметр уретры в области под НУС определялся в расслабленном состоянии и записывался как d1, d2 и d3. 2. Пациентов попросили выполнить УМТД, после чего зафиксировали диаметр уретры (d1′, d2′ и d3′). 3. Разница между двумя измерениями (△1 = d1-d1′, △2 = d2-d2′, △3 = d3-d3′) использовалась для отображения амплитуды сокращения НУС. Сократительную функцию НУС оценивали по соотношению △3 к △1 и определяли как пониженную, если соотношение было меньше 0,8, и нормальную, если соотношение было больше 0,8.
Статистический анализ
Для анализа данных использовали SPSS 19.0 (SPSS Inc., Чикаго, Иллинойс, США) и GraphPad (Prism 5.0). Демографические и клинико-патологические переменные анализировали с помощью t-критерия Стьюдента и критерия хи-квадрат. Связь между характеристиками пациентов с недержанием мочи анализировали с помощью критерия Хи-квадрат. Логистический регрессионный анализ использовали для анализа прогностических факторов относительно послеоперационного недержания мочи. Значимым считали P <0,05.
Результаты
В этом исследовании мы оценивали частоту недержания мочи в 5 временных точках, включая 2 недели и 1, 3, 6 и 12 месяцев после РП. В обеих группах частота недержания мочи со временем возрастала (рисунок 1B). Статистический анализ показал, что через 2 недели, а также через 1, 3, 6 и 12 месяцев частота недержания мочи в группе наблюдения составила 52,0%, 70,0%, 82,0%, 88,0% и 98,0% соответственно, что было значительно выше, чем в контрольной группе (29,7%, 39,1%, 57,8%, 70,3% и 84,4% соответственно; все р < 0,05). Наши данные продемонстрировали, что УМТД под двойным контролем уролога способствовала появлению немедленной, ранней и долговременной возможности удержания мочеиспускания после РП.
Далее мы проанализировали взаимосвязь между сократительной функцией НУС и недержанием мочи в группе наблюдения. Как показано на рисунке 1С, 2-недельные и 1-, 3-, 6- и 12-месячные показатели возможности удержания мочи в группе со сниженной функцией были очевидно ниже, чем в группе с нормальной функцией (21,4% против 63,9%, 35,7% против 83,3, 50% против 94,4%, 57,1% против 100%, 92,9 против 100%, соответственно). Статистический анализ выявил достоверную корреляцию между сокращением наружного уретрального сфинктера и послеоперационным недержанием мочеиспускания во всех временных точках, кроме 12 месяцев.
Наконец, мы пытались определить факторы, которые влияют на способность к удержанию мочеиспускания после РП. Однофакторный логистический регрессионный анализ показал, что трансуретральная резекция простаты (ТУРП) и УМТД под двойным контролем уролога были взаимосвязанными факторами, влияющими на способность к удержанию мочеиспускания через 2 недели после РП (таблица 2). Возраст, ИМТ и другие переменные не имели значимой связи с возможность удержания мочеиспускания на второй неделе. Впоследствии мы проанализировали возраст, ИМТ, ПСА, холестенон, ТУРП и УМТД под двойным контролем уролога с помощью многофакторной логистической регрессионной модели. Многофакторный анализ показал, что ТУРП и УМТД под двойным контролем уролога были независимыми отрицательными и положительными независимыми факторами для способности к удержанию мочеиспускания на 2 недели соответственно (таблица 2), а также для способности к удержанию мочеиспускания через 1, 3, 6 и 12 месяцев (таблица 3). Эти данные продемонстрировали, что УМТД под двойным контролем уролога может быть положительным прогностическим фактором для немедленной, ранней и долговременной возможности удержания мочеиспускания.
Таблица 2 Логистический регрессионный анализ для возможности к удержанию мочеиспускания мочи через 2 недели после РП
| Факторы | Однофакторный анализ | Мультифакторный анализ | |||
| ОШ (95% ДИ) | P value | ОШ (95% ДИ) | P value | ||
| Возраст (лет) | 0.970 (0.914–1.030) | 0.327 | 0.956 (0.894–1.021) | 0.179 | |
| ИМТ (кг/м2) | 0.986 (0.835–1.139) | 0.844 | 0.984 (0.841–1.151) | 0.840 | |
| ПСА (нг/мл) | 0.967 (0.915–1.022) | 0.237 | 0.965 (0.906–1.027) | 0.265 | |
| Холестенон (ммоль/л) | 1.357 (0.907–2.031) | 0.138 | 1.437 (0.934–2.211) | 0.099 | |
| Время выполнения РП (мин) | 0.999 (0.995–1.003) | 0.659 | |||
| Интраоперационное кровотечение (мл) | 1.000 (0.997–1.003) | 0.906 | |||
| Пребывание в больнице | 0.950 (0.894–1.010) | 0.101 | |||
| Оценка по шкале Глисона | ≦7 против ≧8 | 0.736 (0.346–1.564) | 0.425 | 0.732 (0.324–1.652) | 0.453 |
| Неоадъювантная терапия | Нет против да | 1.144 (0.469–2.789) | 0.767 | ||
| ТУРП | Нет против да | 0.377 (0.138–1.029) | 0.057 | 0.293 (0.099–0.876) | 0.027 |
| Гипертензия | Нет против да | 0.858 (0.394–1.870) | 0.700 | ||
| Диабет | Нет против да | 0.569 (0.225–1.441) | 0.234 | ||
| Операция | ЛРП против РАРП | 1.008 (0.471–2.156) | 0.984 | ||
| Иссечение лимфатических узлов | Нет против да | 1.036 (0.461–2.328) | 0.931 | ||
| Указания | Нет против да | 2.566 (1.186–5.550) | 0.017 | 2.538 (1.124–5.732) | 0.025 |
Таблица 3 Множественная логистическая регрессия для возможности удержания мочеиспускания через 1, 3, 6 и 12 месяцев после РП
| Факторы | Однофакторный анализ | Мультифакторный анализ | |||
| ОШ (95% ДИ) | P value | ОШ (95% ДИ) | P value | ||
| Через 1 месяц | |||||
| ТУРП | Нет против да | 0.384 (0.154–0.956) | 0.04 | 0.301 (0.110–0.823) | 0.019 |
| Указания | Нет против да | 3.640 (1.658–7.989) | 0.001 | 3.872 (1.681–8.920) | 0.001 |
| Через 3 месяца | |||||
| Турп | Нет против да | 0.286 (0.115–0.710) | 0.007 | 0.212 (0.075–0.596) | 0.003 |
| Указания | Нет против да | 3.324 (1.385–7.979) | 0.007 | 3.560 (1.364–9.290) | 0.009 |
| Через 6 месяцев | |||||
| Турп | Нет против да | 0.329 (0.125–0.864) | 0.024 | 0.283 (0.099–0.807) | 0.018 |
| Указания | Нет против да | 3.096 (1.131–8.484) | 0.028 | 3.406 (1.158–10.019) | 0.026 |
| Через 12 месяцев | |||||
| Турп | Нет против да | 0.129 (0.034–0.487) | 0.002 | 0.087 (0.015–0.496) | 0.006 |
| Указания | Нет против да | 9.074 (1.120–73.487) | 0.039 | 17.186 (1.580–186.95) | 0.020 |
Обсуждение
Недержание мочи после РП является распространенным осложнением, которое имеет значительное негативное влияние на качество жизни пациентов и требует более тщательного ухода [19]. Ученые постоянно пытаются найти надежный способ уменьшить частоту возникновения недержания мочи после РП. Для лечения послеоперационного недержания мочи был принят ряд стратегий, включая УМТД и хирургические вмешательства [20]. Многочисленные исследования продемонстрировали, что УМТД является наиболее распространенным консервативным методом лечения послеоперационного недержания мочи [13,21,22,23]. Хотя принято считать, что сокращение МТД можно достичь после устных или письменных инструкций по проведению УМТД, до 50% пациентов не достигают эффективных сокращений после выполнения базовых инструкций [24]. Поэтому существует насущная необходимость в повышении эффективности УМТД и стандартизации инструкций.
В данном исследовании, основанном на исследованиях и практике, пациенты в группе УМТД, под двойным контролем уролога, достигли лучшего непрерывного мочеиспускания, чем пациенты в контрольной группе. Из 50 пациентов группы наблюдения 26 пациентов (52,0%) достигли возможности удержания мочеиспускания после удаления катетера (через 2 недели после РП), что было значительно выше, чем в контрольной группе (29,7%). Кроме того, показатели способности к удержанию мочеиспускания через 1, 3, 6 и 12 месяцев после РП в группе наблюдения были выше, чем в контрольной группе. Хотя в предыдущих исследованиях сообщалось о противоречивом влиянии УМТД на улучшение послеоперационной способности к удержанию мочеиспускания [24], наши данные продемонстрировали эффективное влияние УМТД под двойным контролем уролога на немедленное, раннее и долгосрочное восстановление способности удержания мочеиспускания после РП. Для улучшения послеоперационного восстановления способности удержания мочеиспускания применяли модифицированную УМТД. Centemero, A с соавт. инициировали УМТД перед РП и наблюдали улучшение способности к удержанию мочеиспускания по сравнению с послеоперационной УМТД [25]. Seong J. и соавт. разработали серию номограмм для прогнозирования восстановления возможности удержания мочеиспускания после РП и достигли значительного улучшения [26]. Сообщалось, что УМТД под контролем УЗИ улучшает не только раннее восстановление возможности удержания мочеиспускания с частотой 52,8% в течение 30 дней после РП, но и длительное недержание мочи, возникающее через > 1 года [27, 28]. По сравнению с этими исследованиями, наше исследование выявило хорошие показатели немедленного и раннего восстановления возможности удержания мочеиспускания при послеоперационной УМТД под двойным контролем уролога, а также позднего восстановления мочеиспускания. С помощью трансректального ультразвука мы четко наблюдали сокращение НУС и тренировали пациента максимально сокращать наружный сфинктер уретры с помощью цифрового ректального исследования во время УМТД, что свидетельствует о том, что правильное выполнение УМТД является чрезвычайно важным для восстановления возможности удерживать мочеиспускание после РП. Кроме того, правильная УМТД обеспечит долговременный эффект сохранения способности к удержанию мочеиспускания. Однако в этом ретроспективном исследовании существовало значительное расхождение во времени обучения УМТД в двух группах, и роль УМТД под двойным контролем уролога в улучшении восстановления удержания мочеиспускания после РП все еще требует дальнейшей проверки в проспективном исследовании, в котором было бы необходимым проведение синхронного выполнения УМТД.
Во время трансректального ультразвукового исследования измеряли максимальное сокращение НУС. Согласно сформулированным нами алгоритмам, сократительная функция НУС после УМТД была разделена на сниженную и нормальную. В когорте трансректального УЗИ и УМТД под двойным контролем уролога, 2-недельные, 1-месячные, 3-месячные, 6-месячные и 12-месячные показатели возможности удержания мочеиспускания в группе со сниженной функцией были очевидно ниже, чем в группе с нормальной функцией, что свидетельствует о том, что амплитуда сокращения НУС является многообещающим показателем для прогнозирования послеоперационного недержания мочи после РП. Stéphanie J. и соавт. сообщили, что толщина, площадь поперечного сечения и объем сфинктера уретры были увеличены у женщин после 12-недельной групповой реабилитации МТД [29], что было похоже на наше исследование. Сообщается, что > 90% пациентов с длительным недержанием мочи имеют нарушения НУС [30]. Таким образом, уменьшение сокращения после точной УМТД отражало возможность поражения НУС, что может потребовать других методов лечения. С помощью трансректального УЗИ выявить сокращение НУС было легко. В то же время, по сравнению с определением длины перепончатого отдела уретры с помощью МРТ, определение сокращения НУС с помощью УЗИ требовало меньших затрат. Кроме того, с применением микроультразвука в урологии оценка сокращения НУС в будущем будет более точной и легкой [31]. Однако, из-за ограниченного размера выборки в этом исследовании, этот метод оценки сокращения НУС требует большего размера выборки для дальнейшей верификации.
Наконец, мы провели анализ факторов, влияющих на непосредственное, раннее и долговременное недержание мочи после РП. Наши данные показали, что ТУРП и УМТД под двойным контролем уролога были взаимосвязанными факторами, влияющими на возможность удержания мочеиспускания через 2 недели, а также через 1, 3, 6 и 12 месяцев после РП. Предыдущие исследования подтвердили, что ТУРП оказывает негативное влияние на возможность удержания мочеиспускания, возможно, из-за фиброза периуретральных тканей, который может подавлять функцию НУС [32]. Поэтому поддержание целостности НУС и усиление тренировок НУС являются жизненно важными в периоперационном периоде. Было подтверждено, что УМТД под двойным контролем уролога является независимым фактором прогнозирования немедленного, раннего и долговременного улучшения способности к удержанию мочеиспускания, что частично объясняется быстрым и правильным восстановлением функции НУС при современной модели УМТД.
Таким образом, наши данные подтвердили эффективность УМТД под двойным контролем уролога в улучшении способности к удержанию мочеиспускания после РП и возможность использования сокращения НУС для прогнозирования удержания мочеиспускания. Кроме того, в данной модели не использовались вспомогательные устройства, а тренировка без оборудования проводилась до удаления мочевого катетера, что позволило улучшить показатель контроля мочеиспускания после удаления мочевого катетера.
В этом исследовании все же были некоторые недостатки. Во-первых, это было лишь ретроспективное одноцентровое исследование с небольшим размером выборки. Для дальнейшей проверки эффективности современной модели УМТД необходимы многоцентровые, широкомасштабные и проспективные исследования. Во-вторых, это исследование было сосредоточено только на восстановлении организма пациента и не включало оценку психологического статуса, который необходимо оценить в будущем.
Заключение
Трансректальное ультразвуковое исследование и УМТД под двойным контролем уролога играли значительную роль в улучшении немедленной, ранней и долговременной возможности удержания мочеиспускания после РП, а также выступали независимым прогностическим фактором.
Аббревиатуры
АД:
Андрогенная депривация
БТ:
Низкодозная брахитерапия
ВЛТ:
Внешняя лучевая терапия
НУС:
Наружный уретральный сфинктер
РП:
Рак простаты
УМТД:
Упражнения для мышц тазового дна
РП:
Радикальная простатэктомия
Ссылки на источники
- Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022. CA Cancer J Clin. 2022;72:7–33.
- Sandhu S, Moore CM, Chiong E, Beltran H, Bristow RG, Williams SG. Prostate cancer. Lancet. 2021;398:1075–90.
- Lane JA, Donovan JL, Young GJ, et al. Functional and quality of life outcomes of localised prostate cancer treatments (prostate testing for cancer and treatment [ProtecT] study). Bju Int. 2022. https://doi.org/10.1111/bju.15739.
- Lane A, Metcalfe C, Young GJ, et al. Patient-reported outcomes in the ProtecT randomized trial of clinically localized prostate cancer treatments: Study design, and baseline urinary, bowel and sexual function and quality of life. Bju Int. 2016;118:869–79.
- Wallerstedt A, Nyberg T, Carlsson S, et al. Quality of life after open radical prostatectomy compared with robot-assisted radical prostatectomy. Eur Urol Focus. 2019;5:389–98.
- Rajih E, Meskawi M, Alenizi AM, et al. Perioperative predictors for post-prostatectomy urinary incontinence in prostate cancer patients following robotic-assisted radical prostatectomy: long-term results of a Canadian prospective cohort. Can Urol Assoc J. 2019;13:E125–31.
- Li X, Zhang H, Jia Z, et al. Urinary continence outcomes of four years of follow-up and predictors of early and late urinary continence in patients undergoing robot-assisted radical prostatectomy. Bmc Urol. 2020;20:29.
- Cameron AP, Suskind AM, Neer C, et al. Functional and anatomical differences between continent and incontinent men post radical prostatectomy on urodynamics and 3T MRI: a pilot study. Neurourol Urodyn. 2015;34:527–32.
- Mendoza PJ, Stern JM, Li AY, et al. Pelvic anatomy on preoperative magnetic resonance imaging can predict early continence after robot-assisted radical prostatectomy. J Endourol. 2011;25:51–5.
- Nguyen L, Jhaveri J, Tewari A. Surgical technique to overcome anatomical shortcoming: balancing post-prostatectomy continence outcomes of urethral sphincter lengths on preoperative magnetic resonance imaging. J Urol. 2008;179:1907–11.
- Kretschmer A, Hubner W, Sandhu JS, Bauer RM. Evaluation and management of postprostatectomy incontinence: a systematic review of current literature. Eur Urol Focus. 2016;2:245–59.
- Hodges PW, Stafford RE, Hall L, et al. Reconsideration of pelvic floor muscle training to prevent and treat incontinence after radical prostatectomy. Urol Oncol. 2020;38:354–71.
- Goode PS, Burgio KL, Johnson TN, et al. Behavioral therapy with or without biofeedback and pelvic floor electrical stimulation for persistent postprostatectomy incontinence: a randomized controlled trial. JAMA. 2011;305:151–9.
- Chang JI, Lam V, Patel MI. Preoperative pelvic floor muscle exercise and postprostatectomy incontinence: a systematic review and meta-analysis. Eur Urol. 2016;69:460–7.
- Radadia KD, Farber NJ, Shinder B, Polotti CF, Milas LJ, Tunuguntla H. Management of postradical prostatectomy urinary incontinence: a review. Urology. 2018;113:13–9.
- van der Poel HG, de Blok W, Joshi N, van Muilekom E. Preservation of lateral prostatic fascia is associated with urine continence after robotic-assisted prostatectomy. Eur Urol. 2009;55:892–900.
- Aydin SA, Ozbas A. The effect of pelvic floor muscle training on incontinence problems after radical prostatectomy. Am J Mens Health. 2018;12:1007–15.
- Kitamura K, China T, Kanayama M, et al. Significant association between urethral length measured by magnetic resonance imaging and urinary continence recovery after robot-assisted radical prostatectomy. Prostate Int. 2019;7:54–9.
- Chien GW, Slezak JM, Harrison TN, et al. Health-related quality of life outcomes from a contemporary prostate cancer registry in a large diverse population. Bju Int. 2017;120:520–9.
- Del GF, Huang J, Li S, et al. Contemporary trends in the surgical management of urinary incontinence after radical prostatectomy in the United States. Prostate Cancer Prostatic Dis. 2022. https://doi.org/10.1038/s41391-022-00558-x.
- Parekh AR, Feng MI, Kirages D, Bremner H, Kaswick J, Aboseif S. The role of pelvic floor exercises on post-prostatectomy incontinence. J Urol. 2003;170:130–3.
- Pedriali FR, Gomes CS, Soares L, et al. Is pilates as effective as conventional pelvic floor muscle exercises in the conservative treatment of post-prostatectomy urinary incontinence? A randomised controlled trial. Neurourol Urodyn. 2016;35:615–21.
- Wu ML, Wang CS, Xiao Q, Peng CH, Zeng TY. The therapeutic effect of pelvic floor muscle exercise on urinary incontinence after radical prostatectomy: a meta-analysis. Asian J Androl. 2019;21:170–6.
- Hall LM, Aljuraifani R, Hodges PW. Design of programs to train pelvic floor muscles in men with urinary dysfunction: systematic review. Neurourol Urodyn. 2018;37:2053–87.
- Centemero A, Rigatti L, Giraudo D, et al. Preoperative pelvic floor muscle exercise for early continence after radical prostatectomy: a randomised controlled study. Eur Urol. 2010;57:1039–43.
- Jeong SJ, Yeon JS, Lee JK, et al. Development and validation of nomograms to predict the recovery of urinary continence after radical prostatectomy: comparisons between immediate, early, and late continence. World J Urol. 2014;32:437–44.
- Yoshida M, Matsunaga A, Igawa Y, et al. May perioperative ultrasound-guided pelvic floor muscle training promote early recovery of urinary continence after robot-assisted radical prostatectomy? Neurourol Urodyn. 2019;38:158–64.
- Matsunaga A, Yoshida M, Shinoda Y, et al. Effectiveness of ultrasound-guided pelvic floor muscle training in improving prolonged urinary incontinence after robot-assisted radical prostatectomy. Drug Discov Ther. 2022;16:37–42.
- Madill SJ, Pontbriand-Drolet S, Tang A, Dumoulin C. Changes in urethral sphincter size following rehabilitation in older women with stress urinary incontinence. Int Urogynecol J. 2015;26:277–83.
- Majoros A, Bach D, Keszthelyi A, Hamvas A, Romics I. Urinary incontinence and voiding dysfunction after radical retropubic prostatectomy (prospective urodynamic study). Neurourol Urodyn. 2006;25:2–7.
- Calace FP, Napolitano L, Arcaniolo D, et al. Micro-ultrasound in the diagnosis and staging of prostate and bladder cancer: a comprehensive review. Medicina. 2022. https://doi.org/10.3390/medicina58111624.
- Tuygun C, Imamoglu A, Keyik B, Alisir I, Yorubulut M. Significance of fibrosis around and/or at external urinary sphincter on pelvic magnetic resonance imaging in patients with postprostatectomy incontinence. Urology. 2006;68:1308–12.