Автори: P. Anfelter, A. Testa, V. Chiappa, W. Froyman, R. Fruscio, S. Guerriero, J. L. Alcazar, F. Mascillini, M. A. Pascual, M. Sibal, L. Savelli, G. F. Zannoni, D. Timmerman, E. Epstein
Зміст:
- Вступ
- Методи
- Результати
- Обговорення
Вступ
- Ціль
Злоякісні пухлини жовткового мішка (ПЖМ) зустрічаються рідко, і даних про їх морфологічний прояв при ультразвуковому дослідженні мало. Метою цього дослідження було описати ознаки злоякісних ПЖМ яєчників (пухлини ендодермального синуса) за допомогою напівтонового і кольорового доплерівського ультразвукового дослідження, щоб полегшити їх передопераційну діагностику і визначити, чи мають ці пухлини особливий вид.
- Основи
Епідеміологія
Пухлини яєчників зазвичай класифікуються як епітеліальні, неепітеліальні або метастатичні пухлини від іншого первинного злоякісного новоутворення.
Пухлини зародкових клітин є підгрупою в неепітеліальній групі і складають близько 15-20% всіх пухлин яєчників. Найпоширеніша пухлина серед пухлин статевих клітин – це доброякісна зріла тератома.
Пухлини ендодермального синуса, частіше звані ПЖМ, також є пухлинами статевих клітин, але є рідкісними і злоякісними. Інші пухлини статевих клітин – це дисгермінома, незріла злоякісна тератома, хоріокарцинома і ембріональна карцинома.
ПЖМ розвиваються з позаембріональних типів клітин і складають близько 1% всіх злоякісних новоутворень яєчників. Середній вік при зверненні становить 18-25 років, пухлина рідко буває двосторонньою, і більшість пухлин виявляється на ранній стадії. ПЖМ можуть виникати і лікуватися під час вагітності.
ПЖМ яєчників з’являються як в чистому вигляді, так і як частина змішаної герміногенної пухлини. У недавній серії випадків 51% (129/251) ПЖМ були представлені в чистому вигляді, а решта були змішаними.
За визначенням, змішані зародкові пухлини складаються з двох або більше типів злоякісних компонентів зародкових клітин. Найбільш поширена суміш дисгерміноми і ПЖМ; іншими відомими асоціаціями є ембріональна карцинома, хоріокарцинома або незріла тератома. Отже, в патологічному звіті ці випадки слід позначати як змішані зародкові пухлини, описуючи ступінь і відсоток всіх спостережуваних компонентів зародкових клітин.
Мікроскопія
Гістологічно ПЖМ багатогранна з безліччю особливостей. Найхарактернішою гістологічною особливістю ПЖМ є ретикулярна клубочко-подібна структура, яка змусила Шиллера описати пухлини в 1939 р як мезонефричного походження. У 1959 р Teilum переглянув цей опис і встановив позазародкове походження з зародкових клітин. Teilum назвав пухлини пухлинами ендодермального синуса через їх схожість з ендодермальними синусами в плаценті щура. Пізніше був прийнятий термін ПЖМ, і обидва терміни досі широко використовуються.
Подібність ПЖМ з ендодермальним синусом пов’язана з наявністю структур, званих тільцями Шиллера – Дюваля, які складаються з вистилаючих центральних кровоносних судин шаром кубовидних або стовпчастих клітин.
Тільця Шиллера – Дюваля – це поперечні перетини папілярних утворень в ретикулярному лабіринті (зобр. 1). Тільця Шиллера – Дюваля, якщо вони присутні, є діагностичною ознакою ПЖМ, але виявляється, що вони є переважаючим компонентом тільки в 20% випадків. Коли сітчастий, клубочкообразний візерунок зливається, його міжпапілярні простори можуть створювати мікрокістозний вид. Помітні внутрішньоклітинні і позаклітинні краплі гіаліну присутні у всіх пухлинах. Гістологічна різноманітність ПЖМ іноді може ускладнити їх діагностику, оскільки вони можуть імітувати інші пухлини, такі як гепатоїдна карцинома і світлоклітинна карцинома.
Зображення 1: Гістологічні зрізи пухлини жовткового мішка, що показують огляд ретикулярної структури з множинними тільцями Шиллера-Дюваля (а) і крупним планом тільця Шиллера-Дюваля (стрілка) (б).
Макроскопія
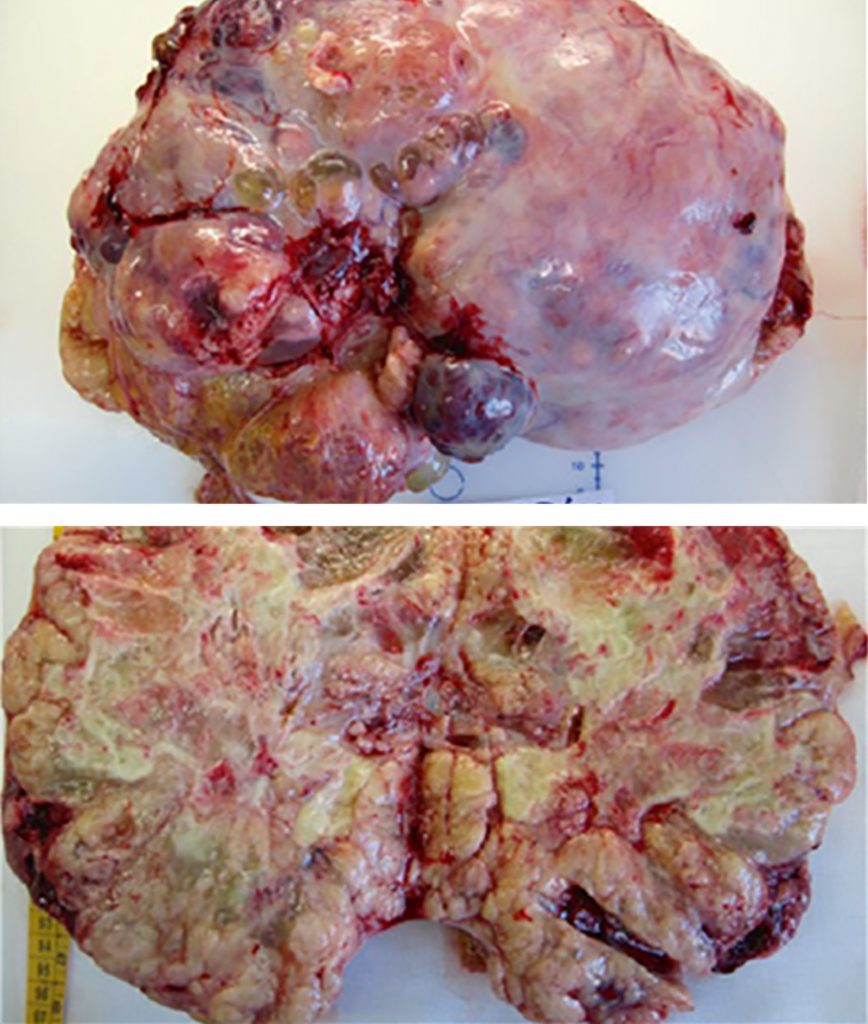
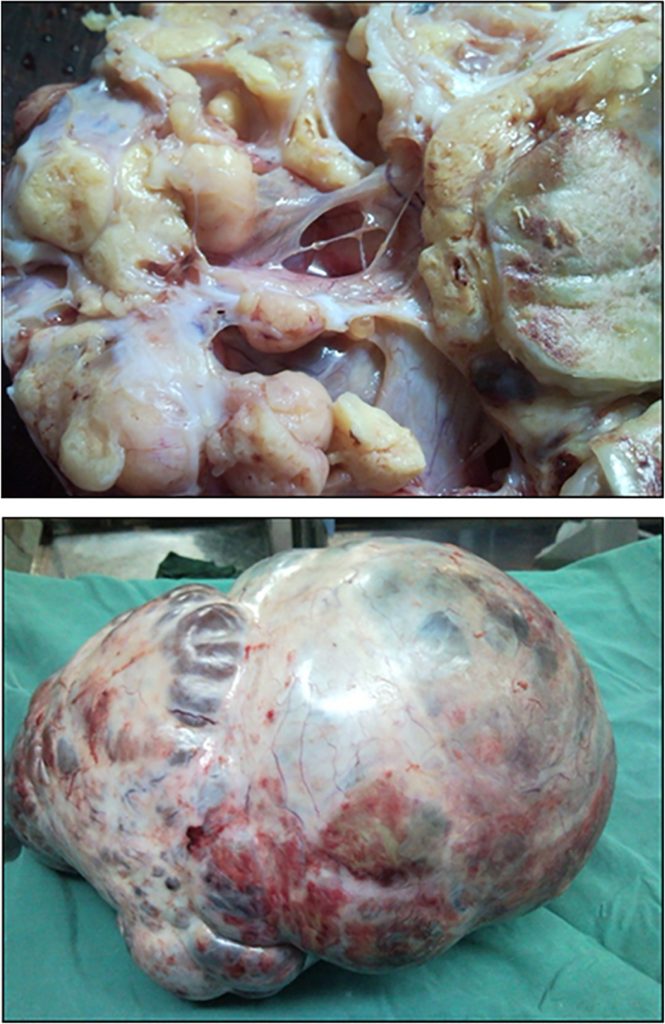
Розміри ПЖМ яєчників варіюють від 5 до 50 см³. Зовнішня поверхня пухлини здається гладенькою, з розрізом від жовтувато-коричневого до жовто-сірого. ПЖМ – це в основному солідні пухлини з кістозними компонентами, і ці кістозні компоненти мають діаметр від декількох мм до 2 см (Зобр. 2 і 3). Іноді спостерігається більш кістозне переродження, що складається з крововиливів і некрозу.
Зображення 2: Загальний вигляд солідної пухлини жовткового мішка яєчника.
Зображення 3: Макро вид мультилокулярної солідної пухлини жовткового мішка яєчника.
Клінічні особливості та прогноз
Найбільш частим симптомом ПЖМ яєчників є біль в животі з подальшим збільшенням живота. Тривалість симптомів часто буває короткою через швидке зростання. Близько 10% пацієнтів поступають з гострим животом в результаті перекручення, кровотечі або розриву пухлини.
Іншими симптомами можуть бути жар, аномальна вагінальна кровотеча або асцит. Сироватковий AFP (S-AFP) є корисним маркером, оскільки підвищені рівні S-AFP присутні майже в 100% випадків, хоча підвищені рівні можуть також бути присутнім в інших пухлинах зародкових клітин. Більш того, рівні S-AFP може використовуватися для оцінки ефекту лікування і виявлення рецидиву. Також може бути присутнім підвищений рівень СА 125 (S-СА 125) в сироватці.
Незважаючи на високу злоякісність, ПЖМ ефективно лікуються комбінацією хірургічного втручання і хіміотерапії. До введення платинової терапії прогноз був песимістичним: 3-річна виживаність становила 13%. Сучасні схеми лікування BEP (блеоміцин, етопозид, цисплатин) поліпшили 5-річну виживаність у жінок з ПЖМ до нинішніх показників 94,8%, 97,1%, 70,9% і 51,6% за даними Міжнародної федерації гінекології і акушерства ( FIGO) пухлин I, II, III і IV стадії відповідно.
Методи
Співробітники IOTA (International Ovarian Tumor Analysis) були запрошені взяти участь в цьому ретроспективному дослідженні. Ми витягли випадки з гістологічним діагнозом ПЖМ яєчників з бази даних IOTA і попросили центри надати зображення і додаткові клінічні і сонографічні дані. Ми також попросили співробітників IOTA виконати пошук в своїх файлах пацієнтів, на локальних робочих станціях з зображеннями і в системах архівування та передачі зображень (PAC) на предмет додаткових випадків. Критерії включення: передопераційне трансвагінальне УЗД з докладною документацією у вигляді архівних зображень, відеороликів або докладного звіту УЗД. Десять центрів УЗД внесли в дослідження 21 випадок: Болонья (n = 3); Барселона (n = 3); Рим (n = 3); Монца (n = 3); Мілан (Національний інститут раку; n = 1); Бангалор (n = 2); Кальярі (n = 1); Левен (n = 1); Наварра (n = 2); і Стокгольм (n = 2). Жінок з досліджень IOTA обстежили в період з 1999 по 2016 рік, а жінок, досліджених поза протоколом IOTA, обстежили в період з 2007 по 2017 рік.
Всі пацієнти були обстежені до операції за допомогою трансвагінального ультразвукового дослідження (при необхідності доповненого трансабдомінальним скануванням) з використанням стандартної методики дослідження. Всі фахівці з ультразвукового обстеження мали досвід роботи в гінекологічній ультразвуковій діагностиці більше 10 років, і обстеження проводилися з використанням високоякісного ультразвукового устаткування. Частота внутрішньовагінальних датчиків варіювала від 5,0 до 9,0 МГц, а частота абдомінальних датчиків – від 3,5 до 9,0 МГц.
Були зареєстровані остаточна гістологія, ступінь пухлини і стадія FIGO. Крім того, ми попросили дослідників повідомити про онкомаркери (S-CA 125, S-AFP і β-хоріонічний гонадотропін людини (β-ХГЛ)) під час постановки діагнозу, якщо вони будуть проаналізовані. Новоутворення були описані з використанням термінів і визначень, опублікованих консорціумом IOTA.
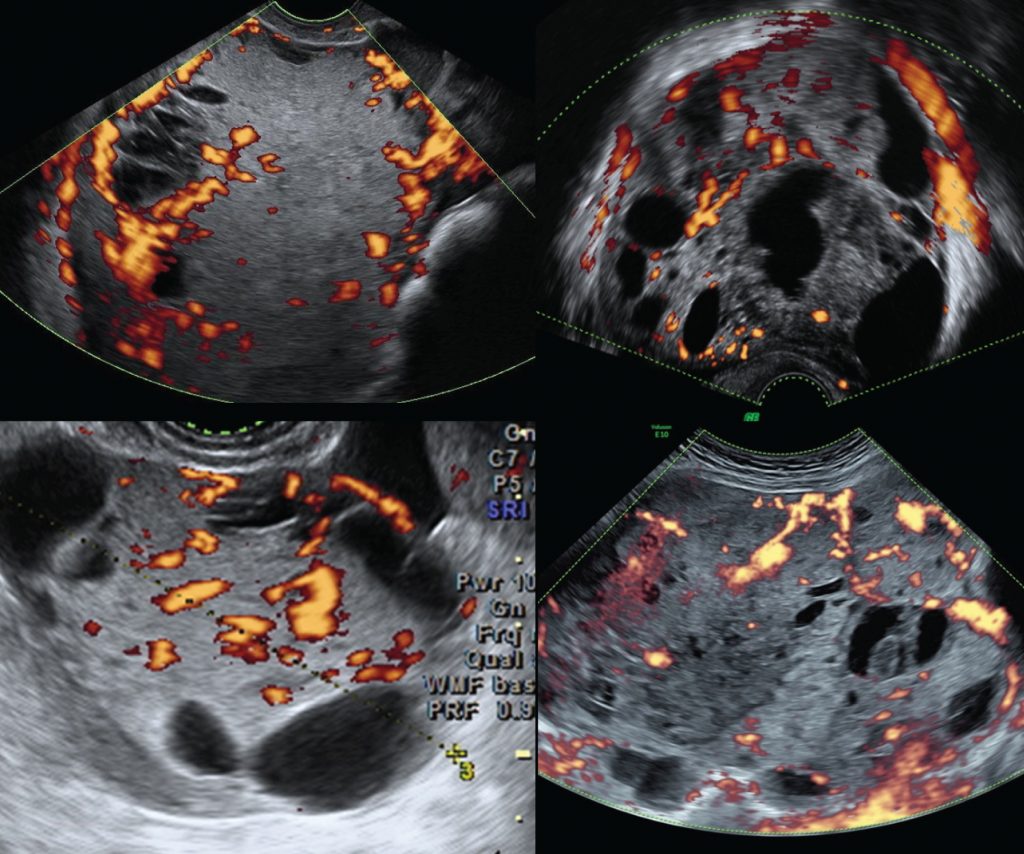
Васкуляризація пухлин за допомогою кольорового доплера описувалася з використанням кольорової шкали IOTA:
- кровотік не виявляється (1);
- мінімальний кровотік (2);
- помірний кровотік (3);
- рясний кровотік (4).
У випадках з двосторонніми пухлинами, відповідно до термінів і визначень IOTA, включалася тільки найбільша пухлина (якщо вона схожа на вигляд) або пухлина з найбільш розвиненою патологією. Був записаний конкретний діагноз, запропонований початковим дослідником УЗД в базі даних IOTA або в початковому звіті УЗД.
Результати
21 пацієнтка з гістологічним діагнозом ПЖМ яєчників була ідентифікована і включена в це дослідження. Всі випадки були чистими ПЖМ, за винятком одного (20/21), який представляв собою змішану пухлину з зародкових клітин, що складається з 80% ПЖМ і 20% ембріональної карциноми. 10 (48%) пацієнток раніше були включені в дослідження IOTA, а решта 11 були ідентифіковані з місцевих клінічних баз даних і баз даних зображень.
Середній вік становив 25,0 (IQR, 19,5-30,5) років, 76% (16/21) жінок були не родили і 76% (16/21) мали пухлину I – II стадії за класифікацією FIGO.
Рівень S-AFP був підвищений в 95% випадків, а рівень S-CA 125 був підвищений в 75% випадків. Рівень β-ХГЛ було виміряно в 11 випадках і не був підвищений ні в одному з них. У однієї жінки в анамнезі була серозна прикордонна пухлина яєчників.
Огляд ультразвукових характеристик показаний в таблиці 1.
| Характеристика | Значення |
| Первинний огляд | |
| Біль при огляді | 11/19 (58) |
| Найбільший діаметр пухлини (мм) | 157 (107–181) |
| Максимальний діаметр твердого компонента (мм) | 110 (66–159) |
| Односторонній | 20 (95) |
| Тип пухлини | |
|
|
|
|
| Кількість локул | |
|
5 (24) |
|
5 (24) |
|
11 (52) |
| Папілярні вирости | 2 (10) |
| Нерівне ураження | 19 (90) |
| Ехогенність рідини | |
|
5 (24) |
|
6 (29) |
|
2 (10) |
|
4 (19) |
|
4 (19) |
| Кольорова гама | |
|
1 (5) |
|
0 (0) |
|
10 (48) |
|
10 (48) |
| Знак півмісяця яєчника | 1 (5) |
| Затемнення | 0 (0) |
| Асцит | 8 (38) |
| Видно метастази | 3 (14) |
| Діагноз, запропонований лікарем УЗД | |
|
0 (0) |
|
1 (5) |
|
0 (0) |
|
5 (24) |
|
15 (71) |
| Огляд зображень і відеороликів | |
| Гіперехогенна-солідна тканина | |
|
16/18 (89) |
|
2/18 (11) |
Зображення 4: Типові результати кольорового доплера для чотирьох різних пухлин жовткового мішка яєчника.
18 випадків із зображеннями і / або відеокліпами достатньої якості були повторно оцінені суб’єктивно двома спостерігачами (P.A. і E.E.). Два спостерігача, які оцінювали ультразвукові зображення погодилися з наступним описом:
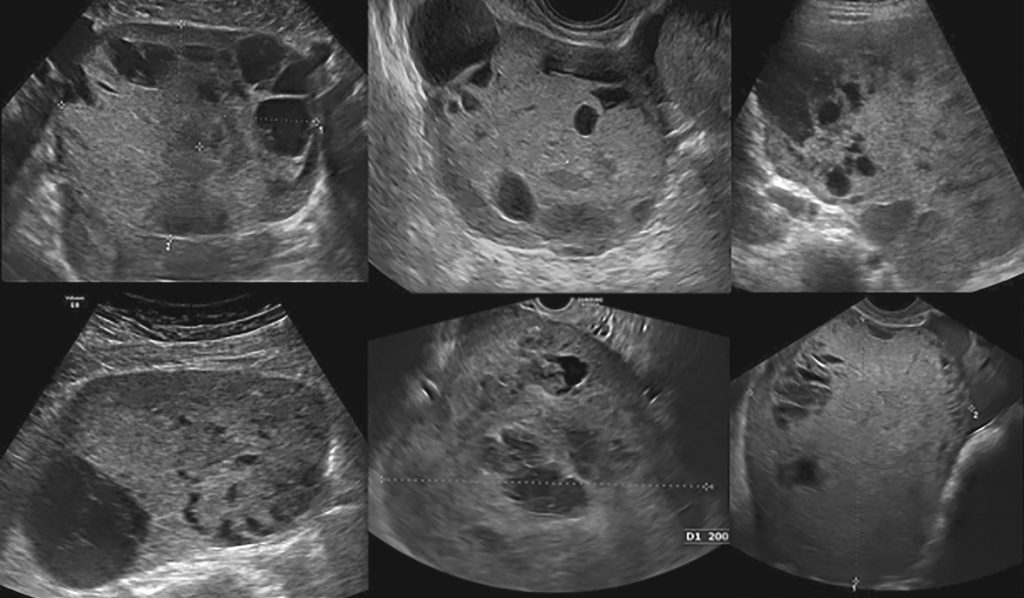
“Пухлини були класифіковані як солідні (малюнки 2 та 5) або мультилокулярні-солідні (малюнки 3 і 6). Більшість (16/18; 89%) пухлин мали негомогенну, але все ж дрібнозернисту і злегка гіперехогенну тверду тканину; в солідних пухлинах це призвело до появи місячної поверхні.”
Ультразвукові зображення двох випадків з сосочковими проекціями показані на зображенні 7. Два випадки без гіперехогенної твердої тканини були мультилокулярними солідними пухлинами з> 10 локул (зображення 8). Мультилокулярні солідні пухлини нагадували інші типи мультилокулярних солідних пухлин, наприклад, гранульозно-клітинну пухлину з видом швейцарського сиру.
Зображення 5: Ультразвукові зображення шести різних солідних пухлин жовткового мішка яєчника.
Зображення 6: Ультразвукові зображення шести різних мультилокулярно-солідних пухлин жовткового мішка яєчника.
Зображення 7: Ультразвукові зображення двох пухлин жовткового мішка яєчника з сосочковими виступами.
Зображення 8: Ультразвукові зображення двох пухлин жовткового мішка яєчника без гіперехогенної твердої тканини.
Обговорення
На УЗД злоякісні ПЖМ яєчників є односторонні, великі, добре васкуляризовані, багатоточкові, тверді або солідні ураження.
Наскільки нам відомо, це перше дослідження, яке описує трансвагінальний сонографічний прояв ПЖМ. Сильною стороною цього дослідження є те, що всі, крім одного випадку, мали чистий випадок ПЖМ, що робить наші сонографичні дані репрезентативними для цього конкретного гістологічного об’єкта. Обмеженнями є невеликий розмір вибірки, ретроспективний дизайн дослідження і в деяких випадках відсутність зображень оптимальної якості. Ці факти могли обмежувати можливість опису всіх варіацій і особливостей ПЖМ, що в деяких випадках також призводило до відсутності клінічної інформації про S-AFP і S-CA 125.
У цій серії, в порівнянні з попередніми дослідженнями, вік (медіана, 25 років проти 18-25 років) і частота пухлин стадії I – II по FIGO (76% проти 38-70%) були в верхньому діапазоні. Одним з пояснень трохи вищого середнього віку в цій серії може бути те, що ПЖМ часто присутні в педіатричній популяції і управляються педіатрами, при цьому трансвагінальне ультразвукове дослідження зазвичай не проводиться, хоча трансректальне ультразвукове дослідження може бути цінним варіантом.
Значно підвищені рівні S-AFP (медіана, 4755 мкг / л) і S-CA 125 (медіана, 126 kU / л) в цьому дослідженні узгоджуються з результатами інших досліджень. Більшість пацієнтів повідомляли про біль під час обстеження. Біль, ймовірно, викликаний або швидким ростом пухлини, що призводить до некрозу, або великим розміром пухлини.
Ми знаємо, що ПЖМ можуть бути присутніми разом з іншими доброякісними або злоякісними пухлинами зародкових клітин в змішаній формі приблизно в 50% випадків. Ультразвукові характеристики чистих ПЖМ можуть не збігатися з ультразвуковими характеристиками змішаних ПЖМ.
Поєднання сонографічних характеристик з клінічною інформацією (наприклад, віком, симптомами) і онкомаркерів може дати ключ до найбільш вірогідного діагнозу. Сонографічний вид може визначати, які пухлинні маркери слід оцінювати, щоб відрізнити неепітеліальні пухлини від епітеліальних, а також підказувати конкретний діагноз; наприклад, дисгерміноми можуть проявлятися підвищеним рівнем ЛДГ і β-ХГЛ, пухлинами гранульозних клітин з підвищеним рівнем естрогену і інгибину, пухлинами клітин Сертолі-Лейдіга з підвищеним рівнем тестостерону або андостендіону, незрілою тератомою з підвищеним рівнем АФП і СА 19-920 і ПЖМ з підвищеним рівнем АФП.