Фіброз є основною характеристикою більшості хронічних захворювань печінки. ASQ – це нове багатообіцяюче програмне забезпечення, яке дає перспективні результати для діагностики цирозу і фіброзу печінки.
Резюме. Метою нашого дослідження була оцінка діагностичної точності програмного забезпечення acoustic structure quantification (ASQ) для визначення ступеня фіброзу печінки у порівнянні з Fibroscan і біопсією.
Матеріали та методи. Сімдесяти семи пацієнтам із хронічним вірусним гепатитом B і С провели ультразвукове дослідження (УЗД), Fibroscan та біопсію печінки. Проводили ASQ аналіз досліджуваної ділянки (ДД) на кожному зображенні, обчислювали моду, середнє статистичне число і стандартне відхилення. Цю методику розробили за допомогою попереднього обстеження 20 здорових добровольців.
Результати. Площа, обмежена ROC-кривою (AUROC) і віссю частки хибних позитивних класифікацій, для діагнозу цироз (F≥4) при ASQ становила 0,77, в той час, як для діагнозу будь-якого ступеня фіброзу (F≥1) – 0,71. AUROC для діагнозу цироз (F≥4) за допомогою Fibroscan становила 0,98, а для діагнозу будь-якого ступеня фіброзу (F≥1) – 0,94. Різниця між AUROC була статистично значима (p <0,05).
Висновки. ASQ – це нове багатообіцяюче програмне забезпечення, яке дає перспективні результати для діагностики цирозу (F = 4) і фіброзу (F≥1) печінки. Однак, на сьогоднішній день, воно не досягло такої діагностичної цінності, як Fibroscan.
ВСТУП. Фіброз є основною характеристикою більшості хронічних захворювань печінки. Оцінка ступеня фіброзу необхідна для вибору лікування пацієнтів з хронічними захворюваннями печінки. Біопсія печінки вважається золотим стандартом для оцінки фіброзу. Однак, це інвазивна, дорога процедура, яка може стати причиною ускладнень, також на діагностичну точність можуть впливати помилки при заборі зразків і варіабельність суб’єктивної експертної оцінки. Необхідно зауважити, що за допомогою біопсії можна оцінити всього лише 1 / 50,000 частину всієї паренхіми печінки і при неправильному заборі матеріалу можна недооцінити ступінь фіброзу. Тому, біопсія печінки непідходящий метод для діагностики та загального скринінгу населення. У зв’язку з чим, необхідний розвиток неінвазивних, точних і однорідних тестів для діагностики та оцінки ступеня фіброзу.
Транзієнтна еластографія (Fibroscan, Echosens, Paris, France) без сумнівів є діагностичним методом, котрий найчастіше використовується. Fibroscan використовує ультразвуковий імпульс для оцінки паренхімної реакції шляхом реєстрації зворотного ехо, і таким чином дозволяє виміряти жорсткість тканини печінки в кПа, що є непрямим показником її фіброзу. Недавно, були запропоновані сучасні технології для неінвазивної діагностики та класифікації фіброзу печінки. Вони засновані на магнітно-резонансній томографії (МРТ): МРТ з подвійним контрастом, МР еластографія, дифузно зважені зображення (diffusion-weighted imaging- DWI), і перфузійна МРТ; та УЗД : ARFI (Siemens, Erlangen, Germany), еластографія в реальному часі (real-time tissue elastography- RTE) (Hitachi Medical Systems Europe, Zurich, Switzerland), акустичний кількісний аналіз структур (ASQ) (Toshiba Medical Systems, Osaka, Japan).
Метою нашого дослідження була оцінка діагностичної точності, чутливості та специфічності сонографічного програмного забезпечення ASQ для визначення ступеня фіброзу печінки у пацієнтів із хронічним вірусним гепатитом В (HBV) або С (HCV), у порівнянні з Fibroscan.
МАТЕРІАЛИ ТА МЕТОДИ
Попереднє оцінювання
З червня по липень 2010 року, ми відібрали 20 здорових добровольців віком від 27 до 42 років (середній вік 35 років; 9 чоловіків і 11 жінок). Всі підписали форму інформованої згоди. Добровольців відбирали за такими критеріями: відсутність в анамнезі дифузного або фокального захворювання печінки, результати лабораторної діагностики в межах норми (аспартатамінотрансфераза (АсАТ), аланінамінотрансфераза (АлАТ), гамма-глутамінтрансфераза (ГГТ), білірубінемія, міжнародне нормалізоване відношення (МНВ), сироватковий альбумін, холінестераза, негативні anti-HCV, HCV-РНК (РНК), антигени до вірусного гепатиту В (HBsAg) і HBV- дезоксирибонуклеїнова кислота (ДНК)) і звичайне ультразвукове дослідження (УЗД). Всім добровольцям провели звичайне абдомінальне УЗД і ASQ зі спеціальним обладнанням і конвексним датчиком 7-5 МГц (Aplio XG, Toshiba Medical Systems, Osaka, Japan) для визначення найкращого акустичного вікна при оцінці з ASQ.
Ми зробили захоплення зображень за допомогою правого підреберного доступу на рівні 7-8 сегмента, одне в аксіальній площині та інше в сагітальній площині, і два знімки лівої частки печінки (ортогонально один до одного, аксіально і сагіттально). Подальша обробка даних (raw data) за допомогою інтегрованого програмного забезпечення показала, що краща ASQ оцінка з низькою кількістю неправильних вимірів була на рівні 7-8 сегмента при аксіальному доступі, в той час, як дані отримані при інших скануваннях не дали таких же результатів.
Насправді, праві сегменти мають більш чисті ділянки паренхіми, де відсутні судинні структури (судини, які візуалізуються під час звичайного УЗД), і периваскулярна сполучна тканина. За даними Toyoda et al. такі структури можуть впливати на мінливість результатів. Крім того, під-час затримки дихання, права доля стає більш доступною для обстеження і захоплення матеріалу. Також, обстеження зроблені на цьому рівні краще корелюють із результатами біопсії печінки та Fibroscan, котрі теж проводяться в 7-8 сегментах.
Сканування селезінки проводилось в позиції пацієнта лежачи на правому боці, що дозволило отримати зображення у поздовжній осі. Всі отримані зображення аналізувалися за допомогою ASQ, виділяючи одну ДД, яка включала найширшу частину паренхіми вільної від васкулярних структур. Далі вираховували моду, середнє статистичне число та стандартне відхилення (СО). ДД розміщувалася на глибині 4-6 см залежно від розмірів печінки, як описано в літературі, ділянка повинна бути віддалена від фіброзної капсули печінки (глісонова капсула).
До того як визначити ДД, ми звіряли дані параметричного картування, щоб переконатися в тому, що вона охоплює таку частину паренхіми печінки, яка характеризує її ехоструктуру в цілому. Крім зображень у відтінках сірого, ASQ дає можливість отримати кольорові знімки, засновані на розподілі ехо-амплітуд, розсіюванні, тобто відхиленні ультразвукових хвиль різними структурами. На підставі червоно-зеленої шкали, високі значення см2 (статистичний параметр отриманий при розподілі ехо-амплітуд) позначаються червоним кольором, а низькі значення см2 зеленим кольором.
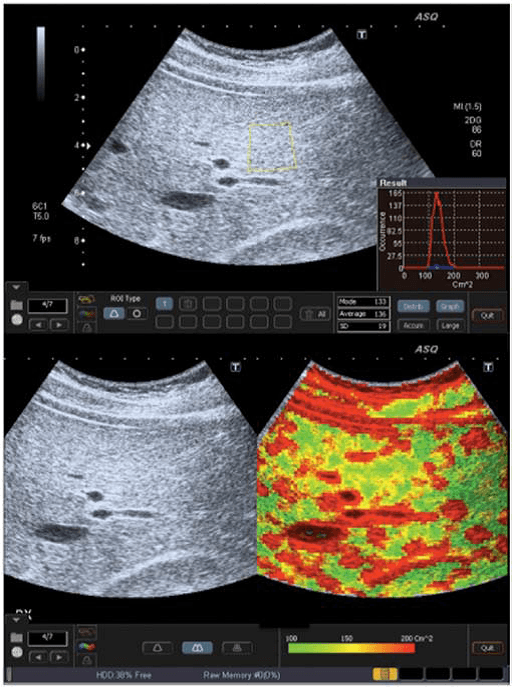
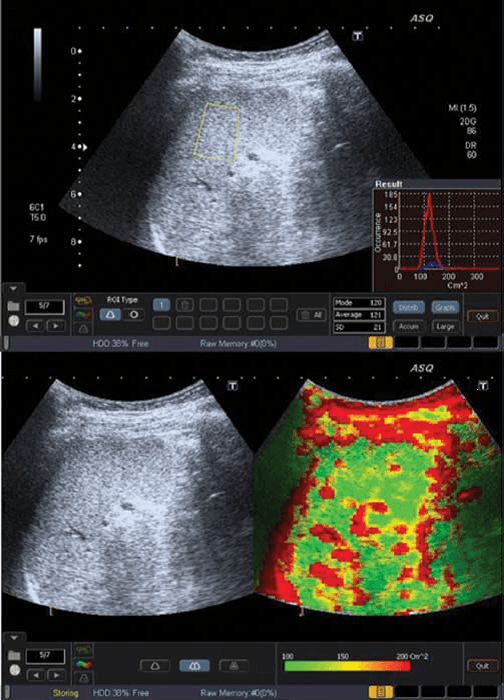
Рис. 1. ASQ обстеження пацієнта з F0 ступенем фіброзу печінки (відсутність фіброзу). a – ASQ знімок правої частки печінки, з позначеною ДД. У нижньому правому куті – гістограма (см2) середнє статистичне значення – 120; b – субкостальна проекція без і з ASQ колірним картуванням. В паренхімі низьке значення см2 (переважно зелений колір), що є ознакою гомогенної паренхіми. Судинні структури печінки позначені червоним кольором (високі значення см2).
При фіброзі, розсіювання збільшується прямо пропорційно до спотворення паренхіми і судинної архітектури. Таким чином, ASQ сканограма відображає високі значення см2, і як результат, збільшення ділянок червоного кольору навколо судин і фіброзу (Рис. 4b). З іншого боку, у пацієнтів зі стеатозом печінки збільшується кількість жирних кислот в гепатоцитах, і це відповідає поступовому зменшенню розсіювання між паренхімою і судинами, що призводить до низьких значень щільності і збільшення кількості зеленого кольору при картуванні (Рис. 1b).
Таблиця 1. Лабораторні параметри у 77 пацієнтів із захворюваннями печінки.
|
Параметр |
Значення (середнє статистичне число ± стандартне відхилення) |
| АсАТ (од/л) |
62,2±51,4 |
| АлАТ (од/л) |
78,1±65,3 |
| Холінестераза (UI/мл) |
8120±1987 |
| Загальний білірубін (мг/дл) |
0,58±0,7 |
| Лужна фосфатаза (од/л) |
126,6±57,3 |
| ГГТ (од/л) |
42,8±52 |
| Альбуміни (г/л) |
3,8±0,7 |
| Загальний холестерин (мг/дл) |
168±41 |
| ЛПНЩ (мг/дл) |
92±33 |
| Тригліцериди (мг/дл) |
101,1±83,9 |
| Глюкоза крові (мг/дл) |
92±10 |
| Тромбоцити (х103/л) |
232±58 |
| МНО |
1,04±0,2 |
| Фібриноген (мг/дл) |
232,9±58,3 |
АсАТ – аспартатамінотрансфераза; АлАТ – аланінамінотрансфераза; ГГТ – гамма-глутамінтрансфераза; ЛПНЩ – ліпопротеїни низької щільності; МНО – міжнародне нормалізоване відношення.
ПРОТОКОЛ ДОСЛІДЖЕННЯ ТА ОЦІНКА БІОПСІЇ
З вересня 2010 р. по червень 2011 р. було відібрано 77 пацієнтів (43 чоловіка і 34 жінки; віковий діапазон 27-75 років, середній вік 59 років) з вірусним гепатитом В або С, з показами для проведення біопсії печінки (Таблиця 1). Із 77 пацієнтів, 69 класифікували, як клас А по Чайлду-П’ю, вісім як клас В. Всім пацієнтам провели стандартне абдомінальне УЗД, ASQ зі спеціальним обладнанням і конвексним датчиком 7-5 МГц (Aplio XG – Toshiba Medical Systems, Osaka, Japan), Fibroscan та біопсію печінки протягом одного тижня. Оцінка біоптату вважалася золотим стандартом діагностичного протоколу.
Таблиця 2. Шкала Ishak для визначення ступеня фіброза.
| Гістологічні ознаки | Індекс |
| Фіброзу немає |
0 |
| Поширення фіброзу на деякі портальні тракти ± короткі фіброзні септи |
1 |
| Поширення фіброзу на більшість портальних трактів ± короткі фіброзні септи |
2 |
| Поширення фіброзу на більшість портальних трактів і поодинокі порто-портальні септи |
3 |
| Поширення фіброзу на портальні тракти з множинними порто-портальними і порто-центральними септами |
4 |
| Виражений мостоподібний фіброз з поодинокими вузлами |
5 |
| Цироз |
6 |
Обстеження печінки проводили за допомогою програмного забезпечення ASQ, відповідно до результатів попереднього дослідження здорових добровольців, з аксіальним доступом на рівні 7-8 сегментів. Селезінку оцінювали по поздовжній осі в положенні пацієнта лежачи на правому боці. Подальше позиціювання ДД на отриманих зображеннях вибиралося за такими критеріями: широка ділянка паренхіми, вільна від великих васкулярних структур. Далі обчислювали моду, середнє статистичне число і стандартне відхилення. ДД позиціонували на глибині 4-6 см, залежно від розмірів органа. Протягом семи днів пацієнтам проводили транзієнтну еластографію (Fibroscan) і біопсію печінки. Вимірювання за допомогою Fibroscan проводили на рівні правої частки печінки в міжреберному доступі у положенні пацієнтів лежачи на спині. Середнє значення 10 захоплень, виражене в кПа, вважалося показником жорсткості (щільності) тканини печінки. Обстеження з показником успішності вище 60% і інтерквартальним діапазоном менше 25% отриманих серединних значень, вважалося достовірним. Біопсію проводив гепатолог під УЗ контролем на рівні 8 сегмента правої частки, де відсутні магістральні судини. Забір матеріалу робили перкутанним доступом голкою 16 калібру. Отримані зразки обробляли формаліном, після чого фарбували гематоксиліном та еозином. Всі біоптати печінки оцінював досвідчений патолог. Ступінь печінкового некрозапалення (necroinflammation) і фіброзу оцінювали за шкалою Ishak (таблиця 2). При проведенні Fibroscan, фіброз оцінювали за шкалою METAVIR. Шкалу переведення одиниць використовували для розподілу пацієнтів на чотири групи, об’єднуючи пацієнтів зі ступенем фіброзу F1 та F2 (METAVIR) у групу 2 (Таблиця 3).
Таблиця 3. Таблиця переведення одиниць для розподілу пацієнтів на чотири групи
| Ishak | METAVIR | Групи |
| F0-F1 | F0 (відсутність фіброзу) | 1=F0 (n=28) |
| F2 | F1 (м’який фіброз) | 2=F1-F2 (n=18) |
| F3 | F2 (помірний фіброз) | – |
| F4 | F3 (виражений фіброз) | 3=F3 (n=14) |
| F5-F6 | F4 (цироз) | 4=F4 (n=17) |
І нарешті, статистичний аналіз був проведений за допомогою SPSS version 19.0 software (SPSS Inc, Chicago, IL) і R version 2.4.1. software (R Foundation, Vienna, Austria).
АКУСТИЧНИЙ КІЛЬКІСНИЙ АНАЛІЗ СТРУКТУР
ASQ – це сонографічне програмне забезпечення, яке дає можливість робити якісний (ASQ сканограма) і кількісний (статистичний аналіз) аналіз для визначення ступеня фіброзу печінки. Це програмне забезпечення використовує фізичний принцип, згідно з яким, ультразвуковий промінь, генерований ультразвуковим датчиком, проходить крізь тканини зі специфічною швидкістю і довжиною хвилі. Розсіювання і відхилення/відображення ультразвукової хвилі визначається акустичним опором тканин.
При нормальних умовах (відсутність макромолекулярних спотворень), розсіювання ультразвукових хвиль мінімальне або відсутнє, але воно збільшується, коли змінюється архітектоніка паренхіми органу, як при фіброзі печінки. ASQ аналізує спекл (speckle) артефакт, викликаний розсіюванням під час проникнення через різні тканини. Спекл представлений множинними пікселями в сірих тонах і аналізується, як сирі/не оброблені дані (raw data). ASQ вимірює різницю (см2) між теоретичним розподілом ехо-амплітуд, який отриманий шляхом статистичного аналізу Хі-квадрат (результат визначення середньостатистичної кількості спеклів у здорових людей) і реальним розподілом ехо-амплітуд, які були зареєстровані в даному дослідженні. Оператор відзначає ДД, де проводитимуться виміри, на сірошкальному зображенні.
FIBROSCAN
Транзієнтна еластографія, також відома як Fibroscan, є неінвазивним методом, який вимірює жорсткість тканини печінки в кПа. Система складається з ультразвукового датчика з вібратором. Вібратор створює вібрації, які передаються тканинам печінки, виробляючи в ній еластичну хвилю.
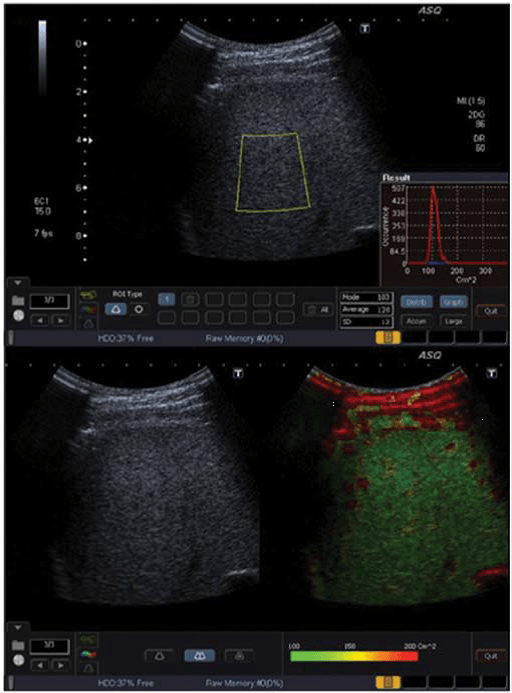
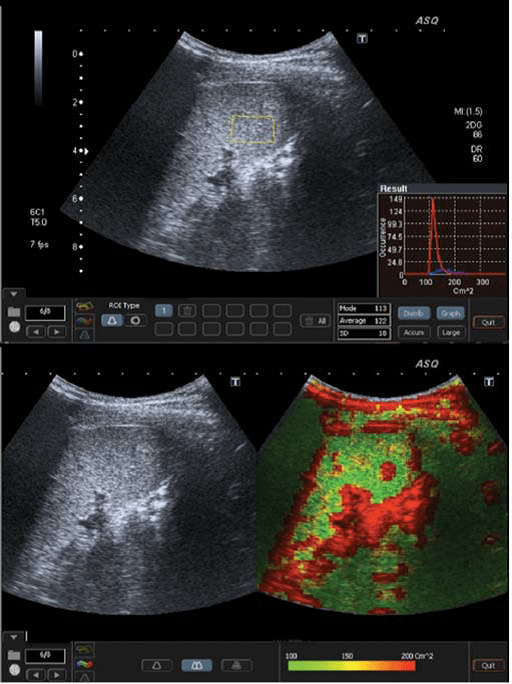
Рис. 2. ASQ обстеження пацієнта з F1-F2, права доля. Для ASQ немає чіткого порогового значення (cut-off value) між F1 та F2. а – гістограма (см2) трохи ширша, із середнім значенням см2 – 136. b – ASQ сканограма показує деяке збільшення судин (жовті, червоні кольори).
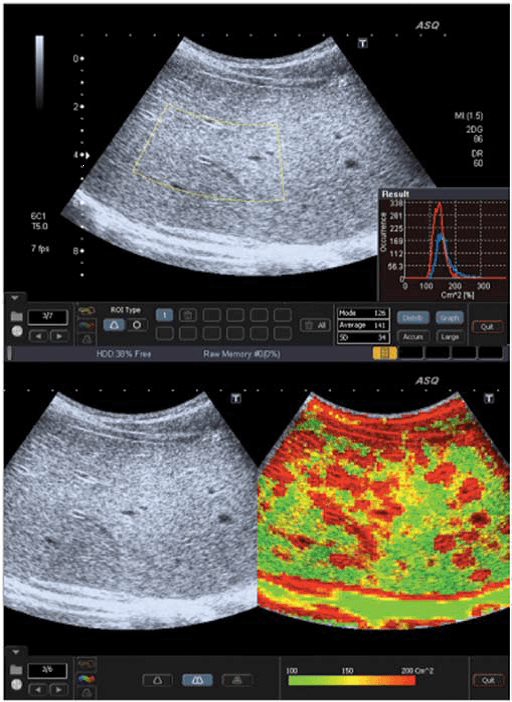
Рис. 3. ASQ обстеження пацієнта з F3 стадією, права доля. а – широка гістограма (см2), із середньостатистичним значенням – 141, показує негомогенність паренхіми. b – ASQ сканограма показує високі значення см2, і відповідно, збільшення червоного кольору, що є типовою ознакою вираженого фіброзу.
Одночасно, ультразвуковий датчик реєструє поширення еластичних хвиль і вимірює їх швидкість, що прямо пропорційно до еластичності тканини [6].
РЕЗУЛЬТАТИ
Двадцять здорових пацієнтів добровольців відібрали в контрольну групу. Пацієнтів із захворюваннями печінки згрупували на підставі біопсії в наступні групи: 1 група – 28 пацієнтів із F0 (Рис. 1); 2 група – 18 із F1 і F2 (Рис. 2); 3 група – 14 із F3 (Рис. 3) і 4 група – 17 із F4 (Рис. 4). Середньостатистичні значення ASQ аналізу печінки та селезінки (Рис. 5 і 6), Fibroscan вимірювання печінки для кожної групи зазначенні в таблиці 4.
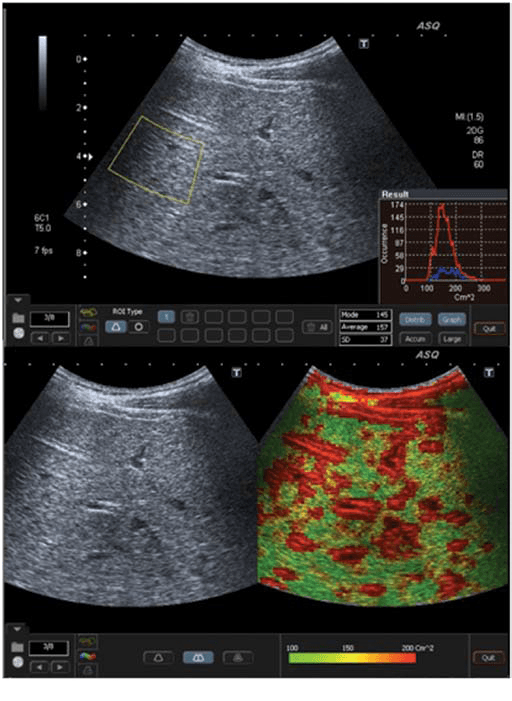
Рис. 4. ASQ обстеження пацієнта з F4 стадією (цироз), права доля. а – середньостатистичне значення см2 було дуже високе – 157, гістограма була дуже широкою і мала неправильну форму. b – ASQ сканограма показує дуже високі значення см2, тому домінує червоний колір з негомогенним розподілом, як типова ознака цирозу.
Рис. 5. ASQ обстеження пацієнта контрольної групи. a – ASQ ультразвуковий знімок паренхіми селезінки, із зазначеною ДД. Гістограма см2 показана в нижньому правому куті, середньостатистичне значення см2 – 121. b – підреберний вигляд селезінки з ASQ і без. Паренхіма має низькі значення см2, тому домінує зелений колір, що характерно для гомогенної тканини, в той час, як периваскулярні зони незначно червоні (вищі значення см2).
СТАТИСТИЧНИЙ АНАЛІЗ
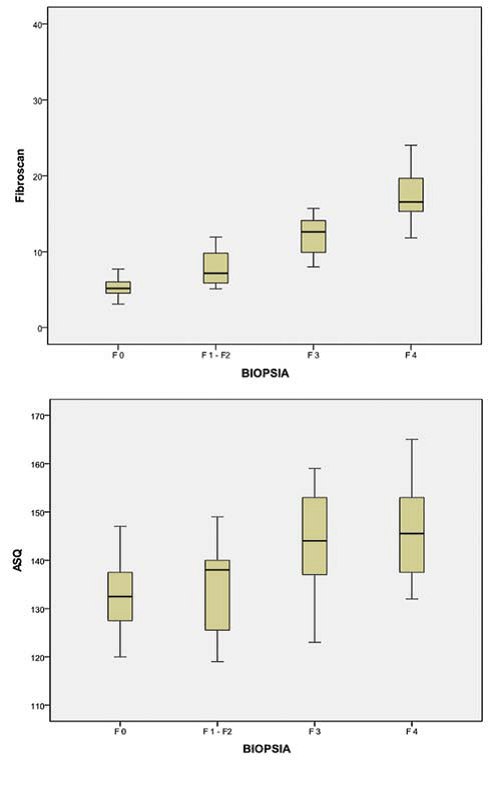
Статистичні відмінності серед чотирьох груп пацієнтів із захворюваннями печінки оцінювалися коефіцієнтом рангової кореляції Спірмена (Рис. 7). У пацієнтів із хронічними захворюваннями печінки, середньостатистичні значення см2 (Рис. 7а) мали значну статистичну кореляцію ступеня фіброзу (коефіцієнт Спірмена ρ = 0,56; р <0,01). У цих пацієнтів, дані Fibroscan корелювали із ступенем фіброзу (коефіцієнт Спірмена ρ = 0,88; р <0,01) (Рис. 7b).
Вивчаючи площі, обмежені ROC-кривими, які були статистично значимі (р<0,05), оцінювали діагностичну точність ASQ порівняно з Fibroscan у визначенні ступеня фіброзу печінки.
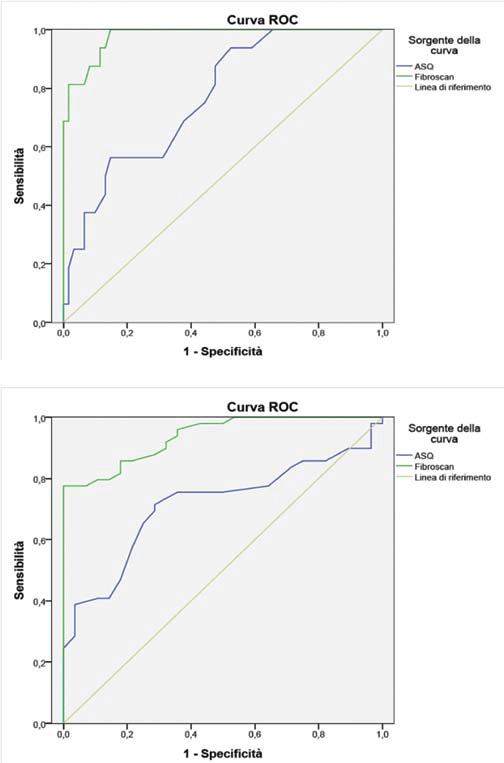
Площа, обмежена ROC-кривою, для діагнозу цироз (F ≥ 4) при ASQ становила 0,77 (95% довірчий інтервал 0,65-0,89), із мінімальним середньостатистичним значенням – 138 см2, що дозволяло виставити діагноз цироз (рис. 8а). Якщо враховувати цю інформацію, то чутливість і специфічність діагностики цирозу печінки складали 68,8% і 62,3%, відповідно. Площа обмежена ROC-кривою для діагнозу цироз (F ≥ 4) при транзієнтній еластографії становила 0,98 (95% довірчий інтервал 0,95-1), із мінімальною щільністю тканини – 12,2 кПа, що дозволяло виставити діагноз цироз (рис. 8а). При цьому чутливість і специфічність діагностики цирозу печінки складали 93,8% і 88,5%, відповідно.
Площа, обмежена ROC-кривою, для будь-якого ступеня фіброзу (F≥1), порівняно з його відсутністю (F = 0), при ASQ була 0,71 (95% довірчий інтервал 0,60-0,83), із мінімальним середньостатистичним значенням – 135 см2, для можливості постановки діагнозу фіброз (Рис. 8b). Чутливість і специфічність діагностики фіброзу печінки складали 71,4% і 71,4%, відповідно. Площа, обмежена ROC-кривою, для будь-якого ступеня фіброзу (F≥1), порівняно з його відсутністю (F = 0), при транзієнтній еластографії була 0,94 (95% довірчий інтервал 0,89-0,99), із мінімальним середньостатистичним значенням – 6,25 кПа, для можливості постановки діагнозу фіброз (Рис. 8b). Чутливість і специфічність діагностики фіброзу печінки складали 85,7% і 82,1%, відповідно.
Рис. 6. ASQ обстеження пацієнта групи F4 (цироз). a – ASQ ультразвуковий знімок паренхіми селезінки, із зазначеною ДД. Гістограма см2 наведена в нижньому правому куті, середньостатистичне значення см2 – 122. b – ASQ сканограма показує зелений колір для гомогенної паренхіми селезінки з жовтими і червоними плямами (вищі значення см2).
ОБГОВОРЕННЯ
Гістологічна оцінка біоптатів є єдиним прийнятим методом для визначення фіброзу печінки. Тим не менше, він інвазивний, і може викликати ускладнення. На діагностичну точність біопсії печінки можуть впливати помилки при заборі матеріалу у зв’язку з неправильним розподілом уражень печінки, і варіабельністю результатів серед дослідників. Необхідно зауважити, що біопсія здатна оцінити всього лише 1/50,000 частину всієї паренхіми печінки. Ці недоліки біопсії можуть привести до недооцінки фіброзу, особливо якщо біоптат маленький або фрагментований. Виходячи з цього, біопсія не підходящий метод для достовірної діагностики і моніторингу населення.
Таблиця 4. Розмах і середньостатистичні значення, отримані при ASQ вимірі печінки та селезінки, і при вимірюванні печінки з Fibroscan.
| Група | ASQ печінки (см2) | ASQ селезінки (см2) | Fibroscan (кПа) |
| Контрольна група | 126 (113-144) | 116 (108-126) | Не оцінювали |
| 1 (F0) | 132 (120-147) | 117 (111-128) | 5,2 (3,1-7,7) |
| 2 (F1-F2) | 134 (119-149) | 115 (106-129) | 7,8 (5,1-11,9) |
| 3 (F3) | 142 (123-159) | 119 (110-127) | 12 (8-15,7) |
| 4 (F4) | 146 (132-165) | 120 (112-130) | 18 (11,8-32) |
Рис. 7. Коробчата діаграма показує різницю у середньостатистичних значеннях см2 (a) і кПа (b), зареєстрованих у чотирьох групах. Групи пацієнтів відрізнялися один від одного зростаючими ступенями фіброзу (F0-F4), представленими на горизонтальній осі, а середньостатистичні значення см2 (a) та кПа (b) представлені на вертикальній осі. Жовта коробка показує значення між першою та третьою квартилями для кожної групи, а чорна вертикальна лінія зображує співвідношення максимального значення до мінімального. Чорна горизонтальна лінія показує середньостатистичне значення.
Рис. 8. а – ROC-крива для діагнозу цироз (F≥4) при ASQ (синя) і Fibroscan (зелена); b – ROC-крива для діагнозу фіброз (F≥1) при ASQ (синя) і Fibroscan (зелена).
З вищезгаданих причин, за останні роки почали розробку нових неінвазивних методів діагностики фіброзу печінки. Ми в даній роботі описали різні еластографічні методики для визначення жорсткості печінки. Транзієнтна еластографія (Fibroscan) – це неінвазивний метод, який став дуже популярним за останні роки. Його поглиблене дослідження показало, що він володіє гарною кореляцією, відносною специфічністю і чутливістю, порівняно з біопсією печінки, особливо у випадках фіброзу, що пов’язаний з HBV/HCV.
Точність Fibroscan вирахували мета-аналізом, який визначив чутливість і специфічність діагностики фіброзу 70% і 84%, відповідно. У тій же роботі, точність встановлення цирозу печінки була більшою, з 87% чутливістю і 91% специфічністю. Не дивлячись на те, що Fibroscan високоточний метод, він має свої недоліки, найбільш наочний із них – труднощі визначення проміжних ступенів фіброзу.
Серед інших недоліків те, що Fibroscan одновимірний метод, який не здатний вибірково обстежити найпридатніші ділянки паренхіми печінки. Більше того, зв’язок зі гістологічним ступенем активності некрозапалення у пацієнтів із хронічним вірусним гепатитом досі є спірним питанням. Виконання обстеження пацієнтів із ожирінням і людей з вузькими міжреберними проміжками дуже складне, і неможливе у пацієнтів із асцитом.
Дослідницькі роботи більше зосереджені на МРТ і УЗ, особливо на еластографічних методиках. Багато з них, засновані на МРТ, застосовувалися для оцінки фіброзу печінки. Деякі з них, засновані на використанні контрастної речовини (МРТ з подвійним контрастом і перфузійна МРТ). Серед методів МРТ, які не використовують контрастні речовини, найважливіші – МР еластографія і дифузно зважені зображення (diffusion-weighted imaging- DWI).
МР еластографія – багатообіцяючий неінвазивний метод, який квантифікує жорсткість печінки шляхом аналізу проникнення механічних хвиль через тканини. Asbach et al. провели дослідження 88 пацієнтів і оцінили діагностичні можливості МР еластографії у визначенні фіброзу печінки з вимірюванням площі, обмеженої RОС-кривою – між 0,91 (F≥1 за класифікацією Десмета) і 0,99 (F = 4 за класифікацією Десмета). Виходячи з цих даних, площі обмежені RОС-кривою збільшувалися із зростанням ступеня фіброзу. Wang et al. довели, що прогностична здатність МР еластографії у визначенні ступеня фіброзу була кращою, ніж DWI. Він повідомив про чутливість 91-95% і специфічності 87-95% у встановленні діагнозу фіброз печінки при МР еластографії, в той час як для DWI вони становили 84-88% і 68-82% відповідно.
Що стосується УЗД, технологія Siemens ARFI застосовувалась багато років з метою оцінки фіброзу печінки. ARFI – різновид технології еластографії, який використовує фізичний принцип, згідно з яким, швидкість проникнення ультразвуку прямопропорційна еластичним властивостям середовища, незалежно від амплітуди хвилі. У 2009 році, Friedrich-Rust et al. в пілотному дослідженні підкреслили, що існує значна кореляція між ARFI технологією і ступенем фіброзу, повідомляючи про значеннях площі обмеженої ROC-кривою 0,82 і 0,91 при встановленні діагнозу помірного фіброзу і цирозу. Piscaglia et al. описали точність ARFI у встановленні діагнозу цирозу між 0,94 (чутливість 93,0% і специфічність 85,1%) і 0,91 (чутливість 81,5% і специфічність 88,4%), використовуючи стандартний Fibroscan і біопсію печінки, відповідно.
Ще одна технологія, яка використовується для оцінки фіброзу печінки – це еластографія в реальному часі (компресійна). Як було показано в роботі Koizumi et al., площа під ROC-кривою 0,89 (для F≥2 за класифікацією METAVIR), 0,94 (для F≥3) і 0,95 (для F = 4). А в 2009 році, Friedrich-Rust et al. показали, що еластографія в реальному часі не підтверджує діагностичну спроможність транзієнтної еластографії (Fibroscan), з площею обмеженою ROC-кривою між 0,69 (для F≥2) і 0,65 (при встановленні діагнозу цироз F = 4).
Ці методи еластографії не здатні оцінювати властивості тканин або дати інформацію стосовно гетерогенності структури печінки, не дивлячись на те, що вони можуть бути використані для оцінки жорсткості тканин. Ультразвукові зображення в В-режимі відображають гранулярну модель, відому як спекл. Цей параметр змінюється з гомогенного до гетерогенного по ходу прогресування фіброзу печінки до цирозу. Ці дані не аналізувалися об’єктивно. Мета ASQ продемонструвати те, що збільшення середньостатистичних значень см2 пов’язане із збільшенням ступеня фіброзу печінки, і що оцінка ступеня фіброзу за допомогою УЗД у В-режимі можлива. Наша робота зосереджена на диференціації, за допомогою ASQ, різних ступенів фіброзу печінки. На підставі нашої роботи, значення см2 представляють параметр, який краще корелює зі ступенем фіброзу у наших пацієнтів (визначеним при біопсії). Ці виміри, проведені на правій частці печінки, корелюють з результатами біопсії і Fibroscan. У пацієнтів із хронічним захворюванням печінки, середньостатистичні значення см2 значно корелювали із ступенем фіброзу (коефіцієнт рангової кореляції Спірмена = 0,56; p <0.01), і лінійним ростом оцінки за шкалою METAVIR.
Середньостатистичні значення см2, отримані на рівні селезінки, не показали значної різниці при зростанні ступеня фіброзу печінки. Це може бути причиною середньої, але не відмінної чутливості цього методу, особливо в порівнянні з Fibroscan (особливо в присутності проміжних ступенів фіброзу, при яких селезінка зазнає невеликих структурних змін). Подальші роботи, що досліджуватимуть великі когорти, можуть підтвердити або спростовувати ці результати.
Що стосується точності діагностики фіброзу з ASQ, найточніше, мінімальне значення для того, щоб виставити діагноз фіброз F1 або вище (за шкалою METAVIR) було в середньому 135 см2 з чутливістю 71,4% і специфічністю 71,4% (площа під ROC- кривою = 0,71; 95% довірчий інтервал 0,60-0,83). Найточніше мінімальне значення для можливості виставлення діагнозу цироз (F4 за шкалою METAVIR) було в середньому 138 см2 із чутливістю 68,8% і специфічністю 62,3% (площа під ROC-кривою = 0,77; 95% довірчий інтервал 0,65 -0,89).
Пацієнтів розділили по групам на підставі оцінки біоптату і встановленні ступеня фіброзу, не беручи до уваги можливі відмінності між HCV і HBV – пов’язаними гепатитами. Аналізи такого роду можуть стати об’єктом нових досліджень з великою вибіркою пацієнтів.
Існує безліч гіпотез, які можуть пояснити недоліки цієї технології. На результати можуть впливати загасання ультразвукової хвилі і артефакти латеральної частки. Більше того, в нашому попередньому дослідженні здорових добровольців, ми виявили, що правильне визначення ступеня фіброзу печінки залежить від ДД тому, що включення ділянок паренхіми багатих на судинні структури, навіть не магістральні, може привести до ненадійних результатів, пов’язаних із периваскулярним фіброзом або вакуумним ефектом просвіту судини. Ми отримали кращу кореляцію, вибираючи ДД в паренхімі на достатній глибині (4-6 см), де відсутні явні судинні структури.
З іншого боку, в процесі аналізу наших результатів, ми повинні усвідомити, що гістологічні заключення стосовно биоптатів не завжди відображають ступінь фіброзу всієї печінки.
Діагностична точність ASQ порівняно з Fibroscan для стадіювання фіброзу печінки визначалася шляхом обчислення різниці між площами, обмеженими ROC-кривими. Ми зареєстрували статистично значиму різницю між двома площами (p <0.05), тому ASQ поки що не можна рахувати, як достовірну діагностичну альтернативу в дослідженні фіброзу печінки.
ВИСНОВКИ
Наш попередній досвід із ASQ показав перспективні результати в діагностиці пацієнтів із цирозом, відсутністю або наявністю фіброзу печінки. Застосування цього програмного забезпечення під час рутинного ультразвукового дослідження пацієнтів із хронічними захворюваннями печінки дозволяє зробити якісну і кількісну оцінку фіброзу, і в результаті скоротити подальше спостереження та грошові витрати.
На сьогоднішній день, ASQ не може прирівнюватись до діагностичної здатності Fibroscan. Тим не менш, ми вважаємо, що комбінований аналіз декількох параметрів цього програмного забезпечення (стандартне відхилення, мода, симетрія гістограми і пікові значення гістограми) разом із недавно доступними асиметричними ДД (більше підходять для розмежування областей паренхіми, вільних від судин) дають можливість накладати ДД на параметричну карту, а алгоритм для автоматичного видалення дрібних судин у ДД може значно поліпшити діагностичну чутливість і точність методу ASQ.















14.10.2019
Анна
14.10.2019
Константин