Фиброз печени является основной характеристикой большинства хронических заболеваний печени. ASQ – это новое многообещающее программное обеспечение, которое дает обнадеживающие результаты для диагностики цирроза и фиброза печени.
Резюме. Целью нашего исследования было оценить диагностическую точность программного обеспечения acoustic structure quantification (ASQ) для определения степени фиброза печени по сравнению с Fibroscan и биопсией.
Материал и методы. Cемидесяти семи пациентам с хроническим вирусным гепатитом B и С провели ультразвуковое исследование (УЗИ), Fibroscan и биопсию печени. ASQ анализ проводили используя одну исследуемую область (ИО) на каждом изображении, и вычислялись мода, среднее статистическое число и стандартное отклонение. Эту методику разработали с помощью предварительного обследования 20 здоровых добровольцев.
Результаты. Площадь ограниченная ROC-кривой (AUROC) и осью доли ложных положительных классификаций для диагноза цирроз (F≥4) c ASQ была 0,77, в то время как для диагноза любой степени фиброза (F≥1) была 0,71. AUROC для диагноза цирроз (F≥4) с Fibroscan была 0,98, а для диагноза любой степени фиброза (F≥1) – 0,94. Разница между AUROC была статистически значимая (p<0,05).
Выводы. ASQ – это новое многообещающее программное обеспечение, которое дает обнадеживающие результаты для диагностики цирроза (F=4) и фиброза (F≥1) печени. Однако, на сегодняшний день, оно не достигло такой диагностической ценности как Fibroscan.
Введение. Фиброз печени является основной характеристикой большинства хронических заболеваний печени. Оценка степени фиброза необходима для выбора лечения пациентов с хроническими заболеваниями печени. Биопсия печени считается золотым стандартом для оценки фиброза. Однако, это инвазивная, дорогостоящая процедура, которая может стать причиной осложнений, также на диагностическую точность могут влиять ошибки при заборе образцов и вариабельность субъективной экспертной оценки. Необходимо заметить, что с помощью биопсии можно оценить всего лишь 1/50,000 часть всей паренхимы печении при неправильном заборе материала можно недооценить степень фиброза. Поэтому, биопсия печени неподходящий метод для диагностики и общего скрининга населения. В связи с чем необходимо развитие неинвазивных, точных и однородных тестов для диагностики и оценки степени фиброза.
Транзиентная эластография (Fibroscan, Echosens, Paris, France) без сомнений является самым часто использованным диагностическим методом. Fibroscan использует ультразвуковой импульс для оценки паренхимной реакции путем регистрации обратного эхо, и таким образом позволяет измерить жесткость ткани печени в кПа, что является непрямым показателем фиброза печени. Недавно, были предложены передовые технологии для неинвазивной диагностики и классификации фиброза печени. Они основаны на магнитно-резонансной томографии (МРТ) (МРТ с двойным контрастом, МР эластография, диффузно взвешенные изображение (diffusion-weighted imaging- DWI), и перфузионная МРТ), на УЗИ – ARFI (Siemens, Erlangen, Germany), эластография в реальном времени (real-time tissue elastography- RTE) (Hitachi Medical Systems Europe, Zurich, Switzerland), акустический количественный анализ структур (ASQ) (Toshiba Medical Systems, Osaka, Japan).
Целью нашего исследования было оценить диагностическую точность, чувствительность и специфичность сонографического программного обеспечения ASQ для определения степени фиброза печени у пациентов с хроническим вирусным гепатитом В (HBV) или С (HCV), по сравнению с Fibroscan.
МАТЕРИАЛЫ И МЕТОДЫ
Предварительное оценивание
С июня по июль 2010 года, мы отобрали 20 здоровых добровольцев возрастом от 27 до 42 лет (средний возраст 35 лет; 9 мужчин и 11 женщин). Все подписали форму информированного согласия. Добровольцев отбирали по следующим критериям: отсутствие в анамнезе диффузного или фокального заболевания печени, результаты лабораторной диагностики в приделах нормы (аспартатаминотрансфераза (АсАТ), аланинаминотрансфераза (АлАТ), гамма-глутаминтрансфераза (ГГТ), билирубинемия, международное нормализованное отношение (МНО), сывороточный альбумин, холинэстераза, отрицательные anti-HCV, HCV-рибонуклеиновая кислота (РНК), антигены к вирусному гепатиту В (HBsAg) и HBV- дезоксирибонуклеиновая кислота (ДНК)) и обычное ультразвуковое исследование (УЗИ). Всем добровольцам провели обычное абдоминальное УЗИ и ASQ со специальным оборудованием и конвексным датчиком 7-5 МГц (Aplio XG, Toshiba Medical Systems, Osaka, Japan) для определения наилучшего акустического окна при оценке с ASQ.
Мы сделали захват изображений с помощью правого подреберного доступа на уровне 7-8 сегмента, одно в аксиальной плоскости и другое в сагиттальной плоскости, и два снимка левой доли (ортогонально друг к другу, аксиально и сагиттально). Последующая обработка сырых данных (rawdata) с помощью интегрированного программного обеспечения показала, что лучшие ASQ оценки с низким количеством неправильных измерений были на уровне 7-8 сегмента при аксиальном доступе, в то время как данные получены при других сканированиях не дали такой же воспроизводимости.
На самом деле, правые сегменты имеют более чистые области паренхимы, где отсутствуют сосудистые структуры (сосуды которые могут визуализироваться во время обычного УЗИ), и периваскулярная соединительная ткань. По данным Toyoda et al. такие структуры могут влиять на изменчивость результатов. Кроме того, во-время задержки дыхания, правая доля стает более доступная для обследование и захвата материала. Также, обследования сделаны на этом уровне лучше коррелируют с результатами биопсии печени и Fibroscan, которые тоже проводятся в 7, 8 сегментах.
Сканирование селезенки проводилось в позиции пациента лежа на правом боку, чтобы получить изображения по продольной оси. Все полученные изображения анализировались с помощью ASQ, выделяя одну ИО, которая включала самую широкую часть паренхимы свободной от васкулярных структур. Далее вычисляли моду, среднее статистическое число и стандартное отклонение (СО). ИО размещалась на глубине 4-6 см зависимо от размеров печени, как описано в литературе, выбирая область отдаленной от фиброзной капсулы печени (Глиссонова капсула).
До того как определить ИО, мы сверяли данные параметрического картирования, чтобы убедиться в том, что она обхватывает такую часть паренхимы печени, которая характеризирует эхоструктуру печени в целом. Кроме изображений в оттенках серого, ASQ дает возможность получить цветные снимки, основанные на распределении эхо-амплитуд, особенно рассеивании, т.е. отклонении ультразвуковых волн разными структурами. На основании красно-зеленой шкалы, высокие значения см2 (статистический параметр полученный при распределении эхо-амплитуд) обозначаются красным цветом, а низкие значения см2 зеленым цветом.
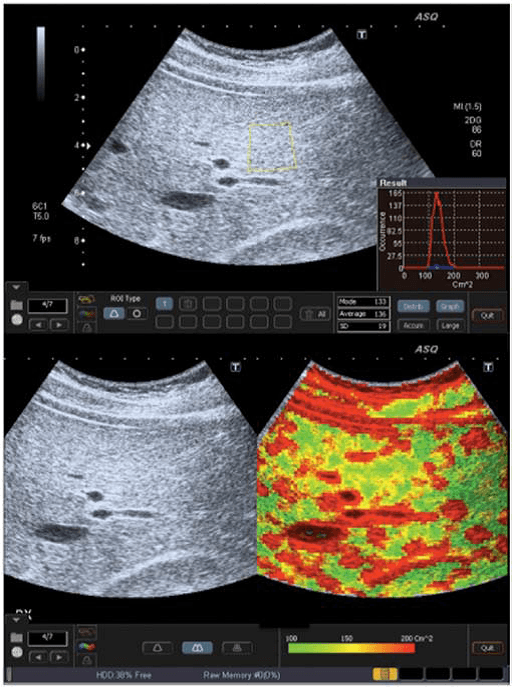
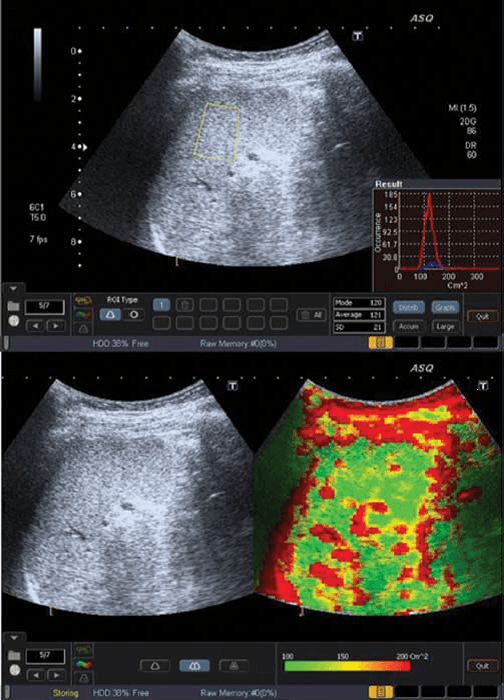
Рис. 1. ASQ обследование пациента с F0 степенью фиброза печени (отсутствие фиброза). a – ASQ снимок правой доли печени, с обозначенной ИО. В нижнем правом угле – гистограмма (см2) среднее статистическое значение – 120; b – субкостальная проекция без и с ASQ цветовым картированием. В паренхиме низкое значения см2 (преимущественно зеленый цвет), что является признаком гомогенной паренхимы. Сосудистые структуры печени обозначены красным цветом (высшие значения см2).
При фиброзе, рассеивание увеличивается прямо пропорционально к искажению паренхимальной и сосудистой архитектуры. Таким образом, ASQ сканограмма отображает высокие значения см2, и как результат, увеличение областей красного цвета вокруг сосудов и фиброза (Рис. 4b). С другой стороны, у пациентов со стеатозом печени увеличивается количество жирных кислот в гепатоцитах, и это соответствует постепенному уменьшению рассеивания между паренхимой и сосудами, что приводит к низким значениям плотности и увеличению количества зеленого цвета на картировании (Рис. 1b).
Таблица 1. Лабораторные параметры у 77 пациентов с заболеваниями печени.
|
Параметр |
Значение (среднее статистическое число ± стандартное отклонение) |
| АсАТ (ед/л) |
62,2±51,4 |
| АлАТ (ед/л) |
78,1±65,3 |
| Холинэстераза (UI/мл) |
8120±1987 |
| Общий билирубин (мг/дл) |
0,58±0,7 |
| Щелочная фосфатаза (ед/л) |
126,6±57,3 |
| ГГТП (ед/л) |
42,8±52 |
| Альбумины (г/л) |
3,8±0,7 |
| Общий холестерин (мг/дл) |
168±41 |
| ЛПНП (мг/дл) |
92±33 |
| Триглицериды (мг/дл) |
101,1±83,9 |
| Глюкоза крови (мг/дл) |
92±10 |
| Тромбоциты (х103/л) |
232±58 |
| МНО |
1,04±0,2 |
| Фибриноген (мг/дл) |
232,9±58,3 |
АсАТ – аспартатаминотрансфераза; АлАТ – аланинаминотрансфераза; ГГТП – гамма-глутаминтрансфераза; ЛПНП – липопротеины низкой плотности; МНО – международное нормализованное отношение.
ПРОТОКОЛ ИССЛЕДОВАНИЯ И ОЦЕНКА БИОПСИИ
С сентября 2010 г. по июнь 2011 г. было отобрано 77 пациентов (43 мужчин и 34 женщин; возрастной диапазон 27-75 лет; средний возраст 59 лет) с вирусным гепатитом В и С, с показаниями на биопсию печени (Таблица 1). С 77 пациентов, 69 классифицировали как класс А по Чайлду-Пью, восемь как класс В. Всем пациентам провели стандартное абдоминальное УЗИ и ASQ со специальным оборудованием и конвексным датчиком 7-5 МГц (Aplio XG – Toshiba Medical Systems, Osaka, Japan), Fibroscan и биопсию печени на протяжении одной недели. Оценка биоптата считалась золотым стандартом диагностического протокола.
Таблица 2. Шкала Ishak для определения степени фиброза.
| Гистологические признаки | Индекс |
| Фиброза нет |
0 |
| Распространение фиброза на некоторые портальные тракты ± короткие фиброзные септы |
1 |
| Распространение фиброза на большинство портальных трактов ± короткие фиброзные септы |
2 |
| Распространение фиброза на большинство портальных трактов и единичные порто-портальные септы |
3 |
| Распространение фиброза на портальные тракты с множественными порто-портальными и порто-центральными септами |
4 |
| Выраженный мостовидный фиброз с единичными узлами |
5 |
| Цирроз |
6 |
Обследование печени проводили с помощью программного обеспечения ASQ, соответственно результатам предварительного исследования здоровых добровольцев, с аксиальным доступом на уровне 7-8 сегмента. Селезенка оценивалась по продольной оси в положении пациента лежа на правом боку. Последующее позиционирование ИО на полученных изображениях выбиралось по таким критериям: широкая паренхимальная область, свободна от крупных васкулярных структур. Далее вычислялись мода, среднее статистическое число и стандартное отклонение. ИО позиционировали на глубине 4-6 см, зависимо от размеров органа, сверяясь с литературой.
В течение семи дней пациентам проводили транзиентную эластографию (Fibroscan) и биопсию печени. Измерения с Fibroscan проводились на уровне правой доли печени с межреберным доступом в положении пациентов лежа на спине. Срединное значение 10 захватов, выраженное в кПа, считалось показателем значения жесткости (плотности) ткани печени. Обследование с показателем успешности выше 60% и интерквартальным диапазоном меньше 25% полученных срединных значений, считалось достоверным. Биопсию проводил гепатолог под УЗ контролем на уровне 8 сегмента правой доли, где отсутствуют магистральные сосуды. Забор материала делали перкутанным доступом иглой 16 калибра. Полученные образцы обрабатывались формалином, за тем окрашивались гематоксилином и эозином. Все биоптаты печени оценивал патолог с многолетним стажем. Степень печеночного некровоспаления (necroinflammation) и фиброза оценивались по шкале Ishak (Таблица 2). При проведении Fibroscan, фиброз оценивался по шкале METAVIR. Шкала перевода единиц использовалась для распределения пациентов на четыре группы, группируя пациентов со степенью фиброза F1 и F2 (METAVIR) вместе в группу 2 (Таблица 3).
Таблица 3. Таблица перевода единиц для распределения пациентов в четыре группы.
| Ishak | METAVIR | Группы |
| F0-F1 | F0 (отсутствие фиброза) | 1=F0 (n=28) |
| F2 | F1 (мягкий фиброз) | 2=F1-F2 (n=18) |
| F3 | F2 (умеренный фиброз) | – |
| F4 | F3 (выраженный фиброз) | 3=F3 (n=14) |
| F5-F6 | F4 (цирроз) | 4=F4 (n=17) |
И наконец, статистический анализ был проведен с помощью SPSS version 19.0 software (SPSS Inc, Chicago, IL) и R version 2.4.1. software (R Foundation, Vienna, Austria).
АКУСТИЧЕСКИЙ КОЛИЧЕСТВЕННЫЙ АНАЛИЗ СТРУКТУР
ASQ – это сонографическое программное обеспечение, которое дает возможность делать качественный (ASQ сканограмма) и количественный (статистический анализ) анализ для определения степени фиброза печени. Это программное обеспечение использует физический принцип, согласно которому, ультразвуковая луч, генерированный ультразвуковым датчиком, проходит сквозь ткани со специфической скоростью и длиной волны. Рассеивание и отклонение/отражение ультразвуковой волны определяется акустическим сопротивлением тканей.
При нормальных условиях (отсутствие макромолекулярных искажений), рассеивание ультразвуковых волн минимальное или отсутствует, но оно увеличивается, когда паренхимальная архитектура органа искажается, как при фиброзе печени. ASQ анализирует спекл (speckle) артефакт вызванный рассеиванием во время проникновения через разные ткани. Спекл представленный множественными пикселями в серых тонах и анализируется как сырые данные (rawdata). ASQ измеряет разницу (см2) между теоретическим распределением эхо-амплитуд, полученным статистическим анализом Хи-квадрат (результат определения среднестатистического количества спеклов у здоровых людей) и реальным распределением эхо-амплитуд, зарегистрированных в данном исследовании. Оператор отмечает ИО, где будут проводиться измерения, на серошкальном изображении.
FIBROSCAN
Транзиентная эластография, также известна как Fibroscan, является неинвазивным методом, который измеряет жесткость ткани печени в кПа. Система состоит из ультразвукового датчика с вибратором. Вибратор создает вибрации, которые передаются тканям печени, вырабатывая в ней эластическую волну.
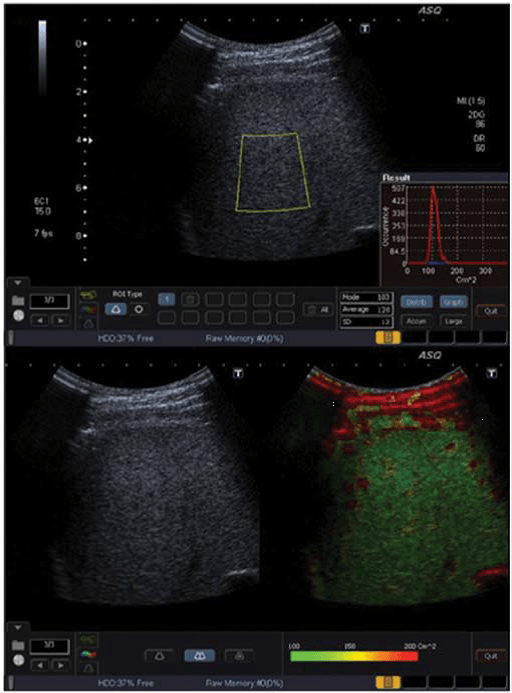
Рис. 2. ASQ обследование пациента с F1-F2, правая доля. Для ASQ нет четкого порогового значения(cut–offvalue) между F1 и F2. а Гистограмма (см2) немного шире, со средним значением см2 – 136. b ASQ сканограмма показывает некоторое увеличение сосудов (желтые, красные цвета).
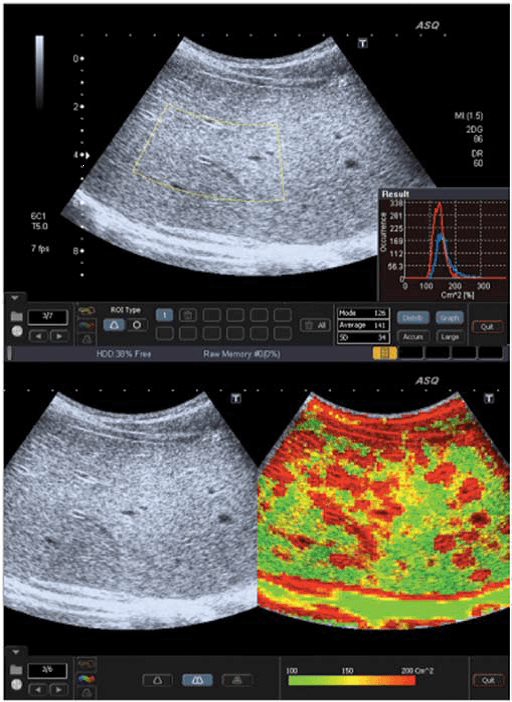
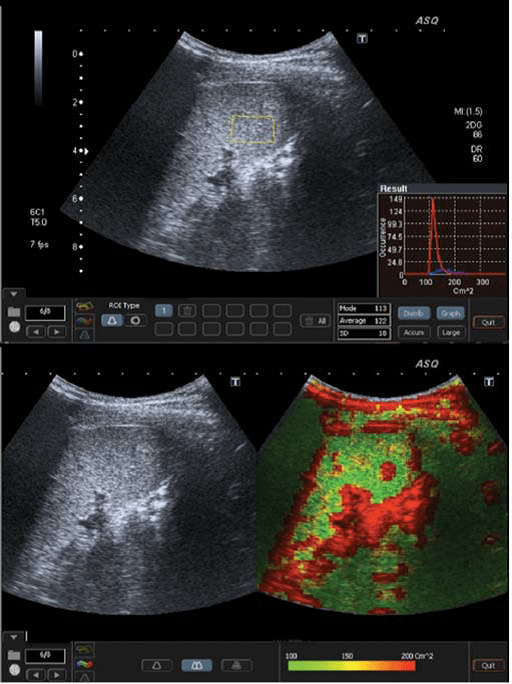
Рис. 3. ASQ обследование пациента с F3 стадией, правая доля. а – Широкая гистограмма (см2), с среднестатистическим значением 141, показывает негомогенность паренхимы. B –ASQ сканограмма показывает высокие значения см2, и следственно, увеличение красного цвета, типический признак выраженного фиброза.
Одновременно, ультразвуковой датчик регистрирует распространение эластических волн и измеряет их скорость, что прямо пропорционально к эластичности ткани.
РЕЗУЛЬТАТЫ
Двадцать здоровых пациентов, добровольцев отобраны в контрольную группу. Пациентов с заболеваниями печени сгруппировали на основании биопсии в следующие групы: 1 группа – 28 пациентов с F0 (Рис. 1); 2 группа – 18 с F1 и F2 (Рис. 2); 3 группа – 14 с F3 (Рис. 3) и 4 группа – 17 с F4 (Рис. 4). Среднестатистические значения ASQ анализа печени и селезенки (Рис. 5 и 6), Fibroscan измерения печеночной доли для каждой группы сформулированы в Таблице 4.
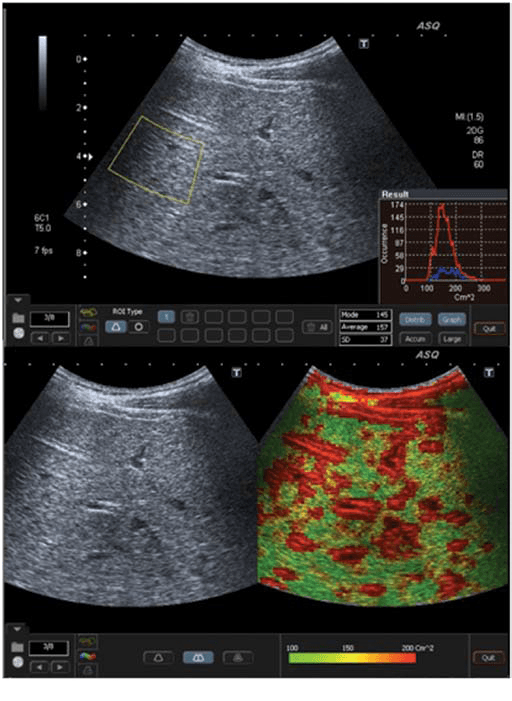
Рис. 4. ASQ обследование пациента с F4 стадией (цирроз), правая доля. А – среднестатистическое значение см2 было очень высокое – 157, гистограмма была очень широкая и имела неправильную форму. b–ASQ сканограмма показывает сверх высокие значения см2, и поэтому доминирует красный цвет с негомогенным распределением, как типичный признак цирроза.
Рис. 5. ASQ обследование пациента контрольной группы. A – ASQ ультразвуковой снимок паренхимы селезенки, с отмеченной ИО. Гистограмма см2 показана в нижнем правом угле, среднестатистическое значение см2 – 121. B – подреберный вид селезенки с ASQ и без. Паренхима имеет низкие значения см2 и доминирует зеленый цвет, что характерно для гомогенной ткани, в то время как периваскулярные зоны незначительно красные (высшие значения см2).
СТАТИСТИЧЕСКИЙ АНАЛИЗ
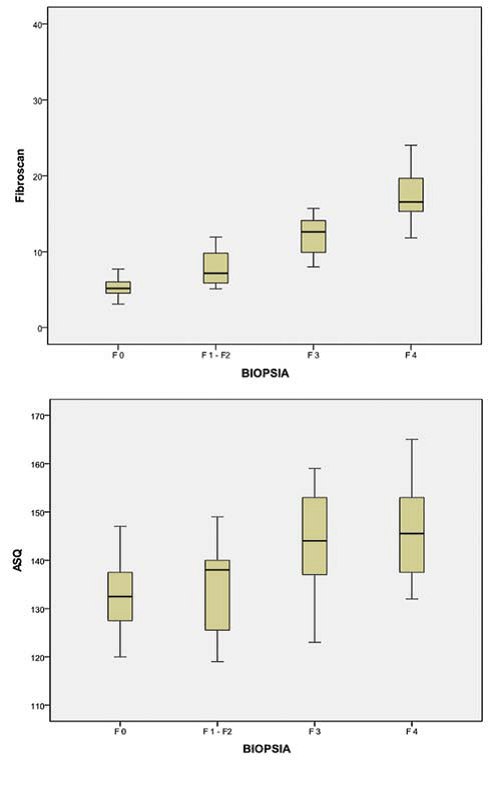
Статистические отличия среди четырех групп пациентов с заболеваниями печени оценивались коэффициентом ранговой корреляции Спирмена (Рис. 7). У пациентов с хроническими заболеваниями печени, среднестатистические значения см2 (Рис. 7а) имели значительную статистическую корреляцию степени фиброза (коэффициент Спирмена ρ=0,56; р<0,01). У этих пациентов, данные Fibroscan коррелировали со степенью фиброза (коэффициент Спирмена ρ=0,88; р<0,01) (Рис. 7b).
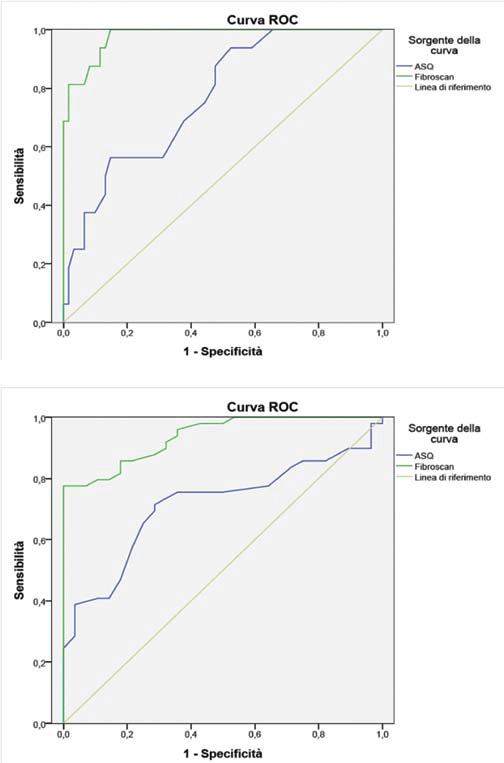
Изучая площади ограниченные ROC-кривыми, которые были статистически значимые (р<0,05), оценивалась диагностическая точность ASQ по сравнению с Fibroscan в определении степени фиброза печени.
Площадь ограниченная ROC-кривой для диагноза цирроза (F ≥ 4) c ASQ составляла 0,77 (95% доверительный интервал 0,65-0,89), с минимальным среднестатистическим значением – 138 см2, для того, чтобы выставить диагноз цирроз (Рис. 8а). Если учитывать эту информацию, то чувствительность и специфичность диагностики цирроза печени было 68,8% и 62,3%, соответственно. Площадь ограниченная ROC-кривой для диагноза цирроза (F ≥ 4) c транзиентной эластографией составляла 0,98 (95% доверительный интервал 0,95-1), с минимальной плотностью ткани – 12,2 кПа, для того, чтобы выставить диагноз цирроз (Рис. 8а). При этом чувствительность и специфичность диагностики цирроза печени были 93,8% и 88,5%, соответственно.
Площадь ограниченная ROC-кривой для любой степени фиброза (F≥1), по сравнению с отсутствием фиброза (F=0), при ASQ была 0,71 (95% доверительный интервал 0,60-0,83), с минимальным среднестатистическим значением – 135 см2, для возможности постановки диагноза фиброза (Рис. 8b). Чувствительность и специфичность диагностики фиброза печени были 71,4% и 71,4%, соответственно. Площадь ограниченная ROC-кривой для любой степени фиброза (F≥1), по сравнению с отсутствием фиброза (F=0), при транзиентной эластографии была 0,94 (95% доверительный интервал 0,89-0,99), с минимальным среднестатистическим значением – 6,25 кПа, для возможности постановки диагноза фиброз (Рис. 8b). Чувствительность и специфичность диагностики фиброза печени были 85,7% и 82,1%, соответственно.
Рис. 6. ASQ обследование пациента группы F4 (цирроз). A – ASQ ультразвуковой снимок паренхимы селезенки, с отмеченной ИО. Гистограмма см2 показана в нижнем правом угле, среднестатистическое значение см2 – 122. B – ASQ сканограмма показывает зеленый цвет для гомогенной паренхимы селезенки с желтыми и красными пятнами (высшие значения см2).
ОБСУЖДЕНИЕ
Гистологическая оценка биоптатов является единственным принятым методом для определения фиброза печени. Тем не менее, он инвазивный, и может вызвать осложнения. На диагностическую точность биопсии печени могут влиять ошибки при заборе материала в связи с неправильным распределением поражений печени, и вариабельностью результатов среди исследователей. Необходимо заметить, что биопсия способна оценить всего лишь 1/50,000 часть всей паренхимы печени. Эти недостатки биопсии могут привести к недооценке фиброза, особенно если биоптат маленький или фрагментированный. Исходя из этого, биопсия не подходящий метод для достоверной диагностики и мониторинга населения.
Таблица 4. Размах и среднестатистические значения, получены при ASQ измерении печени и селезенки, и при измерении печени с Fibroscan.
| Группа | ASQ печени (см2) | ASQ селезенки (см2) | Fibroscan (кПа) |
| Контрольная группа | 126 (113-144) | 116 (108-126) | Не оценивалась |
| 1 (F0) | 132 (120-147) | 117 (111-128) | 5,2 (3,1-7,7) |
| 2 (F1-F2) | 134 (119-149) | 115 (106-129) | 7,8 (5,1-11,9) |
| 3 (F3) | 142 (123-159) | 119 (110-127) | 12 (8-15,7) |
| 4 (F4) | 146 (132-165) | 120 (112-130) | 18 (11,8-32) |
Рис. 7. Коробчатая диаграмма показывает разницу в среднестатистических значениях см2 (a) и кПа (b), зарегистрированных в четырех группах. Группы пациентов отличались друг от друга возрастающими степенями фиброза (F0-F4), представленными на горизонтальной оси, а среднестатистические см2 (a) и кПа (b) значения представленные на вертикальной оси. Желтая коробка представляет значения между первой и третьей квартилью для каждой группы, а черная вертикальная линия изображает соотношение максимального значения до минимального. Черная горизонтальная линия обозначает среднестатистическое значение.
Рис. 8. а – ROC-кривая для диагноза цирроза (F≥4) при ASQ (синяя) и Fibroscan (зеленая); b – ROC-кривая для диагноза фиброза (F≥1) при ASQ (синяя) и Fibroscan (зеленая).
По вышеуказанным причинам, за последние годы начали разрабатывать новые неинвазивные методы диагностики фиброза печени. Мы в данной работе описали разные эластографические методики для определения жесткости печени. Транзиентная эластография (Fibroscan) – это неинвазивный метод, который стал очень популярным за последние годы. Его углубленное исследование показало, что он обладает хорошей корреляцией, относительной специфичностью и чувствительностью, по сравнению с биопсией печени, особенно в случаях фиброза, связанного с HBV/HCV.
Точность Fibroscan вычислили мета-анализом, который определил чувствительность и специфичность установления фиброза 70% и 84%, соответственно. В той же работе, точность установления цирроза печени была большей, с 87% чувствительностью и 91% специфичностью. Не смотря на то, что Fibroscan высокоточный метод, он имеет свои недостатки, самый наглядный из них – трудности определения промежуточных степеней фиброза.
Среди других недостатков, важно понимать, что Fibroscan одномерный метод, который не способен выборочно обследовать самые подходящие участки паренхимы печени. Более того, связь с гистологической степенью активности некровоспаления у пациентов с хроническим вирусным гепатитом до сих пор является спорным вопросом. Выполнение обследования пациентов крупного телосложения и людей с узкими межреберными промежутками очень сложное, и невозможное у пациентов с асцитом.
Исследовательские работы более сосредоточены на МРТ и УЗ, в особенности на эластографических методиках. Многие и них, основаны на МРТ, применялись для оценки фиброза печени. Некоторые из них, основаны на использовании контрастного вещества, (МРТ с двойным контрастом и перфузионная МРТ). Среди методов МРТ, которые не используют контрастные вещества, самые важные – МР эластография и диффузно взвешенные изображение (diffusion-weighted imaging- DWI).
МР эластография – многообещающий неинвазивный метод, который квантифицирует жесткость печени путем анализа проникновения механических волн через ткани. Asbach et al. [11] провели исследование 88 пациентов и оценили диагностические возможности МР эластографии в определении фиброза печени с измерением площади ограниченной RОС-кривой – между 0,91 (F≥1 по классификации Десмета) и 0,99 (F=4 по классификации Десмета). Исходя из этих данных, площади ограниченной RОС-кривой увеличивались с возрастанием степени фиброза. Wang et al. [12] доказали, что прогностическая способность МР эластографии в определении и опознании степени фиброза была лучшей, чем DWI. Он сообщил о чувствительности 91-95% и специфичности 87-95% в установлении диагноза фиброз печени для МР эластографии, в то время как для DWI 84-88% и 68-82% соответственно.
Что касается УЗИ, технология SiemensARFI применялось много лет в целях оценки фиброза печени. ARFI, разновидность технологии эластографии, использует физический принцип, согласно которому, скорость проникновения ультразвука прямо пропорционально эластическим свойствам среды, независимо от амплитуды волны [13,14]. В 2009 году, Friedrich-Rust et al. [15] в пилотном исследовании подчеркнули, что существует значительная корреляция между ARFI технологией и степенью фиброза, сообщая о значениях площади ограниченной ROC-кривой 0,82 и 0,91 при установлении диагноза умеренного фиброза и цирроза. Piscaglia et al. описали точность ARFI в установлении диагноза цирроза между 0,94 (чувствительность 93,0% и специфичность 85,1%) и 0,91 (чувствительность 81,5% и специфичность 88,4%) используя стандартный Fibroscan и биопсию печени, соответственно.
Еще одна технология, которая используется для оценки фиброза печени это эластография в реальном времени (компрессионная). Как было показано в работе Koizumi et al., площадь под ROC-кривой 0,89 (для F≥2 по классификации METAVIR), 0,94 (для F≥3) и 0,95 (для F=4). А в 2009 году, Friedrich-Rust et al. показали, что эластография в реальном времени не подтверждает диагностическую способность транзиентной эластографии (Fibroscan), с площадью ограниченной ROC-кривой между 0,69 (для F≥2) и 0,65 (в установлении диагноза цирроз F=4).
Эти методы эластографии не способны оценивать свойства тканей или дать информацию касательно гетерогенности структуры печени, не смотря на то, что они могут быть использованы для оценки жесткости тканей. Ультразвуковые изображения в В-режиме отображают гранулярную модель, известную как спекл. Этот параметр меняется с гомогенного до гетерогенного по ходу прогрессирования фиброза печени на цирроз. Эти данные не анализировались объективно. Цель ASQ продемонстрировать, что увеличение среднестатистических значений см2 связано с увеличением степени фиброза печени, и что оценка степени фиброза с помощью УЗИ в В-режиме возможна. Наша работа сосредоточена на дифференциации, с помощью ASQ, различных степеней фиброза печени. На основании нашей работы, значения см2 представляют параметр, который лучше коррелирует со степенью фиброза у наших пациентов (определенной при биопсии). Эти измерения, проведенные на правой доле печени, коррелируют с результатами биопсии и Fibroscan. У пациентов с хроническим заболеванием печени, среднестатистические значения см2 значительно коррелировали со степенью фиброза (коэффициент ранговой корреляции Спирмена = 0,56; p<0.01), и линейным ростом оценки по шкале METAVIR.
Среднестатистические значения см2 полученные на уровне селезенки не показали значительной разницы при возрастании степени фиброза печени. Это может быть причиной средней, но не отличной чувствительности этого метода, особенно по сравнению с Fibroscan (особенно в присутствии промежуточных степеней фиброза, при которых селезенка подвергается небольшим структурным изменениям). Дальнейшие работы, исследуя большие когорты, могут подтвердить или опровергать эти результаты.
Что касается точности диагностики фиброза с ASQ, самое точное, минимальное значение для того, чтобы выставить диагноз фиброз F1 или выше (по шкале METAVIR) было в среднем 135 см2 с чувствительностью 71,4% и специфичностью 71,4 % (площадь под ROC-кривой=0,71; 95% доверительный интервал 0,60-0,83). Самое точное минимальное значение для возможность выставления диагноза цирроз (F4 по шкале METAVIR) было в среднем 138 см2 с чувствительностью 68,8% и специфичностью 62,3 % (площадь под ROC-кривой = 0,77; 95% доверительный интервал 0,65-0,89).
Пациентов разделили по группам на основании оценки биоптата и установлении степени фиброза, не беря во внимание возможные отличия между HCV и HBV – связанными гепатитами. Анализы такого рода могут стать объектом новых исследований с большой подборкой пациентов.
Существует множество гипотез, которые могут объяснить недостатки этой технологии. На результаты могут влиять затухание ультразвуковой волны и артефакты латеральной доли. Более того, в нашем предварительном исследовании здоровых добровольцев, мы обнаружили, что правильное определение степени фиброза печени зависит от ИО потому, что включение областей паренхимы богатых на сосудистые структуры, даже не магистральные, может привести к ненадежным результатам, связанным с периваскулярным фиброзом или вакуумным эффектом просвета сосуда. Мы получили лучшую корреляцию, выбирая ИО в паренхиме где отсутствуют явные сосудистые структуры, на достаточной глубине (4-6 см).
С другой стороны, в процессе анализа наших результатов, мы должны осознать, что гистологические заключения биоптатов не всегда отображают степень фиброза всей печени.
Диагностическая точность ASQ по сравнению с Fibroascan для стадирования фиброза печени определялась путем вычисления разницы между площадями ограниченными ROC-кривыми. Мы зарегистрировали статистически значимую разницу между двумя площадями (p<0.05), поэтому ASQ пока что нельзя преподносить как достоверную диагностическую альтернативу в исследовании фиброза печени.
ВЫВОДЫ
Наш предварительный опыт с ASQ показал обнадёживающие результаты в диагностике пациентов с циррозом, отсутствием или наличием фиброза печени. Применение этого программного обеспечение во время рутинного ультразвукового исследования пациентов с хроническими заболеваниями печени позволяет сделать качественную и количественную оценку фиброза, и в результате сократить последующее наблюдение и денежные затраты.
На сегодняшний день, ASQ не может приравниваться к диагностической способности Fibroscan. Тем не менее, мы считаем, что комбинированный анализ нескольких параметров этого программного обеспечения (стандартное отклонение, мода, симметрия гистограммы, и пиковые значения гистограммы) вместе с недавно доступными асимметрическими ИО (больше подходят для разграничения областей паренхимы, свободных от сосудов) дают возможность накладывать ИО на параметрическую карту, а алгоритм для автоматического удаления мелких сосудов в ИО могут значительно улучшить диагностическую чувствительность и точность метода ASQ.















14.10.2019
Анна
14.10.2019
Константин