Автори: Richard D. Bellah, Monica S. Epelman, Kassa Darge
КЛЮЧОВІ СЛОВА:
Сечовивідний, інфекція, оцінка, тракт, сонографія
Інфекція сечовивідних шляхів (ІСВШ) є поширеною патологією у дітей і однією з найбільш частих причин дитячої захворюваності. Золотим стандартом діагностики ІСВШ є виявлення культури патогенних бактерій (зазвичай Escherichia coli, Klebsiella, Proteus і Pseudomonas) в сечі. Однак, в амбулаторних умовах часто використовуються скринінгові методи (наприклад, визначення рівня лейкоцитарної естерази або нітритів в сечі).
У патогенезі ІСВШ у дітей відіграють роль різноманітні складові. Коли такі чинники бактеріальної вірулентності як, наприклад, фактори адгезивності і рухливості, переважають фактори резистентності організму, ймовірність розвитку ІСВШ підвищується. Велику роль відіграють також анатомічні, гуморальні і генетичні чинники. Найбільша захворюваність ІСВШ, як для хлопчиків, так і для дівчаток зустрічається у віці до одного року життя, а потім поступово зменшується. Протягом перших декількох місяців життя захворюваність ІСВШ у хлопчиків перевищує таку у дівчаток, ймовірно, через колонізацію патогенними бактеріями крайньої плоті, у дітей без кругового висічення крайньої плоті. Однак, первинна і рецидивуюча ІСВШ частіше зустрічаються у дівчаток. Оцінка показників інфікування в перші 24 місяці життя наводить такі дані захворюваності: 3% хлопчиків менше 1 року, 2% хлопчиків старше 1 року (<0,5% для хлопчиків з видаленим препуцієм), 7% дівчаток менше 1 року і 8% дівчаток у віці від 1 до 2 років. У деяких дослідженнях також була показана тенденція до зниження ІСВШ у білошкірих, у порівнянні з чорношкірими дівчатками.
Симптоми ІСВШ у дітей можуть бути дуже різними, що залежить від того, чим обмежується інфекція – сечівником, сечовим міхуром або проксимальним відділом сечовивідних шляхів (сечовід, чашково-мискова система або паренхіма нирки). Однак справжня захворюваність достовірно невідома через відсутність специфічності та симптоматики. У разі відсутності даних візуальних досліджень, немовляті з лихоманкою, або дитині з клінічно значимим рівнем бактеріємії без будь-яких інших явних вогнищ інфекції, чисто з клінічної точки зору попередньо ставиться діагноз ІСВШ проксимальних відділів (пієлонефрит). Коли у дитини розвиваються симптоми ІСВШ і на тлі проблем з сечовипусканням, з незначним підвищенням (або без) температури і відсутністю системних проявів, попередньо ставиться діагноз ІСВШ дистальних відділів (цистит). Однак відмінність не завжди очевидна, особливо у маленьких дітей. В результаті, захворювання, пов’язані з ІСВШ, можуть бути дуже різними: від системного ураження, пов’язаного з гострим пієлонефритом, до симптомів порушення сечовипускання – циститу. Хоча дані тривалого динамічного спостереження в літературі обмежені, в декількох дослідженнях дитячої популяції відзначається зв’язок між нирковим фіброзом, який викликається гострим пієлонефритом з гіпертонією, і пізньою стадією ниркової недостатності. Хоча в сучасних дослідженнях і піднімається питання про такий взаємозв’язок, значна поширеність і висока захворюваність, що пов’язані з ІСВШ у дітей, визначили необхідність подальшого вивчення ролі візуальних методів дослідження в алгоритмі діагностики та лікування.
МЕТА ТА ЗАВДАННЯ ПРОВЕДЕННЯ ВІЗУАЛЬНОГО ДОСЛІДЖЕННЯ
Мета дослідження сечовивідної системи у пацієнтів дитячого віку при розвитку інфекції полягає в тому, щоб: (1) виявити можливу причину інфікування, щоб запобігти рецидиву і зменшити ризик поширення хвороби; (2) визначити, чи мають нирки нормальну структуру, чи залучені вони в патологічний процес або чи схильні до ризику розвитку фіброзного процесу; (3) визначити, чи має місце міхурово-сечовідний рефлюкс (МСР), що сприяє розвитку висхідної інфекції від сечового міхура; (4) ідентифікувати конкременти сечовивідних шляхів, які можуть тривалий час зберігатися і служити причиною повторної ІСВШ; (5) виявляти зони обструкції відтоку сечі. Хоча МСР вважається основним фактором ризику розвитку ІСВШ і ураження нирок, було показано, що ІСВШ і фіброзний процес в нирках можуть виникати і без МСР, так само як і деякі діти з ІСВШ і МСР можуть ніколи не мати ознак фіброзного процесу в нирках. Алгоритм візуальної діагностики, який зазвичай включає ультразвукове дослідження (УЗД), радіонуклідне дослідження (з димеркаптобурштиновою кислотою [DMSA – dimercaptosuccinic acid]) і мікційну цистоуретрографію (МЦУГ), поступово піддається змінам. Незважаючи на це, багато організацій, такі як Американське товариство радіологів та Європейська екологічна спільнота дитячої радіології, стандартизували діагностичні візуальні дослідження, і підготували рекомендації для оцінки дитини з ІСВШ. Однак загальновідомим є той факт, що жодна візуальна техніка діагностики не може відповісти на всі основні питання. Ще більш суперечливим є те, що деякі дослідники нещодавно поставили під сумнів використання УЗД, незважаючи на його привабливість в якості неінвазивного методу. Це відбувається головним чином через нездатність ультразвуку виявляти запальні зміни, дрібні пошкоджені ділянки в нирках або переміжну дилатацію, яка пов’язана з МСР. В одному з досліджень, в якому було поставлено під сумнів необхідність проведення рутинного УЗД, були отримані наступні показники для виявлення МСР: чутливість – 17%, специфічність – 88%, позитивна прогностична цінність – 24% і негативна прогностична цінність – 83%. В іншому дослідженні чутливість становила 10%, при цьому в жодного з пацієнтів з аномальною ультразвуковою картиною нирок не було необхідності зміни тактики лікування. Однак, з огляду на той факт, що з’являються і розвиваються нові методи УЗД, а якість техніки ультразвукового дослідження в сірій шкалі і кольоровій доплерографії продовжує вдосконалюватися, радіологічні організації та дитячі урологічні радіологічні товариства завжди включають УЗД в якості важливого етапу алгоритму візуальної діагностики. Практикуючі педіатри як і раніше неохоче відмовляються від традиційного стандартного УЗД, тому що воно не становить жодного ризику чи дискомфорту для пацієнтів молодшого віку. Нижче розбираються основні базові особливості УЗД для постановки діагнозу ІСВШ у дітей, а також описуються переваги потенційних додаткових ультразвукових методів і додатків, таких як ультразвукове дослідження з високою роздільною здатністю, гармонійна візуалізація і мікційна уросонографія (МУС) з контрастним підсиленням.
ІНФЕКЦІЯ СЕЧОВИВІДНИХ ШЛЯХІВ: ТЕХНІКА УЛЬТРАСОНОГРАФІЇ І ІНТЕРПРИТАЦІЯ РЕЗУЛЬТАТІВ
Оцінка стану сечовивідних шляхів у дітей з ІСВШ повинна включати дослідження нирок; сечоводів (якщо їх видно) і сечового міхура. Слід використовувати високочастотний датчик, який охоплює ділянку потрібної глибини. Для немовлят використовується конвексний датчик від 8 до 13 МГц, для дітей молодшого віку, конвексний датчик від 4 до 9 МГц, а для підлітків може використовуватися конвексний датчик від 2 до 5 МГц.
Для немовлят та дітей молодшого віку спочатку слід оглядати сечовий міхур, тому що дитина може самовільно спорожнити свій сечовий міхур, що ускладнює подальше отримання корисної інформації про сам міхур, про стінку сечового міхура і дистальні відділи сечоводів (їх діаметр і місце впадіння). Сечовий міхур повинен бути досить добре розтягнутий і досліджуватися в поперечних і сагітальних площинах. У поперечній площині зображення повинні бути отримані від верхівки сечового міхура до дна в зоні внутрішнього отвору уретри. У сагітальній площині зображення повинні включати внутрішній отвір уретри, дистальний відділ сечоводів з обох сторін, а також місця впадання сечоводів. Кольорова доплерографія може бути ефективна при ідентифікації місця впадіння сечоводів у вигляді цівки сечі.
У пацієнта з ІСВШ метою сонографії сечового міхура є отримання інформації про можливу причину схильності дитини до інфекції. Товщина стінки сечового міхура зазвичай вважається нормальною до 0,3 см при повному сечовому міхурі, і 0,5 см – при порожньому. Патологічні стани, які можуть викликати потовщення стінки сечового міхура і бути провокуючими факторами розвитку інфекції, включають: обструкцію вихідного отвору сечового міхура (внутрішнього отвору уретри) і дисфункцію сечовипускання (з або без нейрогенної дисфункції сечового міхура) (рис. 1).
Рис. 1. Синдром елімінаторної дисфункції. УЗД сечового міхура (поперечна проекція) до сечовипускання (А) і після сечовипускання (В) у 6-річної дівчинки з частим сечовипусканням тонкою цівкою і рецидивуючою ІСВШ. Показано потовщення стінки сечового міхура, і помірна кількість залишкової сечі.
У дитини з так званим «Синдромом елімінаторної дисфункції», на додаток до дисфункції сечовипускання, в розвитку ІСВШ також може відігравати певну роль закреп. Великі дивертикули сечового міхура також можуть призводити до дисфункції сечовипускання через неможливість повного або ефективного спорожнення сечового міхура (рис. 2).
Рис. 2. Великий дивертикул сечового міхура, який призводить до неповного випорожнення сечового міхура. (A) УЗД (поперечна проекція) сечового міхура (bl) демонструє великий правобічний дивертикул сечового міхура (d). (B, C) МЦУГ показує великий правобічний дивертикул сечового міхура (d), який збільшується під час сечовипускання, що призводить до неповного випорожнення сечового міхура.
При гострому початку захворювання, потовщення стінки сечового міхура може бути викликано циститом, який може мати бактеріальне або вірусне походження. На зображеннях у відтінках сірого спостерігається нерівномірне потовщення стінки сечового міхура, а при кольоровій доплерографії визначається гіперваскуляризація стінки сечового міхура (рис. 3).
Рис. 3. Бактеріальний цистит. Кольорова доплерографія сечового міхура (поперечна проекція) показує значне нерівномірне потовщення стінки сечового міхура з гіперваскуляризацією основи сечового міхура (стрілки).
Потовщення стінки сечового міхура при циститі, викликане аденовірусом, може бути настільки вираженим в деяких випадках, що візуально імітує картину пухлини сечового міхура (рис. 4).
Рис. 4. Вірусний цистит, що імітує новоутворення сечового міхура. УЗД сечового міхура в відтінках сірого (A) і кольорова доплерографія (B) демонструють нерівномірне пухлиноподібне потовщення з гіперваскуляризацією, яке охоплює ліву стінку сечового міхура (стрілки). (C) УЗД сечового міхура через 4 тижні показує зникнення осередкового потовщення стінки сечового міхура.
Крім визначення функціональних порушень сечового міхура, УЗД сечового міхура потрібно для виявлення потенційних супутніх аномалій сечовивідного тракту, таких як: ектопія сечоводу, уретероцелє або мегауретер. При цьому оцінюються діаметр і місце впадіння дистального відділу сечоводів. Низькочастотний ехосигнал або внутрішній клітинний дебрис в межах розширеного просвіту можуть вказувати на суперінфекцію або піоуретеронефроз (рис. 5).
Рис. 5. Піоуретеронефроз (верхній полюс) в подвоєною ниркою з уретероцеле. УЗД лівої нирки (сагітальна проекція) (А) і сечового міхура (поперечна проекція) (В) показує розширений ехогенний верхній полюс (стрілки), розширений сечовід (і) і уретероцеле (uc), яке генерує внутрішні ехосигнали.
Звичайне УЗД в сірій шкалі дистальних відділів сечоводів і чашково-мискової системи зазвичай вважається слабким методом скринінгу для виявлення МСР. Hoberman і колеги вивчили 309 дітей у віці від 1 до 24 місяців за допомогою УЗД, DMSA і МЦУГ. При цьому вони виявили, що чутливість ультразвуку для виявлення МСР при проведенні МЦУГ становила 10%, а позитивне прогностичне значення становило 40%. Діагностика МСР може бути поліпшена за допомогою точних і вдосконалених ультразвукових методів. МУС з контрастним посиленням, при якій використовується внутрішньоміхурова ультразвукова контрастна речовина, набирає широкого застосування, особливо в Європі, як безпечна альтернатива традиційним рентгенологічним методам діагностики МСР – МЦУГ і радіонуклідна цистографія. Якщо розглядати методику МЦУГ в якості еталонного стандарту, техніка МУС для діагностики МСР має наступні показники: чутливість від 57% до 100%, специфічність від 85% до 100%, позитивне і негативне прогностичне значення від 58% до 100% і 87% до 100 %, а також діагностичну точність від 78% до 96%. В даний час робляться спроби ввести МУС в Канаді, де вже доступні відповідні контрастні речовини. Однак в Сполучених Штатах відсутність відповідних контрастних речовин для дітей, які схвалених Управлінням з контролю за продуктами і ліками, затримує впровадження цього методу. МУС включає в себе наступні чотири основні етапи: (1) попереднє дослідження, стандартне УЗД сечовивідного тракту в положенні лежачи на спині, (2) катетеризація або надлобкова пункція сечового міхура в стерильних умовах з введенням фізіологічного розчину і контрастної ультразвукової речовини, (3) дослідження після контрастування, повторення стандартної сонографії сечовивідних шляхів, (4) дослідження після контрастування та сечовипускання, сонографія нирок і термінальних відділів сечоводів (уретри) під час і після сечовипускання. Рефлюкс діагностується при виявленні ехогенних мікропухирців в сечоводах або в чашково-мисковій системі. Після контрастування по черзі скануються права і ліва чашково-мискові системи. Дослідження під час сечовипускання може виконуватися, коли пацієнт лежить або сидить на спеціальному судні, або встає і мочиться в пляшку. Тяжкість рефлюксу оцінюється аналогічно міжнародній системі оцінки рефлюксу для МЦУГ (ступінь 1-5).
Залежно від доступного обладнання, при проведенні МУС використовуються різні методи ультразвукової візуалізації для відображення мікропухирців при рефлюксі. Варіанти візуалізації не тільки впливають на видимість мікропухирців, а й на загальну діагностичну точність дослідження. Стандартне (фундаментальне) УЗД широко використовується для проведення МУС. Його можна комбінувати з кольоровою доплерографією, щоб поліпшити якість виявлення рефлюксу. При використанні гармонійних зображень мікропухирці стають більш помітними в порівнянні зі стандартним режимом, що підвищує чутливість визначення рефлюксу. Найсучасніші методи МУС, які значно вдосконалять методику виявлення мікропухирців при рефлюксі, використовують контраст-специфічну візуалізацію, яка налаштована на конкретну контрастну речовину з використанням низького або високого механічного індексу.
Дані контрастні речовини не тільки підсилюють зображення і фарбуються в певний колір на сонограмі, вони також дозволяють візуалізувати тільки мікропухирці при рефлюксі, при цьому блокуючи фонове зображення у відтінках сірого (рис. 6).
Рис. 6. Везікоуретеральний рефлюкс (мікційна уросонографія). Мікційна уросонографія (МУС) до (А) і після (В, С) внутрішньоміхурового введення контрастної речовини на основі галактози. Для дослідження використовують контраст-специфічну візуалізацію з високим механічним індексом. (A) У нирці визначається виражена чашково-мискова дилатація і витончення коркової речовини. Мікропухирці при рефлюксі зображуються у вигляді накладення кольору, без (B) і частково з усуненням фону на сонограмі в сірій шкалі (C).
Потенційними недоліками МУС в порівнянні з МЦУГ є: (1) уретральна сонографія виконується тільки в декількох центрах і до сих пір не отримала широкого поширення, (2) більша тривалість дослідження і (3) обмеження оцінки функції сечового міхура.
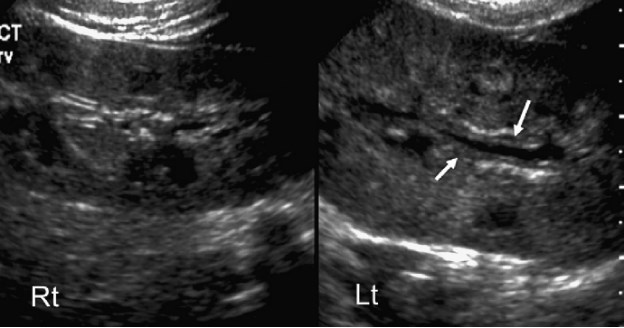
Сонографія нирок переслідує кілька цілей при проведенні первинної оцінки дитини з ІСВШ. Основне її завдання – це виявлення структурних порушень (вроджених або набутих). При гострому процесі, коли у немовляти або дитини молодшого віку діагностується ІСВШ, метою ультразвукового дослідження нирок є визначення ознак інфікування і виявлення вроджених аномалій нирок, які можуть сприяти розвитку інфекції. Серед них виділяють обструктивні уропатії, уроліти, аномалії розміру нирок, аномалії положення або форми, подвоєння чашково-мискової системи з ектопією сечоводу з або без уретероцеле. Довжину нирки (і обсяг) слід вимірювати рутинно і порівнювати з нормальними значеннями відповідно до віку, вагою і, можливо, площею поверхні тіла. Сагітальна площина нирок є найбільш легко відтворюваною проекцією для вимірювання їх довжини, оскільки довжина нирок може варіювати в залежності від положення пацієнта. Збільшення нирок при гострому пієлонефриті може бути дуже варіабельним. Спочатку об’єм нирок може бути нормальним, але з часом він може збільшуватися внаслідок прогресування запального процесу. Збільшення нирок може бути локальним або глобальним (весь орган), в останньому випадку воно варіює від 120 до 175% від нормального розміру (рис. 7).
Рис. 7. Гострий пієлонефрит, дифузний процес. Сонограма нирок з обох сторін демонструє нормальну праву нирку. Ліва нирка рівномірно збільшена, при цьому також збільшена і її загальна ехогенність. Визначається втрата нормальної кортико-медулярної диференціації. Зверніть увагу на потовщення епітелію ниркової миски (стрілки).
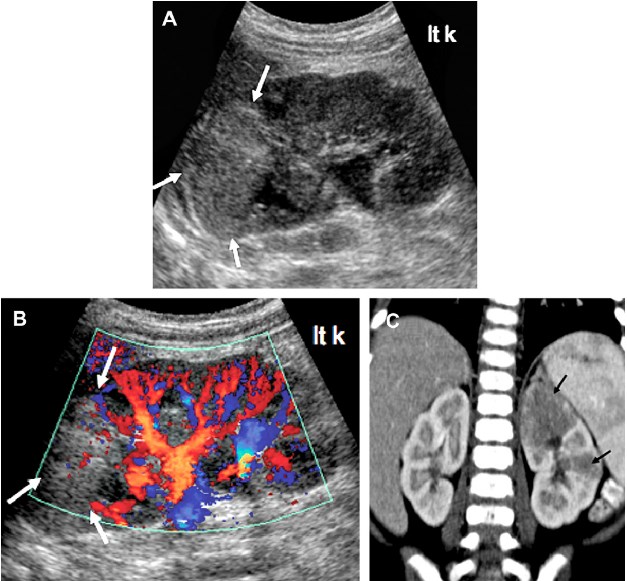
Збільшення нирок може вже не визначатися на сонограмі через 1 – 2 тижні від початку лікування, після усунення вогнища інфекції. Крім однобічного або двобічного збільшення нирок, також визначаються і інші патологічні ознаки, які особливо виражені при важких інфекціях: втрата кортико-медулярної диференціації, локальні гіпоехогенні або гіперогенні осередки в нирковій паренхімі (рис. 8).
Рис. 8. Гострий пієлонефрит, локальний процес. (A) Сонограма в сірій шкалі лівої нирки демонструє велику локальну область (стрілки) гіперехогенності і втрату кортико-медулярної диференціації в зоні верхнього полюса лівої нирки. (B) Кольорова доплерографія демонструє значне зменшення потоку в межах ураженого ехогенного верхнього полюса (стрілки). (C) Контрастна КТ (коронарна реконструкція) підтверджує локальний гострий пієлонефрит в лівому верхньому полюсі і меншу ділянку в середній частині (стрілки) лівої нирки.
Потовщення епітелію чашково-мискової системи нирок або сечоводів може спостерігатися при інфекції (пієліті), а також при МСР (див. рис. 7). На гармонійному зображенні значно краще виділяється заднє затінення, акустичне посилення або артефакт «хвіст комети», що сприяє поліпшенню якості і роздільної здатності зображення невеликих вогнищевих уражень нирок (рис. 9).
Рис. 9. Гострий пієлонефрит, ультрасонографія з високою роздільною здатністю. (A) Ультрасонограмма (сагітальна проекція) лівої нирки з використанням конвексного матричного датчика показує нормальну ехогенність кортикального шару, кортико-медулярну диференціацію і відсутність локальних аномалій. (B) Лінійне зображення високої роздільної здатності показує мультифокальні ділянки (стрілки) кіркового шару у вигляді гіпоехогенних смуг, які характеризують гострий пієлонефрит.
За допомогою гармонійного зображення також може бути покращена контрастна і бічна роздільна здатність, при цьому в педіатричній урологічній практиці гармонійна візуалізація значно перевершує звичайну сонографію при дослідженні нирок з боку спини. У деяких випадках, коли пацієнт може перебувати в спокої і практично не рухатися, кольорова і енергетична доплерографія можуть доповнювати дані дослідження для діагностики гострого пієлонефриту, шляхом відображення ділянок поганої перфузії або її відсутності. Ці ділянки гіпоперфузії відображають васкуліт або вазоконстрикцію периферичних артеріол у відповідь на бактеріальну інфекцію (рис. 10).
Рис. 10. Гострий пієлонефрит, енергетична доплерографія. (A) Сонографія в сірій шкалі демонструє незначне збільшення ехогенності верхнього полюса лівої нирки (стрілки). (B) Енергетична доплерографія демонструє зниження перфузії в верхньому і нижньому полюсах (стрілках) лівої нирки, що характеризує мультифокальний гострий пієлонефрит.
Ця методика особливо важлива для немовлят у віці до 3 місяців, у яких використання Tc-99m DMSA сцинтиграфії, еталонного стандарту для оцінки гострого пієлонефриту, як правило, не рекомендується. Однак в цілому, при діагностиці гострого пієлонефриту без ускладнень, УЗД має гірші показники в порівнянні зі стандартним методом візуалізації, таким як Tc-99m DMSA сцинтиграфія (рис. 11).
Рис. 11. Гострий пієлонефрит, ультрасонографія/DMSA. (A) Сонографія правої нирки демонструє нормальну ехогенність кортикального шару, кортико-медулярну диференціацію і відсутність вогнищевих аномалій. (B). Одночасно проведена DMSA (задня проекція) показує ділянку слабкого наповнення в середині нижнього полюса лівої нирки (стрілки), яка характеризує гострий пієлонефрит.
В одному з досліджень було показано, що патологічні зміни, які були діагностовано при DMSA у 63% з 91 дитини з гострою ІСВШ, ідентифіковані тільки у 24% цієї ж групи за даними сонографії. Однак добре відомо і підтверджено дослідженнями, що ІСВШ у дітей з підвищенням температури може вказувати або на наявність вродженої анатомічної аномалії, або на МСР, тому багато клініцистів вважають, що УЗД нирок залишається необхідним дослідженням в алгоритмі діагностики першого епізоду ІСВШ з фебрильною температурою. УЗД сечового міхура і нирок найчастіше є початковими дослідженнями для виявлення основних патологічних станів, які є сприятливими факторами розвитку інфекції у новонароджених та дітей молодшого віку. Слід, однак, відзначити, що деякі автори ставлять під сумнів цю тактику для тих немовлят, яким проводилася пренатальна сонографія в спеціалізованому центрі після 30-32 тижнів вагітності. У більшості випадків фактором є одна з форм вродженої обструктивної уропатії або вираженого МСР. Цікавим є той факт, що хоча обструкція мисково-сечовідного сегмента є найбільш поширеною вродженою формою обструкції сечовивідного тракту, в нашій практиці ми рідко відзначали обструкцію мисково-сечовідного сегмента в якості основної причини розвитку ІСВШ у дітей. Піоуретеронефроз, при якому інфекція або гнійний дебріс проявляється у вигляді низькочастотного ехосигнала в розширених зонах збиральної системи, переважно розвивається на тлі таких аномалій, як мегауретер і подвоєння нирки з ектопією уретри або уретероцеле, які, в свою чергу, пов’язані з розширенням сечоводу (див. рис. 5). При певних умовах, таких як передчасні пологи або тривале використання антибіотиків, може виникати грибкова інфекція нирок, яка проявляється у вигляді зліпків або грудок ехогенного матеріалу (грибкових кульок) в розширених зонах верхнього відділу сечовивідного тракту (рис. 12).
Рис. 12. Кандидоз нирок (у новонародженого). Сонограма (коронарна проекція) правої нирки у недоношеної дитини демонструє зліпки ехогенного дебрісу в помірно розширеній чашково-мисковій системі всередині нирки.
У рідкісних випадках токсин E. coli може викликати атонію сечоводу, що призводить до ізольованої його дилатації.
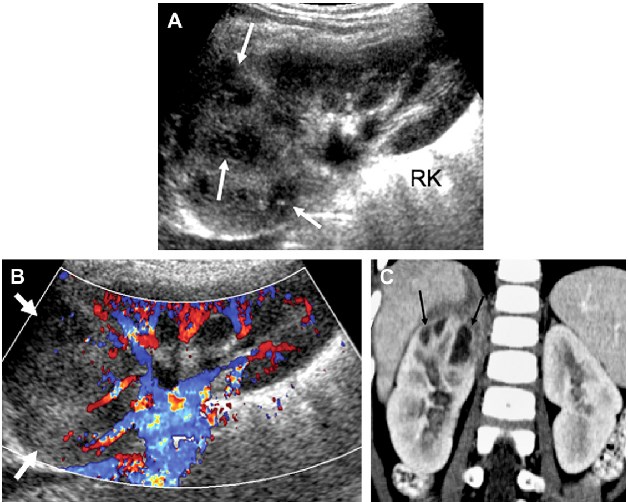
При сонографії можна виявляти ускладнення, пов’язані з гострим пієлонефритом. Серед них: абсцес нирок, перинефральний абсцес, ксантогранулематозний пієлонефрит і ниркові конкременти (рис. 13). Абсцеси можуть бути поодинокими або множинними, при цьому вони є результатом гострого пієлонефриту або гематогенної інфекції. Невеликі паренхіматозні або перинефральні абсцеси можуть погано візуалізуватися на сонограмі у відтінках сірого. Великі абсцеси визначаються як чітко відмежовані гіпоехогенні рідинні скупчення з внутрішнім ехосигналом. У більшості випадків ультразвукове дослідження може бути доповнено додатковою візуалізацією ниркових зрізів в поперечних проекціях, які можуть бути корисні для проведення втручання під ультразвуковим наведенням (рис. 14).
Рис. 13. Ксантогранулематозний пієлонефрит. (A) Сонограма лівої нирки (сагітальна, поперечна проекція) демонструє збільшення лівої нирки з великими гіпоехогенними ділянками, вторинними по відношенню до помірної пієлокалікоектазії. Невеликий конкремент (стрілка) визначається в лівій мисці. (B) Відстрочена контрастна КТ показує нормальну праву нирку, збільшення лівої нирки з запальними змінами фасції Герота, мінімальне кортикальне посилення без екскреції, значну піелокалікоектазію і невеликі ниркові конкременти. (C) Tc-99m Mag-3 сцинтиграфія нирок (задня проекція) демонструє не функціонуючу ліву нирку і нормальну функцію правої нирки
Рис. 14. Гострий пієлонефрит з абсцесами нирки. (A) На сонограмі (сагітальна проекція) правої нирки спостерігається збільшення нирки, з втратою нормальної архітектоніки в зоні верхнього полюса з декількома вогнищевими гіпоехогенними областями (стрілки). (B) Кольорова доплерографія показує виражену перфузію верхнього полюса (стрілки). (C) Контрастна КТ (коронарна проекція) показує ознаки гострого пієлонефриту з мультифокальними абсцесами (стрілки) в верхньому полюсі правої нирки.
Перинефральні абсцеси зазвичай виникають в результаті прориву кортикальних абсцесів в суміжні перинефральні м’які тканини.
Інше завдання первинного ультразвукового дослідження нирок, не обов’язково в період гострого процесу, полягає в виявленні набутих змін, наприклад, паренхіматозний фіброз, викликаний раніше невідомим або не діагностованим інфекційним процесом в нирках. Істотне осередкове витончення кори може бути запідозрено, якщо ехосигнал ниркового синуса (жирова тканина) досягає краю кіркового шару ураженої нирки. Ці зміни найчастіше виявляють себе в ділянках ниркових полюсів (рис. 15).
Рис. 15. Хронічний пієлонефрит. На сонограмі обох нирок показана вогнищева зона стоншування кіркового шару (стрілка) у верхньому полюсі правої нирки (ліва нирка без патології).
Фіброзний процес невеликого і середнього розміру нелегко виявляється при сонографії. Ступінь кортикального стоншення може бути досить серйозним, щоб привести до значного заміщення здорової ниркової тканини. Як і у випадку з гострим пієлонефритом, DMSA є стандартним методом виявлення ниркового фіброзу. Тільки близько 4% дітей мають візуальні ознаки ураження паренхіми в результаті ІСВШ, які видно при DMSA скануванні. У дослідженні Luk і колег з 55 дітей з фіброзним процесом в нирках за даними DMSA, тільки у 29% були патологічні зміни при сонографії (чутливість – 29%, позитивна прогностична цінність – 41%, точність – 89%). У своєму дослідженні вони виявили, що негативна прогностична цінність сонографії в поєднанні з МЦУГ була високою в прогнозуванні відсутності фіброзу, що передбачає, що DMSA не обов’язково виконувати дітям у віці менше 2 років, якщо дані УЗД і МЦУГ є нормальними. Аналогічним чином, Christian і колеги вивчили ризик хибно-негативної діагностики кортикального фіброзу нирки (який виявляється при DMSA сцинтиграфії) якщо використовувати тільки ультразвукове дослідження, факторинг для клінічних ознак (верхніх або нижніх відділів сечовивідного тракту), рецидиви ІСВШ і вікову групу. Вони з’ясували, що ризик відсутності ультразвукових ознак кортикального фіброзу нирки, який виявляється при DMSA, варіює від 0,4% (у дітей шкільного віку з ізольованою ІСВШ нижніх відділів), до 11% (у немовлят з рецидивуючою ІСВШ верхніх відділів). Однак, як і у випадку з ультразвуковими методами, DMSA сцинтиграфія також розвивається. Акцентуючи особливу увагу на нирковому фіброзі, деякі автори вважають, що дітям у віці до 2 років, з документально підтвердженою ІСВШ, має виконуватися і ультразвукове дослідження, для виключення основних анатомічних аномалій, і DMSA сцинтиграфія, для виключення фіброзного процесу в нирках, а також, можливо, необхідне проведення МЦУГ.
РЕЗЮМЕ
За минуле десятиліття алгоритм візуальної діагностики дітей з ІСВШ був поставлений під сумнів на основі даних доказової медицини та досвіду лікарів. Серед розглянутих практичних рекомендацій, які включають в себе кожен з методів візуалізації, рутинне використання УЗД для первісної оцінки неускладненої ІСВШ у дітей стало спірним питанням. Ця думка є результатом кількох досліджень, які показали, що ультразвук має низьку ефективність для отримання додаткової, клінічно корисної інформації. Проте, з огляду на всі переваги ультразвукової методики, в тому числі її ефективність для виявлення структурних порушень сечовидільного тракту, практикуючі фахівці продовжують включати УЗД в якості стандартного дослідження в алгоритм діагностики ІСВШ в педіатричній практиці. А для цих досліджень чудово підійде УЗД апарат від компанії Toshiba – Aplio 300.
Рекомендуємо ознайомитись з нашим оновленим каталогом УЗ сканерів.