Базові знання анатомії черевної аорти та її основних гілок мають важливе значення для правильної інтерпретації результатів ультразвукових досліджень, а також для розуміння патологічних станів, що вражають судини. Існують різні методи доплерівських досліджень, протоколів і діагностичних критеріїв, використовуваних при оцінці аорти та мезентеріальних артерій.
Margarita V. Revzin, MD, MS, John S. Pellerito, MD
ОСНОВНІ ПОЛОЖЕННЯ
• Базові знання анатомії черевної аорти та її основних гілок мають важливе значення для правильної інтерпретації результатів ультразвукових досліджень, а також для розуміння патологічних станів, що вражають судини.
• Розуміння відповідної анатомії та гемодинаміки для нормальних судин, а також при патології, в тому числі аневризми черевної аорти, стенозі судин, розшаруваннях, а також оклюзії, має важливе значення для правильної діагностики.
• Існують різні методи доплерівських досліджень, протоколів і діагностичних критеріїв, використовуваних при оцінці аорти та мезентеріальних артерій.
ВСТУП
У цій статті розглядається сонографічна оцінка черевної аорти та мезентеріальних артерій. У статті розглянута відповідна анатомія і гемодинаміка для нормальних судин, а також при патології, в тому числі аневризмі черевної аорти (АЧА), стенозі судин, розшаруванні і оклюзії. Представлені також різні методи доплерівського дослідження, протоколів і діагностичних критеріїв, використовуваних при оцінці аорти та мезентеріальних артерій. Читачам представлена необхідна інформація для правильної діагностики та показані потенційні помилки, яких необхідно уникати.
Для досліджень рекомендуємо використовувати УЗ систему – SIEMENS S2000.
АНАТОМІЯ ЧЕРЕВНОЇ АОРТИ І ЇЇ ОСНОВНИХ ГІЛОК
Базові знання анатомії черевної аорти та її основних гілок мають важливе значення для правильної інтерпретації результатів ультразвукових досліджень і для розуміння патологічних станів, що вражають ці судини.
Черевна аорта
Черевна аорта є продовженням грудної аорти. Вона починається на рівні аортального отвору діафрагми, на рівні Th12, і закінчується приблизно на рівні L4 шляхом ділення на праву і ліву загальні клубові артерії. Загальні клубові артерії розходяться і розташовуються нижньолатерально уздовж поперекових м’язів. Черевна аорта приблизно 13 см в довжину, її основні гілки можуть бути парними і непарними, парієтальними і вісцеральними. Серед її непарних гілок виділяють: черевний стовбур, верхню брижову артерію (ВБА) і нижню брижову артерію (НБА), а серед парних гілок: ниркові і статеві артерії. Поперекові артерії є парієтальними парними гілками, які знаходяться по обидва боки задньої стінки аорти. Як правило, існує 4 пари поперекових гілок, нижня пара може відходити від загальної клубової артерії. Черевна аорта лежить попереду від хребта, ззаду від підшлункової залози і шлунка та лівіше нижньої порожнистої вени.
Анатомія мезентеріальних артерій та колатеральних шляхів
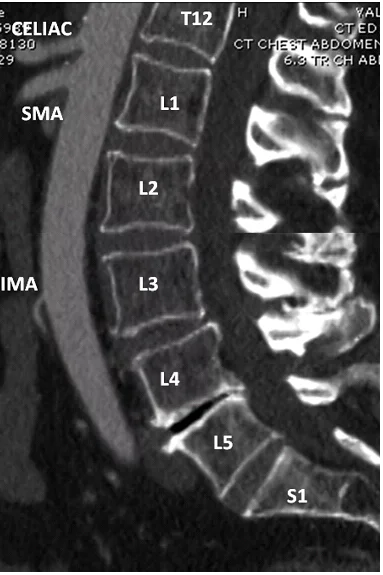
Брижові артерії відходять від черевної аорти. Черевний стовбур є першою гілкою, довжиною приблизно 3 см. Він відходить від передньої поверхні аорти приблизно на рівні Th12 і L1 тіл хребців. Черевний стовбур послідовно розгалужується на селезіночну, печінкову і ліву шлункову артерії. ВБА відходить від передньої поверхні черевної аорти і, як правило, розташована на 1 см нижче черевного стовбура на рівні L1. Судина йде в каудальному напрямку вздовж аорти, в оточенні заочеревинної клітковини, по ходу брижі тонкої кишки в правий нижній квадрант. ВБА ділиться на безліч гілок: нижня панкреатодуоденальна артерія; від 4 до 6 юенальних артерій; від 9 до 13 клубових артерій, клубово-товстокишкова артерія, права і середня товстокишкова артерії. НБА бере початок від передньобічної стінки аорти на рівні тіла L3 хребця, приблизно на 4 см вище біфуркації аорти. Вона ділиться на висхідну ліву товстокишкову артерію і 2 спадні – сигмоподібну і верхню прямокишкову артерії (Рис. 1).
Рис. 1. Гілки аорти. Контрастна сагітальна комп’ютерна томографія (КТ) аорти та її основних гілок. Відношення цих гілок до хребта: черевний стовбур (Th12-L1), ВБА (L1), НБА (L3).
Існує багата колатеральна мережа між всіма мезентеріальними артеріями, яка забезпечує кровотік в життєво важливих органах і кишківнику, якщо одна або більше судин скомпрометовані. Зв’язок між черевним стовбуром і системою ВБА здійснюється через гастродуоденальну артерію. Гастродуоденальна артерія формується з верхньої панкреатодуоденальної артерії – гілки системи черевного стовбура і нижньої панкреатодуоденальної артерії, гілки ВБА. Системи ВБА і НБА з’єднуються дугою Ріолана, що з’єднує середню товстокишкову артерію – гілочку ВБА з лівої товстокишковою артерією – гілочкою НБА. Вона (дуга) утворює коротку петлю, яка проходить поряд з коренем брижі. Крім того, ВБА і НБА анастомозують за допомогою крайової артерії Драмонда, яка є продовженням артеріального кола або аркади уздовж внутрішнього краю товстої кишки, утвореної анастомозами термінальної гілки клубово-товстокишкової артерії, правої і середньої товстокишкової артерії (від ВБА) з лівою товстокишковою і сигмоподібною артеріями НБА. Крім того, є зв’язок НБА і системи внутрішньої клубової артерії через анастомоз верхньої ректальної артерії (гілки НБА) з нижньою ректальною артерією (гілка внутрішньої клубової артерії).
Існують значні відмінності в анатомії колатеральної циркуляції – варіанти зі слабким або відсутнім зв’язом між брижовими артеріями, що зустрічається до 30% населення.
ГЕМОДИНАМІКА ЧЕРЕВНОЇ АОРТИ ТА МЕЗЕНТЕРІАЛЬНИХ АРТЕРІЙ
Гемодинаміка аорти
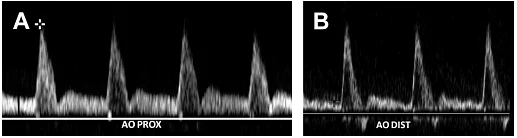
Черевна аорта є еластичною структурою, що забезпечує рух крові на периферію протягом серцевого циклу, розширюючись в систолу і скорочуючись в діаметрі в діастолу. Це фізіологія відбивається у змінах пульсації, які спостерігаються на діаграмі хвилі протягом серцевого циклу. Форми хвилі, отримані в проксимальній черевній аорті відрізняються від отриманих в дистальній аорті. Хоча обидва сегменти показують трифазні форми хвилі, форма хвилі проксимальної черевної аорти має велику тривалість під час діастоли (Рис. 2 А).
Рис. 2. Аортальна хвильова діаграма. (A) Імпульсний доплер проксимального відділу аорти показує сигнал з низьким опором і наявністю потоку в діастолу. (Б) Сигнал дистальної аорти має периферичну трифазну форму.
Це явище обумовлено наявністю декількох великих гілок черевної аорти, які живлять печінку, селезінку і нирки. Ці органи мають кровотік з низьким опором і вимагають безперервного струму крові протягом всієї систоли і діастоли для їх функціонування. Нижче ниркових артерій, форма сигналу черевної аорти імітує периферичні артерії, що характеризуються трифазним сигналом з мінімальним діастолічним потоком і більш помітною зміною напрямку потоку на початку діастоли (див. Мал. 2B). Середня систолічна пікова швидкість (СПШ) в черевній аорті становить 110 см / с в популяції з середнім віком 12 років. Із збільшенням віку, СПШ зменшується, варіюючи від 70 до 100 см / с.
Гемодинаміка мезентеріальних судин
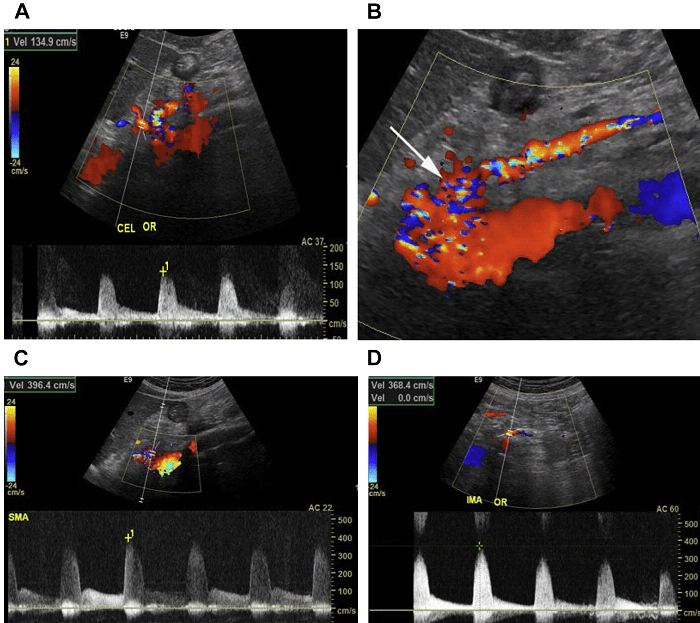
Існує різниця в нормальних параметрах кровотоку між артеріальною системою черевного стовбура і мезентеріальними артеріями (ВБА і НБА). Черевний стовбур кровопостачає органи з низьким опором судинного русла – печінку й селезінку, і тому відбивається безперервним кровотоком, як в систолу, так і діастолу, у зв’язку з високим споживанням кисню печінкою і селезінкою протягом усього серцевого циклу (Рис. 3 А). Суттєвих змін сигналу артеріальної системи черевного стовбура до і після прийому їжі не виявляється.
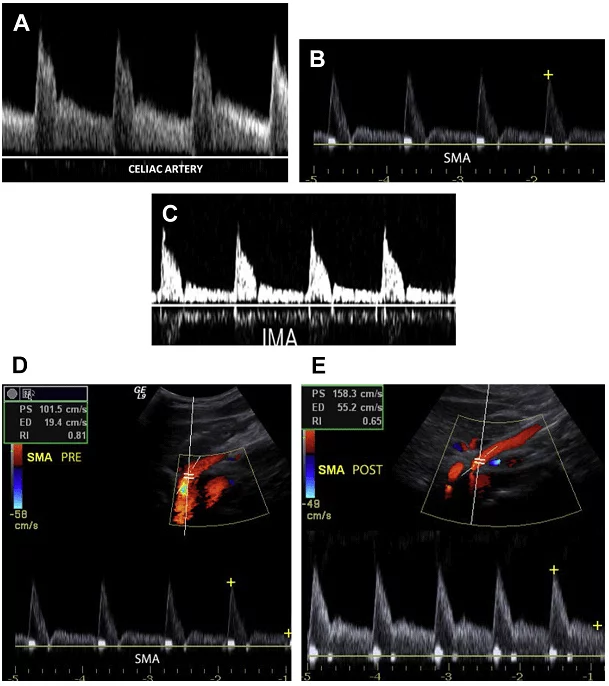
ВБА і НБА кровопостачають шари тонкої кишки і товстої кишки зі змінним опором і, таким чином хвильова діаграма має різну форму: з високим опором в препрандіальному стані і низьким опором потоку в постпрандіальному стані (див. Мал. 3B-Е). Цей стан пов’язаний з розширенням гілок мезентеріальних судин у відповідь на підвищені вимоги в кисні кишківником після вживання їжі. Як результат, пік систолічної і кінцевої діастолічної швидкості збільшується після вживання їжі багатою ліпідами. Середня СПШ в брижових артеріях наступна: в черевному стовбурі діапазони СПШ від 98 до 105 см / с; в ВБА – від 97 до 142 см / с і в НБА – від 93 до 189 см / с (7).
Техніка
Ультразвукове дослідження черевної аорти і вісцеральних судин переважно здійснюється після 8-12 годинного голодування, щоб зменшити кишковий газ. Перед дослідженням не дають ліків.
Використовується сучасне ультрасонографічне обладнання з високоякісним кольоровим, енергетичним і чутливим імпульсним доплером. Враховуючи те, що аорта і брижові артерії розташовані глибоко в черевній порожнині, у стандартних дорослих використовується доплерівський апарат з конвексним низькочастотним датчиком від 2 МГц до 5 МГц.
Рис. 3. Хвильова діаграма мезентеріальних артерій. (A) Імпульсний доплер черевної артерії показує низькорезистивний сигнал з високою діастолічною швидкістю. (B, C) Препрандіальний імпульсний доплер від ВБА і НБА відображає сигнал високого опору з мінімальним потоком в діастолу. (D, E) Препрандіальний і постпрандіальний імпульсний доплер від ВБА відображає збільшення діастолічної швидкості в ВБА після їжі.
Різні види доступу можуть бути використані для вивчення аорти та мезентеріальних артерій. Передній доступ є найбільш поширеним, з розміщенням датчика трохи нижче мечоподібного відростка грудини. При вивченні брижових артерій може використовуватися кілька орієнтирів для забезпечення правильної інтерпретації анатомії. Черевний стовбур в поперечній площині має характерний зовнішній вигляд з Т-подібною біфуркацією (ознака чайки). ВБА часто служить орієнтиром для ідентифікації інших великих судин брижі через її унікальне анатомічне розташування: на поперечних сканах ВБА оточена кільцем заочеревинного жиру, який відділяє її від підшлункової залози. У пацієнтів з нормальним рухомим кишківником, ВБА лежить зліва від верхньої брижової вени, ззаду від селезінкової вени і підшлункової залози і спереду від лівої ниркової вени. Візуалізація цих структур покращує виявлення цих судин і допомагає виявити конкретний варіант анатомії.
ПРОТОКОЛ
Черевна аорта
Стандартний протокол сканування черевної аорти спочатку включає оцінку з використанням сірої шкали та кольорового доплерівського режиму для виявлення будь-яких патологічних станів, таких як атеросклероз судин, звуження просвіту, розшарування або аневризма. Поздовжні і поперечні зображення черевної аорти послідовно отримують від рівня діафрагми до рівня її біфуркації, з візуалізацією загальних клубових артерій. Вимірювання діаметра судини повинні бути виконані на декількох рівнях: проксимальному, середньоабдомінальному, дистальному і проксимальному сегментах обох загальних клубових артерій. На поздовжніх і поперечних сканах аорти і загальної клубової артерії вимірюється зовнішній діаметр до зовнішньому діаметру в передньо-задній і поперечній площинах. Вимірювальні мітки повинні бути розміщені уздовж зовнішньої межі стінки аорти. Поперечний розмір аорти також може бути оцінений у фронтальній площині. Обидві загальні клубові артерії особливо добре візуалізуються у фронтальній площині у пацієнтів в положенні на лівому боці. Потім виконується послідовне кольорове доплерівське сканування середньої частини аорти і спектрометрія.
Мезентеріальні (брижові) артерії
Стандартний протокол сканування судин внутрішніх органів починається з оцінки черевної аорти в сірій шкалі і кольоровим доплером, після чого виконується імпульсне доплерівське дослідження аорти на рівні брижових артерій. Ці виміри слугують базовими показниками швидкості для порівняння з СПШ брижової артерії. СПШ згодом вимірюється у початку проксимального та середнього сегментів черевного стовбура, ВБА і НБА. Дистальні сегменти брижових артерій не видно при ультрасонографії, хоча це не вважається значним обмеженням, тому що більшість атеросклеротичних уражень відбувається поблизу початку цих судин.
АТЕРОСКЛЕРОЗ І ОКЛЮЗІЙНЕ УРАЖЕННЯ АРТЕРІЙ
Структура стінки аорти
Щоб зрозуміти патофізіологію розвитку атеросклеротичної бляшки в черевній аорті, клініцисти повинні мати чітке розуміння структури стінки аорти. Внутрішній шар називається інтимою і складається з ендотеліальних клітин з мінімальною кількістю субендотеліальної сполучної тканини. Його функція полягає у запобігання агрегації тромбоцитів і тромбозу, регулювання тонусу гладкої мускулатури глибоких шарів, модуляція зростання гладком’язових клітин та їх міграції, і контроль впровадження ліпопротеїнів в стінку судини. Зовнішній шар стінки аорти називається адвентицією і відповідає за загальну міцність на розрив. Ваза-вазорум і дрібні нерви проходять через цей шар. Між інтимою і адвентицією знаходиться середня оболонка, яка складається з окремих пучків гладких клітин, еластичних волокон і колагену. М’язовий компонент підтримує тонус стінки судини. Внутрішня і зовнішня еластична мембрана відокремлюють інтиму від середньої оболонки і, відповідно, середню оболонку від адвентиціального шару, відповідно.
Формування атеросклеротичної бляшки
Атеросклероз є найпоширенішим типом артеріальних оклюзійних захворювань, що характеризуються розвитком бляшки уздовж стінки артерії з подальшим звуженням просвіту судини. Це захворювання є хронічним і прогресуючим, що може призвести до майже повної або повної оклюзії судини. Утворення бляшок в першу чергу є результатом пошкодження ендотеліальних клітин інтими з відкладення ліпідів в стінці і розвитком клітинної гіпоксії.
Найбільш раннім проявом атеросклерозу є повільне, прогресуюче потовщення інтими, викликане підвищеною її проникністю з подальшою міграцією лейкоцитів, запальною клітинною відповіддю і поступовим відкладенням пінистих клітин в інтимі. Цей процес призводить до міграції клітин гладких м’язів і розвитку жирових прошарків, які є зонами первісного накопичення ліпідів. Жирові прошарки поступово розвиваються в фіброзні бляшки, які є вогнищевими ураженнями на поверхні просвіту артерії, покритої неушкодженим ендотелієм. Бляшки стають вразливими, коли фіброзна покришка розривається і на її поверхні утворюється тромб. Цей тромб нестабільний і може призвести до емболії.
На відміну від цього, стабільна бляшка – гіалінізована, містить більше фіброзної тканини, кальцинована і має високий вміст ліпідів. Вона вражає більш дрібні судини, викликає менше запалення і має гладку поверхню. Частота емболії при стабільній бляшці дуже низька.
Сонографічна оцінка атеросклеротичної бляшки і асоційованого стенозу просвіту судини
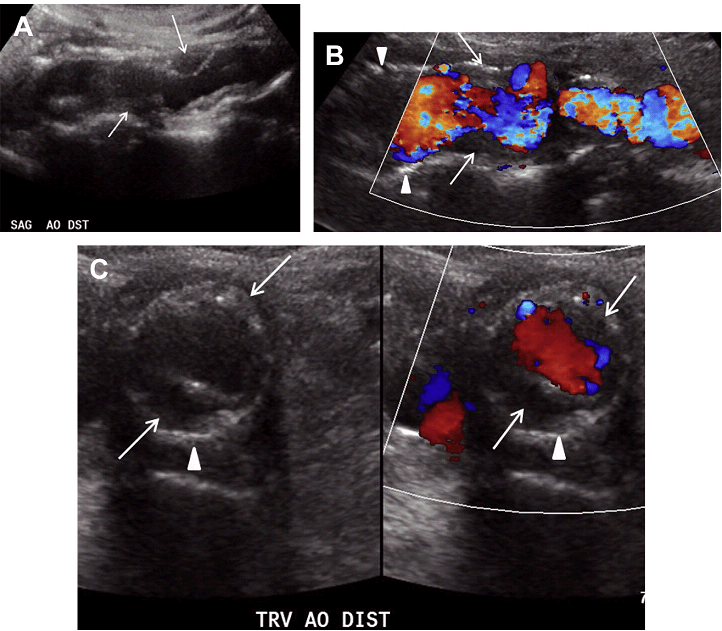
Сонографія відіграє важливу роль у виявленні атеросклеротичних бляшок і оцінці ступеня стенозу, пов’язаного з їх розвитком. На зображенні в сірій шкалі, геморагічна бляшка зазвичай гіпоехогенна, може бути з нерівною поверхнею, яка виступає в якості вогнища для агрегації тромбоцитів. На відміну від цього, стабільна бляшка, як правило, більш гіперехогенна на зображенні в сірій шкалі через велике відкладення кальцію і відмінностей структурного вмісту бляшки. Деякі бляшки більш неоднорідні за ехогенністю: за рахунок ехогенних і гіпоехогенних компонентів м’яких тканин, які відображають мінливість їх складу (Рис. 4 А, В).
В аорті основна частина атеросклеротичних бляшок виникає біля початку її основних судин і в місці біфуркації. Найбільш поширеним місцем розвитку атеросклеротичної бляшки є грудна аорта, а друге за частотою місце – аорто-клубовий сегмент. Більшість атеросклеротичних бляшок асиметричні в поперечному перерізі. Ці дані найкраще оцінювати при ретельному обстеження бляшки в різних площинах, щоб точно визначити ступінь стенозу (Рис. 4 C).
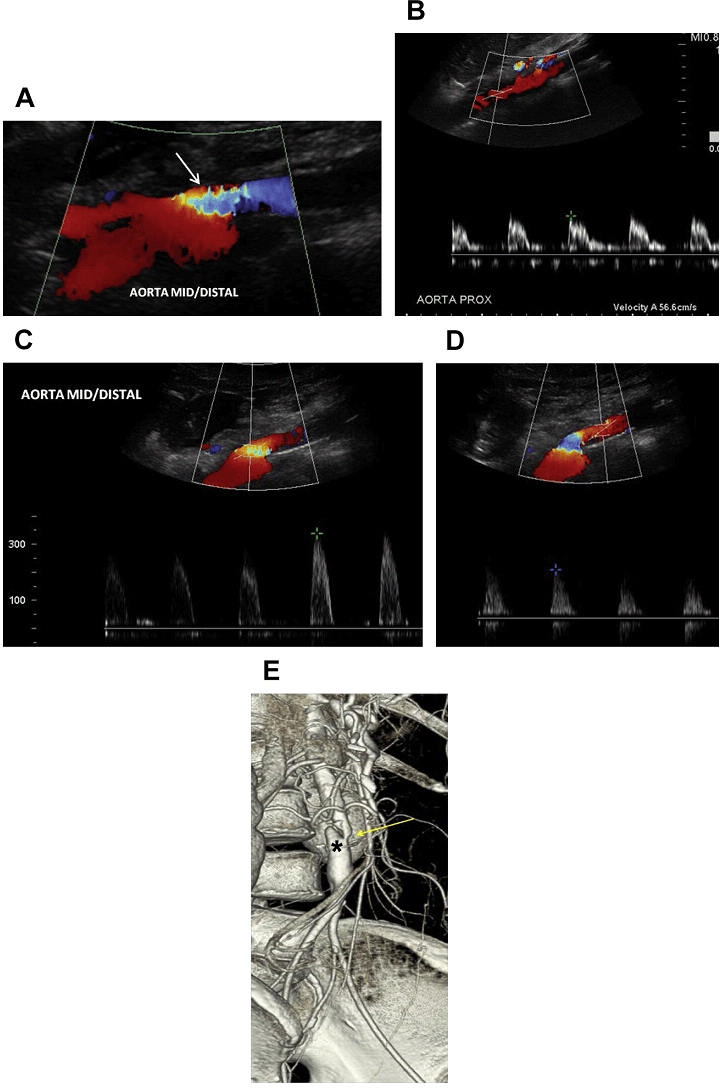
При ультрасонографії, виявлення стенозу посилюється кольоровим доплерівським зображенням при накладенні його на місце очевидного стенозу сегмента (Рис. 5).
Для того щоб збільшити чутливість діагностики аортального стенозу, клініцисти повинні налаштувати параметри кольорового доплера до ламінарного току в неураженому сегменті аорти, а потім шукати будь-які осередкові порушення кровотоку вздовж черевної аорти. Після того, як виявлено порушення кровотоку, проводиться вивчення об’ємного кровотоку в центрі гемодинамічно аномальної судини. Спектральний доплерівський аналіз покаже не тільки помітне зростання СПШ в зоні стенозу, але також може показати наявність повільної і малої форми пульсової хвилі дистальніше стенозованого сегмента, як в основній судині, так і ії гілках (Рис. 6 і 7).
Рис. 4. Атеросклероз і бляшки. Сагітальний скан в сірій шкалі (А) і кольоровий доплер (B) дистального відділу черевної аорти свідчать про значні м’які (стрілки) і кальциновані (наконечники стріл) бляшки, асоційовані з легким та помірно нерівномірним звуженням просвіту. (C) Поперечний скан в сірій шкалі (D) і кольоровий доплер підтверджують ступінь звуження просвіту в зоні м’яких (стрілки) і кальцинованих (наконечники стріл) бляшок.
Оклюзія аорти
Розвиток стенозу високого ступеня є повільним і прогресуючим процесом, який, як правило, супроводжується розвитком каналів колатерального кровотоку. Пацієнти зазвичай звертаються при погіршенні симптому нижніх кінцівок, такого як кульгавість, вторинного по відношенню розвитку прогресуючого оклюзійного звуження аорти. Коли звуження аорти є істотним, симптоми можуть з’являтися в стані спокою, що також може привести до болю в сідницях і стегнах. У чоловіків також може розвиватися імпотенція.
Рис. 5. Аортальний стеноз, скоріше за все, викликаний атеросклеротичною бляшкою. (A) Кольоровий доплер середнього / дистального відділу аорти показує локальне накладення кольорових спектрів (стрілка) – стеноз аорти на цьому рівні. (B) Спектральний доплер проксимальної черевної аорти показує низькошвидкісні (57 см / с), високорезистивні хвилі. (C) Високошвидкісний потік (> 300 см / с) в середній частині аорти відповідає наявності стенозу. (D) Наявність повільної і малої форми пульсової хвилі ідентифіковані дистальніше області стенозу. (Е) Відповідна об’ємна КТ черевної аорти показує виражений стеноз середнього / дистального відділу аорти (жовта стрілка) з постстенотичною ділятацією (зірочка).
Оклюзія дистальної аорти, що супроводжується цими симптомами, називається синдромом Леріша.
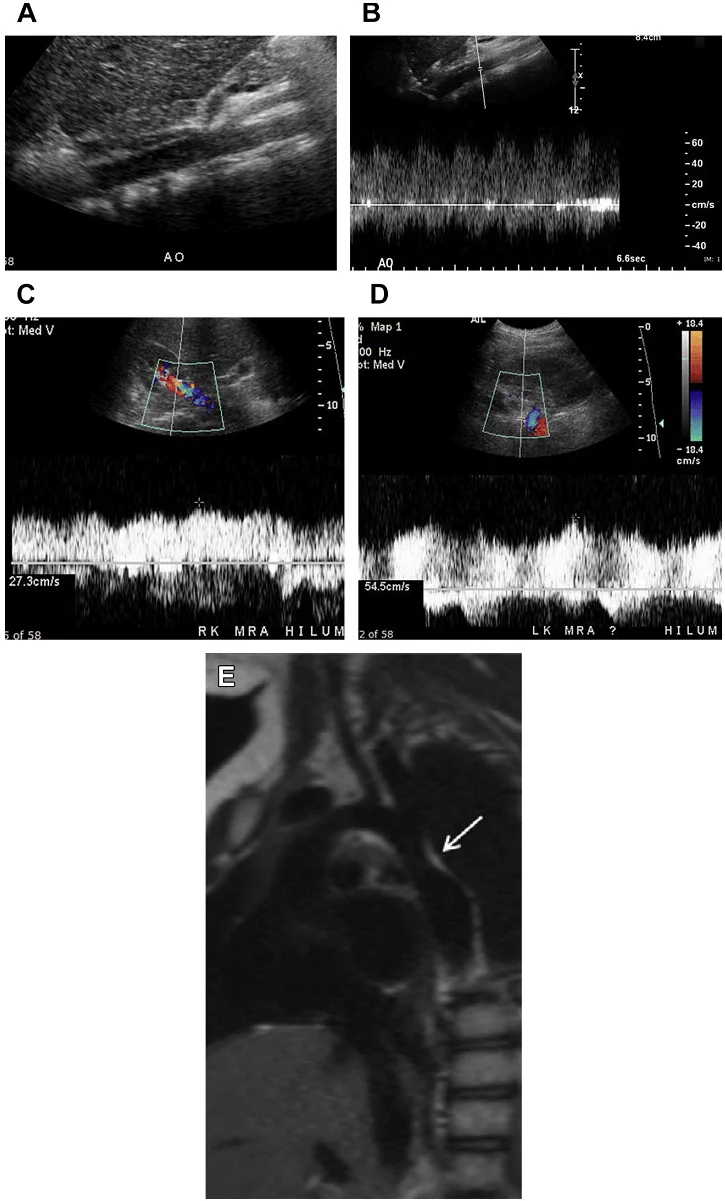
Повна оклюзія аорти найчастіше відбувається в нижній частині черевної аорти (Рис. 8 A D). У більшості випадків тромб поширюється вгору до рівня ниркових артерій без оклюзії ниркових артерій. ВБА і її гілки служать як колатеральне джерело для відновлення кровотоку в загальних клубових артеріях через анастомози з товстокишковими гілками НБА (див. Рис. 8 E G).
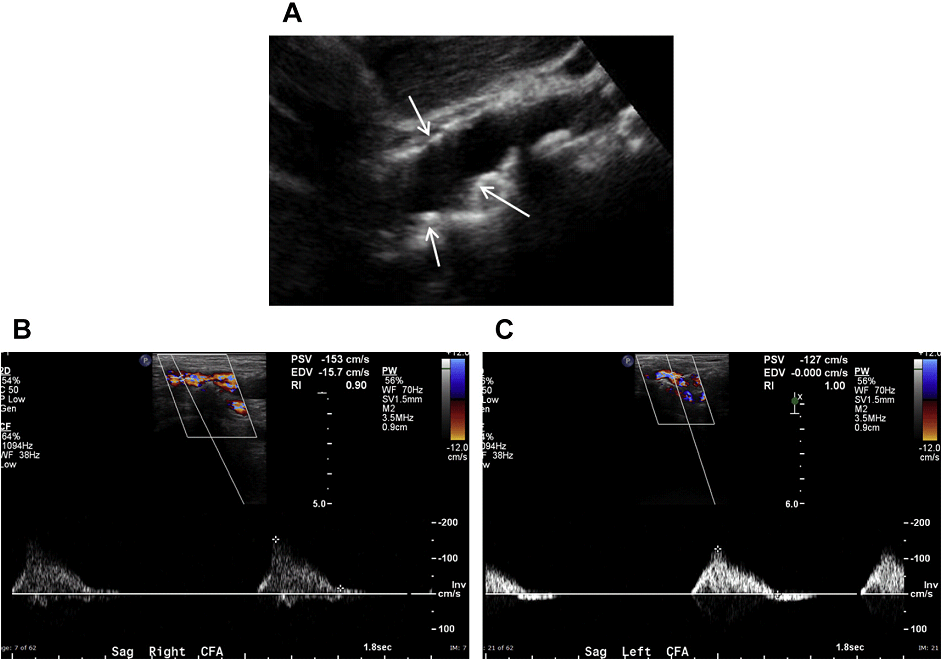
Рис. 6. Аортальний стеноз. (А) Сагітальний скан в сірій шкалі середньої частини черевної аорти показує значну кількість атеросклеротичних бляшок (стрілки); тим не менш, на цьому зображенні ступінь стенозу важко оцінити. (B, C) Спектральний доплер обох загальних стегнових артерій показує наявність повільної і малої форми пульсової хвилі, що припускають наявність значного ураження кровотоку, ймовірно, викликаного аортальним стенозом.
Нормальні розміри черевної аорти
Розміри черевної аорти залежать від статі і віку, у чоловіків ця судина більше, ніж у жінок і дітей. Діаметр аорти збільшується з віком. Середній розмір черевної аорти у чоловіків становить приблизно 27 мм в передньозадньому розмірі на рівні діафрагми і поступово звужується до 21 мм на рівні клубової біфуркації (16). У жінок діаметр аорти менше на 3-5 мм.
Рис. 7. Коарктація аорти. (A) Передпроцедурний сагітальний скан в сірій шкалі черевної аорти показує нормальний діаметр черевної аорти. (BD) Передпроцедурний спектральний доплерівський аналіз показує наявність повільної і малої форми пульсової хвилі по всій черевній аорті та обох ниркових артеріях. (E) Після стентування магніторезонансна (МР) ангіографія грудної клітки показує постійне осередкове звуження просвіту низхідній грудної аорти (стрілки), що відповідає залишковій коарктації.
Рис. 8. Оклюзія аорти. Спектральний (А), кольоровий і енергетичний доплер, сагітальне (В, D, Е), і поперечне (C) зображення аорти показує кровотік тільки в проксимальному відділі черевної аорти (стрілки А). Кровотоку не видно нижче рівня ВБА, відповідно до оклюзії аорти (зірочка А, В, D, Е) і правої клубової (зірочка D) артерії. ВБА служить колатеральним джерелом для відновлення артеріальних систем нижньої кінцівки (стрілка в Е). (F) Високорезистивні хвилі у пацієнта з СПШ в ВБА до 180 см / с. (G) Сагітальний КТ скан аорти показує значно кальциновані бляшки по всій довжині, що обтурують черевну аорту (зірочка). ВБА – розширена і продовжується до рівня таза (стрілка).
АНЕВРИЗМИ ЧЕРЕВНОЇ АОРТИ (АЧА)
Розвиток АЧА
АЧА зазвичай зустрічається при атеросклеротичній хворобі. Найбільш поширеними факторами ризику є: літній вік, куріння і гіпертонія. Інші фактори ризику включають: сімейний анамнез, захворювання сполучної тканини, гіперхолестеринемія, травма і інфекція. АЧА пов’язана з високою смертністю, спричиненою розривом аневризми. Розрив АЧА – 10-а за значимістю причина смерті в Сполучених Штатах. АЧА визначається як збільшення передньозаднього (ПЗ) розміру просвіту аорти більш ніж на 30 мм. Більшість аневризм варіюють в діапазоні від 30 до 40 мм в ПЗ діаметрі.
Патофізіологія АЧА і розрив АЧА
Знання патофізіології аневризм має важливе значення для розуміння механізму розвитку аневризми і її розриву. Освіта АЧА – результати дегенеративного процесу, який характеризується послабленням стінки черевної аорти. Спочатку відбувається активація запального процесу, що відповідає за продукцію і виділення матричних руйнуючих ферментів, які призводять до вкорочення напіврозпаду еластину і апоптозу клітин гладких м’язів з розвитком адгезивного мурального тромбу. Деградація еластичних волокон і колагену призводить до ослаблення і, зрештою, до розриву стінки аорти. АЧА більш ніж 5,5 см, пов’язані з 10% щорічним ризиком розриву, тому ці пацієнти зазвичай потребують хірургічного втручання. Невеликі аневризми також можуть привести до розриву, хоча щорічний ризик істотно менший (1% на рік).
Розрив аневризми викликається нерівномірною напругою і деформацією аномально ослабленої стінки аневризми. Висловлювалося припущення, що внутрішньостінний тромб, що зазвичай зустрічається в просвіті АЧА пов’язаний з більш високою частотою розриву, викликаного ослабленням черевної стінки. Є декілька чинників, які сприяють прогресуванню аневризми і подальшого ії розриву, в тому числі напруження черевної стінки (співвідношення між діаметром аорти та пульсовим тиском), напруження і деформація стінки аневризми і її міцність на розрив. Нерівномірний розподіл навантаження на аорту призводить до вогнищевих відмінностей в міцності на розрив, що веде до неоднорідного взаємозв’язку між міцністю стінки і силою впливу на неї. Якщо аневризма розривається в області патології стінки аорти, то значить сила впливу на судинну стінку перевищує межу її міцності на розрив. Ця закономірність визначається законом Лапласа, в якому говориться, що ризик розриву аневризми безпосередньо пов’язаний з розміром аневризми, так як сила впливу на стінку аорти є результатом сумації радіуса судини і кров’яного тиску.
Темпи зростання аневризм
Більшість малих АЧА збільшуються повільно, але існує висока мінливість темпів зростання серед різних індивідів. Розмір і зростання АЧА залежить від віку пацієнта і його статі. Наприклад 3-см АЧА у пацієнта чоловічої статі має середній темп зростання 1,28 мм на рік. З АЧА до 5 см, темпи зростання 3,61 мм / рік. Загалом, для кожного збільшення діаметра АЧА на 0,5 см, темпи зростання збільшуються на 0,59 мм / рік і частота розриву збільшується в 1,91 (31). Темпи зростання збільшуються у курців (на 0,35 мм / рік) і зменшуються у пацієнтів з цукровим діабетом (на 0,51 мм / рік). Частота розриву майже в 4 рази вище у жінок, ніж у чоловіків і у два рази вище у активних курців. Існує значна гетерогенність темпу зростання серед досліджень, опублікованих в літературі.
АЧА скринінг і спостереження
Скринінг аневризм і подальше регулярне спостереження відомої аневризми має важливе значення у зв’язку з хронічним прогресуючим характером росту аневризми, високим ризиком розриву і подальшої смерті при великих аневризмах. Ультрасонографія найбільш часто використовується як метод скринінгу і спостереження за пацієнтом з АЧА, з точністю дослідження майже 100%. В даний час скринінг пропонується для чоловіків старше 65 років, а також людей з анамнезом куріння. Різні дослідження показали значне зниження смертності від АЧА в результаті скринінгу с 21% до 68%. Інтервали між проведенням досліджень залежать від розміру аневризми, хоча в даний час не існує єдиної думки про оптимальні інтервали часу між спостереженнями. АЧА, як правило, є безсимптомною до моменту розриву.
Як згадувалося раніше, ризик розриву для малих АЧА низький, що говорить на користь очікувальної тактики в такому випадку. Винятки з цього правила включають пацієнтів з цукровим діабетом або затятих курців, в яких ризик розриву є вищим. Більш низький поріг виконання операції для жінок також розглядається, враховуючи те, що в них більш високі темпи зростання аневризми і ризик розриву.
Типи АЧА
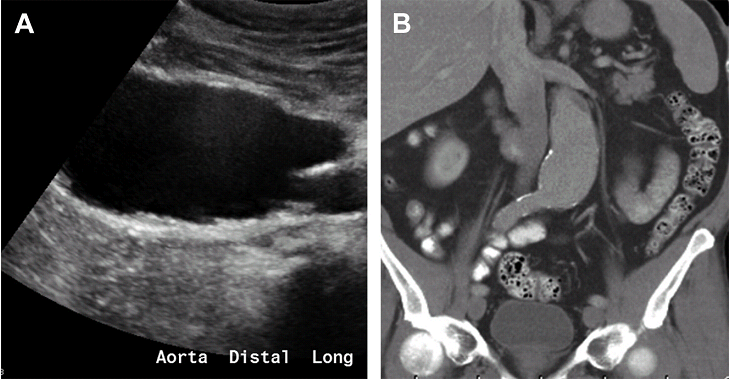
АЧА можна розділити за місцем розташування, морфологією та причинами. Що стосується розташування, АЧА можуть бути поділені на супраренальні (зустрічаються найрідше: травми, інфекції, ятрогенні причини), юкстаренальні і інфраренальні (найбільш поширені). Морфологічні підкатегорії включають: мішечкуваті, веретеноподібні або аневризми по типу пісочного годинника (2 суміжні, аневризми що перериваються, розділені нормальним сегментом аорти) (Рис. 9).
Рис. 9. Веретеноподібна аневризма аорти. Сагітальний (А) і коронарний (В) КТ скан без контрасту дистальної аорти показує веретеноподібне розширення аорти.
Причинно-наслідкові підтипи розділені на: атеросклеротичні (найбільш поширені), запальні (поширеність <10%; пов’язані з заочеревинним фіброзом і характеризуються товстою фіброзною стінкою), та грибкові (поширеність <1%, як правило, викликані інфекцією і розташовані в нетипових місцях, пов’язані з високою смертністю у зв’язку з швидкими темпами росту).
Діагностичні критерії
Ультразвукові критерії для встановлення діагнозу АЧА включають:
1. Локальне розширення черевної аорти більш ніж 3 см;
2. Збільшення діаметра аорти більш ніж в 1,5 раза по відношенню до сусіднього неураженого сегмента;
Приблизні терміни спостереження АЧА
|
Щорічно |
3-4 см |
|
Кожні 6 місяців |
4-4,5см |
|
Кожні 3-6 місяців |
4,5-5см |
|
Кожні 3 місяці |
5-5,5см |
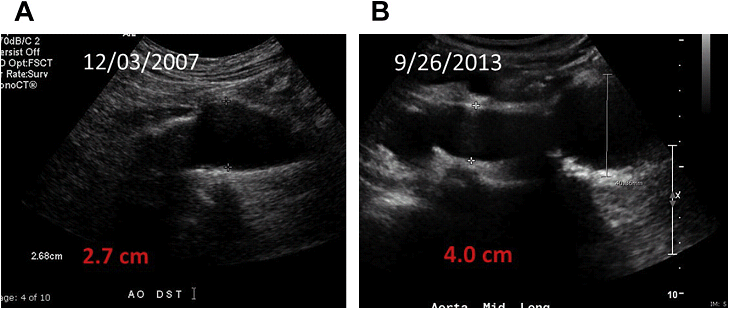
Локальні області ектазії або локалізовані опуклості черевної аорти можуть бути ранніми ознаками формування аневризми і повинні досліджуватися на протязі 2-3 років (Рис. 10).
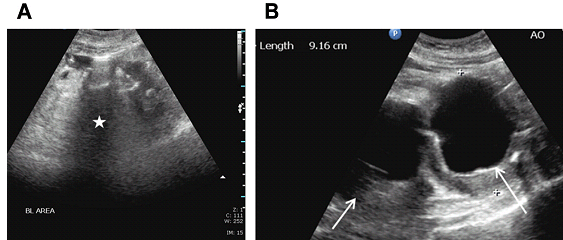
Рис. 10. Зростання аневризми. Сагітальний скан в сірій шкалі дистальної аорти показує збільшення розміру аневризми з 2,7 см 12/03/2007 до 4.0 см 9/26/2013 з темпом росту 2.36 мм / рік.
Сонографічна оцінка АЧА
Сонографічна оцінка аневризми аорти повинна включати візуалізацію в поздовжній площині для виміру ПЗ діаметра і перпендикулярно довгої осі для оцінки поперечного розміру. Обидва поперечний і ПЗ діаметри повинні бути виміряні від зовнішньої стінки до зовнішньої стінки (Мал. 11 AB).
Поперечні розміри також можуть бути отримані у фронтальній площині. При ектазіях, вимір мішка аневризми може бути перебільшений вигином судини. Повинно визначати найбільший розмір. Обов’язково проводиться вимірювання довжини аневризми.
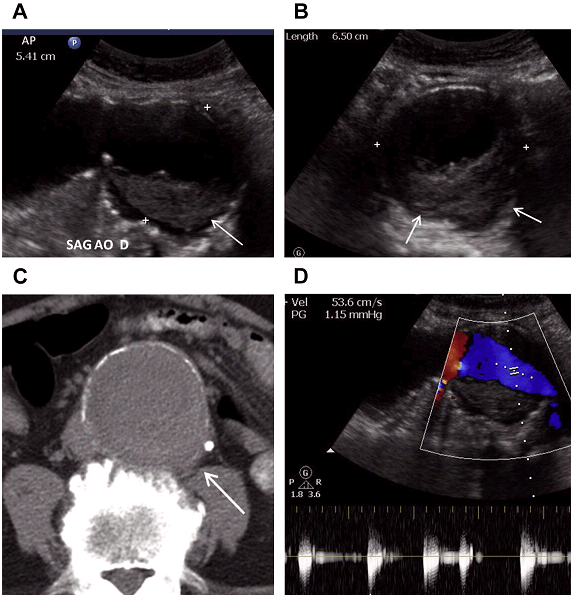
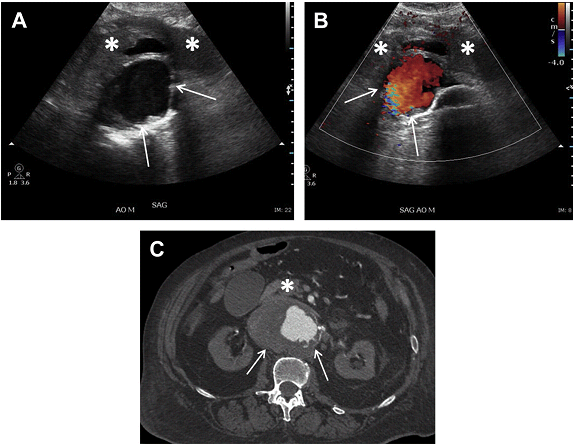
Рис. 11. АЧА з внутрішньопросвітним тромбом у 59-річного чоловіка з болями в животі і черевним шумом при фізикальному дослідженні. (А, В) Сагітальні і поперечні напівтонові зображення через дистальний відділ черевної аорти показують 6,5-см (поперечний) на 5,4-см (ПЗ) аневризми аорти з тромбом на задній стінці (стрілки). Слід зазначити, що діаметр визначається по зовнішній стінці аневризми. (C) Неконтрастне аксіальне КТ зображення показує сплощення задньої стінки аневризми (стрілка), що викликає тривогу на користь розриву. Відзначте кальцифікацію в стінці аневризми. Задній пристінковий тромб менш очевидний на КТ. (D) Турбулентний потік в просвіті аневризми на імпульсному доплері.
Судини також мають бути оцінені на кольоровому доплері для оцінки прохідності просвіту та наявності пристінкового тромбу. Порушення кровотоку в мішку аневризми може бути пов’язано з різкою зміною діаметра судини, що призводить до турбулентного потоку (Рис. 11). Це порушення кровотоку може привести до псевдо “інь-янь” ознаки і не повинно бути прийнято за псевдоаневризму. Наявність пристінкового тромбу, як вважалося раніше, захищає аневризму від розриву. Однак останні дослідження спростували ці дані. В даний час вважається, що запальні процеси, прилеглі до, або в самому тромбі ведуть до подальшого пошкодження стінки аневризми і збільшують ризик її розриву. Розрив аорти є ускладненням, що несе загрозу для життя, і тому може бути запідозреним у пацієнтів з відомою АЧА, які звертаються до лікаря зі скаргами на болі в животі.
Ультразвукова картина при розриві аорти
Хоча сонографія не є методом вибору для оцінки розриву АЧА, вона може бути використана у хворих, які звертаються з неспецифічним болем в животі. Тому дуже важливо, щоб експерт був знайомий з ультразвуковими особливостями розриву аорти.
Найбільш часто при розриві АЧА під час сонографії зустрічаються: заочеревні гематоми, які відображаються як ехогенні заочеревні скупчення рідини, як правило, періаортально, а також гемоперітонеум (Рис. 12 і 13). Рідше, сонографічне обстеження виявляє морфологічну деформацію черевної аорти, флотуючий тромб в просвіті аорти або розрив безперервності стінки аорти в місці передбачуваної патології, з, або без примикаючого заочеревного скупчення рідини. Крововилив в поперековий м’яз також описується.
Лікування та ускладнення АЧА
АЧА зазвичай лікують хірургічним шляхом або ендоваскулярним розміщенням судинного стента. Відкрита операція при АЧА пов’язана з більш високим ризиком смертності (5%), ніж ендоваскулярна (2%), в ранньому післяопераційному періоді. Проте, через пізні ускладнення ендоваскулярних втручань, смертність, пов’язана з цією процедурою зростає до 5%, що вказує на аналогічні віддалені результати.
Рис. 12. Розрив аневризми черевної аорти. 67-річна жінка з відомою АЧА з гострим болем у животі. Сагітальний скан в сірій шкалі (А) і кольорове доплеровське (B) зображення показують аневризму середнього відділу черевної аорти (стрілки) з комплексом аваскулярного ехогенного матеріалу попереду аневризми (зірочки), що відповідає гематомі. (C) Відповідна КТ показує нерівномірну аневрізму середнього відділу черевної аорти (стрілка) з передньої гематомою (зірочка) відповідно до розриву АЧА.
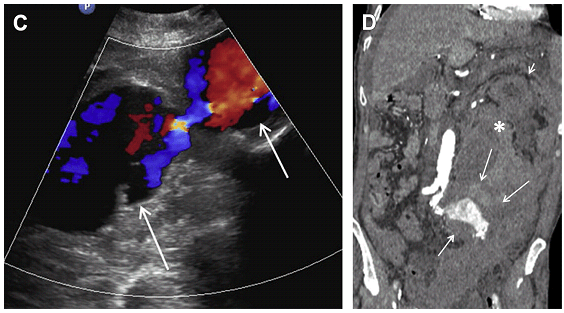
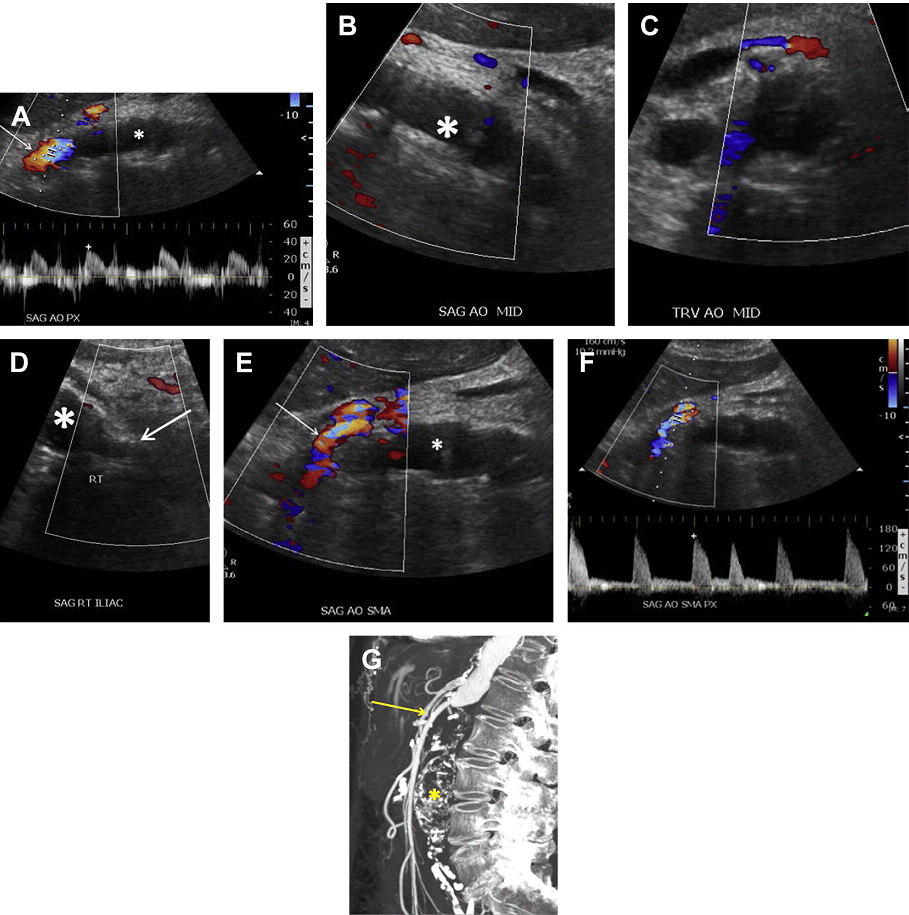
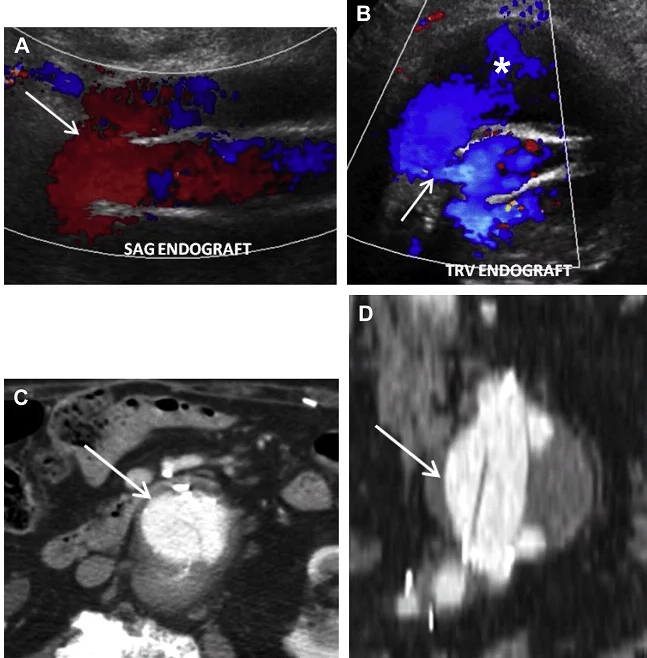
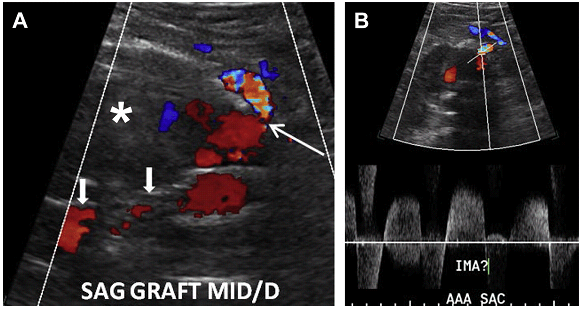
Ризик розриву аневризми менше 5,5 см нижче, ніж ризик хірургічного ускладнення; тому за такими пацієнтамами рекомендується проводити спостереження. Коли планується ендоваскулярна операція, пацієнтам виконується серія досліджень аорти в динаміці з метою оцінки розміру АЧА. Якщо мішок аневризми продовжує рости, то є ризик розвитку ускладнення, пов’язаного з ендоваскулярним стентом. Найбільш частим ускладненням є ендопідтікання, яке можна розділити на 5 підтипів. Тип I є результатом поганої герметизації проксимального або дистального сегменту стента з нативною артеріальною стінкою, тим самим дозволяючи крові текти поза стент і заповнювати мішок аневризми (Рис. 14). Тип II ендопідтікання пов’язаний з ретроградним заповненням мішка аневризми через гілки черевної аорти (найбільш часто поперекові, додаткові ниркові або НБА), (Рис. 15 і 16). Тип III ендопідтікання, як правило, спостерігається в мультисегментарних трансплантатах. При цьому витікання відбувається через дефект або розрив в самому трансплантаті (Рис. 17).
Рис. 14. Тип I ендопідтікання. Поздовжній (А) і поперечний (B) скан кольорового доплера показує потік (стрілки), що проходить від верхньої частини ендопротеза аорти в мішок аневризми (зірочка), відповідно до типу I ендопідтікання. (C, D) Ендопідтікання показане також на аксіальному (стрілка, C) і коронарному (стрілки, D), з контрастним посиленням, КТ зображенні.
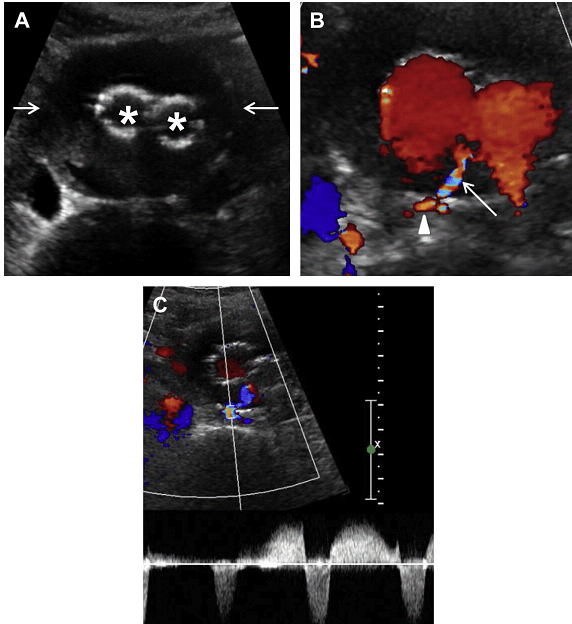
Рис. 15. Тип II ендопідтікання з поперекової артерії. (A) Поперечний скан сірошкальних сонограм показує аневризму (стрілки) з ендопротезом (зірочки). (B) Кольорова доплерографія показує потік в межах задньої стінки аневризми (стрілка) з кольоровим доплерівським потоком в поперековій артерії, яка відходить назад від аорти (стрілки). (С) Спектральне доплерівське дослідження показує кровотік ,,туди і назад,, в поперековій артерії, відповідно до Типу 2 ендопідтікання.
Рис. 16. Тип II ендопідтікання з НБА. (A) Сагітальна кольорова доплерографія показує аневризму (зірочка) з ендопротезом (стрілки). Кольоровий потік видно в передній поверхні сегмента блокованої аневризми (тонка стрілка), викликаний ретроградним потоком від НБА. (B) Імпульсна доплерографія показує кровотік “туди і назад” в НБА, відповідно до Типу 2 ендопідтікання.
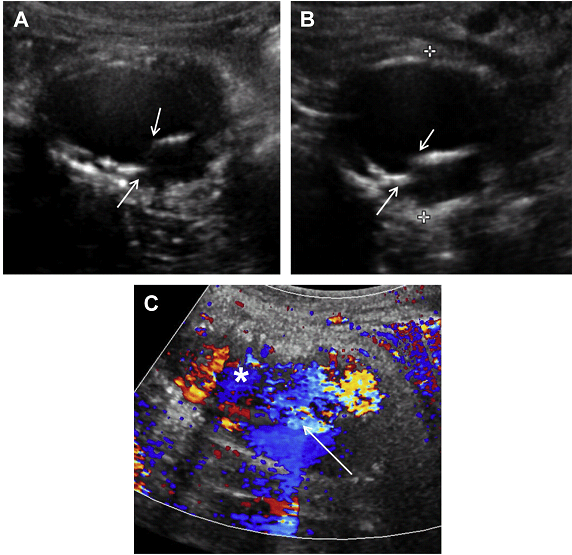
Рис. 17. Тип III ендопідтікання. Збільшення мішка аневризми після ендопротезування аорти. (A, B) Поперечні напівтонові сонографічні зображення в різних фазах серцевого циклу відображають мобільну пластинку (стрілки) з ендопротезного матеріалу. Зверніть увагу на зменшення відстані між стрілками на стадії (В) порівняно з (А). (C) Кольорова доплерографія показує кровотік через цей отвір (стрілка) в ендопротезі в мішок аневризми (зірочка), що узгоджується з ендопідтіканням Типу III.
Тип IV викликаний або наявністю пористої стінки трансплантата, що дозволяє просочуватися крові в мішок аневризми, або наявністю невеликих дефектів тканини в місці накладення швів або опори (при необхідності диференціювання його від Типу III, тип II ендопідтікання найкраще візуалізується на контрастній комп’ютерній томографії або ангіографії). Тип V пов’язаний з ідіопатичним внутрішнім натягом, що призводить до значних розширень мішка аневризми. Вважається, що цей тип ендопідтікання пов’язаний з високим тиском в просвіті АЧА, що може привести до розриву, якщо залишити без лікування. Іншим поширеним ускладненням ендоваскулярного стента є оклюзія кінцівок, яка трапляється в 2-40% випадків. Це залежить в основному від типу трансплантата і тривалості спостереження. Приблизно одна третина пацієнтів з цим ускладненням мають клініку гострої ішемії кінцівки, в той час як у більшості пацієнтів симптоми менш важкі, або цей стан зовсім протікає безсимптомно. На кольоровій доплерографії не виявляється кровотік в оклюзійованій кінцівки після стентування (Рис. 18).
Рис. 18. Усунута АЧА після лікування з обтурованою кінцівкою у 67-річного чоловіка (після розміщення ендопротеза). (A, B) Сагітальний і поперечний кольоровий доплерівський скан через дистальну частину АЧА (стрілки) показує потік в правій кінцівці. Не визначається потік в лівій кінцівці (стрілка, зірочка). (С) Не виявлений кровотік в лівій кінцівці. (D) Артеріальні хвилі присутні в правій кінцівці. (E) Ангіограма показує двостороннє контрастне заповнення ниркових артерій, ендопротеза черевної аорти і правої кінцівки. Немає наповнення судин лівої нижньої кінцівки (стрілки), що відповідає оклюзії лівої нижньої кінцівки.
Рис. 18. Продовження.
РОЗШАРУВАННЯ АОРТИ І МЕЗЕНТЕРІАЛЬНИХ АРТЕРІЙ
Розшарування є найбільш поширеним гострим невідкладним станом аорти, що пов’язаний з високим рівнем захворюваності та смертності, що вимагає термінового медикаментозного або хірургічного лікування. Воно характеризується розділенням інтими і медіального шару стінки аорти, з наступним поширенням крові в несправжній просвіт і подальшим розшаруванням. Існують додаткові розриви в інтимі, які пов’язують справжній і несправжній просвіт. До розшарування черевної аорти зазвичай призводить продовження розшарування грудної аорти. Існуючі раніше пенетрируючі виразки і аневризми також можуть також збільшити ризик розшарування аорти. Пік захворюваності розшарування аорти – шосте й сьоме десятиліття життя, із співвідношенням чоловіки/жінки – 2:1. Існує висока кореляція розшарування аорти з атеросклерозом і гіпертонією. Інші фактори ризику включають: синдром Марфана, синдром Елерса-Данло, коарктація аорти, вживання кокаїну, вагітність і травма. Якщо розшарування діагностується протягом 14 днів від початку симптомів – воно вважається гострим. Розшарування, що діагностується пізніше 2 тижнів від початку симптомів – вважається хронічним.
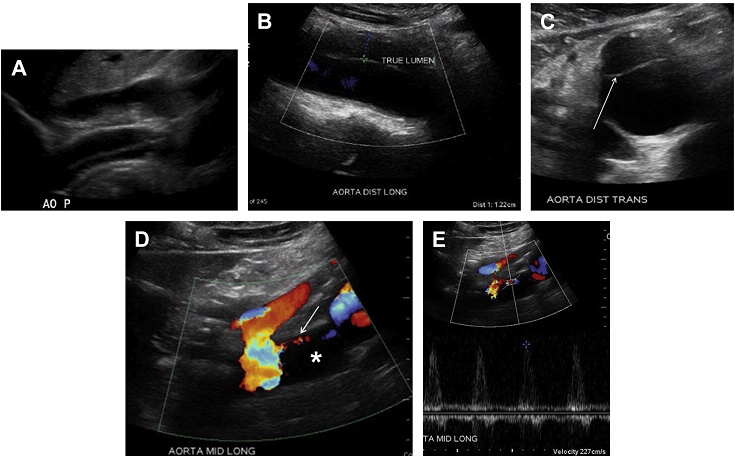
Несправжній просвіт, як правило, є більшим в ПЗ діаметрі, а справжній просвіт може бути звужений і на спектральному доплері показувати збільшення СПШ (Рис. 19).
Розшарований шматок можна побачити у сірій шкалі як ехогенні лінії всередині просвіту аорти (Рис. 19 А-C). Точку входу, що сполучає справжній і несправжній просвіт, також можна побачити в сірій шкалі. Іноді несправжній просвіт тромбований і в такому випадку кровотік в ньому не виявляється і ехогенний шматок важко візуалізується. Несправжній просвіт часто має характерну “туди-сюди” картину на кольоровому доплері, відображаючи кровотік в несправжній просвіт під час систоли, а зворотний потік під час діастоли.
Оцінка основних гілок аорти є необхідною для того, щоб діагностувати розшарування шматка в ВБА, черевному стовбурі, НБА або ниркових артеріях. Збільшення СПШ або відсутність кровотоку в гілках аорти повинні викликати стурбованість на користь розширення зони розшарування шматка в сторону судини, з подальшим звуженням або оклюзією його просвіту (див. Рис. 19 D, E). У цій ситуації дуже важливо оцінити перфузію органу, що кровопостачається з ураженої судини, з метою не допустити можливість виникнення ішемії або інфаркту.
Рис. 19. Розшарування черевної аорти. Сірошкальне сагітальне зображення через проксимальний (A) і дистальний (B) відділ черевної аорти, поперечний (С) скан дистальної аорти відображає ехогенну лінію всередині просвіту аорти, що відповідає частині з розшаруванням (стрілка в C). (D) Кольорове доплерівське зображення через проксимальну черевну аорту на рівні черевної артерії і ВБА показує помітно звужені справжні просвіти (стрілка). Відсутній потік в несправжньому просвіті (зірочка). (E) Існує підвищена СПШ – 227 см / с в справжньому просвіті середньої частини аорти на спектральному доплері, що підтверджує істотне звуження просвіту.
АТЕРОСКЛЕРОТИЧНА ХВОРОБА МЕЗЕНТЕРІАЛЬНИХ АРТЕРІЙ І ІШЕМІЯ кишківника
Природа ішемії кишківника
Прогресивне формування бляшки поблизу початку брижових артерій може призвести до значного стенозу, тим самим ставлячи під загрозу кровопостачання кишківника, що потенційно веде до його ішемії. Через велику кількість колатеральних судин хронічна брижова ішемія не розвивається, як правило, до тих пір поки дві або більше брижові артерії є неураженими (черевний стовбур, ВБА та НБА). Пацієнти з цим захворюванням часто скаржаться на невизначений біль в животі після прийому їжі, втрату ваги, що пов’язана зі зменшенням споживання їжі, здуття живота і пронос. При хронічній мезентеріальній ішемії доплерографію мезентеріальних артерій можна розглядати як початковий неінвазивний метод візуалізаці. Доплерографія може не тільки виявити наявність атеросклеротичних бляшок і збільшення швидкості кровотоку в мезентеріальних артеріях, але може також визначити гемодинамічні значущі стенотичні ураження, показуючи пре- і постстенотичні зміни форми хвилі. Ці результати можуть вплинути на прийняття рішення про втручання у відповідних клінічних умовах.
Діагностичні критерії стенозу брижової артерії
На сьогоднішній день не існує абсолютного консенсусу щодо критеріїв діагностики значимого стенозу брижової артерії. критерії для діагностики значимого стенозу брижової артерії. Найбільш часто прийняті критерії засновані на вимірах СПШ, співвідношення СПШ мезентериальної артерії / аорти (СMA), а також на наявності чи відсутності повільної і малої форми пульсової хвилі (Рис. 20).
Встановлені порогові значення СПШ для черевного стовбура, ВБА та НБА – 200 см/с, 275 см/с і 200 см/с відповідно. Порогові СМА для черевного стовбура, ВБА та НБА є 3,0-3,5. СМА розраховується шляхом ділення СПШ брижової артерії на СПШ сусідньої зони черевної аорти. Наявність повільної і малої форми пульсової хвилі сигналів дуже специфічно для наявності значного проксимального стенозу (майже 100%) всередині судини. Загалом, чутливість сигналу повільної і малої форми пульсової хвилі є низькою, а специфічність – високою.
Інші вторинні ознаки стенозу включають: артефакт кольоровий шум, накладення спектрів кольору і звуження просвіту (див. Рис. 20 B). Іноді наявність колатеральних судин є очевидною. Пошук цих вторинних ознак може полегшити діагностику значимого стенозу брижової артерії. Важливо знати, що наявність декількох діагностичних критеріїв покращує діагностичну точність.
Помилки при проведенні діагностики
Існує декілька підводних каменів, які можна зустріти при виконанні сонографічної оцінки брижових судин. Однією з найпоширеніших помилок є визначення підвищеної СПШ всіх 3 судин, викликане високим систолічним викидом, як правило, у молодих або вагітних, а також у пацієнтів з метаболічними дисбалансом, наприклад, при гіпертиреозі. Дуже низькі СПШ можуть бути виявлені у пацієнтів з низьким систолічним викидом, наприклад, при септичному шоці, крововтраті, серцевій дисфункції, в т.ч. при великих аневризмах аорти. В таких ситуаціях, розрахунок СМА допомагає виявити значущий стеноз. Дуже великий або дуже маленький коефіцієнт повинен насторожити експерта про потенційну помилку. Трапляється, що кровотік збільшується в 1 брижовій артерії в результаті компенсації, в тому випадку, якщо сусідні брижові артерії або оклюзовані, або стенозовані. В цьому випадку, збільшення СПШ визначається по ходу всієї судини і ніяких вторинних ознак стенозу немає.
Рис. 20. Хронічна абдомінальна ішемія. (A) Імпульсний доплерівский скан черевної артерії. СПШ 135 см / с, в межах нормального діапазону. (В) Кольоровий доплер ВБА показує накладення спектрів і артефакт – кольоровий шум в місці стенозу (стрілки). (С) Імпульсний доплер ВБА на місці накладення показує збільшення СПШ (396 см / с), що відповідає значному стенозу. (D) Імпульсний доплерівський скан НБА також показує підвищену СПШ (360 см / с), що узгоджується з істотним стенозом.
Варіантна анатомія брижової артерії може також впливати на точність діагностики. Найбільш часті варіанти анатомії брижових артерій включають: загальний початок черевної артерії і ВБА, варіанти відходження від неї загальної та правої печінкової артерії. Ретельна оцінка брижових артерій усуває ці помилки.
Мезентериальная артеріальна оклюзія
Оклюзія брижової артерії може бути результатом тромбоемболії, а може бути викликана прогресуванням атеросклеротичної бляшки. Вона може носити гострий або хронічний характер. При сонографії не виявляється кровотік в просвіті оклюдованих мезентеріальних судин. При хронічній формі реєструється реверсний потік з повільною і малою формою пульсової хвилі дистальніше місця оклюзії (в результаті відновлення за допомогою колатерального кровообігу). Збільшення компенсаційного кровотоку в сусідній брижовій артерії також може бути видно.
Розшарування мезентеріальних артерій
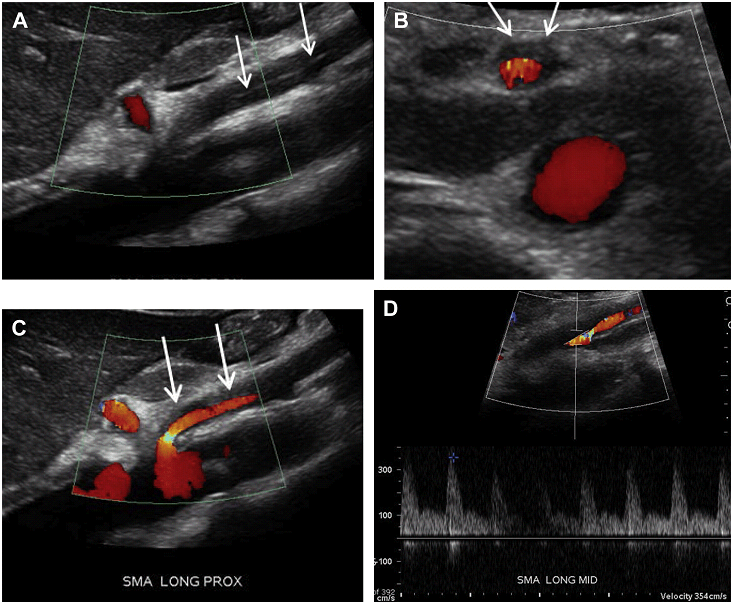
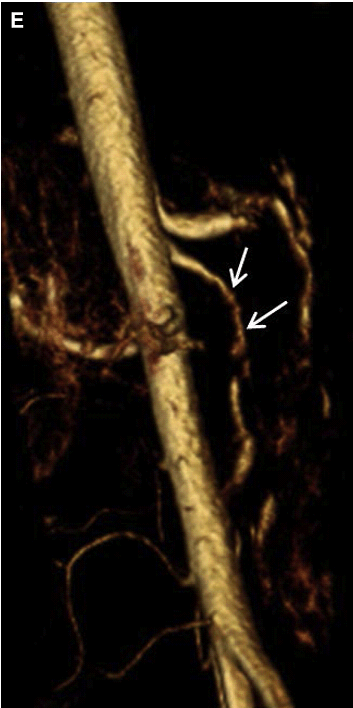
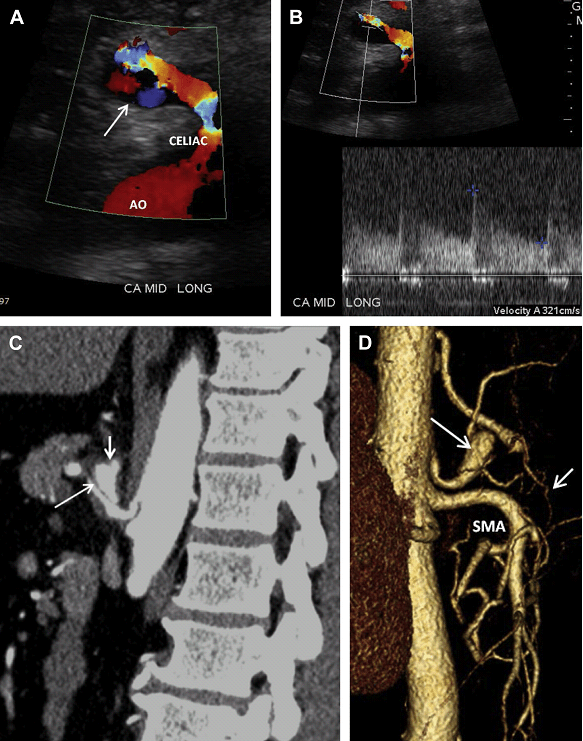
Розшарування брижової артерії зазвичай є продовженням розшарування аорти. Спонтанне ізольоване розшарування брижової артерії зустрічається дуже рідко, а якщо зустрічається, то найчастіше в ВБА. Розшарування печінкової, селезінкової, лівої шлункової і черевної артерій вкрай рідкісні. Причинно-наслідкові чинники включають: атеросклероз, фіброзно-м’язову дисплазію, грибкову інфекцію, травму та вроджені захворювання сполучної тканини. Розташування точки входу ізольованого розшарування ВБА близько 1,5-3 см від її початкового отвору. Цей сегмент ВБА є перехідною зоною між фіксованим сегментом в товщі підшлункової залози і мобільним сегментом в області кореня брижі. Це місце може бути осередком пошкодження інтими, викликане аномальними силовими впливами. Хоча розшаровану частину важко побачити через невеликий діаметр судини, шанси її виявлення можуть бути покращені шляхом ретельної оцінки артеріального просвіту на напівтоновому зображенні (Рис. 21 А). Несправжній просвіт розшарованої артерії – зазвичай тромбований, і може проявитися у вигляді асиметричного її потовщення (Рис. 21 В, С). Справжній просвіт розшарованої артерії може бути помітно звужений, що реєструється підвищеною СПШ на цьому рівні (див. Рис. 21 D).
Синдром серединної дугоподібної зв’язки
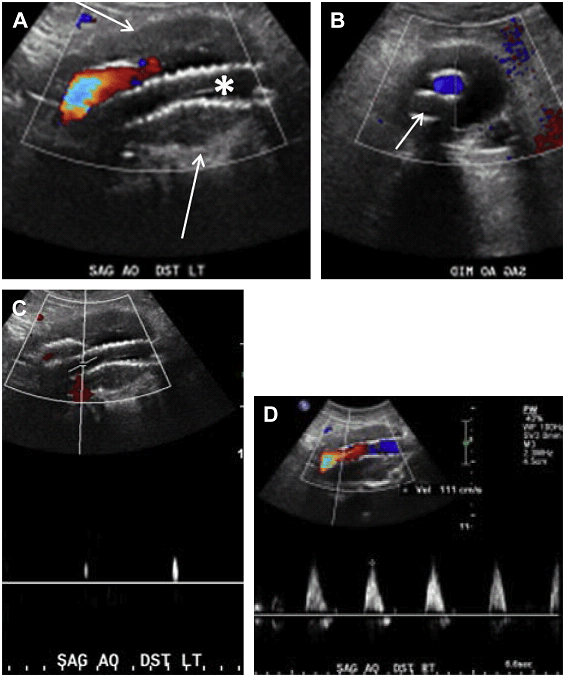
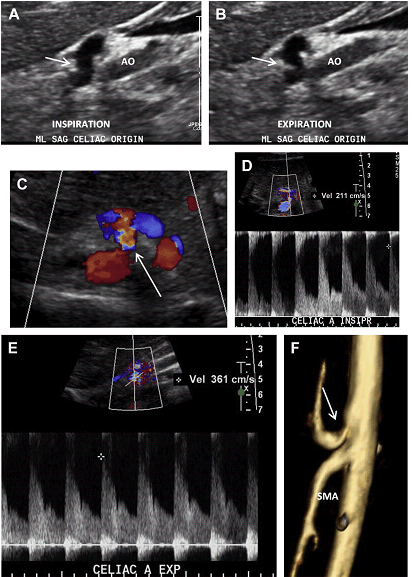
Синдром серединної дугоподібної зв’язки (ССДЗ) визначається утворенням, яке характеризується фіброзним пучком, який перетинає ніжки діафрагми на рівні аортального отвору. Цей пучок знаходиться спереду від черевної артерії і може викликати значне стиснення і стеноз черевного стовбура на видиху. Як результат цього стиснення під час видиху, СПШ в межах початкового / проксимального сегментів черевної артерії помітно збільшується зі зміщенням до заду самої артерії. Типова гачкоподібна картина черевного стовбура під час видиху патогномонічна для діагностики ССДЗ (Рис. 22 А, В).
Рис. 21. Спонтанне розшарування ВБА. (А) Сагітальний скан показує ехогенну лінію всередині просвіту ВБА, відповідно до розшарування (стрілки). (B, C) Поперечний і сагітальний кольоровий доплерівський скан показує потік в справжньому просвіті ВБА і через тромбований несправжній просвіт (стрілки). (D) Спектральний доплер справжнього просвіту ВБА виявив збільшення СПШ (354 см/с), що пов’язано із суттєвим звуженням. (E) Тривимірна (3D) об’ємна КТ-ангіографія показує невеликий, нерівномірний залишковий просвіт ВБА (стрілки).
Рис. 21. Продовження.
Постстенотичне розширення може бути присутнім дистальніше по відношенню до місця оклюзії. Кровотік в черевний стовбур нормалізується під час вдиху, але хронічна компресія черевної артерії при ССДЗ може привести до фіксованого стенозу зі збільшенням СПШ, яке зберігається і під час вдиху (див. Рис. 22 C, F).
АНЕВРИЗМА І ПСЕВДОАНЕВРИЗМА МЕЗЕНТЕРІАЛЬНИХ АРТЕРІЙ
Аневризми вісцеральних артерій є рідкісною клінічною проблемою із вірогідністю смертельного наслідку. Тому дуже важливо знати і діагностувати ці об’єкти, щоб полегшити клінічне лікування. Аневризми вісцеральних артерій найчастіше зустрічаються в печінковій, селезінковій та черевній артеріях. Аневризми панкреатодуоденальної, гастродуоденальної, ВБА та НБА – дуже рідкісні. Аневризми вісцеральних артерій можуть розвиватися в результаті атеросклеротичної хвороби, вроджених аномалій або генетичних захворювань. Ці аневризми зазвичай пов’язані з наявністю неспецифічного болю в животі, а половина з них призводить до розриву, що здебільшого обумовлено помилкою в попередньому діагнозі. Встановлених критеріїв діагностики не існує. Аневризма може бути усунена за допомогою ендоваскулярної емболізації або стентування, або може бути видалена хірургічно. Мішкоподібний тип і більш дистальне розташування брижових аневризм є показаннями до хірургічної резекції. На сонограмі, вони можуть бути видимі, як локальне розширення просвіту судини, при цьому може визначатися “псевдо інь-янь”, ознака на кольоровому доплері (Рис. 23 і 24).
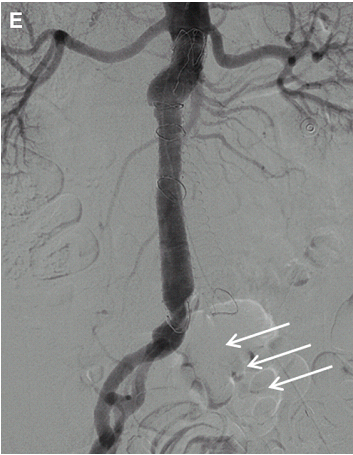
Рис. 22. ССДЗ. 35-річний чоловік з постпрандиальним болем в животі. Сагітальне напівтонове зображення, отримане на вдиху (A) і видиху (B), показує характерну картину ,,риболовного гачка,, з втягуванням черевної артерії на видиху (стрілки). (C) Відзначається накладення в місці початку і проксимальному відділі черевної артерії на кольоровому доплерівському зображення (стрілки). (D, E) Відповідні спектральні доплерівські зображення показують збільшення СПШ в проксимальній черевній артерії на видиху (E). (F) 3D об’ємна МРТ ангіографія показує звуження (стрілка) і стиснення проксимального відділу черевної артерії.
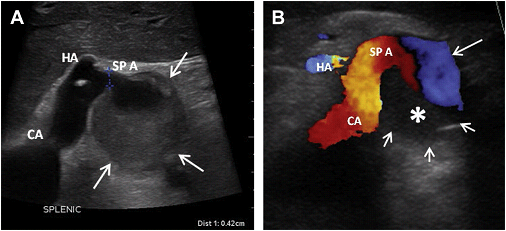
Рис. 23. Аневризма селезінкової артерії у 43-річного чоловіка з фіброзно-м’язовою дисплазією. (A) Поперечне зображення в сірій шкалі на рівні черевної артерії (СА) показує велику (до 3,6 см) частково тромбовану аневризму селезінкової артерії (SPA). (B) Поперечний скан кольорового доплерівського зображення окреслює мішок аневризми (короткі стрілки). Вихровий кровотік (або псевдо “інь-янь” ознака) присутній у видимій частині аневризми (довга стрілка). Частина аневризми тромбована (зірочка). HA – загальна печінкова артерія.
Брижові псевдоаневризми найчастіше зустрічаються при черевній травмі, інфекційних і запальних процесах, таких як панкреатит, вони можуть бути ятрогенними (наприклад, після біопсії). Вони є хибними аневризмами і являють собою судинний розрив, з пошкодженням 2 або більше шарів артеріальної стінки. На сірошкальному зображенні, вони можуть бути видимі, як кістозні структури з, або без пристінкового тромбу. На кольоровому доплері можна побачити “інь-янь” ознаку, але вона не очевидна у випадку тромбозу або дуже повільного кровотоку (Рис. 25). У рідкісних випадках, шийка псевдоаневризми також може бути ідентифікована, що характеризується кровотоком туди і назад по спектральному доплеру. Псевдоаневризма може також мати ознаки розриву – гетерогенний комплекс рідина / згусток в черевній порожнині (Рис. 25). Коли присутній гемоперитонеум, необхідна обережна і ретельна оцінка абдомінальних судинних структур.
Доплерографія відіграє важливу роль в оцінці і лікуванні захворювань аорти та мезентеріальних артерій. Ультрасонографія довела своє значення у виявленні і наступному спостереженні за пацієнтами з АЧА. Вона також може бути використана при оцінці ускладнень після ендоваскулярного лікування аневризми аорти. Ультразвукове дослідження також корисне в діагностиці захворювань брижових артерій, особливо хронічної мезентериальної ішемії, а також допомагає виявити інші порушення, в тому числі розшарування, оклюзію і псевдоаневризму.
Рис. 24. Розшарування аневризми черевного стовбура. Кольоровий і імпульсний доплер показує вихровий кровотік в межах розшарованої аневризми черевної артерії (стрілка, А), збільшений СПШ в справжньому просвіті черевної артерії (B). (C) Розшарований ivfnjr не дуже добре візуалізується при доплерівському дослідженні, але більш очевидний на КТ ангіографії з контрастуванням (довгі стрілки, С). Аневризма черевного стовбура (коротка стрілка) пов’язана з розшарованим шматком (довга стрілка). (D) 3D об’ємна КТ ангіографія виявила аневризму черевного стовбура (довга стрілка). Зверніть увагу на те, що гастродуоденальний кровотік забезпечується колатеральним кровообігом в черевному стовбурі від ВБА (коротка стрілка).
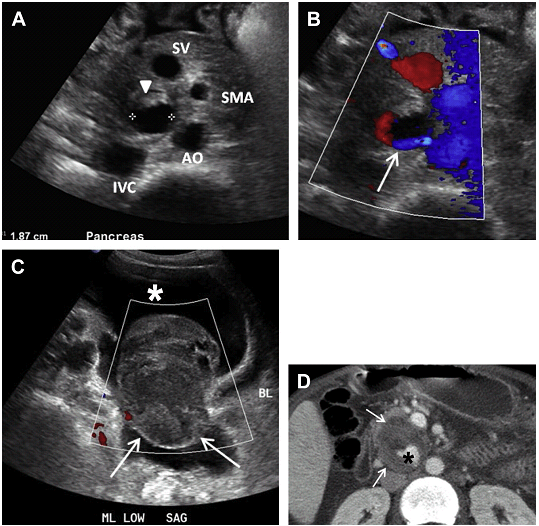
Рис. 25. Розрив псевдоаневризми нижньої панкреатодуоденальної артерії у хворого з хронічним панкреатитом і зниженням гематокриту. (A) Поперечний скан в сірій шкалі через підшлункову залозу показує 1,87-см кістозну структуру (наконечник стрілки) медиальніше нижньої порожнистої вени (IVC), збоку від аорти (AO) і ззаду від селезінкової вени (SV). (B) Зразок потоку типу “інь-янь” (стрілка) відображений на кольоровому доплерівському зображенні. (C) Кольоровий доплер нижньої частини живота показує асцит (зірочка) з поширеним гетерогенним аваскулярним скупченням рідини, що відповідає заочеревинній кровотечі з пошкодженої псевдоаневризми (стрілки). (D) КТ зображення з контрастним посиленням показує частково тромбовану псевдоаневризму (стрілки) нижньої панкреатодуоденальної артерії із заповненням контрасту видимої частини мішка псевдоаневризми (зірочка).















14.10.2019
Павел