Резюме
Мета: Метою цього дослідження було порівняти результати виживання після роботизованої лапароскопічної радикальної гістеректомії (РРГ) та традиційної лапароскопічної радикальної гістеректомії (ЛРГ) при раку шийки матки ІБ1 стадії.
Метод: Це ретроспективне дослідження пацієнток з раком шийки матки стадії IB1, які пройшли хірургічне лікування за допомогою РРГ або ЛРГ. Онкологічні результати пацієнтів порівнювали залежно від хірургічного підходу.
Результати: Загалом, 66 та 29 пацієнтів були розподілені на ЛРГ та РРГ групи. Всі пацієнти мали стадію захворювання IB1 (FIGO 2018). Проміжні фактори ризику (розмір пухлини, лімфоваскулярна інвазія (ЛВІ) та глибока стромальна інвазія), частка пацієнтів, які отримували ад’ювантну терапію (30,3% порівняно з 13,8%, p = 0,09), та середній час спостереження (ЛРГ, 61 місяць; РРГ, 50 місяців; p = 0,085) суттєво не відрізнялися між двома групами. Частота рецидивів була вищою в ЛРГ групі, однак суттєвої різниці між двома групами не було (p=0,250). БВ (55,4 порівняно з 48,2 місяців, р = 0,250) і ЗВ (61,2 порівняно з 50,0 місяців, р = 0,287) були подібними між групами ЛРГ і РРГ.
Висновок: У пацієнтів з розміром пухлини < 2 см частота рецидивів була нижчою в РРГ групі, однак суттєвої різниці не було. Для отримання відповідних даних необхідні подальші широкомасштабні РКД та клінічні дослідження.
Ключові слова: рак шийки матки, роботизована хірургія, роботизована лапароскопічна радикальна гістеректомія, РРЛМ, лапароскопічне обладнання, лапароскопічні стійки.
ВСТУП
Рак шийки матки – один з найпоширеніших видів раку в країнах, що розвиваються 1. У Кореї це другий за поширеністю гінекологічний рак. Хоча захворюваність на рак шийки матки знижується, очікується, що до 2022 року на нього припадатиме 2 971 нових випадків та 749 смертей 2.
Варіанти лікування нововиявленого раку шийки матки добре відомі. Згідно з рекомендаціями Національної комплексної онкологічної мережі (НКОМ), пацієнтки з раком IA, IB і IIA стадії без об’ємних утворень повинні пройти хірургічне лікування 3.
Малоінвазивна хірургія (МІХ) при раку шийки матки вперше була описана в 1992 році Nezhat та співавт. і Canis та співавт. 4, 5. МІХ асоціюється з нижчою операційною захворюваністю та меншою кількістю післяопераційних ускладнень, ніж відкрита операція 6 з подібними результатами 7, 8, що призвело до збільшення використання МІХ 9. Однак у листопаді 2018 року при дослідженні Лапароскопічного підходу до Лікування Раку Шийки Матки (ЛЛРМ) було повідомлено, що МІХ поступається відкритій операції з відносним ризиком (ВР) 3,7 (95% ДІ від 1,63 до 8,58) для рецидиву та 6,0 (95% ДІ від 1,77 до 20,3) для загальної виживаності (ЗВ) 10. Ці результати призвели до зміни парадигми лікування раку шийки матки, і НКОМ та Європейське товариство гінекологічної онкології (ЄТГО) змінили рекомендації щодо лікування раку шийки матки на ранніх стадіях 3, 11.
Існує кілька суперечностей щодо дослідження ЛЛРМ 12, 13. По-перше, результати можуть бути пов’язані з хірургічною технікою або недосвідченістю оператора, а не безпосередньо з МІХ. Використання маткового маніпулятора та інтракорпоральної кольпотомії в умовах пневмоперитонеуму з використанням СО2 може бути причиною розриву і розповсюдження пухлини з її подальшою дисемінацією та обсіменінням очеревини. По-друге, лише 16% учасників дослідження перенесли роботизовану лапароскопічну операцію.
Численні дослідження повідомляють про порівняльні результати між роботизованою лапароскопічною радикальною гістеректомією (РРГ) та відкритою радикальною гістеректомією 14 – 16. Однак лише кілька досліджень порівнювали онкологічні результати між РРГ і традиційною лапароскопічною радикальною гістеректомією (ЛРГ); більшість досліджень в основному були зосереджені на безпеці та доцільності 17 – 19.
Для запобігання інтраопераційного розповсюдження пухлини Kanao та співавт. запровадили техніку “no-look, no-touch” (“не дивись, не торкайся”) 20. Техніка “не дивись, не торкайся” включає наступні заходи: створення вагінальної манжети, маніпуляції з маткою без введення маткового маніпулятора, мінімальний вплив на шийку матки та збір матеріалу в ендобаг. Лапароскопічна радикальна гістеректомія з використанням техніки “не дивись, не торкайся” показала подібні онкологічні результати, як і відкрита радикальна гістеректомія.
З огляду на це, ми припустили, що роботизована лапароскопічна хірургія є кращою за звичайну лапароскопію, якщо вона включає спеціальну процедуру для запобігання інтраопераційного розповсюдження пухлини. Таким чином, ми вирішили оцінити дані нашого закладу, щоб порівняти онкологічні результати в когорті жінок, які перенесли ЛРГ і РРГ з приводу раку шийки матки на ранніх стадіях.
МАТЕРІАЛИ ТА МЕТОДИ
Це ретроспективне когортне дослідження було схвалено Інституційною Оглядовою Радою Католицького Університету Кореї. Вимога щодо отримання інформованої згоди була скасована для цього дослідження через його ретроспективний характер.
Досліджувана група
З онкологічного реєстру нашої установи ми відібрали пацієнток, які пройшли МІХ з приводу раку шийки матки в період з січня 2010 року по грудень 2020 року в лікарні Святого Вінсента. Використовуючи систему стадій FIGO 2018 року, спочатку було включено 119 пацієнток, які отримали первинне хірургічне лікування та мали гістологічно підтверджену стадію IB1 та IB2. Усім пацієнткам була виконана радикальна гістеректомія типу С за класифікацією Querleu-Morrow 21. Ми виключили з аналізу пацієнток з будь-якою з наступних ознак: будь-який гістологічний тип, крім плоскоклітинного раку, аденокарциноми або аденосквамозної карциноми; променева терапія або неоад’ювантна хіміотерапія перед операцією; перенесені операції зі збереженням фертильності або вагінальна радикальна гістеректомія; недостатньо клінічних та/або патологоанатомічних даних. Пацієнток, які відповідали критеріям включення та виключення з дослідження, ми розділили на дві групи: ті, що пройшли ЛРГ, та ті, що пройшли РРГ.
Після операції вибірково проводили ад’ювантну променеву терапію відповідно до критеріїв Седліса 22.
У РРГ групі усім пацієнткам застосовували техніку “не дивись, не торкайся”, щоб уникнути розповсюдження пухлини. У ЛРГ групі матковий маніпулятор використовувався під час операції в кожному конкретному випадку.
Більшість (79,8%) досліджуваної групи мали стадію IB1. Усім пацієнтам зі стадією IB2 була проведена ЛРГ. Жоден з пацієнтів зі стадією IB2 не проходив РРГ. Таким чином, щоб мінімізувати гетерогенність між двома групами, пацієнти зі стадією IB2 були виключені, і були проаналізовані тільки пацієнти зі стадією IB1.
Збір даних та визначення
Ми збирали інформацію про клініко-патологічні характеристики (вік, гістологічний тип, ступінь, стадія за FIGO, розмір пухлини та фактори ризику) та ад’ювантне лікування. Розмір пухлини визначався як найбільший діаметр на основі гістопатологічного дослідження. Безрецидивне виживання (БВ) визначалося як тривалість від дати первинного діагнозу до дати рецидиву на основі даних візуалізації, біопсії тканин або дати останнього спостереження. Загальне виживання (ЗВ) визначалося як тривалість від дати встановлення первинного діагнозу до дати смерті від раку або до дати останнього спостереження.
Статистична оцінка
Відмінності в клініко-патологічних характеристик між двома групами оцінювали за допомогою t-критерію Стьюдента, критерію Xі-квадрат або точного критерію Фішера. Для порівняння БВ та ЗВ між двома групами ми використовували метод Каплана-Мейєра з логранговим критерієм. Всі статистичні аналізи були виконані за допомогою статистичного програмного забезпечення SPSS (версія 21.0; SPSS Inc., Чикаго, Іллінойс, США). Статистична значущість була встановлена на рівні P <0,05.
РЕЗУЛЬТАТИ
Загалом до остаточного аналізу було включено 95 пацієнтів. З них 66 пацієнтам була проведена ЛРГ (69,5%), а 29 – РРГ (30,5%). Клініко-патологічні характеристики пацієнтів представлені в Таблиці 1. Середній вік пацієнтів не відрізнявся між двома групами (52 роки в ЛРГ групі і 50 років у МІХ групі). Жодна з груп не показала суттєвої різниці в гістологічному підтипі або ступені. Всі пацієнти мали стадію захворювання IB1. Проміжні фактори ризику (розмір пухлини, ЛВІ і глибока стромальна інвазія), частка пацієнтів, які отримували ад’ювантну терапію (30,3% порівняно з 13,8%, р = 0,09), і середній час спостереження (ЛРГ, 61 місяць; РРГ, 50 місяців; р = 0,085) суттєво не відрізнялися між двома групами.
Таблиця 1
Клініко-патологічна характеристика пацієнтів залежно від хірургічного підходу (n = 95)
| ЛРГ (n = 66, %) | РРГ (n = 29, %) | P value | |
|---|---|---|---|
| Вік, роки Значення ± СВ |
52.21 ± 1.416 | 50.66 ± 1.568 | 0.766 |
| Гістологічний тип ПКК АК АСК |
50 (75.8) 12 (18.1) 4 (6.1) |
21 (72.4) 8 (27.6) 0 (0) |
0.822 |
| Ступінь 1 2 3 |
19 (28.8) 45 (68.2) 2 (3.0) |
11 (37.9) 18 (62.1) 0 (0) |
0.277 |
| Розмір пухлини (см) Стандартне відхилення |
1.235 ± 0.615 | 1.100 ± 0.788 | 0.062 |
| ЛВІ (+) | 12 (18.2) | 5 (17.2) | 0.913 |
| Глибока стромальна інвазія | 7 (10.6) | 1 (3.4) | 0.250 |
| Ад’ювантна ПТ | 20 (30.3) | 4 (13.8) | 0.090 |
| Час подальшого спостереження (місяці) Медіана, діапазон |
61 14 – 122 |
50 8 – 105 |
0.085 |
ЛРГ, традиційна лапароскопічна радикальна гістеректомія; РРГ, роботизована лапароскопічна радикальна гістеректомія; СВ, cтандартне відхилення; ПКК, плоскоклітинна карцинома; АК, аденокарцинома; АСК, аденосквамозна карцинома; ЛВІ, лімфоваскулярна інвазія; ПТ, променева терапія
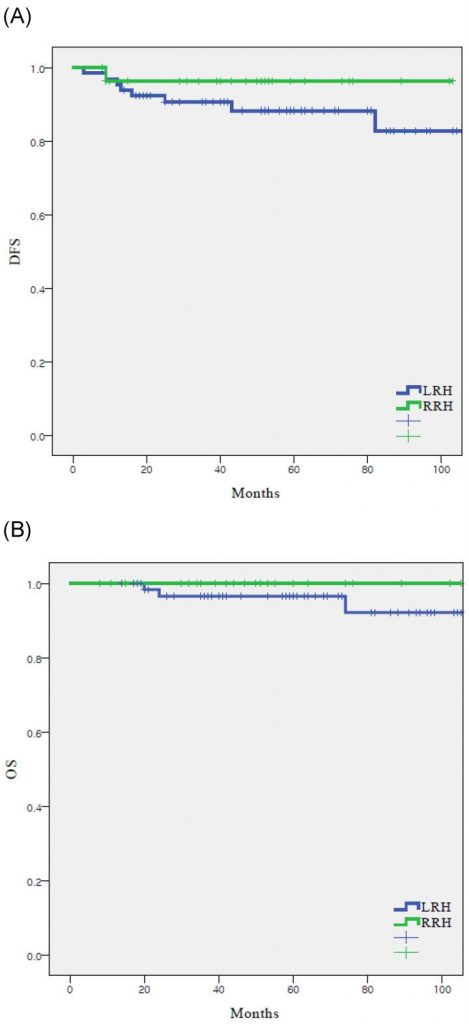
На момент аналізу в когорті було дев’ять рецидивів (9,5%) (Таблиця 2), вісім (12,1%) з ЛРГ і один (3,4%) з РРГ. Частота рецидивів була вищою в ЛРГ групі, однак суттєвої різниці між двома групами не було (p=0,250). У РРГ групі один випадок рецидиву стався в очеревині. У групі ЛРГ п’ять (62,5%) з восьми рецидивів були локальними. У всій когорті було три (3,2%) випадки смерті, пов’язані з раком і всі вони сталися в ЛРГ групі (4,5%). БВ (55,4 порівняно з 48,2 місяців, р = 0,250) і ЗВ (61,2 порівняно з 50,0 місяців, р = 0,287) були подібними між ЛРГ і РРГ групами (Зобр.1).
Зображення 1
Виживаність у досліджуваній популяції. Всі пацієнти. (n = 95) (A) безрецедивне виживання, (B) загальне виживання
Таблиця 2
Результати виживання онкологічних хворих залежно від хірургічного підходу (n = 95)
| ЛРГ (n = 66, %) | РРГ (n = 29, %) | P value | |
|---|---|---|---|
| Рецидив | 8 (12.1) | 1 (3.4) | 0.250 |
| Місця рецидиву, всього Кукса Тазовий лімфатичний вузол Легеня Очеревина |
8 3 (37.5) 2 (25.0) 2 (25.0) 1 (12.5) |
1 0001 (100) |
0.261 |
| Смерть | 3 (4.5) | 0 | 0.287 |
ЛРГ, традиційна лапароскопічна радикальна гістеректомія; РРГ, роботизована лапароскопічна радикальна гістеректомія
Для оцінки прогностичних факторів рецидиву використовували модель пропорційних ризиків Кокса (Таблиця 3). Одновимірний аналіз показав, що жоден з факторів не був достовірно пов’язаний з БВ.
Таблиця 3
Одновимірний та багатовимірний аналіз прогностичних факторів безрецидивного виживання (n = 95)
| Ознаки | Одновимірний аналіз | Багатовимірний аналіз | ||||
|---|---|---|---|---|---|---|
| ВШ | 95% ДІ | P value | ВШ | 95% ДІ | P value | |
| Хірургічний підхід ЛРГ РРГ |
1 (Реф) 0.315 |
– 0.039 – 2.527 |
– 0.251 |
|||
| Гістологічний тип ПКК АК АСК |
1 (Реф) 3.233 – |
– 0.867 – 12.062 – |
– 0.081 0.987 |
|||
| Ступінь 1 2 3 |
1 (Реф) 4.160 – |
0.519 – 33.334 – |
0.179 0.992 |
|||
| ЛВІ Негативний Позитивний |
1 (Реф) 0.536 |
– 0.066 – 4.326 |
– 0.526 |
|||
| Глибока стромальна інвазія | ||||||
| Ні | 1 (Реф) | – | – | |||
| Так | 1.120 | 0.139 – 9.017 | 0.915 | |||
| Ад’ювантна ПТ Ні Так |
1 (Реф) 0.789 |
– 0.163 – 3.820 |
– 0.769 |
|||
До багатовимірної моделі були включені змінні з p < 0,05 при одновимірному аналізі. ВШ відношення шансів; ДІ, довірчий інтервал; Реф, референтне значення; ЛРГ, традиційна лапароскопічна радикальна гістеректомія; РРГ, роботизована лапароскопічна радикальна гістеректомія; ПКК, плоскоклітинна карцинома; АК, аденокарцинома; АСК, аденосквамозна карцинома; ЛВІ, лімфоваскулярна інвазія; ПТ, променева терапія
ОБГОВОРЕННЯ
Вперше про використання МІХ в гінекологічній онкології було повідомлено в 1992 році 23, і численні дослідження порівнювали МІХ з відкритою хірургією при раку шийки матки 6, 9, 24. МІХ була прийнята як альтернатива відкритій хірургії зі зниженою операційною захворюваністю та післяопераційними ускладненнями, а також з подібними результатами. На додаток до традиційної лапароскопії, роботизована лапароскопічна хірургія була схвалена Агентством з контролю за продуктами і ліками для гінекологічних показань у 2005 році. З того часу використання роботизованої хірургії в гінекологічній онкології зросло. Про безпечність та ефективність роботизованої хірургії при раку шийки матки повідомлялося неодноразово 25, 26.
Результати дослідження ЛЛРМ суперечили результатам попередніх досліджень і поставили під сумнів безпеку МІХ 10, що призвело до змін у настановах і протоколах лікування; настанови НКОМ і ЄТГО більше не рекомендують МІХ при раку шийки матки 3, 11. Однією з критичних зауважень до результатів дослідження ЛЛРМ є низький показник РРГ (16%). На противагу цьому, у 2018 році у Швеції понад 80% радикальних гістеректомій було виконано з використанням роботизованої лапароскопічної хірургії 27. Тому дослідження ЛЛРМ може не відображати сучасну практику, особливо в країнах, які впровадили роботизовані платформи для гінекологічної онкології. Після оприлюднення результатів дослідження ЛЛРМ було проведено багато ретроспективних досліджень, в тому числі тих, що спростовували або слідували дослідженню ЛЛРМ 27 – 31. У деяких дослідженнях повідомлялося про подібні онкологічні результати між РРГ і відкритою радикальною гістеректомією 32 – 34. Однак жодне дослідження не показало переваг РРГ порівняно з ЛРГ.
У цьому ретроспективному аналізі, проведеному на базі лікарні, ми порівняли онкологічні результати лікування РРГ та ЛРГ при лікуванні раку шийки матки стадії IB1. У нашій когорті ми не спостерігали відмінностей у клініко-патологічних характеристиках між двома групами. Частота проведення ад’ювантного лікування була вищою в ЛРГ групі, але різниця не була статистично суттєвою.
У нашій когорті частота рецидивів становила 12,1% та 3,4% у ЛРГ та РРГ групах відповідно. Частота рецидивів у ЛРГ групі в нашому дослідженні була подібною до частоти рецидивів у МІХ групі в дослідженні ЛЛРМ (8,5%), а частота рецидивів у РРГ групі в нашому дослідженні була подібною до частоти рецидивів у відкритій групі в дослідженні ЛЛРМ (2,2%).
Нижчу частоту рецидивів у РРГ групі можна пояснити кількома факторами. Перший фактор – це значні переваги роботизованої системи. Роботизована система забезпечує покращений тривимірний зір, більш ергономічне положення хірурга і артикульовані з’єднані інструменти, схожі на зап’ястя, що підвищують хірургічну точність і спритність 35. Оскільки, як відомо, ЛРГ є однією з найскладніших операцій в гінекологічній онкології, переваги роботизованої системи можуть спричинити відмінності в онкологічних результатах. По-друге, для запобігання інтраопераційному розповсюдженню та дисемінації пухлини використовувався метод “не дивись, не торкайся”.
Хоча частота рецидивів суттєво не відрізнялася між двома групами, наші результати свідчать про те, що у пацієнток зі стадією IB1, РРГ мала сприятливіші результати порівняно з ЛРГ. Всі пацієнти в нашому дослідженні мали розмір пухлини < 2 см, і РРГ при пухлинах менше 2 см виявилася більш безпечною. Ці результати узгоджуються з попереднім дослідженням Doo та співавт., в якому аналізувалися результати виживання пацієнтів з пухлинами стадії IB1; пацієнти з пухлинами ≥ 2 см, які проходили РРГ, мали коротший БВ 34. Наші результати свідчать про те, що у пацієнтів з розміром пухлини < 2 см необхідно розглядати можливість проведення РРГ, якщо хірург використовує МІХ в якості хірургічного підходу.
Наше дослідження мало кілька обмежень. По-перше, через ретроспективний дизайн дослідження могли виникнути неминучі проблеми, такі як упередженість відбору. По-друге, розмір вибірки та період спостереження могли бути недостатніми для належного порівняння онкологічних результатів між двома групами. По-третє, не оцінювалася періопераційна захворюваність. По-четверте, не були враховані відмінності в техніці, досвіді та результатах серед хірургів.
Отже, у пацієнтів з розміром пухлини < 2 см частота рецидивів була нижчою в РРГ групі, однак суттєвої різниці не було. Для отримання достовірних даних необхідні подальші великомасштабні РКД та клінічні дослідження.
ПОСИЛАННЯ НА ДЖЕРЕЛА
- Sung H, Ferlay J, Siegel RL. et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71:209–49.
- Jung KW, Won YJ, Kang MJ, Kong HJ, Im JS, Seo HG. Prediction of Cancer Incidence and Mortality in Korea, 2022. Cancer Res Treat. 2022;54:345–51.
- Koh WJ, Abu-Rustum NR, Bean S. et al. Cervical Cancer, Version 3.2019, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2019;17:64–84.
- Nezhat CR, Burrell MO, Nezhat FR, Benigno BB, Welander CE. Laparoscopic radical hysterectomy with paraaortic and pelvic node dissection. Am J Obstet Gynecol. 1992;166:864–5.
- Canis M, Mage G, Wattiez A, Pouly JL, Chapron C, Bruhat MA. Vaginally Assisted Laparoscopic Radical Hysterectomy. J Gynecol Surg. 1992;8:103–105.
- Diver E, Hinchcliff E, Gockley A. et al. Minimally Invasive Radical Hysterectomy for Cervical Cancer Is Associated With Reduced Morbidity and Similar Survival Outcomes Compared With Laparotomy. J Minim Invasive Gynecol. 2017;24:402–6.
- Nam JH, Park JY, Kim DY, Kim JH, Kim YM, Kim YT. Laparoscopic versus open radical hysterectomy in early-stage cervical cancer: long-term survival outcomes in a matched cohort study. Ann Oncol. 2012;23:903–11.
- Wang W, Chu HJ, Shang CL. et al. Long-Term Oncological Outcomes After Laparoscopic Versus Abdominal Radical Hysterectomy in Stage IA2 to IIA2 Cervical Cancer: A Matched Cohort Study. Int J Gynecol Cancer. 2016;26:1264–73.
- Melamed A, Margul DJ, Chen L. et al. Survival after Minimally Invasive Radical Hysterectomy for Early-Stage Cervical Cancer. N Engl J Med. 2018;379:1905–14.
- Ramirez PT, Frumovitz M, Pareja R. et al. Minimally Invasive versus Abdominal Radical Hysterectomy for Cervical Cancer. N Engl J Med. 2018;379:1895–904.
- Querleu D, Cibula D, Concin N. et al. Laparoscopic radical hysterectomy: a European Society of Gynaecological Oncology (ESGO) statement. Int J Gynecol Cancer. 2020;30:15.
- Park JY, Nam JH. How should gynecologic oncologists react to the unexpected results of LACC trial? J Gynecol Oncol. 2018;29:e74.
- Kanao H, Aoki Y, Takeshima N. Unexpected result of minimally invasive surgery for cervical cancer. J Gynecol Oncol. 2018;29:e73.
- Mendivil AA, Rettenmaier MA, Abaid LN. et al. Survival rate comparisons amongst cervical cancer patients treated with an open, robotic-assisted or laparoscopic radical hysterectomy: A five year experience. Surg Oncol. 2016;25:66–71.
- Corrado G, Vizza E, Legge F. et al. Comparison of Different Surgical Approaches for Stage IB1 Cervical Cancer Patients: A Multi-institution Study and a Review of the Literature. Int J Gynecol Cancer. 2018;28:1020–8.
- Sert BM, Boggess JF, Ahmad S. et al. Robot-assisted versus open radical hysterectomy: A multi-institutional experience for early-stage cervical cancer. Eur J Surg Oncol. 2016;42:513–22.
- Chong GO, Lee YH, Hong DG, Cho YL, Park IS, Lee YS. Robot versus laparoscopic nerve-sparing radical hysterectomy for cervical cancer: a comparison of the intraoperative and perioperative results of a single surgeon’s initial experience. Int J Gynecol Cancer. 2013;23:1145–9.
- Sert MB, Abeler V. Robot-assisted laparoscopic radical hysterectomy: comparison with total laparoscopic hysterectomy and abdominal radical hysterectomy; one surgeon’s experience at the Norwegian Radium Hospital. Gynecol Oncol. 2011;121:600–4.
- Kruijdenberg CB, van den Einden LC, Hendriks JC, Zusterzeel PL, Bekkers RL. Robot-assisted versus total laparoscopic radical hysterectomy in early cervical cancer, a review. Gynecol Oncol. 2011;120:334–9.
- Kanao H, Matsuo K, Aoki Y. et al. Feasibility and outcome of total laparoscopic radical hysterectomy with no-look no-touch technique for FIGO IB1 cervical cancer. J Gynecol Oncol. 2019;30:e71.
- Querleu D, Morrow CP. Classification of radical hysterectomy. Lancet Oncol. 2008;9:297–303.
- Sedlis A, Bundy BN, Rotman MZ, Lentz SS, Muderspach LI, Zaino RJ. A randomized trial of pelvic radiation therapy versus no further therapy in selected patients with stage IB carcinoma of the cervix after radical hysterectomy and pelvic lymphadenectomy: A Gynecologic Oncology Group Study. Gynecol Oncol. 1999;73:177–83. [PubMed] [Google Scholar]
- Conrad LB, Ramirez PT, Burke W. et al. Role of Minimally Invasive Surgery in Gynecologic Oncology: An Updated Survey of Members of the Society of Gynecologic Oncology. Int J Gynecol Cancer. 2015;25:1121–7.
- Bogani G, Cromi A, Uccella S. et al. Laparoscopic versus open abdominal management of cervical cancer: long-term results from a propensity-matched analysis. J Minim Invasive Gynecol. 2014;21:857–62.
- Cantrell LA, Mendivil A, Gehrig PA, Boggess JF. Survival outcomes for women undergoing type III robotic radical hysterectomy for cervical cancer: a 3-year experience. Gynecol Oncol. 2010;117:260–5.
- Tinelli R, Malzoni M, Cosentino F. et al. Robotics versus laparoscopic radical hysterectomy with lymphadenectomy in patients with early cervical cancer: a multicenter study. Ann Surg Oncol. 2011;18:2622–8.
- Ratiu D, Luncescu C, Morgenstern B. et al. Comparison of Minimally Invasive Surgery and Abdominal Surgery Among Patients With Cervical Cancer. Anticancer Res. 2019;39:2661–4.
- Kanno K, Andou M, Yanai S. et al. Long-term oncological outcomes of minimally invasive radical hysterectomy for early-stage cervical cancer: A retrospective, single-institutional study in the wake of the LACC trial. J Obstet Gynaecol Res. 2019;45:2425–34.
- Brandt B, Sioulas V, Basaran D. et al. Minimally invasive surgery versus laparotomy for radical hysterectomy in the management of early-stage cervical cancer: Survival outcomes. Gynecol Oncol. 2020;156:591–7.
- Dai D, Huang H, Feng Y. et al. Minimally invasive surgery vs laparotomy for early stage cervical cancer: A propensity score-matched cohort study. Cancer Med. 2020;9:9236–45.
- Guo C, Tang X, Meng Y. et al. Effect of the surgical approach on survival outcomes in patients undergoing radical hysterectomy for cervical cancer: A real-world multicenter study of a large Chinese cohort from 2006 to 2017. Cancer Med. 2020;9:5908–21.
- Alfonzo E, Wallin E, Ekdahl L. et al. No survival difference between robotic and open radical hysterectomy for women with early-stage cervical cancer: results from a nationwide population-based cohort study. Eur J Cancer. 2019;116:169–77.
- Jensen PT, Schnack TH, Frøding LP. et al. Survival after a nationwide adoption of robotic minimally invasive surgery for early-stage cervical cancer – A population-based study. Eur J Cancer. 2020;128:47–56.
- Doo DW, Kirkland CT, Griswold LH. et al. Comparative outcomes between robotic and abdominal radical hysterectomy for IB1 cervical cancer: Results from a single high volume institution. Gynecol Oncol. 2019;153:242–7.
- Bouquet de Joliniere J, Librino A, Dubuisson JB. et al. Robotic Surgery in Gynecology. Front Surg. 2016;3:26.