Резюме
Передумови
Скринінг раку яєчників у носіїв мутації BRCA1/2 включає визначення вуглеводного антигену 125 (CA125) та трансвагінальне ультразвукове дослідження (ТВУ), незважаючи на низьку чутливість та специфічність. Ми оцінили зв’язок між рівнем СА125, статусом мутації BRCA1/2 та менопаузою, щоб надати більше інформації про клінічні стани, які можуть впливати на рівень СА125.
Методи
Ми ретроспективно проаналізували повторні вимірювання рівня СА125 та клінічні дані 466 жінок з високим ризиком розвитку раку яєчників. Рівні СА125 порівнювали між жінками з і без шкідливих мутацій в BRCA1/2. Для визначення зв’язку між віком та рівнем СА125 у сироватці крові використовували кореляцію Пірсона. Відмінності в рівнях СА125 оцінювали за допомогою U-критерію Манна-Уітні. Вплив мутаційного статусу BRCA1/2 та менопаузального статусу на зміну рівня СА125 визначали за допомогою двофакторного дисперсійного аналізу (ANOVA).
Результати
Рівень СА125 у сироватці крові жінок у пременопаузі (медіана 13,8 кОд/мл; діапазон 9,4-19,5 кОд/мл) був значно вищим, ніж у жінок у постменопаузі (медіана 10,4 кОд/мл; діапазон 7,7-14,0 кОд/мл; p < .001). Не було виявлено достовірної різниці в рівнях СА125 у носіїв і не носіїв мутації BRCA в усіх вікових групах (p = 0,612). При дослідженні комбінованого впливу мутації BRCA1/2 і менопаузального статусу дисперсійний аналіз виявив значну взаємодію між статусом мутації BRCA1/2 і менопаузальним статусом на рівні CA125 (p < 0,001). Спостерігалася значна різниця між рівнями СА125 у жінок в пременопаузі та постменопаузі, з великим ефектом у носіїв мутації BRCA (p < 0,001, d = 1,05), тоді як у носіїв без мутації спостерігався лише невеликий ефект (p < 0,001, d = 0,32).
Висновок
Наші результати свідчать про те, що спадкові мутації в BRCA1/2 впливають на зниження рівня СА125 з віком. Щоб довести однозначний вплив цієї мутації на рівень СА125, необхідно провести проспективні дослідження, щоб визначити нові рівні відсікання СА125 у носіїв мутації та оптимізувати скринінг раку яєчників.
Передумови
Епітеліальний рак яєчників є найбільш летальним гінекологічним раком із загальною виживаністю 46% після встановлення діагнозу. Несприятливий прогноз головним чином зумовлений зазвичай запущеною стадією захворювання на момент встановлення діагнозу через безсимптомний перебіг раку яєчників (РЯ) [1]. Жінки, які відносяться до групи “високого ризику” розвитку раку яєчників, як правило, мають обтяжений сімейний анамнез щодо раку яєчників, а також раку молочної залози і є носіями патогенних мутацій в генах, які пригнічують онкогенез цих захворювань. Мутації зародкової лінії в генах BRCA1 і BRCA2 асоціюються з високим ризиком розвитку РЯ і є причиною близько 15-20% всіх випадків. Кумулятивний ризик розвитку раку до 80 років становить 44% у носіїв мутації BRCA1 і 17% у носіїв мутації BRCA2 [2].
Для жінок з високим ризиком мутацій BRCA1/2 ризик-зменшувальна сальпінгоофоректомія (РЗСО) є єдиним доведеним втручанням, що знижує смертність, для профілактики раку маткових труб і виявлення прихованої неоплазії. Її рекомендують жінкам старше 35 років, які вже завершили дітородний період [3, 4]. Хоча РЗСО є дуже ефективною, коли її проводять у пременопаузі [4], вона спричиняє безпліддя та передчасну менопаузу [5], що асоціюється з підвищеним ризиком розвитку остеопорозу [6], а також серцево-судинних [7] та неврологічних захворювань [8]. Деякі жінки-носії мутації BRCA відкладають РЗСО до менопаузи або взагалі відмовляються від втручання, незважаючи на ризики. Ці жінки особливо виграють від ефективної стратегії скринінгу РЯ [9, 10].
Сучасний скринінг для жінок з високим ризиком включає визначення онкомаркерів у сироватці крові CA125 та трансвагінальне ультразвукове дослідження (ТВУ) кожні 6 місяців [11]. Однак ефективність цих тестів є низькою, оскільки чутливість і специфічність СА125 і ТВУ є недостатньою для скринінгу [12,13,14]. Вимірювання СА125 для ранньої діагностики РЯ обмежене хибнонегативними результатами через низьку чутливість на ранніх стадіях захворювання, а також хибнопозитивними результатами, що виникають через його підвищення у фізіологічних і доброякісних станах [15, 16]. До них відносяться гінекологічні захворювання, такі як ендометріоз, а також негінекологічні розлади, такі як захворювання печінки або панкреатит [17,18,19,20]. Демографічні та клінічні фактори, такі як раса, вік та прийом оральних контрацептивів, також впливають на рівень СА125 у сироватці крові [21,22,23].
Рівень СА125 у сироватці крові пов’язаний з функцією яєчників і знижується з віком [16, 21], що призводить до значно вищих значень у жінок у пременопаузі, ніж у постменопаузі [24, 25]. Тому для жінок у постменопаузі рекомендується порогове значення 35 кОд/мл, тоді як для жінок у пременопаузі використовується порогове значення 50 кОд/мл [22]. Хоча сучасна діагностика РЯ базується на спостереженні за рівнем СА125 вище зазначених граничних значень, було показано, що підвищення рівня з часом у межах норми також є ознакою розвитку цього захворювання [10, 26, 27].
Зв’язок між раком яєчників і підвищеним рівнем СА125 у сироватці крові сильніший у жінок у постменопаузі, ніж у пременопаузі [28]. Багато досліджень щодо серійних вимірювань СА125 було проведено на жінках у постменопаузі з популяцій середнього ризику [17, 21, 27, 29, 30]. Однак у більшості жінок з високим спадковим ризиком раку яєчників скринінг починається до менопаузи [31]. Існуючі схеми скринінгу раку яєчників не змогли забезпечити зниження смертності як у середній популяції, так і у пацієнток з високим ризиком [10, 12, 27]. Покращення раннього виявлення раку яєчників є вкрай необхідним, особливо для жінок з високим спадковим ризиком.
Метою цього дослідження було з’ясувати, чи існує різниця в концентрації СА125 у жінок з мутацією в гені BRCA1 або BRCA2 та жінок без цієї генетичної мутації, а також проаналізувати зміни концентрації залежно від віку та менопаузального статусу.
Матеріали та методи
Досліджувана популяція
Цей ретроспективний аналіз базується на даних жінок, які брали участь у програмі раннього виявлення спадкового раку молочної залози та яєчників (СРМЯ) кафедри гінекологічної онкології Віденського медичного університету з 2000 по 2018 рік. До цієї когорти увійшли жінки, які вважалися такими, що мають підвищений ризик розвитку раку молочної залози та яєчників через обтяжену сімейну історію та/або мутації в BRCA1/2. Ми порівняли дані жінок зі шкідливою мутацією BRCA1/2 з даними жінок без шкідливої мутації BRCA1/2. Дані щодо рівня СА125 в сироватці крові, статусу мутації BRCA1 або BRCA2, віку, менопаузального статусу, РЗСО та раку яєчників були зібрані шляхом ретроспективного аналізу карт.
У дослідженні брали участь жінки без раку яєчників, які пройшли тестування на мутації BRCA1 або BRCA2 і ще не пройшли РЗСО. Жінки з діагнозом раку яєчників, невідомим статусом мутацій BRCA1/2 або без вимірювання СА125 були виключені. Також були виключені жінки, в історії хвороби яких було зазначено наявність ендометріозу або запальних захворювань органів малого тазу. Існувала значна різниця в кількості вимірювань СА125 на одну пацієнтку. Тому ми оцінювали кожне виміряне значення СА125 як окремий випадок. Ми не змогли ретроспективно оцінити більшість клінічних факторів, які можуть суттєво впливати на рівень СА125 у здорових жінок. Це призвело до значного розмаїття значень СА125 у зібраних нами даних, причому багато значень значно перевищували поріг 35 кОд/л або 50 кОд/л. Клінічні дослідження, що оцінювали концентрацію СА125 в сироватці крові у жінок з ендометріозом III/IV стадії, ендометріомою або запальними захворюваннями органів малого тазу, переважно повідомляли про середні рівні СА125 в діапазоні від 60 до 70 кОд/л [32,33,34,35,36]. Виходячи з цих даних, ми припустили, що в доброякісних випадках зі значеннями СА125 понад 70 кОд/л, наявність доброякісного гінекологічного захворювання є надзвичайно високою. Отже, ми виключили ці випадки з нашого аналізу.
Враховуючи наші критерії включення та виключення, ми змогли використати в аналізі дані 466 жінок із загальною кількістю 1305 вимірювань СА125. Популяційні дослідження показали, що природна менопауза зазвичай настає в середньому у віці 51 року в країнах з високим рівнем доходу [37, 38]. Тому ми визначили пацієнток віком ≥ 51 року і старше як постменопаузальних, у яких не було інформації про менструальний анамнез, за винятком випадків, коли була доступна конкретна інформація з клінічної карти про те, що пацієнтка все ще перебувала в пременопаузі на момент скринінгу. В іншому випадку жінки у віці < 51 року були класифіковані як жінки в пременопаузі. Характеристики пацієнток наведені в таблицях 1 і 2.
Таблиця 1 Характеристика жінок з високим спадковим ризиком під час першого візиту до лікаря
| Мутація BRCA1/2 | Загалом | ||
| Носіїa | Немає мутаціїb | ||
| Вік, років | |||
| Середнє | 41 | 45 | 45,1 |
| Діапазон | 26—73 | 24—77 | 24—77 |
| Менопаузальний статус | |||
| Передменопаузальний період | 103 | 235 | 338 |
| % серед усіх жінок у пременопаузі | 30,5% | 69,5% | |
| % від загальної кількості | 22,1% | 50,4% | 72,5% |
| У постменопаузі | 29 | 99 | 128 |
| % серед усіх жінок у постменопаузі | 22,7% | 77,3% | |
| % від загальної кількості | 6,2% | 21,2% | 27,5% |
| Всього | 132 (28,3%) | 334 (71,7%) | 466 |
- aНосії – жінки зі шкідливою мутацією в генах BRCA1 або 2
- bНемає мутації – жінки без шкідливої мутації в генах BRCA1 або 2
Таблиця 2 Розподіл за віком та менопаузальним статусом жінок з групи високого ризику під час кожного вимірювання
| Мутація BRCA1/2 | Загалом | ||
| Носіїa | Немає мутаціїb | ||
| Вік, років | |||
| Середнє | 49 | 44 | 47,5 |
| Діапазон | 26—80 | 24—83 | 24 – 83 |
| Менопаузальний статус | |||
| Передменопаузальний період | 496 (38,1%) | 357 (27,4%) | 853 (65,4%) |
| Постменопаузальний період | 343 (26,2%) | 109 (8,3%) | 452 (34,6%) |
| Всього | 839 (64,3%) | 466 (35,7%) | 1305 (100%) |
- aНосії – жінки зі шкідливою мутацією в генах BRCA1 або 2
- bНемає мутації – жінки без шкідливої мутації в генах BRCA1 або 2
Статистичний аналіз
Статистичний аналіз проводили за допомогою програми SPSS (IBM SPSS® 26.0). Сила зв’язку між віком та рівнем СА125 у сироватці крові визначалася за допомогою коефіцієнта кореляції Пірсона (r) за умови, що ці дві змінні перебувають у лінійному зв’язку. Додатково розраховували довірчі інтервали для коефіцієнта кореляції r методом бутстрапінгу, оцінюючи істинне середнє значення вибірки з імовірністю 95%. Бутстрапінг проводився шляхом повторної вибірки випадків. Відмінності в рівнях СА-125 оцінювали за допомогою U-критерію Манна-Уїтні. Вплив мутаційного статусу BRCA1/2 та менопаузального статусу на зміну рівня СА125 визначали за допомогою двофакторного дисперсійного аналізу (ANOVA). Для перевірки однорідності дисперсій використовували критерій Левенса. Для підтвердження наявності відмінностей між групами проводили постфактум t-критерій Уелча. Застосовувалося двостороннє тестування, р-значення нижче 0,05 вважалися статистично значущими. Поправки на багаторазове тестування не проводили, оскільки цілі цього дослідження є дослідницькими. Для оцінки ступеня відмінностей результатів використовували розмір ефекту d за Коеном, який передбачає, що d ≥ 0,20 є малим, d ≥ 0,50 – середнім і d ≥ 0,80 – великим розміром ефекту. Коефіцієнт кореляції r інтерпретувався як розмір ефекту для кореляції, при цьому значення r ≥ 0,10 означає малий, r ≥ 0,30 – середній і r ≥ 0,50 – великий розмір ефекту.
Результати
Цей аналіз базується на даних 466 жінок, серед яких було проведено 1305 оцінок концентрації СА125 у сироватці крові (табл. 1 і 2). Середній вік при першому візиті становив 45,1 року (мін. 24,2, макс. 77,6) років (табл. 1). Середня кількість вимірювань на одного пацієнта становила 2,83 (СВ = 3,33; мін. 1, макс. 38).
Рівні CA125 залежно від віку
Незалежно від мутаційного статусу, спостерігається невелика, але значуща негативна кореляція між віком та рівнем СА125 у сироватці крові, r(1305) = -0,22; 95%-KI [-0,17; -0,28], p < 0,001. Застосовуючи відповідне рівняння регресії, Ŷ = 23,49 + (-0,182 * xi), можна припустити, що рівень СА125 в сироватці крові 50-річної жінки вимірюється на рівні 14,39 кОд/л, незалежно від мутаційного статусу. Враховуючи мутаційний статус, спостерігається дуже невелика, але значуща негативна кореляція між віком і рівнем СА125 в сироватці крові, r(839) = -0,12; 95%-KI [-0,05; -0,19], p < 0,001, у випадках без мутації в BRCA1/2. Використовуючи відповідне кореляційне рівняння, Ŷ = 19,55 + (-0,104 * xi), можна припустити, що рівень СА125 у сироватці крові 50-річного носія без мутації становить 14,35 кОд/л. Для випадків з мутацією BRCA1/2 виявлено помірну негативну кореляцію, r(466) = -0,34; 95%-KI [-0,27; -0,42], p < 0,001. На основі відповідного рівняння кореляції, Ŷ = 28,28 + (-0,288 * xi), можна припустити, що для 50-річного носія BRCA1/2-мутації рівень СА125 в сироватці крові становить 13,88 кОд/л.
Рівні CA125 у носіїв мутації BRCA1/2 та носіїв без мутації
Рівні СА125 були вищими (p < 0,001) у жінок у пременопаузі (медіана 13,8 кОд/мл; діапазон від 9,4 до 19,5 кОд/мл), ніж у жінок у постменопаузі (медіана 10,4 кОд/мл; діапазон від 7,7 до 14,0 кОд/мл). Рівні СА125 наведені в таблиці 3.
Таблиця 3 Рівні СА125 в поєднанні з менопаузальним статусом, а також статусом мутації BRCA, проаналізовані окремо
| n | С ± СВ | мін.-макс. | МД | ІКР | Cередній ранг | |
| Менопаузальний статус | ||||||
| Пременопауза | 853 | 15.93 ± 9.32 | 2.70—67.70 | 13.9 | 9.5; 19.5 | 717.64 |
| Постменопауза | 452 | 12.11 ± 7.26 | 0.60—66.50 | 10.5 | 7.9; 14.0 | 531.02 |
| Всього | 1305 | 14.61 ± 8.85 | 0.60—67.70 | 12.0 | 8.8; 18.1 | |
| BRCA-мутаційний статус | ||||||
| Негативнаa | 839 | 14.31 ± 8.33 | 2.10 – 66.50 | 12.0 | 8.9; 17.7 | 649.05 |
| Позитивнаb | 466 | 15.16 ± 9.71 | 0.60 – 67.70 | 12.75 | 8.7; 18.8 | 660.11 |
| Всього | 1305 | 14.61 ± 8.86 | 0.60—67.70 | 12.0 | 8.8; 18.1 | |
- Скорочення: n Кількість, С Середнє значення, СВ Стандартне відхилення, мін. Мінімум, макс. Максимум, МД Медіана, ІКР Інтерквартильний розмах
- aНегативний результат стосується жінок без шкідливих мутацій в генах BRCA1 або 2
- bПозитивні – жінки без шкідливої мутації в генах BRCA1 або 2
Ми не виявили достовірної різниці (p = 0,612) у рівнях СА125 у носіїв мутації BRCA1/2 (медіана 12,75 кОд/мл; діапазон від 8,7 до 18,8 кОд/мл) порівняно з носіями без мутації (медіана 12 кОд/мл; діапазон від 8,9 до 17,7 кОд/мл) (зображення 1).
Зображення 1
Відмінності в рівнях СА 125 (Md) між жінками з позитивним та негативним статусом BRCA-мутації. Легенда: Результати U-критерію Манна-Уітні, відображені у вигляді гістограм, показують відсутність достовірної різниці (p = .612) у рівнях СА125 у носіїв мутації BRCA1/2 (позитивний, помаранчева гістограма) і носіїв без мутації (негативний, зелена гістограма). На осі абсцис відкладено абсолютне значення СА125 в кОд/мл. Скорочення: (Мд, медіана)
Взаємозв’язок мутаційного статусу BRCA1/2 та менопаузального статусу
Зважаючи на значний вплив менопаузального статусу на рівень СА125, для аналізу впливу мутаційного статусу BRCA1/2 та менопаузального статусу на рівень СА125 було проведено двофакторний дисперсійний аналіз (ANOVA). Розраховані параметри наведені в таблиці 4.
Таблиця 4 Рівні СА125 в сироватці крові залежно від статусу мутації BRCA та менопаузального статусу
| Пременопаузальний | Постменопаузальний | Загалом | |||||||
| Статус BRCA мутації | С | ± СВ | n | С | ± СВ | n | С | ± СВ | n |
| Негативнаa | 15.38 | 8.50 | 496 | 12.76 | 7.85 | 343 | 14.31 | 8.33 | 839 |
| МД (ІКР) | 13.35 | (9.63; 18.84) | 10.80 | (8.30; 14.90) | 12.00 | (8.9; 17.7) | |||
| Позитивнаb | 16.72 | 10.34 | 357 | 10.06 | 4.42 | 109 | 15.16 | 9.71 | 466 |
| МД (ІКР) | 14.20 | (9.15; 21.75) | 9.40 | (6.80; 12.35) | 12.75 | (8.7; 18.75) | |||
| Всього | 15.94 | 9.33 | 853 | 12.11 | 7.26 | 452 | 14.61 | 8.86 | 1305 |
| МД (ІКР) | 13.90 | (9.45; 19.50) | 10.50 | (7.93; 14.00) | 12.00 | (8.8; 18.1) | |||
- Скорочення: n Кількість, С Середнє значення, СВ Стандартне відхилення, мін. Мінімум, макс. Максимум, Мд Медіана, ІКР Інтерквартильний розмах
- aНегативний результат стосується жінок без шкідливих мутацій в генах BRCA1 або 2
- bПозитивні результати стосуються жінок без шкідливих мутацій в генах BRCA1 або 2
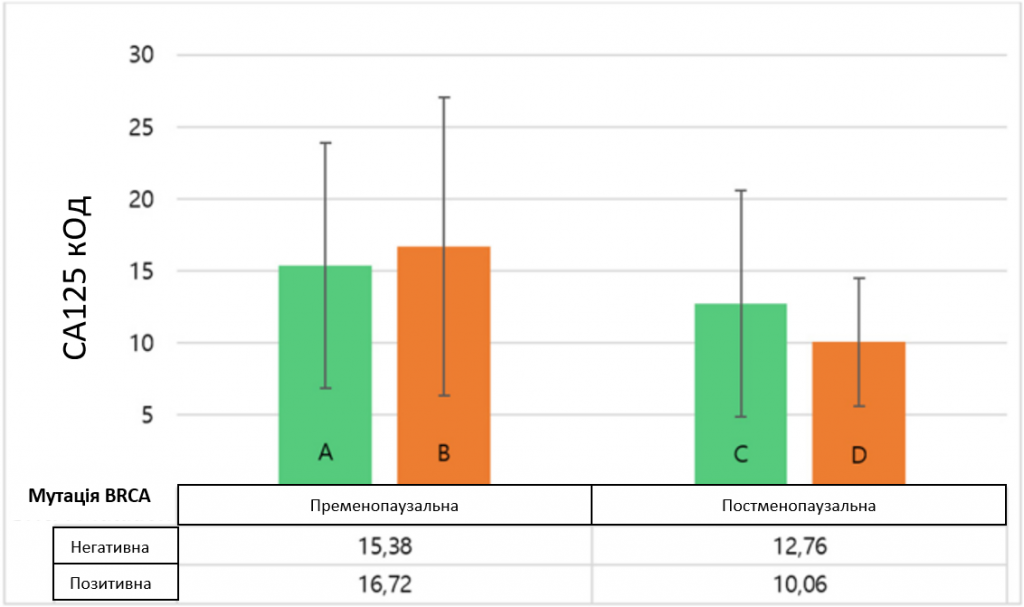
Виявлено статистично значущу взаємодію між впливом мутаційного статусу BRCA1/2 та менопаузального статусу на рівень СА125 у сироватці крові, F(1, 1301) = 12,986, p < 0,001. T-критерій Уелча показав, що рівень СА125 у жінок, які не є носіями мутації, був значно вищим у пременопаузі, ніж у постменопаузі, t(770,98) = 4,583, p < 0,001 з невеликим ефектом, d = 0,32, 95% ДІ [0,18 – 0,46]. Для носіїв мутації BRCA1/2 ми також виявили достовірно вищі рівні СА125 у жінок в пременопаузі порівняно з жінками в постменопаузі, t(417.23) = 9,628, p < 0,001, але з великим ефектом, d = 1,05, 95% ДІ [0,83 – 1,28]. На рисунку 2 показано середні рівні СА125 залежно від статусу BRCA-мутації та менопаузального статусу.
Зображення 2
Рівні CA 125 (M ± 1 СВ) з урахуванням мутаційного статусу BRCA та менопаузального статусу. Умовні позначення: Гістограми, що показують результати двостороннього ANOVA. A Показує середні значення CA125 для жінок у пременопаузі без мутацій (n = 496). B Середні значення CA125 для носіїв мутації BRCA в пременопаузі (n = 357). C Відображено середні значення CA125 для постменопаузальних носіїв без мутацій (n = 343). D Відображено середні значення CA125 для носіїв BRCA-мутації в постменопаузі (n = 109). Скорочення: ANOVA – дисперсійний аналіз; С – середнє значення; СВ – стандартне відхилення
Обговорення
У нашому дослідженні ми виявили значно вищі рівні СА125 у жінок у пременопаузі, ніж у жінок у постменопаузі загалом. Ми спостерігали зниження рівня СА125 зі збільшенням віку як у носіїв BRCA-мутації, так і у носіїв не-BRCA-мутації. Існувала невелика, але значуща негативна кореляція між віком і рівнем СА125, незалежно від мутаційного статусу. Це спостереження узгоджується з даними сучасної літератури [21, 22, 31]. Згідно з нашим рівнянням регресії, можна припустити, що рівень СА125 у сироватці крові 50-річної жінки становить 14,39 кОд/л, незалежно від мутаційного статусу. Подібні результати були отримані Pauler та ін., які виявили, що рівень СА125 у жінок у віці 50 років зазвичай коливається між 13 і 22 одиницями/мл [21]. Цікаво, що при врахуванні мутаційного статусу ми спостерігали дуже невелику, але значущу негативну кореляцію між віком і рівнем СА125 у випадках без мутації в BRCA1/2, порівняно з помірною негативною кореляцією у випадках з мутацією в BRCA1/2.
У нещодавньому дослідженні Gschwantler-Kaulich та ін. [39] було виявлено значно вищі рівні СА125 у жінок з мутацією в BRCA1 порівняно з носіями без мутації. Ми не виявили достовірної різниці в рівнях СА125 у носіїв мутації BRCA1/2 порівняно з носіями без мутації в цілому. Hermsen та співавт. також не виявили суттєвої різниці в рівнях СА125 у жінок з високим спадковим ризиком порівняно зі здоровими жінками [31]. Ретроспективне дослідження Chen та співавт. також порівнювало рівні СА125 у носіїв мутації BRCA1/2 з носіями без мутації і не виявило достовірної різниці між цими групами. Однак менопаузальний статус не розглядався в аналізі як фактор, що потенційно може спричинити неправильну інтерпретацію результатів [40]. Наші результати також показують статистично значущу взаємодію між статусом мутації BRCA1/2 та менопаузальним статусом на рівень CA125 в сироватці крові. Це означає, що вплив менопаузального статусу залежав від наявності мутації в BRCA1/2. Відповідно, ми спостерігали більше зниження рівня СА125 в сироватці крові у носіїв мутації в постменопаузі, ніж у носіїв без мутації.
У кількох дослідженнях повідомлялося про значно нижчий вік настання природної менопаузи у носіїв BRCA-мутації, ніж у здорових не-носіїв [41, 42], що може пояснити більше зниження рівня СА125 в сироватці крові у носіїв BRCA-мутації, оскільки вони вже перебували б у постменопаузі довший час. Дослідження Tea та співавт. навіть показало значно більш ранній початок менопаузи у носіїв BRCA1-мутації порівняно з носіями BRCA2-мутації [43]. Однак нещодавно проведений мета-аналіз, який об’єднав дані 1535 носіїв BRCA1/2-мутацій і 3191 осіб контрольної групи, не підтвердив гіпотезу про зв’язок між шкідливими мутаціями в BRCA1/2 і більш раннім настанням менопаузи [44]. Проте для вирішення питання про те, наскільки патогенні мутації зародкової лінії BRCA1/2 і рання менопауза дійсно пов’язані, необхідно провести більш ретельно сплановані дослідження, оскільки на порівняння віку настання природної менопаузи між носіями і неносіями мутацій BRCA1/2 можуть впливати різні типи упередженості відбору.
Сучасний підхід до скринінгу раку яєчників базується на передумові, що захворювання має бути виявлене на I або II стадії для збільшення шансів на виживання, але все ще обмежений низькою чутливістю та специфічністю [13, 15, 45]. Згідно з нашими результатами та кількома дослідженнями, що повідомляють про більш ранній початок менопаузи у носіїв BRCA-мутації [41,42,43], можна з упевненістю припустити, що зниження рівня СА125 у носіїв BRCA-мутації в постменопаузі підвищить чутливість для виявлення раку яєчників на ранніх стадіях. Тим не менш, важливо пам’ятати, що між чутливістю і специфічністю існує певний взаємозв’язок. Тому, хоча деякі дослідження припускають, що зниження порогового рівня СА125 до 50 кОд/л у жінок в постменопаузі може дозволити виявити більше раку на ранній стадії, це також призведе до збільшення кількості хибнопозитивних результатів і гіпердіагностики [12, 46].
Персоналізація скринінгу раку яєчників за допомогою алгоритму, що ґрунтується на лонгітюдному аналізі СА125 та частішому тестуванні, дала багатообіцяючі результати у жінок з високим ризиком. Наприклад, алгоритм ризику раку яєчників (АРРЯ) виявляє значне підвищення базового рівня СА125 у кожної пацієнтки і, таким чином, підвищує ймовірність раннього виявлення захворювання, навіть до досягнення стандартного порогового рівня, при цьому специфічність зберігається за рахунок виключення пацієнток з високим стабільним рівнем [26]. Було висловлено припущення, що включення статусу мутації BRCA у згадані алгоритми та інші моделі оцінки ризику, засновані на вимірюванні СА125, може сприяти подальшій персоналізації та покращенню скринінгу [10, 28]. Однак, зважаючи на недостатню ефективність вимірювання сироваткового СА125 у великих скринінгових дослідженнях [47, 48], ми не очікуємо, що цей пухлинний маркер стане валідованою частиною скринінгу раку яєчників найближчим часом.
Наше дослідження має кілька обмежень. Визначення менопаузального статусу виключно на основі віку та без вимірювання сироваткового ФСГ та естрадіолу може призвести до неправильної інтерпретації результатів. Це важливо враховувати у пацієнток з мутаціями зародкової лінії BRCA і підвищеним ризиком передчасної оваріальної недостатності. Через ретроспективний характер цього дослідження ми не змогли врахувати використання оральних контрацептивів, куріння та більшість супутніх захворювань, які можуть впливати на рівень СА125 у здорових жінок. Тому нам довелося виключити з нашого аналізу випадки зі значеннями понад 70 кОд/л. Крім того, ми оцінювали кожне виміряне значення СА125 в сироватці крові як окремий випадок, тобто ми не аналізували однакову кількість сироваткових значень у кожної пацієнтки. Враховуючи, що, як показують дослідження, кожна жінка має свій власний базовий рівень СА125 [26], підхід, який ми застосували в нашому статистичному аналізі, може виявитися проблематичним. Це дослідження базується на даних жінок, які брали участь у програмі раннього виявлення спадкового раку молочної залози та яєчників з високим ризиком. Порівняння носіїв мутації BRCA1/2 з жінками, які не мають високого ризику раку молочної залози або яєчників, могло б забезпечити більшу значущість наших результатів.
Висновки
Наші результати свідчать про те, що рівень СА125 в сироватці крові зазнає однакових змін, спричинених старінням і менопаузою, але поводиться по-різному у носіїв мутації BRCA, ніж у жінок без цієї мутації. Менопаузальний статус залишається основним клінічним фактором, що впливає на рівень СА125 в сироватці крові. Ми не знаємо жодного біологічного механізму, який міг би пояснити більш виражене зниження рівня СА125 у носіїв мутації BRCA1/2 зі збільшенням віку.
Наразі нам бракує досліджень, які б оцінювали скринінг СА125 у здорових носіїв мутації BRCA1/2. Доступна література з цього питання обмежена невеликими популяціями. Наша когорта з 466 пацієнтів високого ризику включала 132 носіїв мутації BRCA1/2 і 334 не-носіїв, таким чином, представляючи одну з найбільших на сьогоднішній день одноцентрових дослідницьких когорт для пацієнтів високого ризику. Наскільки нам відомо, це перше дослідження, яке описує рівні CA125 в сироватці крові у здорових носіїв мутації BRCA1/2 в порівнянні з не носіями, а також враховує менопаузальний статус. Ми очікуємо, що це дослідження незабаром надихне ретельно сплановані проспективні дослідження, спрямовані на персоналізацію скринінгу CA125 у носіїв мутації BRCA1/2. Отримані результати можуть призвести до визначення нового граничного рівня СА125 для жінок з високим спадковим ризиком, особливо в постменопаузальному періоді, та покращити скринінг раку яєчників.
Абревіатури
ANOVA:
Двофакторний дисперсійний аналіз
CA125:
Онкомаркер яєчників карбогідрат антиген 125
СРМЯ:
Спадковий рак молочної залози та яєчників
РЯ:
Рак яєчників
РЗСО:
Ризик зменшувальна сальпінгоофоректомія
ТВУ:
Трансвагінальне УЗД
Посилання на джерела
- Lheureux S, Gourley C, Vergote I, Oza AM. Epithelial ovarian cancer. Lancet. 2019;393(10177):1240–53.
- Kuchenbaecker KB, Hopper JL, Barnes DR, Phillips KA, Mooij TM, Roos-Blom MJ, et al. Risks of breast, ovarian, and contralateral breast cancer for BRCA1 and BRCA2 mutation carriers. JAMA. 2017;317(23):2402–16.
- Paluch-Shimon S, Cardoso F, Sessa C, Balmana J, Cardoso MJ, Gilbert F, et al. Prevention and screening in BRCA mutation carriers and other breast/ovarian hereditary cancer syndromes: ESMO clinical practice guidelines for cancer prevention and screening. Ann Oncol. 2016;27(suppl 5):v103–10.
- Finch APM, Lubinski J, Møller P, Singer CF, Karlan B, Senter L, et al. Impact of oophorectomy on cancer incidence and mortality in women with a BRCA1 or BRCA2 mutation. J Clin Oncol. 2014;32(15):1547–53.
- Conte C, Pelligra S, Sarpietro G, Montana GD, Della Corte L, Bifulco G, et al. Hereditary women’s cancer: management and risk-reducing surgery. Medicina (Kaunas). 2023;59(2):300.
- Yoshida T, Takahashi K, Yamatani H, Takata K, Kurachi H. Impact of surgical menopause on lipid and bone metabolism. Climacteric. 2011;14(4):445–52.
- Honigberg MC, Zekavat SM, Aragam K, Finneran P, Klarin D, Bhatt DL, et al. Association of premature natural and surgical menopause with incident cardiovascular disease. JAMA. 2019Dec 24;322(24):2411.
- Rocca WA, Bower JH, Maraganore DM, Ahlskog JE, Grossardt BR, de Andrade M, et al. Increased risk of cognitive impairment or dementia in women who underwent oophorectomy before menopause. Obstet Gynecol Surv. 2008Jan;63(1):32–3.
- Mannis GN, Fehniger JE, Creasman JS, Vanessa LMAS, Beattie MS. Risk-reducing salpingo-oophorectomy and ovarian C screening in 1077 women after BRCA testing. JAMA Intern Med. 2013;173(2):96.
- Rosenthal AN, Fraser LSM, Philpott S, Manchanda R, Burnell M, Badman P, et al. Evidence of stage shift in women diagnosed with ovarian cancer during phase II of the United Kingdom familial ovarian cancer screening study. J Clin Oncol. 2017;35(13):1411–20.
- Sessa C, Balmaña J, Bober SL, Cardoso MJ, Colombo N, Curigliano G, et al. Risk reduction and screening of cancer in hereditary breast-ovarian cancer syndromes: ESMO Clinical Practice Guideline. Ann Oncol. 2023;34(1):33–47.
- Buys SS, Partridge E, Black A, Johnson CC, Lamerato L, Isaacs C, et al. Effect of screening on ovarian cancer mortality: The Prostate, Lung, Colorectal and Ovarian (PLCO) cancer screening randomized controlled trial. JAMA. 2011;305(22):2295–302.
- Jacobs IJ, Menon U, Ryan A, Gentry-Maharaj A, Burnell M, Kalsi JK, et al. Ovarian cancer screening and mortality in the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS): A randomised controlled trial. The Lancet. 2016;387(10022):945–56.
- Smith RA, Andrews KS, Brooks D, Fedewa SA, Manassaram-Baptiste D, Saslow D, et al. Cancer screening in the United States, 2017: a review of current American cancer society guidelines and current issues in cancer screening. CA Cancer J Clin. 2017;67(2):100–21.
- Stirling D, Evans DGR, Pichert G, Shenton A, Kirk EN, Rimmer S, et al. Screening for familial ovarian cancer: Failure of current protocols to detect ovarian cancer at an early stage according to the International Federation of Gynecology and Obstetrics System. J Clin Oncol. 2005;23(24):5589–96.
- Charkhchi P, Cybulski C, Gronwald J, Wong FO, Narod SA, Akbari MR. CA125 and ovarian cancer: a comprehensive review. Cancers (Basel). 2020;12(12):1–29.
- Akinwunmi BO, Babic A, Vitonis AF, Cramer DW, Titus L, Tworoger SS, et al. Chronic medical conditions and CA125 levels among women without ovarian cancer. Cancer Epidemiol Biomarkers Prev. 2018;27(12):1483.
- Sevinc A, Adli M, Kalender ME, Camci C. Benign causes of increased serum CA-125 concentration. Lancet Oncol. 2007;8(12):1054–5.
- Singhal A, Lander E, Karachristos A, Daly E, Dowling P, Patel V, et al. Elevation of CA 125 and CA 19–9 in patients with end-stage liver disease. Int J Biol Markers. 2012;27(2):147–51.
- Van CB, Valentin L, Van HC, Zhang J, Jurkovic D, Lissoni AA, et al. A novel approach to predict the likelihood of specific ovarian tumor pathology based on Serum CA-125: a multicenter observational study. Cancer Epidemiology and Prevention Biomarkers. 2011;20(11):2420–8.
- Pauler DK, Menon U, McIntosh M, Symecko HL, Skates SJ, Jacobs IJ. Factors influencing serum ca125ii levels in healthy postmenopausal women. Cancer Epidemiol Biomarkers Prev. 2001;10(5):489–93.
- Skates SJ, Mai P, Horick NK, Piedmonte M, Drescher CW, Isaacs C, et al. Large prospective study of ovarian cancer screening in high-risk women: CA125 cut-point defined by menopausal status. Cancer Prev Res (Phila). 2011;4(9):1401.
- Babic A, Cramer DW, Kelemen LE, Köbel M, Steed H, Webb PM, et al. Predictors of pretreatment CA125 at ovarian cancer diagnosis: a pooled analysis in the ovarian cancer association consortium. Cancer Causes Control. 2017;28(5):459.
- Bon GG, Kenemans P, Dekker JJ, Hompes PG, Verstraeten RA, Van Kamp GJ, et al. Fluctuations in CA 125 and CA 15–3 serum concentrations during spontaneous ovulatory cycles. Hum Reprod. 1999;14(2):566–70.
- Duffy MJ, Bonfrer JM, Kulpa J, Rustin GJS, Soletormos G, Torre GC, et al. CA125 in ovarian cancer: European Group on Tumor Markers guidelines for clinical use. Int J Gynecol Cancer. 2005;15(5):679–91.
- Skates SJ, Greene MH, Buys SS, Mai PL, Brown P, Piedmonte M, et al. Early detection of ovarian cancer using the risk of ovarian cancer algorithm with frequent CA125 testing in women at increased familial risk – Combined results from two screening trials. Clin Cancer Res. 2017;23(14):3628–37.
- Menon U, Gentry-Maharaj A, Hallett R, Ryan A, Burnell M, Sharma A, et al. Sensitivity and specificity of multimodal and ultrasound screening for ovarian cancer, and stage distribution of detected cancers: results of the prevalence screen of the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS). Lancet Oncol. 2009;10(4):327–40.
- Zhang L, Chen Y, Wang K. Comparison of CA125, HE4, and ROMA index for ovarian cancer diagnosis. Curr Probl Cancer. 2019;43(2):135–44.
- Jacobs IJ, Skates SJ, MacDonald N, Menon U, Rosenthal AN, Davies AP, et al. Screening for ovarian cancer: a pilot randomised controlled trial. The Lancet. 1999;353(9160):1207–10.
- Sasamoto N, Babic A, Rosner BA, Fortner RT, Vitonis AF, Yamamoto H, et al. Predicting circulating CA125 levels among healthy premenopausal women. Cancer Epidemiol Biomarkers Prev. 2019;28(6):1076.
- Hermsen BBJ, von Mensdorff-Pouilly S, Berkhof J, van Diest PJ, Gille JJP, Menko FH, et al. Serum CA-125 in relation to adnexal dysplasia and cancer in women at hereditary high risk of ovarian cancer. J Clin Oncol. 2007;25(11):1383–9.
- Meden H, Fattani-Meiodi A. CA 125 in benign gynecological conditions. Int J Biol Markers. 1998;13(4):231–7.
- Maiorana A, Cicerone C, Niceta M, Alio L. Evaluation of Serum CA 125 Levels in Patients with Pelvic Pain Related to Endometriosis. Biol Markers. 2007;22(3):200–2.
- Oliveira MAP, Raymundo TS, Soares LC, Pereira TRD, Demôro AVE. How to Use CA-125 More Effectively in the Diagnosis of Deep Endometriosis. Biomed Res Int. 2017;2017.
- Kauppila A, Telimaa S, Ronnberg L, Vuori J. Placebo-controlled study on serum concentrations of CA-125 before and after treatment of endometriosis with danazol or high-dose medroxyprogesterone acetate alone or after surgery. Fertil Steril. 1988;49(1):37–41.
- Santulli P, Streuli I, Melonio I, Marcellin L, M’Baye M, Bititi A, et al. Increased serum cancer antigen-125 is a marker for severity of deep endometriosis. J Minim Invasive Gynecol. 2015;22(2):275–84.
- Costanian C, McCague H, Tamim H. Age at natural menopause and its associated factors in Canada: Cross-sectional analyses from the Canadian Longitudinal Study on Aging. Menopause. 2018;25(3):265–72.
- Gold EB, Bromberger J, Crawford S, Samuels S, Greendale GA, Harlow SD, et al. Factors associated with age at natural menopause in a multiethnic sample of midlife women. Am J Epidemiol. 2001;153(9):865–74.
- Gschwantler-Kaulich D, Weingartshofer S, Rappaport-Fürhauser C, Zeilinger R, Pils D, Muhr D, et al. Diagnostic markers for the detection of ovarian cancer in BRCA1 mutation carriers. PLoS ONE. 2017;12(12):1–12.
- Chen Y, Bancroft E, Ashley S, Arden-Jones A, Thomas S, Shanley S, et al. Baseline and post prophylactic tubal-ovarian surgery CA125 levels in BRCA1 and BRCA2 mutation carriers. Fam Cancer. 2014;13(2):197–203.
- Finch A, Valentini A, Greenblatt E, Lynch HT, Ghadirian P, Armel S, et al. Frequency of premature menopause in women who carry a BRCA1 or BRCA2 mutation. Fertil Steril. 2013;99(6):1724–8.
- Lin WT, Beattie M, Chen L may, Oktay K, Crawford SL, Gold EB, et al. Comparison of Age at Natural Menopause in BRCA1/2 Mutation Carriers With a Non–Clinic-Based Sample of Women in Northern California. Cancer. 2013;119(9):1652.
- Tea MKM, Weghofer A, Wagner K, Singer CF. Association of BRCA1/2 mutations with FMR1 genotypes: Effects on menarcheal and menopausal age. Maturitas. 2013;75(2):148–51.
- Kępczyński Ł, Połatyńska K, Nykel A, Sałamunia J, Kałużewski T, Kużawczyk A, et al. Age of natural menopause onset in BRCA1/2 carriers – systematic review and meta-analysis. Prz Menopauzalny. 2020;19(4):171.
- Woodward ER, Sleightholme H V., Considine AM, Williamson S, McHugo JM, Cruger DG. Annual surveillance by CA125 and transvaginal ultrasound for ovarian cancer in both high-risk and population risk women is ineffective. BJOG. 2007;114(12):1500–9.
- Havrilesky LJ, Dinan M, Sfakianos GP, Curtis LH, Barnett JC, van Gorp T, et al. Costs, effectiveness, and workload impact of management strategies for women with an adnexal mass. J Natl Cancer Inst. 2015;107(1):322.
- Henderson JT, Webber EM, Sawaya GF. Screening for ovarian cancer updated evidence report and systematic review for the US preventive services task force. JAMA. 2018;319(6):595–606.
- Menon U, Gentry-Maharaj A, Burnell M, Singh N, Ryan A, Karpinskyj C, et al. Ovarian cancer population screening and mortality after long-term follow-up in the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS): a randomised controlled trial. Lancet. 2021;397(10290):2182.