Автори: Frederik A. Stuebs,Anna K. Dietl,Annika Behrens,Werner Adler,Carol Geppert,Arndt Hartmann,Antje Knöll,Matthias W. Beckmann,Grit Mehlhorn,Carla E. Schulmeyer,Paul Gass, Martin C. Koch
Резюме
Передумови: Мета цього дослідження – оцінити рівень конкордації, чутливості, специфічності, прогностичної цінності позитивного результату (ПЦПР) та прогностичної цінності негативного результату (ПЦНР) кольпоскопії для виявлення плоскоклітинних уражень і карцином високого ступеня (HSIL+).
Методи: Ми провели ретроспективне дослідження кольпоскопій, виконаних у сертифікованому гінекологічному відділенні в Ерлангені в період з січня 2015 року по травень 2022 року (7,5 років). Результати кольпоскопії співвідносилися з біопсіями, отриманими під час обстежень або хірургічних втручань. Випадки без гістології були виключені. Первинним результатом був показник відповідності між кольпоскопічними та гістологічними даними в залежності від типу зони трансформації (TZ), рівня досвіду експерта та віку пацієнток. Результати: Проаналізовано 4778 кольпоскопій у 4001 жінки. Показники конкордантності для CIN I/LSIL, CIN II/HSIL, CIN III/HSIL та карциноми становили 43,4%, 59,5%, 78,5% та 53,9% відповідно. Показник узгодженості був найнижчим для TZ3 і найвищим для кольпоскопістів з досвідом роботи понад 10 років.
Висновки: Кольпоскопія є важливим, доцільним та ефективним методом. Ретельного обстеження потребують жінки з TZ3, старші 35 років, оскільки вони мають найвищий ризик помилкового діагнозу. Найвища конкордантність виявлення HSIL+ спостерігається у кольпоскопістів з досвідом роботи >10 років.
Ключові слова: цервікальна інтраепітеліальна неоплазія; кольпоскопія; рак шийки матки; оцінка скринінгу раку шийки матки
Вступ
Рак шийки матки є одним з найпоширеніших видів раку серед жінок у всьому світі [1–4]. У 2018 році у світі було зареєстровано приблизно 570 000 випадків раку шийки матки та 311 000 смертей, а в Німеччині захворюваність становила 4320 жінок у 2018 році, 1612 з яких померли від раку шийки матки [1,5]. У всьому світі існують географічні відмінності. В останні десятиліття захворюваність на рак шийки матки знизилася в розвинених країнах, в основному завдяки загальнонаціональним скринінговим програмам [6]. Високодиференційовані плоскоклітинні ураження (HSIL) та рак шийки матки спричинені персистуючою інфекцією вірусом папіломи людини Високодиференційовані плоскоклітинні ураження (HSIL) та рак шийки матки спричинені персистуючою інфекцією вірусом папіломи людини (ВПЛ) [7]. Виявлення HSIL відіграє вирішальну роль, оскільки HSIL може прогресувати до раку шийки матки [8]. Підозрілі цитологічні результати, отримані під час скринінгових програм, у багатьох випадках є одними з перших ознак HSIL або інвазивного раку; жінок з аномальною цитологією направляють до сертифікованих гінекологічних відділень або гінекологічних центрів [6,9]. Ці гінекологічні відділення та гінекологічні центри сертифіковані Німецьким онкологічним товариством (Deutsche Krebsge- sellschaft e. V. [DKG]), Робочою групою з гінекологічної онкології (Arbeitsgemeinschaft Gynäkologische Onkologie e. V. [AGO]), Робоча група з патології шийки матки та кольпоскопії (Arbeitsgemeinschaft Zervixpathologie & Kolposkopie [AG-CPC]) та Німецьке товариство гінекології та акушерства (Deutsche Gesellschaft für Gynäkologie und Geburtshilfe e. V. [DGGG]) [9].
Цитологія є найдоступнішим, найдоцільнішим і найефективнішим інструментом для скринінгу HSIL та інвазивного раку [10,11]. Існує значна дискусія щодо точності мазків Папаніколау, яка, як повідомляється, коливається між 53% і 78% [10]. Поєднання кольпоскопії, цитології та біопсії під контролем кольпоскопії є золотим стандартом для діагностики HSIL та раку шийки матки [6,12,13]. Незважаючи на високу ефективність скринінгу раку шийки матки, лікування HSIL є проблемою громадської охорони здоров’я [14].
Кольпоскопія є найпростішим і найефективнішим обстеженням першого етапу для точної діагностики HSIL у жінок, яких направляють на обстеження через аномалії цитологічного дослідження [15]. Кольпоскопія дозволяє лікарю локалізувати потенційні ураження, оцінити ступінь їх тяжкості та отримати кольпоскопічно спрямовану біопсію [15]. Повідомляється, що кольпоскопія має найкращу ефективність у виявленні HSIL порівняно зі звичайними мазками Папаніколау та мазками на рідинній основі [16]. Кольпоскопія краще диференціює HSIL від низькодиференційованих плоскоклітинних уражень (LSIL), ніж диференціює LSIL від нормальної шийки матки [17]. Тим не менш, кольпоскопія залишається предметом клінічного інтересу [15]. Повідомляється про широкий діапазон чутливості та специфічності у виявленні HSIL, що становить 30-90% та 44-97% відповідно [15–17]. Повідомляється, що до 30% HSIL можуть бути пропущені тільки за допомогою кольпоскопії [18]. Щоб не пропустити HSIL або рак шийки матки, необхідна біопсія, спрямована кольпоскопією, яка є інвазивною процедурою, пов’язаною з певними ускладненнями, включаючи біль, кровотечу і фіброз [10]. Також важливо уникати надмірного лікування HSIL, наприклад, великої петлевої ексцизії зони трансформації (LLETZ) або процедур петлевої електрохірургічної ексцизії (LEEP) з лазерною коагуляцією периферії. Необхідно уникати захворюваності, пов’язаної з цією процедурою, такої як перинатальна смертність (відносний ризик 2,87), передчасні пологи (<32/34 тижнів; відносний ризик 2,59-2,78) або низька маса тіла при народженні (<2000 г; відносний ризик 2,53-2,86) [6,19–21].
Існують можливі пояснення широкого діапазону показників чутливості та специфічності кольпоскопії, такі як рівень досвіду кольпоскопістів, тип зони трансформації та вік пацієнток. Метою даного дослідження було визначити конкордантність кольпоскопії в порівнянні з остаточним гістологічним діагнозом, отриманим за допомогою LLETZ, LEEP або лазерної конізації.
Матеріали та методи
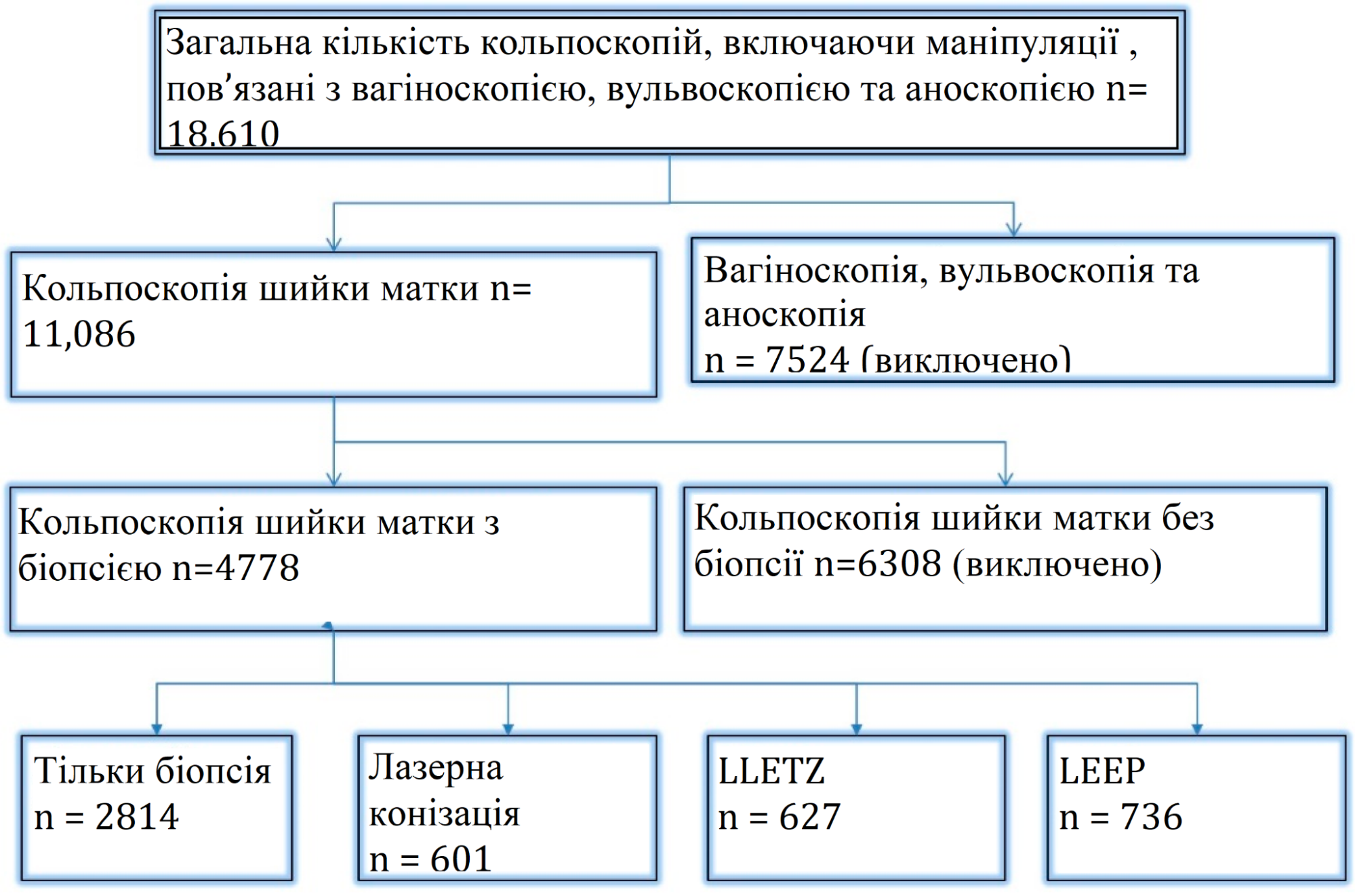
З січня 2015 року по травень 2022 року у державному сертифікованому гінекологічному відділенні Університетської клініки Ерлангена було проведено 11 086 кольпоскопій шийки матки (Зображення. 1). Абсолютно нормальна цитологія шийки матки була найпоширенішою причиною скерування жінок у відділення дисплазії. Всі пацієнтки (n = 4778), яким була проведена біопсія або ексцизійне хірургічне лікування – LLETZ, петльова електрохірургічна ексцизія (LEEP) з лазерною коагуляцією периферійних відділів шийки матки або лазерна коагуляція периферії або лазерна коагуляція – були включені. Пацієнтки, у яких абляція була виконана без взяття біопсії під час кольпоскопічного дослідження, були виключені з аналізу через відсутність гістологічних результатів. Були включені лише жінки з адекватною кольпоскопією.
Зображення 1. Залучення та виключення пацієнтів.
У нашому відділенні кольпоскопія проводиться в стандартизованих умовах за допомогою кольпоскопа Zeiss KSK 150 FC. Загальна оцінка проводилась відповідно до кольпоскопічної термінології шийки матки Міжнародної федерації патології шийки матки та кольпоскопії (IFCPC) 2011 року: “адекватний” або “неадекватний” з причини (наприклад, запалення, кровотеча, рубець); видимість сквамоколонного з’єднання (повністю видимий, частково видимий, не видимий); і зона трансформації (TZ) типів 1, 2 або 3 [22–24]. Стандартний мазок з шийки матки, тест на вірус папіломи людини (гібридний тест захоплення 2, 2015-2018 рр.; аналіз ВПЛ високого ризику Abbott RealTime на Abbott m2000sp, 2019-2020 рр.; або Roche, cobas®4800, HPV Test, Multiplex-RT-PCR, з 2020 р.) та нанесення 5% оцтової кислоти на шийку матки є стандартом лікування у нашому відділенні. Цю процедуру проводять кожній жінці, яка звернулася з патологічним цитологічним дослідженням. Крім того, для більш детального обстеження шийки матки та піхви в деяких випадках застосовують розчин Люголя, щоб візуалізувати передракові ураження у піхві, які раніше не були помітні.
Результати кольпоскопії класифікуються відповідно до IFCPC на “нормальні” та “аномальні”, а також поділяються на “незначні”, “значні” та “підозрілі на інвазію/рак”. Також розрізняють “неспецифічні” та “різні” результати. До нормальних знахідок відносяться, наприклад, плоский епітелій, стовпчастий епітелій або метапластичний плоский епітелій. Незначні зміни складаються з дрібної пунктирності та мозаїчності, тонкого оцтово-білого епітелію, а також нерівних та географічних меж. Гострі межі, ознака внутрішньої межі, ознака гребеня, щільний оцтово-білий епітелій, грубий мозаїчний малюнок і груба пунктировка є типовими великими ураженнями. Атипові судини, крихкі судини, нерівна поверхня, екзофітні ураження, некроз та виразки є підозрілими щодо інвазії. Різні знахідки представлені кондиломами, поліпами або запаленням, а неспецифічні ураження – лейкоплакією або ерозіями [22]. У цьому дослідженні висновки “незлоякісні”, “різні” та “неспецифічні” стосувалися доброякісної гістології, оскільки ці висновки є доброякісними. Кондиломи розглядалися як доброякісна гістологія, хоча деякі патологоанатоми розглядають їх як цервікальну інтраепітеліальну неоплазію I ступеня (CIN I). Якщо є велика знахідка або ураження, підозріле на інвазію, необхідно провести біопсію під контролем кольпоскопії з найбільш підозрілої частини ураження, використовуючи біопсійні щипці (біопсійні щипці Seidl ER076R; Aesculap AG, Тутлінген, Німеччина). У деяких пацієнтів з мультифокальним ураженням необхідна більш ніж одна біопсія. Рішення щодо хірургічного лікування ґрунтується на результатах кольпоскопії, типах TZ, віці жінки на момент встановлення діагнозу, результатах цитологічного дослідження, тестування на ВПЛ та гістологічних даних. У деяких пограничних випадках (наприклад, метаплазія або порційна ектопія) для виключення неопластичних уражень проводиться біопсія, навіть якщо лікарі очікують, що результати будуть нормальними.
Під час проведення ретроспективного аналізу у відділенні дисплазії працювало 11 кольпоскопістів з різним рівнем клінічного досвіду та підготовки. Вони були поділені на три групи: з досвідом роботи від 0 до 5 років, від 5 до 10 років та понад 10 років.
Всі дані, включаючи результати кольпоскопії, мазок Папаніколау та ВПЛ, гістологічні результати, кількість біопсій, тип зони трансформації та епідеміологічні результати, були проспективно занесені в базу даних для подальшого дослідження.
У випадку, якщо гістологічні результати біопсії відрізнялися від результату операції, для порівняння брали найважчий гістологічний результат. Коефіцієнт конкордації – це відсоток пацієнток з однаковими кольпоскопічними знахідками і більш важкою гістологією: нормальні, різні і неспецифічні кольпоскопічні знахідки еквівалентні доброякісній гістології, незначні знахідки – CIN I, великі знахідки – CIN II / CIN III / аденокарцинома in situ (AIS), а підозра на інвазію корелює з інвазивним раком. Надмірною діагностикою вважалося, якщо результати кольпоскопії підозрювали більш поширене ураження, ніж показав гістологічний результат, а недостатньою діагностикою вважалося, якщо остаточна гістологія показала більш поширене ураження, ніж результати кольпоскопії.
Жінок з нормальними або незначними змінами направляли на регулярні контрольні обстеження. Якщо біопсія виявляла HSIL, приймалося рішення на користь хірургічного втручання. Залежно від розміру ураження, TZ і віку пацієнтки були можливі різні типи конізації. Жінкам у постменопаузі, з внутрішньошийковими ураженнями або із зоною трансформації 3-го типу виконували LLETZ. Жінки віком до 25 років з діагнозом HSIL були відібрані для спостереження через високі шанси регресії [25]. Цим жінкам було призначено посилене диспансерне спостереження з цитологічним та кольпоскопічним дослідженням. Хірургічне ексцизійне лікування проводили, якщо HSIL персистував або була підтверджена інвазія. У цих випадках виконували LEEP з лазерною коагуляцією периферії або лазерною конізацією. LEEP також виконується у жінок репродуктивного віку з TZ1 або екстрацервікальними ураженнями. Жінкам репродуктивного віку з TZ3, інтрацервікальними ураженнями або підозрою на мікроінвазію проводили лазерну конізацію. Жінкам з AIS проводили лазерну конізацію через високий ризик інвазії. У жінок, у яких біопсія, проведена за допомогою кольпоскопії, виключила інвазію, дисплазію було видно повністю, а також при TZ1, абляційне лазерне лікування було варіантом, щоб мінімізувати пошкодження, завдані шийці матки. Всі операції були виконані досвідченим і висококваліфікованим персоналом в Університетській лікарні Ерлангена [6].
Статистичний аналіз
Щоб дослідити узгодженість між результатами кольпоскопії та гістології, ми спочатку розрахували рангову кореляцію Спірмена. Потім ми розрахували надмірну діагностику (результати гірші за гістологію), рівень конкордації та недостатню діагностику (гістологія гірша за результати) для наступних чотирьох категорій: (1) норма/різноманітні/неспецифічні; (2) незначні; (3) великі; і (4) підозрілі на рак. Крім того, ми сформували такі дві групи: група 1 (норма/різні/неспецифічні, незначні) і група 2 (великі, підозрілі на рак). Для цих груп ми розрахували чутливість, специфічність, позитивні та негативні прогностичні значення та відповідні 95% довірчі інтервали. Цей аналіз був проведений для загальних даних і повторений для підгруп, визначених за рівнем кольпоскопічного досвіду (0-5, 5-10, >10 років), TZ (1, 2, 3) і віком (<35 років і 35 років). Узгодженість між кольпоскопією та гістологією оцінювали в трьох моделях логістичної регресії, де узгодженість (так/ні) була залежною змінною, а результати кольпоскопії (критерій: великі ураження), ТЗ (критерій: ТЗ1) та стаж (критерій: понад 10 років), відповідно, незалежними змінними. Усі статистичні аналізи проводили за допомогою статистичної програми R V4.2.0 (R Core Team (2022). R: Мова та середовище для статистичних обчислень. R Foundation for Statistical Computing, Відень, Австрія).
Результати
Загалом за період проведення цього ретроспективного дослідження було виконано 11 086 кольпоскопій. У 6308 випадках гістологічне дослідження під час кольпоскопії або хірургічне втручання після кольпоскопії не було необхідним. Таким чином, всього було проведено 4778 кольпоскопій з гістологічним дослідженням у 4001 жінки. Лазерна конізація була проведена у 601 випадку, LLETZ – у 627 випадках, а LEEP – у 736 жінок (див. зобр. 1)
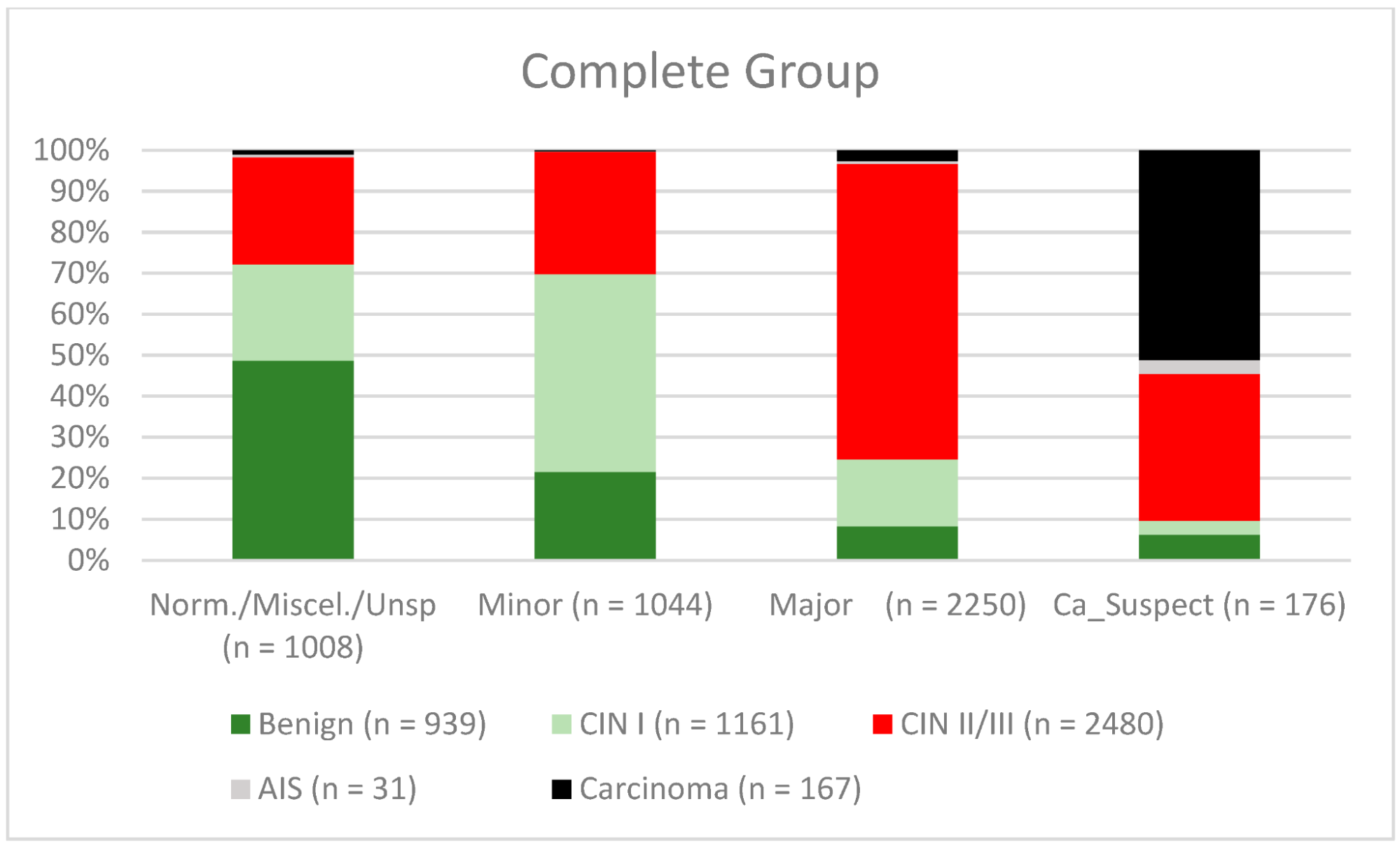
Середній вік жінок, включених у дослідження, на момент проведення кольпоскопії становив 36,8 років (стандартне відхилення 10,8 років). Результати кольпоскопії були “нормальними/різними/неспецифічними” у 1008 випадках, “малими” у 1044 випадках “великими” у 2550 випадках і “підозрілими на рак” у 176 випадках. Найважчим гістологічним діагнозом був “доброякісний” у 939 випадках, “CIN I” у 1161 випадку, “CIN II/CIN III” у 2480 випадках, аденокарцинома in situ (“AIS”) у 31 випадку і “карцинома” у 167 випадках. Нормальні/різноманітні результати/неспецифічні результати мали показник конкордації 52,3% (491/939). Доброякісні новоутворення були діагностовані в 47,7% випадків (448/939). Показник конкордантності для незначних уражень становив 48,3% (504/1161). Показники недодіагностики для CIN I/LSIL і CIN II/CIN III/HSIL становили 20,3% (236/1161) і 23,2% (576/2480), відповідно. Частота гіпердіагностики для CIN I/LSIL; CIN II/CIN III/HSIL становила 36,3% (421/1161) та 2,5% (63/2480) відповідно. Рівень конкордантності для великих уражень становив 74% (CIN II/HSIL; CIN III/HSIL, AIS) (1858/2511). Кольпоскопічні результати “підозри на карциному” були правильними в 51,1% випадків. У 46,1% (77/167) карциному було діагностовано помилково (див. таблицю 1 і зображення 2). Загальна чутливість, специфічність, позитивна прогностична цінність (ПЦПР) і негативна прогностична цінність (ПЦНР) для діагностичної диференціації двох груп – нормальних/різних/неспецифічних/невеликих і великих/підозрілих на рак – були такими: 77,8% (95% ДІ, від 76,12% до 79,31%), 69,3% (95% ДІ, від 67,31% до 71,30%), 76,4% (95% ДІ, від 74,74% до 77,96%) і 71% (95% ДІ, від 68,94% до 72,91%) (для підгруп див. Таблицю 2).
Таблиця 1. Висновки в порівнянні з біопсією (всі пацієнти).
|
Результат/Біопсія |
Доброякісний |
CIN I |
CIN II/III |
AIS |
Карцинома |
|
(p < 0.001) |
(p < 0.001) |
Референтне значення |
(p < 0.001) |
||
|
Нормальні/різні/неспецифічні (n = 1008) |
491 (52.3%) |
236 (20.3%) |
264 (10.6%) |
7 (22.6%) |
10 (6%) |
|
Малий (n = 1044) |
225 (24%) |
504 (43.4%) |
312 (12.6%) |
1 (3.2%) |
2 (1.2%) |
|
Великий (n = 2550) |
212 (22.6%) |
415 (35.7%) |
1841 (74.2%) |
17 (54.8%) |
65 (38.9%) |
|
Підозра на рак (n = 176) |
11 (1.2%) |
6 (0.5%) |
63 (2.5%) |
6 (19.4%) |
90 (53.9%) |
Зображення 2. Висновки в порівнянні з біопсією (всі пацієнтки) (CIN, цервікальна інтраепітеліальна неоплазія; AIS, аденокарцинома in situ).
Примітки до таблиці: Norm/miscel/unsp – нормальний/різний/неспецифічний; minor – малий; major – великий; Ca_Suspect – підозра на карциному; Benign – доброякісний.
Таблиця 2. Чутливість, специфічність, позитивна прогностична цінність (ПЦПР) та негативна прогностична цінність (ПЦНР) для різних підмножин (TZ, зона трансформації; CI, довірчий інтервал)
|
|
Чутливість (95 CI) |
Специфічність (95 CI) |
ППЦ (95 CI) |
НПЦ (95 CI) |
|
Вся група |
77.8% (76.12–79.31%) |
69.3% (67.31–71.30%) |
76.4% (74.74–77.96%) |
71.0% (68.94–72.91%) |
|
TZ1 |
80.1% (77.66–82.33) |
65.7% (62.47–68.9) |
75.9% (73.4–78.26) |
71.0% (67.72–74.12) |
|
TZ2 |
82.4% (79.7–84.93) |
64.4% (60.27–68.43) |
78.1% (75.25–80.77) |
70.4% (66.24–74.39) |
|
TZ3 |
67.7% (64.02–71.26) |
77.8% (74.51–80.87) |
74.8% (71.13–78.21) |
71.3% (67.87–74.48) |
|
Екзаменатор 0–5 |
73.5% (70.86–76.03) |
68.6% (65.87–71.17) |
69.0% (66.36–71.6) |
73.1% (70.41–75.65) |
|
Екзаменатор 5–10 |
70.2% (65.89–74.24) |
77.1% (72.62–81.2) |
79.2% (75.05–82.95) |
67.6% (62.99–71.9) |
|
Екзаменатор >10 |
86.0% (83.77–88.08) |
65.1% (60.77–69.31) |
83.7% (81.34–85.86) |
69.2% (64.76–73.3) |
|
Вік 0–34 |
82.3% (80.18–84.3) |
63.8% (60.68–66.86) |
76.4% (74.19–78.59) |
71.7% (68.51–74.66) |
|
Вік >35 |
73.0% (70.48–75.37) |
74.0% (71.32–76.5) |
76.3% (73.84–78.63) |
70.5% (67.78–73.02) |
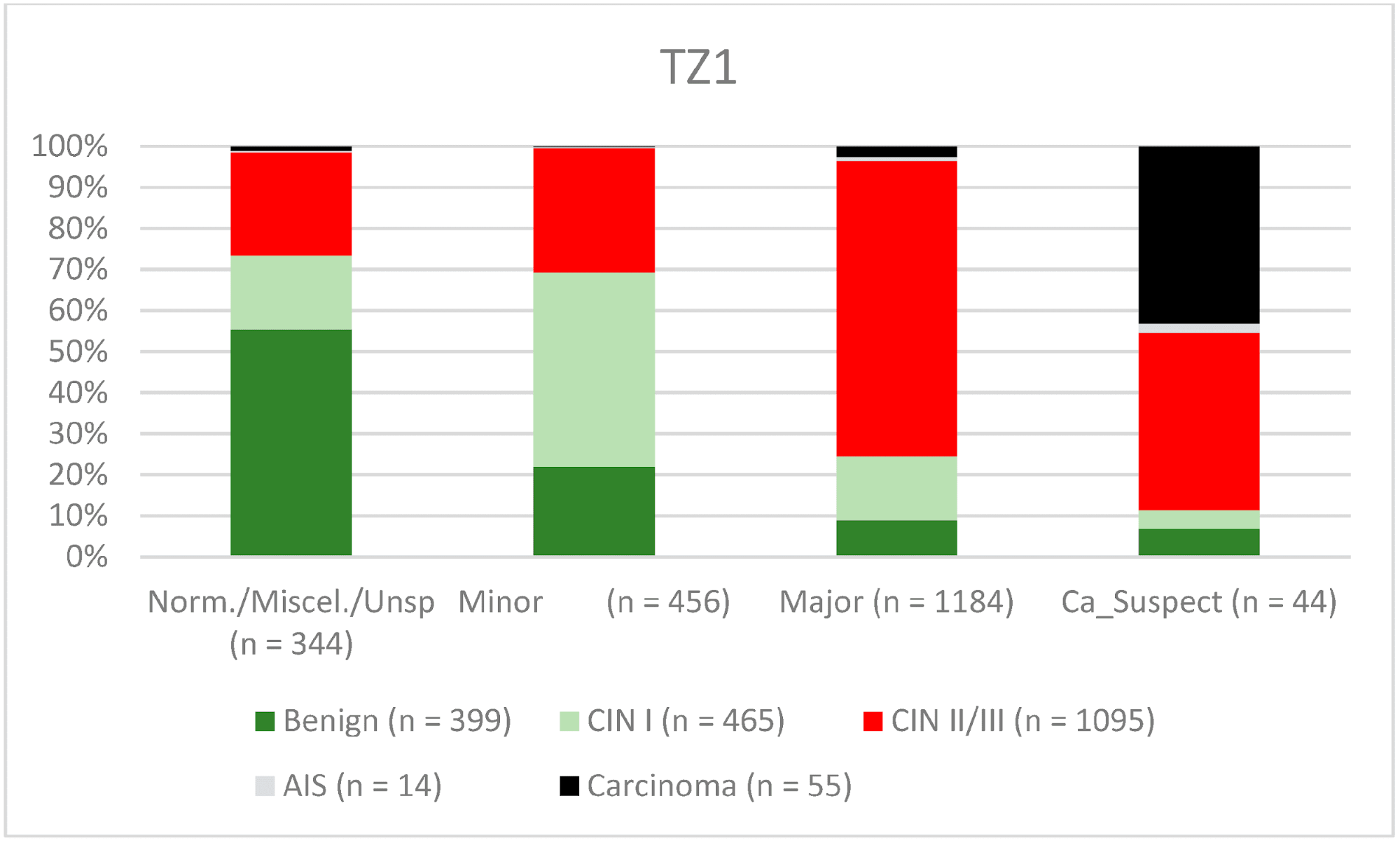
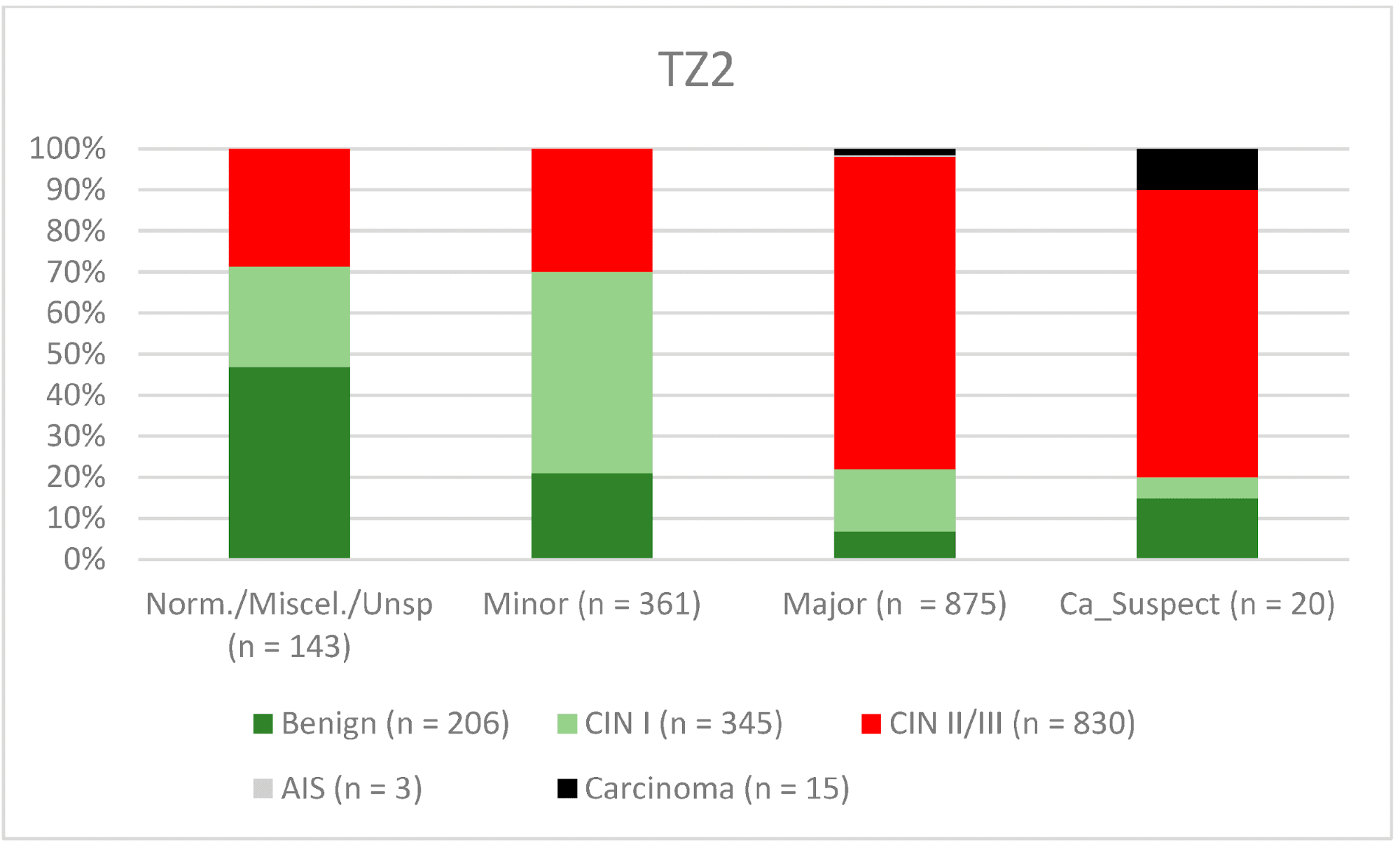
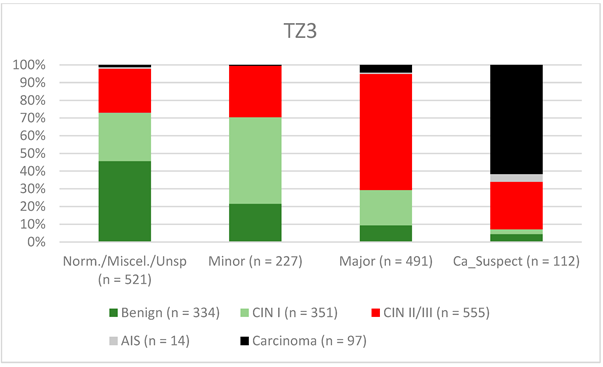
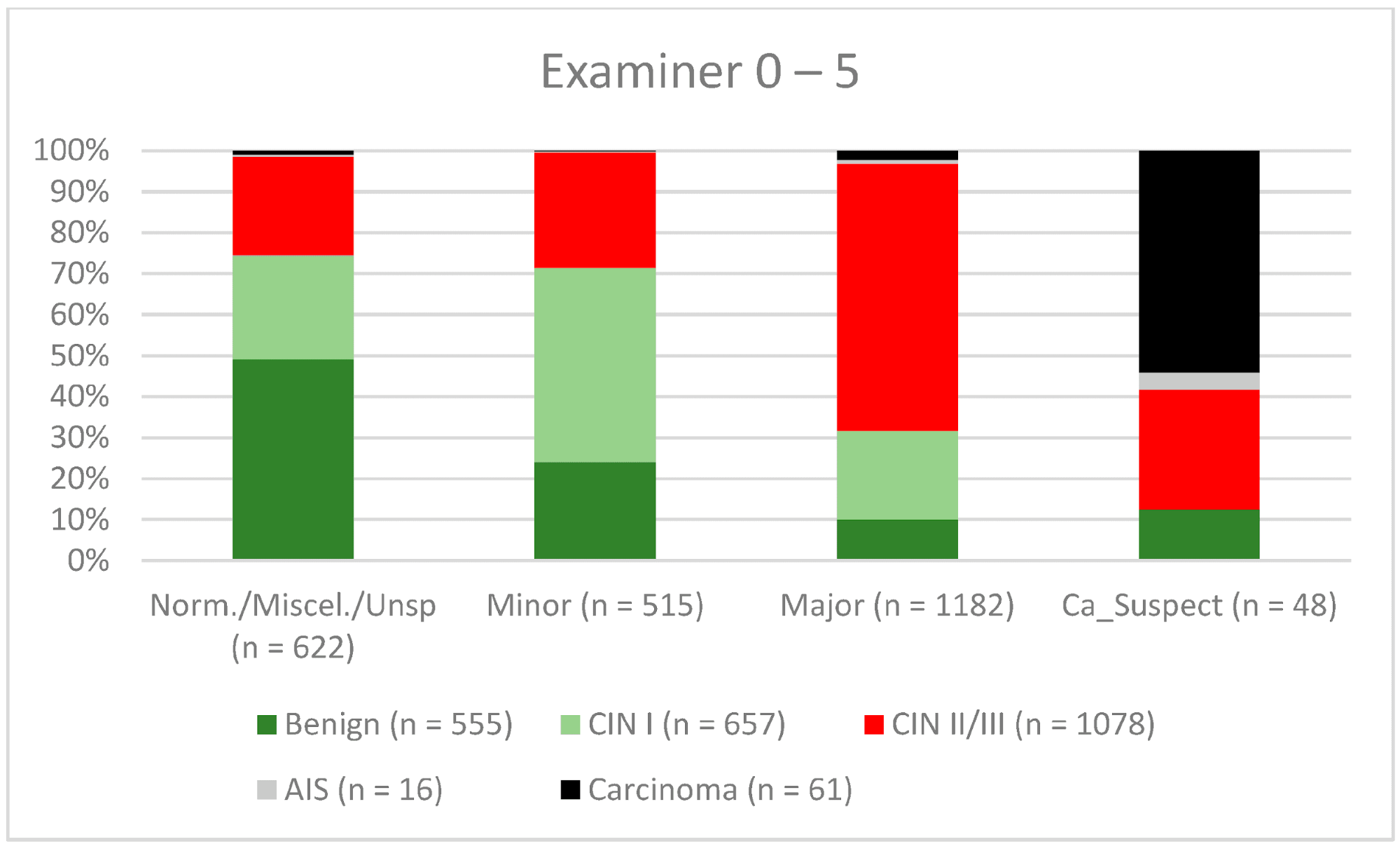
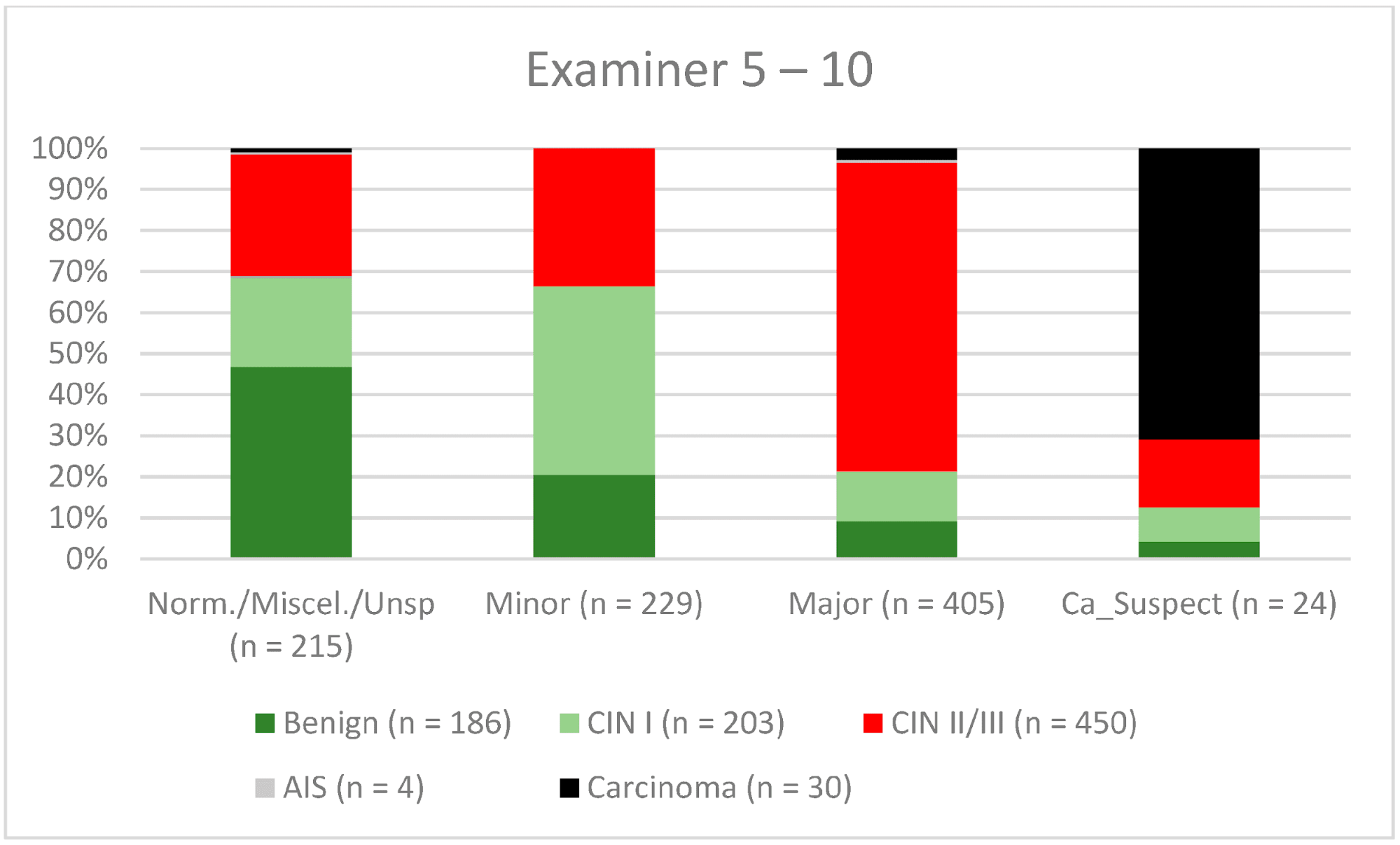
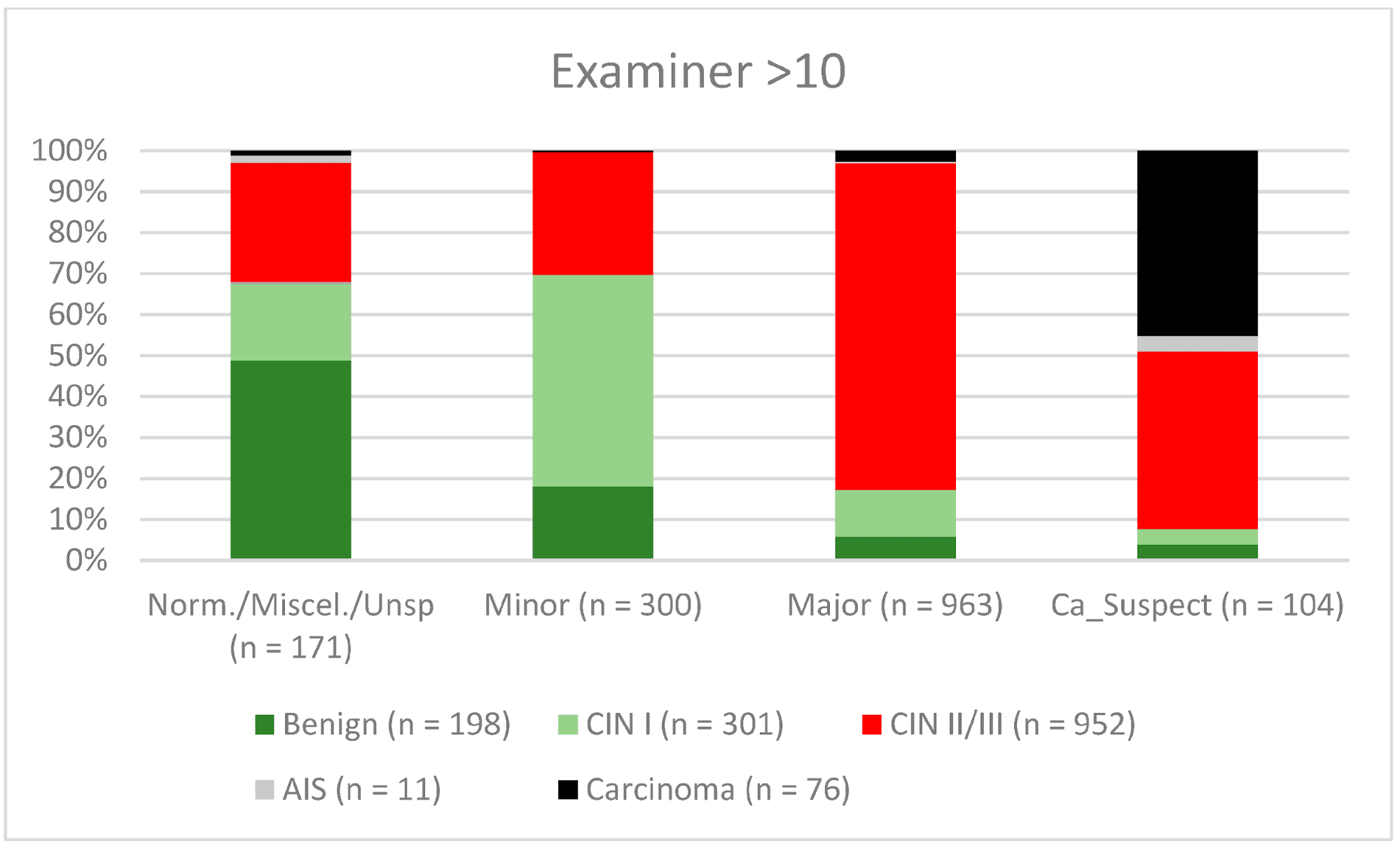
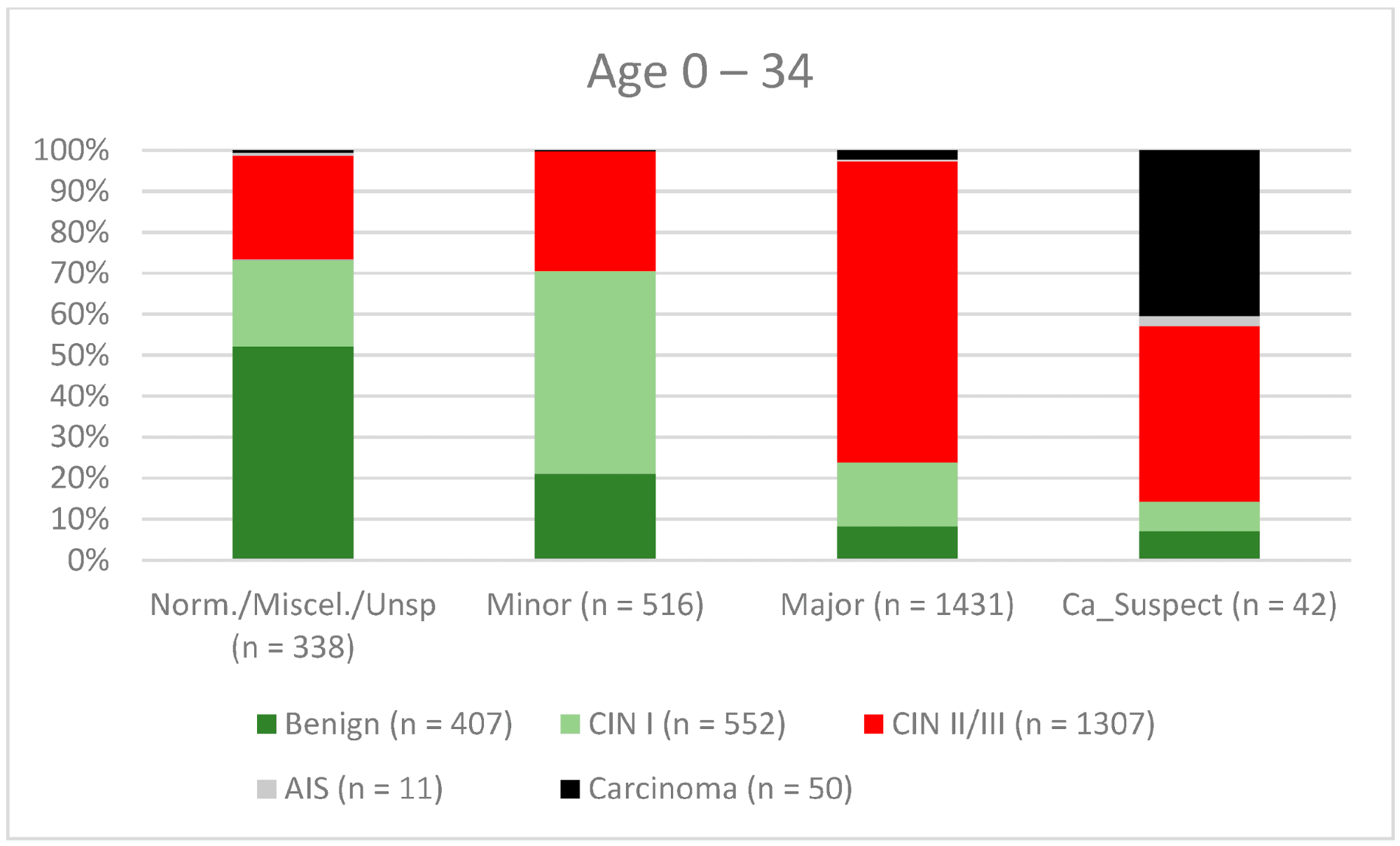
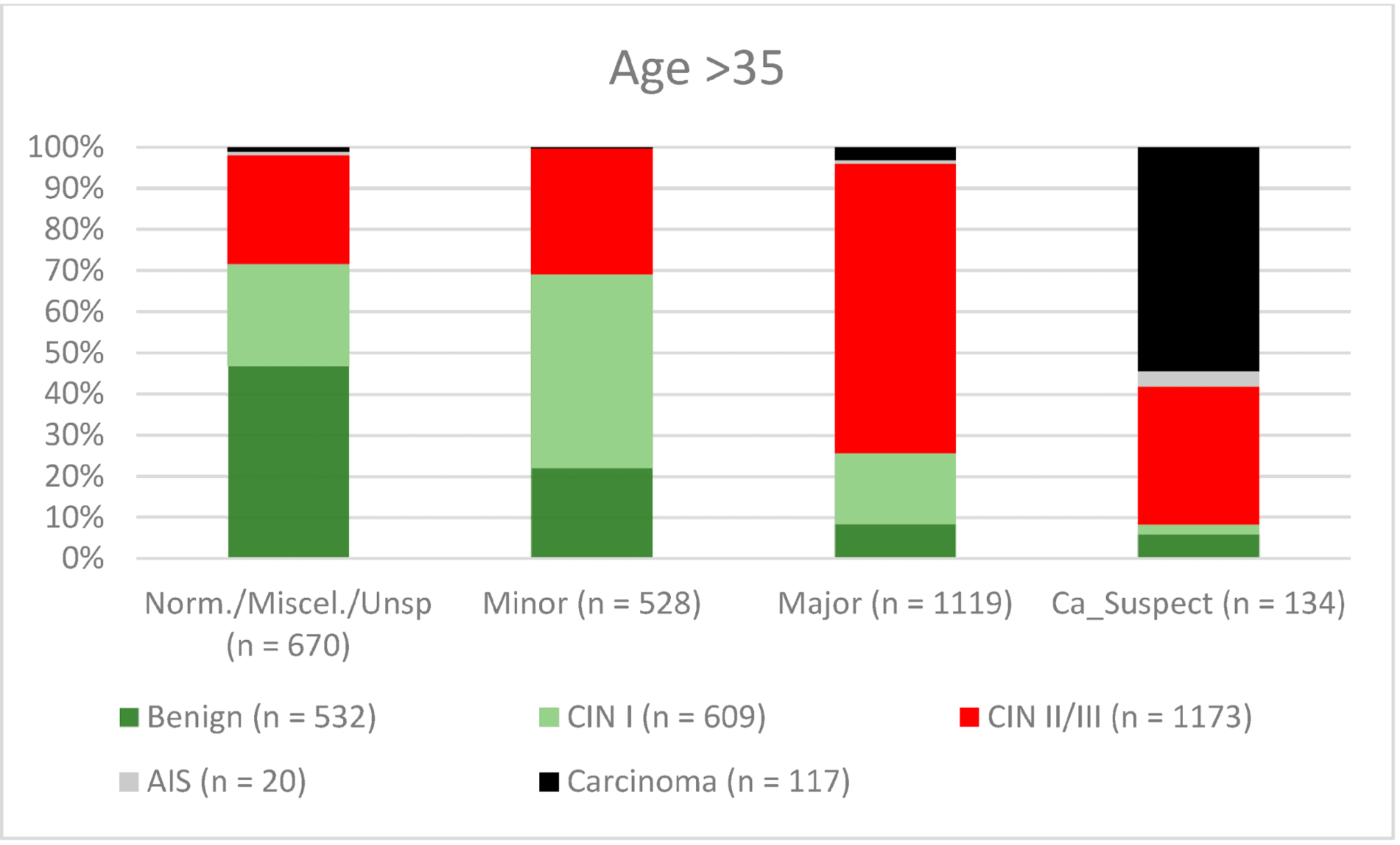
Загалом 2028 жінок мали зону трансформації 1-го типу (TZ1) на момент проведення кольпоскопії; 1399 та 1351 жінка мали зони трансформації 2-го типу (TZ2) або 3-го типу (TZ3), відповідно. Рівень узгодженості основних результатів становив 72,8% (862/1184) для TZ1, 76,6% (670/875) для TZ2 і 66,4% (326/491) для TZ3. CIN II/III/HSIL був правильно діагностований як основний діагноз у 77,8% для TZ1 (852/1095) і для TZ3 у 58% (322/555) (див. Зобр. 3–5). Логістична регресійна модель показала, що різниця між TZ1 і TZ2 не була статистично значущою (p = 0,053), тоді як різниця між TZ1 і TZ3 була значущою (p = 0,009). Рівень узгодженості основних висновків у групі експертів з досвідом роботи від 0 до 5 років становив 65,9% (779/1182); у групі з досвідом роботи від 5 до 10 років – 76% (308/405); а для експертів з досвідом роботи понад 10 років – 80,1% (771/963). Різниця між досвідом роботи понад 10 років і 0-5 років була статистично значущою (p < 0,001), але не було значущої різниці між досвідом роботи 5-10 років і понад 10 років (p = 0,097). CIN II/III/HSIL був правильно діагностований як велике ураження в 71,3% (769/1078) випадків експертами з досвідом роботи 0-5 років і в 80,6% випадків (767/952) групою експертів з досвідом роботи понад 10 років (див. Зобр. 6–8). Частота конкордації для карциноми зростала разом з рівнем досвіду експертів. Для жінок віком до 35 років рівень конкордації основних висновків становив 74,1% (1060/1431), а для жінок віком понад 35 років – 71,3% (798/1119) (див. Зобр. 9 і 10).
Зображення 3. Висновки в порівнянні з гістологією (зона трансформації 1 типу) (CIN, цервікальна інтраепітеліальна неоплазія; AIS, аденокарцинома in situ).
Примітки до таблиці: Norm/miscel/unsp – нормальний/різний/неспецифічний; minor – малий; major – великий; Ca_Suspect – підозра на карциному; Benign – доброякісний.
Зображення 4. Висновки в порівнянні з гістологією (зона трансформації 2 типу) (CIN, цервікальна інтраепітеліальна неоплазія; AIS, аденокарцинома in situ).
Примітки до таблиці: Norm/miscel/unsp – нормальний/різний/неспецифічний; minor – малий; major – великий; Ca_Suspect – підозра на карциному; Benign – доброякісний.
Зображення 5. Висновки в порівнянні з гістологією (зона трансформації 3 типу) (CIN, цервікальна інтраепітеліальна неоплазія; AIS, аденокарцинома in situ).
Примітки до таблиці: Norm/miscel/unsp – нормальний/різний/неспецифічний; minor – малий; major – великий; Ca_Suspect – підозра на карциному; Benign – доброякісний.
Зображення 6. Висновки в порівнянні з гістологією (експерти з досвідом роботи 0-5 років) (CIN, цервікальна інтраепітеліальна неоплазія; AIS, аденокарцинома in situ).
Примітки до таблиці: Norm/miscel/unsp – нормальний/різний/неспецифічний; minor – малий; major – великий; Ca_Suspect – підозра на карциному; Benign – доброякісний.
Зображення 7. Висновки в порівнянні з гістологією (експерти з досвідом роботи 5-10 років) (CIN, цервікальна інтраепітеліальна неоплазія; AIS, аденокарцинома in situ).
Примітки до таблиці: Norm/miscel/unsp – нормальний/різний/неспецифічний; minor – малий; major – великий; Ca_Suspect – підозра на карциному; Benign – доброякісний.
Зображення 8. Висновки в порівнянні з гістологією (експерти з досвідом роботи >10 років) (CIN, цервікальна інтраепітеліальна неоплазія; AIS, аденокарцинома in situ).
Примітки до таблиці: Norm/miscel/unsp – нормальний/різний/неспецифічний; minor – малий; major – великий; Ca_Suspect – підозра на карциному; Benign – доброякісний.
Зображення 9. Висновки в порівнянні з гістологією (пацієнти віком 0-34 роки) (CIN, цервікальна інтраепітеліальна неоплазія; AIS, аденокарцинома in situ).
Примітки до таблиці: Norm/miscel/unsp – нормальний/різний/неспецифічний; minor – малий; major – великий; Ca_Suspect – підозра на карциному; Benign – доброякісний.
Зображення 10. Висновки в порівнянні з гістологією (пацієнти віком > 35 років) (CIN, цервікальна інтраепітеліальна неоплазія; AIS, аденокарцинома in situ).
Примітки до таблиці: Norm/miscel/unsp – нормальний/різний/неспецифічний; minor – малий; major – великий; Ca_Suspect – підозра на карциному; Benign – доброякісний.
Обговорення
Це ретроспективне одноцентрове дослідження включало 4778 кольпоскопій з гістологічним дослідженням. Найпоширенішими кольпоскопічними знахідками були “великі” ураження. У 167 випадках експерти вважали ураження підозрілим на рак. Рівень узгодженості для великих уражень становив 74,6%, а рівень узгодженості для уражень, “підозрілих на рак”, – 51,1%. Для зон трансформації 3-го типу показник конкордації був нижчим. Показник узгодженості збільшувався разом з рівнем досвіду експерта.
У літературі існує певна суперечливість щодо недооцінки та переоцінки результатів кольпоскопічних дослідженнь. В одних дослідженнях ураження шийки матки частіше недостатньо оцінюються, а в інших – надмірно оцінюються [26,27]. Частота надмірної діагностики (19,6%, 938/4778) і недостатньої діагностики (18,8%, 897/4778) була досить збалансованою. У дослідженні Ruan та співавт., що включало 1828 жінок, майже половина HSILs і карцином була недодіагностована [27]. У цьому дослідженні у 46,1% жінок карциноми були недостатньо оцінені, але у 38,9% було діагностовано щонайменше HSIL, так що 85% з них отримали хірургічне втручання після кольпоскопічного обстеження, і жодна жінка не була пропущена.
У метааналізі, що включав 11 досліджень з 6370 учасницями, чутливість кольпоскопічної імпресії варіювала від 0,29 до 1,00, а специфічність – від 0,12 до 0,88 [28] Чутливість у двох інших дослідженнях становила від 56,29% до 64,72%, а специфічність – від 52,74% до 93,82%. Показники ПЦПР та ПЦНР становили від 76,32% до 77,47% та від 85,04% до 95,41% відповідно [10,28]. У даному дослідженні значення чутливості та специфічності становили 77,75% (95% ДІ, 76,12% – 79,31%) і 69,33% (95% ДІ, 67,31% – 71,30%) відповідно. Одним з можливих пояснень цього є те, що діагноз жінкам ставили висококваліфіковані працівники, які спеціалізуються на діагностиці HSIL і карциноми шийки матки. Показники ПЦПР (95% ДІ, 76,38%; діапазон від 74,74% до 77,96%) були порівнянними з даними літератури, а показники ПЦНР (95% ДІ, 70,96%; діапазон від 68,94% до 72,91%) були нижчими.
Можливість проведення візуальної оцінки шийки матки залежить від типу зони трансформації. За визначенням, повна візуальна оцінка шийки матки із зоною трансформації 3-го типу неможлива, і внутрішньошийкові ураження можуть бути пропущені [24]. Для TZ3 конкордантність була найнижчою для виявлення CIN II/III/HSIL (58%). Незначні ураження також рідше виявляли у жінок з TZ3 (31,6%) (див. зобр. 3–5). Ruan та співавт. стверджують, що TZ3 найчастіше зустрічався у жінок з нормальними показниками і низьким ризиком, тоді як TZ1 і TZ2 частіше асоціювалися з HSIL і карциномою. Автори рекомендують приділяти особливу увагу TZ1 і TZ2 [27]. Ми не можемо підтвердити ці дані. У даному дослідженні більшість карцином були пов’язані з TZ3. При стадії IB і більших карциномах ТЗ найчастіше інфільтровані пухлиною, і тому ТЗ не може бути оцінений повністю. Крім того, не було виявлено відмінностей між TZ2 і TZ3 щодо розподілу низько- і високодиференційованих уражень у групі пацієнтів, включених у це дослідження.
Кольпоскопія є дуже суб’єктивним методом дослідження, і узгодженість результатів всередині та між спостерігачами може суттєво відрізнятися навіть серед досвідчених кольпоскопістів [14,29,30]. Дивно, але в ретроспективному огляді Baum та співавт. повідомляють про найвищий рівень узгодженості результатів у лікарів другого року навчання (77%), з нижчими показниками у лікарів третього року навчання (75%) та лікарів четвертого року навчання (73%) [14]. Цікаво, що показник узгодженості був найвищим серед практикуючих медичних сестер (92%). Вони виконували велику кількість кольпоскопій і бачили своїх пацієнтів під час спостереження. Тому вони отримували хороші відгуки про свою роботу [14]. Для CIN II/III/HSIL ми також спостерігали незначне зниження показників конкордації для експертів з досвідом роботи 0-5 років і 5-10 років (71,3% і 80,6% відповідно). Для карциноми спостерігалося постійне зростання конкордантності для різних рівнів досвіду – 42,6%, 56,7% і 61,8% відповідно (див. Зобр. 6–8). У нашому сертифікованому гінекологічному відділенні кожен лікар виконує 500-1000 кольпоскопій на рік. Для того, щоб досягти найкращого показника узгодженості, лікар-кольпоскопіст повинен провести щонайменше 5000-10 000 обстежень і мати досвід роботи 10 років або більше. З 2014 року консультації з гінекологічної дисплазії зобов’язані проводити щонайменше 100 задокументованих кольпоскопій на рік, тоді як відділення гінекологічної дисплазії в Німеччині вимагають щонайменше 300 на рік. Для кольпоскопістів, які працюють у відділенні дисплазії, кожен кольпоскопіст повинен провести щонайменше 100 кольпоскопій. Існує також мінімум 30 дисплазій/карцином (консультативна практика з гінекологічної дисплазії) і 150 дисплазій/карцином (відділення дисплазії) [9]. Ця система сертифікації забезпечує певний рівень якості в сертифікованих установах жіночої консультації та гінекологічних відділеннях. Наші дані підтверджують цей рівень необхідних випадків і підкреслюють потребу в кваліфікованому персоналі.
Нова організована програма скринінгу була впроваджена в Німеччині в січні 2020 року [13]. Жінки у віці від 20 до 34 років продовжують щорічно здавати мазок Папаніколау, тоді як жінки старше 34 років отримують ко-тест, що включає мазок Папаніколау в поєднанні з тестом на врВПЛ кожні 3 роки. Всі жінки у віці 20-65 років запрошуються на тестування постачальниками медичних послуг кожні 5 років [13,31–36]. Тому ми дослідили відмінності між двома різними віковими групами. Рівень конкордації був вищим для CIN I/LSIL, CIN II/III/HSIL і AIS (46,2%, 80,5% і 72,7% відповідно) у жінок віком до 35 років порівняно зі старшою віковою групою (40,9%, 67,3% і 45% відповідно). Це може бути пов’язано з тим, що ці жінки перебувають у репродуктивному віці і мають більшу ймовірність мати TZ1 або TZ2. У молодшій віковій групі 278 з 2327 мали TZ3 (11,9%), а в старшій віковій групі 1073 з 2451 мали TZ3 (43,8%). Це може пояснити нижчий показник конкордантності у старшій віковій групі. Для карцином частота конкордації була вищою у старшій віковій групі (34% проти 62,4%) ( 9 and 10). Одним з можливих пояснень може бути той факт, що середній вік захворювання на рак шийки матки в Німеччині становить 55 років, тому експерти не очікували виявлення карциноми; 60% карцином були запідозрені як великі ураження [37]. Ретельне обстеження також необхідне для молодих жінок, щоб виключити рак шийки матки.
Сильні сторони та обмеження
Це дослідження включає велику групу жінок, які діагностувались у сертифікованому гінекологічному відділенні. Це ретельно відібрана група пацієнток, більшість з яких були направлені у відділення дисплазії через підозрілі результати цитологічного дослідження. Дослідження обмежене упередженістю, притаманною будь-якому ретроспективному дослідженню. Всі жінки з нормальними результатами кольпоскопії, яким не проводили біопсію, були виключені з дослідження. Це дозволило виключити потенційні хибнонегативні результати кольпоскопії. Кольпоскопічні висновки ґрунтуються на огляді, а не на статичних зображеннях, як це було в інших дослідженнях. Цитологічні та гістологічні результати були проаналізовані в тому ж відділенні, в деяких випадках одним і тим же експертом. Цитологи були знайомі з кольпоскопічною картиною і тому знали, чи є підозріле ураження. Це могло вплинути на результати. Не було жодної інформації щодо статусу вакцинації проти ВПЛ у жінок, які були направлені на обстеження. Команда, яка лікує жінок, порівняно невелика, а лікарі вузько спеціалізуються на лікуванні HSIL і раку шийки матки.
Висновки
Кольпоскопія є наріжним каменем у виявленні дисплазії та раку шийки матки. Це доступний та ефективний метод. Опубліковані дані щодо узгодженості, чутливості, специфічності, показників ПЦПР та ПЦНР кольпоскопії є суперечливими. У цьому дослідженні представлені дані з сертифікованого гінекологічного відділення з великою групою жінок. Показник узгодженості був найвищим для виявлення CIN III/HSIL. Майже половина карцином була недодіагностована. Рівень конкордації був найвищим для TZ1 і TZ2 і значно нижчим для TZ3. Щоб виконувати кольпоскопію на професійному рівні, кольпоскопіст повинен мати досвід роботи не менше 10 років. Молоді жінки повинні проходити ретельне обстеження, щоб гарантувати, що карциноми не будуть пропущені.
Посилання на джерела
1. Buskwofie, A.; David-West, G.; Clare, C.A. A Review of Cervical Cancer: Incidence and Disparities. J. Natl. Med. Assoc. 2020,
112, 229–232. [CrossRef]
2. Beckmann, M.W.; Stübs, F.A.; Koch, M.C.; Mallmann, P.; Dannecker, C.; Dietl, A.; Sevnina, A.; Mergel, F.; Lotz, L.; Hack, C.C.; et al. Diagnosis, Therapy and Follow-up of Cervical Cancer. Guideline of the DGGG, DKG and DKH (S3-Level, AWMF Registry
No. 032/033OL, May 2021)—Part 1 with Recommendations on Epidemiology, Screening, Diagnostics and Therapy. Geburtshilfe Frauenheilkd 2022, 82, 139–180. [CrossRef]
3. Fehm, T.; Stübs, F.A.; Koch, M.C.; Mallmann, P.; Dannecker, C.; Dietl, A.; Sevnina, A.; Mergel, F.; Lotz, L.; Ehret, A.; et al. Diagnosis, Therapy and Follow-up of Cervical Cancer. Guideline of the DGGG, DKG and DKH (S3-Level, AWMF Registry No. 032/033OL, May 2021)—Part 2 with Recommendations on Psycho-oncology, Rehabilitation, Follow-up, Recurrence, Palliative Therapy and Healthcare Facilities. Geburtshilfe Frauenheilkd 2022, 82, 181–205.
4. Beckmann, M.W.; Stuebs, F.A.; Vordermark, D.; Koch, M.C.; Horn, L.C.; Fehm, T. The Diagnosis, Treatment, and Aftercare of Cervical Carcinoma. Dtsch. Arztebl. Int. 2021, 118, 806–812.
5. Krebs_in_Deutschland_2027/2018. Available online: https://www.krebsdaten.de/Krebs/DE/Content/Publikationen/Krebs_ in_Deutschland/kid_2021/krebs_in_deutschland_2021.pdf? blob=publicationFile (accessed on 13 August 2022).
6. Stuebs, F.A.; Schulmeyer, C.E.; Mehlhorn, G.; Gass, P.; Kehl, S.; Renner, S.K.; Renner, S.P.; Geppert, C.; Adler, W.; Hartmann, A.; et al. Accuracy of colposcopy-directed biopsy in detecting early cervical neoplasia: A retrospective study. Arch. Gynecol. Obstet. 2019, 299, 525–532. [CrossRef]
7. Stuebs, F.A.; Gass, P.; Dietl, A.K.; Schulmeyer, C.E.; Adler, W.; Geppert, C.; Hartmann, A.; Knöll, A.; Beckmann, M.W.; Koch, M.C. Human papilloma virus genotype distribution in women with premalignant or malignant lesions of the uterine cervix. Arch. Gynecol. Obstet. 2021, 304, 751–758. [CrossRef]
8. Revathidevi, S.; Murugan, A.K.; Nakaoka, H.; Inoue, I.; Munirajan, A.K. APOBEC: A molecular driver in cervical cancer pathogenesis. Cancer Lett. 2021, 496, 104–116. [CrossRef]
9. Beckmann, M.W.; Quaas, J.; Bischofberger, A.; Kämmerle, A.; Lux, M.P.; Wesselmann, S. Establishment of the Certification System “Gynaecological Dysplasia” in Germany. Geburtshilfe Frauenheilkd 2014, 74, 860–867. [CrossRef]
10. Najib, F.S.; Hashemi, M.; Shiravani, Z.; Poordast, T.; Sharifi, S.; Askary, E. Diagnostic Accuracy of Cervical Pap Smear and Colposcopy in Detecting Premalignant and Malignant Lesions of Cervix. Indian J. Surg. Oncol. 2020, 11, 453–458. [CrossRef]
11. Schneider, V. Criticism of the Pap Smear as a Diagnostic Tool in Cervical Cancer Screening. Acta Cytol. 2017, 61, 338–344.
[CrossRef]
12. Nam, K. Colposcopy at a turning point. Obstet. Gynecol. Sci. 2018, 61, 1–6. [CrossRef]
13. Stuebs, F.A.; Koch, M.C.; Dietl, A.K.; Adler, W.; Geppert, C.; Hartmann, A.; Knöll, A.; Beckmann, M.W.; Mehlhorn, G.; Schulmeyer, C.E.; et al. Cytology and High-Risk Human Papillomavirus Test for Cervical Cancer Screening Assessment. Diagnostics 2022, 12, 1748. [CrossRef]
14. Baum, M.E.; Rader, J.S.; Gibb, R.K.; McAlister, R.P.; Powell, M.A.; Mutch, D.G.; Gao, F.; Wright, J.D. Colposcopic accuracy of obstetrics and gynecology residents. Gynecol. Oncol. 2006, 103, 966–970. [CrossRef]
15. Petousis, S.; Christidis, P.; Margioula-Siarkou, C.; Sparangis, N.; Athanasiadis, A.; Kalogiannidis, I. Discrepancy between colposcopy, punch biopsy and final histology of cone specimen: A prospective study. Arch. Gynecol. Obstet. 2018, 297, 1271–1275. [CrossRef]
16. Karimi-Zarchi, M.; Peighmbari, F.; Karimi, N.; Rohi, M.; Chiti, Z. A Comparison of 3 Ways of Conventional Pap Smear, Liquid- Based Cytology and Colposcopy vs Cervical Biopsy for Early Diagnosis of Premalignant Lesions or Cervical Cancer in Women with Abnormal Conventional Pap Test. Int. J. Biomed. Sci. 2013, 9, 205–210.
17. Olaniyan, O.B. Validity of colposcopy in the diagnosis of early cervical neoplasia—A review. Afr. J. Reprod. Health 2002, 6, 59–69.
[CrossRef]
18. Mousavi, A.S.; Fakour, F.; Gilani, M.M.; Behtash, N.; Ghaemmaghami, F.; Karimi Zarchi, M. A prospective study to evaluate the correlation between Reid colposcopic index impression and biopsy histology. J. Low Genit. Tract Dis. 2007, 11, 147–150. [CrossRef]
19. Arbyn, M.; Kyrgiou, M.; Simoens, C.; O Raifu, A.; Koliopoulos, G.; Martin-Hirsch, P.; Prendiville, W.; Paraskevaidis, E. Perinatal mortality and other severe adverse pregnancy outcomes associated with treatment of cervical intraepithelial neoplasia: Meta- analysis. BMJ 2008, 337, a1284. [CrossRef]
20. Kyrgiou, M.; Koliopoulos, G.; Martin-Hirsch, P.; Arbyn, M.; Prendiville, W.; Paraskevaidis, E. Obstetric outcomes after conserva- tive treatment for intraepithelial or early invasive cervical lesions: Systematic review and meta-analysis. Lancet 2006, 367, 489–498. [CrossRef]
21. Kyrgiou, M.; Athanasiou, A.; Kalliala, I.E.J.; Paraskevaidi, M.; Mitra, A.; Martin-Hirsch, P.P.; Arbyn, M.; Bennett, P.; Paraskevaidis, E. Obstetric outcomes after conservative treatment for cervical intraepithelial lesions and early invasive disease. Cochrane Database Syst. Rev. 2017, 11, Cd012847. [CrossRef]
22. Bornstein, J.; Bentley, J.; Bösze, P.; Girardi, F.; Haefner, H.; Menton, M.; Perrotta, M.; Prendiville, W.; Russell, P.; Sideri, M.; et al. 2011 colposcopic terminology of the International Federation for Cervical Pathology and Colposcopy. Obstet. Gynecol. 2012, 120, 166–172. [CrossRef] [PubMed]
23. Quaas, J.; Reich, O.; Kuppers, V. Explanation and Use of the Rio 2011 Colposcopy Nomenclature of the IFCPC (International Federation for Cervical Pathology and Colposcopy): Comments on the general colposcopic assessment of the uterine cervix: Adequate/inadequate; squamocolumnar junction; transformation zone. Geburtshilfe Frauenheilkd 2014, 74, 1090–1092. [PubMed]
24. Quaas, J.; Reich, O.; Tirri, B.F.; Küppers, V. Explanation and Use of the Colposcopy Terminology of the IFCPC (International Federation for Cervical Pathology and Colposcopy) Rio 2011. Geburtshilfe Frauenheilkd 2013, 73, 904–907. [CrossRef]
25. Loopik, D.L.; Doucette, S.; Bekkers, R.L.; Bentley, J.R. Regression and Progression Predictors of CIN2 in Women Younger than 25 Years. J. Low Genit. Tract Dis. 2016, 20, 213–217. [CrossRef]
26. Massad, L.S.; Collins, Y.C. Strength of correlations between colposcopic impression and biopsy histology. Gynecol. Oncol. 2003,
89, 424–428. [CrossRef]
27. Ruan, Y.; Liu, M.; Guo, J.; Zhao, J.; Niu, S.; Li, F. Evaluation of the accuracy of colposcopy in detecting high-grade squamous intraepithelial lesion and cervical cancer. Arch. Gynecol. Obstet. 2020, 302, 1529–1538. [CrossRef]
28. Mustafa, R.A.; Santesso, N.; Khatib, R.; Mustafa, A.A.; Wiercioch, W.; Kehar, R.; Gandhi, S.; Chen, Y.; Cheung, A.; Hopkins, J.; et al. Systematic reviews and meta-analyses of the accuracy of ВПЛ tests, visual inspection with acetic acid, cytology, and colposcopy. Int. J. Gynaecol. Obstet. 2016, 132, 259–265. [CrossRef]
29. Hopman, E.H.; Kenemans, P.; Helmerhorst, T.J. Positive predictive rate of colposcopic examination of the cervix uteri: An overview of literature. Obstet. Gynecol. Surv. 1998, 53, 97–106. [CrossRef]
30. Ferris, D.G.; Litaker, M.S. Colposcopy quality control by remote review of digitized colposcopic images. Am. J. Obstet. Gynecol.
2004, 191, 1934–1941. [CrossRef]
31. Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Krebsfrüherkennungs-Richtlinie und eine Änderung der Richtlinie für organisierte Krebsfrüherkennungsprogramme: Programm zur Früherkennung von Zervixkarzinomen 2018. Available online: https://www.g-ba.de/downloads/39-261-3597/2018-11-22_oKFE-RL_Zervixkarzinom.pdf (accessed on 22 November 2018).
32. Bujan Rivera, J.; Klug, S.J. Cervical cancer screening in Germany. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz
2018, 61, 1528–1535. [CrossRef]
33. Hillemanns, P.; Mallmann, P.; Beckmann, M.W. New Screening Proposals: The Federal Joint Commission Defines the Parameters for Cervical Cancer Screening from 2018: Statement of the Gynecology Oncology Working Group (AGO). Geburtshilfe Frauenheilkd 2016, 76, 145–146. [PubMed]
34. Hillemanns, P.; Friese, K.; Dannecker, C.; Klug, S.; Seifert, U.; Iftner, T.; Hädicke, J.; Löning, T.; Horn, L.; Schmidt, D.; et al. Prevention of Cervical Cancer: Guideline of the DGGG and the DKG (S3 Level, AWMF Register Number 015/027OL, December 2017)—Part 1 with Introduction, Screening and the Pathology of Cervical Dysplasia. Geburtshilfe Frauenheilkd 2019, 79, 148–159. [CrossRef] [PubMed]
35. Hillemanns, P.; Friese, K.; Dannecker, C.; Klug, S.; Seifert, U.; Iftner, T.; Hädicke, J.; Löning, T.; Horn, L.; Schmidt, D.; et al. Prevention of Cervical Cancer: Guideline of the DGGG and the DKG (S3 Level, AWMF Register Number 015/027OL, December 2017)—Part 2 on Triage, Treatment and Follow-up. Geburtshilfe Frauenheilkd 2019, 79, 160–176. [CrossRef] [PubMed]
36. Hillemanns, P.; Tempfer, C.; Beckmann, M.W.; Küppers, V.; Quaas, J. Statement of the AGO and AG-CPC on the Aftercare/Follow- up for Surgical Procedures of the Lower Genital Tract after the Introduction of a New Cancer Screening Guideline. Geburtshilfe Frauenheilkd 2020, 80, 809–812. [CrossRef]
37. Barnes, B.; Kraywinkel, K.; Nowossadeck, E.; Schönfeld, I.; Starker, A.; Wienecke, A.; Wolf, U. RKI-Bericht zum Krebsgeschehen in Deutschland 2016. 2016. Available online: https://www.krebsdaten.de/Krebs/DE/Content/Publikationen/Krebsgeschehen/ Kr-ebsgeschehe (accessed on 5 October 2022).