Резюме:
Предпосылки: Цель этого исследования – оценить уровень конкордации, чувствительности, специфичности, прогностической ценности положительного результата (ПЦПР) и прогностической ценности отрицательного результата (ПЦОР) кольпоскопии для выявления плоскоклеточных поражений и карцином высокой степени (HSIL+).
Методы: Мы провели ретроспективное исследование кольпоскопий, выполненных в сертифицированном отделении дисплазии в Эрлангене в период с января 2015 года по май 2022 года (7,5 лет). Результаты кольпоскопии соотносились с биопсиями, полученными во время обследований или хирургических вмешательств. Случаи без гистологии были исключены. Первичным результатом был показатель соответствия между кольпоскопическими и гистологическими данными в зависимости от типа зоны трансформации (TZ), уровня опыта эксперта и возраста пациенток.
Результаты: Проанализировано 4778 кольпоскопий у 4001 женщины. Показатели конкордантности для CIN I/LSIL, CIN II/HSIL, CIN III/HSIL и карциномы составили 43,4%, 59,5%, 78,5% и 53,9% соответственно. Показатель согласованности был самым низким для TZ3 и самым высоким для кольпоскопистов с опытом работы более 10 лет.
Выводы: Кольпоскопия является важным, целесообразным и эффективным методом. В тщательном обследовании нуждаются женщины с TZ3, старше 35 лет, поскольку они имеют самый высокий риск ошибочного диагноза. Самая высокая конкордантность выявления HSIL+ наблюдается у кольпоскопистов с опытом работы >10 лет.
Ключевые слова: цервикальная интраэпителиальная неоплазия; кольпоскопия; рак шейки матки; оценка скрининга рака шейки матки; оценка скрининга рака шейки матки.
Вступление
Рак шейки матки является одним из самых распространенных видов рака среди женщин во всем мире [1–4]. В 2018 году в мире было зарегистрировано примерно 570 000 случаев рака шейки матки и 311 000 смертей, а в Германии заболеваемость составляла 4320 женщин в 2018 году, 1612 из которых умерли от рака шейки матки [1, 5]. Во всем мире существуют географические различия. В последние десятилетия заболеваемость раком шейки матки снизилась в развитых странах, в основном благодаря общенациональным скрининговым программам [6]. Высокодифференцированные плоскоклеточные поражения (HSIL) и рак шейки матки вызваны персистирующей инфекцией вирусом папилломы человека (ВПЧ) [7]. Выявление HSIL играет решающую роль, поскольку HSIL может прогрессировать до рака шейки матки [8]. Подозрительные цитологические результаты, полученные во время скрининговых программ, во многих случаях являются одними из первых признаков HSIL или инвазивного рака; женщин с аномальной цитологией направляют в сертифицированные отделения дисплазии или гинекологические центры [6, 9]. Эти отделения дисплазии и гинекологические центры сертифицированы Немецким онкологическим обществом (Deutsche Krebsge- sellschaft e. V. [DKG]), Рабочей группой по гинекологической онкологии (Arbeitsgemeinschaft Gynäkologische Onkologie e. V. [AGO]), Рабочей группой по патологии шейки матки и кольпоскопии (Arbeitsgemeinschaft Zervixpathologie & Kolposkopie [AG-CPC]) и Немецким обществом гинекологии и акушерства (Deutsche Gesellschaft für Gynäkologie und Geburtshilfe e. V. [DGGG]) [9].
Цитология является самым доступным, целесообразным и эффективным инструментом для скрининга HSIL и инвазивного рака [10, 11]. Существует значительная дискуссия относительно точности мазков Папаниколау, которая, как сообщается, колеблется между 53% и 78% [10]. Сочетание кольпоскопии, цитологии и биопсии под контролем кольпоскопии является золотым стандартом для диагностики HSIL и рака шейки матки [6, 12, 13]. Несмотря на высокую эффективность скрининга рака шейки матки, лечение HSIL является проблемой общественного здравоохранения [14].
Кольпоскопия является самым простым и эффективным обследованием первого этапа для точной диагностики HSIL у женщин, которых направляют на обследование из-за аномалий цитологического исследования [15]. Кольпоскопия позволяет врачу локализовать потенциальные поражения, оценить степень их тяжести и получить кольпоскопически направленную биопсию [15]. Сообщается, что кольпоскопия имеет лучшую эффективность в выявлении HSIL по сравнению с обычными мазками Папаниколау и мазками на жидкостной основе [16]. Кольпоскопия лучше дифференцирует HSIL от низкодифференцированных плоскоклеточных поражений (LSIL), чем дифференцирует LSIL от нормальной шейки матки [17]. Тем не менее, кольпоскопия остается предметом клинического интереса [15]. Сообщается о широком диапазоне чувствительности и специфичности в выявлении HSIL, что составляет 30-90% и 44-97% соответственно [15–17]. Сообщается, что до 30% HSIL могут быть пропущены только с помощью кольпоскопии [18]. Чтобы не пропустить HSIL или рак шейки матки, необходима биопсия, направленная кольпоскопией, которая является инвазивной процедурой, связанной с определенными осложнениями, включая боль, кровотечение и фиброз [10]. Также важно избегать чрезмерного лечения HSIL, например, большой петлевой эксцизии зоны трансформации (LLETZ) или процедур петлевой электрохирургической эксцизии (LEEP) с лазерной коагуляцией периферии. Необходимо избегать заболеваемости, связанной с этой процедурой, такой как перинатальная смертность (относительный риск 2,87), преждевременные роды (<32/34 недель; относительный риск 2,59-2,78) или низкая масса тела при рождении (<2000 г; относительный риск 2,53-2,86) [6,19–21].
Існують можливі пояснення широкого діапазону показників чутливості та специфічності кольпоскопії, такі як рівень досвіду кольпоскопістів, тип зони трансформації та вік пацієнток. Метою даного дослідження було визначити конкордантність кольпоскопії в порівнянні з остаточним гістологічним діагнозом, отриманим за допомогою LLETZ, LEEP або лазерної конізації. Существуют возможные объяснения широкого диапазона показателей чувствительности и специфичности кольпоскопии, такие как уровень опыта кольпоскопистов, тип зоны трансформации и возраст пациенток. Целью данного исследования было определить конкордантность кольпоскопии по сравнению с окончательным гистологическим диагнозом, полученным с помощью LLETZ, LEEP или лазерной конизации.
Материалы и методы
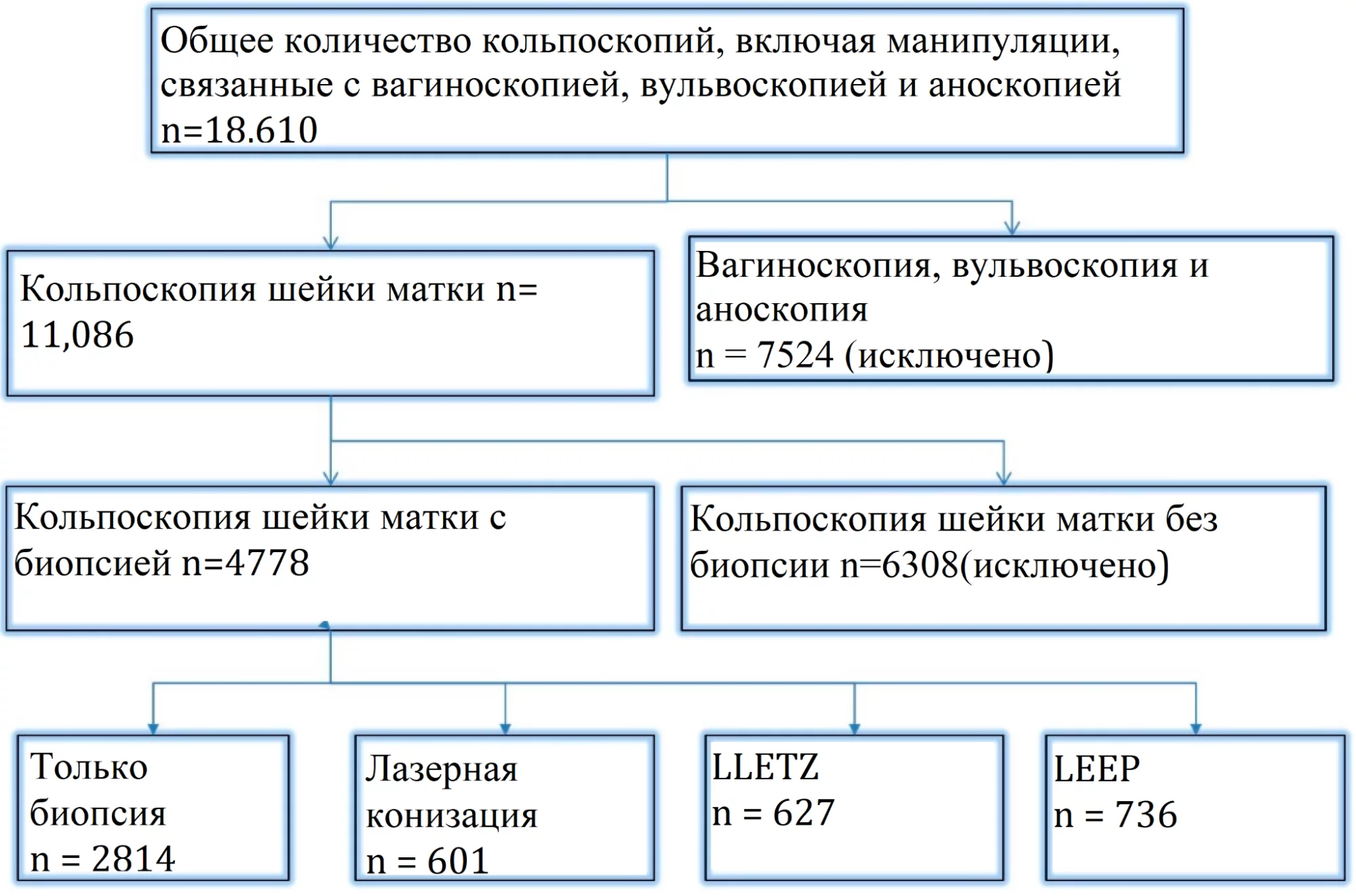
С января 2015 года по май 2022 года в государственном сертифицированном отделении дисплазии Университетской клиники Эрлангена было проведено 11 086 кольпоскопий шейки матки (Рис. 1). Абсолютно нормальная цитология шейки матки была самой распространенной причиной направления женщин в отделение дисплазии. Все пациентки (n = 4778), которым была проведена биопсия или эксцизионное хирургическое лечение – LLETZ, петлевая электрохирургическая эксцизия (LEEP) с лазерной коагуляцией периферийных отделов шейки матки или лазерная коагуляция периферии или лазерная коагуляция – были включены. Пациентки, у которых абляция была выполнена без взятия биопсии во время кольпоскопического исследования, были исключены из анализа из-за отсутствия гистологических результатов. Были включены только женщины с адекватной кольпоскопией.
Рисунок 1. Вовлечение и исключение пациентов
В нашем отделении кольпоскопия проводится в стандартизированных условиях с помощью кольпоскопа Zeiss KSK 150 FC. Общая оценка проводилась в соответствии с кольпоскопической терминологией шейки матки Международной федерации патологии шейки матки и кольпоскопии (IFCPC) 2011 года: “адекватный” или “неадекватный” по причине (например, воспаление, кровотечение, рубец); видимость сквамоколонного соединения (полностью видимый, частично видимый, не видимый); и зона трансформации (TZ) типов 1, 2 или 3 [22–24]. Стандартный мазок из шейки матки, тест на вирус папилломы человека (гибридный тест захвата 2, 2015-2018 гг.; анализ ВПЧ высокого риска Abbott RealTime на Abbott m2000sp, 2019-2020 гг.; или Roche, cobas®4800, HPV Test, Multiplex-RT-PCR, с 2020 г.) и нанесение 5% уксусной кислоты на шейку матки является стандартом лечения в нашем отделении. Эту процедуру проводят каждой женщине, которая обратилась с патологическим цитологическим исследованием. Кроме того, для более детального обследования шейки матки и влагалища в некоторых случаях применяют раствор Люголя, чтобы визуализировать предраковые поражения во влагалище, которые ранее не были заметны.
Результаты кольпоскопии классифицируются в соответствии с IFCPC на “нормальные” и “аномальные”, а также делятся на “незначительные”, “значительные” и “подозрительные на инвазию/рак”. Также различают “неспецифические” и “разные” результаты. К нормальным находкам относятся, например, плоский эпителий, столбчатый эпителий или метапластический плоский эпителий. Незначительные изменения состоят из мелкой пунктирности и мозаичности, тонкого уксусно-белого эпителия, а также неровных и географических границ. Острые границы, признак внутренней границы, признак гребня, плотный уксусно-белый эпителий, грубый мозаичный рисунок и грубая пунктировка являются типичными крупными поражениями. Атипичные сосуды, хрупкие сосуды, неровная поверхность, экзофитные поражения, некроз и язвы являются подозрительными в отношении инвазии. Различные находки представлены кондиломами, полипами или воспалением, а неспецифические поражения – лейкоплакией или эрозиями [22]. В этом исследовании выводы “незлокачественные”, “различные” и “неспецифические” касались доброкачественной гистологии, поскольку эти выводы являются доброкачественными. Кондиломы рассматривались как доброкачественная гистология, хотя некоторые патологоанатомы рассматривают их как цервикальную интраэпителиальную неоплазию I степени (CIN I). Если есть большая находка или поражение, подозрительное на инвазию, необходимо провести биопсию под контролем кольпоскопии из наиболее подозрительной части поражения, используя биопсийные щипцы (биопсийные щипцы Seidl ER076R; Aesculap AG, Тутлинген, Германия). У некоторых пациентов с мультифокальным поражением необходима более чем одна биопсия. Решение о хирургическом лечении основывается на результатах кольпоскопии, типах TZ, возрасте женщины на момент постановки диагноза, результатах цитологического исследования, тестирования на ВПЧ и гистологических данных. В некоторых пограничных случаях (например, метаплазия или порционная эктопия) для исключения неопластических поражений проводится биопсия, даже если врачи ожидают, что результаты будут нормальными.
Во время проведения ретроспективного анализа в отделении дисплазии работало 11 кольпоскопистов с разным уровнем клинического опыта и подготовки. Они были разделены на три группы: с опытом работы от 0 до 5 лет, от 5 до 10 лет и более 10 лет.
Все данные, включая результаты кольпоскопии, мазок Папаниколау и ВПЧ, гистологические результаты, количество биопсий, тип зоны трансформации и эпидемиологические результаты, были проспективно занесены в базу данных для дальнейшего исследования.
В случае, если гистологические результаты биопсии отличались от результата операции, для сравнения брали самый тяжелый гистологический результат. Коэффициент конкордации – это процент пациенток с одинаковыми кольпоскопическими находками и более тяжелой гистологией: нормальные, различные и неспецифические кольпоскопические находки эквивалентны доброкачественной гистологии, незначительные находки – CIN I, большие находки – CIN II / CIN III / аденокарцинома in situ (AIS), а подозрение на инвазию коррелирует с инвазивным раком. Чрезмерной диагностикой считалось, если результаты кольпоскопии подозревали более распространенное поражение, чем показал гистологический результат, а недостаточной диагностикой считалось, если окончательная гистология показала более распространенное поражение, чем результаты кольпоскопии.
Женщин с нормальными или незначительными изменениями направляли на регулярные контрольные обследования. Если биопсия выявляла HSIL, принималось решение в пользу хирургического вмешательства. В зависимости от размера поражения, TZ и возраста пациентки были возможны различные типы конизации. Женщинам в постменопаузе, с внутришейковыми поражениями или с зоной трансформации 3-го типа выполняли LLETZ. Женщины в возрасте до 25 лет с диагнозом HSIL были отобраны для наблюдения из-за высоких шансов регрессии [25]. Этим женщинам было назначено усиленное диспансерное наблюдение с цитологическим и кольпоскопическим исследованием. Хирургическое эксцизионное лечение проводили, если HSIL персистировал или была подтверждена инвазия. В этих случаях выполняли LEEP с лазерной коагуляцией периферии или лазерной конизацией. LEEP также выполняется у женщин репродуктивного возраста с TZ1 или экстрацервикальными поражениями. Женщинам репродуктивного возраста с TZ3, интрацервикальными поражениями или подозрением на микроинвазию проводили лазерную конизацию. Женщинам с AIS проводили лазерную конизацию из-за высокого риска инвазии. У женщин, у которых биопсия, проведенная с помощью кольпоскопии, исключила инвазию, дисплазия была видна полностью, а также при TZ1, абляционное лазерное лечение было вариантом, чтобы минимизировать повреждения, нанесенные шейке матки. Все операции были выполнены опытным и высококвалифицированным персоналом в Университетской больнице Эрлангена [6].
Статистический анализ
Чтобы исследовать согласованность между результатами кольпоскопии и гистологии, мы сначала рассчитали ранговую корреляцию Спирмена. Затем мы рассчитали чрезмерную диагностику (результаты хуже гистологии), уровень конкордации и недостаточную диагностику (гистология хуже результатов) для следующих четырех категорий: (1) норма/различные/неспецифические; (2) незначительные; (3) большие; и (4) подозрительные на рак. Кроме того, мы сформировали следующие две группы: группа 1 (норма/различные/неспецифические, незначительные) и группа 2 (большие, подозрительные на рак). Для этих групп мы рассчитали чувствительность, специфичность, положительные и отрицательные прогностические значения и соответствующие 95% доверительные интервалы. Этот анализ был проведен для общих данных и повторен для подгрупп, определенных по уровню кольпоскопического опыта (0-5, 5-10, >10 лет), TZ (1, 2, 3) и возрасту (<35 лет и 35 лет). Согласованность между кольпоскопией и гистологией оценивали в трех моделях логистической регрессии, где согласованность (да/нет) была зависимой переменной, а результаты кольпоскопии (критерий: большие поражения), ТЗ (критерий: ТЗ1) и стаж (критерий: более 10 лет), соответственно, независимыми переменными. Все статистические анализы проводились с помощью статистической программы R V4.2.0 (R Core Team (2022). R: Язык и среда для статистических вычислений. R Foundation for Statistical Computing, Вена, Австрия).
Результаты
Всего за период проведения этого ретроспективного исследования было выполнено 11 086 кольпоскопий. В 6308 случаях гистологическое исследование во время кольпоскопии или хирургическое вмешательство после кольпоскопии не было необходимым. Таким образом, всего было проведено 4778 кольпоскопий с гистологическим исследованием у 4001 женщины. Лазерная конизация была проведена в 601 случае, LLETZ – в 627 случаях, а LEEP – у 736 женщин (см. рис.1)
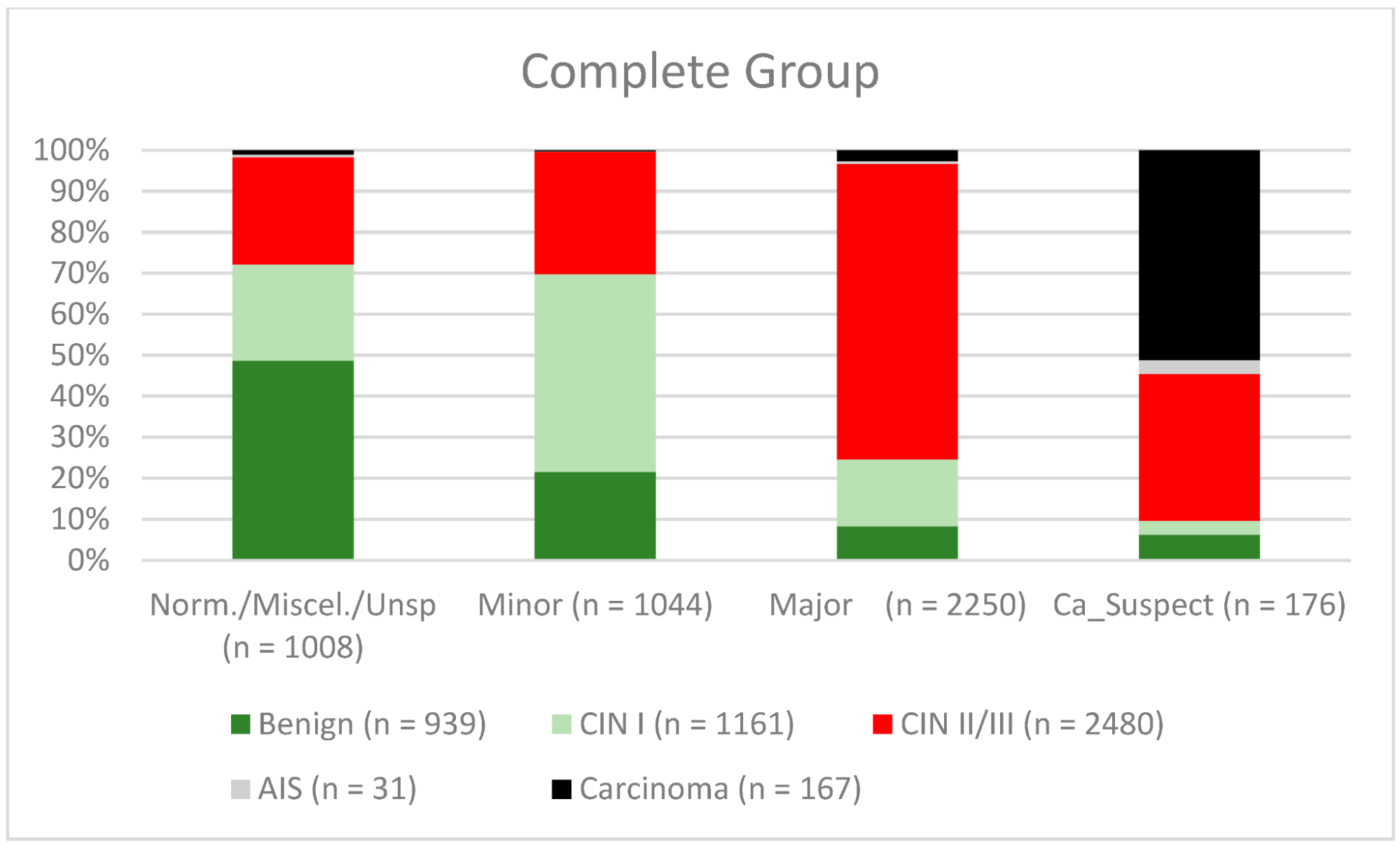
Средний возраст женщин, включенных в исследование, на момент проведения кольпоскопии составлял 36,8 лет (стандартное отклонение 10,8 лет). Результаты кольпоскопии были “нормальными/различными/неспецифическими” в 1008 случаях, “малыми” в 1044 случаях, “большими” в 2550 случаях и “подозрительными на рак” в 176 случаях. Самым тяжелым гистологическим диагнозом был “доброкачественный” в 939 случаях, “CIN I” в 1161 случае, “CIN II/CIN III” в 2480 случаях, аденокарцинома in situ (“AIS”) в 31 случае и “карцинома” в 167 случаях. Нормальные/различные результаты/неспецифические результаты имели показатель конкордации 52,3% (491/939). Доброкачественные новообразования были диагностированы в 47,7% случаев (448/939). Показатель конкордантности для незначительных поражений составил 48,3% (504/1161). Показатели недодиагностики для CIN I/LSIL и CIN II/CIN III/HSIL составляли 20,3% (236/1161) и 23,2% (576/2480), соответственно. Частота гипердиагностики для CIN I/LSIL; CIN II/CIN III/HSIL составляла 36,3% (421/1161) и 2,5% (63/2480) соответственно. Уровень конкордантности для крупных поражений составил 74% (CIN II/HSIL; CIN III/HSIL, AIS) (1858/2511). Кольпоскопические результаты “подозрения на карциному” были правильными в 51,1% случаев. В 46,1% (77/167) карцинома была диагностирована ошибочно (см. таблицу 1 и рисунок 2). Общая чувствительность, специфичность, положительная прогностическая ценность (ПЦПР) и отрицательная прогностическая ценность (ОЦОР) для диагностической дифференциации двух групп – нормальных/различных/неспецифических/небольших и больших/подозрительных на рак – были следующими: 77,8% (95% ДИ, от 76,12% до 79,31%), 69,3% (95% ДИ, от 67,31% до 71,30%), 76,4% (95% ДИ, от 74,74% до 77,96%) и 71% (95% ДИ, от 68,94% до 72,91%) (для подгрупп см. Таблицу 2).
Таблица 1. Выводы по сравнению с биопсией (все пациенты).
|
Результат/Биопсия |
Доброкачественный (n = 939) |
CIN I |
CIN II/III |
AIS |
Карцинома |
|
(p < 0.001) |
(p < 0.001) |
Референтное значение |
(p < 0.001) |
||
|
Нормальные/разные/неспецифические (n = 1008) |
491 (52.3%) |
236 (20.3%) |
264 (10.6%) |
7 (22.6%) |
10 (6%) |
|
Малый (n = 1044) |
225 (24%) |
504 (43.4%) |
312 (12.6%) |
1 (3.2%) |
2 (1.2%) |
|
Большой (n = 2550) |
212 (22.6%) |
415 (35.7%) |
1841 (74.2%) |
17 (54.8%) |
65 (38.9%) |
|
Подозрение на рак (n = 176) |
11 (1.2%) |
6 (0.5%) |
63 (2.5%) |
6 (19.4%) |
90 (53.9%) |
Рисунок 2. Выводы по сравнению с биопсией (все пациентки) (CIN, цервикальная интраэпителиальная неоплазия; AIS, аденокарцинома in situ).
Примечания к таблице: Norm/miscel/unsp – нормальный/разный/неспецифический; minor – малый; major – большой; Ca_Suspect – подозрение на карциному; Benign – доброкачественный.
Таблица 2. Чувствительность, специфичность, положительная прогностическая ценность (ПЦПР) и отрицательная прогностическая ценность (ПЦОР) для различных подмножеств (TZ, зона трансформации; CI, доверительный интервал).
|
|
Чувствительность(95 CI) |
Специфичность (95 CI) |
ПЦПР (95 CI) |
ПЦОР (95 CI) |
|
Вся група |
77.8% (76.12–79.31%) |
69.3% (67.31–71.30%) |
76.4% (74.74–77.96%) |
71.0% (68.94–72.91%) |
|
TZ1 |
80.1% (77.66–82.33) |
65.7% (62.47–68.9) |
75.9% (73.4–78.26) |
71.0% (67.72–74.12) |
|
TZ2 |
82.4% (79.7–84.93) |
64.4% (60.27–68.43) |
78.1% (75.25–80.77) |
70.4% (66.24–74.39) |
|
TZ3 |
67.7% (64.02–71.26) |
77.8% (74.51–80.87) |
74.8% (71.13–78.21) |
71.3% (67.87–74.48) |
|
Экзаменатор 0–5 |
73.5% (70.86–76.03) |
68.6% (65.87–71.17) |
69.0% (66.36–71.6) |
73.1% (70.41–75.65) |
|
Экзаменатор 5–10 |
70.2% (65.89–74.24) |
77.1% (72.62–81.2) |
79.2% (75.05–82.95) |
67.6% (62.99–71.9) |
|
Экзаменатор >10 |
86.0% (83.77–88.08) |
65.1% (60.77–69.31) |
83.7% (81.34–85.86) |
69.2% (64.76–73.3) |
|
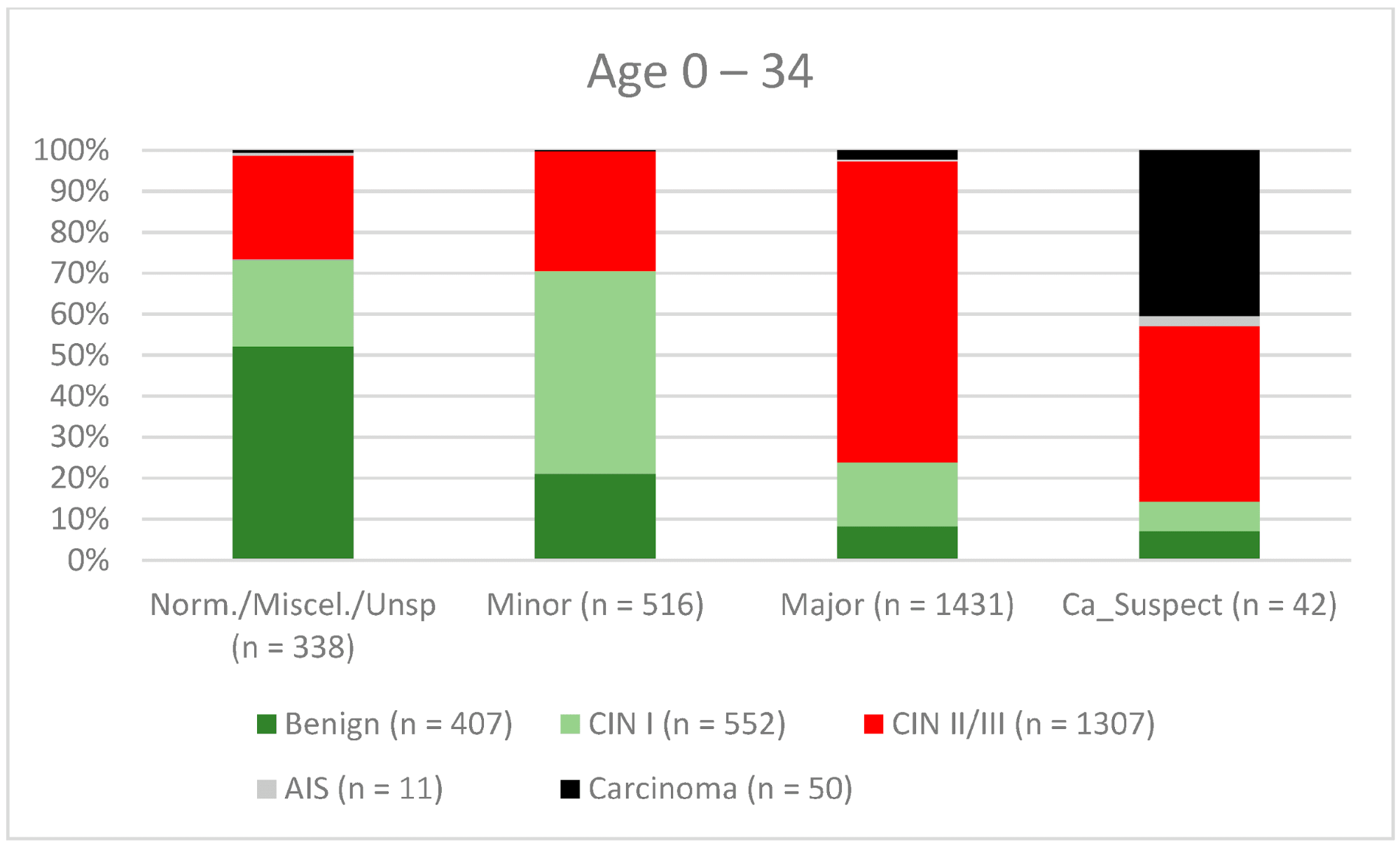
Возраст 0–34 |
82.3% (80.18–84.3) |
63.8% (60.68–66.86) |
76.4% (74.19–78.59) |
71.7% (68.51–74.66) |
|
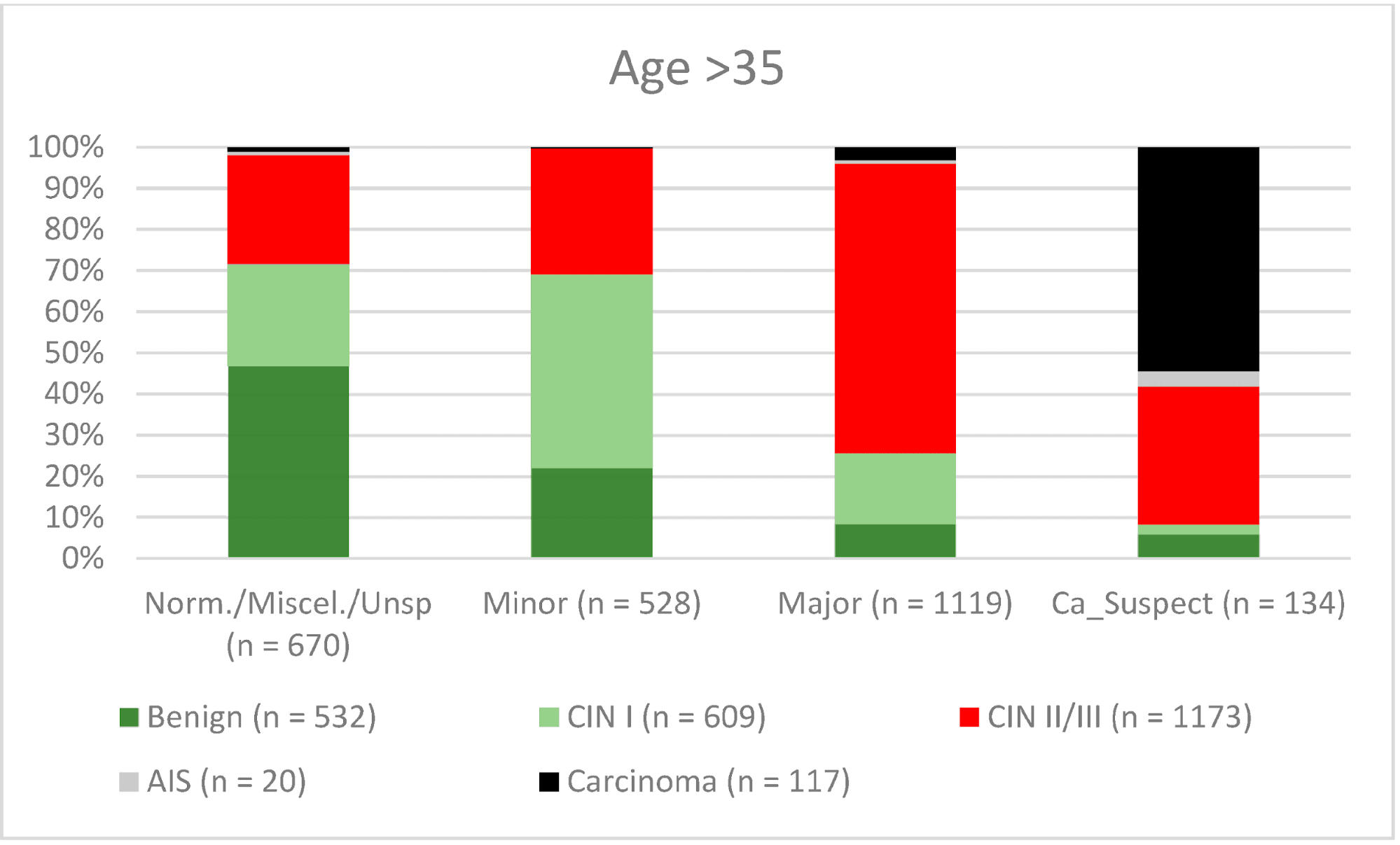
Возраст >35 |
73.0% (70.48–75.37) |
74.0% (71.32–76.5) |
76.3% (73.84–78.63) |
70.5% (67.78–73.02) |
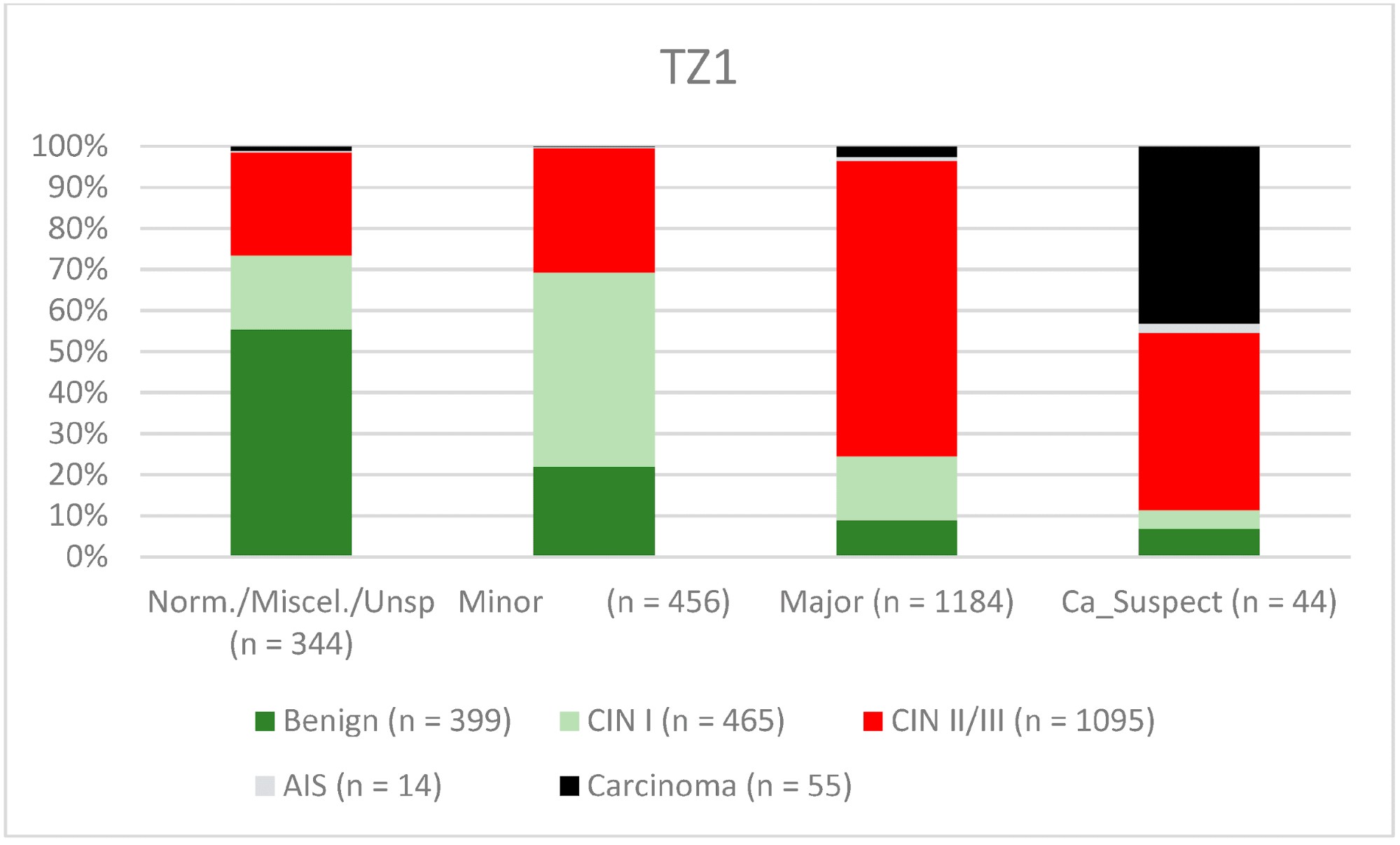
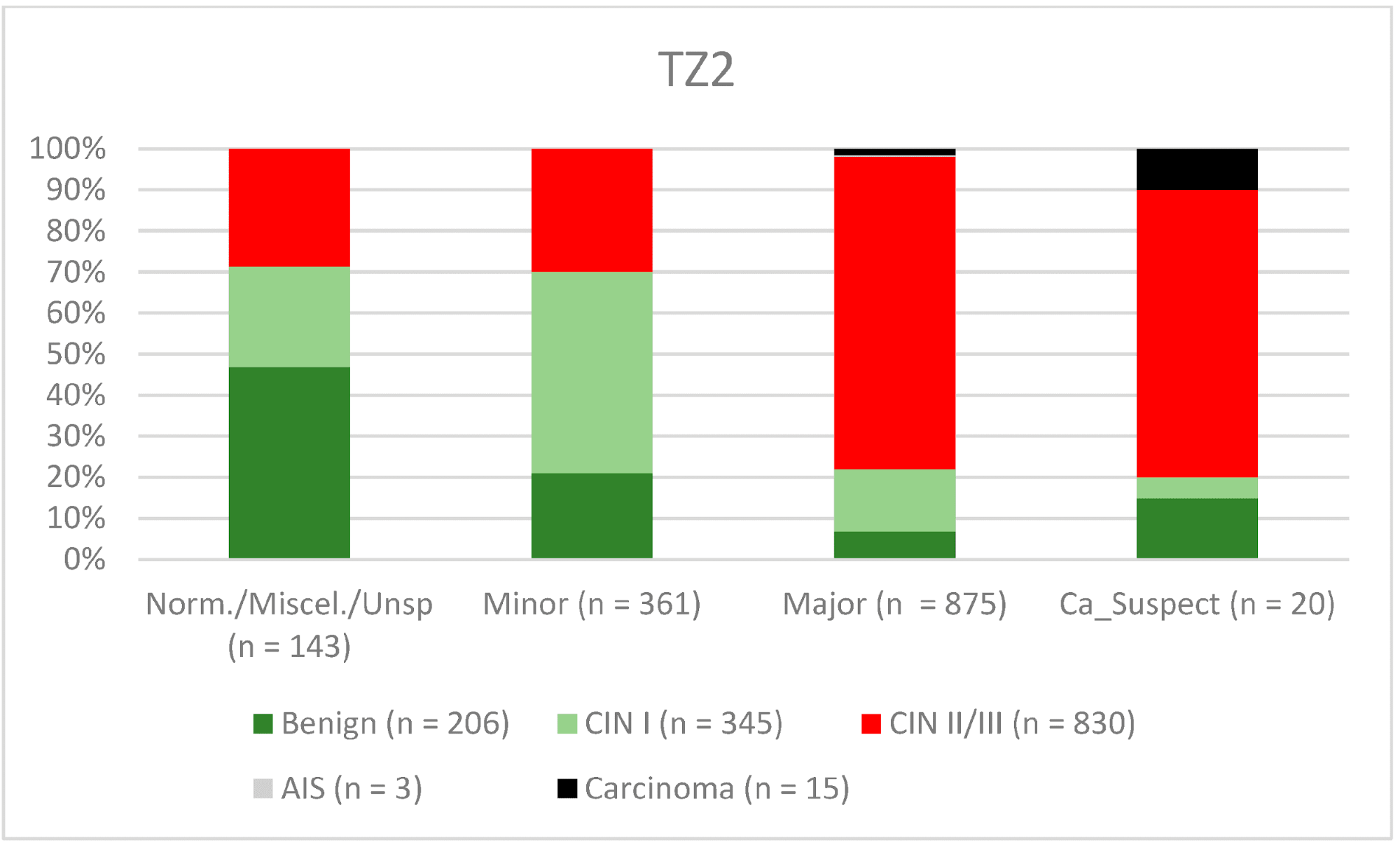
В целом 2028 женщин имели зону трансформации 1-го типа (TZ1) на момент проведения кольпоскопии; 1399 и 1351 женщина имели зоны трансформации 2-го типа (TZ2) или 3-го типа (TZ3), соответственно. Уровень согласованности основных результатов составил 72,8% (862/1184) для TZ1, 76,6% (670/875) для TZ2 и 66,4% (326/491) для TZ3. CIN II/III/HSIL был правильно диагностирован как основной диагноз у 77,8% для TZ1 (852/1095) и для TZ3 у 58% (322/555) (см. Рис. 3–5). Логистическая регрессионная модель показала, что разница между TZ1 и TZ2 не была статистически значимой (p = 0,053), тогда как разница между TZ1 и TZ3 была значимой (p = 0,009). Уровень согласованности основных выводов в группе экспертов с опытом работы от 0 до 5 лет составил 65,9% (779/1182); в группе с опытом работы от 5 до 10 лет – 76% (308/405); а для экспертов с опытом работы более 10 лет – 80,1% (771/963). Разница между опытом работы более 10 лет и 0-5 лет была статистически значимой (p < 0,001), но не было значимой разницы между опытом работы 5-10 лет и более 10 лет (p = 0,097). CIN II/III/HSIL был правильно диагностирован как обширное поражение в 71,3% (769/1078) случаев экспертами с опытом работы 0-5 лет и в 80,6% случаев (767/952) группой экспертов с опытом работы более 10 лет (см. Рис. 6–8). Частота конкордации для карциномы возрастала вместе с уровнем опыта экспертов. Для женщин в возрасте до 35 лет уровень конкордации основных выводов составил 74,1% (1060/1431), а для женщин старше 35 лет – 71,3% (798/1119) (см. Рис. 9 и 10).
Рисунок 3. Выводы по сравнению с гистологией (зона трансформации 1 типа) (CIN, цервикальная интраэпителиальная неоплазия; AIS, аденокарцинома in situ).
Примечания к таблице: Norm/miscel/unsp – нормальный/разный/неспецифический; minor – малый; major – большой; Ca_Suspect – подозрение на карциному; Benign – доброкачественный.
Рисунок 4. Выводы по сравнению с гистологией (зона трансформации 2 типа) (CIN, цервикальная интраэпителиальная неоплазия; AIS, аденокарцинома in situ).
Примечания к таблице: Norm/miscel/unsp – нормальный/разный/неспецифический; minor – малый; major – большой; Ca_Suspect – подозрение на карциному; Benign – доброкачественный.
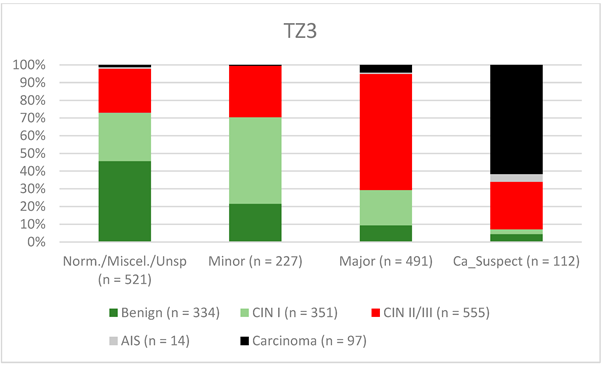
Рисунок 5. Выводы по сравнению с гистологией (зона трансформации 3 типа) (CIN, цервикальная интраэпителиальная неоплазия; AIS, аденокарцинома in situ).
Примечания к таблице: Norm/miscel/unsp – нормальный/разный/неспецифический; minor – малый; major – большой; Ca_Suspect – подозрение на карциному; Benign – доброкачественный.
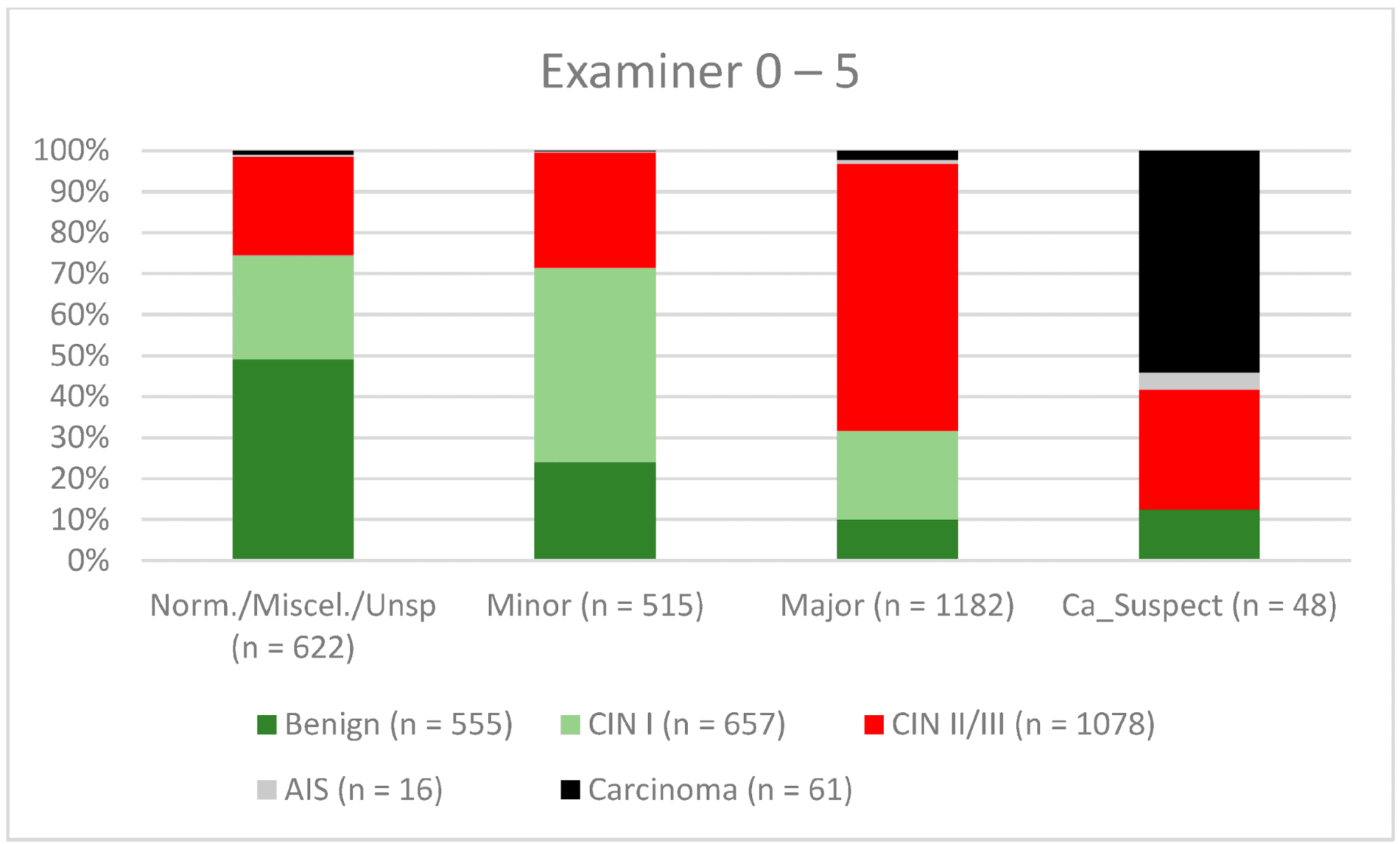
Рисунок 6. Выводы по сравнению с гистологией (эксперты с опытом работы 0-5 лет) (CIN, цервикальная интраэпителиальная неоплазия; AIS, аденокарцинома in situ).
Примечания к таблице: Norm/miscel/unsp – нормальный/разный/неспецифический; minor – малый; major – большой; Ca_Suspect – подозрение на карциному; Benign – доброкачественный.
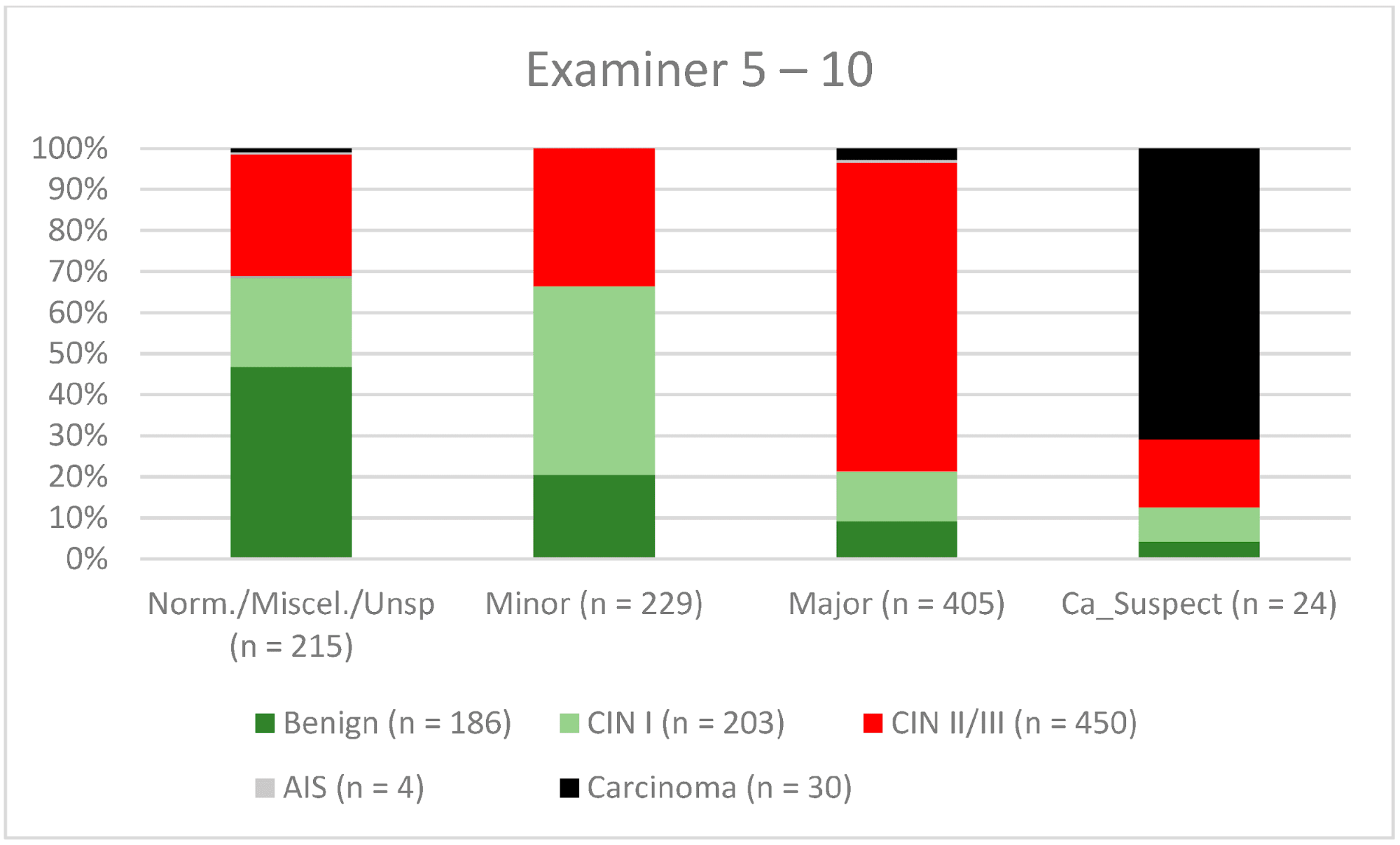
Рисунок 7. Выводы в сравнении с гистологией (эксперты с опытом работы 5-10 лет) (CIN, цервикальная интраэпителиальная неоплазия; AIS, аденокарцинома in situ).
Примечания к таблице: Norm/miscel/unsp – нормальный/разный/неспецифический; minor – малый; major – большой; Ca_Suspect – подозрение на карциному; Benign – доброкачественный.
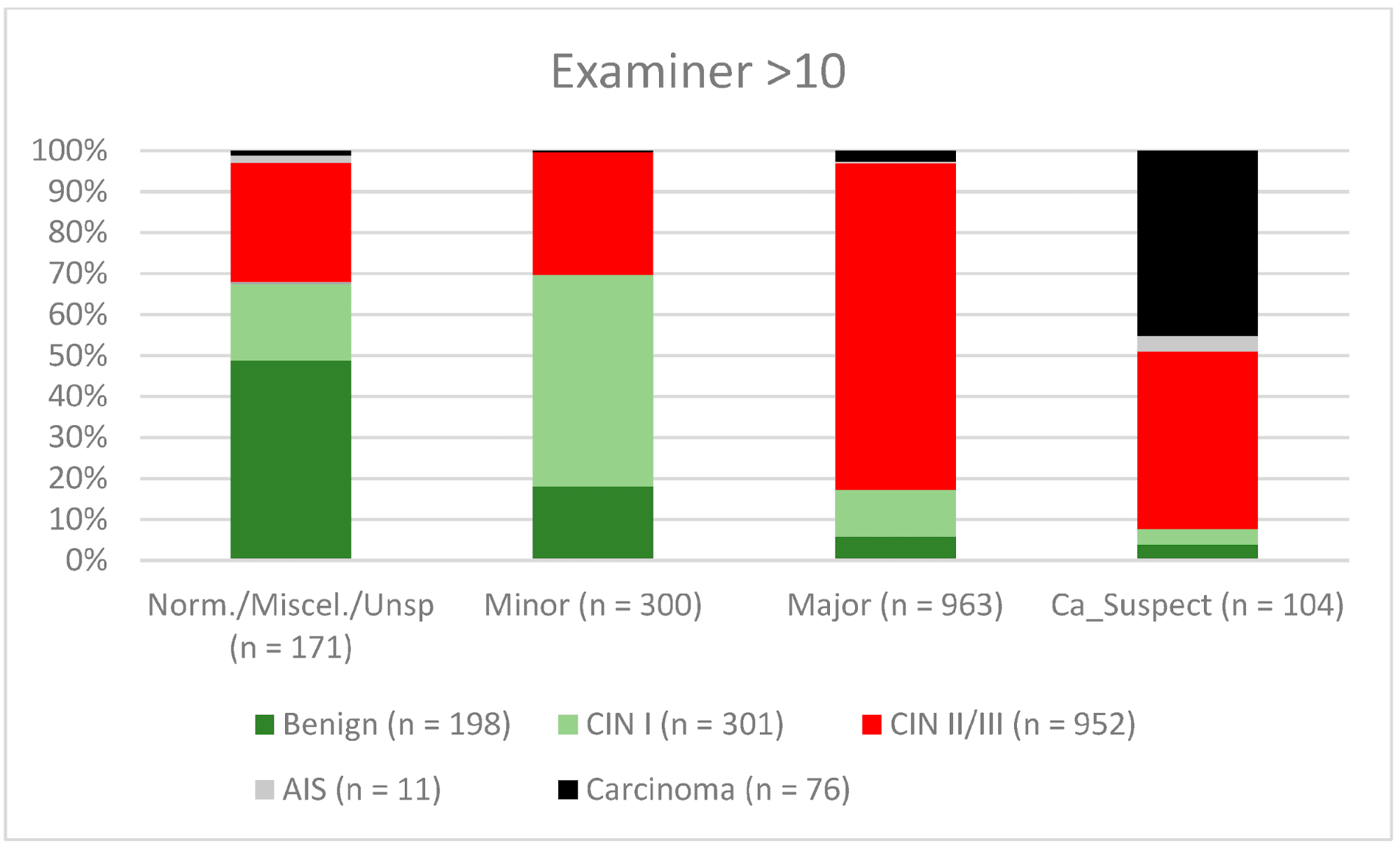
Рисунок 8. Выводы по сравнению с гистологией (эксперты с опытом работы >10 лет) (CIN, цервикальная интраэпителиальная неоплазия; AIS, аденокарцинома in situ).
Примечания к таблице: Norm/miscel/unsp – нормальный/разный/неспецифический; minor – малый; major – большой; Ca_Suspect – подозрение на карциному; Benign – доброкачественный.
Рисунок 9. Выводы по сравнению с гистологией (пациенты в возрасте 0-34 года) (CIN, цервикальная интраэпителиальная неоплазия; AIS, аденокарцинома in situ).
Примечания к таблице: Norm/miscel/unsp – нормальный/разный/неспецифический; minor – малый; major – большой; Ca_Suspect – подозрение на карциному; Benign – доброкачественный.
Рисунок 10.Выводы по сравнению с гистологией (пациенты в возрасте > 35 лет) (CIN, цервикальная интраэпителиальная неоплазия; AIS, аденокарцинома in situ).
Примечания к таблице: Norm/miscel/unsp – нормальный/разный/неспецифический; minor – малый; major – большой; Ca_Suspect – подозрение на карциному; Benign – доброкачественный.
Обсуждение
Это ретроспективное одноцентровое исследование включало 4778 кольпоскопий с гистологическим исследованием. Самыми распространенными кольпоскопическими находками были “большие” поражения. В 167 случаях эксперты считали поражение подозрительным на рак. Уровень согласованности для больших поражений составил 74,6%, а уровень согласованности для поражений, “подозрительных на рак”, – 51,1%. Для зон трансформации 3-го типа показатель конкордации был ниже. Показатель согласованности увеличивался вместе с уровнем опыта эксперта.
В литературе существует определенная противоречивость относительно недооценки и переоценки результатов кольпоскопических исследований. В одних исследованиях поражения шейки матки чаще недостаточно оцениваются, а в других – чрезмерно оцениваются [26, 27]. Частота чрезмерной диагностики (19,6%, 938/4778) и недостаточной диагностики (18,8%, 897/4778) была достаточно сбалансированной. В исследовании Ruan и соавт., включавшем 1828 женщин, почти половина HSILs и карцином была недодиагностирована [27]. В этом исследовании у 46,1% женщин карциномы были недостаточно оценены, но у 38,9% было диагностировано по меньшей мере HSIL, так что 85% из них получили хирургическое вмешательство после кольпоскопического обследования, и ни одна женщина не была пропущена.
В метаанализе, включавшем 11 исследований с 6370 участницами, чувствительность кольпоскопической импрессии колебалась от 0,29 до 1,00, а специфичность – от 0,12 до 0,88 [28] Чувствительность в двух других исследованиях составляла от 56,29% до 64,72%, а специфичность – от 52,74% до 93,82%. Показатели ПЦПР и ПЦОР составляли от 76,32% до 77,47% и от 85,04% до 95,41% соответственно [10,28]. В данном исследовании значения чувствительности и специфичности составляли 77,75% (95% ДИ, 76,12% – 79,31%) и 69,33% (95% ДИ, 67,31% – 71,30%) соответственно. Одним из возможных объяснений этого является то, что диагноз женщинам ставили высококвалифицированные работники, специализирующиеся на диагностике HSIL и карциномы шейки матки. Показатели ПЦПР (95% ДИ, 76,38%; диапазон от 74,74% до 77,96%) были сопоставимы с данными литературы, а показатели ПЦОР (95% ДИ, 70,96%; диапазон от 68,94% до 72,91%) были ниже.
Возможность проведения визуальной оценки шейки матки зависит от типа зоны трансформации. По определению, полная визуальная оценка шейки матки с зоной трансформации 3-го типа невозможна, и внутришейковые поражения могут быть пропущены [24]. Для TZ3 конкордантность была самой низкой для выявления CIN II/III/HSIL (58%). Незначительные поражения также реже выявляли у женщин с TZ3 (31,6%) (см. рис. 3–5). Ruan и соавт. утверждают, что TZ3 чаще всего встречался у женщин с нормальными показателями и низким риском, тогда как TZ1 и TZ2 чаще ассоциировались с HSIL и карциномой. Авторы рекомендуют уделять особое внимание TZ1 и TZ2 [27]. Мы не можем подтвердить эти данные. В данном исследовании большинство карцином были связаны с TZ3. При стадии IB и более крупных карциномах ТЗ чаще всего инфильтрированы опухолью, и поэтому ТЗ не может быть оценен полностью. Кроме того, не было выявлено различий между TZ2 и TZ3 в отношении распределения низко- и высокодифференцированных поражений в группе пациентов, включенных в это исследование.
Кольпоскопия является очень субъективным методом исследования, и согласованность результатов внутри и между наблюдателями может существенно отличаться даже среди опытных кольпоскопистов [14, 29, 30]. Удивительно, но в ретроспективном обзоре Baum и соавт. сообщают о самом высоком уровне согласованности результатов у врачей второго года обучения (77%), с более низкими показателями у врачей третьего года обучения (75%) и врачей четвертого года обучения (73%) [14]. Интересно, что показатель согласованности был самым высоким среди практикующих медицинских сестер (92%). Они выполняли большое количество кольпоскопий и видели своих пациентов во время наблюдения. Поэтому они получали хорошие отзывы о своей работе [14]. Для CIN II/III/HSIL мы также наблюдали незначительное снижение показателей конкордации для экспертов с опытом работы 0-5 лет и 5-10 лет (71,3% и 80,6% соответственно). Для карциномы наблюдался постоянный рост конкордантности для различных уровней опыта – 42,6%, 56,7% и 61,8% соответственно (см. Рис. 6–8). В нашем сертифицированном отделении дисплазии каждый врач выполняет 500-1000 кольпоскопий в год. Для того, чтобы достичь наилучшего показателя согласованности, врач-кольпоскопист должен провести не менее 5000-10 000 обследований и иметь опыт работы 10 лет или более. С 2014 года консультации по гинекологической дисплазии обязаны проводить не менее 100 задокументированных кольпоскопий в год, тогда как отделения гинекологической дисплазии в Германии требуют не менее 300 в год. Для кольпоскопистов, работающих в отделении дисплазии, каждый кольпоскопист должен провести не менее 100 кольпоскопий. Существует также минимум 30 дисплазий/карцином (консультативная практика по гинекологической дисплазии) и 150 дисплазий/карцином (отделение дисплазии) [9]. Эта система сертификации обеспечивает определенный уровень качества в сертифицированных учреждениях женской консультации и отделениях дисплазии. Наши данные подтверждают этот уровень необходимых случаев и подчеркивают потребность в квалифицированном персонале.
Новая организованная программа скрининга была внедрена в Германии в январе 2020 года [13]. Женщины в возрасте от 20 до 34 лет продолжают ежегодно сдавать мазок Папаниколау, тогда как женщины старше 34 лет получают ко-тест, включающий мазок Папаниколау в сочетании с тестом на ВПЧ каждые 3 года. Все женщины в возрасте 20-65 лет приглашаются на тестирование поставщиками медицинских услуг каждые 5 лет [13, 31–36]. Поэтому мы исследовали различия между двумя различными возрастными группами. Уровень конкордации был выше для CIN I/LSIL, CIN II/III/HSIL и AIS (46,2%, 80,5% и 72,7% соответственно) у женщин в возрасте до 35 лет по сравнению со старшей возрастной группой (40,9%, 67,3% и 45% соответственно). Это может быть связано с тем, что эти женщины находятся в репродуктивном возрасте и имеют большую вероятность иметь TZ1 или TZ2. В младшей возрастной группе 278 из 2327 имели TZ3 (11,9%), а в старшей возрастной группе 1073 из 2451 имели TZ3 (43,8%). Это может объяснить более низкий показатель конкордантности в старшей возрастной группе. В случае карцином процент совпадений был выше в старшей возрастной группе (34% против 62,4%) (см. Рисунок 9 и Рисунок 10). Одним из возможных объяснений может быть тот факт, что средний возраст для рака шейки матки в Германии составляет 55 лет, поэтому обследуемые не ожидали карциномы; 60% карцином были заподозрены как крупные поражения [37]. Тщательное обследование необходимо и для более молодых женщин, чтобы исключить рак шейки матки.
Сильные стороны и ограничения
Это исследование включает большую группу женщин, которые наблюдались в сертифицированном отделении дисплазии. Это тщательно отобранная группа пациенток, большинство из которых были направлены в отделение дисплазии из-за подозрительных результатов цитологического исследования. Исследование ограничено предвзятостью, присущей любому ретроспективному исследованию. Все женщины с нормальными результатами кольпоскопии, которым не проводили биопсию, были исключены из исследования. Это позволило исключить потенциальные ложноотрицательные результаты кольпоскопии. Кольпоскопические выводы основываются на осмотре, а не на статических изображениях, как это было в других исследованиях. Цитологические и гистологические результаты были проанализированы в том же отделении, в некоторых случаях одним и тем же экспертом. Цитологи были знакомы с кольпоскопической картиной и поэтому знали, есть ли подозрительное поражение. Это могло повлиять на результаты. Не было никакой информации о статусе вакцинации против ВПЧ у женщин, которые были направлены на обследование. Команда, которая лечит женщин, сравнительно небольшая, а врачи узко специализируются на лечении HSIL и рака шейки матки.
Заключение
Кольпоскопия является краеугольным камнем в выявлении дисплазии и рака шейки матки. Это доступный и эффективный метод. Опубликованные данные о согласованности, чувствительности, специфичности, показателей ПЦПР и ПЦОР кольпоскопии являются противоречивыми. В этом исследовании представлены данные из сертифицированного отделения дисплазии с большой группой женщин. Показатель согласованности был самым высоким для выявления CIN III/HSIL. Почти половина карцином была недодиагностирована. Уровень конкордации был самым высоким для TZ1 и TZ2 и значительно ниже для TZ3. Чтобы выполнять кольпоскопию на профессиональном уровне, кольпоскопист должен иметь опыт работы не менее 10 лет. Молодые женщины должны проходить тщательное обследование, чтобы гарантировать, что карциномы не будут пропущены.
Ссылки на источники
1. Buskwofie, A.; David-West, G.; Clare, C.A. A Review of Cervical Cancer: Incidence and Disparities. J. Natl. Med. Assoc. 2020,
112, 229–232. [CrossRef]
2. Beckmann, M.W.; Stübs, F.A.; Koch, M.C.; Mallmann, P.; Dannecker, C.; Dietl, A.; Sevnina, A.; Mergel, F.; Lotz, L.; Hack, C.C.; et al. Diagnosis, Therapy and Follow-up of Cervical Cancer. Guideline of the DGGG, DKG and DKH (S3-Level, AWMF Registry
No. 032/033OL, May 2021)—Part 1 with Recommendations on Epidemiology, Screening, Diagnostics and Therapy. Geburtshilfe Frauenheilkd 2022, 82, 139–180. [CrossRef]
3. Fehm, T.; Stübs, F.A.; Koch, M.C.; Mallmann, P.; Dannecker, C.; Dietl, A.; Sevnina, A.; Mergel, F.; Lotz, L.; Ehret, A.; et al. Diagnosis, Therapy and Follow-up of Cervical Cancer. Guideline of the DGGG, DKG and DKH (S3-Level, AWMF Registry No. 032/033OL, May 2021)—Part 2 with Recommendations on Psycho-oncology, Rehabilitation, Follow-up, Recurrence, Palliative Therapy and Healthcare Facilities. Geburtshilfe Frauenheilkd 2022, 82, 181–205.
4. Beckmann, M.W.; Stuebs, F.A.; Vordermark, D.; Koch, M.C.; Horn, L.C.; Fehm, T. The Diagnosis, Treatment, and Aftercare of Cervical Carcinoma. Dtsch. Arztebl. Int. 2021, 118, 806–812.
5. Krebs_in_Deutschland_2027/2018. Available online: https://www.krebsdaten.de/Krebs/DE/Content/Publikationen/Krebs_ in_Deutschland/kid_2021/krebs_in_deutschland_2021.pdf? blob=publicationFile (accessed on 13 August 2022).
6. Stuebs, F.A.; Schulmeyer, C.E.; Mehlhorn, G.; Gass, P.; Kehl, S.; Renner, S.K.; Renner, S.P.; Geppert, C.; Adler, W.; Hartmann, A.; et al. Accuracy of colposcopy-directed biopsy in detecting early cervical neoplasia: A retrospective study. Arch. Gynecol. Obstet. 2019, 299, 525–532. [CrossRef]
7. Stuebs, F.A.; Gass, P.; Dietl, A.K.; Schulmeyer, C.E.; Adler, W.; Geppert, C.; Hartmann, A.; Knöll, A.; Beckmann, M.W.; Koch, M.C. Human papilloma virus genotype distribution in women with premalignant or malignant lesions of the uterine cervix. Arch. Gynecol. Obstet. 2021, 304, 751–758. [CrossRef]
8. Revathidevi, S.; Murugan, A.K.; Nakaoka, H.; Inoue, I.; Munirajan, A.K. APOBEC: A molecular driver in cervical cancer pathogenesis. Cancer Lett. 2021, 496, 104–116. [CrossRef]
9. Beckmann, M.W.; Quaas, J.; Bischofberger, A.; Kämmerle, A.; Lux, M.P.; Wesselmann, S. Establishment of the Certification System “Gynaecological Dysplasia” in Germany. Geburtshilfe Frauenheilkd 2014, 74, 860–867. [CrossRef]
10. Najib, F.S.; Hashemi, M.; Shiravani, Z.; Poordast, T.; Sharifi, S.; Askary, E. Diagnostic Accuracy of Cervical Pap Smear and Colposcopy in Detecting Premalignant and Malignant Lesions of Cervix. Indian J. Surg. Oncol. 2020, 11, 453–458. [CrossRef]
11. Schneider, V. Criticism of the Pap Smear as a Diagnostic Tool in Cervical Cancer Screening. Acta Cytol. 2017, 61, 338–344.
[CrossRef]
12. Nam, K. Colposcopy at a turning point. Obstet. Gynecol. Sci. 2018, 61, 1–6. [CrossRef]
13. Stuebs, F.A.; Koch, M.C.; Dietl, A.K.; Adler, W.; Geppert, C.; Hartmann, A.; Knöll, A.; Beckmann, M.W.; Mehlhorn, G.; Schulmeyer, C.E.; et al. Cytology and High-Risk Human Papillomavirus Test for Cervical Cancer Screening Assessment. Diagnostics 2022, 12, 1748. [CrossRef]
14. Baum, M.E.; Rader, J.S.; Gibb, R.K.; McAlister, R.P.; Powell, M.A.; Mutch, D.G.; Gao, F.; Wright, J.D. Colposcopic accuracy of obstetrics and gynecology residents. Gynecol. Oncol. 2006, 103, 966–970. [CrossRef]
15. Petousis, S.; Christidis, P.; Margioula-Siarkou, C.; Sparangis, N.; Athanasiadis, A.; Kalogiannidis, I. Discrepancy between colposcopy, punch biopsy and final histology of cone specimen: A prospective study. Arch. Gynecol. Obstet. 2018, 297, 1271–1275. [CrossRef]
16. Karimi-Zarchi, M.; Peighmbari, F.; Karimi, N.; Rohi, M.; Chiti, Z. A Comparison of 3 Ways of Conventional Pap Smear, Liquid- Based Cytology and Colposcopy vs Cervical Biopsy for Early Diagnosis of Premalignant Lesions or Cervical Cancer in Women with Abnormal Conventional Pap Test. Int. J. Biomed. Sci. 2013, 9, 205–210.
17. Olaniyan, O.B. Validity of colposcopy in the diagnosis of early cervical neoplasia—A review. Afr. J. Reprod. Health 2002, 6, 59–69.
[CrossRef]
18. Mousavi, A.S.; Fakour, F.; Gilani, M.M.; Behtash, N.; Ghaemmaghami, F.; Karimi Zarchi, M. A prospective study to evaluate the correlation between Reid colposcopic index impression and biopsy histology. J. Low Genit. Tract Dis. 2007, 11, 147–150. [CrossRef]
19. Arbyn, M.; Kyrgiou, M.; Simoens, C.; O Raifu, A.; Koliopoulos, G.; Martin-Hirsch, P.; Prendiville, W.; Paraskevaidis, E. Perinatal mortality and other severe adverse pregnancy outcomes associated with treatment of cervical intraepithelial neoplasia: Meta- analysis. BMJ 2008, 337, a1284. [CrossRef]
20. Kyrgiou, M.; Koliopoulos, G.; Martin-Hirsch, P.; Arbyn, M.; Prendiville, W.; Paraskevaidis, E. Obstetric outcomes after conserva- tive treatment for intraepithelial or early invasive cervical lesions: Systematic review and meta-analysis. Lancet 2006, 367, 489–498. [CrossRef]
21. Kyrgiou, M.; Athanasiou, A.; Kalliala, I.E.J.; Paraskevaidi, M.; Mitra, A.; Martin-Hirsch, P.P.; Arbyn, M.; Bennett, P.; Paraskevaidis, E. Obstetric outcomes after conservative treatment for cervical intraepithelial lesions and early invasive disease. Cochrane Database Syst. Rev. 2017, 11, Cd012847. [CrossRef]
22. Bornstein, J.; Bentley, J.; Bösze, P.; Girardi, F.; Haefner, H.; Menton, M.; Perrotta, M.; Prendiville, W.; Russell, P.; Sideri, M.; et al. 2011 colposcopic terminology of the International Federation for Cervical Pathology and Colposcopy. Obstet. Gynecol. 2012, 120, 166–172. [CrossRef] [PubMed]
23. Quaas, J.; Reich, O.; Kuppers, V. Explanation and Use of the Rio 2011 Colposcopy Nomenclature of the IFCPC (International Federation for Cervical Pathology and Colposcopy): Comments on the general colposcopic assessment of the uterine cervix: Adequate/inadequate; squamocolumnar junction; transformation zone. Geburtshilfe Frauenheilkd 2014, 74, 1090–1092. [PubMed]
24. Quaas, J.; Reich, O.; Tirri, B.F.; Küppers, V. Explanation and Use of the Colposcopy Terminology of the IFCPC (International Federation for Cervical Pathology and Colposcopy) Rio 2011. Geburtshilfe Frauenheilkd 2013, 73, 904–907. [CrossRef]
25. Loopik, D.L.; Doucette, S.; Bekkers, R.L.; Bentley, J.R. Regression and Progression Predictors of CIN2 in Women Younger than 25 Years. J. Low Genit. Tract Dis. 2016, 20, 213–217. [CrossRef]
26. Massad, L.S.; Collins, Y.C. Strength of correlations between colposcopic impression and biopsy histology. Gynecol. Oncol. 2003,
89, 424–428. [CrossRef]
27. Ruan, Y.; Liu, M.; Guo, J.; Zhao, J.; Niu, S.; Li, F. Evaluation of the accuracy of colposcopy in detecting high-grade squamous intraepithelial lesion and cervical cancer. Arch. Gynecol. Obstet. 2020, 302, 1529–1538. [CrossRef]
28. Mustafa, R.A.; Santesso, N.; Khatib, R.; Mustafa, A.A.; Wiercioch, W.; Kehar, R.; Gandhi, S.; Chen, Y.; Cheung, A.; Hopkins, J.; et al. Systematic reviews and meta-analyses of the accuracy of ВПЛ tests, visual inspection with acetic acid, cytology, and colposcopy. Int. J. Gynaecol. Obstet. 2016, 132, 259–265. [CrossRef]
29. Hopman, E.H.; Kenemans, P.; Helmerhorst, T.J. Positive predictive rate of colposcopic examination of the cervix uteri: An overview of literature. Obstet. Gynecol. Surv. 1998, 53, 97–106. [CrossRef]
30. Ferris, D.G.; Litaker, M.S. Colposcopy quality control by remote review of digitized colposcopic images. Am. J. Obstet. Gynecol.
2004, 191, 1934–1941. [CrossRef]
31. Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Krebsfrüherkennungs-Richtlinie und eine Änderung der Richtlinie für organisierte Krebsfrüherkennungsprogramme: Programm zur Früherkennung von Zervixkarzinomen 2018. Available online: https://www.g-ba.de/downloads/39-261-3597/2018-11-22_oKFE-RL_Zervixkarzinom.pdf (accessed on 22 November 2018).
32. Bujan Rivera, J.; Klug, S.J. Cervical cancer screening in Germany. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz
2018, 61, 1528–1535. [CrossRef]
33. Hillemanns, P.; Mallmann, P.; Beckmann, M.W. New Screening Proposals: The Federal Joint Commission Defines the Parameters for Cervical Cancer Screening from 2018: Statement of the Gynecology Oncology Working Group (AGO). Geburtshilfe Frauenheilkd 2016, 76, 145–146. [PubMed]
34. Hillemanns, P.; Friese, K.; Dannecker, C.; Klug, S.; Seifert, U.; Iftner, T.; Hädicke, J.; Löning, T.; Horn, L.; Schmidt, D.; et al. Prevention of Cervical Cancer: Guideline of the DGGG and the DKG (S3 Level, AWMF Register Number 015/027OL, December 2017)—Part 1 with Introduction, Screening and the Pathology of Cervical Dysplasia. Geburtshilfe Frauenheilkd 2019, 79, 148–159. [CrossRef] [PubMed]
35. Hillemanns, P.; Friese, K.; Dannecker, C.; Klug, S.; Seifert, U.; Iftner, T.; Hädicke, J.; Löning, T.; Horn, L.; Schmidt, D.; et al. Prevention of Cervical Cancer: Guideline of the DGGG and the DKG (S3 Level, AWMF Register Number 015/027OL, December 2017)—Part 2 on Triage, Treatment and Follow-up. Geburtshilfe Frauenheilkd 2019, 79, 160–176. [CrossRef] [PubMed]
36. Hillemanns, P.; Tempfer, C.; Beckmann, M.W.; Küppers, V.; Quaas, J. Statement of the AGO and AG-CPC on the Aftercare/Follow- up for Surgical Procedures of the Lower Genital Tract after the Introduction of a New Cancer Screening Guideline. Geburtshilfe Frauenheilkd 2020, 80, 809–812. [CrossRef]
37. Barnes, B.; Kraywinkel, K.; Nowossadeck, E.; Schönfeld, I.; Starker, A.; Wienecke, A.; Wolf, U. RKI-Bericht zum Krebsgeschehen in Deutschland 2016. 2016.