Точність тестування на вірус папіломи людини високого онкогенного ризику за допомогою тесту Xpert ВПЛ на вагінальних самостійно зібраних зразках порівнювали зі зразками, відібраними лікарем, у рамках дослідження VALHUDES. Ми набрали 523 жінки в п’яти бельгійських клініках кольпоскопії, з яких 483 (середній вік – 40 років; інтерквартильний розмах – від 31 до 49 років) були включені в основний аналіз (226 були зібрані за допомогою щіточки Evalyn і 257 – за допомогою Qvintip). Зразки з шийки матки були зібрані за допомогою Cervex-Brush. Результати кольпоскопії та гістології розглядалися як референтний стандарт. Аналіз Xpert ВПЛ мав подібну точність для цервікальної інтраепітеліальної неоплазії ≥2 на зразках, зібраних самостійно, порівняно зі зразками, зібраними лікарем [відносна чутливість 0,96 (95% ДІ, 0,91-1,02); і відносна специфічність 0,96 (95% ДІ, 0,89-1,04)]. Відносна точність дещо відрізнялася залежно від пристрою для вагінального збору [відношення чутливості 0,98 (95% ДІ, 0,90-1,06) і 0,94 (95% ДІ, 0,87-1,02) для Evalyn і Qvintip відповідно; відношення специфічності 1,06 (95% ДІ, 0,95-1,19) і 0,88 (95% ДІ, 0,80-0,98) для Evalyn і Qvintip відповідно]. Не було виявлено різниці у значеннях ПЦ між вагінальними та цервікальними зразками. Отже, чутливість тесту Xpert ВПЛ на цервікальну інтраепітеліальну неоплазію ≥2 на вагінальних самостійно зібраних зразках була подібною до чутливості зразків з шийки матки. Клінічна специфічність була нижчою, ніж на зразках, зібраних лікарем, коли самостійно зібрані зразки були взяті за допомогою Qvintip.
Скринінг на нуклеїнові кислоти типів вірусу папіломи людини високого онкогенного ризику (ВПЛ), збудників раку шийки матки, є більш ефективним, ніж цитологія, і тому рекомендований в останніх настановах щодо вторинної профілактики цієї неоплазії.1, 2, 3 Більше того, аналізи на ВПЛ можна проводити на самостійно зібраних зразках.4
Тестування на ВПЛ за допомогою самостійного забору зразків привернуло увагу всього світу завдяки своєму потенціалу в охопленні жінок, які не беруть участі в регулярному скринінгу або не відвідують його.5,6 Оскільки жінки, які не проходять скринінг, залишаються в групі ризику розвитку раку шийки матки, охоплення цієї групи населення стало пріоритетним завданням охорони здоров’я в багатьох країнах світу.6 Рандомізовані дослідження продемонстрували, що пропозиція самостійного забору зразків є більш ефективною, ніж традиційні запрошення до клініки для забору зразків з шийки матки медичним працівником.4,5 Крім того, нещодавні дослідження показали, що тестування на ВПЛ на адекватно підготовлених вагінальних самостійно зібраних зразках за допомогою валідованого ПЛР-тесту на основі ВПЛ має таку ж точність виявлення передраку шийки матки, як і тестування на ВПЛ на зразках з шийки матки.5
Відсутність міжнародних стандартизованих протоколів щодо самостійного забору зразків надихнула на розробку системи валідації аналізів та пристроїв для забору зразків для тестування на ВПЛ з піхви та сечі (VALHUDES).7 Такі стандартизовані протоколи та валідація існують для зразків шийки матки вже більше десяти років.8,9 Близько десятка тестів на ДНК ВПЛ відповідають міжнародним критеріям валідації на зразках, взятих лікарями, і список клінічно валідованих тестів постійно розширюється.10 Подібні дослідження необхідні для вирішення існуючих проблем у робочому процесі тестування ВПЛ на основі самостійно зібраних зразків.11 Попередні звіти VALHUDES продемонстрували, що два тести [Аналіз на ВПЛ високого онкогенного ризику в режимі реального часу (Abbott Molecular Diagnostics, Дес-Плейнс, Іллінойс); і аналіз на ВПЛ BD Onclarity (BD Diagnostics, Sparks, доктор медичних наук)] мають таку ж точність виявлення передраку шийки матки у вагінальних самостійно зібраних зразках і в сечі, взятій при першому сечовипусканні, як і в зразках, взятих лікарями.12, 13, 14, 15.
У поточному звіті VALHUDES ми оцінюємо аналітичні та клінічні характеристики тесту Xpert ВПЛ (Xpert ВПЛ; Cepheid, Саннівейл, Каліфорнія), аналізу на основі картриджа, який застосовується в місцях надання медичної допомоги для самостійного забору вагінальних зразків.16
Матеріали та методи
Структура дослідження
Протокол VALHUDES (NCT03064087; https://clinicaltrials.gov, останній доступ 20 травня 2023 року)7 був розроблений для оцінки відносної клінічної точності аналізів на ВПЛ на самостійно зібраних зразках з піхви та сечі порівняно з аналізами на ВПЛ на зразках, взятих у клініці, відповідно до Стандартів звітності про дослідження діагностичної точності, як описано вище.17 У період з грудня 2017 року по січень 2020 року 523 жінки були включені в дослідження через наявну ВПЛ-інфекцію або патологію шийки матки. Середній вік учасниць становив 40 років (інтерквартильний розмах від 31 до 49 років). Набір проводився в п’яти бельгійських клініках кольпоскопії (університетські лікарні Антверпена, Брюсселя, Гента та Льєжа, а також загальна регіональна лікарня Heilig Hart Tienen). Критеріями виключення з дослідження були: вагітність, гістеректомія, відмова від участі, нерозуміння та непідписання інформованої згоди. Всі учасники дослідження підписали інформовану згоду.
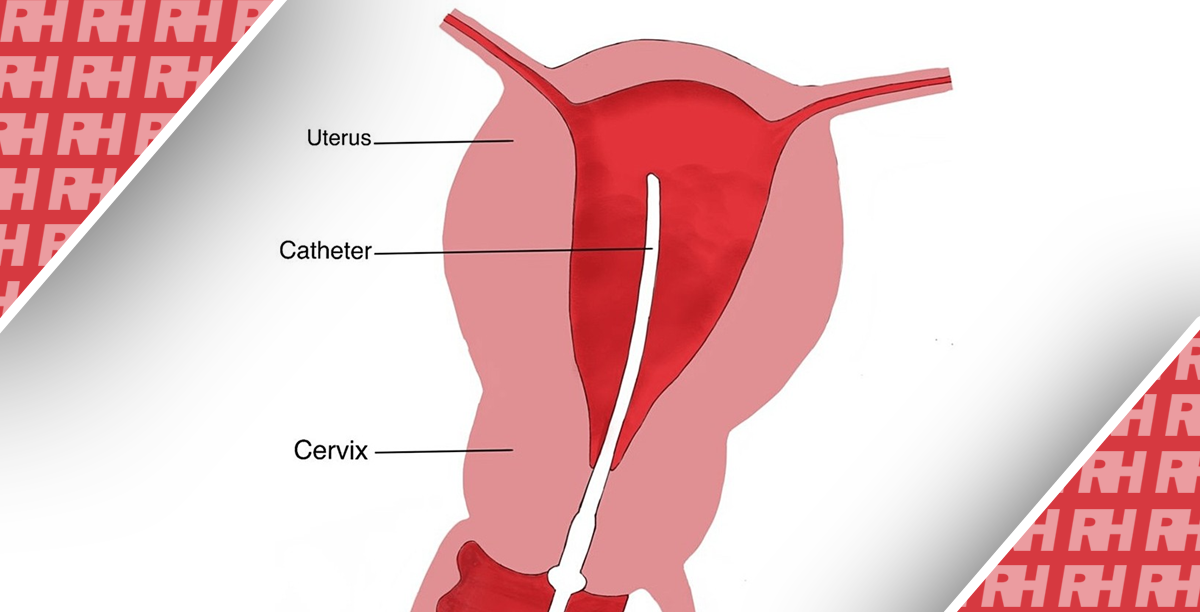
Після прибуття до клініки кольпоскопії медсестри проінструктували учасниць дослідження щодо самостійного забору вагінального зразка за допомогою вагінального пристрою Qvintip (Aprovix AB, Стокгольм, Швеція) або щіточки Evalyn (Rovers Medical Devices, Осс, Нідерланди). Зразки з шийки матки збиралися гінекологом за допомогою Cervex-Brush (Медичні прилади Rovers) відповідно до європейських рекомендацій.18 Клініки кольпоскопії в Брюсселі, Льєжі та Tienen ініціювали дослідження, запропонувавши учасницям пристрій Qvintip, тоді як клініки в Антверпені та Генті запропонували щітку Evalyn. Пристрої для самостійного відбору зразків були замінені, коли було досягнуто майже половини обсягу вибірки.
Сухі головки вагінальних щіток зберігалися в клініках кольпоскопії при кімнатній температурі, тоді як зразки з шийки матки були ресуспендовані в 20 мл середовища PreservCyt (Hologic, Inc., Бедфорд, штат Массачусетс) після відбору гінекологом. Обидва зразки були відправлені до лабораторії Algemeen Medisch (Антверпен, Бельгія) для зберігання та подальшої обробки протягом максимум 6 днів після збору. Після прибуття до лабораторії Algemeen Medisch, сухі вагінальні зразки були поміщені в 20 мл середовища PreservCyt. Всі зразки зберігали при 4°C максимум до 3 місяців, після чого вортексували протягом 15-20 секунд і розподіляли на аліквоти об’ємом 1 мл, які заморожували при -80°C (Biobank; BB190002).
Тестування на ВПЛ
Тестування на ВПЛ було проведено на 499 парних зразках шляхом перенесення 1 мл аліквоти цервікального та вагінального зразків безпосередньо в картридж Xpert. Картридж містить реагенти для екстракції ДНК і праймери з зондами для ампліфікації та виявлення ВПЛ. Xpert ВПЛ заснований на мультиплексній ПЛР в реальному часі, націленій на онкогени E6 і E7 14 генотипів ВПЛ. Ампліфікація проводиться в п’яти флуоресцентних каналах для виявлення наступних груп: ВПЛ 16, ВПЛ 18/45, ВПЛ 31/33/35/52/58, ВПЛ 51/59 і ВПЛ 39/56/66/68. Інтерпретація результатів виконується автоматично за допомогою програмного забезпечення GeneXpert. Гідроксиметилбілансинтазу людини визначали як контроль валідності та адекватності зразків та ампліфікаційної здатності ДНК. Позитивність ВПЛ визначалася, якщо відсікання ПЦ становило ≤40 для ВПЛ 16 і ВПЛ 18/45, і ≤38 для ВПЛ 31/35/33/52/58, ВПЛ 51/59 і ВПЛ 39/68/56/66. Зразки вважалися адекватними, якщо гідроксиметилбілансинтаза була ≤38 ПЦ.19 Ті ж самі межі були застосовані для вагінальних і цервікальних зразків.
Для оцінки клінічної точності автори визначили тестування на ВПЛ на вагінальних самостійно зібраних зразках як індексний тест, а на цервікальних зразках – як компаратор, тоді як для референтного стандарту використовували результати кольпоскопії та гістології. Якщо біопсію не проводили, а кольпоскопія була задовільною і не виявила підозрілих знахідок, результат класифікували як цервікальну інтраепітеліальну неоплазію (ЦІН) <2.
Статистичний аналіз
Загалом в основний аналіз було включено 483 жінки (середній вік – 40 років; інтерквартильний розмах – від 31 до 49 років). Двадцять чотири жінки були виключені з дослідження через серйозні порушення протоколу, як описано в інших джерелах.12,14 Шість цервікальних і п’ять вагінальних зразків були повторно протестовані через системну помилку, з яких один вагінальний зразок залишився недійсним після повторного тестування. Десять цервікальних і п’ять вагінальних зразків були виключені через відсутність β-глобіну у відповідних зразках (Зображення 1). Один вагінальний зразок був виключений через невдалий повторний тест. Абсолютну та відносну ефективність тестування на ВПЛ оцінювали для всієї досліджуваної популяції (N = 483) та для жінок віком ≥30 років (N = 386). Серед учасниць 47% збирали вагінальний зразок за допомогою щіточки Evalyn (226/483) і 53% збирали вагінальний зразок за допомогою Qvintip (257/483). Характеристики досліджуваної популяції були описані раніше.12,15
Зображення 1 Блок-схема зразків, включених у дослідження VALHUDES, протестованих за допомогою тесту Xpert ВПЛ. Сірим кольором позначені виключені зразки. Причини виключення зразків перед тестуванням на вірус папіломи людини (ВПЛ) були детально описані раніше.12 ЦІН – цервікальна інтраепітеліальна неоплазія.
Автори використовували тест МакНемара та парні 95% ДІ для порівняння відмінностей між цервікальними та вагінальними зразками. Для оцінки відповідності між зразками використовували коефіцієнт Каппа Коена з наступною класифікацією: 0,00-0,19 – погана; 0,20-0,39 – задовільна; 0,40-0,59 – помірна; 0,60-0,79 – добра; і 0,80-1,00 – відмінна узгодженість. Узгодженість і коефіцієнт Каппа Коена оцінювали для загальної позитивності ВПЛ та груп генотипування, як визначено в аналізі. Відмінності в середніх значеннях ПЦ між співставними цервікальними і вагінальними зразками, а також між результатами ЦІН ≥2 і ЦІН <2 оцінювали за допомогою t-критерію. Статистичний аналіз проводили за допомогою програми Stata 16.1 (StataCorp LLC, Коледж-Стейшн, Техас).
Етичне схвалення
Дослідження VALHUDES (NCT03064087) було схвалено центральним Комітетом з питань етики Університетської лікарні Антверпена/Університету Антверпена (B300201733869) та локальними комітетами з питань етики всіх інших залучених центрів. Дослідження проводилося відповідно до Гельсінської декларації. Письмова інформована згода була отримана від усіх учасників дослідження перед включенням до нього.
Результати
Клінічна точність
Клінічна чутливість Xpert ВПЛ для виявлення ЦІН ≥2 у вагінальних самостійно зібраних зразках за допомогою щіточки Evalyn або Qvintip була подібною до зразків з шийки матки (відношення 0,96; 95% ДІ, 0,91-1,02); однак чутливість для виявлення ЦІН 3 була на 9% нижчою (відношення 0,91; 95% ДІ, 0,82-0,998). Специфічність для ЦІН <2 у вагінальних самостійних зразках не відрізнялася від цервікальних зразків (відношення 0,96; 95% ДІ, 0,89-1,04) (Таблиця 1).
Таблиця 1 Відносна чутливість та специфічність тесту Cepheid Xpert на ВПЛ на зразках, зібраних лікарем, у порівнянні з самостійно зібраними зразками
| Змінна | Відносна чутливість (95% ДІ) ЦІН ≥2 | Відносна чутливість (95% ДІ) ЦІН 3 | Відносна специфічність (95% ДІ) ЦІН <2 |
| Загальна кількість досліджуваних (n = 483) | |||
| Вагінальна (E + Q) | 0.96 (0.91–1.02) | 0.91 (0.82–0.998) | 0.96 (0.89–1.04) |
| Evalyn Brush | 0.98 (0.90–1.06) | 0.91 (0.80–1.04) | 1.06 (0.95–1.19) |
| Qvintip | 0.94 (0.87–1.02) | 0.90 (0.78–1.04) | 0.88 (0.80–0.98) |
| Жінки віком ≥30 років (n = 386) | |||
| Вагінальна (E + Q) | 0.95 (0.87–1.03) | 0.88 (0.77–0.997) | 0.95 (0.88–1.03) |
| Evalyn | 0.97 (0.86–1.09) | 0.87 (0.71–1.06) | 1.06 (0.95–1.17) |
| Qvintip | 0.93 (0.83–1.03) | 0.88 (0.74–1.05) | 0.87 (0.77–0.98) |
ЦІН, цервікальна інтраепітеліальна неоплазія; E + Q, зразки, зібрані за допомогою Evalyn Brush та Qvintip у поєднанні.
При стратифікації аналізу за вагінальним пристроєм чутливість для ЦІН ≥2 Xpert ВПЛ на зразках Evalyn Brush (співвідношення 0,98; 95% ДІ, 0,90-1,06) і Qvintip (співвідношення 0,94; 95% ДІ, 0,87-1,02) також була подібною до чутливості для зразків з шийки матки. Відношення відносної клінічної чутливості Xpert для ЦІН ≥2 на щіточці Evalyn до Qvintip становило 1,04 (95% ДІ, 0,88-1,22; незрівнянне зіставлення). Специфічність Xpert ВПЛ на зразках Evalyn Brush не відрізнялася від цервікальних зразків (співвідношення 1,06; 95% ДІ, 0,95-1,19), тоді як на зразках Qvintip специфічність була значно нижчою (співвідношення 0,88; 95% ДІ, 0,80-0,98). Співвідношення специфічності щітки Evalyn та Qvintip становило 1,12 (95% ДІ, 0,89-1,39; незрівнянне порівняння).
При обмеженні аналізу жінками віком ≥30 років точність була дещо нижчою порівняно із загальною популяцією (Таблиця 1).
Аналітична ефективність
Xpert ВПЛ одночасно виявив ВПЛ у 56% (270/483) зразків, а 33% зразків були одночасно негативними на ВПЛ. З цих зразків 5% (24/483) були позитивними лише на цервікальних зразках і 6% (28/483) були позитивними лише на вагінальних самостійно зібраних зразках. Автори спостерігали від помірної до відмінної загальної та специфічної для кожного типу тесту узгодженість між цервікальними та вагінальними зразками зі значеннями Каппа Коена від 0,67 до 0,93 (Таблиця 2).
Таблиця 2 Загальна та типоспецифічна збіжність між цервікальним та вагінальним (Evalyn Brush + Qvintip) зразками
| Зразок | Тип ВПЛ | +/+ | +/− | −/+ | −/− | Узгодженість, % | Коефіцієнт Каппа Коена(95% ДІ) |
| Загальна кількість досліджуваних (n = 483) | врВПЛ | 270 | 24 | 28 | 161 | 89.2 | 0.773 (0.715–0.831) |
| ВПЛ 16 | 72 | 6 | 11 | 394 | 96.5 | 0.873 (0.814–0.932) | |
| ВПЛ 18/45 | 37 | 9 | 3 | 434 | 97.5 | 0.847 (0.762–0.932) | |
| ВПЛ 31/33/35/52/58 | 126 | 13 | 14 | 330 | 94.4 | 0.864 (0.814–0.914) | |
| ВПЛ 51/59 | 53 | 10 | 10 | 410 | 95.9 | 0.817 (0.740–0.895) | |
| ВПЛ 39/56/66/68 | 83 | 13 | 18 | 369 | 93.6 | 0.802 (0.736–0.869) | |
| ЦІН ≥2 (n = 85) | врВПЛ | 74 | 4 | 1 | 6 | 94.1 | 0.674 (0.409–0.939) |
| ВПЛ 16 | 39 | 2 | 0 | 44 | 97.7 | 0.953 (0.888–1.000) | |
| ВПЛ 18/45 | 7 | 1 | 1 | 76 | 97.7 | 0.862 (0.674–1.000) | |
| ВПЛ 31/33/35/52/58 | 33 | 2 | 1 | 49 | 96.5 | 0.927 (0.846–1.000) | |
| ВПЛ 51/59 | 12 | 1 | 1 | 71 | 97.7 | 0.909 (0.785–1.000) | |
| ВПЛ 39/56/66/68 | 17 | 2 | 5 | 61 | 91.8 | 0.775 (0.618–0.933) | |
| ЦІН <2 (n = 398) | врВПЛ | 196 | 20 | 27 | 155 | 88.2 | 0.761 (0.697–0.825) |
| ВПЛ 16 | 33 | 4 | 11 | 350 | 96.2 | 0.794 (0.693–0.895) | |
| ВПЛ 18/45 | 30 | 8 | 2 | 358 | 97.5 | 0.843 (0.749–0.938) | |
| ВПЛ 31/33/35/52/58 | 93 | 11 | 13 | 281 | 94.0 | 0.845 (0.785–0.905) | |
| ВПЛ 51/59 | 41 | 9 | 9 | 339 | 95.5 | 0.794 (0.702–0.886) | |
| ВПЛ 39/56/66/68 | 66 | 11 | 13 | 308 | 94.0 | 0.813 (0.755–0.870) |
Коефіцієнт узгодженості Каппа Коена між вагінальними та цервікальними зразками представлений наступним чином: від 0,00 до 0,20 – погана; від 0,21 до 0,40 – задовільна; від 0,41 до 0,60 – помірна; від 0,61 до 0,80 – добра; від 0,81 до 1,00 – відмінна.
+/+, позитивний на вагінальних і цервікальних зразках; +/-, позитивний тільки на цервікальних зразках; -/+, позитивний тільки на вагінальних зразках; -/-, негативний на обох типах зразків; ЦІН, цервікальна інтраепітеліальна неоплазія; ВПЛ, вірус папіломи людини; врВПЛ, ВПЛ високого онкогенного ризику.
Середні значення ПЦ для ампліфікації ВПЛ і ДНК людини були нижчими для загальної кількості ВПЛ і ВПЛ 16 у жінок з ЦІН ≥2 порівняно з ЦІН <2 у зразках шийки матки. Не було виявлено різниці в середніх значеннях ПЦ в залежності від статусу захворювання у вагінальних зразках, а також не спостерігалося різниці в середніх значеннях ПЦ між цервікальними і вагінальними зразками.
Обговорення
У цьому звіті VALHUDES ми продемонстрували подібні аналітичні та клінічні показники Xpert ВПЛ для ЦІН ≥2 при самостійно зібраних вагінальних зразках порівняно зі зразками, відібраними лікарем. Відповідно до наших попередніх висновків, ми спостерігали, що клінічні результати тестування на ВПЛ відрізняються залежно від пристрою для забору вагінальних зразків. Xpert на щіточці Evalyn був аналогічно чутливим, але більш специфічним, ніж на Qvintip. У перших звітах VALHUDES оцінювали точність тесту на ВПЛ високого онкологічного ризику в режимі реального часу та BD Onclarity ВПЛ аналіз. Обидва тести показали подібну чутливість для виявлення ЦІН ≥2 у вагінальних самостійно зібраних зразках порівняно з цервікальними зразками, відібраними лікарем, хоча тест на ВПЛ високого онкологічного ризику в режимі реального часу потребував оптимізації відсікання числа циклів для досягнення подібної чутливості на вагінальних самостійно зібраних зразках порівняно зі зразками, зібраними лікарем.12, 13, 14, 15.
Різниця в точності між Evalyn і Qvintip може бути пояснена конструкцією пристрою. Щіточка Evalyn має велику м’яку головку для збору, схожу на щітку, тоді як Qvintip має маленьку головку з твердого пластику з кількома боковими канавками для збору клітин цервікально-вагінальних клітин. Тому щіточка Evalyn може збирати більше відлущених клітин шийки матки порівняно з Qvintip, а отже, і точність впливу буде вищою.
Було опубліковано багато статей про ефективність тестування на ВПЛ на самостійно зібраних зразках. В оновлений метааналіз, проведений Arbyn та ін. 5 , було включено 56 досліджень точності. Ця робота продемонструвала таку ж високу точність тестів на ВПЛ для виявлення передраку шийки матки на вагінальних самостійно зібраних зразках, як і на зразках, зібраних лікарем, якщо тест, що використовувався, базувався на валідованому ПЛР-аналізі, тоді як тести на основі посилення сигналу були менш чутливими при самостійному заборі зразків. Інший метааналіз статистики узгодження, який включав 26 досліджень, що об’єднали понад 10 000 учасників, показав 89% узгодження з коефіцієнтом 0,72 κ тестів на ВПЛ на основі ПЛР на вагінальних самостійно зібраних зразках порівняно з цервікальними зразками. Ці дані свідчать про те, що якщо валідовані ПЛР-тести на ВПЛ на цервікальних і вагінальних зразках продемонструють високу узгодженість і значення коефіцієнта Каппа Коена з новими пристроями/носіями, їх можна буде поширити на альтернативні пристрої та/або носії. 20 Такий підхід може полегшити валідацію нових комбінацій тестів на ВПЛ і пристроїв або носіїв для самостійного забору зразків і прискорити їх впровадження в рамках скринінгових програм.
Xpert ВПЛ був валідований для скринінгу раку шийки матки на цервікальних зразках, що зберігаються в PreservCyt в рамках VALGENT-2. 10,16 Аналіз Xpert також був оцінений на цервікальних зразках 535 жінок, які живуть з ВІЛ, і 586 жінок, які не живуть з ВІЛ, відібраних в контексті скринінгу та кольпоскопії в клініках в Південній Африці.21 Автори модифікували порогові значення позитивності ВПЛ, щоб підвищити специфічність тесту в групі жінок, які живуть з ВІЛ, оскільки поширеність ВПЛ і вірусне навантаження у цих жінок вищі, ніж у загальній популяції. Дослідження показало, що для окремих груп онкологічного ризику можуть знадобитися скориговані порогові значення, щоб знайти оптимальний баланс між чутливістю та специфічністю. Раніше ми використовували подібний апостеріорний підхід до оптимізації порогових значень на власних зразках; однак у поточному дослідженні VALHUDES оптимізація порогових значень не була необхідною, оскільки точність на самостійно зібраних зразках порівняно з клінічними зразками була подібною.12,14 Saidu та ін. 22 аналогічно оцінювали тест Xpert на самостійно зібраних зразках, включивши понад 1000 жінок з популяцій скринінгу та кольпоскопії в Південній Африці, як це рекомендовано для досліджень діагностичної точності. Xpert виявився однаково чутливим до самостійно зібраних вагінальних зразків порівняно з цервікальними зразками, взятими лікарем. Це збігається з нашими результатами, але про нижчу специфічність повідомили Saidu та ін. 22 у південноафриканському дослідженні жінки самостійно збирали зразки за допомогою стандартного тампона, який поміщали в 4 мл розчину PreservCyt. У дослідженні VALHUDES два використані вагінальні пристрої (Evalyn та Qvintip) ресуспендували у 20 мл розчину PreservCyt. Автори з Південної Африки повідомили, що менший об’єм ресуспензії міг призвести до вищої концентрації вірусу і, отже, до нижчої специфічності.
Поживні середовища PreservCyt і SurePath схвалені Управлінням з продовольства і медикаментів США для скринінгу раку шийки матки на основі цитологічного дослідження. PreservCyt та SurePath були розроблені для збереження клітин, що дозволяє проводити цитологічну інтерпретацію, і містять метанол та етанол відповідно, а тому є відносно дорогими для транспортування. За даними нашого дослідження VALHUDES, тестування на ВПЛ на вагінальних зразках з використанням PreservCyt показало таку ж точність, як і результати тестування на ВПЛ на цервікальних зразках, зібраних лікарем, з використанням того ж середовища. Оскільки тести на ВПЛ призначені для виявлення вірусної ДНК або РНК, спиртові розчини не є необхідними для збереження ДНК ВПЛ. Крім того, висока вартість цих середовищ спонукає країни з обмеженими ресурсами шукати дешевші альтернативні рішення. Тому для отримання достатніх доказів ефективності альтернативних носіїв необхідні розширені підходи до валідації. Хоча зацікавленість учасників скринінгу у використанні самостійно зібраних зразків зросла, все ще потрібні додаткові дослідження для отримання необхідних знань про вплив різноманітних преаналітичних та аналітичних параметрів на клінічну точність.11,23
Xpert ВПЛ був протестований на семи серіях розведень (від одного до семи імітованих 10-кратних розведень) штучно підготовленої людської та вірусної ДНК з клітинних ліній ВПЛ 16, ВПЛ 18 і ВПЛ 31, що зберігалися в п’яти різних транспортних середовищах.24 Розчин PreservCyt порівнювали з чотирма безалкогольними розчинами: фосфатно-буферним фізіологічним розчином (Thermo Fisher Scientific, Уолтем, Массачусетс, США), Sigma Virocult (Medical Wire and Equipment, Великобританія), MSwab (Copan, Італія), і Xpert Transport Media (Cepheid). ДНК людини була виявлена у всіх середовищах і в усіх концентраціях. Розчин MSwab був єдиним середовищем, де ДНК ВПЛ була виявлена в п’ятому 10-кратному розведенні у всіх трьох клітинних лініях, і, отже, може бути альтернативою PreservCyt.24 Тим не менш, необхідні подальші дослідження для тестування таких середовищ на реальних зразках, отриманих від пацієнта, і зразках, зібраних лікарями. Поєднання альтернативних транспортних носіїв з Xpert ВПЛ може бути дешевшим та ефективнішим підходом для країн з обмеженими ресурсами. Тестування на ВПЛ за допомогою Xpert проводиться з використанням одного інтегрованого картриджа, який містить реагенти для екстракції ДНК, а також праймери та зонди для ампліфікації та виявлення ДНК ВПЛ.20,21 Для проведення тестування на ВПЛ необхідні обмежені ресурси як з точки зору лабораторних можливостей, так і з точки зору людського потенціалу; тому Xpert ВПЛ може становити особливий інтерес для віддалених країн з обмеженими ресурсами, враховуючи його придатність для проведення тестування в місцях надання медичної допомоги.
Одним з обмежень дослідження VALHUDES є те, що жінок набирали в клініках, де проводять кольпоскопію, що призвело до високого показника позитивних результатів на ВПЛ і низької абсолютної специфічності.12, 13, 14, 15 Ці дані узгоджуються з іншими подібними дослідженнями діагностичної точності, проведеними в умовах кольпоскопії.5 Однак було продемонстровано, що відносна точність тестування на ВПЛ на основі самостійно зібраних зразків порівняно зі зразками, зібраними лікарем, є порівнянною в групах спостереження і скринінгу.5 Таким чином, відносна точність повинна розглядатися як стійкий параметр для подібних досліджень точності діагностування. Сильні сторони та обмеження VALHUDES були детально описані раніше.12, 13, 14, 15.
Висновок
Тестування на врВПЛ за допомогою Xpert ВПЛ на самостійно зібраних вагінальних зразках виявилося таким же точним для виявлення передраку, як і на зразках шийки матки, зібраних лікарем. На точність може впливати пристрій для самостійного забору зразків.
Посилання на джерела
- Arbyn M, Ronco G, Anttila A, Meijer CJLM, Poljak M, Ogilvie G, Koliopoulos G, Naucler P, Sankaranarayanan R, Peto J: Evidence regarding human papillomavirus testing in secondary prevention of cervical cancer. Vaccine 2012, 30:F88eF99 Q21
- Arbyn M, Gultekin M, Morice P, Nieminen P, Cruickshank M, Poortmans P, Kelly D, Poljak M, Bergeron C, Ritchie D, Schmidt D, Kyrgiou M, Van den Bruel A, Bruni L, Basu P, Bray F, Weiderpass E: The European response to the WHO call to eliminate cervical cancer as a public health problem. Int J Cancer 2021, 148:277e284
- Bouvard V, Wentzensen N, Mackie A, Berkhof J, Brotherton J, GiorgiRossi P, Kupets R, Smith R, Arrossi S, Bendahhou K, Canfell K, Chirenje ZM, Chung MH, del Pino M, de Sanjosé S, Elfström M, Franco EL, Hamashima C, Hamers FF, Herrington CS, Murillo R, Sangrajrang S, Sankaranarayanan R, Saraiya M, Schiffman M, Zhao F, Arbyn M, Prendiville W, Indave Ruiz BI, Mosquera-Metcalfe I, Lauby-Secretan B: The IARC perspective on cervical cancer screening. N Engl J Med 2021, 385:1908e1918
- Arbyn M, Verdoodt F, Snijders PJ, Verhoef VM, Suonio E, Dillner L, Minozzi S, Bellisario C, Banzi R, Zhao FH, Hillemanns P, Anttila A: Accuracy of human papillomavirus testing on self-collected versus clinician-collected samples: a meta-analysis. Lancet Oncol 2014, 15: 172e183
- Arbyn M, Smith SB, Temin S, Sultana F, Castle P: Detecting cervical precancer and reaching underscreened women by using HPV testing on self samples: updated meta-analyses. BMJ 2018, 363:k4823
- Serrano B, Ibáñez R, Robles C, Peremiquel-Trillas P, de Sanjosé S, Bruni L: Worldwide use of HPV self-sampling for cervical cancer screening. Prev Med 2022, 154:106900
- Arbyn M, Peeters E, Benoy I, Vanden Broeck D, Bogers J, De Sutter P, Donders G, Tjalma W, Weyers S, Cuschieri K, Poljak M, Bonde J, Cocuzza C, Zhao FH, Van Keer S, Vorsters A: VALHUDES: a protocol for validation of human papillomavirus assays and collection devices for HPV testing on self-samples and urine samples. J Clin Virol 2018, 107:52e56
- Meijer CJLM, Berkhof J, Castle PE, Hesselink AT, Franco EL, Ronco G, Arbyn M, Bosch FX, Cuzick J, Dillner J, Heideman DAM, Snijders PJF: Guidelines for human papillomavirus DNA test requirements for primary cervical cancer screening in women 30 years and older. Int J Cancer 2009, 124:516e520
- Arbyn M, Depuydt C, Benoy I, Bogers J, Cuschieri K, Schmitt M, Pawlita M, Geraets D, Heard I, Gheit T, Tommasino M, Poljak M, Bonde J, Quint W: VALGENT: a protocol for clinical validation of human papillomavirus assays. J Clin Virol 2016, 76:S14eS21
- Arbyn M, Simon M, Peeters E, Xu L, Meijer C, Berkhof J, Cuschieri K, Bonde J, Ostrbenk Vanlencak A, Zhao FH, Rezhake R, Gultekin M, Dillner J, de Sanjosé S, Canfell K, Hillemanns P, Almonte M, Wentzensen N, Poljak M: 2020 List of human papillomavirus assays suitable for primary cervical cancer screening. Clin Microbiol Infect 2021, 27:1083e1095
- Arbyn M, Latsuzbaia A, Castle PE, Sahasrabuddhe VV, Broeck DV: HPV testing of self-samples: influence of collection and sample handling procedures on clinical accuracy to detect cervical precancer. Lancet Reg Health Eur 2022, 14:100332
- Van Keer S, Peeters E, Vanden Broeck D, De Sutter P, Donders G, Doyen J, Tjalma WAA, Weyers S, Vorsters A, Arbyn M: Clinical and analytical evaluation of the RealTime high risk HPV assay in Colli-Pee collected first-void urine using the VALHUDES protocol. Gynecol Oncol 2021, 162:575e583
- Van Keer S, Latsuzbaia A, Vanden Broeck D, De Sutter P, Donders G, Doyen J, Tjalma WAA, Weyers S, Arbyn M, Vorsters A: Analytical and clinical performance of extended HPV genotyping with BD Onclarity HPV Assay in home-collected first-void urine: a diagnostic test accuracy study. J Clin Virol 2022, 155:105271
- Latsuzbaia A, Vanden Broeck D, Van Keer S, Weyers S, Tjalma WAA, Doyen J, Donders G, De Sutter P, Vorsters A, Peeters E, Arbyn M: Clinical performance of the realtime high risk HPV assay on self-collected vaginal samples within the VALHUDES framework. Microbiol Spectr 2022, 10:e0163122
- Latsuzbaia A, Vanden Broeck D, Van Keer S, Weyers S, Donders G, Doyen J, Tjalma W, De Sutter P, Peeters E, Vorsters A, Arbyn M: Validation of BD Onclarity HPV assay on vaginal self-samples versus cervical samples using the VALHUDES protocol. Cancer Epidemiol Biomarkers Prev 2022, 31:2177e2184
- Cuschieri K, Geraets D, Cuzick J, Cadman L, Moore C, Vanden Broeck D, Padalko E, Quint W, Arbyn M: Performance of a cartridgebased assay for detection of clinically significant human papillomavirus (HPV) infection: lessons from VALGENT (Validation of HPV Genotyping Tests). J Clin Microbiol 2016, 54:2337e2342
- Cohen JF, Korevaar DA, Altman DG, Bruns DE, Gatsonis CA, Hooft L, Irwig L, Levine D, Reitsma JB, de Vet HC, Bossuyt PM: STARD 2015 guidelines for reporting diagnostic accuracy studies: explanation and elaboration. BMJ Open 2016, 6:e012799
- Arbyn M, Herbert A, Schenck U, Nieminen P, Jordan J, McGoogan E, Patnick J, Bergeron C, Baldauf JJ, Klinkhamer P, Bulten J, MartinHirsch P: European guidelines for quality assurance in cervical cancer screening: recommendations for collecting samples for conventional and liquid-based cytology. Cytopathology 2007, 18:133e139
- Castle PE, Smith KM, Davis TE, Schmeler KM, Ferris DG, Savage AH, Gray JE, Stoler MH, Wright TC Jr, Ferenczy A, Einstein MH: Reliability of the Xpert HPV assay to detect high-risk human papillomavirus DNA in a colposcopy referral population. Am J Clin Pathol 2015, 143:126e133
- Arbyn M, Castle PE, Schiffman M, Wentzensen N, HeckmanStoddard B, Sahasrabuddhe VV: Meta-analysis of agreement/concordance statistics in studies comparing self- vs cliniciancollected samples for HPV testing in cervical cancer screening. Int J Cancer 2022, 151:308e312
- Kuhn L, Saidu R, Boa R, Tergas A, Moodley J, Persing D, Campbell S, Tsai W-Y, Wright TC, Denny L: Clinical evaluation of modifications to a human papillomavirus assay to optimise its utility for cervical cancer screening in low-resource settings: a diagnostic accuracy study. Lancet Glob Health 2020, 8:e296ee304
- Saidu R, Kuhn L, Tergas A, Boa R, Moodley J, Svanholm-Barrie C, Persing D, Campbell S, Tsai WY, Wright TC, Denny L: Performance of Xpert HPV on self-collected vaginal samples for cervical cancer screening among women in South Africa. J Low Genit Tract Dis 2021, 25:15e21
- Arbyn M, Costa S, Latsuzbaia A, Kellen E, Girogi Rossi P, Cocuzza CE, Basu P, Castle PE: HPV-based cervical cancer screening on self-samples in the Netherlands: challenges to reach women and test performance questions. Cancer Epidemiol Biomarkers Prev 2023, 32: 159e163
- Badman SG, Vallely AJ, Pardo C, Mhango LP, Cornall AM, Kaldor JK, Whiley D: A comparison of ThinPrep against four nonvolatile transport media for HPV testing at or near the point of care. Pathology 2021, 53:264e266