Захворювання у черевній порожнині, до яких відносять синдром компресії черевного стовбура, перекрут ніжки кісти яєчника, розшарування аорти, коарктацію аорти та інші, відносно важко діагностувати через брак явних симптомів. У такому випадку найефективнішим методом є використання доплерографії.
ВИПАДОК 1. СИНДРОМ КОМПРЕСІЇ ЧЕРЕВНОГО СТОВБУРА
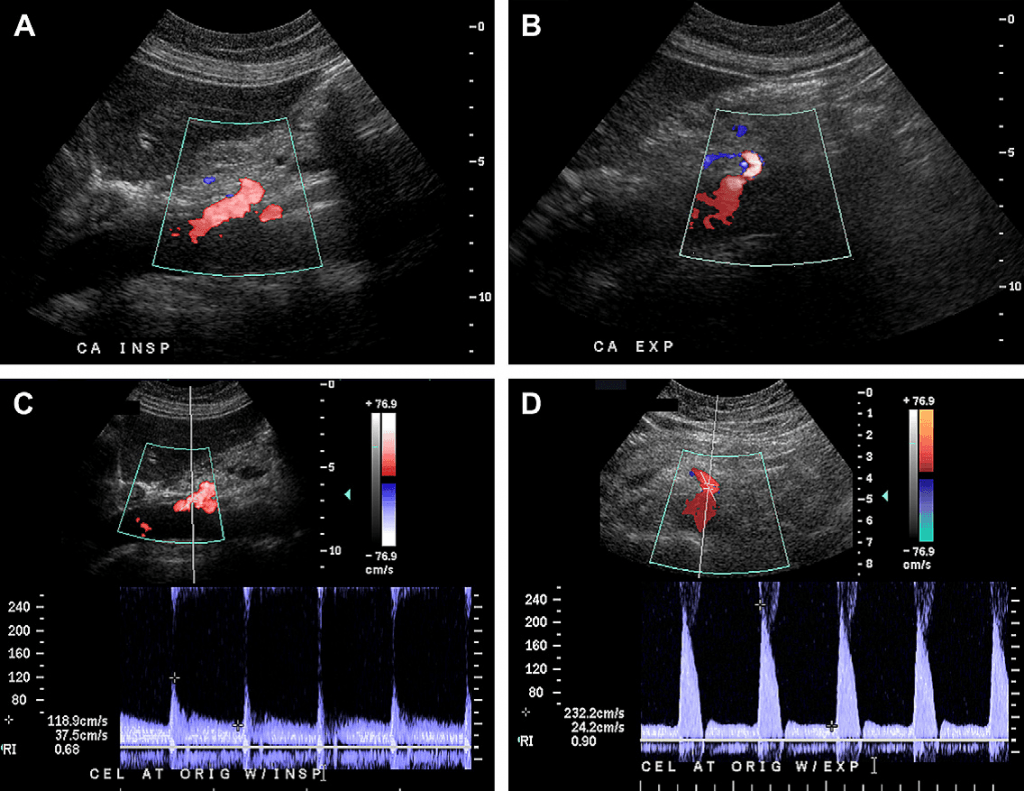
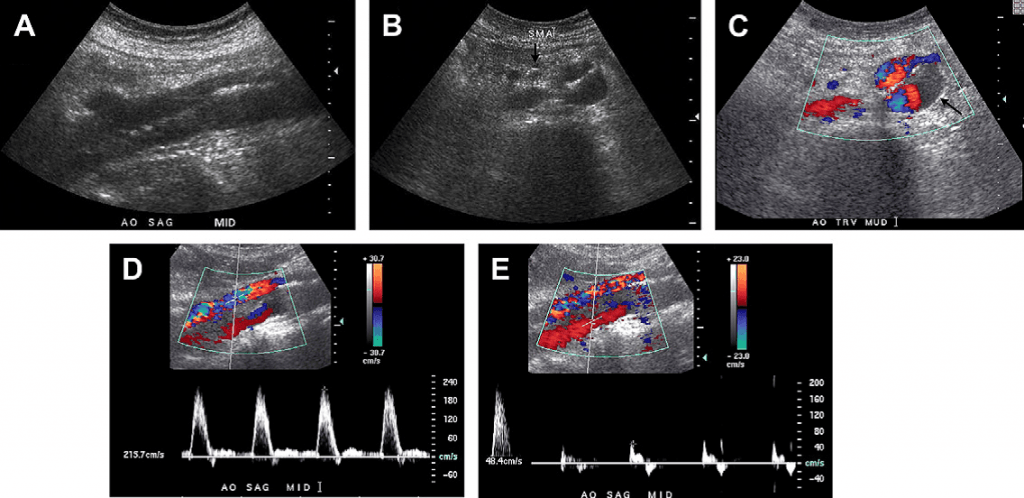
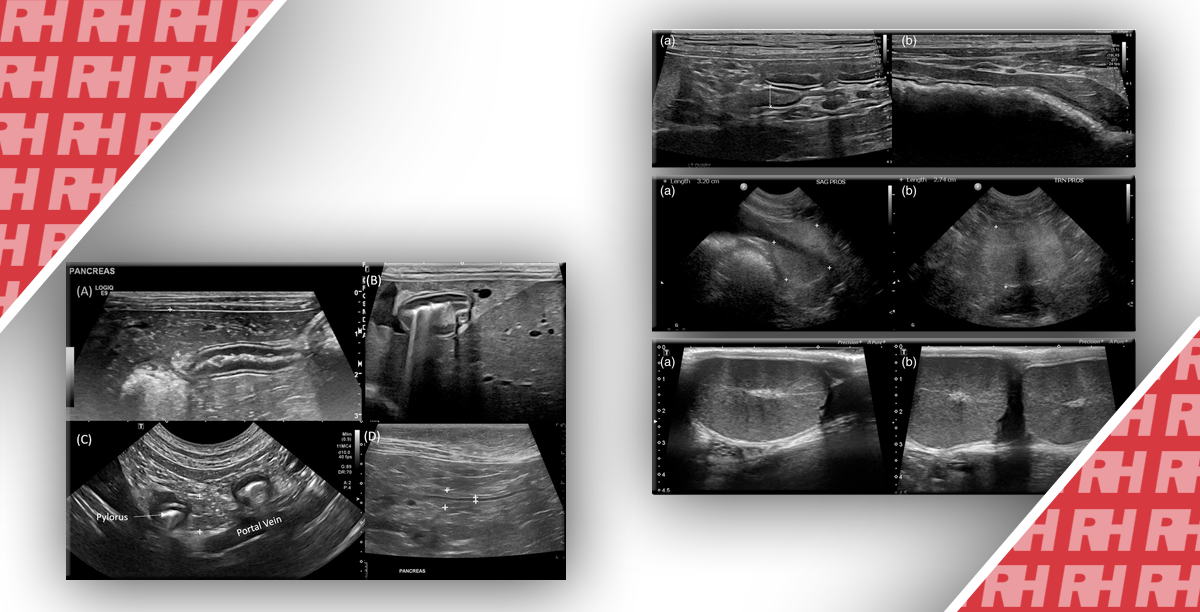
Випадок 1. 34-річна жінка зі скаргами на абдомінальний біль та втрату ваги. Кольорові допплерівські зображення черевної артерії на вдиху (А) та видиху (В) показують зміну зовнішнього вигляду черевної артерії. Під час видиху черевна артерія стає більш гостро вигнутою у краніальному напрямку, отримуючи гачкоподібну форму. Зверніть увагу на те, що пікова систолічна швидкість (ПСШ) також збільшилась від 118 см/с на видиху (С) до 232 см/с на вдиху (D). У цієї пацієнтки діагностовано синдром серединної дугоподібної зв’язки (ССДЗ), який лікували за допомогою хірургічного втручання із подальшим зменшенням симптомів.
Серединна дугоподібна зв’язка діафрагми – це фіброзна зв’язка, яка у більшості людей проходить над черевною аортою та над рівнем черевного стовбура, з’єднуючи праву і ліву ніжки діафрагми, розташовані з обох боків аортального отвору.
Однак, приблизно у 10-24% людей ця зв’язка проходить нижче, перетинаючи проксимальну частину черевного стовбура та спричиняючи його компресію, що більш чітко виражено на видиху. Не зважаючи на те, що такий вроджений варіант у багатьох пацієнтів виявляться випадково, від 87% до 50% із них мають явні симптоми компресії проксимального черевного стовбура, такі як біль, нудота, блювота та/або втрата ваги: сукупність симптомів, вперше згадана у 1963 році Harjola.
Клінічно значиму компресію черевного стовбура називають компресійним стенозом черевного стовбура (КСЧС), хоча це достатньо суперечливий клінічний стан. Він найчастіше проявляється у худих жінок у віці від 20 до 40 років. Больові відчуття можуть бути, або не бути пов’язані із прийомом їжі. Під час фізикального обстеження у надчеревній зоні можна почути характерний шум, який змінюється під час дихання.
Патологічну фізіологію КСЧС поки ще достеменно не визначено. Деякі дослідники вважають, що у наслідок стиснення черевного стовбура виникає дистальна ішемія, яка спричиняє біль у черевній порожнині, не зважаючи на добре відомий факт, що для появи брижової ішемії необхідне звуження двох із трьох брижових судин. Інші підтримують гіпотезу про те, що біль у черевній порожнині спричинений обкраданням коллатералій з верхньої брижової артерії. Компресію або ішемію черевного сплетіння також включили до можливих причин виникнення болю у черевній порожнині у пацієнтів із діагнозом КСЧС.
КСЧС найчастіше діагностують за допомогою традиційної ангіографії або ЗD комп’ютерної томографічної ангіографії (КТА), відображаючи фокальне звуження проксимальної частини черевного стовбура, зазвичай на п’ятисантиметровій відстані від місця її виходу, яке стає більш виразним на видиху. Окрім того, під час видиху можна побачити характерний гачкоподібний вигляд проксимальної частини черевного стовбура. Наявність постстенотичного розширення та/або наявність колатерального кровотоку від гілок верхньої брижової артерії до басейну черевного стовбура, що призводить до появи специфічних агіографічних та КТА симптомів, які допомагають диференціювати інші причини, які призводять до звуження черевного стовбура, такі як атеросклероз. Ультразвукова дуплексна ангіографія може використовуватись як більш дешева альтернатива для скринінгу. Для ультразвукового діагностування КСЧС використовуються наступні критерії: (1) зміна пікової систолічної швидкості (ПСШ) у черевному стовбурі під час дихання та її підвищення до 200 см/с і більше на видиху; (2) співвідношення ПСШ у черевній артерії на видиху до ПСШ у черевній аорті, розташованій одразу під діафрагмою, більше, ніж 3:1; та (3) гачкоподібний вигляд черевного стовбура на кольоровому доплерівському або сірошкальному зображенні на видиху. Деякі дослідники висловили думку про те, що специфічність цих симптомів збільшується коли ультразвуковий огляд проводять у вертикальному положенні. Проте, специфічність даних проявів є суперечливою, адже вони можуть зустрічатись як у безсимптомних пацієнтів, так і у тих, чий стеноз черевного стовбура був спричинений атеросклерозом.
Більшість вважають лапароскопічну хірургію із розділенням або резекцією серединної дугоподібної зв’язки для послаблення компресії проксимальної дванадцятипалої кишки оптимальним методом лікування пацієнтів із діагнозом ПСШ. Звуження зв’язок над черевним стовбуром деяких пацієнтів призводить до пошкодження судин, які можуть потребувати реконструкції. У випадку інших доведено, що декомпресія, розділення, резекція або невроліз фіброзного черевного сплетіння приносять позитивний результат. Однак, у зв’язку із тим, що симптоми, виявлені при КТА та ультразвуковій діагностиці не є специфічними, хірургічна декомпресія не завжди може гарантувати значне полегшення. Reilly разом із колегами повідомив, що пацієнтів у віці від 40 до 60 років, які скаржаться на больові відчуття після прийому їжі та втрату понад 9 кг ваги, а при ангіографії та КТА у яких виявлено постстенотичне розширення колатеральних судин, найефективніше оперувати.
ВИПАДОК 2: ПЕРЕКРУТ НІЖКИ КІСТИ ЯЄЧНИКА
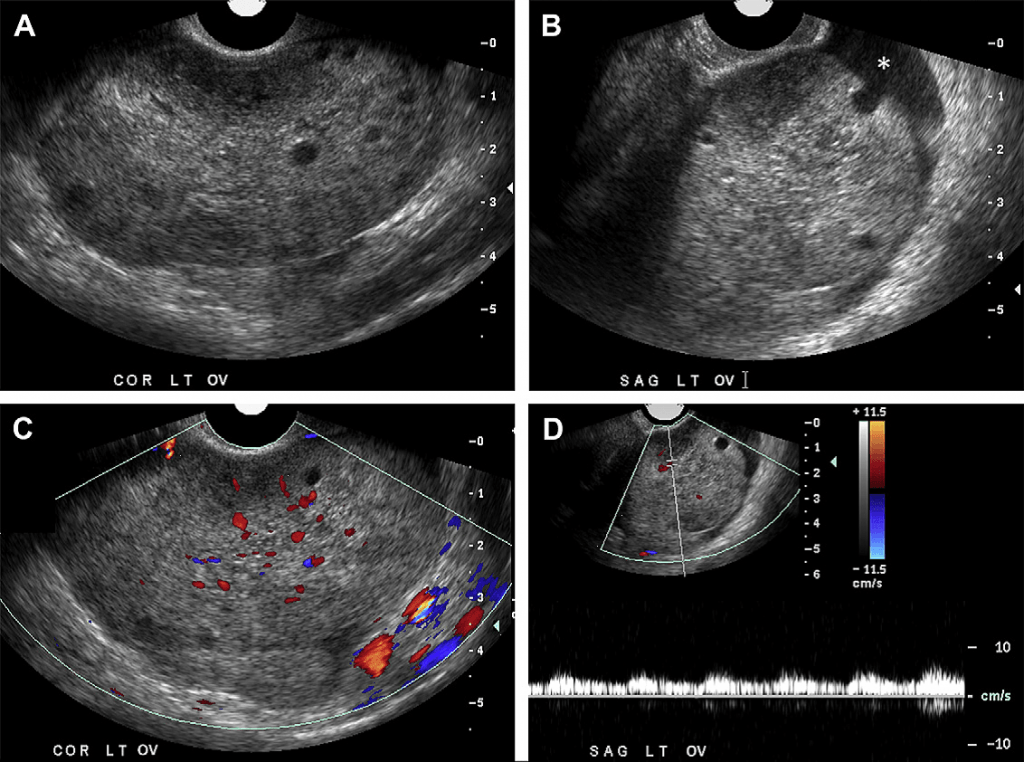
Випадок 2. 24-річна жінка потрапила у відділення невідкладної допомоги зі скаргами на періодичний біль у ділянці малого таза. На сірошкальному зображенні (A, B) видно, що лівий яєчник збільшений у розмірі із гетерогенною стромою у центрі та периферійним зміщенням маленьких фолікулів. Зверніть увагу на незначну кількість вільної рідини навколо яєчника (зірочка на Рис. В). На зображенні кольорового доплера (С) спостерігаємо кровотік у паренхімі яєчників із артеріальним потоком, що підтверджується на зображенні спектрального доплера (D). Перекрут лівого яєчника виявили під час лапароскопії.
Діагноз перекруту ніжки кісти яєчника становить приблизно 2,7 % від усіх невідкладних станів, які підлягають оперативному лікуванню у гінекології. Перекрут ніжки кісти яєчника найчастіше виникає у правих додатках, що скоріш за все пов’язано із браком місця у ділянці лівих додатків, через проекцію сигмоподібної кишки. Зазвичай у пацієнтів із перекрутом кісти яєчника виникає раптовий сильний біль у ділянці малого таза, після якого часто наступає повне полегшення. Однак, майже у 50% випадків перекручення придатків може бути частковим або інтермітуючим, супроводжуючись незначними або періодичними симптомами, притаманними також і для інших захворювань жіночих статевих органів.
Перекрут ніжки кісти яєчника найбільш характерний для жінок репродуктивного віку, проте зустрічається в усіх вікових групах. У 50-80% випадків у яєчниках виявляють новоутворення. Найчастіше вони є доброякісними і вважається, що запалення, злуковий процес або місцева інвазія злоякісного новоутворення запобігає перекрученню ніжки яєчника. Майже 20% випадків перекруту кісти пов’язані з вагітністю, найчастіше відбуваючись у першому триместрі або після пологів. Пацієнтки, які проходять процедуру симуляції овуляції, також мають підвищений ризик перекруту ніжки яєчника. Попереднє хірургічне втручання, особливо трубна стерилізація, також належить до факторів ризику перекруту ніжки кисти яєчника. У дітей із діагнозом перекруту ніжки кісти яєчника, яєчник у більшості випадків є нормальним, а факторами, які спричиняють перекрут, вважається слабкість власних зв’язок яєчника та раптова зміна внутрішньочеревного тиску.
Перекрут ніжки кісти яєчника може охоплювати яєчник, маткову трубу чи обох. При перекруті ніжки кісти відбувається лімфатичний застій, спричиняючи набряк яєчника та його збільшення. Подальше перекручення ніжки кісти яєчника призводить до венозної та артеріальної обструкції. Якщо не провести хірургічну декомпресію, то одразу після артеріальної обструкції розвивається некроз яєчника. Виявлено, що лікування на ранній стадії знижує ступінь ризику розвитку ускладнень, серед яких перитоніт та тромбоемболія легеневої артерії, та підвищує шанси зберегти яєчник. Проте не варто забувати, що у зв’язку із наявністю подвійного притоку крові до яєчника, перекрут однієї артеріальної системи може приховуватись або компенсуватись посиленням кровотоку у іншій артерії. Перекрут ніжки кісти яєчника у багатьох випадках може також бути періодичним або частковим, принаймні циклічно зберігаючи кровотік. Окрім того, у випадку хронічного перекручення ніжки кісти яєчника може з’явитись як венозний, так і артеріальний колатеральний кровотік.
Для огляду пацієнта із підозрами на діагноз перекруту ніжки кісти яєчника можна скористатись ультразвуковою діагностикою, яка вважається оптимальним методом візуалізації. Збільшені у розмірі яєчники із нечіткою та гетерогенною у центрі стромою та периферійним розміщенням у яєчнику малих фолікулів (див. Рис. 2) є найбільш характерним зображенням у В-режимі УЗД, яке, однак, не завжди спостерігається. Після некрозу ультразвукове зображення дуже змінюється, іноді нагадуючи геморагічну кісту або гематому, якщо паренхіма знаходиться цілком у розрідженому стані. Зазвичай при обстеженні візуалізується пухлиноподібний отвір і в меншій мірі паренхіма яєчника. Часто у малому тазі наявна незначна кількість вільної рідини. Збільшений у розмірі яєчник при обстеженні є чутливим та розташований атипово, в серединній позиції. Під час уважного огляду зони між яєчником та маткою можна виявити збільшену, набряклу фаллопієву трубу, яка при перехресному скануванні може нагадувати мішень із почергово розташованих гіпоехогенних та ехогенних кіл, перші з яких мають вигляд перекручених або обмотаних судин у набряклій ніжці кісти яєчника. Окрім того, ультразвукове обстеження відіграє важливу роль у виключенні інших причин появи болю у ділянці живота та малого таза, до яких належить розірвана або геморагічна кіста, тубооваріальний абсцес, апендицит та камені у сечоводі.
Хоча раніше вважалось, що відсутність кровотоку при доплерографічному огляді буде важливим специфічним симптомом перекруту ніжки кісти яєчника, проте симптоми у пацієнтів із перекрутом ніжки кісти яєчника, виявлені під час кольорової та спектральної доплерографії, варіюються, відображаючи як ступінь перекруту та тиску у перекрученій ніжці кісти яєчника та її хронічний чи періодичний характер, так і наявність подвійного кровопостачання до яєчника. Відсутність венозного чи артеріального кровотоку у новоутворенні придатків пов’язана із діагнозом перекруту ніжки кісти яєчника. Однак, якщо яєчник знаходиться глибоко по відношенню до ультразвукового променю, доплер може не відображати кровотік у нормальному яєчнику, із чим буде пов’язаний помилковий діагноз, який ґрунтується на висновках доплерографічного огляду. На зображенні кольорового доплера, судини у перекрученій ніжці кісти яєчника будуть позначені кольором (якщо не закупорені тромбом), створюючи так званий «симптом закрутки», тобто доплерівське зображення, аналогічне до симптому «мішені», описаного раніше. «Симптом закрутки» також визначають як специфічний симптом перекручення ніжки кісти яєчника. Однак, у багатьох випадках під час доплерівського ультразвукового обстеження було виявлено артеріальний та венозний кровотік у яєчнику, але під час хірургічного втручання виявлено перекрут ніжки кісти яєчника (див. Рис. 2). У випадку періодичного перекручення або скручення/розкручення швидкість кровотоку може тимчасово збільшуватись. Саме тому кровотік в судинах яєчника, який спостерігається при доплерівському обстеженні у пацієнта, симптоми на сірошкальному зображенні якого вказують на перекручення ніжки кісти яєчника чи інші серйозні клінічні проблеми, не повинен перешкоджати діагностиці перекруту ніжки кісти яєчника. Спірним залишається питання чи наявність артеріального та венозного кровотоку у яєчнику передбачає життєздатність яєчника під час хірургічного втручання.
ВИПАДОК 3: АРТЕРІОВЕНОЗНА ФІСТУЛА ТА ПСЕВДОАНЕВРИЗМА В ТРАНСПЛАНТОВАНІЙ НИРЦІ
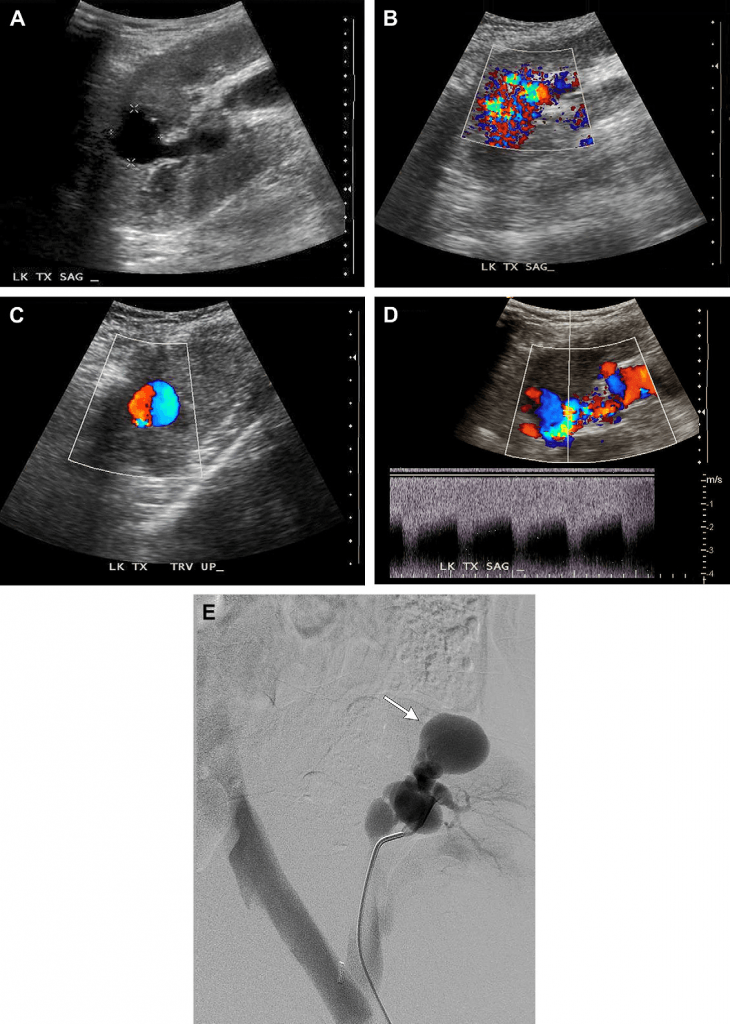
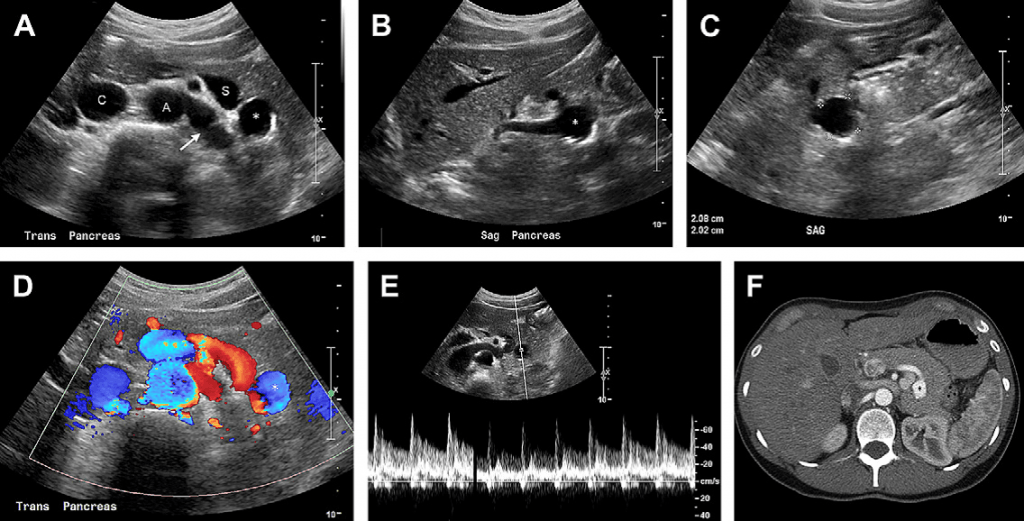
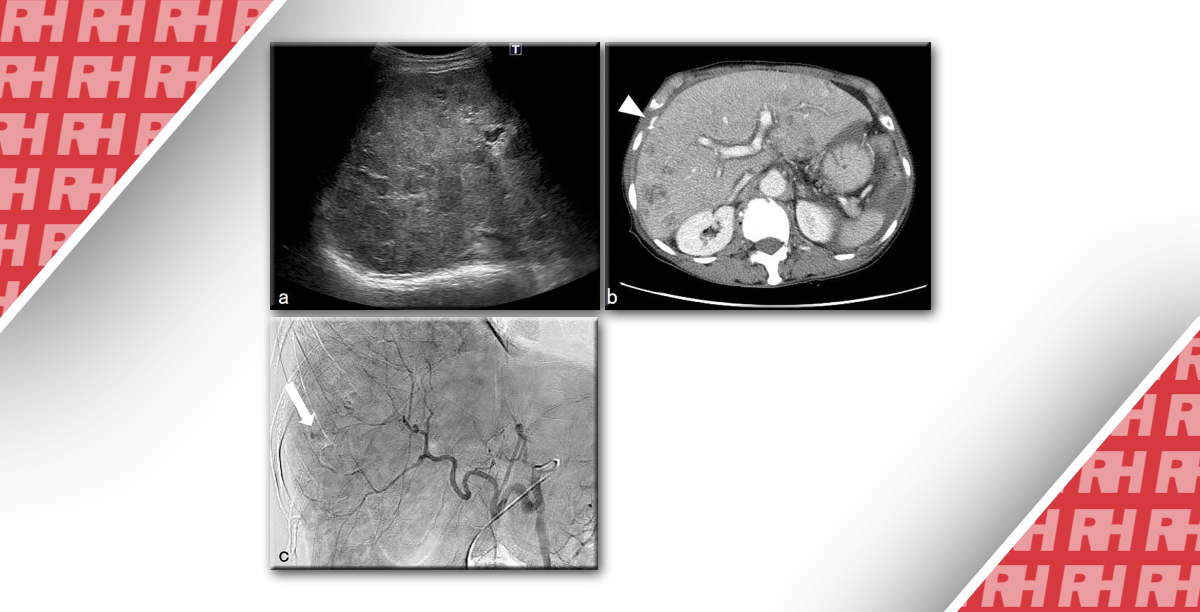
Випадок 3. У цього 73-річного чоловіка після трансплантації нирки наявні симптоми гематурії, яка проявилась після черезшкірної біопсії нирки, проведеної через підвищення рівня креатиніну. (А) На сірошкальному зображенні трансплантованої нирки видно анехогенне кругле утворення (каліпери) у корковій речовині нирки на рівні верхнього полюсу. У пацієнта після ниркової біопсії це скоріш за все псевдоаневризма (ПСА) або фокально розширена дренуюча вена з артеріовенозної фістули (АВФ). Зверніть увагу на трубчасте анехогенне утворення, яке потрапляє до цієї зони від ехогенного ниркового синусу, являючись або розширеною живильною артерією, або дренуючою веною. (В) На зображенні кольорового доплера видно кольоровий aliasing-ефект у фокальній зоні, що вказує на високошвидкісний кровотік у даній точці, та червоні і сині плями навколо, які позначають «шуми у м’яких тканинах», спричинені вібрацією (турбулентністю). Червоним та синім кольором позначено кровотік із нижчою швидкістю, що є характерним для «шумів у м’яких тканинах». Така сукупність симптомів притаманна як для АВФ, так і ПСА. (С) Зображення кольорового доплера після збільшення колориметричної шкали та фільтру руху стінок судин. «Шум у мяких тканинах» більше не реєструється, замість нього видно чергування кровотоку, позначене червоним та синім кольором – так званий кровотік у вигляді «інь-янь», характерний для ПСА. (D) На спектральному доплерівському зображенні не показано високошвидкісного руху крові «туди і назад», що зазвичай притаманно для шийки ПСА, а хвилю із посиленим систолічним та діастолічним кровотоком, характерну для АВФ. (Е) На ангіограмі видно як випинання ПСА (стрілка), так і розташований внизу клубок кровоносних судин із раннім венозним відтоком, що характерно для АВФ.
Артеріовенозна фістула (АВФ) це аномальне пряме сполучення між артерією та веною. Псевдоаневризма (ПСА) з’являється коли кров витікає через розрив у артеріальній стінці та оточується псевдокапсулою із компресованих навколишніх м’яких тканин. Як АВФ, так і ПСА є відомими ускладненнями біопсії нирок. Не зважаючи на те, що АВФ та ПСА є поширеними ускладненнями після черезшкірної біопсії, їх зазвичай діагностують окремо, а випадки виявлення суміжних АВФ та ПСА як у цього пацієнта є рідкісними.
Частота виявлення АВФ після ренальної біопсії сягає від 0,3% до 19% у власній нирці та від 6% до 8% у трансплантованій. Виявлення клінічно значимих АВФ після біопсії є помітно нижчим, якщо її проводять під прицільним контролем УЗД. АВФ, які з’являються після біопсії, зазвичай є безсимптомними та виявляються випадково. Однак, великі за розміром АВФ іноді можуть спричиняти біль у боці, макрогематурію, гіпертонію, хронічну серцеву недостатність та, зрідка, ниркову недостатність. Хоча симптоми найчастіше проявляються одразу після проведення біопсії, відомо також і про випадки пізніх проявів. Більшість клінічно значимих АВФ можна діагностувати за допомогою ультразвукового доплерівського обстеження. Посилення кровотоку через АВФ спричиняє вібрацію навколишніх м’яких тканин, що на зображенні кольорового доплерівського картування матиме вигляд фокальної кольорової мозаїки над суміжними м’якими тканинами, яку називають «шумом м’яких тканин» (див. Рис.3). Підвищені пікова систолічна та кінцева діастолічна швидкості, так званий низькорезистентний профіль кривої кровотоку (див. Рис. 3), будуть видимі на спектральних доплерівських зображеннях живильної артерії, а у дренуючій вені збільшиться швидкість кровотоку із пульсуючим профілем кривої. Малі АВФ можуть з часом розсмоктуватись. Однак симптомні, дуже великі за розміром або позаниркові АВФ зазвичай лікують за допомогою черезшкірної емболізації .
На УЗД у В-режимі ПСА має вигляд анехогенного круглого або мішкоподібного кістозного утворення, приєднаного до артерії, яке при обстеженні за допомогою кольорового допплерівського картування заповнюється кольором, нагадуючи «інь-янь» (див. Рис. 3). На сірошкальному зображенні тромб у ПСА показаний гіппоехогенним, а при скануванні у кольоровому режимі – безколірним. При обстеженні шийки ПСА за допомогою спектрального допплерівського обстеження зазвичай видно профіль кривої кровотоку «туди і назад», із рухом крові над ізолінією у напрямку ПСА під час систоли та під ізолінією у напрямку від ПСА під час діастоли, якщо шийка вузька. Якщо ж шийка широка, то спостерігаємо більш нерегулярну, безладну модель кровотоку. Більшість ПСА є безсимптомними. Можна спостерігати за малою ПСА, щоб виявити чи у ній відбувається спонтанний тромбоз. Однак через ризик можливого розриву ПСА із діаметром понад 2 см, зростаючі або позаниркові ПСА зазвичай лікують за допомогою черезшкірної емболізації. У лікуванні позаниркових ПСА перевага може надаватись стентуванню.
ВИПАДОК 4: ПОВІТРЯ У ВОРІТНІЙ ВЕНІ
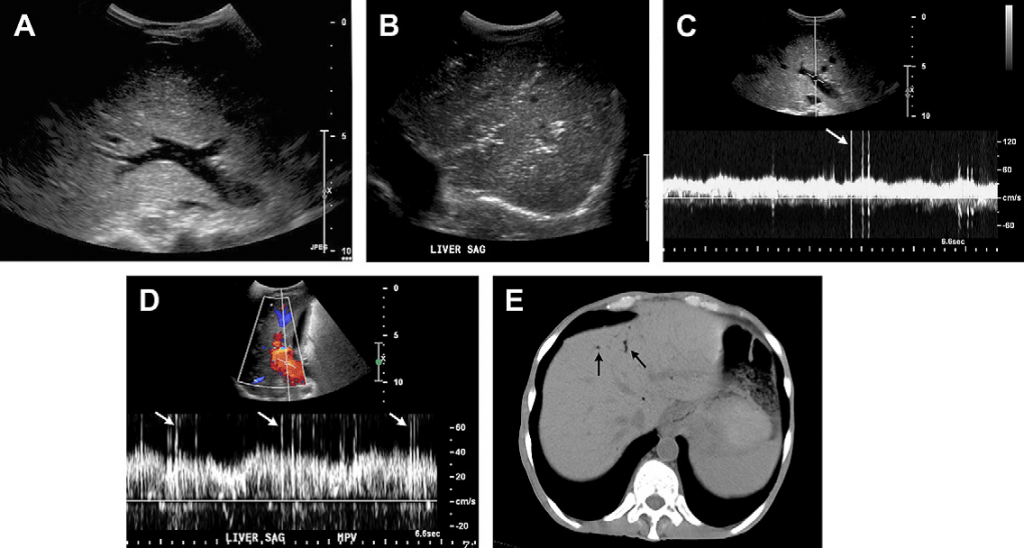
Випадок 4. 54-річний пацієнт після трансплантації нирок зі скаргами на біль у животі. (А) На УЗД-зображенні у В-режимі у повздовжньому зрізі ворітної вени видно крапкоподібні ехогенні фокуси у просвіті судини. Хоча вони можуть бути артефактами, при скануванні у режимі реального часу є можливість побачити їхній рух периферійно. (В) Сірошкальне зображення печінки показує гіперехогенні вогнища у паренхімі печінки, які у переважно лінійній формі простягаються до капсули печінки. Не спостерігається дистального затінення чи артефакту реверберації. Більша концентрація гіперехогенних вогнищ у просвіті менших судин, ближче до розгалуження ворітної вени (C, D) На зображеннях спектрального доплера, отриманих при дослідженні кровотоку у ворітній вені, видно пікоподібні артефакти (стрілки) внаслідок наявності пухирців повітря. Поява пікоподібних артефактів пов’язана із надзвичайно високою відбиваючою здатністю повітря. (Е) Обстеження за допомогою КТ підтверджує наявність повітря у периферійних ворітних венах печінки (стрілки). Цей пацієнт вживав преднізолон та мав помітно розтягнену товсту кишку, що пов’язано копростазом, без видимих ознак ішемії кишечнику на КТ. Після очистки кишечнику стан пацієнта покращився.
Наявність газу у ворітній вені є рідкісним, проте клінічно значимим симптомом, виявленим під час рентгенівського обстеження, що виступає передвісником ішемічної хвороби кишечнику, та потребує негайного хірургічного втручання. Вперше його опис на рентгенівських знімках живота 6 новонароджених, які померли через некроз кишечнику, здійснили у 1955 році Wolfe та Evans. Майже у 50% випадків окрім газу у ворітній вені у пацієнтів також діагностують пневматоз кишечнику або газ у його стінках. Вважається, що повітря із стінок кишки потрапляє у дренуючі вени у брижі кишечнику та проходить до системи ворітної вени; таким чином, пневматоз кишечнику та повітря у ворітній вені разом демонструють прогресування у розвитку одного і того ж процесу. Серйозні, небезпечні для життя наслідки можуть викликати бактеріальний коліт/некротичний ентероколіт, ішемія/інфаркт кишечнику (особливо товстої кишки), заочеревинний або внутрішньоочеревинний абсцес, інфікований жовчний міхур, абсцес печінки, некротичний панкреатит та злоякісні пухлини у кишечнику. Наявність повітря у ворітних венах характерна також і для більш доброякісних процесів, серед яких розтягнення кишечнику (особливо шлунку та товстої кишки), запальне захворювання кишечнику, виразка шлунка, недавні медичні втручання/операції та емфізема. Рідко наявність повітря в портальній та печінковій венозній системі при ультразвуковій діагностиці у абсолютно асимптомних пацієнтів без видимих захворювань кишечнику, можлива внаслідок турбулентності або підвищеної швидкості кровотоку у судинах.
Не сірошкальному ультразвуковому зображенні у режимі реального часу видно, як крихітні фокуси із високою відбиваючою здатністю, які представляють пухирці повітря у ворітній вені, рухаються периферійно. Гіперехогенні вогнища лінійної форми без дорзального затемнення в периферії паренхіми печінки також можна побачити при поширенні повітря в портальній венозній системі до капсули печінки. Фокуси із високою відбиваючою здатністю зустрічаються у менш чітко відокремлених зонах, коли повітря поширюється у паренхіму печінки через невеликі розгалужені канали ворітних вен [43,44]. На зображенні спектрального імпульсного доплера видно пікоподібні сигнали, накладені на спектр кровотоку ворітної вени, що пов’язано із дуже високою відбиваючою здатністю повітряних бульбашок у ворітній вені. Коли при ультразвуковому обстеженні діагностують або підозрюють наявність повітря у ворітній вені, для верифікації діагнозу рекомендується провести КТ, адже цей стан може бути небезпечним для життя. Проте, висновки декількох досліджень показують, що УЗД є більш чутливим методом у діагностиці наявності газу у ворітній вені, аніж КТ. Якщо наявність газу у ворітній вені не підтверджується при подальшому КТ-скануванні, виявлений симптом скоріш за все є доброякісним або випадковим.
Потрібно диференціювати наявність повітря у ворітній вені та у жовчних протоках. На сірошкальних зображеннях повітря у внурішньопечінкових та позапечінкових жовчних протоках має вигляд ехогенних фокусів у різних частинах печінки, які у межах портальної тріади мають лінійну конфігурацію. Можна часто спостерігати дистальне затемнення або артефакт реверберації, які займають центральне положення поблизу ворітної вени, на відміну від газу у ворітній вені, для якого характерне периферійне розміщення. Ехогенність повітря у жовчних протоках часто є вищою, ніж у ворітній вені, що скоріш за все пов’язано зі статичністю повітря у зовнішніх протоках та більшою схильністю до накопичення, а не дифузії у паренхіму печінки. Шанси побачити паренхіматозні зони із підвищеною ехогенністю у пацієнтів із повітрям у жовчній протоці є незначним. Окрім того, ехогенні фокуси у жовчних протоках зазвичай є статичними, із рідкісними випадками зміщення, які спостерігаються при зміні положення тіла пацієнта.
ВИПАДОК 5: РОЗШАРУВАННЯ АОРТИ
Випадок 5. У 57-річного чоловіка раптово з’явився сильний біль у спині. (А) На сагітальному зрізі (SAG) аорти (АО) у сірошкальному режимі видно ехогенний клапоть у просвіті, поява якого пов’язана із розшаруванням аорти. Зверніть увагу, що аорта не є розширеною. (В) На поперечному зрізі аорти у режимі сірої шкали видно ехогенний клапоть інтими. Верхня брижова артерія (SMA) (стрілка). (С) На кольоровому доплерівському зображенні спостерігаємо, що обидва просвіти є розкритими, хоча несправжній просвіт, який знаходиться позаду, не позначений кольором, що пов’язано із наявністю тромбу (стрілка). (D) На зображеннях спектрального доплера видно нормальний високорезистентний профіль кривої кровотоку у справжньому просвіті. Однак, зверніть увагу на збільшену пікову систолічну швидкість – ПСШ (215 см/с), пов’язану зі звуженням справжнього просвіту. (Е) Спектральне доплерівське зображення несправжнього просвіту показує аномальний профіль кривої кровотоку із зниженою ПСШ.
Розшарування аорти починається із розриву інтими стінки аорти та потрапляння крові у м’язовий шар стінки судини через прорив, відділяючи інтиму від оточуючого її м’язового шару (медіа) та/або від зовнішньої еластичної мембрани (адвентиції), утворюючи несправжній просвіт. Розшарування може поширюватись дистально та/або проксимально по відношенню до місця розриву, включаючи гілки аорти та аортальний клапан, дозволяючи крові потрапити у просвіт перикарда. Із цим процесом пов’язані численні клінічні прояви, серед яких ішемія (коронарна, церебральна, спінальна або вісцеральна), аортальна недостатність та тампонада серця. Несправжній просвіт може живити гілки аорти. Тому, якщо несправжній просвіт буде закупорено, подібне може статись із судинами, які розгалужуються від аорти, також. Розшарування аорти зазвичай починаються у грудному відділі аорти, проте можуть також досягати черевного відділу аорти. Рідко трапляється, що розшарування аорти відбувається лише у черевному відділі аорти. Серед чинників, які сприяють виникненню розшарування аорти, можна виділити гіпертонію, атеросклероз, попередню аневризму аорти, васкуліт, колагенові судинні захворювання (наприклад синдроми Елерса-Данлоса та Марфана), травми, двостулковий аортальний клапан, коарктацію аорти, кокаїнову залежність та інтенсивні силові тренування. Розшарування аорти можна діагностувати у пацієнта із клінічними проявами раптових нападів гострого чи ріжучого болю у грудях або животі, змінами у периферійному пульсі (нд., відсутність пульсу у верхніх кінцівках чи у сонній артерії) або різницею між систолічним тиском правої та лівої руки більш, ніж на 20 мм рт. ст., та розширенням середостіння, видимим на рентгенівському зображенні грудної клітки.
В умовах невідкладної терапії перевага надається КТ грудної клітки. Черезстравохідна ехокардіографія (ЧСЕ) та магнітно-резонансне сканування також підходять для обстеження гемодинамічно стабільних пацієнтів. Особливо важливо швидко ідентифікувати характер розшарувань у висхідній аорті (тип А Стенфордської класифікації), які визначаються як такі, що потребують негайного хірургічного втручання. Для порівняння, розшарування у низхідній аорті (тип В по Стенфордській класифікації) мають більше шансів бути гемодинамічно стабільними та зазвичай лікуються медикаментозно.
Не зважаючи на те, що ультразвукова діагностика не є оптимальним методом діагностики при підозрі наявності у пацієнта розшарування аорти у грудній клітці, проте розшарування у черевному відділі аорти легко візуалізувати за допомогою ультразвуку. Виявлення у В-режимі ехогенного клаптю відшарованої інтими у просвіті судини вказує на наявність розшарування. При скануванні у режимі реального часу даний клапоть може бути рухомим. За умови, що один із просвітів закупорений тромбом, всередині може з’явитись ехогенний сигнал. За допомогою кольорової доплерографії можна визначити чи є обидва просвіти незаповненими. На зображенні спектрального доплера можна побачити розходження між хвилею кровотоку у справжньому та несправжньому просвіті, з характерною для несправжнього просвіту зниженою швидкістю та атиповим виглядом хвилі кровотоку. Необхідно ретельно перевірити місце розгалуження черевного стовбура, верхньої брижової артерії та ниркових артерій у черевній порожнині, щоб визначити чи немає там розшарування. Поширення розшарування на ці судини може спричинити їхній стеноз або тромбоз.
ВИПАДОК 6: АНЕВРИЗМА СЕЛЕЗІНКОВОЇ АРТЕРІЇ
Випадок 6. У цієї 40-річної жінки є скарги на біль у лівому верхньому квадранті живота. (А) На поперечному зрізі у В-режимі видно анехогенне утворення (зірочка), яке знаходиться за підшлунковою залозою та селезінковою веною (S). А, аорта; С, нижня порожниста вена. Ліва ниркова вена (стрілка). На сагітальному зрізі у В-режимі (В) видно, що це утворення (зірочка) з’єднане із селезінковою артерією. (С) У В-режимі видно, що стінки даного утворення (каліпери) є ехогенними та з кальцинатами. (D) На кольоровому доплерівському зображенні видно аневризму селезінкової артерії, заповнену кольором (зірочка). (Е) На спектральному доплерівському зображенні показано артеріальний профіль хвилі кровотоку. (F) Контрастне КТ зображення показує аневризму селезінкової артерії (зірочка).
Аневризма селезінкової артерії (АСА) є найпоширенішою аневризмою вісцеральних артерій. Існує зв’язок між АСА та портальною гіпертензією, тому ризик захворювання у таких пацієнтів може досягати 7,1% у порівнянні із 1,6% серед населення взагальному. АСА також пов’язана із фіброзно-м’язовою дисплазією та іншими типами васкуліту, панкреатитом (часто псевдоаневризмами), атеросклерозом, гіпертонією, автоімунними чи колагеновими судинним розладами, травмами та зловживанням внутрішньовенними наркотиками (грибковими). АСА вчетверо більш поширені серед жінок, ніж чоловіків, і до 95% частіше відбуваються під час вагітності. Часті випадки вияву симптомів АСА у вагітних жінок пов’язані із гормональним впливом, або із шунтуванням крові у селезінкову артерію. Найбільш критичним ускладненням АСА є її розрив, який відбувається у 3-10% випадків. Розрив під час вагітності супроводжуються непропорційно високими показниками смерті матерів та плодів. Феномен подвійного розриву, вперше описаний Brockman, характерний у 20-25% випадків. За даного клінічного сценарію стан пацієнтів із симптомами раптового нападу болю у животі, гіпотонією та втратою свідомості, у більшості випадків швидко покращується завдяки переливанню крові, яке проводять після того як, сальник або тромб закупорює сальникову сумку, яка оточує АСА. Вважається, що це тимчасове закупорювання підвищує шанси пацієнта вижити, адже з’являється додатковий час для діагностування та відповідного лікування. Однак, у межах двох діб після латентного періоду відбувається прорив у очеревину та раптовий розвиток серцево-судинної недостатності. До інших виражених симптомів можна включити біль у животі та спині, симптом Кера (біль у лівому плечі, спричинений подразненням діафрагми) та гемодинамічну нестабільність, яка з’являється після розриву. У рідкісних випадках може відбутись інфаркт селезінки. Однак, діаметр більшості АСА не перевищує 2,5 см, а новоутворення такого розміру зазвичай є безсимптомними і виявляються випадково. Розриви АСА із діаметром менше 2,5 см є дуже рідкісним явищем.
Більшість АСА є поодинокими (71%) та мішкоподібної форми (80%), вони розташовані у середній чи дистальній частині селезінкової артерії (80%), найчастіше біля воріт селезінки. Хірургічна реконструкція судин залишається найбільш оптимальним методом лікування. Однак, черезшкірна емболізація або стентування проводяться все частіше, не зважаючи на те, що довготривалість ефекту черезшкірної терапії поки не доведено. Лікування слід розпочинати за наявності симптомів/розриву, у випадку вагітності чи наміру завагітніти, при збільшенні розміру АСА до двох чи більше см. Безсимптомні АСА із діаметром менше 2 см підлягають вибірковому видаленню, або уважному моніторингу. Можливий ризик при вибірковому видаленні є низьким із мінімальною смертністю. Якщо є змога, слід зберегти селезінку, а спленектомія застосовується при аневризмі, виявленої у воротах селезінки або під час екстрених ситуацій.
Якщо АСА є кальцинованою, це можна виявити на рентгенівських знімках живота або зображеннях КТ. На контрастному КТ-зображенні незаповнена АСА візуалізується як випинання селезінкової артерії. Якщо АСА заповнена тромбом, а стінка не кальцинована, її може бути складно виявити через схожість на лімфатичні вузли та брижові вени. Хоча АСА найчастіше діагностують при КТ-скануванні, за допомогою ультразвуку можна неінвазивно та недорого проводити моніторинг зміни розміру АСА без іонізуючого випромінювання. У зв’язку із цим під час вагітності перевага у діагностуванні надається дуплексній доплерографії. При ультразвуковій діагностиці АСА може мати вигляд анехогенного випинання селезінкової артерії на сірошкальному зображенні, яке під час кольорової допелрографії буде заповнене кольором. Якщо стінка кальцинована, вона буде візуалізуватись як гіперехогенне утворення із дистальним затемненням. Якщо АСА закупорена тромбом, буде виявлено низькорівневі ехо-сигнали та відсутність кровотоку на зображенні кольорового доплера. У ході ультразвукової діагностики також легко виявити вільну рідину чи гемоперитонеум, які з’являються після розриву. Обмеження можливостей ультразвукової діагностики залежить від лікаря та від ступеню затухання ультразвукових хвиль, які проходять через жирову тканину та/або газ у кишечнику. Саме тому у зв’язку із затіненням від газу у кишечнику навіть найкращий спеціаліст не зможе виявити усі середні або центральні АСА. Достатньо складною може бути ідентифікація сильно кальцинованих АСА. Не зважаючи на те, що стандартне проведення скрінінгу усіх вагітних пацієнток не є практичним, адже відсоток виявлених АСА низький, дехто схиляється до думки, що обстеження груп із високим ризиком може дати позитивні результати.
ВИПАДОК 7: КОАРКТАЦІЯ АОРТИ У ВИГЛЯДІ СТЕНОЗУ НИРКОВОЇ АРТЕРІЇ
Випадок 7. Цей 11-річний хлопчик страждає від гіпертонії. На кольорових доплерівських зображеннях правої (А) та лівої (В) ниркової артерії видно зменшення величини пульсової хвилі або криву tardus parvus (parvus – низька швидкість, tardus – сповільнене наростання швидкості), в обох випадках пов’язані із проксимальним стенозом. Крива tardus parvus настільки яскраво виражена, що за профілем майже нагадує венозний кровотік. Проте, зверніть увагу на зображення нормальної лівої ниркової вени (синя, кровотік від нирки), яка іде паралельно із нирковою артерією (червона, кровотік до нирки), на кольоровому доплерівському картуванні. (В) У місці відходження ниркової артерії не виявлено підвищення швидкості. Подібну форму хвилі помічено у аорті вище відходження ниркових артерій. (С) Саме тому стеноз повинен бути проксимальніше до черевної аорти. У хлопця діагностували коарктацію аорти.
Ультразвук часто використовують для оцінки стенозу ниркової артерії (СНА). Нирка може бути зменшена у розмірах із підвищеною ехогенністю або стоншенням коркової речовини нирки, спричиненим хронічною ішемію.
На зображенні кольорового доплера можна спостерігати aliasing-ефект в ділянці стенозу ниркової артерії. До виявлених на спектральному допплерівському зображенні симптомів, які дозволяють діагностувати СНА (>60%), належить збільшення пікової систолічної швидкості у нирковій артерії від 180-200 см/с і вище, співвідношення між ПСШ у нирковій артерії та у аорті на рівні ниркових артерій вище, ніж 3,0 до 3,5, постстенотичне спектральне розширення та сповільнення систолічного прискорення на спектральній кривій кровотоку сегментарних або міждольових артерій, показане на ультразвуковому зображенні. Сповільнене систолічне прискорення вказує на проксимальний стеноз. Проте, це не є специфічним симптомом, адже точний рівень стенозу визначити неможливо, за винятком того, що він є більш проксимальним до точки передачі сигналу. Сповільнення систолічного прискорення можна вирахувати, вимірявши час прискорення (ЧП), тобто проміжок часу від початку систоли до моменту наближення до пікасистолічної швидкості, або індекс прискорення (ІП), який являє собою криву, що з’єднує початок систоли із моментом наближення до пікасистолічної швидкості. Аномальними вважаються ЧП тривалістю більше 70 мілісекунд та ІП менше 3 мс². І навпаки, підвищення систолічної швидкості можна суб’єктивно оцінити, дивлячись на криву tardus parvus, для якої характерний повільний рух вгору (tardus) та повільний, округлий (parvus) систолічний пік. Коли атеросклероз спричиняє вазоренальну гіпертензію, у вихідній або проксимальній точці норкової артерії, чи, рідше, у місці розгалуження, виявляється звуження. Якщо вазоренальну гіпертензію спричинила фіброзно-м’язова дисплазія, уражається ділянка від середини до дистальної частини ниркової артерії із можливою появою симптому «намиста».
Деякі дослідники дійшли висновку, що у випадку зниженої швидкості кровотоку у аорті (нд., сповільнене скорочення серцевого м’язу) та ПСШ у аорті, яка не перевищує 40 см/с, показник ПСШ у нирковій артерії буде штучно завищеним. І навпаки, у випадку серйозних ознак атеросклерозу або гіпертонії у черевній аорті та ПСШ у аорті, яка перевищує 100 см/с, показник ПСШ у нирковій артерії буде помилково заниженим. За таких умов у якості основного чинника, який визначає клінічну значимість СНА, слід використовувати показник ПСШ, який перевищує 200 см/с та постстенотичну турбулентність у нирковій артерії. Однак все ще необхідно довести, чи можна використовувати однаковий абсолютний показник ПСШ у випадку значно збільшеної чи зменшеної швидкості кровотоку у аорті.
Крива «tardus parvus» у інтрапаренхімальних ниркових артеріях не є специфічним симптомом стенозу ниркової артерії, проте може вказувати на наявність більш проксимального стенозу у аорті або навіть на рівні аортального клапану. У таких випадках, щоправда, профіль кривої «tardus parvus» є показником, виявленим у обох ниркових артеріях. До причин звуження аорти відносять коарктацію, синдром Вільямса, нейрофіброматоз, заочеревинний фіброз та деякі види васкуліту. У пацієнтів із коарктацією аорти крива «tardus parvus» буде виявлена у черевній та у обох ниркових аортах. Для діагностування стенозу ниркової артерії слід використовувати критерії ПСШ та показник ПСШ ниркової артерії, не посилаючись на аналіз інтрапаренхімального профілю кровотоку.
Отож, крива «tardus parvus» може з’явитись завдяки стенозу у будь-якій точці, проксимальній до обстежуваної артерії. Якщо у обох інтрапаренхімальних ниркових артеріях виявлено криву «tardus parvus», слід звернути увагу на зону у аорті чи аортальному клапані, більш проксимальну до ниркових судин. Також важливо пам’ятати, що коарктація аорти, нейрофіброматоз та синдром Вільямса можуть спричинити вторинну гіпертензію, зокрема у дітей. Аномальний профіль кривої кровотоку у ниркових артеріях дорослих можуть бути пов’язані із стенозом аорти, розшаруванням аорти, значним атеросклерозом та, у рідкісних випадках, із заочеревинним фіброзом.
ВИПАДОК 8: АСИМЕТРИЧНІ ПРОФІЛІ КРИВИХ КРОВТОКУ У ЛІВІЙ ТА ПРАВІЙ ПЕЧІНКОВІЙ АРТЕРІЇ
Випадок 8. У цієї 54-річної жінки виявлено сепсис, спричинений численними абсцесами печінки. (А) На спектральному доплерівському зображенні печінкової артерії (ПА) видно криву «tardus parvus», пов’язану із проксимальним стенозом. У правій печінковій артерії було виявлено схожий профіль кривої кровотоку (не показано). Однак, на спектральному зображенні лівої печінкової артерії (ЛПА) (В) видно нормальний гострий систолічний комплекс (+). Під час ангіографії було виявлено стеноз довгого відрізка загальної печінкової артерії із відходження лівої ниркової артерії від лівої шлункової артерії.
Даний варіант анатомії печінкової артерії є поширеним явищем, із чисельністю зареєстрованих випадків від 23% до 45%. Обстеживши 180 пацієнтів, Jones та Hardy довели, що ліва печінкова артерія виходить із стовбура загальної печінкової артерії у 80% випадків, з лівої шлункової артерії у 15% випадків, від селезінкової артерії у 2% випадків, із гастродуоденальної артерії у 1% й ще рідше з аорти, черевного стовбура та верхньої брижової артерії (ВБА). Права печінкова артерія (ППА) виходить із головного стовбура загальної печінкової артерії у 75% випадків, від ВБА у 18%, з гастродуоденальної артерії у 6% та від правої шлункової артерії чи аорти у 1,6% випадків. Підрахували, що частота відходження лівої печінкової артерії (ЛПА) від лівої шлункової артерії складає 10%, а відходження ППА від ВБА – 11 % (тип ІІ та ІІІ класифікації анатомії печінкової артерії Michel, відповідно). Подібні варіанти анатомії можуть мати серйозні наслідки під час хірургії, у зв’язку із чим рентгенологу важливо знати про їх наявність. Хоча одразу візуалізувати вроджені зміни місць походження печінкових артерії може виявитись складно, на їх наявність може вказати асиметричність профілів кривих кровотоку у печінці.
ВИПАДОК 9: АРТЕРІОВЕНОЗНА МАЛЬФОРМАЦІЯ ПЕЧІНКИ
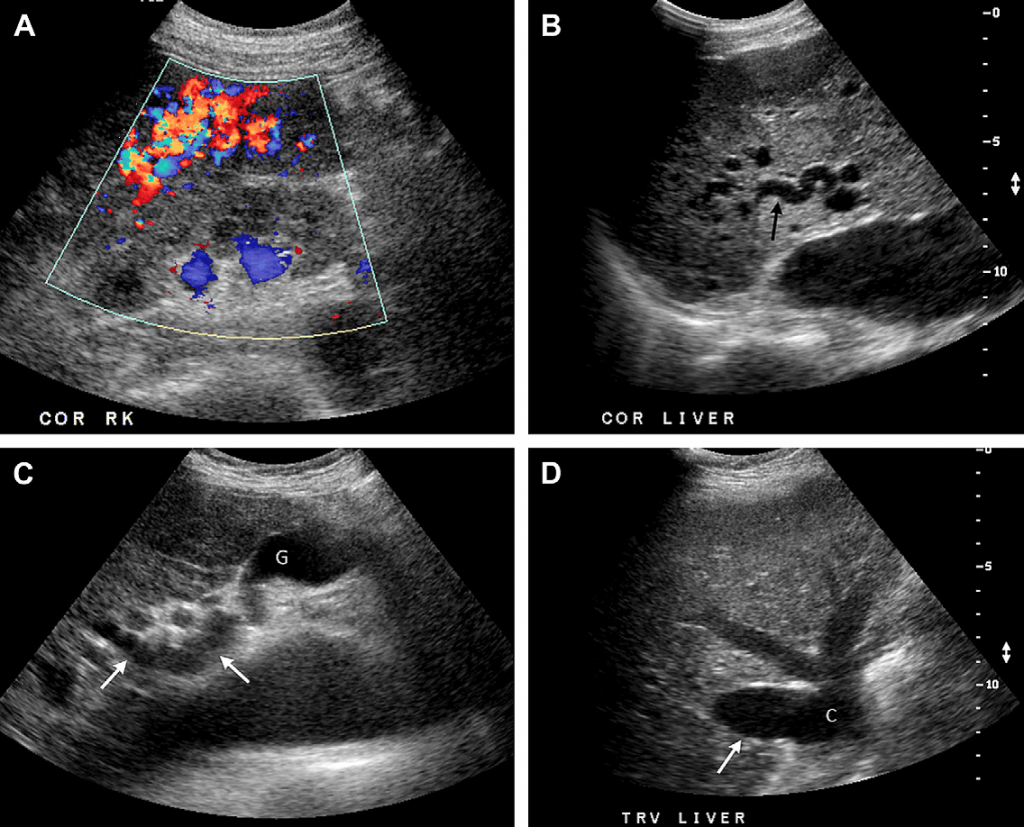
Випадок 9. У цієї 48-річної жінки діагностовано спадкову геморагічну телеангіектазію (СГТ) та скарги на біль у правому верхньому квадранті. (А) На кольоровому доплерівському зображенні правої долі печінки видно клубок збільшених судин, пов’язаний із артеріовенозною мальформацією. COR, коронарний; RK, права нирка. Більш центральне УЗД-зображення у В-режимі (В) показує збільшену живильну артерію (стрілка). УЗД-зображення «воріт» печінки у В-режимі (С) показує збільшену звивисту печінкову артерію (стрілки). G, жовчний міхур. (D) Зверніть увагу на значно збільшену дренуючу праву печінкову вену (стрілка) у порівнянні із нормальними середньою та лівою печінковими венами. С, нижня порожниста вена.
Дифузні артеріовенозні мальформації печінки (АВМ) можна спостерігати у випадку прояву спадкової геморагічної телеангіектазії (СГТ), відомої також як хвороба Ослера-Вебера-Рандю. Частота проявів АВМ печінки у пацієнтів із діагнозом СГТ досягає від 8% до 31%. Не зважаючи на безсимптомний перебіг, ураження печінки може спричинити серцеву недостатність з високим викидом. У рідкісних випадках шунтування крові призводить до некрозу жовчного міхура, абсцесу печінки або навіть до портальної гіпертензії. До інших причин утворення артеріовенозних фістул (АВФ) та АВМ належать травми печінки, вроджені аномалії, цироз печінки, синдром Бадда-Кіарі та новоутворення.
До симптомів, виявлених при сонографічному обстеженні пацієнтів із діагнозом СГТ та АВМ печінки, відносять великі живильні артерії, пульсуючий венозний кровотік, наявність численних розширених звивистих трубчастих утворень у паренхімі печінки та великі дренуючі вени. Розширена загальна печінкова артерія у печінково-дуоденальній зв’язці та «ворота» печінки можуть нагадувати розширені жовчні протоки на сірошкальному зображенні. Однак, на зображенні кольорового доплера кровотік у збільшених звивистих артеріях позначено кольором. При спектральному доплерографічному скануванні у зоні АВМ може виявитись спектральне розширення, а у живильних артеріях – високошвидкісний кровотік та низькорезистентний профіль кривої кровотоку. Аналіз дренуючої вени показує артеріалізований профіль кривої кровотоку під час систоли та відсутність дихальної фазності. Спектральна та кольорова доплерографія також може бути корисною для моніторингу пацієнтів після лікування шляхом емболізації або для виявлення печінкових аномалій у родичів пацієнтів із діагнозом СГТ.
ВИПАДОК 10: ЕМБОЛІЯ НИРКОВОЇ АРТЕРІЇ
Випадок 10. 65-річна жінка із симптомами гострого болю у боці та нирковою недостатністю. У неї діагностували каміння і тому відправили у відділення інтервенційної радіології для проведення нефростомії та можливого стентування. Однак на зображенні кольорового доплера не було виявлено симптомів гідронефрозу (А). Окрім того, у нирковому синусі чи у корковій речовині не спострегається артеріальний кровотік. (В) Поперечне кольорове доплерівське зображення аорти (А) ліва ниркова артерія (стрілки). Ангіограма підтвердила оклюзію лівої ниркової артерії (стрілка) (С).
У пацієнтів тромбоемболія ниркової артерії зазвичай проявляється появою гострого болю у боці. Рання діагностика та лікування за допомогою антикоагулянтів, фібринолітичних засобів чи емболектомія має вирішальне значення для запобігання безповоротного ушкодження нирок. Оклюзія ниркової артерії може відбуватись у зв’язку із прогресуванням атеросклерозу від стенозу до повного закупорювання; емболічними ускладнення при травмі, розшаруванням аорти чи серцевою недостатністю; та у якості ускладнення після хірургічної операції чи ангіопластики/стентування ниркової артерії (зазвичай після розшарування, розриву чи крововиливу у бляшку). Серце є джерелом емболів в артеріальній системі артеріальної емболії у 94% пацієнтів. Чотири основні причини виникнення системної емболії включають миготливу аритмію, гострий інфаркт міокарда (постінфарктні тромби зазвичай у аневризмах шлуночка), протезні клапани та ревматичний мітральний стеноз. До менш поширених чинників появи системної емболії належить атріальна міксома, бактеріальний ендокардит, та атероматозна речовина з аневризми чи бляшки. Лише 2-3% емболів периферійних артерій уражають нирки. Однак, емболи є найпоширенішою причиною виникнення сегментарного інфаркту нирки.
Діагностування гострої реноваскулярної оклюзії часто являється складним та потребує високого ступеня клінічної настороженості. Її слід запідозрити, коли одразу після маніпуляцій із аортою чи нирковою артерією з’являється гостра ниркова недостатність, особливо якщо видно симптоми позаниркових тромбоемболічих проявів. При виникненні інфаркту нирок можна спостерігати збільшений рівень сироваткової лактатдегідрогенази.
На сірошкальному зображенні одразу не можна виявити аномальні симптоми. Однак на кольоровому енергетичному доплерівському зображенні буде показано відсутність кровотоку у корковій речовині нирки та у нирковій артерії. З часом нирка зменшиться у розмірі, а коркова речовина нирки стане тонкою та гіперехогенною. На ультразвуковому зображенні фокальні чи сегментарні інфаркти нирок можуть бути або гіперехогенними, або гіпоехогенними. Врешті, зони паренхімального некрозу можуть стати кістозними. Фокальні інфаркти зазвичай мають клиноподібну форму та легко ідентифікуються, проте можуть ставати більш округлими із нечіткими межами. На енергетичному кольоровому доплерівському зображенні, шляхом чіткої візуалізації навколишніх тонких маленьких судин у нормально перфузованій нирковій паренхімі можуть виявити фокальні дефекти перфузії.
УЗД апарат Toshiba Aplio XG – тільки кращі пропозиції від компанії RH.