Резюме
Гліобластома (ГБМ) – це агресивний тип раку, який виникає в клітинах, що називаються астроцитами, які підтримують функціонування нервових клітин. Він може розвиватися як в головному, так і в спинному мозку і також відомий як мультиформна гліобластома. Гліобластома – це високоагресивний рак, який може виникнути як в головному, так і в спинному мозку. Виявлення ГБМ в біологічних рідинах пропонує потенційні переваги над існуючими методами діагностики та моніторингу лікування гліальних пухлин. Виявлення ГБМ за допомогою біологічних рідин фокусується на визначенні пухлинних біомаркерів у крові та спинномозковій рідині. На сьогоднішній день для виявлення біомаркерів ГБМ використовуються різні методи, починаючи від різних методів візуалізації і закінчуючи молекулярними підходами. Кожен метод має свої сильні та слабкі сторони. Цей огляд має на меті ретельний аналіз різних методів діагностики ГБМ, з акцентом на протеомічних методах і біосенсорах. Іншими словами, це дослідження має на меті надати огляд найбільш значущих результатів досліджень, заснованих на протеоміці та біосенсорах для діагностики ГБМ.
Вступ
Гліобластома – найпоширеніша та найагресивніша первинна злоякісна пухлина головного мозку у дорослих. У 2016 році Всесвітня організація охорони здоров’я (ВООЗ) класифікувала гліоми на три основні типи на основі гістологічних підходів: астроцитома, олігодендрогліома та епендимома [1, 2]. Фактори ризику розвитку ГБМ майже не піддаються визначенню, а клінічний перебіг, як правило, фатальний [3, 4]. Діагноз ґрунтується на гістопатологічних даних, але оцінка молекулярних маркерів, таких як метилювання промотора О6-метилгуаніл-ДНК-метилтрансферази (МГМТ) та ізоцитратдегідрогенази (ІДГ), а також ширше молекулярне профілювання можуть бути прогностично важливими [3, 4]. Вторинні ГБМ виникають з анапластичної астроцитоми або дифузної астроцитоми низького ступеня злоякісності і зустрічаються у молодих пацієнтів. Вони мають низький ступінь некрозу, локалізуються переважно в лобовій частці і мають значно кращий прогноз порівняно з первинними ГБМ [5, 6]. Хоча первинна і вторинна гліобластома майже не відрізняються гістологічно, вони мають різні генетичні та епігенетичні профілі [5,6,7].
Було зроблено кілька неповних і остаточних спроб виявити специфічні асоціації між ГБМ та професійним впливом і факторами навколишнього середовища. Іонізуюче випромінювання є одним з небагатьох ідентифікованих факторів ризику, який чітко вказує на підвищений ризик розвитку гліоми [8, 9]. Радіаційно-індукована ГБМ , як правило, спостерігається через роки після терапевтичного опромінення з приводу іншого захворювання або пухлини. Інші впливи навколишнього середовища, такі як пестициди, ПВХ, паління, нафтопереробка та виробництво синтетичного каучуку, неточно пов’язані з розвитком гліоми [10]. Клініка вперше діагностованої ГБМ суттєво відрізняється залежно від локалізації та розміру пухлини, а також анатомічних особливостей ураженого мозку [11]. Пацієнти часто мають симптоми внутрішньочерепної гіпертензії, включаючи локалізовані або прогресуючі неврологічні дефекти та головний біль [11].
Рання діагностика ГБМ може включати магнітно-резонансну томографію (МРТ) або комп’ютерну томографію (КТ) [12]. МРТ з гадолінієвим контрастом висвітлює майже всі ГБМ, виявляючи утворення неправильної форми з гіпоінтенсивними некротичними центрами і щільними кільцями просвітлення [12]. Некроз є характерною ознакою ГБМ, і його наявність необхідна для віднесення пухлини головного мозку до IV ступеня або ГБМ за класифікацією ВООЗ [12]. Лікування вперше діагностованого ГБМ вимагає міждисциплінарного підходу. Сучасний стандарт лікування передбачає максимально безпечне хірургічне видалення пухлини з подальшою комбінованою променевою терапією з темозоломідом (ТМЗ), пероральним алкілуючим хіміопрепаратом, та ад’ювантною хіміотерапією з ТМЗ. Однак комплексна і повна хірургічна резекція ГБМ є складним завданням, оскільки ці пухлини часто є інвазивними і розташовуються в важливих ділянках мозку, які контролюють рухи, мову і відчуття. Це дослідження має на меті підтвердити останні досягнення у виявленні ГБМ – від методів візуалізації до протеоміки та біосенсорів.
Біомаркери та методи виявлення ГБМ
Для різних типів пухлин використовуються різні біомаркери. При ГБМ зазвичай використовують нуклеїнові кислоти, білки, малі молекули, мікроРНК, циркулюючі пухлинні клітини (ЦПК), позаклітинні везикули, пухлинні тканини та рідини організму [13,14,15]. Виявлення гліальних пухлин за допомогою біологічних рідин пропонує кілька підходів до поліпшення якості життя пацієнтів з ГБМ [16]. Раннє виявлення пухлин за допомогою скринінгових методів може затримати прогресування пухлини і підвищити ймовірність успішного лікування [17]. Наприклад, при найбільш поширених злоякісних новоутвореннях, таких як рак молочної залози та рак товстої кишки, раннє виявлення солідних пухлин за допомогою скринінгових мамографічних та колоноскопічних досліджень стало усталеною клінічною парадигмою [18,19,20,21,22,23].
Аналіз злоякісних маркерів у біологічних рідинах спочатку був визнаний при колоректальному раку, де були виявлені підвищені рівні сироваткового карциноембріонального антигену [24,25,26]. Однак діагностичне значення цього нормального фізіологічного білка обмежене, оскільки його рівень не обов’язково є підвищеним, а високі діапазони асоціюються з низкою інших видів раку [25, 27]. Своєчасна діагностика та чутливий моніторинг лікування залишаються основними проблемами в лікуванні ГБМ [28]. Клінічна оцінка відповіді в першу чергу базується на лабораторних дослідженнях та магнітно-резонансній томографії (МРТ) [28, 29]. Однак і МРТ, і лабораторні тести є нечутливими показниками стану захворювання. Наприклад, найнижча достатня роздільна здатність для розпізнавання за допомогою МРТ становить порядку декількох міліметрів [28, 29]. Спроби скористатися перевагами потужних візуалізаційних можливостей МРТ призвели до альтернативних досягнень. Вдосконалені методи МРТ, такі як дифузійно-зважена візуалізація (ДЗВ), динамічна контрастна перфузійна візуалізація (ДКВ) та МР-спектроскопія (МРС), теоретично надають фізіологічну інформацію, яку неможливо отримати лише за допомогою звичайної МРТ. Наприклад, МРС на основі протонів (або 1H-МРС) надає інформацію про метаболічний склад у вибраних ділянках тканини-мішені, що концептуально схоже на “електронну біопсію”. Порівняння відносних концентрацій цих метаболітів виявляє фактори, які допомагають оцінити наявність життєздатних пухлин у досліджуваній ділянці, такі як оборот мембрани В-клітин і життєздатність нейронів. МРС є більш привабливим, ніж недіагностичні методи, оскільки додає лише 15-30 хвилин до традиційної методики МРТ, яка зазвичай використовується в лікуванні пацієнтів зі злоякісною гліомою [30, 31]. Таким чином, позаклітинні везикули (ПВ) є резервуарними біомаркерами з великим потенціалом для оцінки пухлин гліобластоми in situ [30, 32]. Декілька молекулярних маркерів все ще знаходяться на стадії дослідження, але рутинно використовуються у пацієнтів з ГБМ, включаючи ізоцитратдегідрогеназу (ІДГ), О6-метилгуанін ДНК-метилтрансферазу (МГМТ), VEGF і рецептор епідермального фактора росту (EGFR). Крім того, білок-супресор пухлин TP53, фосфатази, гомолог тензину (PTEN), ген p16INK4a, метаболіти фосфоліпідів, ракові стовбурові клітини, а останнім часом і біомаркери візуалізації – всі вони були широко валідовані в клінічних умовах [33] (Таблиця 1).
Таблиця 1 Біомаркери ГБМ та методи їх виявлення
| # | Біомаркер | Методи | Коментарі | Посилання |
| 1 | Солідна пухлина | МРТ | Солідні пухлини, як правило, високоагресивні, важко піддаються лікуванню за допомогою повної хірургічної резекції або променевої терапії, а також асоціюються з частими рецидивами та поганим прогнозом | [34, 35] |
| 2 | мікроРНК | ПЛР-ЗТ | Деякі мікроРНК, такі як miR-10b, miR-5096, mi-R-709 та miR-19a, сприяють диференціації олігодендроцитів | [36, 37] |
| 3 | ІДГ
ІДГ ІДГ |
Мініатюрний мас-спектрометр | ІДГ мутантна ГБМ є кінцевою стадією злоякісного прогресування ІДГ мутантної дифузної астроцитоми (клас II за ВООЗ) або ІДГ мутантної анапластичної астроцитоми (клас III за ВООЗ). | [38, 39] |
| МРТ | – | [40] | ||
| Мультипараметрична МРТ | – | [41] | ||
| 4 | EVs | Мас-спектрометрія | ПВ отримані з сироватки крові пацієнтів з ГПМК, також асоціюються з цитокінами, що сприяють розвитку пухлини, які підтримують Th2, а не Th1 фенотип. | [31, 42] |
| 5 | EGFR | Мас-спектрометрія | У гліомах, зокрема гліобластомах, виявлено багато змін у гені EGFR, включаючи ампліфікації, делеції та однонуклеотидні поліморфізми (ОНП). | [43] |
| 6 | p16INK4a gene | Метилювання генів | p16INK4A це ген-супресор пухлин, мутації та/або делеції якого часто зустрічаються в багатьох пухлинах людини, включаючи гліобластоми, меланому та лейкемії. | [44, 45] |
| 7 | Метаболіти фосфоліпідів | ELISA | Ліпідний обмін, зокрема метаболізм фосфоліпідів, значно змінюється при різних типах раку, в тому числі при ГБМ. | [46,47,48] |
| 8 | Cancer stem cells | МРТ | ГБМ, найпоширеніша і найзлоякісніша первинна пухлина головного мозку, містить самовідновлювані, пухлиногенні ракові стовбурові клітини (РСК), які відіграють певну роль у розвитку пухлини і сприяють резистентності до терапії. | [49, 50] |
| 9 | PTEN | Скринінг нового покоління | PTEN – це фосфатаза PIP3, яка функціонує як антагоніст канцерогенної сигналізації PI3-кінази. Це один з найпотужніших мутантних супресорів пухлин, особливо в пухлинах головного мозку, оскільки він відіграє вирішальну роль у придушенні потужних сигнальних шляхів. | [51, 52] |
- Діагностична візуалізація є одним з декількох методів виявлення ГБМ, які детально описані в Таблиці 1. Незважаючи на свої переваги, цей підхід має певні недоліки, найсуттєвішим з яких є його недостатня специфічність. Технологія візуалізації також потребує дорогого, високотехнологічного обладнання, а також кваліфікованого персоналу
- МРТ Магнітно-резонансна томографія, ПЛР-ЗТ Полімеразна ланцюгова реакція зі зворотною транскрипцією, ELISA Імуноферментний аналіз, TH2 Т-хелпер 2, TH1 Т-хелпер 1, ПВ Позаклітинні везикули, ІДГ ізоцитратдегідрогеназа, МГМТ O6-метилгуанін ДНК-метилтрансфераза, EGFR рецептор епідермального фактору росту, TP53 білок-супресор пухлин, PTEN-фосфатаза і гомолог тензину
Протеоміка
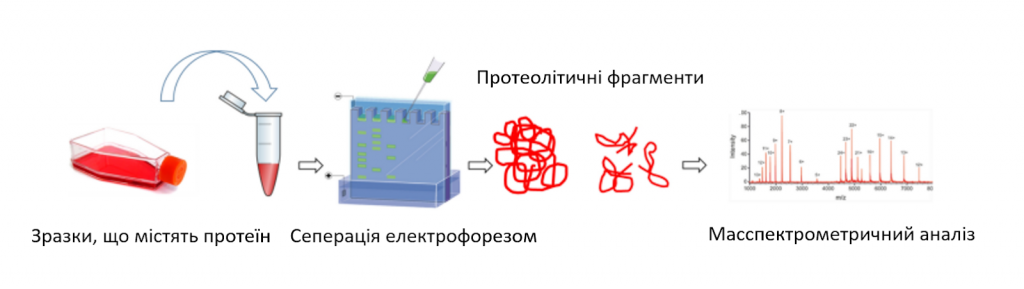
Платформи на основі протеоміки стають дедалі потужнішими у виявленні потенційних механізмів захворювань та біомаркерів [53]. Протеоміка передбачає використання надскладних методів скринінгу білків для широкомасштабного біологічного розуміння [53]. Ця інформація може бути об’єднана з геномними даними для досягнення кращого розуміння біологічних механізмів, що лежать в основі синдрому Гійєна-Барре (СГБ) [53, 54]. Типовим методом попередньої обробки зразків для протеомного аналізу є розщеплення білків протеазами (такими як трипсин або LysC) до пептидів, їх розділення за допомогою обернено-фазової рідинної хроматографії C18 та аналіз за допомогою мас-спектрометрії (ОРХГ/МС) [55]. На зображенні 1 наведено короткий вступ до методу протеоміки.
Зображення 1
Ілюстрація методу протеоміки [56].
Підходи протеоміки можуть бути легко використані для з’ясування природних механізмів продукування мікроорганізмів і рослин [57, 58]. Ця стратегія також успішно застосовується до різних типів захворювань, таких як пародонтит, хвороба Альцгеймера, захворювання щитовидної залози та різні типи пухлин [59, 60]. У гліомі методи протеоміки виявили зміни в експресії білків, але послідовність і біологічне значення цих змін не встановлені [61]. Багато інноваційних протеомних досліджень проводяться з різних аспектів імунотерапії гліоми, включаючи онколітичні віруси, моноклональні антитіла, вакцини з дендритних клітин (ДК) і Т-клітини з химерними антигенними рецепторами (ХАР) [61]. Тому застосування протеоміки в імунотерапії може прискорити дослідження в галузі лікування ГБМ [61]. Протеомний аналіз людини на основі клінічної мас-спектрометрії (МС) крові є потужним інструментом для вивчення біомаркерів раку [62]. За останнє десятиліття повідомлялося про численні клінічні дослідження ГБМ з використанням різних кількісних підходів. Мас-спектрометрія з послідовним отриманням всіх фрагментів теоретичних іонних спектрів (ПОФС-МС) є новим кількісним методом, який поєднує високоспецифічний незалежний від даних метод отримання (НМО) з новою стратегією цілеспрямованого вилучення даних для отримання результуючого набору іонних фрагментів [62]. ПОФС-МС аналіз пропонує кілька переваг у відкритті протеоміки, включаючи високу відтворюваність і надійну кількісну інформацію [63]. Поєднання ПОФС-МС і QTAP-аналізу дозволило виявити вісім біомаркерів-кандидатів у плазмі пацієнтів з ГБМ [64]. Кількісна протеоміка на основі мас-спектрометрії без міток була розроблена для ідентифікації та характеристики білків, які диференційовано експресуються при ГБМ, для кращого розуміння взаємодій та функцій, які призводять до розвитку захворювання. Поглиблена ідентифікація висхідних регуляторів забезпечує нові потенційні терапевтичні мішені. Пухлини ГБМ аналізували за допомогою SDS PAGE фракцій з внутрішніми ДНК-маркерами з подальшою рідинною хроматографією-тандемною мас-спектрометрією (МС) [65]. Основним викликом у дослідженні ГБМ було виявлення нових молекулярних терапевтичних мішеней і точних діагностичних/прогностичних біомаркерів. Багато сучасних клінічних терапевтичних мішеней для імунотоксинів і ліганд-спрямованих токсинів проти клітин гліоми високого ступеня злоякісності (ГВСЗ) є поверхнево сіалілізованими глікопротеїнами [66]. Для характеристики та точного кількісного визначення одноклітинного поверхневого сіалопротеїну в тканині ГБМ людини, астроцитах людини, ембріональних та дорослих нейронних клітинах-попередниках (НКП) людини було охарактеризовано та точно кількісно визначено за допомогою стратегії біоортогонального хімічного репортеру (БОХР) у поєднанні з безмітковою кількісною мас-спектрометрією (БМКМС). Цей підхід комплексно визначає нові біомаркери та терапевтичні мішені для лікування злоякісної гліоми за допомогою кількісної протеоміки сіалоглікопротеїнів з клінічно значущими первинними клітинами гліоми, отриманими від пацієнтів [66]. Крім того, було розроблено простий і чутливий таргетований протеомний метод для кількісного визначення мембранних і білкових факторів транскрипції в дегенерованих білкових шляхах клітин гліобластоми. Цей метод використовує рідинну хроматографію та мас-спектрометрію для забезпечення високої чутливості виявлення та отримання кількісних даних для прогностичного аналізу та тестування ефективності [67]. Найбільш злоякісною формою серед усіх гліом є ГБМ, яка характеризується поганою відповіддю на лікування і високим ступенем гетерогенності. Субвентрикулярна зона (СВЗ) є ключовою ділянкою нейрогенезу мозку і багата на нейронні стовбурові клітини. Оскільки пухлини ГБМ часто розташовуються поблизу СВЗ, їх можна класифікувати як СВЗ- або СВЗ+. Пухлини, які знаходяться в безпосередній близькості до СВЗ, класифікуються як СВЗ+, тоді як пухлини, які віддалені від СВЗ, класифікуються як СВЗ-. Щоб отримати уявлення про підвищену агресивність СВЗ+ пухлин, були застосовані протеомні системи, такі як ОРХГ/МС і 2DDIGE, для вивчення можливих змін протеоміки між двома підтипами. У той час як протеомний аналіз сироватки крові виявив значні зміни в різних білках, що переносять ліпіди, і білках гострої фази, протеомний аналіз тканин показав значні зміни в регуляторних білках, зв’язуванні ліпідів, цитоскелеті, шаперонах і клітинному циклі. Ці результати дають ключ до молекулярної основи підвищеної агресивності пухлин СВЗ+ ГБМ і можуть призвести до визначення терапевтичних мішеней для покращення лікування цих високоінвазивних пухлин [68].
Кількісна ПЛР у реальному часі (кПЛРРЧ) та мас-спектрометрія (МС) були використані для ідентифікації потенційних мішеней для довгих некодуючих РНК (днРНК) HULC, які сприяють прогресуванню ГБМ [69, 70]. Підхід на основі протеоміки в зразках пацієнтів був використаний для ідентифікації антигенів-мішеней Т-клітин в інтегрованих стовбурових клітинах гліобластоми. У цьому дослідженні було виявлено новий імуногенний білок, який часто індукує пухлиноспецифічні Т-клітинні відповіді у пацієнтів з ГЛМ, а також виявляється в резистентних до терапії, неспокійних і повільно циркулюючих СКГ in vitro. Стабільна експресія цих Т-клітинних мішеней у первинних і рецидивуючих ГБМ підтверджує їх придатність для майбутнього клінічного застосування [71].
Отримані результати свідчать про те, що протеоміка передбачає використання надскладних методів скринінгу білків, які можуть бути використані для широкомасштабного біологічного розуміння ГБМ. Ця інформація може бути об’єднана з геномними даними для кращого розуміння основних біологічних механізмів, що лежать в основі ГБМ.
Біосенсорна технологія
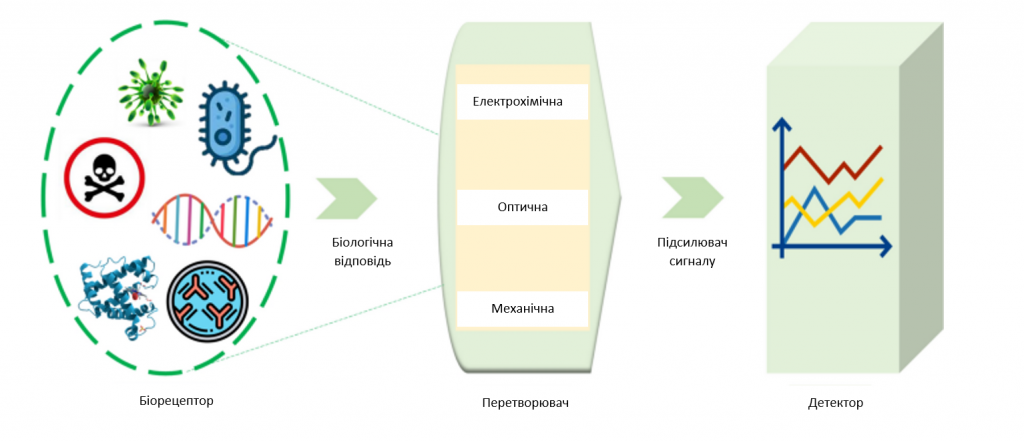
Моніторинг та діагностика різних порушень вимагають значних зусиль для регулярного дослідження зразків крові та проведення супутніх тестів [72,73,74]. Однак ці тести потребують загальних аналітичних методик, ефективного персоналу для їх виконання та часу для збору необхідних зразків для клінічних досліджень [75]. Лабораторні тести дозволяють кваліфікованому персоналу здійснювати моніторинг та діагностувати різноманітні захворювання [73, 75]. Відомо, що певні аналізи є специфічними для певного захворювання і можуть бути корисними для моніторингу його прогресування [76, 77]. Клінічна корисність біохімічних тестів визначається їхньою чутливістю для виявлення захворювання без хибнонегативних результатів і специфічністю для уникнення хибнопозитивних результатів у людей, які не хворіють [76]. Біосенсори використовують специфічність біомолекул у поєднанні з фізико-хімічними перетворювачами для перетворення біологічних сигналів в оптичні/електрохімічні сигнали [78]. Схему біосенсорної технології наведено на зображення 2.
Зображення 2
Схема біосенсорної технології
Численні біосенсори на основі метаболітів доступні для моніторингу клінічно важливих параметрів, таких як рівень цукру в крові, сечовини, сечової кислоти, молочної кислоти, холестерину та інших [56]. Ці біосенсори більші за розмірами, ніж додаткові лабораторні аналізи речовин, що беруть участь у клінічному аналізі [72]. Ферменти добре відомі для розробки біосенсорів через їх специфічність як біологічних сенсорних матеріалів, а їх роль у клінічній діагностиці відома вже кілька років. Однак ферменти менш стабільні в розчині і потребують іммобілізації та стабілізації для використання в біосенсорних пристроях [79]. Іммобілізована фаза забезпечує чудову стабільність і може бути використана повторно. Зшивання, ковалентне зв’язування, фізсорбція, інкапсуляція та захоплення – ось деякі з методів, що використовуються для стабілізації ферментів для розробки біосенсорних пристроїв [80]. Матриця або основа, обрана для іммобілізації, залежить від природи методу іммобілізації та біомолекули. Для іммобілізації біомолекул/ферментів при розробці різних типів біосенсорів використовують різні матриці, такі як полімерні плівки та вуглець, графіт, мембрани, гелі, LB плівки, діафосфати та провідні полімери [80,81,82].
Біосенсори розроблені для виявлення біомаркерів ГБС
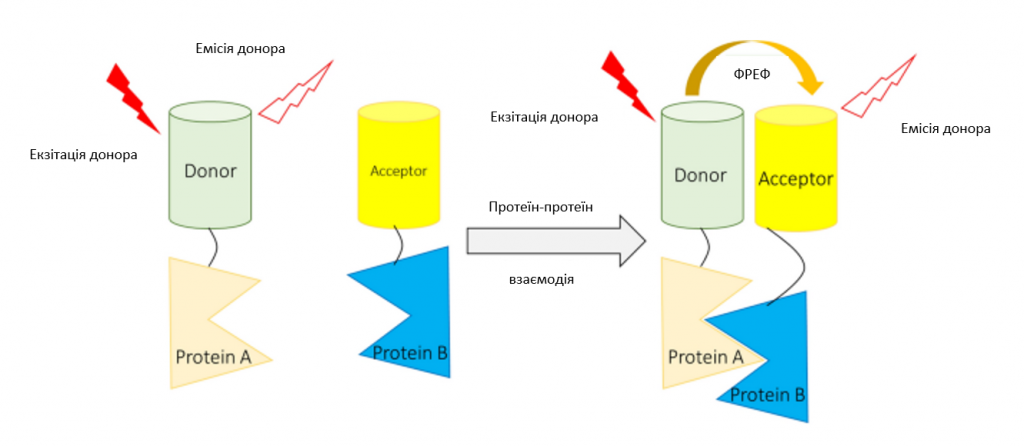
У цьому дослідженні було створено нову та чутливу електрогенну хемілюмінесцентну (ЕХЛ) біосенсорну систему для виявлення гена p16INK4a з використанням функціонального пастоподібного нановолоконного композитного вуглецевого електрода, модифікованого трафаретним друком (ВЕМТ) [83]. Мутації в ДНК-зв’язуючому домені р53 впливають на його конформацію і здатність зв’язуватися з хроматином, тим самим впливаючи на його здатність регулювати експресію генів-мішеней і функцію контрольних точок клітинного циклу в багатьох видах раку, включаючи ГБМ. Низькомолекулярні препарати, які відновлюють структуру і функцію неправильно згорнутого р53, можуть посилити хіміотерапію, активуючи р53-опосередковане старіння. Для визначення змін у структурі білка р53, опосередкованих низькомолекулярними препаратами, було сконструйовано біосенсор молекулярної комплементації (NRLUCp53CRLUC) для розщепленої Renilla-люциферази (RLUC). Після первинної оцінки біосенсорів на трьох різних клітинних лініях сконструйована платформа ідентифікувала ендогенно модифікований p53P98L [84]. Флуоресцентний резонанс/Фостерівський перенос енергії (ФРЕФ) – це безвипромінювальна передача енергії між двома молекулами, яка може відбуватися, коли дві молекули знаходяться в безпосередній близькості (< 10 нм) [85, 86]. Як наслідок, ФРЕФ можна використовувати для вимірювання того, чи взаємодіють дві молекули, такі як ліганд і рецептор, одна з одною [85, 86]. Для того, щоб ФРЕФ відбувся, спектр флуоресцентного випромінювання донора повинен перекриватися зі спектром поглинання акцептора, а орієнтації диполів переходу повинні бути приблизно паралельними [85, 86]. На зображення 3 наведено ілюстрацію застосування методу ФРЕФ для виявлення взаємодії білок-білок.
Зображення 3
Ілюстрація підходу на основі ФРЕФ для виявлення білок-білкових взаємодій. За допомогою ФРЕФ-зондів клітини гліоми, які проникають у паренхіму мозку, мають вищу активність Rac1 і Cdc42 і нижчу активність RhoA, ніж клітини, які проникають у периваскулярну зону. Іншими словами, метод на основі ФРЕФ виявився корисним для моніторингу способу інвазії клітин ГБМ. Це можна контролювати шляхом балансування активності ГТФази родини Rho та Cdc42-специфічного GEF
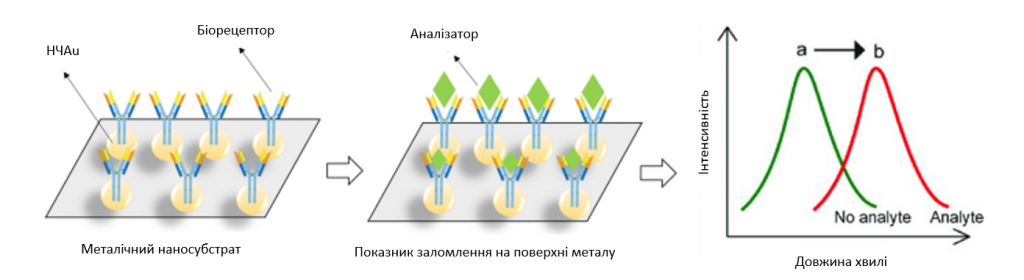
Електричне клітинно-субстратне імпедансне зондування (ЕКІЗ) – це безміткова методика, заснована на імпедансі, для аналізу в реальному часі поведінки клітин згідно з їхньою адгезією [87]. Кілька досліджень показали, що ЕКІЗ підходить для вимірювання адгезії клітин ГБМ і може вимірювати їхню адгезію. Результати показали, що ЕКІЗ надійно вимірює адгезію диференційованих клітин ГБМ на різних типах матриць. Крім того, ЕКІЗ може вимірювати міграційну поведінку диференційованих клітин ГБМ на електроді ЕКІЗ після зміни [88]. Однак, оскільки стовбурові клітини ГБМ є адгезивними, ЕКІЗ має значно нижчу здатність вимірювати адгезію порівняно з диференційованими аналогами. Це означає, що хоча ЕКІЗ може бути корисним для деяких культур ГБМ, він може бути не дуже корисним для стовбурових клітин зі слабкою адгезією [88]. Було розроблено електрохімічний біосенсор для виявлення формальдегіду у водних розчинах за допомогою ферменту формальдегіддегідрогенази в поєднанні з модифікованим вуглецевими нанотрубками (ВНТ) електродом трафаретного друку (ЕТД). Запропонована система екранує амперометричну відповідь на формальдегід, що вивільняється з клітин ГБМ людини U251 у біосенсорному відділенні у відповідь на обробку різними протипухлинними препаратами, що складаються з формальдегіду і масляної кислоти [74, 89,90,91]. Поверхневі плазмонні поляритони (ППП), також відомі як поверхневі плазмові хвилі, є унікальним режимом електромагнітного поля, який може виникати на межі розділу між діелектриком і металом. Ці ППП поводяться майже так само, як плазма вільних електронів [92, 93]. Поверхневі плазмони характеризуються своїми константами поширення і розподілом магнітного поля, вони перебувають у поперечному магнітному режимі (магнітні вектори перпендикулярні до напрямку поширення хвилі і паралельні до межі поділу) [92, 93]. Біосенсорика на основі локалізованого поверхневого плазмонного резонансу (ЛППР) забезпечує чутливий, безмітковий, недорогий і швидкий метод виявлення біомолекулярних взаємодій з просторовою роздільною здатністю на нанорівні [94,95,96]. Цей метод є перспективним для надійного і точного виявлення біомолекулярних взаємодій. Портативність і малий розмір сенсорів дозволяють мініатюризувати датчики до масштабів, недосяжних для інших планарних методів, таких як ППР. Біосенсорні пристрої на основі ЛППР легко виготовляти, використовуючи недорогу сенсорну платформу. Корисність зондування на основі ЛППР можна підвищити, інтегрувавши його в мультиплексовані мікрофлюїдні пристрої [94, 95]. На зображення 4 наведено схему біосенсора ЛППР.
Зображення 4
Схематичне зображення біосенсора ЛППР
У ГБМ секретований лактат сприяє експресії кластера диференціювання 44 (CD44) і вивільненню клітинних нановезикул (30-200 нм), таких як екзосоми, що сприяє злоякісній прогресії пухлин. У смертельних пухлинах головного мозку лактат-керована регуляція злоякісних клітин гліобластоми (ГМ) сприяла вивільненню екзосом, багатих на CD44, збільшенню міграції ГМ та утворення ендотеліальних клітин, а також секреції екзосом. Було виявлено, що CD44 може бути сенсибілізований “захопленням” титану та ідентифікований біосенсором ЛППР (див. зображення 5) [97].
Зображення 5
Це зображення запозичене з посилання [97]
На цьому зображенні представлено високочутливий метод виявлення екзосомальних CD44 і CD133 за допомогою біосенсорів TIC-AFM і TiN-NH-LSPR для відстеження прогресування ГЛМ у мишей. У пухлинному мікрооточенні (ПМО) клітини ГБМ використовують накопичений позаклітинний лактат для свого виживання, частково шляхом підвищення регуляції CD44 і CD133 та вивільнення екзосом. Ці екзосоми не тільки роблять клітини більш злоякісними, але й дозволяють сусіднім ЕК стати більш ангіогенними. Кіназа CDK5 активується через контакт з різними компонентами, включаючи регулятори p35/p25. Активна CDK5 відіграє життєво важливу роль у деяких нейронних функціях, а її гіперактивність сприяє розвитку різних видів раку людини та деяких нейродегенеративних процесів, особливо нейробластоми та ГБМ. Зонд-партнер, який взаємодіє з CDK5, та синтетичний флуоресцентний хінолімідний пептид, отриманий з чашечки CDK5, були впроваджені in vitro для виявлення клітин нейробластоми N2a та ГБМ U87 [98].
Поверхнево-посилене резонансне раманівське розсіювання (ППРР) – це чутливий і селективний метод для характеристики біомолекулярних ділянок, які демонструють електронні переходи при енергіях, близьких або узгоджених з частотою використовуваного лазера [99, 100]. Біомолекули адсорбуються на відповідній металевій підкладці, зазвичай срібній, і вимірювання зазвичай проводяться in situ в буферному або підтримуючому середовищі. Ця процедура має кілька переваг. Резонансну чутливість і чутливість поверхнево-посиленого раманівського розсіювання (ППКР) можна комбінувати, що дає змогу використовувати ці методи для вимірювання нанорозмірних концентрацій [99,100,101]. Виявлення наночастинок ППРР за допомогою методу візуалізації на основі спектроскопії поверхнево-посиленого раманівського розсіювання має значні переваги над іншими підходами з використанням молекулярних контрастних речовин [102]. Наприклад, порівняно з флуоресцентною візуалізацією, наші ППРР нанозонди не тільки мають вищу чутливість, але й набагато вищу фотостабільність, ніж сучасні флуорохроми [102]. При збудженні одним джерелом з довжиною хвилі 785 нм наночастинки ППРР з різними раманівськими репортерами випромінюють складний спектр [102,103,104]. Здатність наночастинок поверхнево-посиленого резонансного раманівського розсіювання (ППРР), націлених на інтегрин, точно відображати справжній розмір пухлини в моделі ГБМ миші, яка наближено імітує патологію у людини, була належним чином досліджена. Ця технологія візуалізації наночастинок на основі раманівської спектроскопії є перспективною для забезпечення високоточної візуалізації справжнього розміру злоякісних пухлин головного мозку [102]. На основі бібліотеки CDK5-специфічних субстратів сконструйовано флуоресцентний пептидний репортер активності кінази CDK5. Встановлено його здатність реагувати з рекомбінантним CDK5/p25, а чутливі зміни інтенсивності флуоресценції повідомляють про активність CDK5 в клітинному екстракті гліобластоми. Було розроблено клітинно-проникаючий варіант цього біосенсора, який можна використовувати для просторового та часового картування динаміки активації CDK5. Це відкриває широкі можливості для розробки діагностичних тестів для виявлення нейропатології, пов’язаної з надмірною активацією CDK5, а також супутніх тестів для оцінки реакції на нові методи лікування, спрямовані на цю кіназу [105]. Для виявлення нескінченно малої кількості екзосомних біомаркерів було розроблено чип-сенсор на основі локалізованого поверхневого плазмонного резонансу (ЛППР). Сенсорний чіп використовував самозбірні наночастинки срібла, окладені золотими наноострівцями (Ag@AuНО), для забезпечення специфічної біокон’югації біотинільованих антитіл для виявлення екзосомальних поверхневих біомаркерів [106, 107]. Крім того, було створено біосенсор на основі магнітно-ковалентних органічних каркасних наносфер на основі мікроРНК для чутливого виявлення гліоми [108] (табл. 2).
Таблиця 2 Розроблені біосенсори для виявлення біомаркерів ГБС
| # | Біомаркер | Платформа | Техніка | НЧAu | Лінійний діапазон | Межа виявлення (МВ) | Посилання |
| 1 | p53 | Флуоресцентна мікроскопія | Візуалізація клітин | – | від 0,375 до 250 мкМ | 31,25 мкМ | [84] |
| 2 | Родина Rho | ФРЕФ | – | – | 16 106 клітин в 1 мл | 20 мМ | [109] |
| 3 | Стовбурові клітини | ECIS | – | – | – | – | [88] |
| 4 | Формальдегід (AN) | ECL | Амперометричний | MWCNTs, SPE | 0,1-100 мкМ | 0,1 мкМ | [89] |
| 5 | СГБ | ЛППР | – | НЧAu | 0,005 до 50 мкг/мл | 5,29 × 10-1 мкг/мл | [97] |
| 6 | CDK5 Кіназа | ФРЕФ | Спектр Uvis | – | – | 0,2 мкМ | [98] |
| 7 | Пухлини | ППРР | Зонд молекулярної візуалізації | НЧAu | 3,5 нМ | 10-15 M | [102] |
| 8 | CDK5 Кіназа | – | Флуоресцентний | – | 10 мкг | – | [105] |
- p53 Пухлинний білок p53, ФРЕФ Флуоресцентний резонанс/Фостерівський перенос енергії, ЕКІЗ Електричне клітинно-субстратне імпедансне зондування, МКОН Магнітно-ковалентні органічні наноструктури, НЧAu Наночастинки золота, ЕХЛ Електрогенна хемілюмінесценція, ЛППР Біосенсорика на основі локалізованого поверхневого плазмонного резонансу, ППРР Поверхнево-посилене резонансне раманівське розсіювання, СГБ Синдром Гійєна – Барре, БШВНТ Багатошарові вуглецеві нанотрубки, КЕП Коефіцієнт ефективності поверхні.
Порівняння технологій протеоміки та біосенсорів в ідентифікації ГБМ
Як зазначалося раніше, існує кілька способів діагностики ГБМ, кожен з яких має свої переваги та недоліки. Основна мета цього дослідження – допомогти у виборі відповідного методу для діагностики ГПМК. Для досягнення цієї мети в цьому розділі порівнюються методи протеоміки та біосенсорики. У таблиці 3 узагальнено переваги та недоліки протеоміки та біосенсорів у виявленні ГБМ.
Таблиця 3 Переваги та недоліки протеоміки та біосенсорів в ідентифікації ГБМ
| Методи | Переваги | Недоліки |
| Протеоміка | Висока пропускна здатність дозволяє оцінювати сотні поліпептидів за один прогін і спеціально розроблена для виявлення взаємодії білків з різними молекулярними типами. Антитіла можна використовувати для зондування поліпептидів і виявлення посттрансляційних змін. Експресію білка можна вимірювати напівкількісно, і ці методи сумісні з іншими методами [110,111,112]. | Розпізнаются лише відомі білки і мають невеликий динамічний діапазон порівняно з іншими методами ізоляції. Вони також специфічні до антитіл і можуть мати труднощі з ідентифікацією нативних конформацій білків, може відбуватися придушення сигналу дуже великою кількістю білків, а також обмежена повторюваність, що вимагає підтвердження для клінічного діагнозу. Крім того, методи протеоміки часто вимагають невеликих, відносно чистих зразків, і змусити білки прийняти їх нативну конформацію може бути складно [110,111,112]. |
| Біосенсори | Стратегія практичного застосування біосенсорної системи повинна враховувати декілька факторів, включаючи широкий діапазон виявлення, низьку межу виявлення (НМВ), швидкий час реакції, низьку вартість і простоту системи, хорошу чутливість і специфічність, високу селективність, прийнятну стабільність і простий метод виробництва [113,114,115]. | Потреба у великих розмірах зразків, обмежена пропускна здатність, різноманітність обладнання, адсорбція компонентів розчину на поверхні мембрани та вплив на режими перенесення заряду – все це може призвести до неточності вимірювань в електрохімічному зондуванні. Крім того, відновлення поверхні мікроелектродів може бути складним завданням. Тому протокол реактивації електрода, який включає складні методи програмованого потенціалу, може допомогти підвищити точність вимірювання [113,114,115]. |
Висновок
Протеомічний аналіз є цінним методом у дослідженнях, пов’язаних з ГБМ, для визначення взаємозв’язків між внутрішньоклітинними білками. Він може надати як якісну, так і кількісну інформацію, ідентифікувати тип експресованого білка і дослідити фенотип кожного експресованого білка за різних умов. Аналогічно, біосенсори є потужним інструментом для діагностики гліоми. Перевірені дослідження показали, що використання біосенсорів для виявлення біомаркерів у рідинах організму є доцільним. Інші методи, такі як МРТ та протеоміка, можуть бути придатними для вивчення пухлин, їх структури, розміру та морфології. Таким чином, біосенсори відіграють важливу роль у розвитку датчиків ГБ для швидкого, ефективного і недорогого виявлення. Постійна робота і прогрес у створенні великомасштабних плазмових наноструктур досягається за допомогою різних методів, таких як мікросферна літографія, виготовлення суперпарамагнітних частинок, інтерференційна літографія, наноімпринтинг і нові конструкції з покращеними експлуатаційними характеристиками. Для методів ППР, ЛППР, ППРР, SEF, SEIRA корисним є більш точний спосіб зчитування, який зменшує витрати і полегшує тестування з підкладками великої площі, а також підсилення сигналу.
Посилання
- Kamran N, Alghamri MS, Nunez FJ, Shah D, Asad AS, Candolfi M, Altshuler D, Lowenstein PR, Castro MG. Current state and future prospects of immunotherapy for glioma. Immunotherapy. 2018;10(4):317–39.
- Wen PY, Huse JT. 2016 World Health Organization classification of central nervous system tumors. CONTINUUM: Lifelong Learn Neurol. 2017;23(6):1531–47.
- Alexander BM, Cloughesy TF. Adult glioblastoma. J Clin Oncol. 2017;35(21):2402–9.
- Davis ME. Glioblastoma: overview of disease and treatment. Clin J Oncol Nurs. 2016;20(5):S2.
- Stragliotto G, Pantalone MR, Rahbar A, Söderberg-Nauclér C. Valganciclovir as add-on to standard therapy in secondary glioblastoma. Microorganisms. 2020;8(10):1471.
- Kleihues P, Ohgaki H. Primary and secondary glioblastomas: from concept to clinical diagnosis. Neuro Oncol. 1999;1(1):44–51.
- Yousefi B, Mohammadlou M, Abdollahi M, Salek Farrokhi A, Karbalaei M, Keikha M, Kokhaei P, Valizadeh S, Rezaiemanesh A, Arabkari V. Epigenetic changes in gastric cancer induction by Helicobacter pylori. J Cell Physiol. 2019;234(12):21770–84.
- Ellor SV, Pagano-Young TA, Avgeropoulos NG. Glioblastoma: background, standard treatment paradigms, and supportive care considerations. Los Angeles: SAGE Publications; 2014.
- Shafiei M, Ghasemian A, Eslami M, Nojoomi F, Rajabi-Vardanjani H. Risk factors and control strategies for silicotuberculosis as an occupational disease. New Microbes New Infect. 2019;27:75–7.
- Johnson DR, Fogh SE, Giannini C, Kaufmann TJ, Raghunathan A, Theodosopoulos PV, Clarke JL. Case-based review: newly diagnosed glioblastoma. Neuro-oncol Pract. 2015;2(3):106–21.
- Young RM, Jamshidi A, Davis G, Sherman JH. Current trends in the surgical management and treatment of adult glioblastoma. Ann Transl Med. 2015;3(9):121.
- Scribner EY. Mathematical modeling of brain tumors advances patient care, oncogenesis, and the use of in silico clinical trials. The University of Alabama at Birmingham; 2017.
- Birkó Z, Nagy B, Klekner Á, Virga J. Novel molecular markers in glioblastoma-benefits of liquid biopsy. Int J Mol Sci. 2020;21(20):7522.
- Zhou E, Li Y, Wu F, Guo M, Xu J, Wang S, Tan Q, Ma P, Song S, Jin Y. Circulating extracellular vesicles are effective biomarkers for predicting response to cancer therapy. EBioMedicine. 2021;67:103365–103365.
- Amirsaadat S, Jafari-Gharabaghlou D, Dadashpour M, Zarghami N. Potential anti-proliferative effect of nano-formulated curcumin through modulating micro RNA-132, Cyclin D1, and hTERT genes expression in breast cancer cell lines. J Clust Sci. 2023. https://doi.org/10.1007/s10876-023-02404-z.
- Krol I, Castro-Giner F, Maurer M, Gkountela S, Szczerba BM, Scherrer R, Coleman N, Carreira S, Bachmann F, Anderson S. Detection of circulating tumour cell clusters in human glioblastoma. Br J Cancer. 2018;119(4):487–91.
- Figueroa JM, Carter BS. Detection of glioblastoma in biofluids. J Neurosurg. 2017;129(2):334–40.
- Mogheri F, Jokar E, Afshin R, Akbari AA, Dadashpour M, Firouzi-amandi A, Serati-Nouri H, Zarghami N. Co-delivery of metformin and silibinin in dual-drug loaded nanoparticles synergistically improves chemotherapy in human non-small cell lung cancer A549 cells. J Drug Deliv Sci Technol. 2021;66:102752.
- Ahmadi S, Dadashpour M, Abri A, Zarghami N. Long-term proliferation and delayed senescence of bone marrow-derived human mesenchymal stem cells on metformin co-embedded HA/Gel electrospun composite nanofibers. J Drug Deliv Sci Technol. 2023;80:104071.
- Nejati K, Rastegar M, Fathi F, Dadashpour M, Arabzadeh A. Nanoparticle-based drug delivery systems to overcome gastric cancer drug resistance. J Drug Deliv Sci Technol. 2022;70:103231.
- Eslami M, Yousefi B, Kokhaei P, Hemati M, Nejad ZR, Arabkari V, Namdar A. Importance of probiotics in the prevention and treatment of colorectal cancer. J Cell Physiol. 2019;234(10):17127–43.
- Salek Farrokhi A, Mohammadlou M, Abdollahi M, Eslami M, Yousefi B. Histone deacetylase modifications by probiotics in colorectal cancer. J Gastrointest Cancer. 2020;51:754–
- Ghorbani F, Kokhaei P, Ghorbani M, Eslami M. Application of different nanoparticles in the diagnosis of colorectal cancer. Gene Rep. 2020;21:100896.
- Ota T, Sakashita K, Sawada R, Seki K, Maeda H, Tanaka N, Tsujinaka T. Long-term survival with nivolumab followed by irinotecan after total gastrectomy in alpha-fetoprotein-producing gastric cancer: a case report and review of the literature. Surgical Case Reports. 2023 Dec;9(1):1-8.
- Aoki T, Kondo Y, Karakida K, Naito H, Kajiwara H, Ota Y. A mucinous adenocarcinoma of the lip with elevated serum carcinoembryonic antigen levels: a case report. Oral Maxillofac Surg. 2020;24(1):127–32.
- Hemmati M, Yousefi B, Bahar A, Eslami M. Importance of heme oxygenase-1 in gastrointestinal cancers: functions, inductions, regulations, and signaling. J Gastrointest Cancer. 2021;52:454–61.
- Salek Farrokhi A, Darabi N, Yousefi B, Askandar RH, Shariati M, Eslami M. Is it true that gut microbiota is considered as panacea in cancer therapy? J Cell Physiol. 2019;234(9):14941–50.
- Sorensen AG, Batchelor TT, Wen PY, Zhang W-T, Jain RK. Response criteria for glioma. Nat Clin Pract Oncol. 2008;5(11):634–44.
- Grossman SA, Batara JF. Current management of glioblastoma multiforme. Semin Oncol. 2004;31:635–44.
- Hallal S, Azimi A, Wei H, Ho N, Lee MYT, Sim H-W, Sy J, Shivalingam B, Buckland ME, Alexander-Kaufman KL. A comprehensive proteomic SWATH-MS workflow for profiling blood extracellular vesicles: a new avenue for glioma tumour surveillance. Int J Mol Sci. 2020;21(13):4754.
- Mondal A, Ashiq K, Phulpagar P, Singh DK, Shiras A. Effective visualization and easy tracking of extracellular vesicles in glioma cells. Biol Proced Online. 2019;21(1):1–12.
- Liu H, Kang M, Wang J, Blenkiron C, Lee A, Wise M, Chamley L, Chen Q. Estimation of the burden of human placental micro-and nano-vesicles extruded into the maternal blood from 8 to 12 weeks of gestation. Placenta. 2018;72:41–7.
- Carlsson SK, Brothers SP, Wahlestedt C. Emerging treatment strategies for glioblastoma multiforme. EMBO Mol Med. 2014;6(11):1359–70.
- Li X, Feng Q, Jiang X. Microfluidic synthesis of Gd-based nanoparticles for fast and ultralong MRI signals in the solid tumor. Adv Healthc Mater. 2019;8(20):1900672.
- Alves TR, Lima FRS, Kahn SA, Lobo D, Dubois LGF, Soletti R, Borges H, Neto VM. Glioblastoma cells: a heterogeneous and fatal tumor interacting with the parenchyma. Life Sci. 2011;89(15):532–9.
- Akers JC, Ramakrishnan V, Kim R, Phillips S, Kaimal V, Mao Y, Hua W, Yang I, Fu C-C, Nolan J. miRNA contents of cerebrospinal fluid extracellular vesicles in glioblastoma patients. J Neurooncol. 2015;123(2):205–16.
- Buruiană A, Florian ȘI, Florian AI, Timiș T-L, Mihu CM, Miclăuș M, Oșan S, Hrapșa I, Cataniciu RC, Farcaș M, et al. The roles of miRNA in glioblastoma tumor cell communication: diplomatic and aggressive negotiations. Int J Mol Sci. 2020;21(6):1950.
- Brown HM, Pu F, Dey M, Miller J, Shah MV, Shapiro SA, Ouyang Z, Cohen-Gadol AA, Cooks RG. Intraoperative detection of isocitrate dehydrogenase mutations in human gliomas using a miniature mass spectrometer. Anal Bioanal Chem. 2019;411(30):7929–33.
- Das A, Hawkins C, Tabori U. Germline predisposition to glial neoplasms in children and young adults: a narrative review. Glioma. 2021;4(4):68.
- Suh CH, Kim HS, Jung SC, Choi CG, Kim SJ. Imaging prediction of isocitrate dehydrogenase (IDH) mutation in patients with glioma: a systemic review and meta-analysis. Eur Radiol. 2019;29(2):745–58.
- Peng H, Huo J, Li B, Cui Y, Zhang H, Zhang L, Ma L. Predicting isocitrate dehydrogenase (IDH) mutation status in gliomas using multiparameter MRI radiomics features. J Magn Reson Imaging. 2021;53(5):1399–407.
- Yekula A, Yekula A, Muralidharan K, Kang K, Carter BS, Balaj L. Extracellular vesicles in glioblastoma tumor microenvironment. Front Immunol. 2020;10:3137–3137.
- Brevet M, Johnson ML, Azzoli CG, Ladanyi M. Detection of EGFR mutations in plasma DNA from lung cancer patients by mass spectrometry genotyping is predictive of tumor EGFR status and response to EGFR inhibitors. Lung Cancer. 2011;73(1):96–102.
- González-Pérez L-V, Isaza-Guzmán D-M, Arango-Pérez E-A, Tobón-Arroyave S-I. Analysis of salivary detection of P16INK4A and RASSF1A promoter gene methylation and its association with oral squamous cell carcinoma in a Colombian population. J Clin Exp Dent. 2020;12(5):e452.
- Hung K-S, Hong C-Y, Lee J, Lin S-K, Huang SC, Wang T-M, Tse V, Sliverberg GD, Weng S-C, Hsiao M. Expression of p16INK4A induces dominant suppression of glioblastoma growth in situ through necrosis and cell cycle arrest. Biochem Biophys Res Commun. 2000;269(3):718–25.
- Morillon A-C, Yakkundi S, Thomas G, Gethings LA, Langridge JI, Baker PN, Kenny LC, English JA, McCarthy FP. Association between phospholipid metabolism in plasma and spontaneous preterm birth: a discovery lipidomic analysis in the cork pregnancy cohort. Metabolomics. 2020;16(2):1–10.
- Nalli C, Somma V, Andreoli L, Büttner T, Schierack P, Mahler M, Roggenbuck D, Tincani A. Anti-phospholipid IgG antibodies detected by line immunoassay differentiate patients with anti-phospholipid syndrome and other autoimmune diseases. Autoimmun Highlights. 2018;9(1):1–11.
- Rezaei MB, Alipour Astaneh SD. Lipid peroxidation inhibition, superoxide anion and nitric oxide radical scavenging properties of thymus daenensis and anethum graveolens essential oils. 2011.
- Wang S, Ren W, Wang J, Jiang Z, Saeed M, Zhang L, Li A, Wu A. Black TiO 2-based nanoprobes for T 1-weighted MRI-guided photothermal therapy in CD133 high expressed pancreatic cancer stem-like cells. Biomat Sci. 2018;6(8):2209–18.
- Lathia JD, Mack SC, Mulkearns-Hubert EE, Valentim CLL, Rich JN. Cancer stem cells in glioblastoma. Genes Dev. 2015;29(12):1203–17.
- Juric D, Andre F, Singer CF, Sohn J, Campone M, Loibl S, Conte P, Iwata H, Ciruelos E, Mayer IA. Abstract P4–10–04: clinical outcomes of alpelisib in hormone receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer by next-generation sequencing-detected PIK3CA alteration status and phosphatase and tensin homolog loss: biomarker analysis from the SOLAR-1 study. In: AACR; 2020.
- Yang J-M, Schiapparelli P, Nguyen HN, Igarashi A, Zhang Q, Abbadi S, Amzel LM, Sesaki H, Quiñones-Hinojosa A, Iijima M. Characterization of PTEN mutations in brain cancer reveals that pten mono-ubiquitination promotes protein stability and nuclear localization. Oncogene. 2017;36(26):3673–85.
- Dutt MJ, Lee KH. Proteomic analysis. Curr Opin Biotechnol. 2000;11(2):176–9.
- Fredman G, Skov L, Mann M, Dyring-Andersen B. Towards precision dermatology: emerging role of proteomic analysis of the skin. Dermatology. 2022;238(2):185–94.
- Hedrick VE, LaLand MN, Nakayasu ES, Paul LN. Digestion, purification, and enrichment of protein samples for mass spectrometry. Curr Protoc Chem Biol. 2015;7(3):201–22.
- Mobed A, Ahmadalipour A, Fakhari A, Kazem SS, Saadi GK. Bioassay: a novel approach in antipsychotic pharmacology. Clin Chim Acta. 2020;509:30–5.
- Tocmo R, Veenstra JP, Huang Y, Johnson JJ. Covalent modification of proteins by plant-derived natural products: proteomic approaches and biological impacts. Proteomics. 2021;21(3–4):1900386.
- Sadeghzadeh J, Shahabi P, Farhoudi M, Ebrahimi-kalan A, Mobed A, Shahpasand K. Tau protein biosensors in the diagnosis of neurodegenerative diseases.
- Gouveia D, Grenga L, Pible O, Armengaud J. Quick microbial molecular phenotyping by differential shotgun proteomics. Environ Microbiol. 2020;22(8):2996–3004.
- Binti Badlishah Sham NI, Lewin SD, Grant MM. Proteomic investigations of in vitro and in vivo models of periodontal disease. PROTEOMICS—Clin Appl. 2020;14(3):1900043.
- Chen L, Qin D, Guo X, Wang Q, Li J. Putting proteomics into immunotherapy for glioblastoma. Front Immunol. 2021;12:593255.
- Jayaram S, Gupta MK, Polisetty RV, Cho WC, Sirdeshmukh R. Towards developing biomarkers for glioblastoma multiforme: a proteomics view. Expert Rev Proteomics. 2014;11(5):621–39.
- Gautam P, Nair SC, Gupta MK, Sharma R, Polisetty RV, Uppin MS, Sundaram C, Puligopu AK, Ankathi P, Purohit AK. Proteins with altered levels in plasma from glioblastoma patients as revealed by iTRAQ-based quantitative proteomic analysis. PLoS ONE. 2012;7:e46153.
- Miyauchi E, Furuta T, Ohtsuki S, Tachikawa M, Uchida Y, Sabit H, Obuchi W, Baba T, Watanabe M, Terasaki T. Identification of blood biomarkers in glioblastoma by SWATH mass spectrometry and quantitative targeted absolute proteomics. PLoS ONE. 2018;13(3):e0193799.
- Heroux MS, Chesnik MA, Halligan BD, Al-Gizawiy M, Connelly JM, Mueller WM, Rand SD, Cochran EJ, LaViolette PS, Malkin MG, et al. Comprehensive characterization of glioblastoma tumor tissues for biomarker identification using mass spectrometry-based label-free quantitative proteomics. Physiol Genomics. 2014;46(13):467–81.
- Autelitano F, Loyaux D, Roudieres S, Deon C, Guette F, Fabre P, Ping Q, Wang S, Auvergne R, Badarinarayana V. Identification of novel tumor-associated cell surface sialoglycoproteins in human glioblastoma tumors using quantitative proteomics. PLoS ONE. 2014;9(10):e110316.
- Nguyen CDL, Malchow S, Reich S, Steltgens S, Shuvaev KV, Loroch S, Lorenz C, Sickmann A, Knobbe-Thomsen CB, Tews B, et al. A sensitive and simple targeted proteomics approach to quantify transcription factor and membrane proteins of the unfolded protein response pathway in glioblastoma cells. Sci Rep. 2019;9(1):8836.
- Gollapalli K, Ghantasala S, Kumar S, Srivastava R, Rapole S, Moiyadi A, Epari S, Srivastava S. Subventricular zone involvement in Glioblastoma—A proteomic evaluation and clinicoradiological correlation. Sci Rep. 2017;7(1):1449.
- Ye S, Wu J, Wang Y, Hu Y, Yin T, He J. Quantitative proteomics analysis of glioblastoma cell lines after lncRNA HULC silencing. Sci Rep. 2021;11(1):12587.
- Gholizadeh O, Akbarzadeh S, Moein M, Yasamineh S, Hosseini P, Afkhami H, Amini P, Dadashpour M, Tahavvori A, Eslami M. The role of non-coding RNAs in the diagnosis of different stages (HCC, CHB, OBI) of hepatitis B infection. Microb Pathog. 2023;176:105995.
- Rapp C, Warta R, Stamova S, Nowrouzi A, Geisenberger C, Gal Z, Roesch S, Dettling S, Juenger S, Bucur M, et al. Identification of T cell target antigens in glioblastoma stem-like cells using an integrated proteomics-based approach in patient specimens. Acta Neuropathol. 2017;134(2):297–316.
- Chauhan N, Maekawa T, Kumar DNS. Graphene based biosensors—accelerating medical diagnostics to new-dimensions. J Mater Res. 2017;32(15):2860–82.
- Mobed A, Razavi S, Ahmadalipour A, Shakouri SK, Koohkan G. Biosensors in Parkinson’s disease. Clin Chim Acta. 2021;518:51–8.
- Eslami M, Peyghan AA. DNA nucleobase interaction with graphene like BC3 nano-sheet based on density functional theory calculations. Thin Solid Films. 2015;589:52–6.
- Piunno PA, Krull UJ. Trends in the development of nucleic acid biosensors for medical diagnostics. Anal Bioanal Chem. 2005;381(5):1004–11.
- Mascini M, Tombelli S. Biosensors for biomarkers in medical diagnostics. Biomarkers. 2008;13(7–8):637–57.
- Aminabad ED, Mobed A, Hasanzadeh M, Feizi MAH, Safaralizadeh R, Seidi F. Sensitive immunosensing of α-synuclein protein in human plasma samples using gold nanoparticles conjugated with graphene: an innovative immuno-platform towards early stage identification of Parkinson’s disease using point of care (POC) analysis. RSC Adv. 2022;12(7):4346–57.
- Sadighbathi S, Mobed A. Genosensors, a nanomaterial-based platform for microRNA-21 detection, non-invasive methods in early detection of cancer. Clin Chim Acta. 2022;530:27–38.
- Huang X, Zhu Y, Kianfar E. Nano biosensors: properties, applications and electrochemical techniques. J Market Res. 2021;12:1649–72.
- Zahirinejad S, Hemmati R, Homaei A, Dinari A, Hosseinkhani S, Mohammadi S, Vianello F. Nano-organic supports for enzyme immobilization: scopes and perspectives. Colloids Surf, B. 2021;204:111774.
- Khan MR. Current and future role of immobilized enzymes in medical field. Curr Med Drug Res. 2021;5(1):1–9.
- Izadi M, Tahmasebi S, Pustokhina I, Yumashev AV, Lakzaei T, Alvanegh AG, Roshangar L, Dadashpour M, Yousefi M, Ahmadi M. Changes in Th17 cells frequency and function after ozone therapy used to treat multiple sclerosis patients. Mult Scler Relat Disord. 2020;46:102466.
- Wang X, Wang Y, Shan Y, Jiang M, Jin X, Gong M, Xu J. A novel and sensitive electrogenerated chemiluminescence biosensor for detection of p16INK4a gene based on the functional paste-like nanofibers composites-modified screen-printed carbon electrode. J Electroanal Chem. 2018;823:368–77.
- Paulmurugan R, Afjei R, Sekar TV, Babikir HA, Massoud TF. A protein folding molecular imaging biosensor monitors the effects of drugs that restore mutant p53 structure and its downstream function in glioblastoma cells. Oncotarget. 2018;9(30):21495–511.
- Wu L, Huang C, Emery BP, Sedgwick AC, Bull SD, He X-P, Tian H, Yoon J, Sessler JL, James TD. Förster resonance energy transfer (FRET)-based small-molecule sensors and imaging agents. Chem Soc Rev. 2020;49(15):5110–39.
- Kaur A, Kaur P, Ahuja S. Förster resonance energy transfer (FRET) and applications thereof. Anal Methods. 2020;12(46):5532–50.
- Wegener J, Keese CR, Giaever I. Electric cell–substrate impedance sensing (ECIS) as a noninvasive means to monitor the kinetics of cell spreading to artificial surfaces. Exp Cell Res. 2000;259(1):158–66.
- Robilliard LD, Yu J, Jun S-M, Anchan A, Finlay G, Angel CE, Graham ES. Can ECIS biosensor technology be used to measure the cellular responses of glioblastoma stem cells? Biosensors. 2021;11(12):498.
- Bareket L, Rephaeli A, Berkovitch G, Nudelman A, Rishpon J. Carbon nanotubes based electrochemical biosensor for detection of formaldehyde released from a cancer cell line treated with formaldehyde-releasing anticancer prodrugs. Bioelectrochemistry. 2010;77(2):94–9.
- Eslami M, Vahabi V, Peyghan AA. Sensing properties of BN nanotube toward carcinogenic 4-chloroaniline: a computational study. Physica E. 2016;76:6–11.
- Yang Y, Sun A, Eslami M. A density functional theory study on detection of amphetamine drug by silicon carbide nanotubes. Physica E. 2021;125:114411.
- Singh P. SPR biosensors: historical perspectives and current challenges. Sens Actuators, B Chem. 2016;229:110–30.
- Nguyen HH, Park J, Kang S, Kim M. Surface plasmon resonance: a versatile technique for biosensor applications. Sensors. 2015;15(5):10481–510.
- Cottat M, Thioune N, Gabudean A-M, Lidgi-Guigui N, Focsan M, Astilean S, Lamy de la Chapelle M. Localized surface plasmon resonance (LSPR) biosensor for the protein detection. Plasmonics. 2013;8(2):699–704.
- Hall WP, Ngatia SN, Van Duyne RP. LSPR biosensor signal enhancement using nanoparticle−antibody conjugates. J Phys Chem C. 2011;115(5):1410–4.
- Eslami M, Moradi M, Moradi R. DFT investigation of hydrogen adsorption on the C3N nanotube. Vacuum. 2016;133:7–12.
- Thakur A, Xu C, Li WK, Qiu G, He B, Ng S-P, Wu C-ML, Lee Y. In vivo liquid biopsy for glioblastoma malignancy by the AFM and LSPR based sensing of exosomal CD44 and CD133 in a mouse model. Biosens Bioelectron. 2021;191:113476.
- Fueyo-González F, Herranz R, Plesselova S, Giron MD, Salto R, Paredes JM, Orte A, Morris MC, González-Vera JA. Quinolimide-based peptide biosensor for probing p25 in vitro and in living cells. Sens Actuators, B Chem. 2021;339:129929.
- Campion A, Kambhampati P. Surface-enhanced Raman scattering. Chem Soc Rev. 1998;27(4):241–50.
- Corio P, Brown S, Marucci A, Pimenta M, Kneipp K, Dresselhaus G, Dresselhaus M. Surface-enhanced resonant Raman spectroscopy of single-wall carbon nanotubes adsorbed on silver and gold surfaces. Phys Rev B. 2000;61(19):13202.
- Yasamineh S, Yasamineh P, Kalajahi HG, Gholizadeh O, Yekanipour Z, Afkhami H, Eslami M, Kheirkhah AH, Taghizadeh M, Yazdani Y. A state-of-the-art review on the recent advances of niosomes as a targeted drug delivery system. Int J Pharm. 2022;624:121878.
- Huang R, Harmsen S, Samii JM, Karabeber H, Pitter KL, Holland EC, Kircher MF. High precision imaging of microscopic spread of glioblastoma with a targeted ultrasensitive SERRS molecular imaging probe. Theranostics. 2016;6(8):1075.
- Harmsen S, Huang R, Wall MA, Karabeber H, Samii JM, Spaliviero M, White JR, Monette S, O’Connor R, Pitter KL. Surface-enhanced resonance Raman scattering nanostars for high-precision cancer imaging. Sci Transl Med. 2015;7(271):271ra277-271ra277.
- Amirazad H, Dadashpour M, Zarghami N. Application of decellularized bone matrix as a bioscaffold in bone tissue engineering. J Biol Eng. 2022;16(1):1–18.
- Peyressatre M, Laure A, Pellerano M, Boukhaddaoui H, Soussi I, Morris MC. Fluorescent biosensor of CDK5 kinase activity in glioblastoma cell extracts and living cells. Biotechnol J. 2020;15(9):1900474.
- Liu L, Thakur A, Kar Li W, Qiu G, Yang T, He B, Lee Y, Lawrence Wu C-M. Site specific biotinylated antibody functionalized Ag@AuNIs LSPR biosensor for the ultrasensitive detection of exosomal MCT4, a glioblastoma progression biomarker. Chem Eng J. 2022;446:137383.
- Dadashpour M, Firouzi-Amandi A, Pourhassan-Moghaddam M, Maleki MJ, Soozangar N, Jeddi F, Nouri M, Zarghami N, Pilehvar-Soltanahmadi Y. Biomimetic synthesis of silver nanoparticles using Matricaria chamomilla extract and their potential anticancer activity against human lung cancer cells. Mater Sci Eng, C. 2018;92:902–12.
- Liang D, Zhang X, Wang Y, Huo T, Qian M, Xie Y, Li W, Yu Y, Shi W, Liu Q, et al. Magnetic covalent organic framework nanospheres-based miRNA biosensor for sensitive glioma detection. Bioact Mater. 2022;14:145–51.
- Hirata E, Yukinaga H, Kamioka Y, Arakawa Y, Miyamoto S, Okada T, Sahai E, Matsuda M. In vivo fluorescence resonance energy transfer imaging reveals differential activation of Rho-family GTPases in glioblastoma cell invasion. J Cell Sci. 2012;125(Pt 4):858–68.
- Hamdan M, Righetti PG. Modern strategies for protein quantification in proteome analysis: advantages and limitations. Mass Spectrom Rev. 2002;21(4):287–302.
- Srzentić K, Fornelli L, Laskay UA, Monod M, Beck A, Ayoub D, Tsybin YO. Advantages of extended bottom-up proteomics using Sap9 for analysis of monoclonal antibodies. Anal Chem. 2014;86(19):9945–53.
- Conrotto P, Souchelnytskyi S. Proteomic approaches in biological and medical sciences: principles and applications. Exp Oncol. 2008;30:171–80.
- Li X, Chen N, Zhou X, Gong P, Wang S, Zhang Y, Zhao Y. A review of specialty fiber biosensors based on interferometer configuration. J Biophotonics. 2021;14(6):e202100068.
- Kucherenko I, Soldatkin O, Dzyadevych S, Soldatkin A. Electrochemical biosensors based on multienzyme systems: main groups, advantages and limitations—a review. Anal Chim Acta. 2020;1111:114–31.
- Plekhanova YV, Reshetilov A. Microbial biosensors for the determination of pesticides. J Anal Chem. 2019;74(12):1159–73.