Резюме
Глиобластома (ГБМ) – это агрессивный тип рака, который возникает в клетках, называемых астроцитами, которые поддерживают функционирование нервных клеток. Он может развиваться как в головном, так и в спинном мозге и также известен как мультиформная глиобластома. Глиобластома – это высокоагрессивный рак, который может возникнуть как в головном, так и в спинном мозге. Выявление ГБМ в биологических жидкостях предлагает потенциальные преимущества над существующими методами диагностики и мониторинга лечения глиальных опухолей. Выявление ГБМ с помощью биологических жидкостей фокусируется на определении опухолевых биомаркеров в крови и спинномозговой жидкости. На сегодняшний день для выявления биомаркеров ГБМ используются различные методы, начиная от различных методов визуализации и заканчивая молекулярными подходами. Каждый метод имеет свои сильные и слабые стороны. Этот обзор имеет целью тщательный анализ различных методов диагностики ГБМ, с акцентом на протеомических методах и биосенсорах. Другими словами, это исследование имеет целью предоставить обзор наиболее значимых результатов исследований, основанных на протеомике и биосенсорах для диагностики ГБМ.
Вступление
Глиобластома – самая распространенная и самая агрессивная первичная злокачественная опухоль головного мозга у взрослых. В 2016 году Всемирная организация здравоохранения (ВОЗ) классифицировала глиомы на три основных типа на основе гистологических подходов: астроцитома, олигодендроглиома и эпендимома [1, 2]. Факторы риска развития ГБМ почти не поддаются определению, а клиническое течение, как правило, фатальное [3, 4]. Диагноз основывается на гистопатологических данных, но оценка молекулярных маркеров, таких как метилирование промотора О6-метилгуанин-ДНК-метилтрансферазы (МГМТ) и изоцитратдегидрогеназы (ИДГ), а также более широкое молекулярное профилирование могут быть прогностически важными [3, 4]. Вторичные ГБМ возникают из анапластической астроцитомы или диффузной астроцитомы низкой степени злокачественности и встречаются у молодых пациентов. Они имеют низкую степень некроза, локализуются преимущественно в лобной доле и имеют значительно лучший прогноз по сравнению с первичными ГБМ [5, 6]. Хотя первичная и вторичная глиобластома почти не отличаются гистологически, они имеют разные генетические и эпигенетические профили [5,6,7].
Было сделано несколько неполных и окончательных попыток выявить специфические ассоциации между ГБМ и профессиональным воздействием и факторами окружающей среды. Ионизирующее излучение является одним из немногих идентифицированных факторов риска, который четко указывает на повышенный риск развития глиомы [8, 9]. Радиационно-индуцированная ГБМ, как правило, наблюдается спустя годы после терапевтического облучения по поводу другого заболевания или опухоли. Другие воздействия окружающей среды, такие как пестициды, ПВХ, курение, нефтепереработка и производство синтетического каучука, неточно связаны с развитием глиомы [10]. Клиника впервые диагностированной ГБМ существенно отличается в зависимости от локализации и размера опухоли, а также анатомических особенностей пораженного мозга [11]. Пациенты часто имеют симптомы внутричерепной гипертензии, включая локализованные или прогрессирующие неврологические дефекты и головную боль [11].
Ранняя диагностика ГБМ может включать магнитно-резонансную томографию (МРТ) или компьютерную томографию (КТ) [12]. МРТ с гадолиниевым контрастом освещает почти все ГБМ, выявляя образования неправильной формы с экстенсивными некротическими центрами и плотными кольцами просветления [12]. Некроз является характерным признаком ГБМ, и его наличие необходимо для отнесения опухоли головного мозга к IV степени или ГБМ по классификации ВОЗ [12]. Лечение впервые диагностированного ГБМ требует междисциплинарного подхода. Современный стандарт лечения предусматривает максимально безопасное хирургическое удаление опухоли с последующей комбинированной лучевой терапией с темозоломидом (ТМЗ), пероральным алкилирующим химиопрепаратом, и адъювантной химиотерапией с ТМЗ. Однако комплексная и полная хирургическая резекция ГБМ является сложной задачей, поскольку эти опухоли часто являются инвазивными и располагаются в важных участках мозга, которые контролируют движения, речь и ощущения. Это исследование имеет целью подтвердить последние достижения в выявлении ГБМ – от методов визуализации до протеомики и биосенсоров.
Биомаркеры и методы обнаружения ГБМ
Для разных типов опухолей используются различные биомаркеры. При ГБМ обычно используют нуклеиновые кислоты, белки, малые молекулы, микроРНК, циркулирующие опухолевые клетки (ЦОК), внеклеточные везикулы, опухолевые ткани и жидкости организма [13,14,15]. Выявление глиальных опухолей с помощью биологических жидкостей предлагает несколько подходов к улучшению качества жизни пациентов с ГБМ [16]. Раннее выявление опухолей с помощью скрининговых методов может задержать прогрессирование опухоли и повысить вероятность успешного лечения [17]. Например, при наиболее распространенных злокачественных новообразованиях, таких как рак молочной железы и рак толстой кишки, раннее выявление солидных опухолей с помощью скрининговой маммографии и колоноскопии стало устоявшейся клинической парадигмой [18,19,20,21,22,23].
Анализ злокачественных маркеров в биологических жидкостях сначала был признан при колоректальном раке, где были обнаружены повышенные уровни сывороточного карциноэмбрионального антигена [24,25,26]. Однако диагностическое значение этого нормального физиологического белка ограничено, поскольку его уровень не обязательно является повышенным, а высокие диапазоны ассоциируются с рядом других видов рака [25, 27]. Своевременная диагностика и чувствительный мониторинг лечения остаются основными проблемами в лечении ГБМ [28]. Клиническая оценка ответа в первую очередь базируется на лабораторных исследованиях и магнитно-резонансной томографии (МРТ) [28, 29]. Однако и МРТ, и лабораторные тесты являются нечувствительными показателями состояния заболевания. Например, самое низкое достаточное разрешение для распознавания с помощью МРТ составляет порядка нескольких миллиметров [28, 29]. Попытки воспользоваться преимуществами мощных визуализационных возможностей МРТ привели к альтернативным достижениям. Усовершенствованные методы МРТ, такие как диффузионно-взвешенная визуализация (ДВВ), динамическая контрастная перфузионная визуализация (ДКВ) и МР-спектроскопия (МРС), теоретически предоставляют физиологическую информацию, которую невозможно получить только с помощью обычной МРТ. Например, МРС на основе протонов (или 1H-МРС) предоставляет информацию о метаболическом составе в выбранных участках ткани-мишени, что концептуально похоже на “электронную биопсию”. Сравнение относительных концентраций этих метаболитов выявляет факторы, которые помогают оценить наличие жизнеспособных опухолей в исследуемой области, такие как оборот мембраны В-клеток и жизнеспособность нейронов. МРС является более привлекательным, чем недиагностические методы, поскольку добавляет лишь 15-30 минут к традиционной методике МРТ, которая обычно используется в лечении пациентов со злокачественной глиомой [30, 31]. Таким образом, внеклеточные везикулы (ВВ) являются резервуарными биомаркерами с большим потенциалом для оценки опухолей глиобластомы in situ [30, 32]. Несколько молекулярных маркеров все еще находятся на стадии исследования, но рутинно используются у пациентов с ГБМ, включая изоцитратдегидрогеназу (ИДГ), О6-метилгуанин ДНК-метилтрансферазу (МГМТ), VEGF и рецептор эпидермального фактора роста (EGFR). Кроме того, белок-супрессор опухолей TP53, фосфатазы, гомолог тензина (PTEN), ген p16INK4a, метаболиты фосфолипидов, раковые стволовые клетки, а в последнее время и биомаркеры визуализации – все они были широко валидированы в клинических условиях [33] (Таблица 1).
Таблица 1 Биомаркеры ГБМ и методы их выявления
| # | Биомаркер | Методы | Комментарии | Ссылки |
| 1 | Солидная опухоль | МРТ | Солидные опухоли, как правило, высокоагрессивные, трудно поддаются лечению с помощью полной хирургической резекции или лучевой терапии, а также ассоциируются с частыми рецидивами и плохим прогнозом | [34, 35] |
| 2 | микроРНК | ПЦР-ОТ | Некоторые микроРНК, такие как miR-10b, miR-5096, mi-R-709 и miR-19a, способствуют дифференциации олигодендроцитов | [36, 37] |
| 3 | ИДГ
ИДГ ИДГ |
Миниатюрный масс-спектрометр | ИДГ мутантная ГБМ является конечной стадией злокачественного прогрессирования ИДГ мутантной диффузной астроцитомы (класс II по ВОЗ) или ИДГ мутантной анапластической астроцитомы (класс III по ВОЗ). | [38, 39] |
| МРТ | – | [40] | ||
| Мультипараметрическая МРТ | – | [41] | ||
| 4 | EVs | Масс-спектрометрия | ВВ полученные из сыворотки крови пациентов с ГБМ, также ассоциируются с цитокинами, способствующими развитию опухоли, которые поддерживают Th2, а не Th1 фенотип. | [31, 42] |
| 5 | EGFR | Масс-спектрометрия | В глиомах, в частности глиобластомах, выявлено много изменений в гене EGFR, включая амплификации, делеции и однонуклеотидные полиморфизмы (ОНП). | [43] |
| 6 | p16INK4a ген | Метилирование генов | p16INK4A это ген-супрессор опухолей, мутации и/или делеции которого часто встречаются во многих опухолях человека, включая глиобластомы, меланому и лейкемии. | [44, 45] |
| 7 | Метаболиты фосфолипидов | ELISA | Липидный обмен, в частности метаболизм фосфолипидов, значительно изменяется при различных типах рака, в том числе при ГБМ. | [46,47,48] |
| 8 | Раковые стволовые клетки | МРТ | ГБМ, самая распространенная и самая злокачественная первичная опухоль головного мозга, содержит самовосстанавливающиеся, опухолегенные раковые стволовые клетки (РСК), которые играют определенную роль в развитии опухоли и способствуют резистентности к терапии. | [49, 50] |
| 9 | PTEN | Скрининг нового поколения | PTEN – это фосфатаза PIP3, которая функционирует как антагонист канцерогенной сигнализации PI3-киназы. Это один из самых мощных мутантных супрессоров опухолей, особенно в опухолях головного мозга, поскольку он играет решающую роль в подавлении мощных сигнальных путей. | [51, 52] |
- 1. Диагностическая визуализация является одним из нескольких методов выявления ГБМ, которые подробно описаны в Таблице 1. Несмотря на свои преимущества, этот подход имеет определенные недостатки, самым существенным из которых является его недостаточная специфичность. Технология визуализации также требует дорогостоящего, высокотехнологичного оборудования, а также квалифицированного персонала
- МРТ Магнитно-резонансная томография, ПЦР-ОТ Полимеразная цепная реакция с обратной транскрипцией, ELISA Иммуноферментный анализ, TH2 Т-хелпер 2, TH1 Т-хелпер 1, ВВ Внеклеточные везикулы, ИДГ изоцитратдегидрогеназа, МГМТ O6-метилгуанин ДНК-метилтрансфераза, EGFR рецептор эпидермального фактора роста, TP53 белок-супрессор опухолей, PTEN-фосфатаза и гомолог тензина
Протеомика
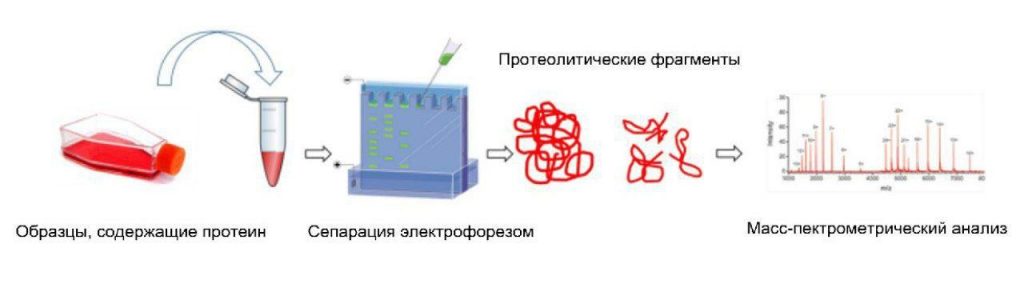
Платформы на основе протеомики становятся все более мощными в выявлении потенциальных механизмов заболеваний и биомаркеров [53]. Протеомика предполагает использование сверхсложных методов скрининга белков для широкомасштабного биологического понимания [53]. Эта информация может быть объединена с геномными данными для достижения лучшего понимания биологических механизмов, лежащих в основе синдрома Гийена-Барре (СГБ) [53, 54]. Типичным методом предварительной обработки образцов для протеомного анализа является расщепление белков протеазами (такими как трипсин или LysC) до пептидов, их разделение с помощью обратно-фазовой жидкостной хроматографии C18 и анализ с помощью масс-спектрометрии (ОЖХГ/МС) [55]. На рисунке 1 приведено краткое введение в метод протеомики.
Рисунок 1
Иллюстрация метода протеомики [56].
Подходы протеомики могут быть легко использованы для выяснения природных механизмов продуцирования микроорганизмов и растений [57, 58]. Эта стратегия также успешно применяется к различным типам заболеваний, таких как пародонтит, болезнь Альцгеймера, заболевания щитовидной железы и различные типы опухолей [59, 60]. В глиоме методы протеомики выявили изменения в экспрессии белков, но последовательность и биологическое значение этих изменений не установлены [61]. Много инновационных протеомных исследований проводятся по различным аспектам иммунотерапии глиомы, включая онколитические вирусы, моноклональные антитела, вакцины из дендритных клеток (ДК) и Т-клетки с химерными антигенными рецепторами (ХАР) [61]. Поэтому применение протеомики в иммунотерапии может ускорить исследования в области лечения ГБМ [61]. Протеомный анализ человека на основе клинической масс-спектрометрии (МС) крови является мощным инструментом для изучения биомаркеров рака [62]. За последнее десятилетие сообщалось о многочисленных клинических исследованиях ГБМ с использованием различных количественных подходов. Масс-спектрометрия с последовательным получением всех фрагментов теоретических ионных спектров (ППФС-МС) является новым количественным методом, который сочетает высокоспецифичный независимый от данных метод получения (НМП) с новой стратегией целенаправленного извлечения данных для получения результирующего набора ионных фрагментов [62]. ППФС- МС анализ предлагает несколько преимуществ в открытии протеомики, включая высокую воспроизводимость и надежную количественную информацию [63]. Сочетание ППФС-МС и QTAP-анализа позволило выявить восемь биомаркеров-кандидатов в плазме пациентов с ГБМ [64]. Количественная протеомика на основе масс-спектрометрии без меток была разработана для идентификации и характеристики белков, которые дифференцированно экспрессируются при ГБМ, для лучшего понимания взаимодействий и функций, которые приводят к развитию заболевания. Углубленная идентификация восходящих регуляторов обеспечивает новые потенциальные терапевтические мишени. Опухоли ГБМ анализировали с помощью SDS PAGE фракций с внутренними ДНК-маркерами с последующей жидкостной хроматографией-тандемной масс-спектрометрией (МС) [65]. ]. Основным вызовом в исследовании ГБМ было выявление новых молекулярных терапевтических мишеней и точных диагностических/прогностических биомаркеров. Многие современные клинические терапевтические мишени для иммунотоксинов и лиганд-направленных токсинов против клеток глиомы высокой степени злокачественности (ГВСЗ) являются поверхностно сиализированными гликопротеинами [66]. Для характеристики и точного количественного определения одноклеточного поверхностного сиалопротеина в ткани ГБМ человека, астроцитах человека, эмбриональных и взрослых нейронных клетках-предшественниках (НКП) человека было охарактеризовано и точно количественно определено с помощью стратегии биоортогонального химического репортера (БОХР) в сочетании с безметочной количественной масс-спектрометрией (БМКМС). Этот подход комплексно определяет новые биомаркеры и терапевтические мишени для лечения злокачественной глиомы с помощью количественной протеомики сиалогликопротеинов с клинически значимыми первичными клетками глиомы, полученными от пациентов [66]. Кроме того, был разработан простой и чувствительный таргетированный протеомный метод для количественного определения мембранных и белковых факторов транскрипции в дегенерированных белковых путях клеток глиобластомы. Этот метод использует жидкостную хроматографию и масс-спектрометрию для обеспечения высокой чувствительности обнаружения и получения количественных данных для прогностического анализа и тестирования эффективности [67]. Наиболее злокачественной формой среди всех глиом является ГБМ, которая характеризуется плохим ответом на лечение и высокой степенью гетерогенности. Субвентрикулярная зона (СВЗ) является ключевым участком нейрогенеза мозга и богата нейронными стволовыми клетками. Поскольку опухоли ГБМ часто располагаются вблизи СВЗ, их можно классифицировать как СВЗ- или СВЗ+. Опухоли, которые находятся в непосредственной близости к СВЗ, классифицируются как СВЗ+, тогда как опухоли, которые удалены от СВЗ, классифицируются как СВЗ-. Чтобы получить представление о повышенной агрессивности СВЗ+ опухолей, были применены протеомные системы, такие как ОЖХГ/МС и 2DDIGE, для изучения возможных изменений протеомики между двумя подтипами. В то время как протеомный анализ сыворотки крови выявил значительные изменения в различных белках, переносящих липиды, и белках острой фазы, протеомный анализ тканей показал значительные изменения в регуляторных белках, связывании липидов, цитоскелете, шаперонах и клеточном цикле. Эти результаты дают ключ к молекулярной основе повышенной агрессивности опухолей СВЗ+ ГБМ и могут привести к определению терапевтических мишеней для улучшения лечения этих высокоинвазивных опухолей [68].
Количественная ПЦР в реальном времени (кПЦРРВ) и масс-спектрометрия (МС) были использованы для идентификации потенциальных мишеней для длинных некодирующих РНК (днРНК) HULC, которые способствуют прогрессированию ГБМ [69, 70]. Подход на основе протеомики в образцах пациентов был использован для идентификации антигенов-мишеней Т-клеток в интегрированных стволовых клетках глиобластомы. В этом исследовании был обнаружен новый иммуногенный белок, который часто индуцирует опухолеспецифические Т-клеточные ответы у пациентов с ГБМ, а также обнаруживается в резистентных к терапии, беспокойных и медленно циркулирующих СКГ in vitro. Стабильная экспрессия этих Т-клеточных мишеней в первичных и рецидивирующих ГБМ подтверждает их пригодность для будущего клинического применения [71].
Полученные результаты свидетельствуют о том, что протеомика предполагает использование сверхсложных методов скрининга белков, которые могут быть использованы для широкомасштабного биологического понимания ГБМ. Эта информация может быть объединена с геномными данными для лучшего понимания основных биологических механизмов, лежащих в основе ГБМ.
Биосенсорная технология
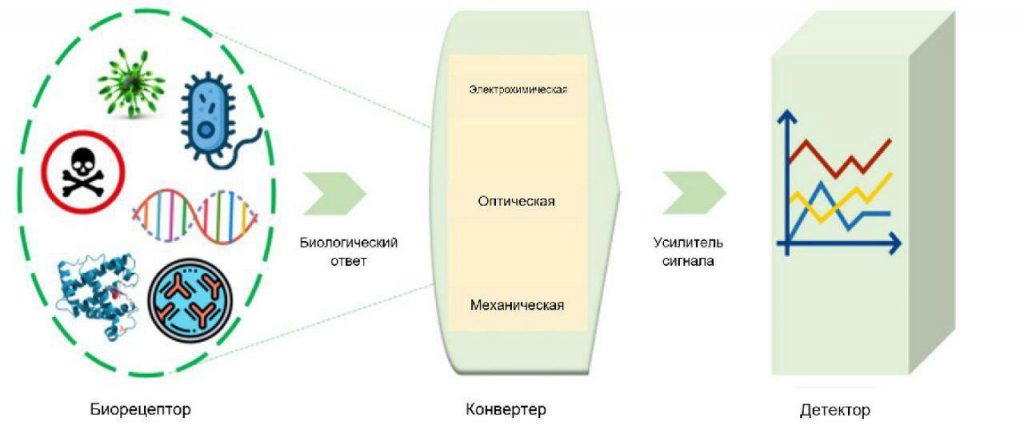
Мониторинг и диагностика различных нарушений требуют значительных усилий для регулярного исследования образцов крови и проведения сопутствующих тестов [72,73,74]. Однако эти тесты требуют общих аналитических методик, эффективного персонала для их выполнения и времени для сбора необходимых образцов для клинических исследований [75]. Лабораторные тесты позволяют квалифицированному персоналу осуществлять мониторинг и диагностировать различные заболевания [73, 75]. Известно, что определенные анализы являются специфическими для определенного заболевания и могут быть полезными для мониторинга его прогрессирования [76, 77]. Клиническая полезность биохимических тестов определяется их чувствительностью для выявления заболевания без ложноотрицательных результатов и специфичностью для избежания ложноположительных результатов у людей, которые не болеют [76]. Биосенсоры используют специфичность биомолекул в сочетании с физико-химическими преобразователями для преобразования биологических сигналов в оптические/электрохимические сигналы [78]. Схема биосенсорной технологии приведена на рисунке 2.
Рисунок 2
Схема биосенсорной технологии
Многочисленные биосенсоры на основе метаболитов доступны для мониторинга клинически важных параметров, таких как уровень сахара в крови, мочевины, мочевой кислоты, молочной кислоты, холестерина и других [56]. Эти биосенсоры больше по размерам, чем дополнительные лабораторные анализы веществ, участвующих в клиническом анализе [72]. Ферменты хорошо известны для разработки биосенсоров из-за их специфичности как биологических сенсорных материалов, а их роль в клинической диагностике известна уже несколько лет. Однако ферменты менее стабильны в растворе и требуют иммобилизации и стабилизации для использования в биосенсорных устройствах [79]. Иммобилизованная фаза обеспечивает превосходную стабильность и может быть использована повторно. Сшивание, ковалентное связывание, физсорбция, инкапсуляция и захват – вот некоторые из методов, используемых для стабилизации ферментов для разработки биосенсорных устройств [80]. Матрица или основа, выбранная для иммобилизации, зависит от природы метода иммобилизации и биомолекулы. Для иммобилизации биомолекул/ферментов при разработке различных типов биосенсоров используют различные матрицы, такие как полимерные пленки и углерод, графит, мембраны, гели, LB пленки, диафосфаты и проводящие полимеры [80,81,82].
Биосенсоры разработаны для выявления биомаркеров СГБ
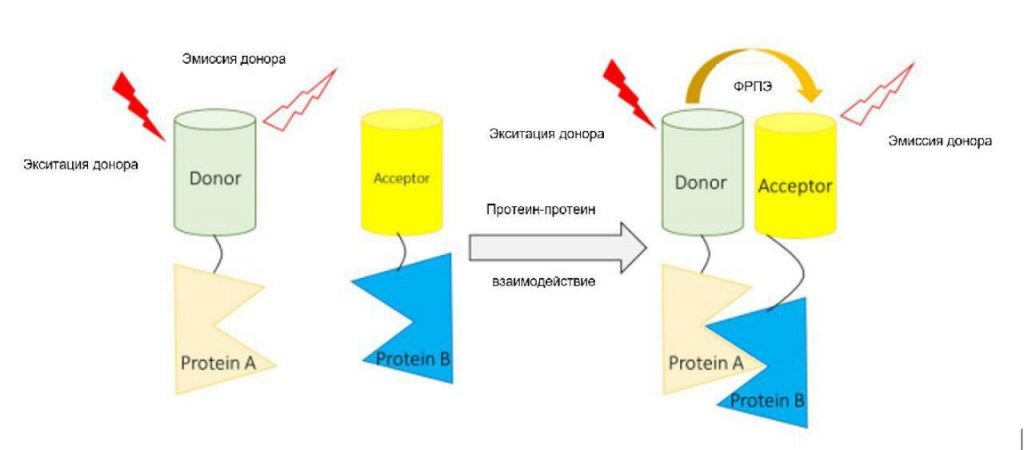
В этом исследовании была создана новая и чувствительная электрогенная хемилюминесцентная (ЭХЛ) биосенсорная система для выявления гена p16INK4a с использованием функционального пастообразного нановолоконного композитного углеродного электрода, модифицированного трафаретной печатью (УЭТП) [83]. Мутации в ДНК-связывающем домене р53 влияют на его конформацию и способность связываться с хроматином, тем самым влияя на его способность регулировать экспрессию генов-мишеней и функцию контрольных точек клеточного цикла во многих видах рака, включая ГБМ. Низкомолекулярные препараты, которые восстанавливают структуру и функцию неправильно свернутого р53, могут усилить химиотерапию, активируя р53-опосредованное старение. Для определения изменений в структуре белка р53, опосредованных низкомолекулярными препаратами, был сконструирован биосенсор молекулярной комплементации (NRLUCp53CRLUC) для расщепленной Renilla-люциферазы (RLUC). После первичной оценки биосенсоров на трех различных клеточных линиях сконструированная платформа идентифицировала эндогенно модифицированный p53P98L [84]. Флуоресцентный резонанс/Фостеровский перенос энергии (ФРПЭ) – это безызлучательная передача энергии между двумя молекулами, которая может происходить, когда две молекулы находятся в непосредственной близости (< 10 нм) [85, 86]. Как следствие, ФРПЭ можно использовать для измерения того, взаимодействуют ли две молекулы, такие как лиганд и рецептор, друг с другом [85, 86]. Для того, чтобы ФРПЭ состоялся, спектр флуоресцентного излучения донора должен перекрываться со спектром поглощения акцептора, а ориентации диполей перехода должны быть примерно параллельными [85, 86]. На рисунке 3 приведена иллюстрация применения метода ФРПЭ для выявления взаимодействия белок-белок.
Рисунок 3
Иллюстрация подхода на основе ФРПЭ для выявления белок-белковых взаимодействий. С помощью ФРПЭ-зондов клетки глиомы, которые проникают в паренхиму мозга, имеют более высокую активность Rac1 и Cdc42 и более низкую активность RhoA, чем клетки, которые проникают в периваскулярную зону. Другими словами, метод на основе ФРПЭ оказался полезным для мониторинга способа инвазии клеток ГБМ. Это можно контролировать путем балансировки активности ГТФазы семейства Rho и Cdc42-специфического GEF
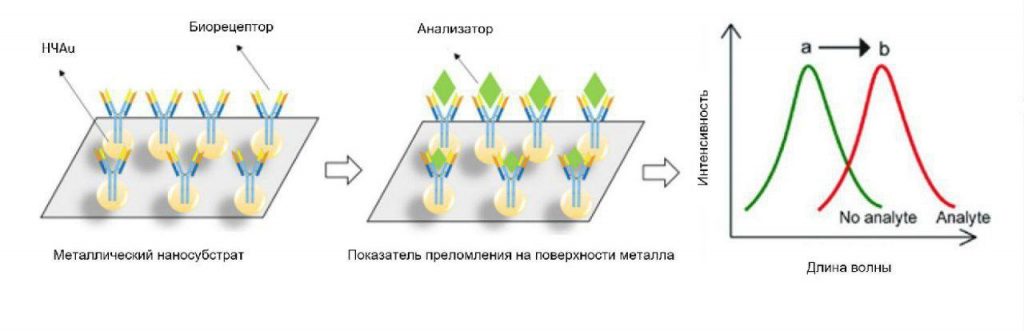
Электрическое клеточно-субстратное импедансное зондирование (ЭКИЗ) – это безметочная методика, основанная на импедансе, для анализа в реальном времени поведения клеток согласно их адгезии [87]. Несколько исследований показали, что ЭКИЗ подходит для измерения адгезии клеток ГБМ и может измерять их адгезию. Результаты показали, что ЭКИЗ надежно измеряет адгезию дифференцированных клеток ГБМ на различных типах матриц. Кроме того, ЭКИЗ может измерять миграционное поведение дифференцированных клеток ГБМ на электроде ЭКИЗ после изменения [88]. Однако, поскольку стволовые клетки ГБМ являются адгезивными, ЭКИЗ имеет значительно более низкую способность измерять адгезию по сравнению с дифференцированными аналогами. Это означает, что хотя ЭКИЗ может быть полезным для некоторых культур ГБМ, он может быть не очень полезным для стволовых клеток со слабой адгезией [88]. Был разработан электрохимический биосенсор для обнаружения формальдегида в водных растворах с помощью фермента формальдегид дегидрогеназы в сочетании с модифицированными углеродными нанотрубками (УНТ) электродом трафаретной печати (ЭТП). Предложенная система экранирует амперометрический ответ на формальдегид, высвобождаемый из клеток ГБМ человека U251 в биосенсорном отделении в ответ на обработку различными противоопухолевыми препаратами, состоящими из формальдегида и масляной кислоты [74, 89,90,91]. Поверхностные плазмонные поляритоны (ППП), также известные как поверхностные плазменные волны, представляют собой уникальный режим электромагнитного поля, который может возникать на границе раздела между диэлектриком и металлом. Эти ППП ведут себя почти так же, как плазма свободных электронов [92, 93]. Поверхностные плазмоны характеризуются своими константами распространения и распределением магнитного поля, они находятся в поперечном магнитном режиме (магнитные векторы перпендикулярны к направлению распространения волны и параллельны к границе раздела) [92, 93]. Биосенсорика на основе локализованного поверхностного плазмонного резонанса (ЛППР) обеспечивает чувствительный, безмолекулярный, недорогой и быстрый метод обнаружения биомолекулярных взаимодействий с пространственным разрешением на наноуровне [94,95,96]. Этот метод является перспективным для надежного и точного обнаружения биомолекулярных взаимодействий. Портативность и малый размер сенсоров позволяют миниатюризировать датчики до масштабов, недостижимых для других планарных методов, таких как ППР. Биосенсорные устройства на основе ЛППР легко изготавливать, используя недорогую сенсорную платформу. Полезность зондирования на основе ЛППР можно повысить, интегрировав его в мультиплексированные микрофлюидные устройства [94, 95]. На рисунке 4 приведена схема биосенсора ЛППР.
Рисунок 4
Схематический рисунок биосенсора ЛППР
В ГБМ секретируемый лактат способствует экспрессии кластера дифференцировки 44 (CD44) и высвобождению клеточных нановезикул (30-200 нм), таких как экзосомы, что способствует злокачественной прогрессии опухолей. В смертельных опухолях головного мозга лактат-управляемая регуляция злокачественных клеток глиобластомы (ГМ) способствовала высвобождению экзосом, богатых CD44, увеличению миграции ГМ и образованию эндотелиальных клеток, а также секреции экзосом. Было обнаружено, что CD44 может быть сенсибилизирован “захватом” титана и идентифицирован биосенсором ЛППР (см. рисунок 5) [97].
Рисунок 5
Этот рисунок заимствован из ссылки [97]
На этом рисунке представлен высокочувствительный метод обнаружения экзосомальных CD44 и CD133 с помощью биосенсоров TIC-AFM и TiN-NH-LSPR для отслеживания прогрессирования ГБМ у мышей. В опухолевом микроокружении (ОМО) клетки ГБМ используют накопленный внеклеточный лактат для своего выживания, частично путем повышения регуляции CD44 и CD133 и высвобождения экзосом. Эти экзосомы не только делают клетки более злокачественными, но и позволяют соседним ЭК стать более ангиогенными. Киназа CDK5 активируется через контакт с различными компонентами, включая регуляторы p35/p25. Активная CDK5 играет жизненно важную роль в некоторых нейронных функциях, а ее гиперактивность способствует развитию различных видов рака человека и некоторых нейродегенеративных процессов, особенно нейробластомы и ГБМ. Зонд-партнер, который взаимодействует с CDK5, и синтетический флуоресцентный хинолимидный пептид, полученный из чашечки CDK5, были внедрены in vitro для выявления клеток нейробластомы N2a и ГБМ U87 [98].
Поверхностно-усиленное резонансное рамановское рассеяние (ПУРР) – это чувствительный и селективный метод для характеристики биомолекулярных участков, которые демонстрируют электронные переходы при энергиях, близких или согласованных с частотой используемого лазера [99, 100]. Биомолекулы адсорбируются на соответствующей металлической подложке, обычно серебряной, и измерения обычно проводятся in situ в буферной или поддерживающей среде. Эта процедура имеет несколько преимуществ. Резонансную чувствительность и чувствительность поверхностно-усиленного рамановского рассеяния (ПУРР) можно комбинировать, что позволяет использовать эти методы для измерения наноразмерных концентраций [99,100,101]. Обнаружение наночастиц ППРР с помощью метода визуализации на основе спектроскопии поверхностно-усиленного рамановского рассеяния имеет значительные преимущества перед другими подходами с использованием молекулярных контрастных веществ [102]. Например, по сравнению с флуоресцентной визуализацией, наши ПУРР нанозонды не только имеют более высокую чувствительность, но и гораздо более высокую фотостабильность, чем современные флуорохромы [102]. При возбуждении одним источником с длиной волны 785 нм наночастицы ПУРР с различными рамановскими репортерами излучают сложный спектр [102,103,104]. Способность наночастиц поверхностно-усиленного резонансного рамановского рассеяния (ПУРР), нацеленных на интегрин, точно отображать истинный размер опухоли в модели ГБМ мыши, которая приближенно имитирует патологию у человека, была должным образом исследована. Эта технология визуализации наночастиц на основе рамановской спектроскопии является перспективной для обеспечения высокоточной визуализации истинного размера злокачественных опухолей головного мозга [102]. На основе библиотеки CDK5-специфических субстратов сконструирован флуоресцентный пептидный репортер активности киназы CDK5. Установлена его способность реагировать с рекомбинантным CDK5/p25, а чувствительные изменения интенсивности флуоресценции сообщают об активности CDK5 в клеточном экстракте глиобластомы. Был разработан клеточно-проникающий вариант этого биосенсора, который можно использовать для пространственного и временного картирования динамики активации CDK5. Это открывает широкие возможности для разработки диагностических тестов для выявления нейропатологии, связанной с чрезмерной активацией CDK5, а также сопутствующих тестов для оценки реакции на новые методы лечения, направленные на эту киназу [105]. Для обнаружения бесконечно малого количества экзосомных биомаркеров был разработан чип-сенсор на основе локализованного поверхностного плазмонного резонанса (ЛППР). Сенсорный чип использовал самосборные наночастицы серебра, обложенные золотыми наноостровками (Ag@AuНО), для обеспечения специфической биоконъюгации биотинированных антител для выявления экзосомальных поверхностных биомаркеров [106, 107]. Кроме того, был создан биосенсор на основе магнитно-ковалентных органических каркасных наносфер на основе микроРНК для чувствительного обнаружения глиомы [108] (табл. 2).
Таблица 2 Разработанные биосенсоры для выявления биомаркеров СГБ
| # | Биомаркер | Платформа | Техника | НЧAu | Линейный диапазон | Предел обнаружения (ПО) | Ссылки | |||
| 1 | p53 | Флуоресцентная микроскопия | Визуализация клеток | – | от 0,375 до 250 мкМ | 31,25 мкМ | [84] | |||
| 2 | Родина Rho | ФРПЭ | – | – | 16 106 клеток в 1 мл | 20 мМ | [109] | |||
| 3 | Стволовые клетки | ECIS | – | – | – | – | [88] | |||
| 4 | Формальдегид (AN) | ECL | Амперометрический | MWCNTs, SPE | 0,1-100 мкМ | 0,1 мкМ | [89] | |||
| 5 | СГБ | ЛППР | – | НЧAu | 0,005 до 50 мкг/мл | 5,29 × 10-1 мкг/мл | [97] | |||
| 6 | CDK5 Киназа | ФРПЭ | Спектр Uvis | – | – | 0,2 мкМ | [98] | |||
| 7 | Опухоли | ПУРР | Зонд молекулярной визуализации | НЧAu | 3,5 нМ | 10-15 M | [102] | |||
| 8 | CDK5 Киназа | – | Флуоресцентный | – | 10 мкг | – | [105] | |||
| 9 | Экзосомальный MCT4 | ЛППР | Оптический | Ag@AuNIs | 0,4 нг/мл | 4 × 10−4 до 50 мкг/мл | [106] | |||
| 10 | МикроРНК-182 | МКОН | ЭХЛ | Fe3O4 | 20 фм | 0.1 – 10 пм | [108] | |||
p53 Опухолевый белок p53, ФРПЭ Флуоресцентный резонанс/Фостеровский перенос энергии, ЭКИЗ Электрическое клеточно-субстратное импедансное зондирование, МКОН Магнитно-ковалентные органические наноструктуры, НЧAu Наночастицы золота, ЭХЛ Электрогенная хемилюминесценция, ЛППР Биосенсорика на основе локализованного поверхностного плазмонного резонанса, ППРР Поверхностно-усиленное резонансное рамановское рассеяние, СГБ Синдром Гийена – Барре, МСУНТ Многослойные углеродные нанотрубки, КЭП Коэффициент эффективности поверхности.
Сравнение технологий протеомики и биосенсоров в идентификации ГБМ
Как отмечалось ранее, существует несколько способов диагностики ГБМ, каждый из которых имеет свои преимущества и недостатки. Основная цель этого исследования – помочь в выборе подходящего метода для диагностики ГБМ. Для достижения этой цели в этом разделе сравниваются методы протеомики и биосенсорики. В таблице 3 обобщены преимущества и недостатки протеомики и биосенсоров в выявлении ГБМ.
Таблица 3 Преимущества и недостатки протеомики и биосенсоров в идентификации ГБМ
| Методы | Преимущества | Недостатки |
| Протеомика | Высокая пропускная способность позволяет оценивать сотни полипептидов за один прогон и специально разработана для обнаружения взаимодействия белков с различными молекулярными типами. Антитела можно использовать для зондирования полипептидов и обнаружения посттрансляционных изменений. Экспрессию белка можно измерять полуколичественно, и эти методы совместимы с другими методами [110,111,112]. | Распознаются только известные белки и имеют небольшой динамический диапазон по сравнению с другими методами изоляции. Они также специфичны к антителам и могут иметь трудности с идентификацией нативных конформаций белков, может происходить подавление сигнала очень большим количеством белков, а также ограниченная повторяемость, что требует подтверждения для клинического диагноза. Кроме того, методы протеомики часто требуют небольших, относительно чистых образцов, и заставить белки принять их нативную конформацию может быть сложно [110,111,112]. |
| Биосенсоры | Стратегия практического применения биосенсорной системы должна учитывать несколько факторов, включая широкий диапазон обнаружения, низкий предел обнаружения (НПО), быстрое время реакции, низкую стоимость и простоту системы, хорошую чувствительность и специфичность, высокую селективность, приемлемую стабильность и простой метод производства [113,114,115]. | Потребность в больших размерах образцов, ограниченная пропускная способность, разнообразие оборудования, адсорбция компонентов раствора на поверхности мембраны и влияние на режимы переноса заряда – все это может привести к неточности измерений в электрохимическом зондировании. Кроме того, восстановление поверхности микроэлектродов может быть сложной задачей. Поэтому протокол реактивации электрода, который включает сложные методы программируемого потенциала, может помочь повысить точность измерения [113,114,115]. |
Заключение
Протеомический анализ является ценным методом в исследованиях, связанных с ГБМ, для определения взаимосвязей между внутриклеточными белками. Он может предоставить как качественную, так и количественную информацию, идентифицировать тип экспрессируемого белка и исследовать фенотип каждого экспрессируемого белка при различных условиях. Аналогично, биосенсоры являются мощным инструментом для диагностики глиомы. Проверенные исследования показали, что использование биосенсоров для выявления биомаркеров в жидкостях организма является целесообразным. Другие методы, такие как МРТ и протеомика, могут быть пригодными для изучения опухолей, их структуры, размера и морфологии. Таким образом, биосенсоры играют важную роль в развитии датчиков ГБ для быстрого, эффективного и недорогого обнаружения. Постоянная работа и прогресс в создании крупномасштабных плазменных наноструктур достигается с помощью различных методов, таких как микросферная литография, изготовление суперпарамагнитных частиц, интерференционная литография, наноимпринтинг и новые конструкции с улучшенными эксплуатационными характеристиками. Для методов ППР, ЛППР, ПУРР, SEF, SEIRA полезным является более точный способ считывания, который уменьшает затраты и облегчает тестирование с подложками большой площади, а также усиление сигнала.
Ссылки на источники:
- Kamran N, Alghamri MS, Nunez FJ, Shah D, Asad AS, Candolfi M, Altshuler D, Lowenstein PR, Castro MG. Current state and future prospects of immunotherapy for glioma. Immunotherapy. 2018;10(4):317–39.
- Wen PY, Huse JT. 2016 World Health Organization classification of central nervous system tumors. CONTINUUM: Lifelong Learn Neurol. 2017;23(6):1531–47.
- Alexander BM, Cloughesy TF. Adult glioblastoma. J Clin Oncol. 2017;35(21):2402–9.
- Davis ME. Glioblastoma: overview of disease and treatment. Clin J Oncol Nurs. 2016;20(5):S2.
- Stragliotto G, Pantalone MR, Rahbar A, Söderberg-Nauclér C. Valganciclovir as add-on to standard therapy in secondary glioblastoma. Microorganisms. 2020;8(10):1471.
- Kleihues P, Ohgaki H. Primary and secondary glioblastomas: from concept to clinical diagnosis. Neuro Oncol. 1999;1(1):44–51.
- Yousefi B, Mohammadlou M, Abdollahi M, Salek Farrokhi A, Karbalaei M, Keikha M, Kokhaei P, Valizadeh S, Rezaiemanesh A, Arabkari V. Epigenetic changes in gastric cancer induction by Helicobacter pylori. J Cell Physiol. 2019;234(12):21770–84.
- Ellor SV, Pagano-Young TA, Avgeropoulos NG. Glioblastoma: background, standard treatment paradigms, and supportive care considerations. Los Angeles: SAGE Publications; 2014.
- Shafiei M, Ghasemian A, Eslami M, Nojoomi F, Rajabi-Vardanjani H. Risk factors and control strategies for silicotuberculosis as an occupational disease. New Microbes New Infect. 2019;27:75–7.
- Johnson DR, Fogh SE, Giannini C, Kaufmann TJ, Raghunathan A, Theodosopoulos PV, Clarke JL. Case-based review: newly diagnosed glioblastoma. Neuro-oncol Pract. 2015;2(3):106–21.
- Young RM, Jamshidi A, Davis G, Sherman JH. Current trends in the surgical management and treatment of adult glioblastoma. Ann Transl Med. 2015;3(9):121.
- Scribner EY. Mathematical modeling of brain tumors advances patient care, oncogenesis, and the use of in silico clinical trials. The University of Alabama at Birmingham; 2017.
- Birkó Z, Nagy B, Klekner Á, Virga J. Novel molecular markers in glioblastoma-benefits of liquid biopsy. Int J Mol Sci. 2020;21(20):7522.
- Zhou E, Li Y, Wu F, Guo M, Xu J, Wang S, Tan Q, Ma P, Song S, Jin Y. Circulating extracellular vesicles are effective biomarkers for predicting response to cancer therapy. EBioMedicine. 2021;67:103365–103365.
- Amirsaadat S, Jafari-Gharabaghlou D, Dadashpour M, Zarghami N. Potential anti-proliferative effect of nano-formulated curcumin through modulating micro RNA-132, Cyclin D1, and hTERT genes expression in breast cancer cell lines. J Clust Sci. 2023. https://doi.org/10.1007/s10876-023-02404-z.
- Krol I, Castro-Giner F, Maurer M, Gkountela S, Szczerba BM, Scherrer R, Coleman N, Carreira S, Bachmann F, Anderson S. Detection of circulating tumour cell clusters in human glioblastoma. Br J Cancer. 2018;119(4):487–91.
- Figueroa JM, Carter BS. Detection of glioblastoma in biofluids. J Neurosurg. 2017;129(2):334–40.
- Mogheri F, Jokar E, Afshin R, Akbari AA, Dadashpour M, Firouzi-amandi A, Serati-Nouri H, Zarghami N. Co-delivery of metformin and silibinin in dual-drug loaded nanoparticles synergistically improves chemotherapy in human non-small cell lung cancer A549 cells. J Drug Deliv Sci Technol. 2021;66:102752.
- Ahmadi S, Dadashpour M, Abri A, Zarghami N. Long-term proliferation and delayed senescence of bone marrow-derived human mesenchymal stem cells on metformin co-embedded HA/Gel electrospun composite nanofibers. J Drug Deliv Sci Technol. 2023;80:104071.
- Nejati K, Rastegar M, Fathi F, Dadashpour M, Arabzadeh A. Nanoparticle-based drug delivery systems to overcome gastric cancer drug resistance. J Drug Deliv Sci Technol. 2022;70:103231.
- Eslami M, Yousefi B, Kokhaei P, Hemati M, Nejad ZR, Arabkari V, Namdar A. Importance of probiotics in the prevention and treatment of colorectal cancer. J Cell Physiol. 2019;234(10):17127–43.
- Salek Farrokhi A, Mohammadlou M, Abdollahi M, Eslami M, Yousefi B. Histone deacetylase modifications by probiotics in colorectal cancer. J Gastrointest Cancer. 2020;51:754–
- Ghorbani F, Kokhaei P, Ghorbani M, Eslami M. Application of different nanoparticles in the diagnosis of colorectal cancer. Gene Rep. 2020;21:100896.
- Ota T, Sakashita K, Sawada R, Seki K, Maeda H, Tanaka N, Tsujinaka T. Long-term survival with nivolumab followed by irinotecan after total gastrectomy in alpha-fetoprotein-producing gastric cancer: a case report and review of the literature. Surgical Case Reports. 2023 Dec;9(1):1-8.
- Aoki T, Kondo Y, Karakida K, Naito H, Kajiwara H, Ota Y. A mucinous adenocarcinoma of the lip with elevated serum carcinoembryonic antigen levels: a case report. Oral Maxillofac Surg. 2020;24(1):127–32.
- Hemmati M, Yousefi B, Bahar A, Eslami M. Importance of heme oxygenase-1 in gastrointestinal cancers: functions, inductions, regulations, and signaling. J Gastrointest Cancer. 2021;52:454–61.
- Salek Farrokhi A, Darabi N, Yousefi B, Askandar RH, Shariati M, Eslami M. Is it true that gut microbiota is considered as panacea in cancer therapy? J Cell Physiol. 2019;234(9):14941–50.
- Sorensen AG, Batchelor TT, Wen PY, Zhang W-T, Jain RK. Response criteria for glioma. Nat Clin Pract Oncol. 2008;5(11):634–44.
- Grossman SA, Batara JF. Current management of glioblastoma multiforme. Semin Oncol. 2004;31:635–44.
- Hallal S, Azimi A, Wei H, Ho N, Lee MYT, Sim H-W, Sy J, Shivalingam B, Buckland ME, Alexander-Kaufman KL. A comprehensive proteomic SWATH-MS workflow for profiling blood extracellular vesicles: a new avenue for glioma tumour surveillance. Int J Mol Sci. 2020;21(13):4754.
- Mondal A, Ashiq K, Phulpagar P, Singh DK, Shiras A. Effective visualization and easy tracking of extracellular vesicles in glioma cells. Biol Proced Online. 2019;21(1):1–12.
- Liu H, Kang M, Wang J, Blenkiron C, Lee A, Wise M, Chamley L, Chen Q. Estimation of the burden of human placental micro-and nano-vesicles extruded into the maternal blood from 8 to 12 weeks of gestation. Placenta. 2018;72:41–7.
- Carlsson SK, Brothers SP, Wahlestedt C. Emerging treatment strategies for glioblastoma multiforme. EMBO Mol Med. 2014;6(11):1359–70.
- Li X, Feng Q, Jiang X. Microfluidic synthesis of Gd-based nanoparticles for fast and ultralong MRI signals in the solid tumor. Adv Healthc Mater. 2019;8(20):1900672.
- Alves TR, Lima FRS, Kahn SA, Lobo D, Dubois LGF, Soletti R, Borges H, Neto VM. Glioblastoma cells: a heterogeneous and fatal tumor interacting with the parenchyma. Life Sci. 2011;89(15):532–9.
- Akers JC, Ramakrishnan V, Kim R, Phillips S, Kaimal V, Mao Y, Hua W, Yang I, Fu C-C, Nolan J. miRNA contents of cerebrospinal fluid extracellular vesicles in glioblastoma patients. J Neurooncol. 2015;123(2):205–16.
- Buruiană A, Florian ȘI, Florian AI, Timiș T-L, Mihu CM, Miclăuș M, Oșan S, Hrapșa I, Cataniciu RC, Farcaș M, et al. The roles of miRNA in glioblastoma tumor cell communication: diplomatic and aggressive negotiations. Int J Mol Sci. 2020;21(6):1950.
- Brown HM, Pu F, Dey M, Miller J, Shah MV, Shapiro SA, Ouyang Z, Cohen-Gadol AA, Cooks RG. Intraoperative detection of isocitrate dehydrogenase mutations in human gliomas using a miniature mass spectrometer. Anal Bioanal Chem. 2019;411(30):7929–33.
- Das A, Hawkins C, Tabori U. Germline predisposition to glial neoplasms in children and young adults: a narrative review. Glioma. 2021;4(4):68.
- Suh CH, Kim HS, Jung SC, Choi CG, Kim SJ. Imaging prediction of isocitrate dehydrogenase (IDH) mutation in patients with glioma: a systemic review and meta-analysis. Eur Radiol. 2019;29(2):745–58.
- Peng H, Huo J, Li B, Cui Y, Zhang H, Zhang L, Ma L. Predicting isocitrate dehydrogenase (IDH) mutation status in gliomas using multiparameter MRI radiomics features. J Magn Reson Imaging. 2021;53(5):1399–407.
- Yekula A, Yekula A, Muralidharan K, Kang K, Carter BS, Balaj L. Extracellular vesicles in glioblastoma tumor microenvironment. Front Immunol. 2020;10:3137–3137.
- Brevet M, Johnson ML, Azzoli CG, Ladanyi M. Detection of EGFR mutations in plasma DNA from lung cancer patients by mass spectrometry genotyping is predictive of tumor EGFR status and response to EGFR inhibitors. Lung Cancer. 2011;73(1):96–102.
- González-Pérez L-V, Isaza-Guzmán D-M, Arango-Pérez E-A, Tobón-Arroyave S-I. Analysis of salivary detection of P16INK4A and RASSF1A promoter gene methylation and its association with oral squamous cell carcinoma in a Colombian population. J Clin Exp Dent. 2020;12(5):e452.
- Hung K-S, Hong C-Y, Lee J, Lin S-K, Huang SC, Wang T-M, Tse V, Sliverberg GD, Weng S-C, Hsiao M. Expression of p16INK4A induces dominant suppression of glioblastoma growth in situ through necrosis and cell cycle arrest. Biochem Biophys Res Commun. 2000;269(3):718–25.
- Morillon A-C, Yakkundi S, Thomas G, Gethings LA, Langridge JI, Baker PN, Kenny LC, English JA, McCarthy FP. Association between phospholipid metabolism in plasma and spontaneous preterm birth: a discovery lipidomic analysis in the cork pregnancy cohort. Metabolomics. 2020;16(2):1–10.
- Nalli C, Somma V, Andreoli L, Büttner T, Schierack P, Mahler M, Roggenbuck D, Tincani A. Anti-phospholipid IgG antibodies detected by line immunoassay differentiate patients with anti-phospholipid syndrome and other autoimmune diseases. Autoimmun Highlights. 2018;9(1):1–11.
- Rezaei MB, Alipour Astaneh SD. Lipid peroxidation inhibition, superoxide anion and nitric oxide radical scavenging properties of thymus daenensis and anethum graveolens essential oils. 2011.
- Wang S, Ren W, Wang J, Jiang Z, Saeed M, Zhang L, Li A, Wu A. Black TiO 2-based nanoprobes for T 1-weighted MRI-guided photothermal therapy in CD133 high expressed pancreatic cancer stem-like cells. Biomat Sci. 2018;6(8):2209–18.
- Lathia JD, Mack SC, Mulkearns-Hubert EE, Valentim CLL, Rich JN. Cancer stem cells in glioblastoma. Genes Dev. 2015;29(12):1203–17.
- Juric D, Andre F, Singer CF, Sohn J, Campone M, Loibl S, Conte P, Iwata H, Ciruelos E, Mayer IA. Abstract P4–10–04: clinical outcomes of alpelisib in hormone receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer by next-generation sequencing-detected PIK3CA alteration status and phosphatase and tensin homolog loss: biomarker analysis from the SOLAR-1 study. In: AACR; 2020.
- Yang J-M, Schiapparelli P, Nguyen HN, Igarashi A, Zhang Q, Abbadi S, Amzel LM, Sesaki H, Quiñones-Hinojosa A, Iijima M. Characterization of PTEN mutations in brain cancer reveals that pten mono-ubiquitination promotes protein stability and nuclear localization. Oncogene. 2017;36(26):3673–85.
- Dutt MJ, Lee KH. Proteomic analysis. Curr Opin Biotechnol. 2000;11(2):176–9.
- Fredman G, Skov L, Mann M, Dyring-Andersen B. Towards precision dermatology: emerging role of proteomic analysis of the skin. Dermatology. 2022;238(2):185–94.
- Hedrick VE, LaLand MN, Nakayasu ES, Paul LN. Digestion, purification, and enrichment of protein samples for mass spectrometry. Curr Protoc Chem Biol. 2015;7(3):201–22.
- Mobed A, Ahmadalipour A, Fakhari A, Kazem SS, Saadi GK. Bioassay: a novel approach in antipsychotic pharmacology. Clin Chim Acta. 2020;509:30–5.
- Tocmo R, Veenstra JP, Huang Y, Johnson JJ. Covalent modification of proteins by plant-derived natural products: proteomic approaches and biological impacts. Proteomics. 2021;21(3–4):1900386.
- Sadeghzadeh J, Shahabi P, Farhoudi M, Ebrahimi-kalan A, Mobed A, Shahpasand K. Tau protein biosensors in the diagnosis of neurodegenerative diseases.
- Gouveia D, Grenga L, Pible O, Armengaud J. Quick microbial molecular phenotyping by differential shotgun proteomics. Environ Microbiol. 2020;22(8):2996–3004.
- Binti Badlishah Sham NI, Lewin SD, Grant MM. Proteomic investigations of in vitro and in vivo models of periodontal disease. PROTEOMICS—Clin Appl. 2020;14(3):1900043.
- Chen L, Qin D, Guo X, Wang Q, Li J. Putting proteomics into immunotherapy for glioblastoma. Front Immunol. 2021;12:593255.
- Jayaram S, Gupta MK, Polisetty RV, Cho WC, Sirdeshmukh R. Towards developing biomarkers for glioblastoma multiforme: a proteomics view. Expert Rev Proteomics. 2014;11(5):621–39.
- Gautam P, Nair SC, Gupta MK, Sharma R, Polisetty RV, Uppin MS, Sundaram C, Puligopu AK, Ankathi P, Purohit AK. Proteins with altered levels in plasma from glioblastoma patients as revealed by iTRAQ-based quantitative proteomic analysis. PLoS ONE. 2012;7:e46153.
- Miyauchi E, Furuta T, Ohtsuki S, Tachikawa M, Uchida Y, Sabit H, Obuchi W, Baba T, Watanabe M, Terasaki T. Identification of blood biomarkers in glioblastoma by SWATH mass spectrometry and quantitative targeted absolute proteomics. PLoS ONE. 2018;13(3):e0193799.
- Heroux MS, Chesnik MA, Halligan BD, Al-Gizawiy M, Connelly JM, Mueller WM, Rand SD, Cochran EJ, LaViolette PS, Malkin MG, et al. Comprehensive characterization of glioblastoma tumor tissues for biomarker identification using mass spectrometry-based label-free quantitative proteomics. Physiol Genomics. 2014;46(13):467–81.
- Autelitano F, Loyaux D, Roudieres S, Deon C, Guette F, Fabre P, Ping Q, Wang S, Auvergne R, Badarinarayana V. Identification of novel tumor-associated cell surface sialoglycoproteins in human glioblastoma tumors using quantitative proteomics. PLoS ONE. 2014;9(10):e110316.
- Nguyen CDL, Malchow S, Reich S, Steltgens S, Shuvaev KV, Loroch S, Lorenz C, Sickmann A, Knobbe-Thomsen CB, Tews B, et al. A sensitive and simple targeted proteomics approach to quantify transcription factor and membrane proteins of the unfolded protein response pathway in glioblastoma cells. Sci Rep. 2019;9(1):8836.
- Gollapalli K, Ghantasala S, Kumar S, Srivastava R, Rapole S, Moiyadi A, Epari S, Srivastava S. Subventricular zone involvement in Glioblastoma—A proteomic evaluation and clinicoradiological correlation. Sci Rep. 2017;7(1):1449.
- Ye S, Wu J, Wang Y, Hu Y, Yin T, He J. Quantitative proteomics analysis of glioblastoma cell lines after lncRNA HULC silencing. Sci Rep. 2021;11(1):12587.
- Gholizadeh O, Akbarzadeh S, Moein M, Yasamineh S, Hosseini P, Afkhami H, Amini P, Dadashpour M, Tahavvori A, Eslami M. The role of non-coding RNAs in the diagnosis of different stages (HCC, CHB, OBI) of hepatitis B infection. Microb Pathog. 2023;176:105995.
- Rapp C, Warta R, Stamova S, Nowrouzi A, Geisenberger C, Gal Z, Roesch S, Dettling S, Juenger S, Bucur M, et al. Identification of T cell target antigens in glioblastoma stem-like cells using an integrated proteomics-based approach in patient specimens. Acta Neuropathol. 2017;134(2):297–316.
- Chauhan N, Maekawa T, Kumar DNS. Graphene based biosensors—accelerating medical diagnostics to new-dimensions. J Mater Res. 2017;32(15):2860–82.
- Mobed A, Razavi S, Ahmadalipour A, Shakouri SK, Koohkan G. Biosensors in Parkinson’s disease. Clin Chim Acta. 2021;518:51–8.
- Eslami M, Peyghan AA. DNA nucleobase interaction with graphene like BC3 nano-sheet based on density functional theory calculations. Thin Solid Films. 2015;589:52–6.
- Piunno PA, Krull UJ. Trends in the development of nucleic acid biosensors for medical diagnostics. Anal Bioanal Chem. 2005;381(5):1004–11.
- Mascini M, Tombelli S. Biosensors for biomarkers in medical diagnostics. Biomarkers. 2008;13(7–8):637–57.
- Aminabad ED, Mobed A, Hasanzadeh M, Feizi MAH, Safaralizadeh R, Seidi F. Sensitive immunosensing of α-synuclein protein in human plasma samples using gold nanoparticles conjugated with graphene: an innovative immuno-platform towards early stage identification of Parkinson’s disease using point of care (POC) analysis. RSC Adv. 2022;12(7):4346–57.
- Sadighbathi S, Mobed A. Genosensors, a nanomaterial-based platform for microRNA-21 detection, non-invasive methods in early detection of cancer. Clin Chim Acta. 2022;530:27–38.
- Huang X, Zhu Y, Kianfar E. Nano biosensors: properties, applications and electrochemical techniques. J Market Res. 2021;12:1649–72.
- Zahirinejad S, Hemmati R, Homaei A, Dinari A, Hosseinkhani S, Mohammadi S, Vianello F. Nano-organic supports for enzyme immobilization: scopes and perspectives. Colloids Surf, B. 2021;204:111774.
- Khan MR. Current and future role of immobilized enzymes in medical field. Curr Med Drug Res. 2021;5(1):1–9.
- Izadi M, Tahmasebi S, Pustokhina I, Yumashev AV, Lakzaei T, Alvanegh AG, Roshangar L, Dadashpour M, Yousefi M, Ahmadi M. Changes in Th17 cells frequency and function after ozone therapy used to treat multiple sclerosis patients. Mult Scler Relat Disord. 2020;46:102466.
- Wang X, Wang Y, Shan Y, Jiang M, Jin X, Gong M, Xu J. A novel and sensitive electrogenerated chemiluminescence biosensor for detection of p16INK4a gene based on the functional paste-like nanofibers composites-modified screen-printed carbon electrode. J Electroanal Chem. 2018;823:368–77.
- Paulmurugan R, Afjei R, Sekar TV, Babikir HA, Massoud TF. A protein folding molecular imaging biosensor monitors the effects of drugs that restore mutant p53 structure and its downstream function in glioblastoma cells. Oncotarget. 2018;9(30):21495–511.
- Wu L, Huang C, Emery BP, Sedgwick AC, Bull SD, He X-P, Tian H, Yoon J, Sessler JL, James TD. Förster resonance energy transfer (FRET)-based small-molecule sensors and imaging agents. Chem Soc Rev. 2020;49(15):5110–39.
- Kaur A, Kaur P, Ahuja S. Förster resonance energy transfer (FRET) and applications thereof. Anal Methods. 2020;12(46):5532–50.
- Wegener J, Keese CR, Giaever I. Electric cell–substrate impedance sensing (ECIS) as a noninvasive means to monitor the kinetics of cell spreading to artificial surfaces. Exp Cell Res. 2000;259(1):158–66.
- Robilliard LD, Yu J, Jun S-M, Anchan A, Finlay G, Angel CE, Graham ES. Can ECIS biosensor technology be used to measure the cellular responses of glioblastoma stem cells? Biosensors. 2021;11(12):498.
- Bareket L, Rephaeli A, Berkovitch G, Nudelman A, Rishpon J. Carbon nanotubes based electrochemical biosensor for detection of formaldehyde released from a cancer cell line treated with formaldehyde-releasing anticancer prodrugs. Bioelectrochemistry. 2010;77(2):94–9.
- Eslami M, Vahabi V, Peyghan AA. Sensing properties of BN nanotube toward carcinogenic 4-chloroaniline: a computational study. Physica E. 2016;76:6–11.
- Yang Y, Sun A, Eslami M. A density functional theory study on detection of amphetamine drug by silicon carbide nanotubes. Physica E. 2021;125:114411.
- Singh P. SPR biosensors: historical perspectives and current challenges. Sens Actuators, B Chem. 2016;229:110–30.
- Nguyen HH, Park J, Kang S, Kim M. Surface plasmon resonance: a versatile technique for biosensor applications. Sensors. 2015;15(5):10481–510.
- Cottat M, Thioune N, Gabudean A-M, Lidgi-Guigui N, Focsan M, Astilean S, Lamy de la Chapelle M. Localized surface plasmon resonance (LSPR) biosensor for the protein detection. Plasmonics. 2013;8(2):699–704.
- Hall WP, Ngatia SN, Van Duyne RP. LSPR biosensor signal enhancement using nanoparticle−antibody conjugates. J Phys Chem C. 2011;115(5):1410–4.
- Eslami M, Moradi M, Moradi R. DFT investigation of hydrogen adsorption on the C3N nanotube. Vacuum. 2016;133:7–12.
- Thakur A, Xu C, Li WK, Qiu G, He B, Ng S-P, Wu C-ML, Lee Y. In vivo liquid biopsy for glioblastoma malignancy by the AFM and LSPR based sensing of exosomal CD44 and CD133 in a mouse model. Biosens Bioelectron. 2021;191:113476.
- Fueyo-González F, Herranz R, Plesselova S, Giron MD, Salto R, Paredes JM, Orte A, Morris MC, González-Vera JA. Quinolimide-based peptide biosensor for probing p25 in vitro and in living cells. Sens Actuators, B Chem. 2021;339:129929.
- Campion A, Kambhampati P. Surface-enhanced Raman scattering. Chem Soc Rev. 1998;27(4):241–50.
- Corio P, Brown S, Marucci A, Pimenta M, Kneipp K, Dresselhaus G, Dresselhaus M. Surface-enhanced resonant Raman spectroscopy of single-wall carbon nanotubes adsorbed on silver and gold surfaces. Phys Rev B. 2000;61(19):13202.
- Yasamineh S, Yasamineh P, Kalajahi HG, Gholizadeh O, Yekanipour Z, Afkhami H, Eslami M, Kheirkhah AH, Taghizadeh M, Yazdani Y. A state-of-the-art review on the recent advances of niosomes as a targeted drug delivery system. Int J Pharm. 2022;624:121878.
- Huang R, Harmsen S, Samii JM, Karabeber H, Pitter KL, Holland EC, Kircher MF. High precision imaging of microscopic spread of glioblastoma with a targeted ultrasensitive SERRS molecular imaging probe. Theranostics. 2016;6(8):1075.
- Harmsen S, Huang R, Wall MA, Karabeber H, Samii JM, Spaliviero M, White JR, Monette S, O’Connor R, Pitter KL. Surface-enhanced resonance Raman scattering nanostars for high-precision cancer imaging. Sci Transl Med. 2015;7(271):271ra277-271ra277.
- Amirazad H, Dadashpour M, Zarghami N. Application of decellularized bone matrix as a bioscaffold in bone tissue engineering. J Biol Eng. 2022;16(1):1–18.
- Peyressatre M, Laure A, Pellerano M, Boukhaddaoui H, Soussi I, Morris MC. Fluorescent biosensor of CDK5 kinase activity in glioblastoma cell extracts and living cells. Biotechnol J. 2020;15(9):1900474.
- Liu L, Thakur A, Kar Li W, Qiu G, Yang T, He B, Lee Y, Lawrence Wu C-M. Site specific biotinylated antibody functionalized Ag@AuNIs LSPR biosensor for the ultrasensitive detection of exosomal MCT4, a glioblastoma progression biomarker. Chem Eng J. 2022;446:137383.
- Dadashpour M, Firouzi-Amandi A, Pourhassan-Moghaddam M, Maleki MJ, Soozangar N, Jeddi F, Nouri M, Zarghami N, Pilehvar-Soltanahmadi Y. Biomimetic synthesis of silver nanoparticles using Matricaria chamomilla extract and their potential anticancer activity against human lung cancer cells. Mater Sci Eng, C. 2018;92:902–12.
- Liang D, Zhang X, Wang Y, Huo T, Qian M, Xie Y, Li W, Yu Y, Shi W, Liu Q, et al. Magnetic covalent organic framework nanospheres-based miRNA biosensor for sensitive glioma detection. Bioact Mater. 2022;14:145–51.
- Hirata E, Yukinaga H, Kamioka Y, Arakawa Y, Miyamoto S, Okada T, Sahai E, Matsuda M. In vivo fluorescence resonance energy transfer imaging reveals differential activation of Rho-family GTPases in glioblastoma cell invasion. J Cell Sci. 2012;125(Pt 4):858–68.
- Hamdan M, Righetti PG. Modern strategies for protein quantification in proteome analysis: advantages and limitations. Mass Spectrom Rev. 2002;21(4):287–302.
- Srzentić K, Fornelli L, Laskay UA, Monod M, Beck A, Ayoub D, Tsybin YO. Advantages of extended bottom-up proteomics using Sap9 for analysis of monoclonal antibodies. Anal Chem. 2014;86(19):9945–53.
- Conrotto P, Souchelnytskyi S. Proteomic approaches in biological and medical sciences: principles and applications. Exp Oncol. 2008;30:171–80.
- Li X, Chen N, Zhou X, Gong P, Wang S, Zhang Y, Zhao Y. A review of specialty fiber biosensors based on interferometer configuration. J Biophotonics. 2021;14(6):e202100068.
- Kucherenko I, Soldatkin O, Dzyadevych S, Soldatkin A. Electrochemical biosensors based on multienzyme systems: main groups, advantages and limitations—a review. Anal Chim Acta. 2020;1111:114–31.
- Plekhanova YV, Reshetilov A. Microbial biosensors for the determination of pesticides. J Anal Chem. 2019;74(12):1159–73.