Резюме
Кольорова допплерографія (КДГ), будучи неінвазивним методом, широко використовується в акушерстві для дослідження кровообігу плода і плаценти. Традиційні режими КДГ включають кольорове допплерівське дослідження потоку (КДДП) та енергетичне допплерівське дослідження (ЕДД). В останні роки все частіше застосовуються нові режими, включаючи візуалізацію потоку високої чіткості (ВПВЧ), променистий потік, візуалізацію мікросудинного потоку (ВМСП) і три-/чотиривимірну візуалізацію в режимі “Glass-body”. У порівнянні з КДДП, ВПВЧ має вищу роздільну здатність і чутливість і дозволяє виявляти повільніші потоки. ВМСП підвищує чутливість до тонких судин або судин з низьким кровотоком, створюючи при цьому мало або зовсім не створюючи артефактів руху. Променистий потік показує кровотік з відчуттям глибини і зменшує переповнення крові. Режим скляного тіла, що відображає як сіру шкалу, так і кольорову інформацію про потік, може продемонструвати пов’язані з серцевим циклом події потоку і просторове співвідношення судин. У цьому огляді обговорюються характеристики та застосування різних режимів КДГ в акушерстві. Зокрема, представлено, як ці нові технології інтегровані в детальну діагностику та раннє морфологічне сканування.
Ключові слова: 3D/4D ультразвук, ПЧКЗ, кольоровий доплер, акушерство, променистий потік, покращена візуалізація мікросудин
1. Вступ
Кольорова допплерографія (КДГ), будучи неінвазивним методом, широко використовується в акушерстві для дослідження кровообігу плода і плаценти. КДГ можна використовувати для визначення наявності та напрямку кровотоку, оцінки анатомії серця та периферичних судин плода, а також для корекції кута між променем та судиною для правильного вимірювання швидкості [1]. Додавання КДГ до сірошкальної ультразвукової діагностики може покращити пренатальну діагностику, серед іншого, вад серця, аномалій пуповини та плацентарних порушень [2,3,4,5,6,7]. Традиційні режими КДГ включають кольорове допплерівське дослідження потоку (КДДП) та енергетичне допплерівське дослідження (ЕДД). В останні роки все частіше застосовуються нові режими, включаючи візуалізацію потоку високої чіткості (ВПВЧ), візуалізацію мікросудинного потоку (ВМСП), променевий потік і три-/чотиривимірний рендеринг в режимі “glass-body”. Мета цього огляду – узагальнити характеристики різних режимів КДГ та оцінити їх застосування в акушерстві. Зокрема, обговорюється, як ці нові технології інтегруються в детальну діагностику та раннє морфологічне сканування, як це нещодавно було рекомендовано [8,9,10,11,12,13].
2. Режими кольорової доплерографії
На відміну від КДДП, який вимірює зсув частоти, що генерується швидкістю потоку еритроцитів у судині (Зображення 1A), ЕДД вимірює амплітуду (потужність) допплерівського сигналу, що генерується інтенсивністю їх сигналу. Обчислюючи різницю в інтенсивності світіння без урахування напрямку і швидкості, ЕДД не має аліасингу сигналу і може дозволити виявити потоки з меншими швидкостями [1]. Однак ЕДД не надає інформації про напрямок кровотоку і не може продемонструвати наявність або відсутність турбулентності.
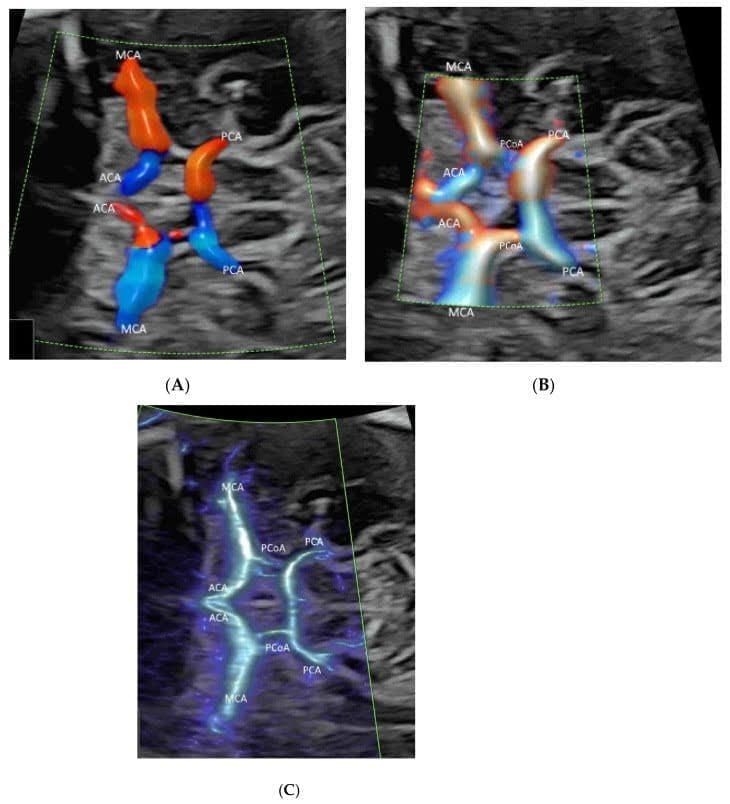
Зображення 1
Демонстрація Вілізієвого кола (ВК) в поперечній площині нормального плода в 25 тижнів гестації за допомогою кольорового допплерівського зображення потоку (КДДП)(A), візуалізації потоку високої чіткості (ВПВЧ) (B) та візуалізації мікросудинного потоку (ВМСП) (C) з променистим потоком. Зверніть увагу, що передня мозкова артерія (ПМА), середня мозкова артерія (СМА) і задня мозкова артерія (ЗМА) добре візуалізуються у всіх трьох режимах, в той час як задня сполучна артерія (ЗСА) візуалізується при ВПВЧ (B) і ВМСП (C), але не при КДДП (A).
Візуалізація потоку високої чіткості (ВПВЧ), яку також називають двонаправленою енергетичною доплерівською візуалізацією, використовує цифрову широкосмугову оцінку допплерівських сигналів, яка поєднує допплерівські частотні зсуви з амплітудами сигналів. ВПВЧ присвоює колір на основі виміряного допплерівського зміщення, не беручи до уваги напрямок або швидкість [14,15]. Порівняно з КДДП, ВПВЧ має вищу роздільну здатність і чутливість (Зображення 1B). Однак на КДДП, ЕДД і ВПВЧ впливають завади і артефакти руху, які є похідними від рухів, пульсації і дихання вагітної жінки [16]. Для видалення цих артефактів зазвичай застосовують одновимірний пристінний фільтр. На жаль, цей фільтр також видаляє сигнали низькошвидкісного потоку, що перекриваються, що призводить до втрати низькошвидкісних компонентів потоку [16].
Візуалізація мікросудинного потоку (ВМСП) – це нова технологія, яка застосовує багатовимірну або дуже складну систему пристінної фільтрації для відокремлення сигналів низькошвидкісного потоку від артефактів, що перекриваються [17,18,19,20]. Таким чином, ВМСП підвищує чутливість до тонких або низькошвидкісних судин, створюючи при цьому мало або зовсім не створюючи артефактів руху (Зображення 1C). Крім того, ВМСП використовує високочастотні методи дискретизації і високу частоту кадрів, відображаючи зображення з високою роздільною здатністю [17,18,19,20]. ВМСП може виявляти потік, навіть коли кут інсоляції неоптимальний. Деякі нещодавно розроблені системи ВМСП здатні надавати кольорову інформацію про напрямок руху, що накладається на зображення у В-режимі. Подібна технологія була розроблена в декількох галузях, включаючи технологію Superb Microvascular Imaging (SMI) (TOSHIBA Inc., Токіо, Японія), MicroFlow imaging (Philips Healthcare), MV-Flow (Samsung Medison) і SlowFlowHD (GE Healthcare).
Променистий потік (GE Healthcare) або LumiFlow (Samsung Medison) – це нова технологія, яка перетворює показник щільності еритроцитів у певній ділянці в індекс висоти і може бути застосована для КДДП, ЕДД, ВПВЧ або ВМСП [21] (Зображення 2A-C). Ця нова двовимірна (2D) технологія показує кровотік з відчуттям глибини або “тривимірного (3D) вигляду”, зменшує переповнення крові та покращує просторове сприйняття кровоносних судин та їх меж [21].
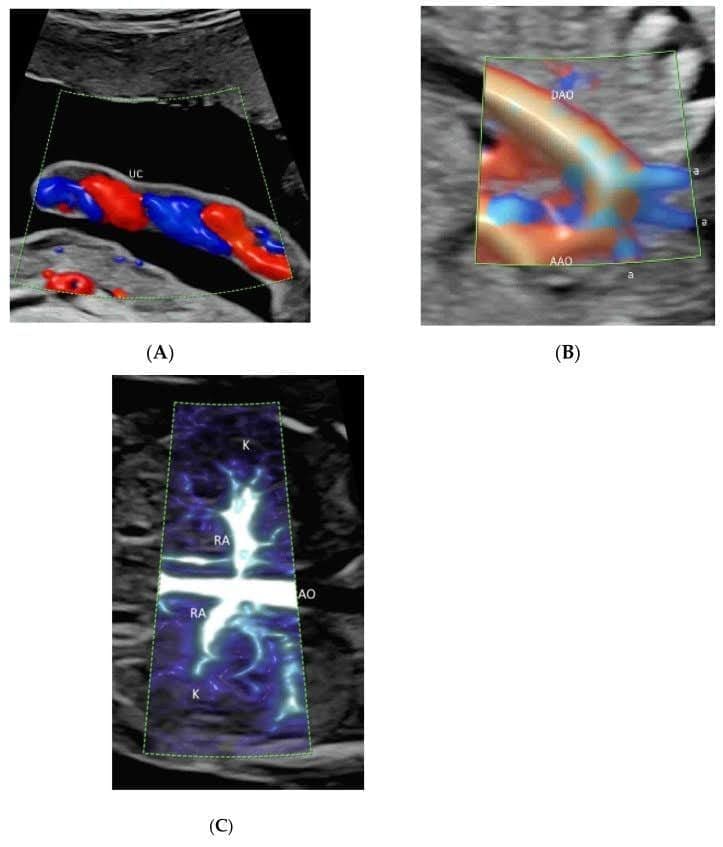
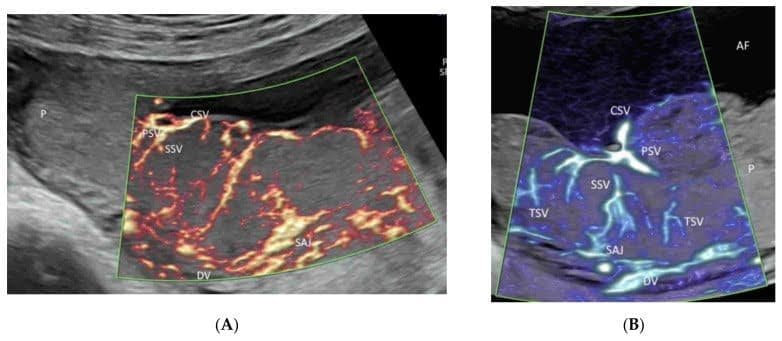
Зображення 2
Демонстрація променистого потоку, застосованого до кольорової допплерографії (А), високої чіткості (В) та мікросудинної візуалізації (С) візуалізації потоку. Зверніть увагу, що кровотік показано з відчуттям глибини в судинах пуповини (А), дуги аорти та її гілок (а) (В), а також ниркових артерій (НА) та їх гілок (С). AAO – висхідна аорта; DAO – низхідна аорта; AO – аорта.
Нещодавно розроблений режим “glass-body”, після отримання об’ємного 3D або 4D просторово-часової кореляції зображень (ПЧКЗ), демонструє пов’язані з серцевим циклом події кровотоку та просторові взаємовідношення судин, відображаючи як сірошкальну, так і кольорову інформацію [4,22] (Зображення 3А). Крім того, спеціальне програмне забезпечення дозволяє регулювати джерело світла для досягнення ефектів освітлення та затінення, а отже, покращити сприйняття глибини та просторове враження від судинних структур [4]. HDlive silhouette, ще один спеціальний режим, відображає кровотік, стінки судин та їх напівпрозорі просвіти з підвищеною чіткістю [23] (Зображення 3В).
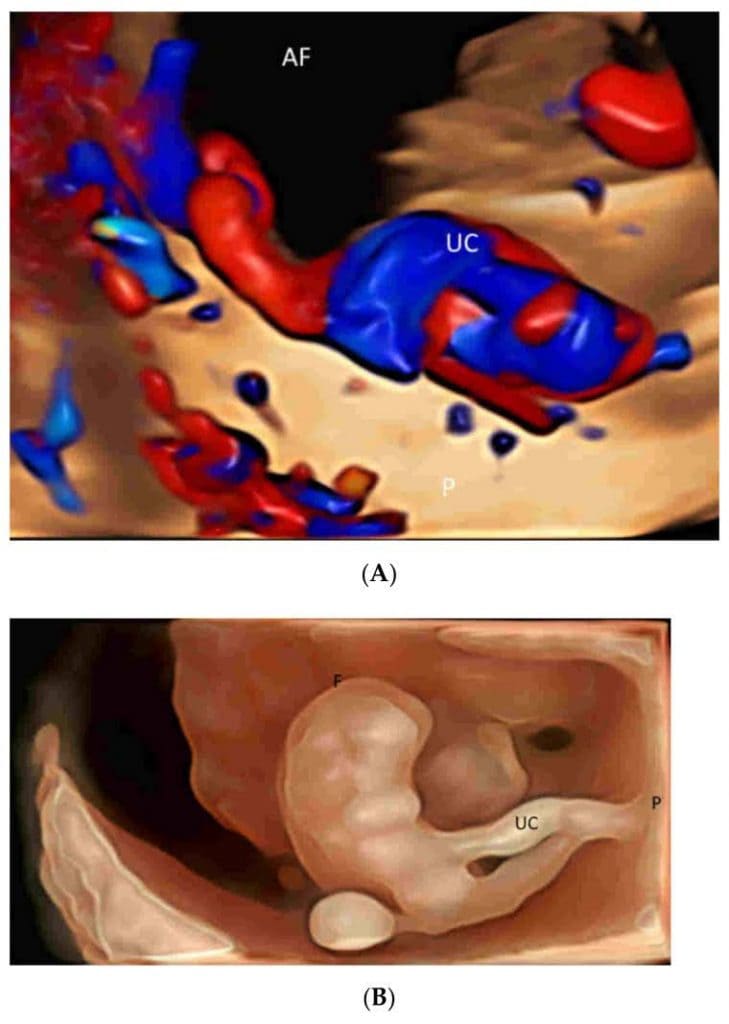
Зображення 3
(А) Об’ємне зображення з просторово-часовою кореляцією зображень (ПЧКЗ), що відображається в режимі “glass-body” як з сірошкальною, так і з кольоровою інформацією, демонструє вставлення пуповини (UC) в плаценту (P). AF- амніотична рідина. (B) Тривимірне ультразвукове зображення, показане в режимі HDlive силуету, демонструє пуповину (UC), що з’єднує нормальний плід (F) з плацентою (P) в терміні 8 тижнів гестації.
3. Оптимізація безпеки
Діагностична акушерська ультрасонографія загалом вважається безпечною [1]. Особливу увагу слід приділяти використанню КДГ, оскільки вихід енергії при КДГ вищий, ніж при В-режимі. Важливо обмежити вплив КДГ на плід до мінімально допустимого рівня (МДР), особливо під час першого триместру вагітності. Як термічний індекс, так і механічний індекс слід підтримувати на рівні ≤1,0 [1].
Для оптимізації якості зображення необхідний вибір правильного ультразвукового обладнання, відповідного маршруту дослідження (трансабдомінального або трансвагінального), пресетів та режимів КДГ [1,8]. Важливо, щоб область інтересу (ROI) була якомога меншою за рахунок звуження кута сканування, збільшення глибини візуалізації, а потім застосування КДГ зі збільшенням [1]. Щоб уникнути артефактів руху, ультразвукові дослідження проводять під час спокою плода і без рухів матері. Для ВМСП зменшення акустичної потужності та підсилення може зменшити артефакти спалахів [20]. Для дослідження різних типів кровообігу слід обирати відповідний режим КДГ. КДДП, ЕДД/ВПВЧ та ВМСП дозволяють виявляти швидкі, проміжні та повільні потоки відповідно (Зображення 1B та Зображення 2A,C).
4. Клінічне застосування в гінекології
КДГ зазвичай використовується для оцінки анатомії та кровотоку серця плода, периферичних судин, пуповини та плаценти [1,2,3,4,5,6,7]. КДГ також корисна для оцінки різних структур у першому триместрі та при вагітності двійнею [9,24].
4.1. Серце плода
ISUOG рекомендує додавати КДГ до рутинного скринінгу в середині триместру вагітності [13]. КДГ може полегшити візуалізацію різних структур серця, особливо у жінок з ожирінням [25], і допомогти у виявленні вад серця, таких як стеноз легеневої артерії або аорти з аномальним кровотоком [5,26]. Поперечне розгортання серця від чотирикамерного зрізу, через шляхи відтоку до трикамерного зрізу трахеї є корисним для оцінки [13]. Отриманий кліп може полегшити подальший покадровий перегляд ультразвукових зображень. Розумне використання функції cine-loop може частково подолати вплив артефактів руху [1].
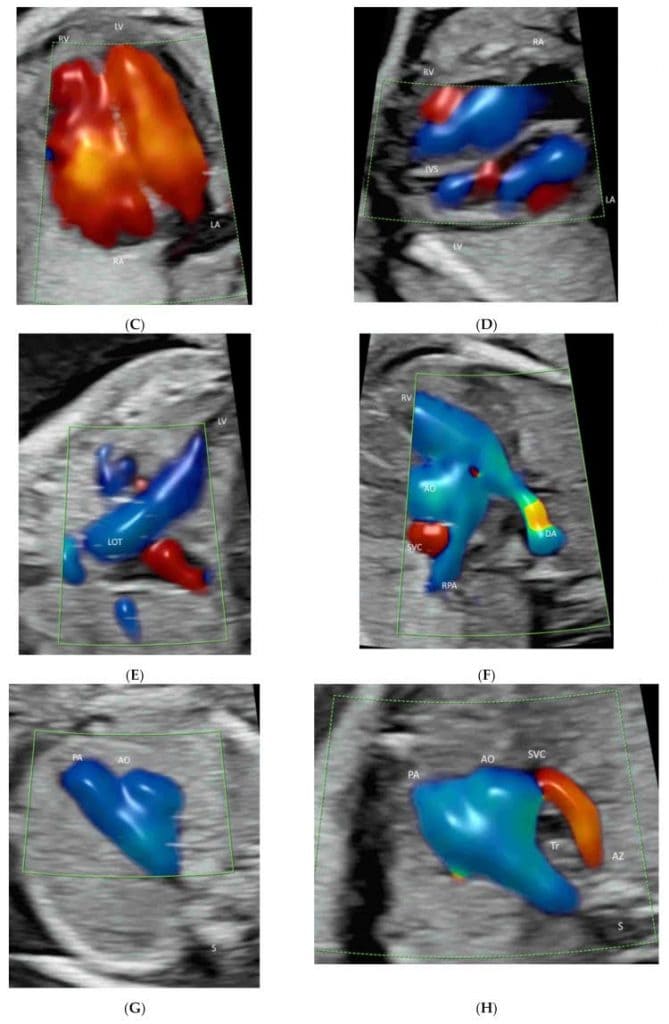
ISUOG рекомендує додавати КДГ при ехокардіографії плода [13]. AIUM рекомендує використовувати КДГ для оцінки (а) системних вен (включаючи верхню і нижню порожнисті вени і венозну протоку), (b) легеневих вен (щонайменше дві: одна права і одна ліва вени), (c) міжпередсердна перегородка і овальний отвір, (d) атріовентрикулярні клапани, (e) міжшлуночкова перегородка, (f) півмісяцеві клапани, (g) дуга протоки і (g) дуга аорти [11] (Зображення 4A-J). Променевий потік показує детальну інформацію про внутрішньосерцевий кровотік [21]. ВПВЧ корисна для виявлення легеневих вен [27].
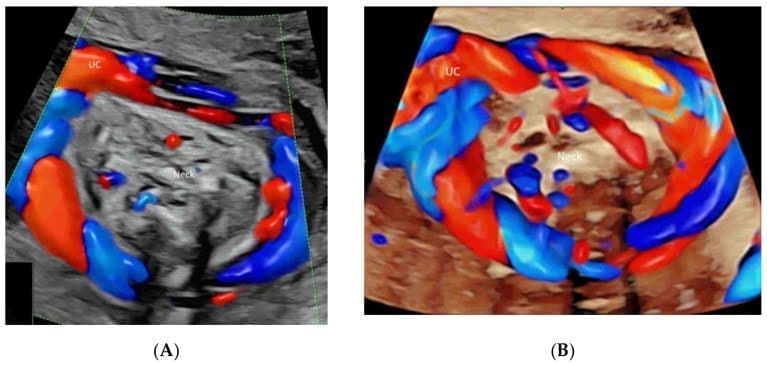
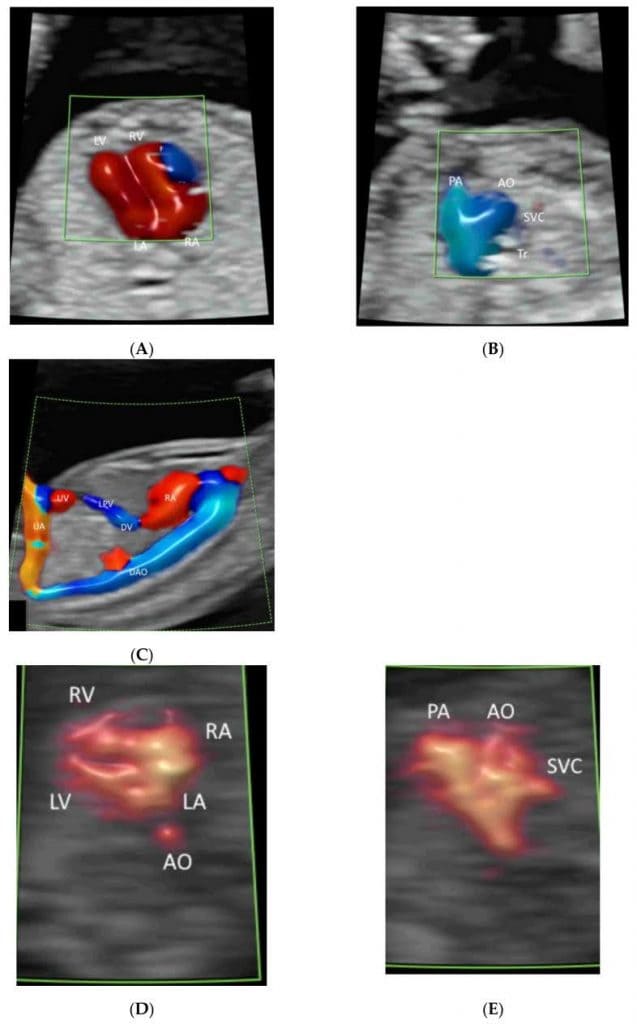
Зображення 4
Кольорова доплерографія кровотоку в ехокардіографії плода: Венозна протока (DV) та нижня порожниста вена (IVC)(A), легеневі вени (PV), міжпередсердна перегородка та овальний отвір(B), атріовентрикулярні клапани(C), міжшлуночкова перегородка(D), півмісяцеві клапани(E-H), дуга протоки(I) та (g) дуга аорти(J). Зверніть увагу на вихідний тракт лівого шлуночка (LOT) (E), гілки RPA (F), трисудинний зріз(G), зріз трьох судин і трахеї (H) і три висхідні гілки (1-3) (J). LPV, ліва ворітна вена; LHV, ліва печінкова вена; RA, праве передсердя, LA, ліве передсердя; RV, правий шлуночок; LV, лівий шлуночок; IAS, міжпередсердна перегородка; IVS, міжшлуночкова перегородка; DA, артеріальна протока; PA, легенева артерія; RPA, права легенева артерія; Tr, трахея; AZ, непарна вена; AO, аорта; DAO, низхідна аорта; AAO, висхідна аорта.
Чотиривимірна ехокардіографія плода може допомогти в оцінці складних вад серця, включаючи конотрункулярні вади, аномалії дуги аорти та аномалії легеневого венозного повернення [28,29,30,31]. Використання кольорової допплерографії з ПЧКЗ в режимі “glass-body” може показати нормальну та аномальну анатомію серця та магістральних судин плода [4]. Зокрема, можна продемонструвати взаємовідношення магістральних судин при вадах серця. HDlive flow та/або HDlive flow силует можна використовувати для дослідження різних вад серця, виявляючи просторові взаємовідносини між серцевими структурами плода [23]. Тривимірні візуалізовані зображення корисні для консультування батьків, а об’єм ПЧКЗ може полегшити проведення телеконсультацій [21].
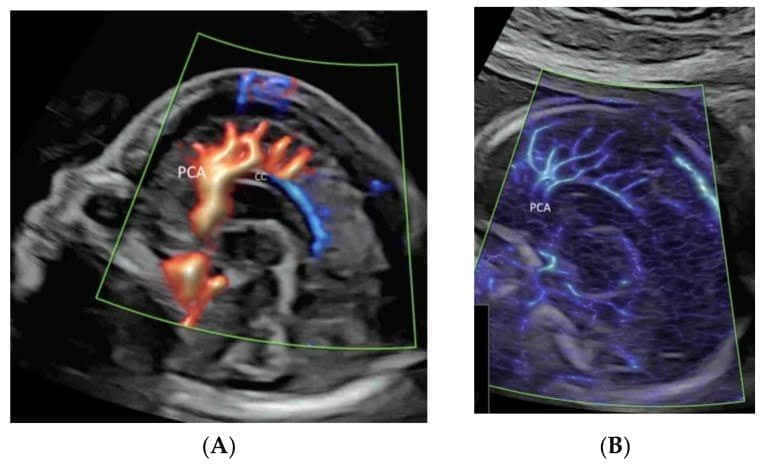
4.2. Мозок плода
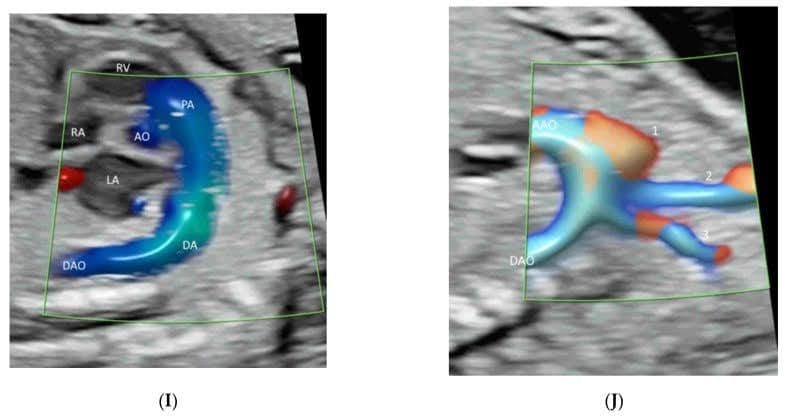
Застосування ЕДД, ВПВЧ або ВМСП у середньосагітальній площині може продемонструвати передню мозкову артерію та перикаллозальні артерії з їхніми гілками (Зображення 5А,В). Однак, згідно з рекомендаціями ISUOG [12], її роль в оцінці мозолистого тіла є маргінальною. У корональній площині через таламус кровоносні судини навколо зорової хіазми можна побачити близько до основи черепа і по середній лінії (Зображення 6) [12]. КДДП, ВПВЧ і ВМСП можуть показувати коло Вілліса в поперечній площині з різним ступенем деталізації (Зображення 1A-C). Трансвагінальне 3D УЗД з високою роздільною здатністю за допомогою ВПВЧ може продемонструвати медулярні судини білої речовини [32]. Використання ВМСП у поперечній площині може показати повільний кровотік у дрібних внутрішньочерепних судинах та судинах орбіти (Зображення 7) [33]. Оцінка васкуляризації головного мозку може допомогти в діагностиці та прогнозуванні неврологічного прогнозу при деяких захворюваннях центральної нервової системи [32]. Двовимірна та тривимірна КДКП/ВПВЧ є ефективними інструментами для діагностики та характеристики вени аневризматичної мальформації Галена [34].
Зображення 5
Демонстрація перикаллозальної артерії (PCA) та її гілок у середньосагітальній площині двох нормальних плодів у 21-23 тижні гестації за допомогою візуалізації потоку високої роздільної здатності (A) та візуалізації мікросудинного потоку (B). Зверніть увагу на нормальний хід ВСА навколо мозолистого тіла (СС).
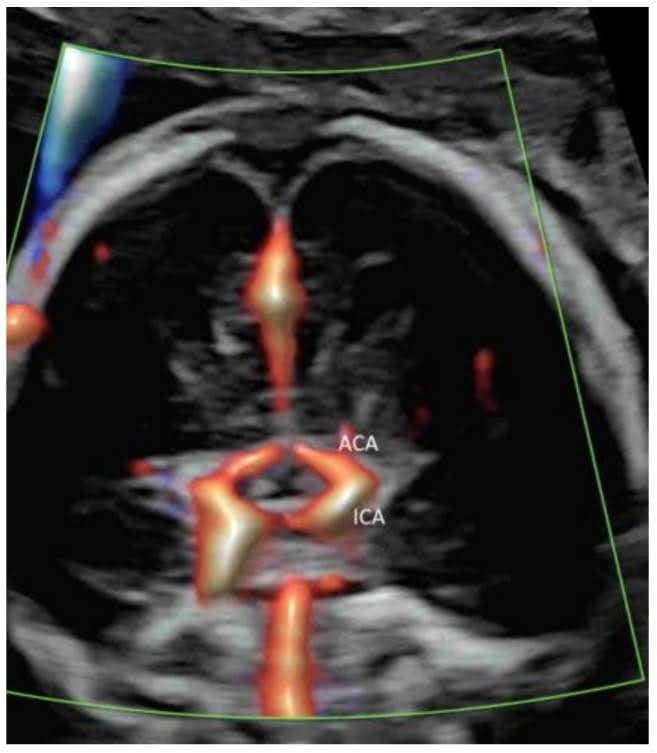
Зображення 6
Корональне зображення у високій роздільній здатності через переднє тім’ячко нормального плода в 20 тижнів гестації показує зорову хіазму, Х-подібну структуру в центрі, оточену супракавернозним сегментом внутрішньої сонної артерії (ICA) і передньою мозковою артерією (ACA).
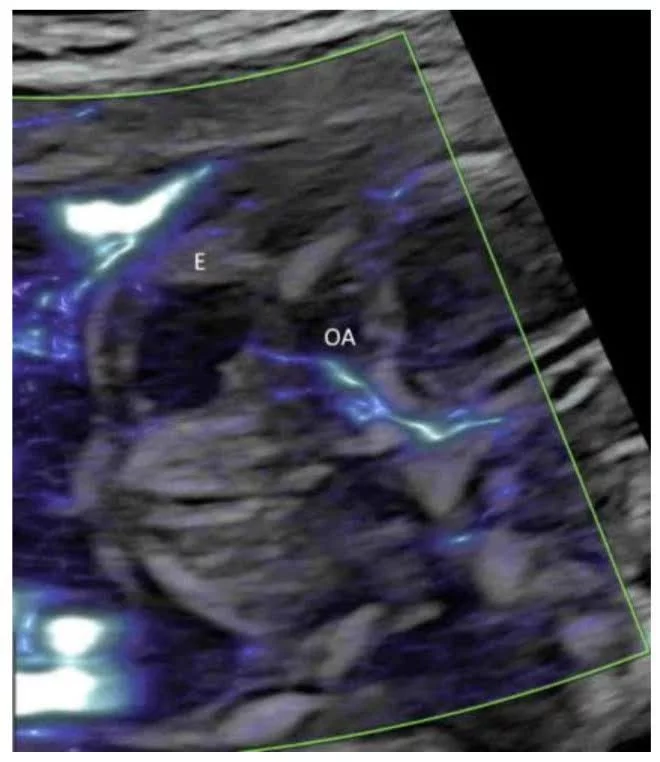
Зображення 7
Візуалізація мікросудинного кровотоку в поперечному зображенні нормального мозку плода в 20 тижнів гестації, що показує очну артерію (ОА). Е – око.
4.3. Черевна порожнина та інші судини плоду
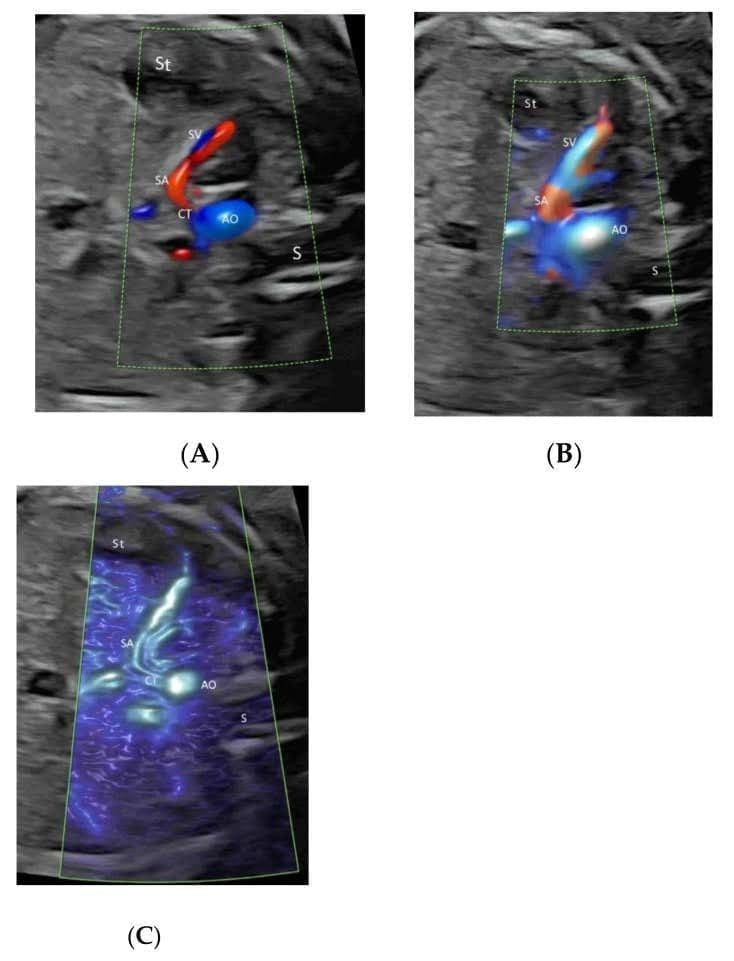
Цілеспрямоване дослідження пупково-портальної венозної системи плода необхідне при виявленні або підозрі на аномалію венозної системи під час вимірювання окружності живота плода або при виявленні вади серця чи іншої аномалії плода [35]. Систематична оцінка цієї венозної системи може бути досягнута за допомогою КДДП або ВПВЧ у двох поперечних площинах і одній сагітальній площині, як запропоновано Yagel [36] (Зображення 4А і Зображення 8А,В). Така оцінка може полегшити пренатальну діагностику венозних аномалій [36]. Використання ВПВЧ та променевого потоку допомагає пренатальній діагностиці аберантного перебігу венозної протоки [37].
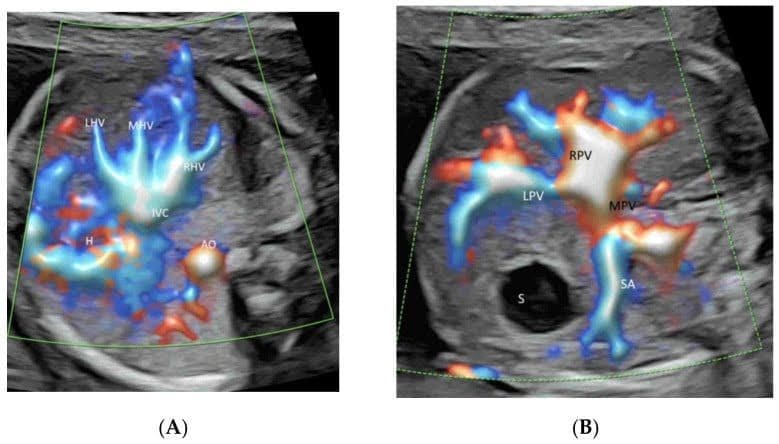
Зображення 8
Високочітке потокове зображення прекордіальної венозної системи у двох поперечних площинах живота нормального плода в терміні гестації 22 тижні. Зображення верхньої частини живота плода демонструє нормальний “знак тризуба” лівої (LHV), середньої (MHV) та правої (RHV) печінкових вен, що з’єднуються з нижньою порожнистою веною (IVC)(A). Зверніть увагу на з’єднання лівої ворітної вени (LPV) та головної ворітної вени (MPV) з правою ворітною веною (RPV) на рівні шлунка(B). S – шлунок; аорта (Ao), селезінкова артерія (SA) і шлунок (St).
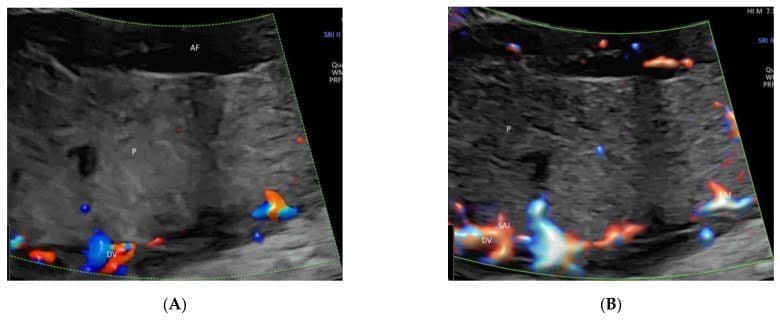
Leung KY нещодавно описав новий підхід використання ПЧКЗ з візуалізацією об’єму в режимі скляного тіла і TUI для полегшення оцінки цієї складної венозної системи [38] (Зображення 9). Зв’язок печінкових вен, венозної протоки і нижньої порожнистої вени з серцем плода та їх просторові взаємовідношення можна відобразити в режимі “glass-body”. ПЧКЗ cine-петля може показати кровотік прекордіальної венозної системи в серцевому циклі з двома різними шляхами до правого передсердя [38]. Потрібні подальші дослідження, щоб оцінити, чи може цей підхід покращити пренатальну діагностику венозних аномалій.
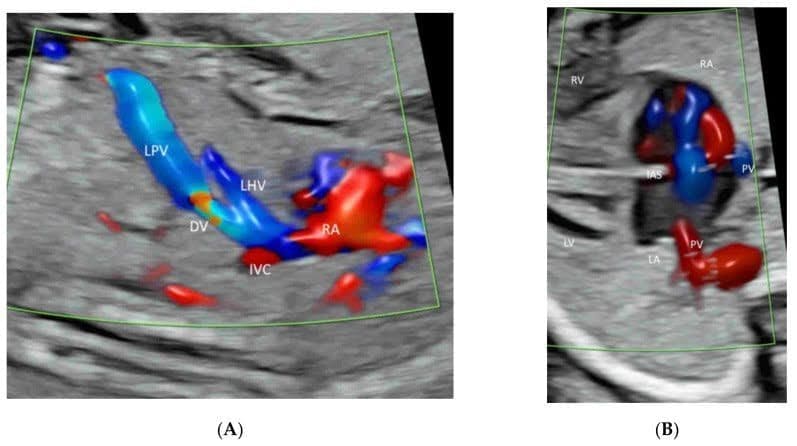
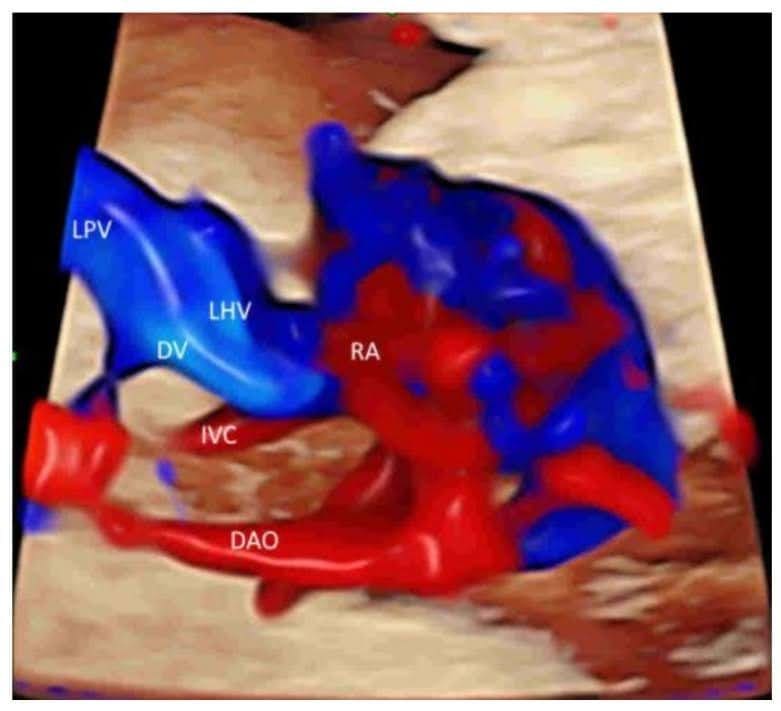
Зображення 9
Просторово-часове кореляційне об’ємне зображення в кольоровому доплерівському режимі, що відображається в режимі “glass-body”, в поздовжньому зображенні нормального плода в 20 тижнів гестації, що показує пупкову вену (UV), ліву ворітну вену (LPV), ліву печінкову вену (LHV), венозну протоку (DV) і нижню порожнисту вену (IVC). Зверніть увагу, що венозна протока (DV), яка виникає з лівої ворітної вени (LPV), лівої печінкової вени (LHV) і нижньої порожнистої вени (IVC), з’єднується з піддіафрагмальним передоднем. Праве передсердя (RA), низхідна аорта (DAO).
Для оцінки кількості судин пуповини загальноприйнятою практикою є використання КДГ з низьким потоком для виявлення двох пуповинних артерій, які оточують сечовий міхур, а потім спрямовуються до місця вставлення пуповини (Зображення 10) [39]. Це може полегшити пренатальну діагностику однієї пупкової артерії.
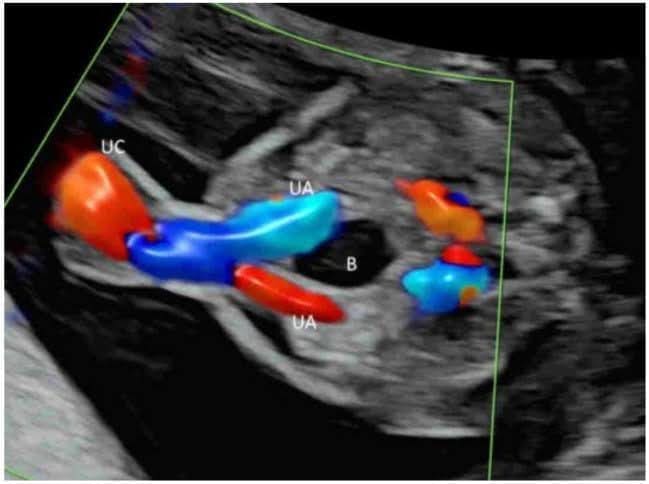
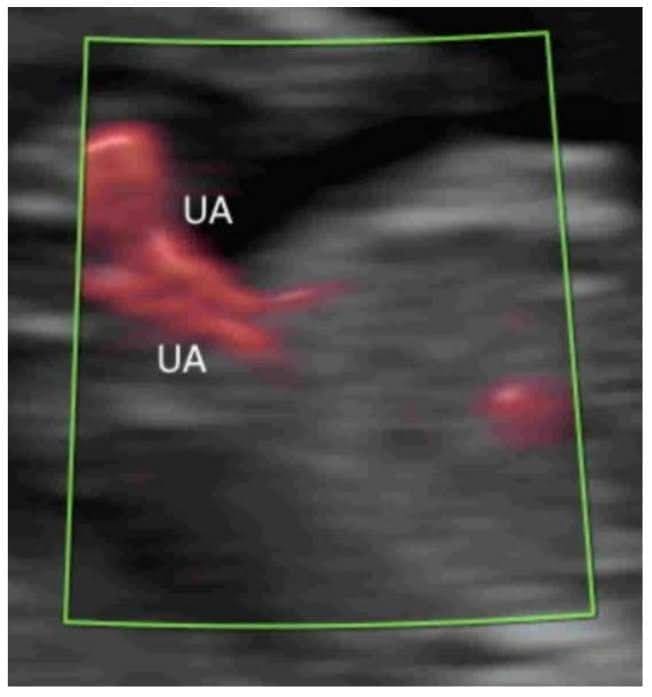
Зображення 10
Кольорова допплерографія в поперечній площині нормального плода в 20 тижнів гестації показує дві пупкові артерії (UA), що оточують сечовий міхур (B). Пуповина – пуповина.
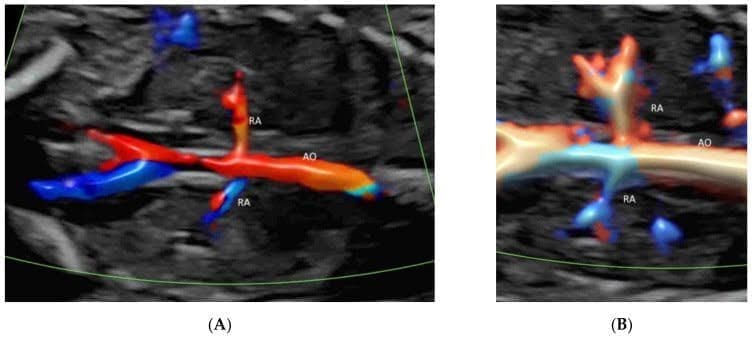
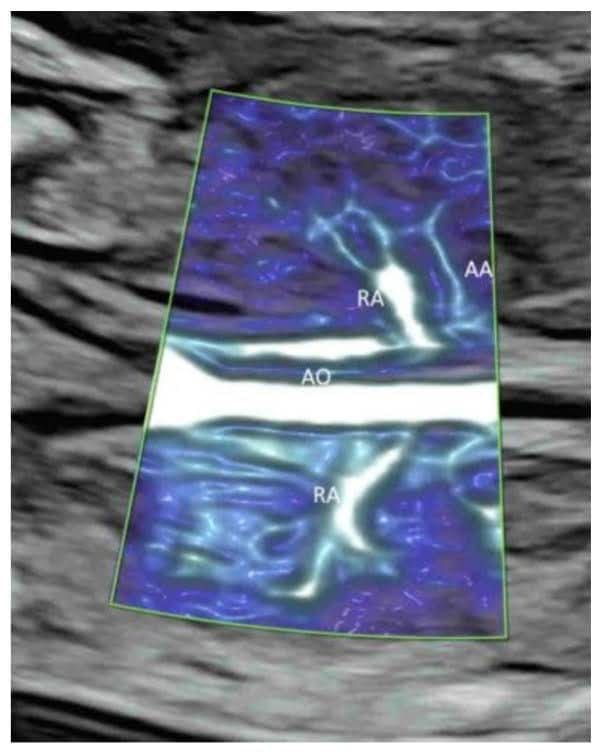
У коронарній площині через спину плода, безпосередньо перед хребтом, КДГ з низькими налаштуваннями потоку показує ниркові артерії та їх продовження в ниркову миску (Зображення 2C та Зображення 11A,B) [39]. ВМСП показує судини від гілок ниркової артерії до периферичних дрібних кровоносних капілярів (Зображення 2C) [33]. ВМСП можна використовувати для підтвердження відсутності кровотоку до мультикістозної диспластичної нирки або відсутньої нирки [40].
Зображення 11
Кольорова доплерографія (А) та зображення високої чіткості(В) потоку в коронарній площині через спину нормального плоду в 20 тижнів гестації показує обидві ниркові артерії (RA), що виходять з аорти (AO).
ВПВЧ або ВМСП можна використовувати вибірково в легенях, печінці, селезінці, надниркових залозах та кінцівках плода при виявленні або підозрі на аномалію в цих структурах (Зображення 12А-С) [40]. У плодів з вродженою діафрагмальною грижею ЕДД/ВПВЧ можна використовувати для дослідження сегментів легеневих артерій у легені, контралатеральній до грижі, а змінений легеневий ЕДД/ВПВЧ у віці від 26 до 38 тижнів асоціюється з неонатальною смертністю [41]. КДГ селезінкової артерії може допомогти в пренатальній діагностиці гетеротаксичних синдромів [42].
Зображення 12
Кольорова допплерографія(А), зображення високої чіткості(В) та мікросудинного кровотоку (С) у поперечній площині нормального плода в 23 тижні гестації, що демонструє селезінкову артерію (SA), гілку брижового стовбура (CT), що відходить від аорти (AO). St – шлунок; S – хребет.
КДДП або ВПВЧ можуть виявляти ембріональні судинні пухлини, такі як гемангіоми печінки, пухлини судин кінцівок та крижово-куприкові тератоми [43,44]. При виявленні поверхневої кістозної структури над кінцівкою або тілом на ультразвуковому дослідженні КДГ корисна для оцінки наявності та інтенсивності сигналів кровотоку в ділянці ураження та/або наявності артеріовенозних нориць [45]. У той час як гіперваскуляризація вказує на те, що ураження є гемангіомою, відсутність кровотоку в умовах низької швидкості кровотоку вказує на лімфангіому [45].
Нещодавні дослідження показали, що розмір надниркової залози плода в третьому триместрі змінюється при затримці росту плода або гестаційному цукровому діабеті [46,47]. Артерія надниркової залози добре демонструється при ВМСП (Зображення 13). При виявленні кістозного утворення наднирника на пренатальному ультразвуковому дослідженні важко диференціювати, чи є це утворення крововиливом у наднирник, чи кістозною нейробластомою [48]. Наявність судин у зовнішній стінці або внутрішній перегородці утворення свідчить на користь останньої [49].
Зображення 13
Візуалізація мікросудинного потоку в корональній площині через спину нормального плода в 20 тижнів гестації, що показує надниркову артерію (АА). АО – аорта; RА – ниркова артерія.
4.4. Плацента
КДГ корисна для оцінки плацентарних озер або кіст. Якщо на КДГ з низьким рівнем потоку немає кровотоку, невеликі гіпоехогенні судинні озерця зазвичай не мають клінічного значення [50], тоді як множинні великі плацентарні озерця асоціюються з затримкою росту плода [51]. Наявність мультикістозних уражень з різним ступенем кровотоку всередині кіст при КДГ з низьким рівнем кровотоку (вітражний вигляд) та розширеними судинами хоріона свідчать про мезенхімальну хворобу плаценти, яка асоціюється з несприятливими наслідками для матері та плода [52]. Підвищений судинний потік у лакунах плаценти та субплацентарна та/або матково-піхвова гіперваскуляризація є ознаками порушень спектра прикріплення плаценти (PAS) [53]. Поєднання 3D УЗД з ЕДД і подальшим мультипланарним аналізом дозволяє точно оцінити інтерфейс плацента-плодовий міхур [54]. Питання, чи є ВМСП корисним на ранніх стадіях інвазивних патологій плаценти, потребує подальших досліджень [33]. КДГ корисна для пренатальної діагностики та моніторингу хорангіоми плаценти з демонстрацією живильних судин і васкуляризації [55].
ВМСП надає нові можливості для неінвазивної характеристики мікросудинного малюнка плаценти під час вагітності без контрастування [33]. ВМСП показує внутрішньоплацентарні дрібні судини більш чітко, ніж CDI або ЕДД [33], зберігаючи при цьому відносно високу частоту кадрів (Зображення 14A-C) [56]. Нещодавнє поздовжнє дослідження показало, що ВМСП можна використовувати для оцінки розвитку мікроваскуляризації плаценти протягом нормальної вагітності [57].
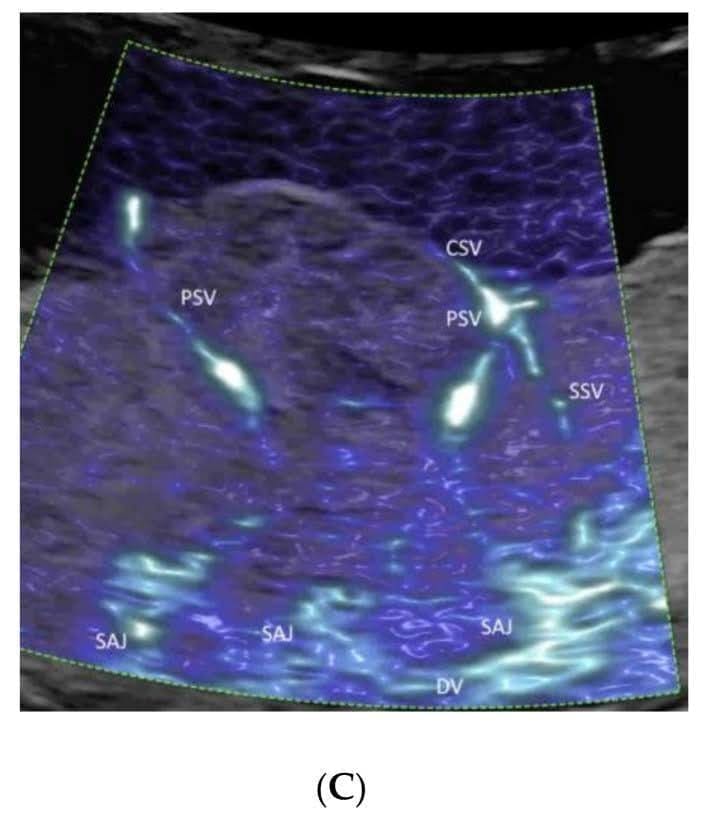
Зображення 14
Кольорова допплерографія(A), зображення високої чіткості(B) та мікросудинного кровотоку(C) судин плаценти при нормальній вагітності в 23 тижні гестації. Зверніть увагу на демонстрацію спірального артеріального струменя (SAJ), а також первинних (PSV) і вторинних (SSV) стовбурових ворсинок на зображенні(C). DV – децидуальні судини, CSV – поверхневі судини хоріона; AF – амніотична рідина.
У першому триместрі вагітності ВМСП може показувати первинні та вторинні стовбурові ворсинчасті судини та струмінь спіральної артерії [58] (Зображення 15А). У другому та третьому триместрах вагітності на ВМСП, окрім вищезазначених судин, можна побачити третинні стовбурові ворсинчасті судини (Зображення 15В) [58]. Тривимірне візуалізоване зображення може показувати просторове співвідношення внутрішньоплацентарних судин, поверхневих судин хоріона та децидуальних судин (Зображення 15C) [58].
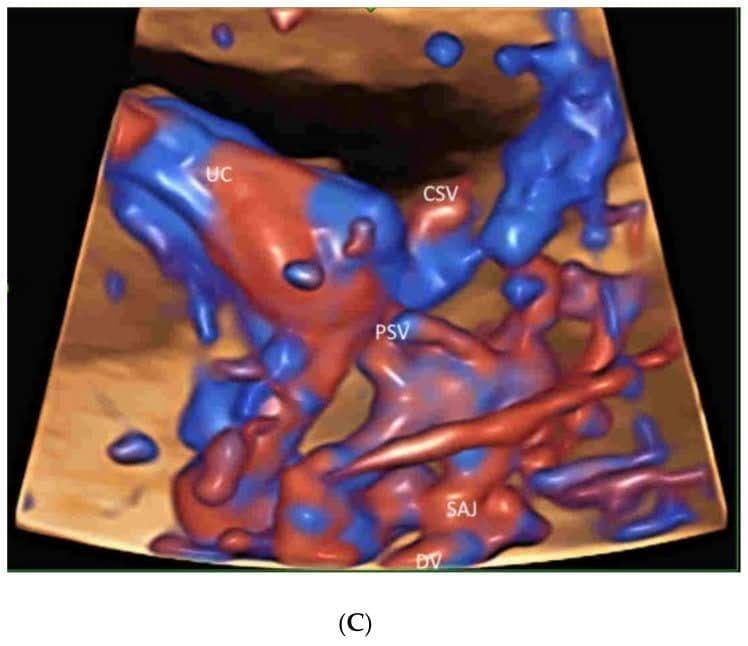
Зображення 15
Візуалізація мікросудинного потоку судин плаценти (P) у двох нормальних вагітностях у терміні 13 тижнів(A) та 23 тижні(B). Зверніть увагу на демонстрацію спірального артеріального струменя (SAJ) та первинних (PSV) і вторинних (SSV) стовбурових ворсинок на зображенні(A). Крім того, третинні стовбурові ворсинки показані на(В). Тривимірне ультразвукове дослідження з високою роздільною здатністю, що відображається в режимі “glass-body”, демонструє просторове співвідношення судин плаценти в 20 тижнів гестації(С). Пуповина – UC, децидуальні судини – DV, поверхневі судини хоріона – CSV, навколоплідні води – AF, амніотична рідина – AF.
Візуалізація мікросудинного потоку судин плаценти (P) у двох нормальних вагітностях у терміні 13 тижнів(A) та 23 тижні(B). Зверніть увагу на демонстрацію спірального артеріального струменя (SAJ) та первинних (PSV) і вторинних (SSV) стовбурових ворсинок на зображенні(A). Крім того, третинні стовбурові ворсинки показані на(В). Тривимірне ультразвукове дослідження з високою роздільною здатністю, що відображається в режимі “glass-body”, демонструє просторове співвідношення судин плаценти в 20 тижнів гестації(С). Пуповина – UC, децидуальні судини – DV, поверхневі судини хоріона – CSV, навколоплідні води – AF, амніотична рідина – AF.
4.5. Пуповина
Ідентифікація місця вставлення пуповини в плаценту полегшується за допомогою КДДП або ЕДД/ВПВЧ. Веламентарне або маргінальне введення пуповини можна чітко побачити (Зображення 16A,B). КДДП або ЕДД над внутрішнім вічком може допомогти виключити vasa previa, що є критично важливою знахідкою [39].
Зображення 16
Кольорова доплерографія плаценти, що демонструє крайове(А) та оболонкове(В) прикріплення пуповини (UC) до плаценти (P). AF – амніотична рідина; CSV – поверхневі судини хоріона; U – матка.
КДГ корисна для виявлення пуповини та оцінки її характеристик, включаючи кількість кіл обвиття, напрямок заплутування та типи (Зображення 17А,В) [60]. Відрізнити справжній вузол від хибного вузла пуповини непросто. Діагноз може полегшити 3D/4D сонографія з КДДП або ВПВЧ[61,62].
Зображення 17
Кольорова допплерографія в поперечній площині шиї плода в терміні гестації 24 тижні, що демонструє обвиту навколо шиї пуповину(A). Просторово-часова кореляція об’єму зображення відображається в режимі “glass-body”(B).
4.6. Перший триместр
Коротка оцінка паравезикальної ділянки за допомогою КДГ допомагає підтвердити наявність двох пупкових артерій, хоча це не є частиною рутинної оцінки (Зображення 18) [8]. Для раннього виявлення великих вад серця додають КДДП для оцінки чотирикамерного зображення серця і шляхів відтоку, а також кровотоку через тристулковий клапан і у венозній протоці (Зображення 19A-C) [63]. ВМСП може підвищити роздільну здатність зображення у В-режимі, показуючи кровотік у чотирьох камерах серця (Зображення 19D) і двох шляхах відтоку (Зображення 19E) [20]. Включення та виключення променевого потоку може полегшити візуалізацію шляхів відтоку та чотирьох камер, відповідно, в першому триместрі [20].
Зображення 18
Візуалізація мікросудинного кровотоку в поперечній площині плода в 11 тижнів гестації, що показує дві пупкові артерії (UA).
Зображення 19
Кольорове допплерівське зображення з променевим потоком, що демонструє чотирикамерний вигляд нормального серця плода(А), трисудинну трахею(В) та венозну протоку (ВВ), що з’єднується з серцем(С), у віці 12-13 тижнів вагітності. Візуалізація мікросудинного кровотоку серця нормального плода в 11 тижнів гестації: чотирикамерний вигляд(D) і вигляд з трьома судинами(E). RA – праве передсердя; RV – правий шлуночок; LA – ліве передсердя; LV – лівий шлуночок; PA – легенева артерія; AO – аорта; SVC – верхня порожниста вена; Tr – трахея; LPV – ліва ворітна вена; UA – пупкова артерія; UV – пупкова вена; DAO – нисхідна аорта.
4.7. Близнюки
Судинні анастомози монохоріальних плацент є основною причиною розвитку трансфузійного синдрому близнюків (ТСБ) та інших ускладнень. Нещодавнє дослідження показало, що для виявлення плацентарних анастомозів при монохоріальній двійні можливо використовувати 2D і 3D ультразвукове дослідження з використанням ВПВЧ у поєднанні з томографічною ультразвуковою візуалізацією (ТУВ) [24]. Артеріо-артеріальні анастомози є поверхневими з сигналами кровотоку туди і назад під час різних частин серцевого циклу. Артеріо-венозні анастомози є глибокими, при цьому в одну часточку плаценти потрапляють не супутні артерії та вени від двох близнюків [24]. Ці результати є цікавими, оскільки розробка точного ультразвукового картування плацентарних анастомозів є важливою передумовою для майбутньої розробки неінвазивних методів лікування ТСБ [24].
Близнюкова зворотна артеріальна перфузія (БЗАП) характеризується зворотною артеріальною перфузією через пуповину близнюка-реципієнта, що демонструється за допомогою КДДП або ВПВЧ[64]. При монохоріальній та моноамніотичній вагітності двійнею одним з основних ускладнень є переплетення пуповини, яке можна візуалізувати за допомогою КДДП або ВПВЧ.
5. Підводні камені КДГ
КДГ схильні до помилок, які зазвичай спричинені ефектом часткового об’єму, обмеженою часовою та швидкісною роздільною здатністю, невідповідними кутами інсоляції, аліасингом та нездатністю виявити повільний потік [65]. Такі помилки можуть призвести до неправильної інтерпретації нормальної або аномальної судинної анатомії та кровотоку. Таким чином, необхідна оптимізація зображення, як обговорювалося в Розділі 2.
Допплерівські артефакти можуть бути наслідком неправильних налаштувань апарату, неправильної організації дослідження, реверберації від навколишніх тканин або рухів оператора чи пацієнта. До поширених артефактів належать випадкові шуми, аліасинг, рух і “цвітіння”. Важливо розпізнавати, запобігати та виправляти ці артефакти під час КДГ, наскільки це можливо.
Хоча КДГ може надати інформацію про потік на великій площі, інформація, що надається, є обмеженою. Наприклад, розрахунок об’єму вени аневризми Галена повинен базуватися на 3D відтінках сірого, а не на 3D кольоровому/енергетичному допплерівському візуалізації [34]. Використання індексації судинності 3D-гістограми, а саме індексу васкуляризації, індексу потоку та індексу васкуляризація-потік, має бути обережним через низьку внутрішньо- та міжспостережну надійність цих індексів, наприклад, при оцінці васкуляризації плаценти [66]. Для вимірювання швидкостей та оцінки форми хвилі необхідне двовимірне спектральне допплерівське дослідження. Крім того, отримання об’єму ПЧКЗ займає від 7,5 до 12,5 с і схильне до артефактів руху. Електронно-матричний датчик – це нова технологія, яка дозволяє швидко отримати об’єм ПЧКЗ з підвищеною роздільною здатністю [4].
6. Особливі покази до застосування нових режимів КДГ
У вагітних із затримкою росту плода або прееклампсією, або з ризиком їх виникнення, ВМСП надає нові можливості для неінвазивної характеристики мікросудинного малюнка плаценти з першого по третій триместр [33,56,57,58]. ВМСП також може бути використана для підтвердження відсутності кровотоку, зокрема, при мультикістозній диспластичній нирці, відсутній нирці [40] або плацентарних озерах [50,51].
Для оцінки аномалій головного мозку, легень, печінки, селезінки, надниркових залоз та кінцівок плода можна використовувати або ВПВЧ, або ВМСП для оцінки їх судинної структури [32,33,40]. ВМСП є кращим, якщо необхідна оцінка дрібних судин або кровоносних капілярів [32,33].
При підозрі на складні вади серця плода використання кольорової допплерографії з ПЧКЗ в режимі “glass-body” може допомогти в оцінці стану серця та магістральних судин плода [28,29,30,31]. Нещодавно ця методика була використана для оцінки прекордіальної венозної системи черевної порожнини в серцевому циклі [38]. Додавання променевого потоку в КДГ може покращити відображення кровотоку в серці або складних судинних структурах [21].
З міркувань безпеки використання нових режимів, так само як і традиційних режимів КДГ, повинно бути обмежене найкоротшою можливою тривалістю для отримання адекватної клінічної інформації за допомогою одного або обох режимів, відповідно до принципу МДР [1]. Наразі нові режими не є широко доступними. Впровадження нових методів пов’язане з додатковими витратами, але вони є неінвазивними і дешевшими порівняно з КТ або МРТ-ангіографією. Аналіз витрат і переваг використання нових режимів порівняно з традиційними режимами КДГ потребує подальших досліджень.
7. Висновки
На відміну від попередніх оглядів нових ультразвукових технологій в акушерстві [67,68], цей огляд зосереджений на характеристиках і застосуванні нових, а також традиційних режимів КДГ. ВПВЧ і ВМСП, які є більш чутливими до маловоддя і кровотоку в дрібних судинах, є доповненням до традиційної КДДП. Для дослідження різних плодово-плацентарних кровотоків з різною швидкістю кровотоку слід обирати відповідний режим КДГ. Ми виділили конкретні показання до застосування нових режимів. Зростає використання ВМСП для дослідження мікросудинного русла плаценти. До нових або нових застосувань відносяться (а) ВМСП для дослідження серця плода в першому триместрі, (b) ВМСП для виявлення ранніх стадій ПАС або відшарування плаценти, (c) ПЧКЗ з режимом “glass-body” для дослідження прекордіальної венозної системи черевної порожнини та (d) ВПВЧ у поєднанні з ТУІ для виявлення плацентарних анастомозів при монохоріальній вагітності двійнею. Для оцінки їх потенційних переваг необхідні подальші дослідження.
Посилання на джерела
- Bhide A., Acharya G., Baschat A., Bilardo C.M., Brezinka C., Cafici D., Ebbing C., Hernandez-Andrade E., Kalache K., Kingdom J., et al. ISUOG Practice Guidelines (updated): Use of Doppler velocimetry in obstetrics. Ultrasound Obstet. Gynecol. 2021;58:331–339. doi: 10.1002/uog.23698.
- Sepulveda W., Rojas I., Robert J.A., Schnapp C., Alcalde J.L. Prenatal detection of velamentous insertion of the umbilical cord: A prospective color Doppler ultrasound study. Ultrasound Obstet. Gynecol. 2003;21:564–569. doi: 10.1002/uog.132.
- Wiechec M., Knafel A., Nocun A. Prenatal detection of congenital heart defects at the 11- to 13-week scan using a simple color Doppler protocol including the 4-chamber and 3-vessel and trachea views. J. Ultrasound Med. 2015;34:585–594. doi: 10.7863/ultra.34.4.585.
- Chaoui R., Abuhamad A., Martins J., Heling K.S. Recent development in three and four dimension fetal echocardiography. Fetal Diagn. Ther. 2020;47:345–353. doi: 10.1159/000500454.
- Nadel A.S. Addition of color Doppler to the routine obstetric sonographic survey aids in the detection of pulmonic stenosis. Fetal Diagn. Ther. 2010;28:175–179. doi: 10.1159/000318192.
- Grosvenor A., Silver R., Porter T.F., Zempolich K. Optimal management of placenta accreta. Am. J. Obstet. Gynecol. 2006;195:S82. doi: 10.1016/j.ajog.2006.10.261.
- Committee on Obstetric Practice Committee opinion no. 529: Placenta accreta. Obstet. Gynecol. 2012;120:207–211. doi: 10.1097/AOG.0b013e318262e340.
- Salomon L.J., Alfirevic Z., Bilardo C.M., Chalouhi G.E., Ghi T., Kagan K.O., Lau T.K., Papageorghiou A.T., Raine-Fenning N.J., Stirnemann J., et al. ISUOG Practice Guidelines: Performance of first-trimester fetal ultrasound scan. Ultrasound Obstet. Gynecol. 2013;41:102–113.
- Syngelaki A., Hammami A., Bower S., Zidere V., Akolekar R., Nicolaides K.H. Diagnosis of fetal non-chromosomal abnormalities on routine ultrasound examination at 11–13 weeks’ gestation. Ultrasound Obstet. Gynecol. 2019;54:468–476. doi: 10.1002/uog.20844.
- Anonymous. AIUM Practice Parameter for the Performance of Detailed Second- and Third-Trimester Diagnostic Obstetric Ultrasound Examinations. J. Ultrasound Med. 2019;38:3093–3100. doi: 10.1002/jum.15163.
- Anonymous. AIUM Practice Parameter for the Performance of Fetal Echocardiography. J. Ultrasound Med. 2020;39:E5–E16.
- Paladini D., Malinger G., Birnbaum R., Monteagudo A., Pilu G., Salomon L.J., Timor-Tritsch I.E. ISUOG Practice Guidelines (updated): Sonographic examination of the fetal central nervous system. Part 2: Performance of targeted neurosonography. Ultrasound Obstet. Gynecol. 2021;57:661–671. doi: 10.1002/uog.23616.
- International Society of Ultrasound in Obstetrics and Gynecology. Carvalho J.S., Allan L.D., Chaoui R., Copel J.A., DeVore G.R., Hecher K., Lee W., Munoz H., Paladini D., et al. ISUOG Practice Guidelines (updated): Sonographic screening examination of the fetal heart. Ultrasound Obstet. Gynecol. 2013;41:348–359. doi: 10.1002/uog.12403.
- Wang Z., Tyson M., Casey C. LV Function Evaluation Using LV eFlow. White paper, Hitachi Aloka Medical America. [(accessed on 15 December 2021)]. Available online: http://www.hitachi-aloka.com/assets/pdf/white-paper-LV-eFlow%20pdf
- Wu G., Xie T.R., Dimaano M.M., Alghrouz M.I., Ahmad M. High-definition blood flow imaging in the assessment of left ventricular function: Initial experience and comparison with contrast echocardiography. Echocardiography. 2019;36:546–557. doi: 10.1111/echo.14282.
- Karaca L., Oral A., Kantarci M., Sade R., Ogul H., Bayraktutan U., Okur A., Yüce I. Comparison of the superb microvascular imaging technique and the color Doppler techniques for evaluating children’s testicular blood flow. Eur. Rev. Med. Pharmacol. Sci. 2016;20:1947–1953.
- Wu L., Yen H.H., Soon M.S. Spoke-wheel sign of focal nodular hyperplasia revealed by superb micro-vascular ultrasound imaging. QJM Int. J. Med. 2015;108:669–670. doi: 10.1093/qjmed/hcv016.
- Ma Y., Li G., Li J., Ren W.D. The diagnostic value of superb microvascular imaging (SMI) in detecting blood flow signals of breast lesions. Medicine. 2015;94:e1502. doi: 10.1097/MD.0000000000001502.
- Ishikawa M., Ota Y., Nagai M., Kusaka G., Tanaka Y., Naritaka H. Ultrasonography monitoring with superb microvascular imaging technique in brain tumor surgery. World Neurosurg. 2017;97:749.e11–749.e20. doi: 10.1016/j.wneu.2016.10.111.
- Athanasopoulos N., Seale A.N., Kilby M.D. SlowflowHD for the Examination of the Fetal Heart in the First Trimester. [(accessed on 15 December 2021)]. Available online: https://www.womens-health.net/img/first-trimester/SlowFlow_HD_Whitepaper_JB83959XXf_v9.pdf
- Wang Y., Zhang Y. Fetal Vascular Rings and Pulmonary Slings: Strategies for Two- and Three- Dimensional Echocardiographic Diagnosis. J. Am. Soc. Echocardiogr. 2021;34:336–351. doi: 10.1016/j.echo.2020.10.013.
- Gindes L., Pretorius L.H., Romine L.E., Kfir M., D’Agostini D., Hull A., Achiron R. Three-Dimensional Ultrasonographic Depiction of Fetal Abdominal Blood Vessels. J. Ultrasound Med. 2009;28:977–988. doi: 10.7863/jum.2009.28.8.977.
- Ito M., AboEllail M.A.M., Yamamoto K., Kanenishi K., Tanaka H., Masaoka H., Hata T. HDlive Flow silhouette mode and spatiotemporal image correlation for diagnosing congenital heart disease. Ultrasound Obstet. Gynecol. 2017;50:411–415. doi: 10.1002/uog.17519.
- Sun W., Chen L.Z., Yin S.W., Cai A.L., Yang Z.Y. Non-invasive dynamic observation of placental vascular anastomoses in monochorionic twins: Assessment using three-dimensional sonography combined with tomographic ultrasound imaging. Placenta. 2020;95:84–90. doi: 10.1016/j.placenta.2020.04.015.
- Paladini D. Sonography in obese and overweight pregnant women: Clinical, medicolegal and technical issues. Ultrasound Obstet. Gynecol. 2009;33:720–729. doi: 10.1002/uog.6393.
- Del Bianco A., Russo S., Lacerenza N., Rinaldi M., Rinaldi G., Nappi L., Greco P. Four chamber view plus three-vessel and trachea view for a complete evaluation of the fetal heart during the second trimester. J. Perinat. Med. 2006;34:309–312. doi: 10.1515/JPM.2006.059.
- He Y.H., Liu K., Gu X.Y., Zhang Y., Han J.C., Liu X.W., Li Z.A. The application of high definition flow imaging in fetal hemodynamics. Clin. Exp. Obstet. Gynecol. 2015;42:11–17.
- Molina F.S., Faro C., Sotiriadis A., Dagklis T., Nicolaides K.H. Heart stroke volume and cardiac output by four-dimensional ultrasound in normal fetuses. Ultrasound Obstet. Gynecol. 2008;32:181–187. doi: 10.1002/uog.5374.
- Paladini D., Volpe P., Sglavo G., Vassallo M., De Robertis V., Marasini M., Russo M.G. Transposition of the great arteries in the fetus: Assessment of the spatial relationships of the arterial trunks by four-dimensional echocardiography. Ultrasound Obstet. Gynecol. 2008;31:271–276. doi: 10.1002/uog.5276.
- Volpe P., Campobasso G., De Robertis V., Di Paolo S., Caruso G., Stanziano A., Volpe N., Gentile M. Two- and four-dimensional echocardiography with B-flow imaging and spatiotemporal image correlation in prenatal diagnosis of isolated total anomalous pulmonary venous connection. Ultrasound Obstet. Gynecol. 2007;30:830–837. doi: 10.1002/uog.5145.
- Volpe P., Tuo G., De Robertis V., Campobasso G., Marasini M., Tempesta A., Gentile M., Rembouskos G. Fetal interrupted aortic arch: 2D-4D echocardiography, associations and outcome. Ultrasound Obstet. Gynecol. 2010;35:302–309. doi: 10.1002/uog.7530.
- Pooh R.K. Normal anatomy by three-dimensional ultrasound in the second and third trimesters. Semin. Fetal Neonatal Med. 2012;17:269–277. doi: 10.1016/j.siny.2012.06.003.
- Hasegawa J., Yamada H., Kawasaki E., Matsumoto T., Takahashi S., Suzuki N. Application of superb micro-vascular imaging (SMI) in obstetrics. J. Matern. Fetal Neonatal Med. 2018;31:261–263. doi: 10.1080/14767058.2016.1278206.
- Paladini D., Deloison B., Rossi A., Chalouhi G.E., Gandolfo C., Sonigo P., Buratti S., Millischer A.E., Tuo G., Ville Y., et al. Vein of Galen aneurysmal malformation (VGAM) in the fetus: Retrospective analysis of perinatal prognostic indicators in a two-center series of 49 cases. Ultrasound Obstet. Gynecol. 2017;50:192–199. doi: 10.1002/uog.17224.
- Yagel S., Cohen S.M., Valsky D.V., Shen O., Lipschuetz M., Messing B. Systematic examination of the fetal abdominal precordial veins: A cohort study. Ultrasound Obstet. Gynecol. 2015;45:578–583. doi: 10.1002/uog.13444.
- Yagel S., Cohen S.M., Valsky D.V. Simplifying imaging of the abdominal fetal precordial venous system. Ultrasound Obstet. Gynecol. 2019;53:571–575. doi: 10.1002/uog.19053.
- Wang Y., Zhang Y., Wang M. Prenatal diagnosis of an aberrant ductus venosus draining into the coronary sinus using two- and three-dimensional echocardiography: A case report. BMC Pregnancy Childbirth. 2021;21:392. doi: 10.1186/s12884-021-03870-x.
- Leung K.Y. Imaging of fetal precordial venous system by four-dimensional ultrasound with spatiotemporal image correlation technology. J. Clin. Ultrasound. 2021 doi: 10.1002/jcu.23111.
- Bethune M., Alibrahim E., Davies B., Yong E. A pictorial guide for the second trimester ultrasound. Australas. J. Ultrasound Med. 2013;16:98–113. doi: 10.1002/j.2205-0140.2013.tb00106.x.
- Aboellail M.A., Ito M., Hata T., Kanenishi K., Mori N., Nitta E., Miyake T. Advances in Color Doppler in Obstetrics. J. South Asian Fed. Obstet. Gynecol. 2019;11:1–12. doi: 10.5005/jp-journals-10006-1641.
- Sepulveda W., Sepulveda F., Corral E., Gutierrez J. Giant hepatic hemangioma in the fetus: Case reports and updated review of the literature. J. Matern. Fetal Neonatal Med. 2021;34:2554–2566. doi: 10.1080/14767058.2019.1669555.
- Abuhamad A.Z., Robinson J.N., Bogdan D., Tannous R.J. Color Doppler of the splenic artery in the prenatal diagnosis of heterotaxic syndromes. Am. J. Perinatol. 1999;16:0469–0474. doi: 10.1055/s-1999-6806.
- Tenkumo C., Hanaoka U., AboEllail M.A.M., Ishimura M., Morine M., Maeda K., Hata T. HDlive Flow with HDlive silhouette mode in diagnosis of fetal hepatic hemangioma. Ultrasound Obstet. Gynecol. 2017;49:541–542. doi: 10.1002/uog.16215.
- Gucciardo L., Uyttebroek A., De Wever I., Renard M., Claus F., Devlieger R., Lewi L., De Catte L., Deprest J. Prenatal assessment and management of sacrococcygeal teratoma. Prenat. Diagn. 2011;31:678–688. doi: 10.1002/pd.2781.
- Ivanitskaya O., Andreeva E., Odegova N. Prenatal diagnosis of Klippel-Trenaunay syndrome: Series of four cases and review of the literature. Ultrasound. 2020;28:91–102. doi: 10.1177/1742271X19880327.
- Garcia-Flores J., Cruceyra M., Cañamares M., Garicano A., Espada M., Nieto O., Tamarit I., de la Cuesta R.S. Sonographic Evaluation of Fetal Adrenal Gland in Gestational Diabetes: Relation to Fetal Growth and Maternal Biochemical Markers. J. Ultrasound Med. 2017;36:999–1007. doi: 10.7863/ultra.16.03005.
- Mohajeri Z.F., Aalipour S., Sheikh M., Shafaat M., Hantoushzadeh S., Borna S., Khazardoost S. Ultrasound measurement of fetal adrenal gland in fetuses with intrauterine growth restriction, an early predictive method for adverse outcomes. J. Matern. Fetal Neonatal Med. 2019;32:1485–1491. doi: 10.1080/14767058.2017.1410125.
- De Luca J., Rousseau T., Durand C., Sagot P., Sapin E. Diagnostic and therapeutic dilemma with large prenatally detected cystic adrenal masses. Fetal Diagn. Ther. 2002;17:11–16. doi: 10.1159/000047998.
- Eo H., Kim J.H., Jang K.M., Yoo S.Y., Lim G.Y., Kim M.J., Kim O.H. Comparison of Clinico-Radiological Features between Congenital Cystic Neuroblastoma and Neonatal Adrenal Hemorrhagic Pseudocyst. Korean J. Radiol. 2011;12:52–58. doi: 10.3348/kjr.2011.12.1.52.
- Thompson M.O., Vines S.K., Aquilina J., Wathen N.C., Harrington K. Are placental lakes of any clinical significance? Placenta. 2002;23:685–690. doi: 10.1053/plac.2002.0837.
- Schiffer V., van Haren A., De Cubber L., Bons J., Coumans A., van Kuijk S.M., Spaanderman M., Al-Nasiry S. Ultrasound evaluation of the placenta in healthy and placental syndrome pregnancies: A systematic review. Eur. J. Obstet. Gynecol. Reprod. Biol. 2021;262:45–56. doi: 10.1016/j.ejogrb.2021.04.042.
- Colpaert R.M., Ramseyer A.M., Luu T., Quick C.M., Frye L.T., Magann E.F. Diagnosis and Management of Placental Mesenchymal Disease. A Review of the Literature. Obstet. Gynecol. Surv. 2019;74:611–622.
- Pagani G., Cali G., Acharya G., Trisch I.T., Palacios-Jaraquemada J., Familiari A., Buca D., Manzoli L., Flacco M.E., Fanfani F., et al. Diagnostic accuracy of ultrasound in detecting the severity of abnormally invasive placentation: A systematic review and meta-analysis. Acta Obstet. Gynecol. Scand. 2018;97:25–37. doi: 10.1111/aogs.13238.
- Calì G., Foti F., Minneci G. 3D power Doppler in the evaluation of abnormally invasive placenta. J. Perinat. Med. 2017;45:701–709. doi: 10.1515/jpm-2016-0387.
- Amer H.Z.M., Heller D.S. Chorangioma and related vascular lesions of the placenta–A review. Fetal Pediatr. Pathol. 2010;29:199–206. doi: 10.3109/15513815.2010.487009.
- Mack L.M., Mastrobattista J.M., Gandhi R., Castro E.C., Burgess A.P.H., Lee W. Characterization of Placental Microvasculature Using Superb Microvascular Imaging. J. Ultrasound Med. 2019;38:2485–2491. doi: 10.1002/jum.14919.
- Sainz J.A., Carrera J., Borrero C., García-Mejido J.A., Fernández-Palacín A., Robles A., Sosa F., Arroyo E. Study of the Development of Placental Microvascularity by Doppler SMI (Superb Microvascular Imaging): A Reality Today. Ultrasound Med. Biol. 2020;46:3257–3267. doi: 10.1016/j.ultrasmedbio.2020.08.017.
- Hata T., Kanenishi K., Yamamoto K., AboEllail M.A.M., Mashima M., Mori N. Microvascular imaging of thick placenta with fetal growth restriction. Ultrasound Obstet. Gynecol. 2018;51:837–839. doi: 10.1002/uog.18837.
- García-Jiménez R., Arroyo E., Borrero C., Garcia-Mejido J.A., Sosa F., Fernández-Palacín A., Sainz J.A. Evaluation of Placental Micro-vascularization by Superb Micro-vascular Imaging Doppler in Cases of Intra-uterine Growth Restriction: A First Step. Ultrasound Med. Biol. 2021;47:1631–1636. doi: 10.1016/j.ultrasmedbio.2021.01.029.
- Chen Y.H., Liu X., Xu C.M., Yan S.P., Hu Q., Long F.W., Qin G.C. Standardization of diagnosis for coiling of the umbilical cord around fetal neck by ultrasound. Int. J. Gynecol. Obstet. 2019;147:96–101. doi: 10.1002/ijgo.12909.
- Abuhamad A. Three-dimensional ultrasound with color Doppler imaging of an umbilical cord true knot. Ultrasound Obstet. Gynecol. 2014;43:360. doi: 10.1002/uog.13297.
- Hasbun J., Alcalde J.L., Sepulveda W. Three-dimensional power Doppler sonography in the prenatal diagnosis of a true knot of the umbilical cord: Value and limitations. J. Ultrasound Med. 2007;26:1215–1220. doi: 10.7863/jum.2007.26.9.1215.
- Minnella G.P., Crupano F.M., Syngelaki A., Zidere V., Akolekar R., Nicolaides K.H. Diagnosis of major heart defects by routine first-trimester ultrasound examination: Association with increased nuchal translucency, tricuspid regurgitation and abnormal flow in ductus venosus. Ultrasound Obstet. Gynecol. 2020;55:637–644. doi: 10.1002/uog.21956.
- Wong A.E., Sepulveda W. Acardiac anomaly: Current issues in prenatal assessment and treatment. Prenat. Diagn. 2005;25:796–806. doi: 10.1002/pd.1269.
- Winkler P., Helmke K., Mahl M. Major pitfalls in doppler investigations. Pediatr. Radiol. 1990;20:304–310. doi: 10.1007/BF02013161.
- Martins W., Lima J.C., Welsh A.W., Araujo E., Miyague A.H., Filho F.M., Raine-Fenning N.J. Three-dimensional Doppler evaluation of single spherical samples from the placenta: Intra- and interobserver reliability. Ultrasound Obstet. Gynecol. 2012;40:200–206. doi: 10.1002/uog.11076.
- Abramowicz J.S. Obstetric ultrasound: Where are we and where are we going? Ultrasonography. 2021;40:57–74. doi: 10.14366/usg.20088.
- Leung K.Y. Applications of advanced ultrasound technology in obstetrics. Diagnostics. 2021;11:1217. doi: 10.3390/diagnostics11071217.