АВТОР: Lori L. Barr
ІНФЕКЦІЙНІ ЗАХВОРЮВАННЯ
Діагностика пре- і постнатальної інфекції ЦНС майже завжди проводиться клінічно. Загальні інфекції під час пренатального періоду описані в комплексі TORCH (токсоплазмоз, краснуха, цитомегаловірус [ЦМВ], простий герпес; «O» включає гепатит B, ВІЛ, парвовірус B19, сифіліс і герпес-зостер). Перинатальні інфекції зазвичай викликаються Escherichia coli, стрептококом групи B і моноцитогенами Listeria; все це причини неонатального менінгіту. Ультразвукові результати подібні між цими категоріями і можуть припускати інфекційну етіологію в клінічно «німих» випадках. В іншому випадку роль зображення полягає у виявленні ускладнень інфекції. Ускладнення інфекції включають: абсцес, кальцифікацію, енцефаліт, енцефаломаляцію, гідроцефалію, інфаркти, ішемію, мальформацію, мінералізуючі васкулопатії і утворення перетинок всередині шлуночків. Деякі з цих ускладнень мають прогностичні значення. У недоношених новонароджених наявність внутрішньоутробної інфекції і перивентрикулярного геморагічного інфаркту пов’язане з абсолютною летальністю, незалежно від проведеного лікування.
Внутрішньоматкова інфекція
Цитомегаловірус
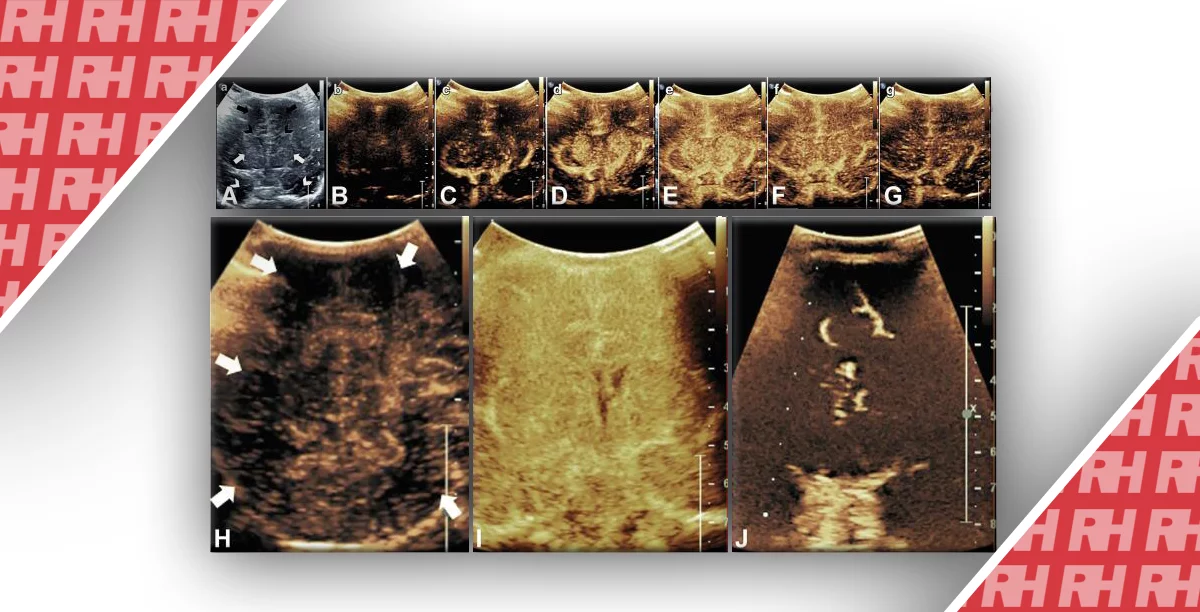
Це найбільш поширена причина внутрішньоутробної інфекції у всьому світі, при цьому люди є єдиними носіями, які виявлені на сьогоднішній день. Цей представник сімейства вірусів герпесу поширюється через рідини організму, включаючи грудне молоко. Поширеність народжуваності з вірусом оцінюється в 0,7%, а у 12,7% інфікованих новонароджених розвиваються клінічні ознаки інфекції. Постійні ускладнення зустрічаються у 40% – 58% пацієнтів з симптомами і у 13,5% пацієнтів з безсимптомною хворобою. В ЦНС мішенню вірусу є зародкова матриця, оскільки його активність впливає на недиференційовані клітини під час міграції, проліферації і диференціювання. Відмінною рисою інфекції є наявність кальцифікації, яка може визначатися в базальних гангліях, корі, а також мають перивентрикулярну субепендимальну і субкортикальну локалізацію. Двосторонні перивентрикулярні осередки кальцифікації, оточені гіпоехогенними кільцями, які характерні для ЦМВ-інфекції (рис. 18).
Рис.18. Перивентрикулярна кальцифікація. (A) Передня коронарна проекція демонструє численні перивентрикулярні зони кальцифікації, які з’єднують стінки бічних шлуночків у немовляти з фетальною ЦМВ-інфекцією. (B) Парасагітальна проекція, оптимізована для бічного шлуночка з субепендимальними зонами кальцифікації. (C) Задня коронарна проекція демонструє додаткові субепендимальні зони кальцифікації. Подібні результати присутні при інших TORCH інфекціях і при туберозному склерозі.
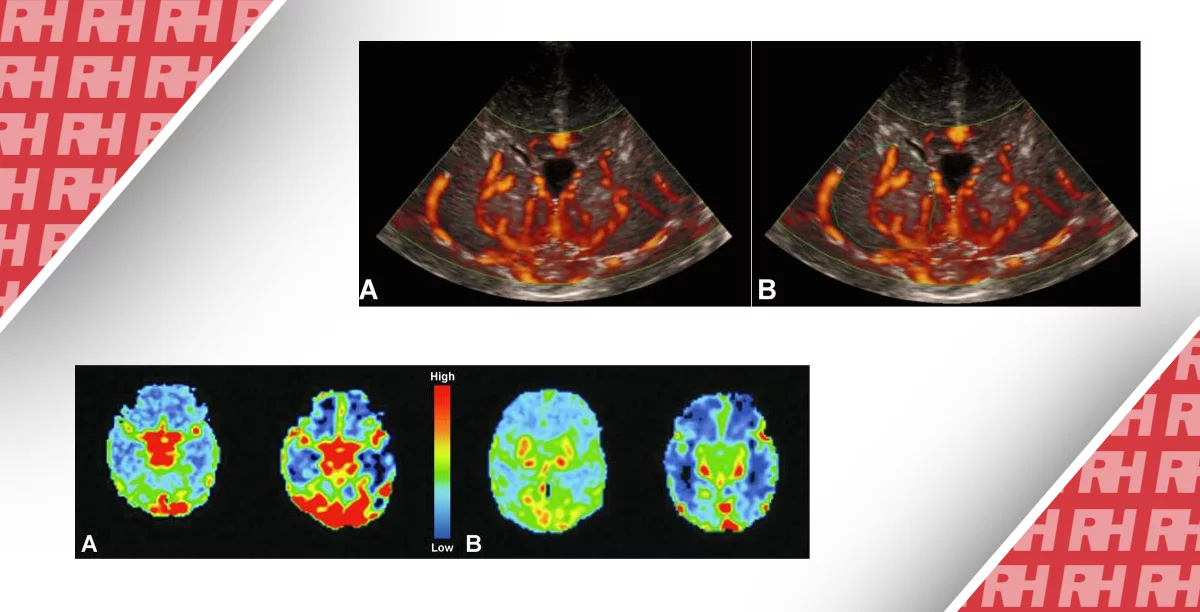
Іншими загальними ознаками для ЦМВ-інфекції є мінералізуюча (лентикулостріарна) васкулопатія, при якій зустрічаються мікроскопічні мінеральні відкладення уздовж глибоких артерій (гілочки середньо-мозкової артерії) в базальних гангліях, що призводить до появи ехогенних ліній у вигляді свічника (рис. 19).
Рис. 19. Мінералізуюча (лентикулостріарна) васкулопатія. (A) Парасагітальна нейросонограма показує розгалужені лінії ехогенності мінеральних відкладень вздовж глибоких лентикулостріарних судин (стрілка). (B) Коронарна проекція демонструє розташування відкладень в базальних гангліях (стріл) медіально від сильвієвої борозни.
Ці лінії неспецифічні для ЦМВ-інфекції, так як також визначаються при асфіксії, серцевому захворюванні з ціанозом, синдромі Дауна, фетальному алкогольному синдромі, ішемії, неімунній водянці і трисомії 13. ЦМВ-інфекція також пов’язана з аномаліями міграції і проліферації/диференціювання нейронів.
Toxoplasma gondii (Токсоплазмоз)
Токсоплазмоз викликаний інвазією протозойної Toxoplasma gondii в організм людини, як правило, шляхом контакту з інфікованими фекаліями (кішка або домашня птиця, найчастіше в Сполучених Штатах) або шляхом вживання недостатньо термічно обробленого зараженого м’яса (яловичина, курка, кінське м’ясо, свинина, баранина) або сирих овочів, так як стійкі ооцити живуть в грунті. Третина населення світу заражена Toxoplasma gondii. Коли у вагітних жінок розвивається первинна інфекція, у 90% дітей розвивається двосторонній хоріоретиніт, а у половини цих дітей спостерігається неврологічна дисфункція. Основними показниками при антенатальній візуалізації є внутрішньочерепні зони кальцифікації в базальних гангліях і перивентрикулярно.
Краснуха
Програми вакцинації зменшили кількість випадків зараження краснухою, які розвиваються під час вагітності, але вроджена краснуха як і раніше є проблемою системи охорони здоров’я в усьому світі. Клінічні прояви при краснусі для немовлят, інфікованих протягом перших 8 тижнів вагітності, характеризуються катарактою, хоріоретинітом, серцевими мальформаціями, глухотою, глаукомою, мікрофтальмією і мікроенцефалією. Нейросенсорна глухота є відмінною рисою. Ультразвукові ознаки включають мінералізуючу васкулопатію, субепендимальні псевдокісти, клітинний дебріс в шлуночках, аномалії міграції, гіпоплазію мозочка, стеноз водопроводу і затримку мієлінізації. Субепендімальні псевдокісти є кістоподобними скупченнями рідини, які розвиваються в зародковій матриці у відповідь на будь-яке пошкодження і є неспецифічними для інфекційного процесу (рис. 20).
Рис. 20. Субепендимальні псевдокісти. (A) Парасагітальна нейросонограма демонструє множинні кістозні області вздовж бічного шлуночка. (B) Коронарна нейросонограма демонструє двосторонні симетричні кістозні області в ділянці зародкової матриці.
Герпетична інфекція
Трансплацентарна передача вірусів простого герпесу 1 і 2 типу становить лише близько 5% випадків герпесу, який проявляється в неонатальному періоді. Решта викликані контактом з серопозитивними носіями або інфікованими ураженнями під час, або незабаром після народження. Ці немовлята надходять до лікарні у віці від 2 до 4 тижнів. Інфекційний процес простого герпесу в неонатальному періоді може варіюватися від легкого, до поширеного. Залучення ЦНС відбувається в 50%. Характерні симптоми включають лихоманку, дратівливість, загальмованість і судоми. До 70% пацієнтів з інфекцією ЦНС мають енцефаліт, а летальний результат, якщо не проводити лікування, становить понад 80%. Нейросонографія може виявляти вроджені аномалії, пов’язані з трансплацентарною передачею (такий же спектр результатів характерний для інших внутрішньоутробних інфекцій), а також набряк мозку, який пов’язаний з неонатальною інфекцією. Неоднорідна картина перивентрикулярної білої речовини або поширений набряк на тлі стертого малюнка мозкових звивин, щілиноподібна картина шлуночків і груба ехо-текстура, є показанням для подальшої оцінки за допомогою МРТ візуалізації і спектроскопії. Інші результати, які можна отримати за допомогою сонографії включають геморагічний інфаркт (рис. 21), набряк головного мозку і підвищений кровотік до мозкових оболонок. Мультикістозна енцефаломаляція, кортикальна кальцифікація і зниження об’єму головного мозку є віддаленими ускладненнями.
Рис. 21. Підгострий геморагічний інфаркт. Парасагітальне зображення кори лівої тім’яної області демонструє збільшену звивину з гетерогенної картиною. Скупчені елементи крові утворили рівень рідина/осад в зоні інфаркту (стрілка).
Менінгоенцефаліт
Клінічні ознаки бактеріального менінгіту мінімальні, коли інфекція виникає в неонатальному періоді, але поширеність патології в відділеннях інтенсивної терапії новонароджених складає від 1,3% до 1,4%. Escherichia coli і стрептокок 3-го типу є характерною причиною інфекційного менінгіту в неонатальному періоді, при цьому клінічно пацієнти часто мають судоми і опукле тім’ячко. Геморагічний менінгоенцефаліт зазвичай викликається Listeria monocytogenes. Зовсім недавно як причину розвитку патології назвали Bacillus cereus. До захворювання більш схильні недоношені діти чоловічої статі. Дані візуального дослідження включають в себе асиметричні області підвищеної ехогенності, що представляють собою осередковий енцефаліт або інфаркт; поренцефалію (наявність кіст в півкулях великого мозку), набряк головного мозку з порушенням кортикального рельєфу або огрубіння ехотекстури; області підвищеної ехогенності, рівною або більшою, ніж ехогенність судинного сплетення, що вказує на крововилив, підвищену ехогенність звивин, оболонок і стінок шлуночків, а також підвищена ехогенність або комплексна картина спинномозкової рідини (рис. 22).
Рис. 22. Менінгоенцефаліт. (A) Ліва парасагітальна нейросонограма демонструє збільшений бічний шлуночок з підвищеною ехогенністю епендимальних оболонок, перетинки і клітинного дебрісу. (B) Парасагітальна нейросограма в іншого немовляти демонструє складний абсцес (A) з навколишнім набряком. (C) Коронарна передня проекція іншого немовляти з менінгітом (Citrobacter) демонструє двосторонній складний субдуральний ексудат, потовщення м’якої і павутинної оболонок мозку, енцефаліт з посиленою гетерогенною білою речовиною і абсцес правої лобної ділянки (A). (D) Права парасагітальна проекція того ж пацієнта з менінгітом (Citrobacter) демонструє абсцес правої лобної ділянки (A) і дифузний енцефаліт. (E) Ліва парасагітальна проекція того ж пацієнта з менінгітом демонструє енцефаліт скроневої області з посиленою гетерогенною сірою і білою речовиною. (F) Коронарна задня проекція того ж пацієнта з менінгітом демонструє дифузний двосторонній енцефаліт з посиленою гетерогенною білою речовиною. Зверніть увагу на нечітку область розрідження, яка проявляється низькою ехогенністю (стрілка).
ПОШКОДЖЕННЯ
Пренатальні, перинатальні та післяпологові травми є причиною широкого спектра нейросонографічних даних, які варіюються в залежності від зрілості плода під час пошкодження. Якщо діагностика проводиться в передбачуваний період пошкодження, то клінічна картина змінюється більше, ніж при хронічних змінах, які спостерігаються в мозку після його відновлення. Особлива увага приділяється недоношеним новонародженим, немовлятам з перинатальною асфіксією і екстракорпоральною мембранною оксигенацією. Дані хронічного процесу відносно однорідні, незалежно від форми і типу початкового ушкодження. Хронічні ознаки травми включають енцефаломаляцію, виступаючі шлуночки і екстра-осьові (нетипові) рідинні простори, кальцифікацію і атрофію (рис. 23). Наявність будь-якої з цих ознак без відповідного анамнезу травми, гіпоксії або інфекції змушує розглядати в якості основної причини невипадкову (побутову) травму. МРТ дослідження і інші інструменти клінічної оцінки використовуються для повноцінної оцінки ймовірності насильства.
Рис. 23. Зниження об’єму білої речовини. Коронарна нейросограма демонструє рівномірне витончення білої речовини. Звивини знаходяться в безпосередній близькості від шлуночків. Зверніть увагу на грубу кальцифікацію справа (стрілка).
Внутрішньочерепна кровотеча і перивентрикулярний геморагічний інфаркт
Недоношені новонароджені схильні до ризику внутрішньочерепного крововиливу через велике венозне сплетення всередині зародкової матриці до 32 тижнів ГВ. До 20% немовлят вагою менше 1500 г схильні до ризику. Стресові фактори, які можуть призвести до крововиливу, включають будь-який природний процес або терапію, яка призводить до зниження церебральної перфузії з подальшим відновленням кровотоку з втратою саморегуляція. Характерними прикладами є: аспірація ендотрахеальної трубки, пневмоторакс, гіпотонії і міокардіальна втома. Інші незалежні фактори ризику включають: ранній сепсис, запліднення in vitro і недостатнє (відсутність) використання антенатальних стероїдів при передчасних пологах.
Як тільки розвивається крововилив, порушується доставка кисню в мозок. У 15% немовлят з внутрішньошлуночковим крововиливом розвиваються перивентрикулярні геморагічні інфаркти, які представляють собою венозні інфаркти мозкових вен в перивентрикулярній білій речовині. Оскільки більшість крововиливів є клінічно безсимптомними, всім новонародженим з ГВ менше 30-ти тижнів або з вагою при народженні менше 1500 г рекомендується скринінгова нейросонографія. Тільки 30% крововиливів розвивається протягом 24 годин після народження, а 90% припадає на перший тиждень життя. Якщо клінічний стан немовляти не погіршується, скринінгове обстеження краще відкласти і провести у віці 7-14 днів, і ще раз, коли дитина досягне 36-40 тижнів. Класифікація (система оцінок) Papile і ін. є найбільш широко відомою системою для опису перинатальних внутрішньошлуночкових крововиливів. Стан варіюється від легкої кровотечі каудоталамічної звивини зародкової матриці (1-й клас) до перивентрикулярного геморагічного інфаркту (4-й клас) (рис. 24).
Рис. 24. Внутрішньочерепний крововилив. (A) Коронарна нейросонограма демонструє двосторонню асиметричну підвищену ехогенність в каудоталамічній борозні зародкової матриці (стрілка). (B) Ліва парасагітальна проекція демонструє також крововилив 1-го класу (стрілка). (C) Коронарна нейросонограма в іншого недоношеного новонародженого з ехогенною кров’ю в правому бічному шлуночку (B). (D) Права парасагітальна нейросограма того ж немовляти з крововиливом 2-го класу (B). (E) Коронарна нейросограма іншого немовляти зі збільшеним лівим боковим шлуночком, заповненим кров’ю (B). (F) Ліве парасагітальне зображення показує «зворотню букву С», що представляє собою крововилив 3-го класу – збільшений лівий боковий шлуночок, який весь заповнений кров’ю. (G) Коронарна нейросограма іншої недоношеної дитини зі збільшеним лівим боковим шлуночком, який заповнений кров’ю і суміжним перивентрикулярним геморагічним венозним інфарктом (B). (H) На лівому парасагітальному зображенні показана кровотеча 4-класу (стрілка).
У 12-річному динамічному дослідженні великої когорти недоношених новонароджених наявність геморагії 3-го або 4-го класу було найсильнішим предиктором поганого інтелекту.
У недоношених дітей також існує ризик крововиливів в задні ямки, які майже завжди беруться до уваги, якщо тільки при нейросонографії не використовується передній підхід. Переважний метод для оцінки крововиливу в задній ямці є сонографія через проекцію шилоподібного відростка (див. рис. 14). Як тільки виявляється крововилив, проводиться щотижневе контрольне обстеження для того, щоб ідентифікувати ускладнення на ранній стадії, наприклад, гідроцефалію. У недавньому дослідженні виявлено, що гідроцефалія розвивалася у 21% пацієнтів і була пов’язана з меншою функціональною незалежністю у віці 5 років.
Перивентрикулярна лейкомаляція
Якщо через запалення або ішемію у недоношених дітей знижується церебральний кровотік, незріла олігодендроглія білої речовини схильна ризику травми, що називається перивентрикулярною лейкомаляцією. У 60% недоношених новонароджених розвивається неврологічний дефіцит, при цьому найпоширеніша причина – перивентрикулярна лейкомаляція. Серед основних причин розвитку виділяють сепсис, дуже низьку вагу при народженні, юний ГВ і серцеві захворювання. Ішемізовані області можуть мати повністю нормальну нейросонографічну картину або проявлятися у вигляді плямистих областей підвищеної ехогенності білої речовини, також можуть мати області з геморагічними змінами (що діагностується тоді, коли аномальна ехогенність дорівнює або більше ехогенності судинного сплетення) (рис. 25).
Рис. 25. Перивентрикулярна лейкомаляція. (A) Коронарна нейросограма недоношеної дитини з респіраторним дистрес-синдромом демонструє невеликі плямисті області підвищеної ехогенності в перивентрикулярній білій речовині зліва (стрілка). (B) Ліва парасагітальна проекція перивентрикулярної лейкомаляції (стрілка).
Згодом області ішемії можуть зникнути без втрати нейронів у віддаленому періоді або розвиваються поренцефалічні кісти. Кістозна перивентрикулярна лейкомаляція є однією з трьох основних ультразвукових знахідок (інші дві – крововилив 3-го і 4-го ступеня і вогнищевий інфаркт), які були пов’язані з церебральним паралічем у недоношених дітей високого ризику.
Використання допоміжних акустичних вікон, таких як шилоподібний відросток, заднє тім’ячко і великий потиличний отвір розширює можливість ідентифікувати зони, які схильні до ризику.
Гіпоксично-ішемічна енцефалопатія
Два доношених немовляти на кожні 1000 живонароджених страждають від системної перинатальної асфіксії, а від 15% до 20% помирають. Ще 25% мають постійні нейропсихічні ускладнення. Неврологічна захворюваність з 1975 року не змінилася, хоча показники виживаності у цих пацієнтів збільшилися. Швидка ідентифікація пацієнтів, яким можна було б з ефективністю провести раннє терапевтичне лікування, має вирішальне значення для зміни цієї тенденції. Локалізація процесу у доношених немовлят відрізняється від такої у недоношених новонароджених і, як правило, локалізується в корі головного мозку в судинних або рідинних просторах. Нейросонографія є недостатньо ефективним методом дослідження наявності або відсутності гіпоксично-ішемічної енцефалопатії та віддаленого прогнозування. Оскільки даний метод мобільний і часто використовується у нестабільних пацієнтів, важливо знати ознаки, які вказують на наявність патології. Ці ознаки включають: посилення ехогенності мозку, огрубіння мозкової ехотекстури, облітерацію оточуючих рідинних просторів і згладжування рельєфу (рис. 26).
Рис. 26. Набряк мозку. Коронарна нейросограма немовляти, у якого розвинувся набряк мозку на ЕКМО. Зверніть увагу на грубу ехотекстуру мозку і згладжування рельєфу мозку. Протилежність малюнку 23.
Важка гіпоксія призводить до збільшення або зниження показників резистентності (< 50 або > 90), які достовірно вимірюються за допомогою транскраніальної доплерографії. Виконання магнітно-резонансної томографії, дифузійної тензорної візуалізації і спектроскопії є золотими стандартами при лікуванні цієї популяції пацієнтів.
Екстракорпоральна мембранна оксигенація
Екстракорпоральна мембранна оксигенація (ЕКMO) залишається основою для лікування дітей грудного та раннього віку з респіраторною недостатністю. У дитинстві причинами, які призводять до респіраторної недостатності, є: сепсис, аспірація меконію, легенева гіпоплазія і вроджена діафрагмальна грижа. Канюлю поміщають через праву внутрішню яремну вену в праве передсердя. Кардіопульмональний шунт дозволяє крові проходити через оксигенатор зовнішньої мембрани, а потім повертатися в дугу аорти через канюлю в правій загальній сонній артерії. Можна також використовувати веновенозні катетери, щоб кров рухалася в праве передсердя і з правого передсердя. ЕКМО-терапія має показник виживаності 76% і дуже високу частоту важкої неврологічної інвалідності в 13%. Немовлята при ЕКМО постійно отримують антикоагулянти і піддаються ризику розвитку внутрішньочерепного крововиливу, а також негеморагічних змін паренхіми і екстра-аксіальних рідинних порожнин, які є провісниками майбутньої неврологічної інвалідності. Поки тім’ячка відкриті, виконується базова сонографія до початку ЕКМО. Пацієнти не є кандидатами для ЕКМО-терапії, якщо спостерігаються важкі аноксично-ішемічні травми, великі інфаркти або внутрішньошлуночкові крововиливи, що перевищують 2-й клас. Щоденне ультразвукове сканування проводиться для оцінки розвитку крововиливу. Будь-який крововилив вище 1-го класу є причиною припинення терапії. Слід зазначити, що крововилив, який розвивається на тлі прийому антикоагулянтів, не є таким ехогенним, як крововилив, який зустрічається у немовлят з нормальними факторами згортання крові. Наявність утворення, яке не було помічено на попередній сонограмі, може бути єдиною ознакою того, що стався крововилив (рис. 27).
Рис. 27. Крововилив в базальні ганглії при ЕКМО. Коронарна нейросограма на один день пізніше, ніж на малюнку 26. Мозок менш набряклий, про що свідчить поява рельєфу поверхні. В базальних гангліях визначаються ізоехогенні геморагії (H), ліворуч трохи більше, ніж справа. У пацієнтів з антикоагуляційною терапією крововилив може бути ізоехогенним по відношенню до мозку.
Невипадкова (побутова) травма
Головною причиною захворюваності і смертності серед дітей, які зазнали насильства, є черепно-мозкова травма. Ультразвукове сканування може виявляти незрозумілі субдуральні випоти або неспецифічні кортикальні структури, що може насторожити медичну бригаду про можливість невипадкової (побутової) травми (рис. 28).
Рис. 28. Невипадкова (побутова) травма. (A) Коронарна сонограма демонструє ехогенний забій лобно-скроневої частини мозку зліва. Зверніть увагу на різницю в ширині мозкових оболонок збоку (стрілки). Ширші мозкові оболонки зліва пов’язані з субдуральною гематомою. (B) Коронарна нейросонограма немовляти демонструє широку нечітку картину глибокого субарахноїдального простору з двох сторін, зліва картина гірша, ніж права. (C) Випинають біфронтальні екстра-осьові скупчення рідини, справа більше, ніж зліва. Якщо в анамнезі немає інфікування або травми, необхідно враховувати невипадкову (побутову) травму.
Диференціальним діагнозом нез’ясовного випинання субдуральної СМР є доброякісна макрокранія, коли субарахноїдальний простір над обома мозковими поверхнями збільшується за рахунок шлуночків нормального розміру, родової травми або попередньої інфекції. МРТ допомагає виявляти елементи крові в екстра-осьових рідинних об’єктах, коли вони діагностуються.
ПУХЛИНА
Більшість пухлин ЦНС, які виявляються в дитинстві, є супратенторіальними (65%) і найчастіше це астроцитома (30,5%). Тверді новоутворення в головному мозку найчастіше є гіперехогенними (рис. 29), при цьому також можна побачити і вторинні ознаки набряку та ефект наявності новоутворення або гідроцефалії.
Рис. 29. Високодиференційована астроцитома. Інтраопераційна коронарна проекція лівої лобної ділянки з боку лівої фронтальної області. Серп мозку (F) проходить від вершини зліва до передніх рогів бічних шлуночків. Дуже важко відрізнити пухлину (Т) від навколишнього набряку на межі сірої/білої речовини.
МРТ візуалізація є золотим стандартом для передопераційної діагностики. Інтраопераційна нейросонографія продовжує відігравати значну роль в лікуванні цих немовлят, оскільки протяжність резекції та гістологія є двома найбільш важливими прогностичними факторами.
РЕЗЮМЕ
Нейросонографія була, і буде як і раніше залишатися первинним скринінговим методом діагностики у немовлят в зв’язку з її низькою вартістю, мобільністю і безпекою. З розвитком 3D-технологій, досягненнями в кількісних алгоритмах і впровадженні контрастування в ультразвукове дослідження, в майбутньому можуть бути отримані додаткові корисні ефекти цього методу у ліжка пацієнта. Для проведення досліджень рекомендуємо використовувати апарат від компании GE Voluson E8.
Пропонуємо переглянути наш каталог товарів, щоб обрати УЗД апарат, який відповідає Вашим професійним вимогам. Ми надамо детальну консультацію, звоніть або залишайте заявку на сайті.