Автори: Jérôme Baranger, Olivier Villemain, Matthias Wagner, Mariella Vargas-Gutierrez, Mike Seed, Olivier Baud, Birgit Ertl-Wagner, Julien Aguetg
3.2.3. Ультразвук з контрастним посиленням (CEUS)
CEUS спрямований на підвищення внутрішньосудинної ехогенності шляхом введення контрастної речовини для ультразвуку: газових мікропухирців, укладених в фосфоліпідну мембрану, які стискаються і розширюються нелінійним чином під впливом ультразвукового променя. Результуючий посилений ехо-сигнал створює внутрішньосудинний контраст, в принципі схожий на зображення поперечного перерізу з використанням внутрішньосудинних контрастних агентів (зобр. 7).
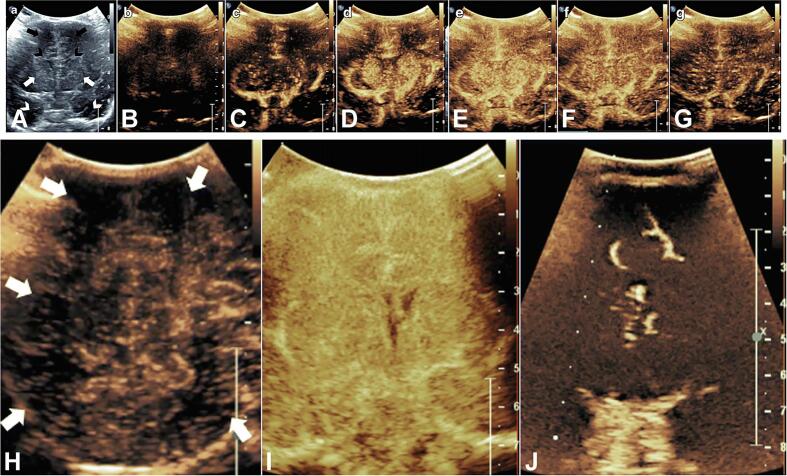
Зображення 7: Ультразвук з контрастним посиленням (CEUS). A: Середньо-корональне зображення в b-режимі, що показує двосторонні лобові частки (чорні стрілки), лобові роги бокових шлуночків (чорні шеврони), базальні ганглії (білі стрілки) і скроневі частки (білі шеврони). B-G: Статичні зображення динамічного вливання мікропухирців на средньокорональних зображеннях здорового новонародженого. H: Задній тім’яно-потиличний вид новонародженого з гіпоксично-ішемічним пошкодженням, що показує дифузну гіпоперфузію з безліччю ділянок з малою кількістю мікропухирців (білі стрілки), що відображають порушення перфузії. I: корональний вид через базальні ганглії у новонародженого з дифузним гіпоксично-ішемічним пошкодженням в період відразу після травми, що демонструє дифузну гіперперфузію. J: Корональне зображення базальних гангліїв у немовляти після тривалої зупинки серця, яке демонструє дифузну гіпоперфузію. Зображення адаптовано і використано з дозволу Hwang.
Використання CEUS у новонароджених було обмежено. Хоча до 2016 року це вважалося протипоказанням для пацієнтів з серцевим шунтом, контрастні речовини для ультразвукових досліджень за минулі роки довели свою безпеку і ефективність (Appis et al., 2015). Використання контрастних агентів для УЗД як і раніше не рекомендовано для ультразвукового дослідження головного мозку і вимагає згоди батьків. CEUS може бути краще МРТ з точки зору необхідної інфраструктури, доставки контрастної речовини і витрат. Однак в даний час є мало даних, що підтверджують рутинне використання ультразвукового контрасту для візуалізації головного мозку новонароджених (Hwang, 2019).
3.2.4. Надшвидка ультразвукова візуалізація (UUI)
За останні два десятиліття в ультразвуковій візуалізації стався великий прорив з появою нових технологій, таких як UUI. Хоча лежача в основі акустична фізика така ж, як і в звичайному ультразвуку, раніше описаному в цій роботі, прогрес в електроніці та обчислювальній техніці дозволив використовувати плоскі або розбіжні хвилі.
Ці несфокусовані хвилі дозволяють реконструювати зображення за допомогою одного випромінювання. Отже, модальність може досягати частоти кадрів до 10 000 зображень в секунду. За рахунок об’єднання декількох хвиль різної орієнтації просторова роздільна здатність еквівалентна звичайному ультразвуку (до 50 мкм) (Tanter and Fink, 2014 року).
Поєднання цієї високої частоти кадрів і високого просторово-часового дозволу дозволяє використовувати передові стратегії обробки сигналів для зображення потоків крові у великих артеріях, а також більш повільних потоків в мікросудинах (зі швидкістю до 1 мм / с), що призводить до надшвидкого доплерівського сканування.
Цей метод особливо добре підходить для новонароджених, так як ультразвук може проникати глибоко в мозок (до 8 см) через тім’ячко і проводитися біля ліжка хворого. Як і у випадку зі звичайним ультразвуком, UUI не інвазивний і не вимагає іонізуючого випромінювання. За допомогою усереднення надшвидких зображень Power Doppler протягом одного серцевого циклу, карти васкуляризації мозку з високою роздільною здатністю були отримані Демени і ін. З використанням лінійного датчика (зобр. 8, A, B, C). Секторні зображення були отримані з використанням датчика з фазованою решіткою деякими авторами цієї роботи (JB, OV, JA) в лікарні для хворих дітей, Торонто, Канада (рис. 8D).
Зображення 8: Надшвидка ультразвукова візуалізація (UUI). Трансфонтанелярні надшвидкі доплерівські зображення мозку новонародженого в різних ракурсах. A: Зліва направо, коронарний, похилий парасагітальний і парасагітальний види. Колірна шкала відображає CBV з використанням функції ультразвукового доплера. B: зліва направо, сагітальний, парасагітальний і трансскроневий осьові види. Зображення Power-Doppler включають інформацію про направлення (червоний: потік до датчика, синій: потік від датчика). Видимі структури включають периклозальну артерію, вени нижче шлуночків головного мозку, коркові проникаючі артеріоли і венули, а також вілізієве коло. C: Судинні зони інтересу, відображені в сагітальній, аксіальній і парасагітальній проекціях. (A, B і C). D: Секторне надшвидке доплерівське зображення, отримане в корональній проекції.
В рамках одного і того ж збору даних також можна кількісно оцінити кровотік в будь-який цікавлячих областях з точки зору CBV і швидкості потоку. Як і в звичайному доплерівському режимі, вимірювання CBV виражаються у відносних одиницях. Таким чином, надшвидкий доплер об’єднує традиційний кольоровий доплер і імпульсно-хвильовий доплер в єдину модальність.
Аналізуючи зміни потоку під час серцевого циклу, можна оцінити і нанести на карту судинний опір кожної судини (зобр. 8C). Перші клінічні застосування виявили потенціал цього методу в вивченні перфузії головного мозку новонароджених під час гіпотермії у новонароджених. Аналіз змін кровотоку під час серцевого циклу також дозволяє диференціювати артеріальний і венозний кровотік на основі їх різного опору.
Надшвидка доплерографія – багатообіцяючий метод приліжкового моніторингу. При повторному отриманні зображень перфузії головного мозку також можна спостерігати нервово-судинний зв’язок. Перше застосування цього так званого функціонального ультразвукового методу дозволило по-новому поглянути на складну підкіркову і коркову гемодинаміку під час епілептиформних нападів.
Спостережувані спонтанні коливання CBV також виявляються різними в таламічній і корковій областях у недоношених і новонароджених у контрольній групі новонароджених.
3.3. Комп’ютерна томографія (КТ)
КТ-перфузія – це динамічне отримання послідовних КТ-зрізів після внутрішньовенного введення болюса йодованої контрастної речовини (Proisy et al., 2016).
Режим безперервного сканування (режим кіно) використовується для відстеження проходження болюса контрасту через судинну мережу головного мозку, в той час як посилення контрасту тканини зображується кривою загасання з тимчасовим дозволом. КТ-перфузія може забезпечити точну оцінку регіонального мозкового кровотоку (CBF), об’єму (CBV) і середнього часу проходження (Krishnan et al. 2017). Карти CBF, CBV і середнього часу проходження інтерпретуються за допомогою програмного забезпечення для постобробки для візуальної оцінки і кількісного аналізу.
У новонароджених менший розмір мозку і більш висока швидкість кровотоку є біологічними перешкодами, які перешкоджають здійсненню перфузії КТ в цій віковій групі. Крім того, перфузія при КТ у дітей утруднена через більш високу частоту артефактів руху, використання невеликих внутрішньовенних катетерів, які обмежують швидкість ін’єкції і збільшують час ін’єкції, і, що найбільш важливо, через іонізуючого випромінювання, яке зазвичай вимагає додаткових 1, 57 – 2,96 мЗв для комп’ютерно томографічної перфузії. Аналіз ризику і користі іонізуючого випромінювання при КТ-перфузії передбачає, що його застосування у дітей дуже обмежене (Raybaud and Barkovich, 2012).
Далеко не всі КТ-дослідження перфузії включали новонароджених. Wintermark et al. оцінили використання перфузії КТ в умовах невідкладної допомоги (Wintermark et al., 2005) і визначили вікові варіації кількісних значень перфузії при КТ у 77 дітей у віці від 7 днів до 18 років, включаючи 10 пацієнтів молодше 12 місяців (рис. 9). Значення перфузії при КТ відповідали іншим методам візуалізації і показали вікові варіації з піком перфузії у віці близько 3 років.
Зображення 9: Комп’ютерна томографія (КТ) перфузії. Розміщення областей інтересу (ROI) для аналізу регіонального об’єму церебральної крові і кровотоку в сірому (чорні області інтересу) і білому (білі області інтересу) речовинах.
3.4. Спектроскопія в ближньому інфрачервоному діапазоні (NIRS)
NIRS – це неінвазивний метод візуалізації, який використовує різні властивості оптичного поглинання біологічних структур. Біологічна тканину відносно прозора для ближнього інфрачервоного світла в так званому оптичному вікні з довжинами хвиль від 650 до 1350 нм (Smith et al., 2009). У цьому ж вікні всмоктування крові сильно залежить від концентрації оксігемоглобіну і дезоксігемоглобіну (Mohammadi-Nejad et al., 2018).
При випромінюванні ближнього інфрачервоного світла в тканини головного мозку через непошкоджений череп фотони можуть проникати в тканини на відстань кількох сантиметрів. Через багаторазове розсіювання частина цього світла досягає шкіри голови в віддаленій від випромінювача точці, де її можна знайти (зобр. 10). Дотримуючись закону Бера-Ламберта, динамічні зміни абсорбції можуть бути пов’язані зі змінами оксігемоглобіну і дезоксігемоглобіну. На основі цих концентрацій NIRS забезпечує аналіз локальних змін об’єму крові, а також споживання кисню.
Клінічно NIRS використовувався в реанімації для безперервного неінвазивного моніторингу регіональної мозкової сатурації оксигенації, що дозволяє приймати діагностичні та терапевтичні рішення (Claessens et al., 2019, Garvey and Dempsey, 2018). Однією з переваг використання NIRS є його простота і портативність, яка полягає в розміщенні оптичних датчиків або «оптодів» на шкірі новонародженого біля ліжка хворого, що можливо з урахуванням тонкої кістки черепа і відносної відсутності волосся.
Зображення 10: A – Принципи ближньої інфрачервоної спектроскопії (NIRS). Оптод пропускає інфрачервоне світло через шкіру голови і череп, тканини, які мають обмежене поглинання на цих довжинах хвиль. Приймальний оптод збирає розсіяне світло. Адаптовано з дозволу Mohammadi-Nejad et al. (Mohammadi-Nejad et al., 2018). B – Динамічні зміни абсорбції можуть бути пов’язані з концентрацією оксі- і дезоксігемоглобіну [HbO] і [HbR], що володіють різними характеристиками абсорбції, з яких потім визначаються зміна об’єму церебральної крові і оксиметрія. [HbT] – загальна концентрація гемоглобіну.
Поєднання моніторингу церебральної оксигенації з артеріальним тиском – це неінвазивний метод, який безперервно оцінює церебральну ауторегуляцію і дає можливість підтримувати стабільну церебральну перфузію і оксигенацію під час коливань артеріального тиску (Claessens et al., 2019).
Недоношені новонароджені, немовлята, які перенесли кардіохірургічні операції з приводу критичного вродженого пороку серця, а також діти, яким потрібна екстракорпоральна мембранна оксигенація, схильні до ризику придбаного пошкодження головного мозку через змінену гемодинаміки, кровотеч і / або емболічних явищ. Безперервний нейромоніторинг змін гемодинамічного статусу надзвичайно важливий для цих новонароджених в спробі виявити тих, хто схильний до більш високого ризику травми головного мозку на ранній стадії.
Було показано, що NIRS є цінним інструментом для безперервного моніторингу церебральної оксигенації, особливо для недоношених дітей (Hyttel-Sorensen et al., 2015) і для новонароджених, які перенесли кардіохірургічні операції (Hirsch et al., 2009).
Його тимчасовий дозвіл величезний (≈ 10 мс) в порівнянні з МРТ або нуклеарною візуалізацією. Він також вивчається як багатообіцяючий метод моніторингу епілепсії (Wallois et al., 2010). Крім того, функціональний NIRS – це метод нейровізуалізації, що розвивається, і здатний оцінити нервово-судинний зв’язок. Подальші поліпшення включають розробку матриць оптодів високої щільності (HD) для поліпшення просторового дозволу, що призвело до появи дифузійної оптичної томографії HD (Singh et al., 2014 року).
Головний недолік – погане просторовий дозвіл, оскільки шлях світла через тканину по суті невідомий. Дослідження глибоких структур також представляє проблему для NIRS через обмежене проникнення.
3.5. Ядерна візуалізація
Підходи ядерної медицини з використанням або однофотонної емісійної томографії (ОФЕКТ), або позитронно-емісійної томографії (ПЕТ) були розроблені для візуалізації різних фізіологічних і біохімічних процесів в мозку, який розвивається.
У ПЕТ-сканування використовуються радіоактивно мічені індикатори з короткоживучими ізотопами, що випускають позитрони, які реагують з електронами, виділяючи високоенергетичні гамма-промені, які виявляються ПЕТ-камерою. Швидкість місцевого метаболізму глюкози в головному мозку оцінюється in vivo з використанням 2-дезоксі-2 [18F] -фтор-D-глюкози (FDG) (Huang et al., 1980). На відміну від цього, в ОФЕКТ використовуються сполуки, що випромінюють гамма-випромінювання, при цьому виявлення одиночного гамма-випромінювання обмежує його просторову роздільну здатність (5-7 мм для ОФЕКТ в порівнянні з 3-4 мм для ПЕТ). Індикатори ОФЕКТ можна використовувати для оцінки церебрального кровотоку.
У той час як ПЕТ і ОФЕКТ використовувалися для вимірювання біохімічних процесів у дітей з порушеннями розвитку, ПЕТ також застосовувалася у новонароджених. Новонароджених з різними типами черепно-мозкових травм, включаючи перинатальну гіпоксію-ішемію і внутрішньошлуночкові крововиливи, оцінювали за допомогою ПЕТ (Doyle et al., 1983), і було показано, що низький метаболізм глюкози пов’язаний або зі зниженням кровотоку, або із затримкою розвитку ( Suhonen-Polvi). і ін., 1993).
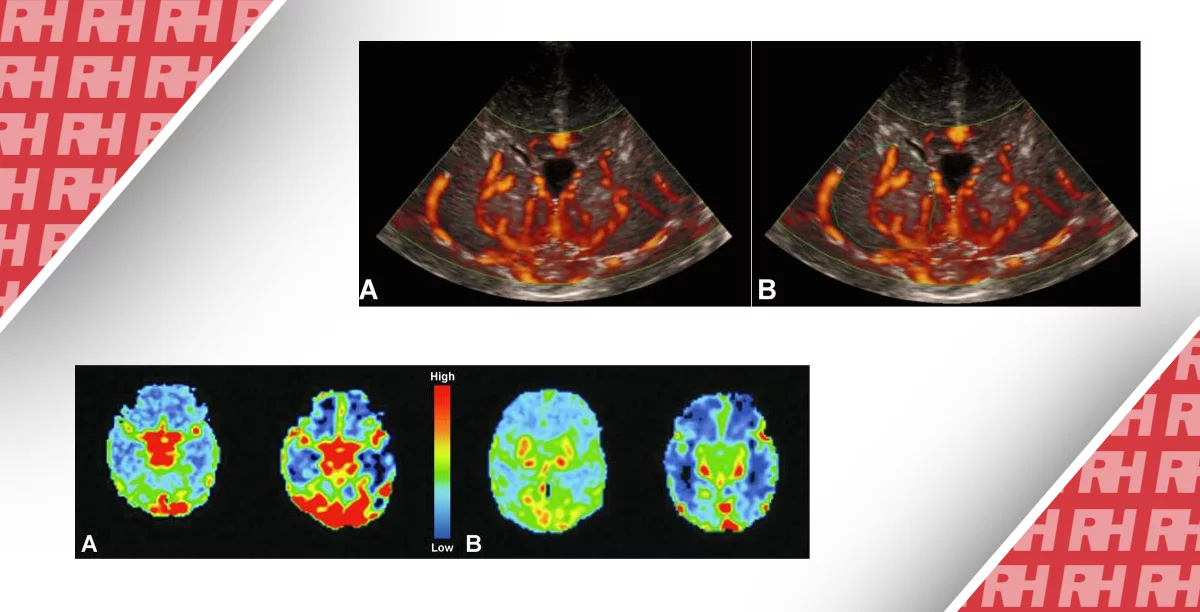
Було виявлено, що результати ПЕТ протягом перших трьох тижнів життя корелюють з інтегрованою за амплітудою ЕЕГ і дозволяють прогнозувати результат розвитку нервової системи після перинатальної асфіксії (Thorngren-Jerneck et al., 2001) (зобр. 11).
Зображення 11: Позитронно-емісійна томографія (ПЕТ). Швидкість церебрального метаболізму глюкози вимірюється в підгострому періоді (10-11 днів) після перинатальної асфіксії у трьох дітей (по одному на стовпець) з різним ступенем гіпоксично-ішемічної енцефалопатії і відображається на рівні мозочка (верхній ряд), таламуса. (Середній ряд) і сенсомоторної кори (нижній ряд). У новонародженого справа розвинувся церебральний параліч з ускладненими припадками. Новонароджений зліва був здоровим при дворічному спостереженні. Адаптовано з дозволу Thorngren-Jerneck et al.
Як правило, роль ядерної візуалізації, включаючи ПЕТ і ОФЕКТ, у новонароджених дуже обмежена, враховуючи природний вплив іонізуючого випромінювання. Незважаючи на те, що вона все ще вважається відносно низькою, розрахунковий еквівалент ефективної дози на все тіло в дослідженнях, проведених Thorngren-Jerneck et al. склав 0,16-0,17 мЗв / МБк. Якщо прийняти стандартну вагу новонародженого 3,5 кг (IRCP, 2002) і слідувати керівним принципам введення радіофармпрепаратів на основі ваги (Treves et al., 2016), розрахункова введена активність складе 14 МБк, що призведе до ефективної дози приблизно 2,4 мЗв.
Поточні обмеження і перспективи неонатальної візуалізації головного мозку
Існує кілька методів візуалізації для оцінки перфузії мозку. Однак при візуалізації новонародженого безпеку і здійсненність обмежують доступні варіанти. Як описано в цьому огляді, комп’ютерна томографія і ядерна візуалізація мають технічні переваги, але властиві їм ризики, пов’язані з впливом іонізуючого випромінювання, обмежують їх використання у новонароджених. З іншого боку, NIRS вважається безпечним і легко вживаним у ліжку пацієнта, однак має обмежене застосування, враховуючи його місцеву і недосконалу оцінку перфузії мозку. У світлі цього, ультразвук і МРТ в даний час здаються найбільш підходящими методами візуалізації для відповідності обмеженням і особливостям новонароджених