АВТОРИ: Mirko D’Onofrio, Stefano Crosara, Riccardo De Robertis, Stefano Canestrini, Emanuele Demozzi, Roberto Pozzi Mucelli
Відділення радіології, Університетський госпіталь G.B. Rossi, Університет Верони, Італія
РЕЗЮМЕ
Еластографія не так давно була представлена в клінічних дослідженнях як новий метод, що застосовується для ультразвукової візуалізації. Завдання цієї нової техніки полягає в тому, щоб відрізняти різні тканини на основі їх специфічної жорсткості. Оскільки в злоякісних пухлинах є тенденція до більш жорсткої структури, ніж при доброякісних ураженнях і в паренхімі, цей новий підхід може бути клінічно значущим. Початковий клінічний досвід в ультразвуковій еластографії був багатообіцяючим при диференціальній діагностиці вузлів молочної залози, щитоподібної залози і простати. Застосування ультразвукової еластографії до підшлункової залози почалося відносно недавно і знаходиться в стадії апробації. Існує лише кілька досліджень, опублікованих на даний момент в літературі.
КЛЮЧОВІ СЛОВА: підшлункова залоза, ультразвук, еластографія, ARFI, зсувна хвиля
ВСТУП
Еластографія не так давно була представлена в клінічних дослідженнях як новий метод, застосовуваний для ультразвукової візуалізації. Завдання цієї нової техніки полягає в тому, щоб відрізняти різні тканини на основі їх специфічної щільності.
При еластографії були запропоновані різні методи компресії тканини (зображення деформаціъ за допомогою компресії), візуалізація швидкості зсуву хвилі в режимі реального часу і акустична променева імпульсна візуалізація (ARFI), які отримані з двох технічних рішень, відомих як деформаційна (компресійна) еластографія і зсувнохвильова еластографія.
В останні роки зростає інтерес до оцінки пружних властивостей тканин за допомогою сонографії. Еластографія м’яких тканин заснована на деформації, яка викликана прикладеною силою на орган-мішень. Цей метод заснований на двох основних методах візуалізації. Перший – деформаційна візуалізація жорсткості; його реалізація вимагає безперервної компресії датчиком або зовнішньої механічної компресії за рахунок дихальних рухів і пульсації серця. Його головний недолік полягає в тому, що компресію неможливо визначити кількісно, а місце компресії не може бути обмежене конкретними досліджуваними областями, що призводить до переміщення цілі і спотворення вимірюваних результатів. Другий тип – це візуалізація жорсткості за рахунок акустичного удару, включаючи ARFI візуалізацію і надзвукову зсувнохвильову візуалізацію, яка генерує короткодіючу акустичну променеву енергію в необхідну область, при цьому не викликає руху всієї ділянки. Крім того, сила акустичного випромінювання може бути визначена кількісно і, отже, лікар отримує можливість отримати кількісну інформацію. Цей метод робить результати вимірювань менш залежними від рухів оператора.
Деформація тканини при компресійній еластографії відбувається тоді, коли застосовується невелика мануальна компресія/декомпресія за допомогою датчика або за допомогою фізіологічних рухів суміжних органів (дихання або серцебиття). Абсолютне значення деформації уздовж поздовжньої осі пропорційно інтенсивності прикладеної компресії. Ступінь деформації розраховується шляхом вимірювання коливань ультразвукової частоти до і після компресії. Спеціальне програмне забезпечення обчислює еластичність тканини в певній області поля зору. Кольорова еластограма накладається на ультразвукове зображення і оновлюється в режимі реального часу з частотою компресії 10-15 Гц. Вона складається з колірної карти (більш жорсткі області кодуються синім кольором, більш м’які області – червоними, а зелений – з проміжними рівнями жорсткості). Деякі типи ультразвукового устаткування демонструють масштаб у відтінках сірого, при цьому більш жорсткі тканини представлені як більш темні.
Неможливо точно визначити інтенсивність сили, що діє на тканини, тому еластографія шляхом компресії забезпечує тільки якісну, а не кількісну інформацію. Дані відносної еластичності можуть змінюватися в залежності від тканин, присутніх в досліджуваній області, розміру досліджуваного поля і інтенсивності тиску, що створюється.
У м’яких тканинах поширюються два типи механічних хвиль: компресійні хвилі (ультразвукові – компресійні хвилі в заданому діапазоні частот) і рухомі (поперечні) хвилі. Компресійні хвилі рухаються набагато швидше, ніж зсувні хвилі в м’яких тканинах.
Зсувнохвильова еластографія забезпечує в реальному часі оцінку поширення зсувних хвиль в тканинах. Звичайний ультразвуковий датчик, підключений до системи, генерує хвилі тиску і реєструє рух тканини за допомогою послідовності тисяч зображень в секунду для створення спеціально розробленого концентратора випромінювання. Як тільки швидкість поширення стискаючих хвиль вимірюється, створюється хроматична двовимірна карта в’язкопружних властивостей тканини (області великої жорсткості – червоні, м’якші області – сині, зелені – проміжний рівень жорсткості).
Значення жорсткості тканини також виражаються в кілопаскалях (кПа). Зсувнохвильова візуалізація дозволяє проводити як якісну, так і кількісну оцінки. На відміну від деформаційної еластографії, яка залишається якісною, зсувнохвильова візуалізація дозволяє провести абсолютно кількісну оцінку механічних властивостей тканини.
Акустична променева імпульсна візуалізація (ARFI), свого роду зсувнохвильова візуалізація, яка здатна якісно і кількісно визначити жорсткість тканини без необхідності зовнішньої компресії. Вона використовує короткочасні променеві акустичні імпульси для створення локалізованих зміщень тканини, які реєструються ультразвуковим сканером. Такі зміщення безпосередньо корелюють з в’язкопружними властивостями локальних м’яких тканин.
ARFI може використовуватися двома різними способами. Один з них якісний, в якому використовується короткий акустичний імпульс високої інтенсивності для деформування елементів тканини і створення статичної карти (еластограми) відносної жорсткості тканин, що входять в область інтересу. Інший є кількісним, в якому використовується первинний акустичний імпульс, орієнтований на необхідну область (діагностична мітка з фіксованими розмірами), для генерування компресійних хвиль, які переміщуються перпендикулярно напрямку звукового поштовхового імпульсу в тканини, який самостійно здатний деформувати тканину. Швидкість хвилі через тканину розраховується в метрах в секунду. Чим жорсткіше тканина, тим більша швидкість зсувної хвилі. Як якісний, так і кількісний варіант методу ARFI зменшують внутрішньодослідницьку варіабельність, оскільки при цьому не потрібна зовнішня компресія, але він забезпечує тільки статичною інформацією, а не динамічною, як при еластографії шляхом компресії. Оскільки в злоякісних пухлинах є тенденція до більш щільної структури, ніж при доброякісних ураженнях і в паренхімі, цей новий підхід може бути клінічно значущим. Початковий клінічний досвід в ультразвуковій еластографії був багатообіцяючим при диференціальній діагностиці вузлів молочної залози, щитоподібної залози і простати. Застосування ультразвукової еластографії до підшлункової залози почалося відносно недавно і знаходиться в стадії апробації. Існує лише кілька досліджень, опублікованих на даний момент в літературі.
ТЕХНІКА І МЕТОДИ
Еластографія підшлункової залози може бути виконана з використанням двох різних підходів: черезшкірного і ендоскопічного. Черезшкірний підхід, хоча і є легким і відразу ж практично здійсненним, залежить від добре відомих внутрішніх обмежень. Навпаки, ендоскопічний підхід в даний час найбільш широко вивчається.
2.1. Ендоскопічний підхід
Ендоскопічна ультрасонографія (Endoscopic ultrasonography – EUS) в даний час є найбільш частим методом, який використовується для еластографічного дослідження підшлункової залози. Щоб отримати еластографічне зображення, ехоендоскоп позиціонується і маневрує відповідно до досліджуваних органів. Площа, яка оцінюється, визначається розміром ROI (region of interest- область інтересу, кольорове вікно). При маніпулюванні зондом може бути застосована необхідна компресія. Придатність еластографічного сигналу позначається числовою шкалою всередині зображення. Зображення відображаються одночасно з використанням еластографічного і B-режиму. При еластографії потрібна дуже невелика додаткова компресія, як правило, достатнім є тиск, що незначно відрізняється від пульсації сусідніх судин. ROI повинне бути досить великим, щоб включати в себе досліджувану область і достатню навколишню тканину для порівняння. Нові технічні розробки дозволяють проводити усереднення по декільком кадрам, з метою обчислення середнього значення відтінкової гістограми, що відповідає загальній еластичності тканин в обраній зоні. Порівняння двох різних областей тканини в межах ROI (наприклад, пухлини підшлункової залози і прилеглої паренхіми підшлункової залози) полегшує розрахунок співвідношення деформації між підозрілим пухлинними ураженнями та контрольною тканиною.
2.2. Черезшкірний підхід
При використанні черезшкірного підходу може застосовуватися метод акустичної променевої імпульсної візуалізації (ARFI). ARFI візуалізація – це новий спосіб ультразвукової візуалізації для оцінки жорсткості глибоких тканин. Короткочасні акустичні променеві імпульси (<1 мс) генерують механічні хвилі, які призводять до локалізованих зсувів в межах попередньо ідентифікованого ROI, обраного в області тканини-мішені, на основі анатомічного розташування за допомогою зображень при стандартному ультразвуковому дослідженні. Використання акустичних поштовхових імпульсів для генерації зсувних хвиль в межах фіксованого прицільного ROI забезпечує можливість проведення якісних візуальних і кількісних вимірювань. Дослідження контролюється за допомогою ультразвукової картинки, а результат відображає в’язкопружні властивості тканин, що виникають із-за деформації тканини, яка пов’язана з опором тканини у відповідь на поширення хвилі. Сильна сторона методу ARFI полягає в отриманні чисельного значення (м/с) для швидкості зсувних хвиль, які поширюються в досліджуваній тканині.
ІНТЕРПРЕТАЦІЯ ЗОБРАЖЕНЬ
Внутрішня структура підшлункової залози зазвичай рівномірно ізо/гіперехогенна в порівнянні з печінкою. Вона виглядає як помірно м’яка, однорідна зона м’яких тканин, яка позначається зеленим кольором при еластографії. З віком ехогенність підшлункової залози значно зростає в результаті розвитку жирової та сполучної тканин. Зображення при еластографії стає неоднорідним.
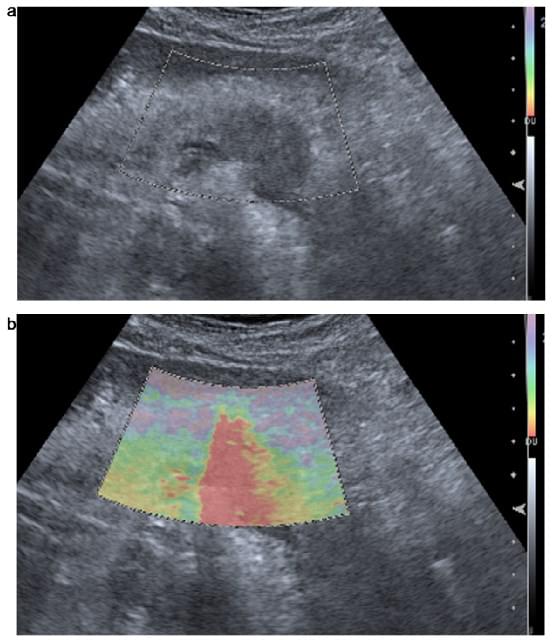
Еластограмма представлена зображеннями з використанням хроматичних (сіра/кольорова) панелей (рис.1). Система налаштована на використання відтінкової хроматичної (в сірій шкалі або червоно-зелено-синій) карти, в якій області твердих тканин показані в чорному або синьому кольорі, області м’яких тканин – в білому або червоному, а тканини з проміжною жорсткістю характеризуються жовтим/зеленим кольором. Одним з обмежень цього методу є те, що повний спектр від синього до червоного кодування застосовується до кожного еластографічного запису і вказує на градацію відносної еластичності в області дослідження. Не існує абсолютної шкали жорсткості тканини.
Рис. 1. Еластографія підшлункової залози. (А) В-режим, осьова проекція аденокарциноми підшлункової залози, яка показана у вигляді гіпоехогенного і твердого (всередині еластографічної мітки) новоутворення тіла підшлункової залози, при цьому воно є жорстким (червоним) при еластографічному дослідженні (В).
3.1. EUS
Результати якісної еластосонографічної оцінки підшлункової залози дещо відрізняються в різних дослідженнях. Тільки здорова підшлункова залоза однозначно характеризується як м’яка тканина, яка представлена однорідно-зеленим кольором в кожній з опублікованих серій.
Доброякісна запальна патологія підшлункової залози може проявлятися у вигляді картини стільника, з переважно блакитним відтінком; гетерогенної змішаної кольорової картини з переважаючими м’якими тканинами або однорідно-зеленої картини. Dietrich описав аутоімунний панкреатит (СВП) як синю тканину при еластосонографічному хроматичному аналізі, яка оточена більш твердою структурою, ніж нормальна здорова тканина підшлункової залози.
Аденокарцинома при еластосонографії проявляється як синя тканина. Giovannini показав, що аденокарцинома підшлункової залози також може характеризуватися однорідно-зеленим або гетерогенним м’яким малюнком у випадках з накладенням некрозу або кістозної дегенерації.
Нейроендокринні пухлини піжщлункової залози (НЕПЗ) можуть мати картину у вигляді переважно блакитного стільникового малюнка відповідно до Janssen, Hirche, Itokawa і Giovannini і у вигляді однорідного синього малюнка відповідно до Hirche і Iglesias-Garcia або як зелена центральна область, яка оточена синьою тканиною, згідно Itokawa і Giovannini. Itokawa і Giovannini продемонстрували також однорідну зелену картину для НЕПЗ. Метастази виявляються як неоднорідно-синій малюнок в роботах Giovannini і Iglesias-Garcia.
Мікрокістозна серозна аденома проявляється у вигляді стільникового, переважно блакитного, малюнка; як однорідний блакитний малюнок або у вигляді зеленої області, оточеної синьою тканиною.
Виходячи з цього, стає ясно, чому результати, про які йдеться в літературі, не завжди однозначні і не узгоджуються. Це означає, що необхідні подальші дослідження.
3.2. ARFI
ARFI аналізує механічні деформаційні властивості тканин без необхідності зовнішньої компресії: м’яка тканина створює великий зсув в порівнянні з жорсткою тканиною, яка призводить тільки до незначного зсуву або взагалі до його відсутності, тому, чим жорсткіша тканина, тим більше буде механічна швидкість хвилі. Після попереднього вибору досліджуваного ROI на звичайному ультразвуковому зображенні, акустичний поштовховий імпульс, який передається через тканину в сторону досліджуваного ROI, індукує звукові хвилі. Потім обчислюється числове значення швидкості хвилі (м/с) в результаті декількох вимірювань, виконаних автоматично для конкретного просторового розташування. Чим жорсткіша тканина, тим більше числове значення буде отримано.
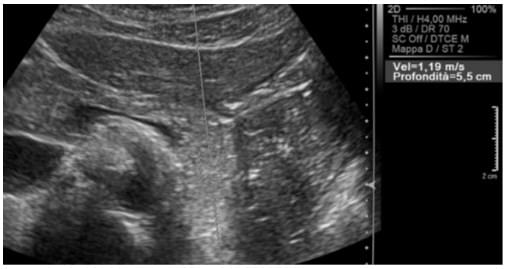
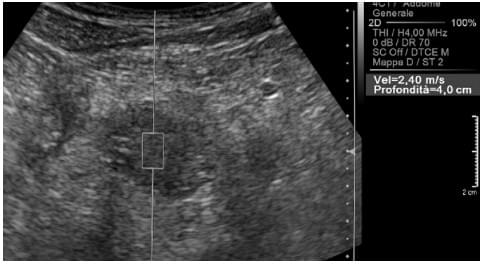
Згідно з попередніми результатами, середнє значення швидкості, виміряне через нормальну паренхіму підшлункової залози (рис. 2), становить приблизно 1,40 м/с. Відомо, що панкреатична протокова аденокарцинома є твердою пухлиною, більш жорсткою, ніж прилегла паренхіма, внаслідок наявності фіброзу. Тому вона характеризується більш високим значенням швидкості хвилі (рис. 3 і 4).
Рис. 2. Кількісна оцінка ARFI підшлункової залози. Нормальне значення.
Рис. 3. Аденокарцинома головки підшлункової залози. Високе значення швидкості зсувної хвилі.
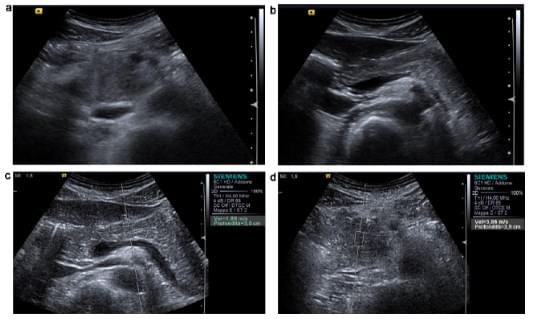
Рис. 4. Аденокарцинома головки підшлункової залози. Збільшення головки підшлункової залози (а) з неоднорідною будовою без дилатації основної протоки підшлункової залози (в): сумнівна інтерпретація. Нормальне значення тканини підшлункової залози на рівні тіла залози (с). Більш висока швидкість хвилі в зоні ураження підшлункової залози (d), вказує на велику жорсткість, ніж у звичайній паренхіми підшлункової залози (передбачувана протокова аденокарцинома).
Повідомляється, що показники жорсткості підшлункової залози, виміряні за допомогою ARFI, також є високими у пацієнтів з хронічним панкреатитом.
Методика ARFI тестувалася не тільки при оцінці твердих тканин. Хоча механічні хвилі (ультразвук) поширюються через тверді тіла, а зсувні хвилі сильно загасають в рідинах, в яких можуть бути виміряні тільки поздовжні хвилі або відображення зсувних хвиль на межі розділу твердої і рідкої фаз, широкий діапазон відмінностей значень в рідинах in vivo, сприяв проведенню випробувань ARFI в рідких середовищах. При цьому були отримані різні результати, відповідно до в’язкості.
КЛІНІЧНІ ЗАСТОСУВАННЯ
У різних дослідженнях немає чіткої узгодженості щодо точності еластографії при патології підшлункової залози.
4.1. EUS
EUS може адекватно і відтворювано розрізняти нормальну підшлункову залозу і більшість пухлин підшлункової залози, в яких переважають щільні сині області.
Повідомляється, що при характеристиці локальних твердих пухлин, переважно зелена картина підшлункової залози виключає злоякісну пухлину з високою точністю. Для маленьких ендокринних пухлин визначається жорстка, або трохи більш жорстка картина, ніж для нормальної паренхіми підшлункової залози.
Однак, клінічна ефективність методики для диференціальної діагностики обмежена, оскільки усі, крім однієї, пухлини підшлункової залози в серії Hirche були більш жорсткими, ніж навколишня тканина, незалежно від природи (злоякісна в порівнянні з доброякісною). Отже, згідно з роботою Hirche, малоймовірно, що інформація, надана EUS, дозволить уникнути необхідності цитологічного або біопсійного дослідження, для підтвердження остаточного діагнозу. Основний диференційний діагноз, який має розрізняти EUS – це хронічний панкреатит і рак підшлункової залози. Головна проблема при диференціації цих двох захворювань при EUS-еластографії – подібна щільність цих двох нозологій. Крім того, утворення каменів і кальцифікації (часто пов’язані з хронічним панкреатитом) дають щільну жорстку структуру, яку можна порівняти із злоякісними структурами. І в черговий раз різні дослідження наводять різні висновки. Janssen стверджує, що EUS еластографія не здатна відрізняти хронічний панкреатит від новоутворень різних типів, особливо злоякісних пухлин, і характеризується низькою специфічністю і позитивною прогностичною значимістю (ППЗ) для еластографічної діагностики хронічного панкреатиту (56,9% і 46,6% відповідно ) і новоутворень підшлункової залози (65,4% і 51,7%). Відповідно до вищезгаданої роботи, EUS-еластографія може бути придатна для ранньої діагностики хронічного панкреатиту і для оцінки кількості фіброзної тканини при хронічному панкреатиті. У серії Itokawa було продемонстровано, що специфічність EUS еластографії в диференціальній діагностиці доброякісних і злоякісних уражень підшлункової залози є низькою (64,3%). Ці результати показують, що при панкреатичній патології щільні ураження не завжди злоякісні, а м’які ураження не завжди доброякісні. Згідно Itokawa, EUS еластографія сама по собі не може розрізняти злоякісні або доброякісні ураження підшлункової залози; проте може відігравати важливу роль в позиціонуванні при EUS-тонкоголковій біопсії.
У свою чергу дослідження Itokawa вводить поняття співвідношення деформації (СД), як напівкількісний метод для об’єктивної оцінки жорсткості тканини: коли застосовується компресія до двох різних зон тканини підшлункової залози (включаючи області, які розцінюються злоякісними і не злоякісними) одночасно, кожне значення деформації збільшується пропорційно стисненню. СД для раку підшлункової залози (45,23 – в роботі Itokawa) було значно вище, ніж СД для туморозного панкреатиту (5.78), що вказує на те, що цей новий підхід може бути корисним методом диференціальної діагностики.
З іншого боку, Saftoiu продемонстрував дуже хорошу міждослідницьку кореляцію (k = 0,72) при якісному аналізі еластографічних даних. Група Saftoiu також провела кількісний аналіз з використанням спеціального програмного забезпечення для отримання числових даних при конверсії відеороликів, записаних для кожного пацієнта, для отримання відтінкової гістограми. У цьому дослідженні, при комп’ютерному аналізі усереднених відтінкових гістограм EUS-еластографічних зображень, в більшості випадків була виявлена різниця між хронічним псевдотуморозним панкреатитом і раком підшлункової залози. Відповідно до цього дослідження (в якому для EUS-еластографії були розраховані чутливість, специфічність і точність, близькі до 80%, а ППЗ досягала 95%) EUS-еластографія може потенційно використовуватися в негативних випадках EUS-тонкоголкової біопсії для планування повторної біопсії, або хірургічного втручання у випадках, коли при EUS-еластографії підозрюється злоякісне ураження.
Giovannini в своїх попередніх результатах по EUS-еластографії повідомив про високу чутливість і специфічність (100% і 67%) методики в діагностиці злоякісних панкреатичних новоутворень, проте в подальшому дослідженні підтвердив ті ж результати Itokawa і Saftoiu.
У своєму дослідженні група Iglesias-Garcias продемонструвала дуже гарну точність EUS-еластографії при виявленні злоякісних новоутворень підшлункової залози (включаючи аденокарциному, метастази і нейроендокринні пухлини) з чутливістю, специфічністю, ППЗ, НПЗ і точністю 100%, 85,5%, 90,7%, 100% і 94%, відповідно.
На закінчення слід сказати, що необхідно провести додаткові дослідження, щоб отримати однозначну думку про застосування EUS-еластографії і можливості диференціальної діагностики при доброякісній і злоякісній патології підшлункової залози. Можливо, точність і клінічна ефективність цього методу будуть покращені, і при розробці нових технологічних пристроїв буде досягнутий узгоджений результат вимірювань.
4.2. ARFI
Панкреатична протокова аденокарцинома є більш жорстким новоутворенням, ніж прилегла паренхіма, через наявність фіброзу і виражену десмоплазію, що характеризується більш високим значенням швидкості хвилі (рис. 1c). Однак, результатом нашого особистого досвіду є лише широкий спектр отриманих значень і невелика кількість даних в літературі. Більш того, як було зазначено вище, для EUS-еластографії диференціальна діагностика з хронічним панкреатитом дійсно проблематична.
Фактично, в даний час не існує порогових значень. На сьогоднішній день ARFI техніка була протестована для оцінки тільки твердих уражень, в той час як в повсякденній клінічній практиці кістозні утворення як і раніше характеризуються і класифікуються за візуальною оцінкою на основі їх морфології і архітектури. Проте, остаточний діагноз кістозних уражень підшлункової залози як і раніше вимагає інвазивного аналізу кістозного вмісту. Більш того, рідина in vivo може бути дійсно різної природи: серозна цистаденома характеризується простим рідким вмістом, тоді як муцинозні кістозні ураження мають більш складний рідинний склад. Згідно з літературними даними, в простый рідини, такій як вода, майже завжди виходить значення – XXXX/0, проте в більш складних рідких середовищах, таких як в’язкі рідини, можна отримати чисельне значення. При аналізі рідини за допомогою ARFI в серозних цистаденомах часто виходять значення XXXX/0, в той же час при муцинозних новоутвореннях найчастіше очікуються чисельні значення. Таким чином, ARFI може потенційно розширити діагностичну характеристику панкреатичних кістозних уражень, що представляє собою новий підхід для неінвазивного аналізу рідинного вмісту.
МАЙБУТНІ РОЗРОБКИ
Майбутні розробки включають оцінку техніки біопсії уражень підшлункової залози і лімфатичних вузлів за допомогою еластографічного наведення.
Подальше майбутнє застосування еластографії при патології підшлункової залози полягає в розмежуванні аденокарцином на основі жорсткості і кореляції їх реакції на хіміотерапію. Крім того, дослідження перітуморальної тканини підшлункової залози за допомогою ARFI може бути виконано до хірургічної резекції, з метою прогнозування ризику післяопераційної фістули, ймовірність якої обернено пропорційно жорсткості залози. Для проведення досліджень рекомендуємо використовувати апарат від компании Siemens S2000.



14.10.2019
Стив Джобс