АВТОРЫ: Mirko D’Onofrio, Stefano Crosara, Riccardo De Robertis, Stefano Canestrini, Emanuele Demozzi, Roberto Pozzi Mucelli
Отделение радиологии, Университетский госпиталь G.B. Rossi, Университет Вероны, Италия
РЕЗЮМЕ
Эластография не так давно была представлена в клинических исследованиях как новый метод, применяемый для ультразвуковой визуализации. Задача этой новой техники состоит в том, чтобы отличать различные ткани на основе их специфической жесткости. Поскольку в злокачественных опухолях имеется тенденция к более жесткой структуре, чем при доброкачественных поражениях и в паренхиме, этот новый подход может быть клинически значимым. Первоначальный клинический опыт в ультразвуковой эластографии был многообещающим при дифференциальной диагностике узлов молочной железы, щитовидной железы и простаты. Применение ультразвуковой эластографии к поджелудочной железе началось относительно недавно и находится в стадии апробации. Существует лишь несколько исследований, опубликованных до сих пор в литературе.
КЛЮЧЕВЫЕ СЛОВА: поджелудочная железа, ультразвук, эластография, ARFI, сдвиговая волна
ВВЕДЕНИЕ
Эластография не так давно была представлена в клинических исследованиях как новый метод, применяемый для ультразвуковой визуализации. Задача этой новой техники состоит в том, чтобы отличать различные ткани на основе их специфической плотности.
При эластографии были предложены различные методы компрессии ткани (изображение деформация с помощью компрессии), визуализация скорости сдвига волны в режиме реального времени и акустическая лучевая импульсная визуализация (ARFI), которые получены из двух технических решений, известных как деформационная (компрессионная) эластография и сдвиговолновая эластография.
В последние годы возрастает интерес к оценке упругих свойств тканей с помощью сонографии. Эластография мягких тканей основана на деформации, вызванной приложенной силой на орган-мишень. Этот метод основан на двух основных методах визуализации. Первый – деформационная визуализация жёсткости; его реализация требует непрерывной компрессии датчиком или внешней механической компрессии за счет дыхательных движений и пульсации сердца. Его главный недостаток заключается в том, что компрессию невозможно определить количественно, а место компрессии не может быть ограничено конкретными исследуемыми областями, что приводит к перемещению цели и искажению измеренных результатов. Второй тип – это визуализация жесткости за счет акустического удара, включая ARFI визуализацию и сверхзвуковую сдвиговолновую визуализацию, которая генерирует короткодействующую акустическую лучевую энергию в интересующую область, при этом не вызывает движения всей области. Кроме того, сила акустического излучения может быть определена количественно и, следовательно, врач получает возможность получить количественную информацию. Этот метод делает результаты измерений менее зависимыми от движений оператора.
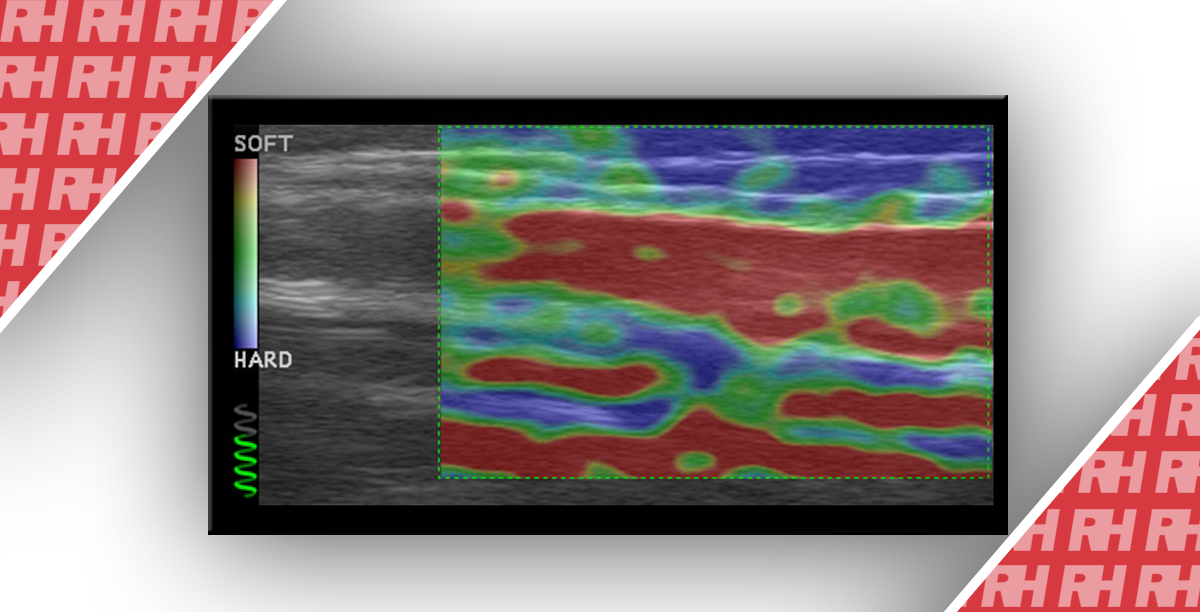
Деформация ткани при компрессионной эластографии происходит тогда, когда применяется небольшая мануальная компрессия/декомпрессия с помощью датчика или посредством физиологических движений смежных органов (дыхание или сердцебиение). Абсолютное значение деформации вдоль продольной оси пропорционально интенсивности прилагаемой компрессии. Степень деформации рассчитывается путем измерения колебаний ультразвуковой частоты до и после компрессии. Специальное программное обеспечение вычисляет эластичность ткани в определенной области поля зрения. Цветная эластограмма накладывается на ультразвуковое изображение и обновляется в режиме реального времени с частотой компрессии 10-15 Гц. Она состоит из цветовой карты (более жесткие области кодируются синим цветом, более мягкие области – красными, а зеленый – с промежуточными уровнями жесткости). Некоторые типы ультразвукового оборудования демонстрируют масштаб в оттенках серого, при этом более жесткие ткани представлены как более темные.
Невозможно точно определить интенсивность силы, действующей на ткани, поэтому эластография путем компрессии обеспечивает только качественную, а не количественную информацию. Данные относительной эластичности могут изменяться в зависимости от тканей, присутствующих в исследуемой области, размера исследуемого поля и интенсивности оказываемого давления.
В мягких тканях распространяются два типа механических волн: компрессионные волны (ультразвуковые – компрессионные волны в заданном диапазоне частот) и сдвиговые (поперечные) волны. Компрессионные волны движутся намного быстрее, чем сдвиговые волны в мягких тканях.
Сдвиговолновая эластография обеспечивает в реальном времени оценку распространения сдвиговых волн в тканях. Обычный ультразвуковой датчик, подключенный к системе, генерирует волны давления и регистрирует движение ткани с помощью последовательности тысяч изображений в секунду для создания специально разработанного концентратора излучения. Как только скорость распространения сдавливающих волн измеряется, создается хроматическая двумерная карта вязкоупругих свойств ткани (области большой жесткости – красные, более мягкие области – синие, зеленые – промежуточный уровень жесткости).
Значения жесткости ткани также выражаются в килопаскалях (кПа). Сдвиговолновая визуализация позволяет проводить как качественную, так и количественную оценки. В отличие от деформационной эластографии, которая остается качественной, сдвиговолновая визуализация позволяет провести абсолютно количественную оценку механических свойств ткани.
Акустическая лучевая импульсная визуализация (ARFI), своего рода сдвиговолновая визуализация, которая способна качественно и количественно определить жесткость ткани без необходимости внешней компрессии. Она использует кратковременные лучевые акустические импульсы для создания локализованных сдвигов ткани, которые регистрируются ультразвуковым сканером. Такие смещения напрямую коррелируют с вязкоупругими свойствами локальных мягких тканей.
ARFI может использоваться двумя разными способами. Один из них качественный, в котором используется короткий акустический импульс высокой интенсивности для деформирования элементов ткани и создания статической карты (эластограммы) относительной жесткости тканей, входящих в область интереса. Другой является количественным, в котором используется первичный акустический импульс, ориентированный на интересующую область (диагностическая метка с фиксированными размерами), для генерирования компрессионных волн, которые перемещаются перпендикулярно направлению звукового толчкового импульса в ткани, который самостоятельно способен деформировать ткань. Скорость волны через ткань рассчитывается в метрах в секунду. Чем жестче ткань, тем больше скорость сдвиговой волны. Как качественный, так и количественный вариант метода ARFI уменьшают внутриисследовательскую вариабельность, поскольку не требуется внешняя компрессия, но он обеспечивает только статической информацией, а не динамической, как при эластографии путем компрессии. Поскольку в злокачественных опухолях имеется тенденция к более плотной структуре, чем при доброкачественных поражениях и в паренхиме, этот новый подход может быть клинически значимым. Первоначальный клинический опыт в ультразвуковой эластографии были многообещающими при дифференциальной диагностике узлов молочной железы, щитовидной железы и простаты. Применение ультразвуковой эластографии к поджелудочной железе началось относительно недавно и находится в стадии апробации. Существует лишь несколько исследований, опубликованных до сих пор в литературе.
ТЕХНИКА И МЕТОДЫ
Эластография поджелудочной железы может быть выполнена с использованием двух разных подходов: чрескожного и эндоскопического. Чрескожный подход, хотя и является легким и сразу же практически выполнимым, зависит от хорошо известных внутренних ограничений. Напротив, эндоскопический подход в настоящее время наиболее широко изучается.
2.1. Эндоскопический подход
Эндоскопическая ультрасонография (Endoscopic ultrasonography – EUS) в настоящее время является наиболее частым методом, который используется для эластографического исследования поджелудочной железы. Чтобы получить эластографическое изображение, эхоэндоскоп позиционируется и маневрирует в соответствии с исследуемыми органами. Площадь, которая оценивается, определяется размером ROI (region of interest- область интереса, цветное окно). При манипулировании зондом может быть применена необходимая компрессия. Пригодность эластографического сигнала обозначается числовой шкалой внутри изображения. Изображения отображаются одновременно с использованием эластографического и B-режима. При эластографии требуется очень небольшая дополнительная компрессия, как правило, достаточным является давление, незначительное отличающееся от пульсации соседних сосудов. ROI должно быть достаточно большим, чтобы включать в себя исследуемую область и достаточную окружающую ткань для сравнения. Новые технические разработки позволяют проводить усреднение по нескольким кадрам, с целью вычисления среднего значения оттеночной гистограммы, соответствующего общей эластичности тканей в выбранной области. Сравнение двух разных областей ткани в пределах ROI (например, опухоли поджелудочной железы и прилегающей паренхимы поджелудочной железы) облегчает расчет отношения деформации между подозрительным опухолевыми поражениями и контрольной тканью.
2.2. Чрескожный подход
При использовании чрескожного подхода может применяться метод акустической лучевой импульсной визуализации (ARFI). ARFI визуализация – это новый способ ультразвуковой визуализации для оценки жесткости глубоких тканей. Кратковременные акустические лучевые импульсы (<1 мс) генерируют механические волны, которые приводят к локализованным смещениям в пределах предварительно идентифицированного ROI, выбранного в области ткани-мишени, на основе анатомического местоположения с помощью изображений при стандартном ультразвуковом исследовании. Использование акустических толчковых импульсов для генерации сдвиговых волн в пределах фиксированного прицельного ROI обеспечивает возможность проведения качественных визуальных и количественных измерений. Исследование контролируется с помощью ультразвуковой картинки, а результат отражает вязкоупругие свойства тканей, возникающие из-за деформации ткани, которая связана с сопротивлением ткани в ответ на распространение волны. Сильная сторона метода ARFI заключается в получении численного значения (м/с) для скорости сдвиговых волн, которые распространяются в исследуемой ткани.
ИНТЕРПРЕТАЦИЯ ИЗОБРАЖЕНИЙ
Внутренняя структура поджелудочной железы обычно равномерно изо/гиперэхогенна по сравнению с печенью. Она выглядит как умеренно мягкая, однородная зона мягких тканей, которая обозначается зеленым цветом при эластографии. С возрастом эхогенность поджелудочной железы значительно возрастает в результате развития жировой и соединительной тканей. Изображение при эластографии становится неоднородным.
Эластограмма представлена изображениями с использованием хроматических (серая/цветная) панелей (рис.1). Система настроена на использование оттеночной хроматической (в серой шкале или красно-зелено-синей) карты, в которой области твердых тканей показаны в черном или синем цвете, области мягких тканей – в белом или красном, а ткани с промежуточной жесткостью характеризуются желтым/зеленым цветом. Одним из ограничений этого метода является то, что полный спектр от синего до красного кодирования применяется к каждой эластографической записи и указывает на градацию относительной эластичности в области исследования. Не существует абсолютной шкалы жесткости ткани.
Рис. 1. Эластография поджелудочной железы. (А) В-режим осевая проекция аденокарциномы поджелудочной железы, которая показана в виде гипоэхогенного и твердого (внутри эластографической метки) новообразования тела поджелудочной железы, при этом оно является жестким (красным) при эластографическом исследовании (В).
3.1. EUS
Результаты качественной эластосонографической оценки поджелудочной железы несколько отличаются в разных исследованиях. Только здоровая поджелудочная железа однозначно характеризуется как мягкая ткань, которая представлена однородно-зеленым цветом в каждой из опубликованных серий.
Доброкачественная воспалительная патология поджелудочной железы может проявляться в виде картины сот, с преимущественно голубым оттенком; гетерогенной смешанной цветной картины с преобладающими мягкими тканями или однородно-зеленой картины. Dietrich описал аутоиммунный панкреатит (АИП) как синюю ткань при эластосонографическом хроматическом анализе, которая окружена более твердой структурой, чем нормальная здоровая ткань поджелудочной железы.
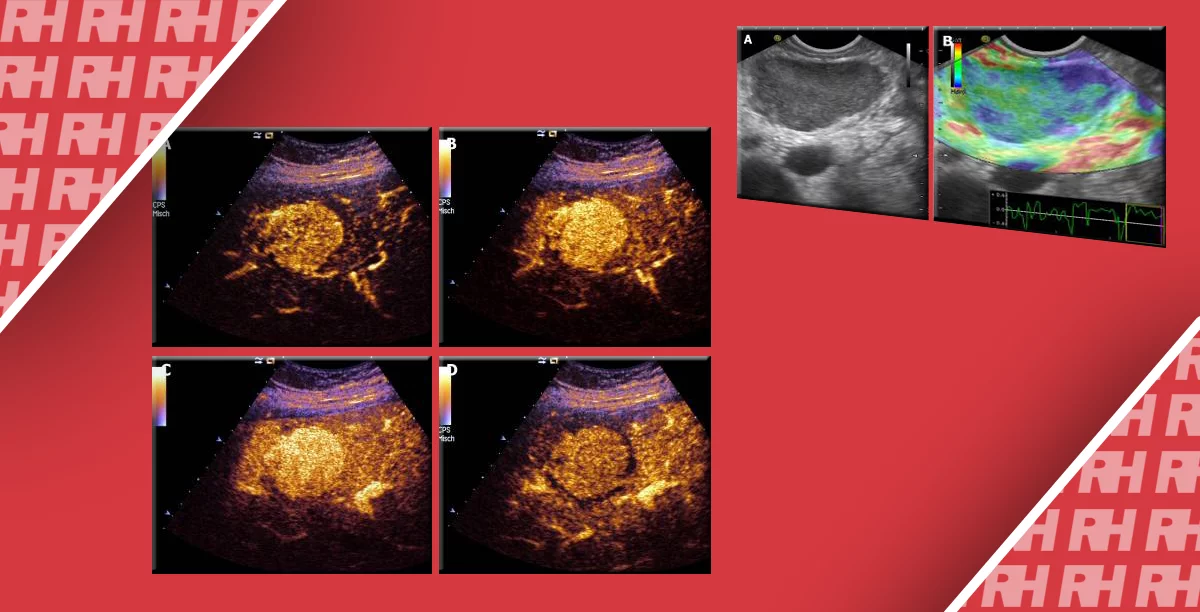
Аденокарцинома при эластосонографии проявляется как синяя ткань. Giovannini показал, что аденокарцинома поджелудочной железы также может характеризоваться однородно-зеленым или гетерогенным мягким рисунком в случаях с наложением некроза или кистозной дегенерации.
Нейроэндокринные опухоли поджедудочной железы (НЭОПЗ) могут иметь картину в виде преимущественно голубого сотового рисунка в соответствии с Janssen, Hirche, Itokawa и Giovannini и в виде однородного синего рисунка в соответствии с Hirche и Iglesias-Garcia или как зеленая центральная область, которая окружена синей тканью, согласно Itokawa и Giovannini. Itokawa и Giovannini продемонстрировали также однородную зеленую картину для НЭОПЗ. Метастазы проявляются как неоднородно-синий рисунок в работах Giovannini и Iglesias-Garcia.
Микрокистозная серозная аденома проявляется в виде сотового, преимущественно голубого, рисунка; как однородно голубой рисунок или в виде зеленой области, окруженной синей тканью.
Исходя из этого, становится ясно, почему результаты, о которых говорится в литературе, не всегда однозначны и не согласуются. Это означает, что необходимы дальнейшие исследования.
3.2. ARFI
ARFI анализирует механические деформационные свойства тканей без необходимости внешней компрессии: мягкая ткань создает большое смещение по сравнению с жесткой тканью, которая приводит только к незначительному смещению или вообще к его отсутствию, поэтому, чем жестче ткань, тем больше будет механическая скорость волны. После предварительного выбора исследуемого ROI на обычном ультразвуковом изображении, акустический толчковый импульс, передаваемый через ткань в сторону исследуемого ROI, индуцирует звуковые волны. Затем вычисляется числовое значение скорости волны (м/с) в результате нескольких измерений, выполненных автоматически для конкретного пространственного местоположения. Чем жестче ткань, тем большее числовое значение будет получено.
Согласно предварительным результатам, среднее значение скорости, измеренное через нормальную паренхиму поджелудочной железы (рис. 2), составляет приблизительно 1,40 м/с. Известно, что панкреатическая протоковая аденокарцинома является твердой опухолью, более жесткой, чем прилегающая паренхима, вследствие наличия фиброза. Поэтому она характеризуется более высоким значением скорости волны (рис. 3 и 4).
Рис. 2. Количественная оценка ARFI поджелудочной железы. Нормальное значение.
Рис. 3. Аденокарцинома головки поджелудочной железы. Высокое значение скорости сдвиговой волны.
Рис. 4. Аденокарцинома головки поджелудочной железы. Увеличение головки поджелудочной железы (а) с неоднородным строением без дилатации основного протока поджелудочной железы (в): сомнительная интерпретация. Нормальное значение ткани поджелудочной железы на уровне тела железы (с). Более высокая скорость волны в зоне поражения поджелудочной железы (d), указывает на большую жесткость, чем у обычной паренхимы поджелудочной железы (предполагаемая протоковая аденокарцинома).
Сообщается, что показатели жесткости поджелудочной железы, измеренные с помощью ARFI, также являются высокими у пациентов с хроническим панкреатитом.
Методика ARFI тестировалась не только при оценке твердых тканей. Хотя механические волны (ультразвук) распространяются через твердые тела, а сдвиговые волны сильно затухают в жидкостях, в которых могут быть измерены только продольные волны или отражение сдвиговых волн на границе раздела твердой и жидкой фаз, широкий диапазон различий значений в жидкостях in vivo, способствовал проведению испытаний ARFI в жидких средах. При этом были получены различные результаты, в соответствии с вязкостью.
КЛИНИЧЕСКИЕ ПРИМЕНЕНИЯ
В разных исследованиях нет четкой согласованности в отношении точности эластографии при патологии поджелудочной железы.
4.1. EUS
EUS может адекватно и воспроизводимо различать нормальную поджелудочную железу и большинство опухолей поджелудочной железы, в которых преобладают плотные синие области.
Сообщается, что при характеристике локальных твердых опухолей, преимущественно зеленая картина поджелудочной железы исключает злокачественную опухоль с высокой точностью. Для маленьких эндокринных опухолей определяется жесткая, или немного более жесткая картина, чем для нормальной паренхимы поджелудочной железы.
Однако, клиническая эффективность методики для дифференциальной диагностики, ограничена, поскольку все, кроме одной, опухоли поджелудочной железы в серии Hirche были более жесткими, чем окружающая ткань, независимо от природы (злокачественная в сравнении с доброкачественной). Следовательно, согласно работе Hirche, маловероятно, что информация, предоставленная EUS, позволит избежать необходимости цитологического или биопсийного исследования, для подтверждения окончательного диагноза. Основной дифференциальный диагноз, который должна различать EUS – это хронический панкреатит и рак поджелудочной железы. Главная проблема при дифференциации этих двух заболеваний при EUS-эластографии – сходная плотность этих двух нозологий. Кроме того, образование камней и кальцификации (часто связанные с хроническим панкреатитом) дают плотную жесткую структуру, сопоставимую со злокачественными структурами. И в очередной раз разные исследования приводят разные выводы. Janssen утверждает, что EUS эластография не способна отличать хронический панкреатит от новообразований различных типов, особенно злокачественных опухолей, и характеризуется низкой специфичностью и позитивной прогностической значимостью (ППЗ) для эластографической диагностики хронического панкреатита (56,9% и 46,6% соответственно) и новообразований поджелудочной железы (65,4% и 51,7%). Согласно вышеупомянутой работе, EUS-эластография может быть пригодна для ранней диагностики хронического панкреатита и для оценки количества фиброзной ткани при хроническом панкреатите. В серии Itokawa было продемонстрировано, что специфичность EUS эластографии в дифференциальной диагностике доброкачественных и злокачественных поражений поджелудочной железы является низкой (64,3%). Эти результаты показывают, что при панкреатической патологии плотные поражения не всегда злокачественные, а мягкие поражения не всегда доброкачественные. Согласно Itokawa, EUS эластография сама по себе не может различать злокачественные или доброкачественные поражения поджелудочной железы; однако может играть важную роль в позиционировании при EUS-тонкоигольной биопсии.
В свою очередь исследование Itokawa вводит понятие отношения деформации (ОД), как полуколичественный метод для объективной оценки жесткости ткани: когда применяется компрессия к двум разным зонам ткани поджелудочной железы (включая области, которые расцениваются злокачественными и не злокачественными) одновременно, каждое значение деформации увеличивается пропорционально сжатию. ОД для рака поджелудочной железы ( в работе Itokawa) было значительно выше, чем ОД для туморозного панкреатита (5.78), что указывает на то, что этот новый подход может быть полезным методом дифференциальной диагностики.
С другой стороны, Saftoiu продемонстрировал очень хорошую межисследовательскую корреляцию (k = 0,72) при качественном анализе эластографических данных. Группа Saftoiu также провела количественный анализ с использованием специального программного обеспечения для получения числовых данных при конверсии видеороликов, записанных для каждого пациента, для получения оттеночной гистограммы. В этом исследовании, при компьютерном анализе усредненных оттеночных гистограмм EUS-эластографических изображений, в большинстве случаев была выявлена разница между хроническим псевдотуморозным панкреатитом и раком поджелудочной железы. В соответствии с этим исследованием (в котором для EUS-эластографии были рассчитаны чувствительность, специфичность и точность, близкие к 80%, а ППЗ достигала 95%) EUS-эластография может потенциально использоваться в отрицательных случаях EUS-тонкоигольной биопсии для планирования повторной биопсии, или хирургического вмешательства в случаях, когда при EUS-эластографии подозревается злокачественное поражение.
Giovannini в своих предварительных результатах по EUS-эластографии сообщил о высокой чувствительности и специфичности (100% и 67%) методики в диагностике злокачественных панкреатических новообразований, однако в последующем исследовании подтвердил те же результаты Itokawa и Saftoiu.
В своем исследовании группа Iglesias-Garcias продемонстрировала очень хорошую точность EUS-эластографии при выявлении злокачественных новообразований поджелудочной железы (включая аденокарциному, метастазы и нейроэндокринные опухоли) с чувствительностью, специфичностью, ППЗ, ОПЗ и точностью 100%, 85,5% , 90,7%, 100% и 94%, соответственно.
В заключение следует сказать, что необходимо провести дополнительные исследования, чтобы получить однозначное мнение о применении EUS-эластографии и возможностях дифференциальной диагностики при доброкачественной и злокачественной патологии поджелудочной железы. Возможно, точность и клиническая эффективность этого метода будут улучшены, и при разработке новых технологических устройств будет достигнут согласованный результат измерений.
4.2. ARFI
Панкреатическая протоковая аденокарцинома представляет собой более жесткое новообразование, чем прилегающая паренхима, из-за наличия фиброза и выраженной десмоплазии, что характеризуется более высоким значением скорости волны (рис. 1c). Однако, результатом нашего личного опыта является лишь широкий спектр полученных значений и небольшое количество данных в литературе. Более того, как было указано выше, для EUS-эластографии дифференциальная диагностика с хроническим панкреатитом действительно проблематична.
Фактически, в настоящее время не существует пороговых значений. На сегодняшний день ARFI техника была протестирована для оценки только твердых поражений, в то время как в повседневной клинической практике кистозные образования по-прежнему характеризуются и классифицируются при визуальной оценке на основе их морфологии и архитектуры. Тем не менее, окончательный диагноз кистозных поражений поджелудочной железы по-прежнему требует инвазивного анализа кистозного содержимого. Более того, жидкости in vivo могут быть действительно разными: серозная цистаденома характеризуется простым жидким содержимым, тогда как муцинозные кистозные поражения имеют более сложный жидкостный состав. Согласно литературным данным, в простой жидкости, такой как вода, почти всегда получается значение – XXXX/0, однако в более сложных жидких средах, таких как вязкие жидкости, можно получить численное значение. При анализе жидкости с помощью ARFI в серозных цистаденомах часто получаются значения XXXX/0, в то же время при муцинозных новообразованиях чаще всего ожидаются численные значения. Таким образом, ARFI может потенциально расширить диагностическую характеристику панкреатических кистозных поражений, что представляет собой новый подход для неинвазивного анализа жидкостного содержимого.
БУДУЩИЕ РАЗРАБОТКИ
Будущие разработки включают оценку техники биопсии поражений поджелудочной железы и лимфатических узлов с помощью эластографического наведения.
Дальнейшее будущее применение эластографии при патологии поджелудочной железы заключается в разграничении аденокарцином на основе жесткости и корреляции их реакции на химиотерапию. Кроме того, исследование перитуморальной ткани поджелудочной железы с помощью ARFI может быть выполнено до хирургической резекции, с целью прогнозирования риска послеоперационной фистулы, вероятность которой обратно пропорционально жесткости железы. Для проведения исследований рекомендуем использовать аппарат от компании Siemens S2000.








14.10.2019
Стив Джобс