Резюме
Передумови
У 2018 році в Японії у 8000 жінок було вперше діагностовано рак шийки матки. Політика медичного страхування в Японії дозволяє лікарям проводити цитологічне дослідження склепіння піхви та вимірювання сироваткових біомаркерів під час кожного візиту, а також візуалізаційні дослідження через певні проміжки часу з метою скринінгу рецидивів після первинного лікування. Однак основні настанови з нагляду, опубліковані в США та європейських країнах, рекомендують зосередитися на огляді органів малого тазу та оцінці симптомів, щоб уникнути непотрібних тестів. Це дослідження мало на меті переоцінити переваги стандартних методів спостереження, прийнятих у цьому дослідженні, шляхом ретроспективного аналізу.
Методи
З січня 2009 року по грудень 2015 року для цього дослідження були зібрані медичні картки пацієнток з рецидивом, у яких спочатку був діагностований рак шийки матки I-III стадії за класифікацією Міжнародної федерації гінекології та акушерства. Клініко-патологічні дані були статистично проаналізовані для виявлення значущих факторів. Протягом перших 2 років пацієнтки проходили регулярне спостереження, що включало гінекологічне обстеження, аналіз сироватки крові на онкомаркери, цитологічне дослідження склепіння піхви кожні 1-3 місяці та візуалізаційні методи діагностики з інтервалом від 6 до 12 місяців. Протягом наступних 2 років пацієнтки проходили регулярне обстеження тими ж методами кожні 4 місяці та щорічні візуалізаційні дослідження. Після цього пацієнти проходили регулярний скринінг кожні 6-12 місяців.
Результати
За період дослідження у 84 з 981 пацієнта виникли рецидиви, причому у 88,1% з них рецидиви були безсимптомними. У одновимірному аналізі первинне лікування, локалізація рецидиву та метод діагностики були значущими факторами для результатів виживання. На противагу цьому, багатофакторний аналіз показав, що лише первинне лікування було значущим фактором. У пацієнтів з місцевим рецидивом багатофакторний аналіз продемонстрував, що променева терапія як рятівна є незалежним прогностичним фактором загального виживання після рецидиву.
Висновки
У цьому ретроспективному дослідженні рутинна візуалізація уражень і вимірювання сироваткових біомаркерів не вплинули на прогноз пацієнтки після рецидиву. На противагу цьому, цитологія склепіння піхви може покращити виживання після рецидиву у деяких пацієнток. Персоналізовані методи спостереження, що базуються на індивідуальних особливостях захворювання та способах лікування, можуть покращити результати виживання після рецидиву.
Вступ
Кількість хворих на рак шийки матки поступово зростає в Японії з 2000 року. Приблизно у 8000 пацієнток було вперше діагностовано рак шийки матки у 2018 році [1]. Крім того, за останнє десятиліття пік захворюваності на рак шийки матки, скоригований за віком, змістився до більш молодого віку – приблизно 40 років. Оскільки приблизно 75% пацієнток мають I та II стадію раку шийки матки, очікується, що більшість пацієнток матимуть сприятливий прогноз. Однак деякі жінки, особливо на пізніх стадіях, залишаються в групі ризику рецидиву пухлини. Передбачається, що спостереження після первинного лікування дозволяє виявити ранній рецидив, що може призвести до подовження виживаності та покращення якості життя завдяки застосуванню адекватної рятівної терапії та підтримуючого догляду. Однак різні установи та країни мають різні протоколи спостереження через брак достовірних доказів щодо методів спостереження та інтервалів між спостереженнями.
На відміну від віддаленого метастазування та метастазування у тканини бічної стінки малого тазу, місцевий рецидив піддається лікувальній терапії [2, 3]. Для виявлення місцевого рецидиву використовують цервіковагінальну цитологію [4], але частота його виявлення є низькою [5, 6]. Тому Товариство гінекологічної онкології (ТГО) рекомендує обмежити цитологічні дослідження до одного разу на рік [7]. Пацієнтки також можуть захотіти пройти візуалізаційні дослідження, включаючи комп’ютерну томографію (КТ), магнітно-резонансну томографію (МРТ) та позитронно-емісійну томографію (ПЕТ), щоб перевірити наявність безсимптомного рецидиву. Однак, з точки зору співвідношення витрат і результатів, жодне дослідження не показало, що регулярне спостереження з аналізом зображень не покращує виживання після рецидиву, оскільки потенційно виліковним є лише місцевий рецидив. Таким чином, настанови ТГО та Європейського товариства медичної онкології (ЕТМО) не рекомендують рутинне спостереження за допомогою візуалізаційних методів, за винятком обмежених випадків [7, 8]. Для оцінки стадії захворювання, відповіді на терапію та рецидиву пухлини також використовують сироватковий рівень антигену плоскоклітинного раку (SCC) для плоскоклітинних пухлин та рівень ракового антигену 125 (CA125) для аденокарциноми при раку шийки матки. Підвищення рівнів SCC і CA125 в сироватці крові може свідчити про рецидив плоскоклітинних пухлин і аденокарциноми до появи клінічних симптомів [9, 10]. Однак безсимптомний рецидив, діагностований за підвищеними рівнями SCC і CA125 в сироватці крові, не сприяє поліпшенню результатів виживання [11].
В Японії майже всі пацієнтки охоплені державним медичним страхуванням, яке покриває більшість медичних витрат, що дозволяє лікарям проводити інтенсивне спостереження за пацієнтками з раком шийки матки, навіть за відсутності симптомів, за допомогою гінекологічного обстеження, мазка Папаніколау, вимірювання рівня пухлинного антигену в сироватці крові під час кожного візиту та періодичного аналізу зображень, включаючи КТ, МРТ та ПЕТ-сканування, навіть за відсутності будь-яких симптомів.
Як зазначалося вище, настанови, опубліковані в США та європейських країнах, рекомендують зосередитися на ознаках і симптомах, щоб зменшити кількість непотрібних обстежень і заощадити кошти. Однак залишаються суперечки щодо рутинного нагляду з використанням цитології піхвового склепіння та аналізу зображень. У цьому дослідженні ми вперше оцінили протокол інтенсивного спостереження, прийнятий в Японії, шляхом ретроспективного аналізу даних, включаючи методи нагляду для виявлення рецидиву, місця рецидиву та періоди виживання після рецидиву. Ми також мали на меті дослідити фактори, які позитивно впливають на виживання після рецидиву. Зрештою, ми маємо намір переглянути метод нагляду для рутинного спостереження на основі результатів цього дослідження.
Методи
Структура дослідження
Базова структура дослідження була опублікована в нашому попередньому спостережному дослідженні раку ендометрію [12]. Медичні записи були отримані для пацієнток з раком шийки матки, вперше діагностованим згідно з Міжнародною федерацією гінекології та акушерства (FIGO 2018) стадією 1-3c2 в період з 2009 по 2015 рік.
У перші 2 роки пацієнтки проходили регулярне спостереження, що включало огляд органів малого тазу, мазок Папаніколау і аналіз сироваткових біомаркерів (SCC або CA125) кожні 1-3 місяці, а візуальну діагностику з інтервалом від 6 до 12 місяців. Протягом наступних 2 років регулярне спостереження проводилося кожні 4 місяці з щорічною візуальною діагностикою. Після цього пацієнти проходили стандартний нагляд кожні 6-12 місяців. Медичні картки пацієнтів, у яких розвинулися рецидивні пухлини, були зібрані з трьох установ і проаналізовані для цього ретроспективного дослідження. Всі пацієнти з рецидивом на стадії I-3c2 за FIGO були включені в дослідження.
Статистичний аналіз
Демографічні дані, стадія за FIGO, гістологія, первинне лікування, метод діагностики рецидиву пухлини, терапія після рецидиву та період виживання після рецидиву були включені в статистичний аналіз, оскільки ці фактори потенційно залучені в оцінку значущості методів спостереження та результатів виживання. Інтервали між візитами до встановлення діагнозу рецидиву були стратифіковані на 1, 2 та > 3 місяців для перевірки зсуву часу очікування після рецидиву. Для всіх пацієнтів після рецидиву був проведений одновимірний і багатовимірний аналіз (Таблиця 2). Одновимірний і багатовимірний аналізи також були проведені для пацієнтів з місцевим рецидивом (табл. 3), оскільки ці пацієнти мали кращу загальну виживаність після рецидиву (зобр. 2А). Час від рецидиву до смерті був проаналізований за допомогою моделі пропорційних ризиків Кокса для розрахунку відношень ризиків (ВР) і 95% довірчих інтервалів (95% ДІ) після проведення тесту пропорційних ризиків. Факторами, що були включені, були стадія за FIGO, гістологія, первинне лікування, місце рецидиву та метод діагностики при рецидиві в Таблиці 1; метод діагностики, первинне лікування та відновлювальна терапія після рецидиву в Таблиці 2; та метод діагностики при рецидиві, первинне лікування та відновлювальна терапія після рецидиву в Таблиці 3. Після оцінки мультиколінеарності за допомогою коефіцієнта інфляції дисперсії був проведений регресійний аналіз Кокса в багатовимірному аналізі з використанням методу покрокового відбору змінних для факторів, які показали статистично значущі відмінності в одновимірному аналізі (табл. 2 і 3). Інтервал відсутності захворювання після первинного лікування та криві виживання для загальної післярецидивної виживаності залежно від місця рецидиву, методу діагностики або локального рецидиву розраховували за допомогою методу Каплана-Мейєра та лог-рангового тесту. Статистична значущість була встановлена на рівні p < 0,05; всі тести були двосторонніми. Весь статистичний аналіз проводили за допомогою програми EZR версії 1.55 [13].
Таблиця 1 Характеристика пацієнтів при первинному лікуванні та рецидиві
| Параметри | Ні | % |
| Початкова стадія раку | ||
| Вік | 26–83 (52)a | |
| стадія за FIGO | ||
| 1a | 3 | (3.6) |
| 1b1 | 12 | (14.3) |
| 1b2 | 4 | (4.7) |
| 1b3 | 4 | (4.7) |
| 2a1 | 5 | (6.0) |
| 2a2 | 2 | (2.4) |
| 2b | 10 | (11.9) |
| 3a | 2 | (2.4) |
| 3b | 3 | (3.6) |
| 3c1 | 34 | (40.4) |
| 3c2 | 5 | (6.0) |
| Гістологія | ||
| плоскоклітинний | 49 | (58.3) |
| Адено | 24 | (28.6) |
| аденосквамозний | 5 | (6.0) |
| Інші | 6 | (7.1) |
| Первинне лікування | ||
| Опе | 15 | (17.9) |
| Опе+Пт | 6 | (7.1) |
| Опе+ СХМТ | 16 | (19.0) |
| Опе+Хімо | 13 | (15.5) |
| ПТ | 9 | (10.7) |
| СХМТ | 25 | (29.8) |
| У разі рецидиву | ||
| Інтервал спостереження | ||
| 1 місяць | 46 | (54.7) |
| 2 місяць | 24 | (28.6) |
| 3 >місяць | 14 | (16.7) |
| Місце рецидиву | ||
| Локально | 19 | (22.6) |
| Тазові Лв | 9 | (10.7) |
| Дистальні Лв | 14 | (16.7) |
| Віддалені метастази | 27 | (32.1) |
| Множинне метастазування | 15 | (17.9) |
| Методи діагностики | ||
| Симтоми | 10 | (11.9) |
| Мазок Папаніколау | 13 | (15.5) |
| Маркери пухлин | 19 | (22.6) |
| Візуалізація | 42 | (50.0) |
- aДіапазон (медіана)
- Опе Операція, ПТ Променева терапія, СХПТ Супутня хіміопроменева терапія, Хімо Хіміотерапія, ЛВ Лімфатичний вузол
Таблиця 2 Одновимірний та багатовимірний аналіз результатів виживання після рецидиву
| Одновимірний | Багатовимірний | |||
| Відношення ризиків [95% ДІ] | p-value* | Відношення ризиків [95% ДІ] | p-value* | |
| Стадія за FIGO | ||||
| I | ref | |||
| II | 1.63 [0.76–3.48] | 0.211 | ||
| IIIa та IIIb | 1.44 [0.41–5.08] | 0.571 | ||
| IIIc1 та IIIc2 | 1.76 [0.94–3.31] | 0.080 | ||
| Гістологія | 0.270 | |||
| Плоскоклітинний | ref | |||
| Адено | 0.84 [0.47–1.48] | 0.540 | ||
| Інший | 1.59 [0.78–3.21] | 0.200 | ||
| Первинне лікування | ||||
| Опе | ref | ref | ||
| Опе+Хімо | 4.09 [1.46–11.4] | 0.007 | 3.14 [1.05–9.42] | 0.041 |
| Опе+ПТ або СХПТ | 4.83 [1.86–12.55] | 0.001 | 4.81 [1.60–14.45] | 0.005 |
| ПТ або СХПТ | 4.23 [1.70–10.73] | 0.002 | 4.62 [1.57–13.60] | 0.005 |
| Місце рецидиву | ||||
| Місцево | ref | Враховано, але не є значущим в остаточному багатовимірному аналізі | ||
| Тазові ЛВ | 2.83 [1.07–7.52] | 0.036 | ||
| Дистальні ЛВ | 1.51 [0.63–3.60] | 0.353 | ||
| Віддалені метастази | 2.68 [1.24–5.81] | 0.012 | ||
| Множинні метастази | 4.70 [1.99–11.07] | < 0.001 | ||
| Метод діагностики при рецидиві | ||||
| Мазок Папаніколау | ref | Враховано, але не є значущим в остаточному багатовимірному аналізі | ||
| Симптоми | 12.43 [3.73–41.46] | < 0.001 | ||
| Маркери пухлин | 4.13 [1.47–11.58] | 0.007 | ||
| Візуалізація | 2.94 [1.14–7.55] | 0.025 | ||
- *Використано регресійний аналіз Кокса
- Опе Операція, ПТ Променева терапія, СХПТ Супутня хіміопроменева терапія, Хімо Хіміотерапія, ЛВ Лімфатичний вузол
Таблиця 3 Одновимірний та багатовимірний аналіз результатів виживання після рецидиву у пацієнтів з місцевим рецидивом
| Одновимірний | Багатовимірний | |||||
| Відношення ризиків [95% ДІ] | p-value* | Відношення ризиків [95% ДІ] | p-value* | |||
| Метод діагностики при рецидиві | ||||||
| Мазок Папаніколау | ref | Враховано, але не є значущим в остаточному багатовимірному аналізі | ||||
| Симптоми | 19.10 [1.99–183.40] | 0.011 | ||||
| Маркери пухлин | 12.03 [0.91–159.10] | 0.059 | ||||
| Візуалізація | 5.69 [1.09–29.77] | 0.039 | ||||
| Початкове лікування | ||||||
| Опе, Опе+Хімо | ref | Враховано, але не є значущим в остаточному багатовимірному аналізі | ||||
| Опе+ПТ або СХМТ, ПТ, СХМТ | 5.84 [1.16–29.38] | 0.030 | ||||
| Рятівна терапія після рецидиву | ||||||
| ПТ | ref | ref | ||||
| Хіміотерапія | 18.52 [2.15–160] | 0.008 | 18.52 [2.15–160] | 0.008 | ||
- *Використано регресійний аналіз Кокса
- Oпe Операція, ПТ Променева терапія, СХМТ Супутня хіміопроменева терапія, Хемо Хіміотерапія, ЛВ Лімфатичний вузол
Результати
З січня 2009 року по грудень 2015 року 981 пацієнтка пройшла лікування раку шийки матки в трьох установах, які брали участь у цьому дослідженні. Для цього дослідження були зібрані медичні картки 84 пацієнток з рецидивами пухлин. Рецидив розвинувся у 56% і 79% пацієнток протягом 1 і 2 років відповідно. Загалом рецидив виник у 8,6% пацієнтів. Ризик рецидиву для кожної стадії становив 1,1%, 7,0%, 9,4% і 17,5% на стадіях Ia, Ib, II і III відповідно. Основні характеристики пацієнтів з рецидивом захворювання наведені в таблиці 1.
При первинній діагностиці у 44 (52,4%) пацієнток було діагностовано рак шийки матки ІІІ стадії, а у 49 (58,3%) – плоскоклітинний рак шийки матки. Під час первинного лікування 35 з 50 пацієнток, яким було виконано хірургічне втручання, пройшли ад’ювантну терапію променевою і супутньою хіміопроменевою терапією або хіміотерапією. У 46 (54,7%) пацієнтів було діагностовано рецидив з інтервалом спостереження в 1 місяць. У 19 (22,6%) пацієнтів був місцевий рецидив; лише у 10 (11,9%) пацієнтів був симптоматичний рецидив.
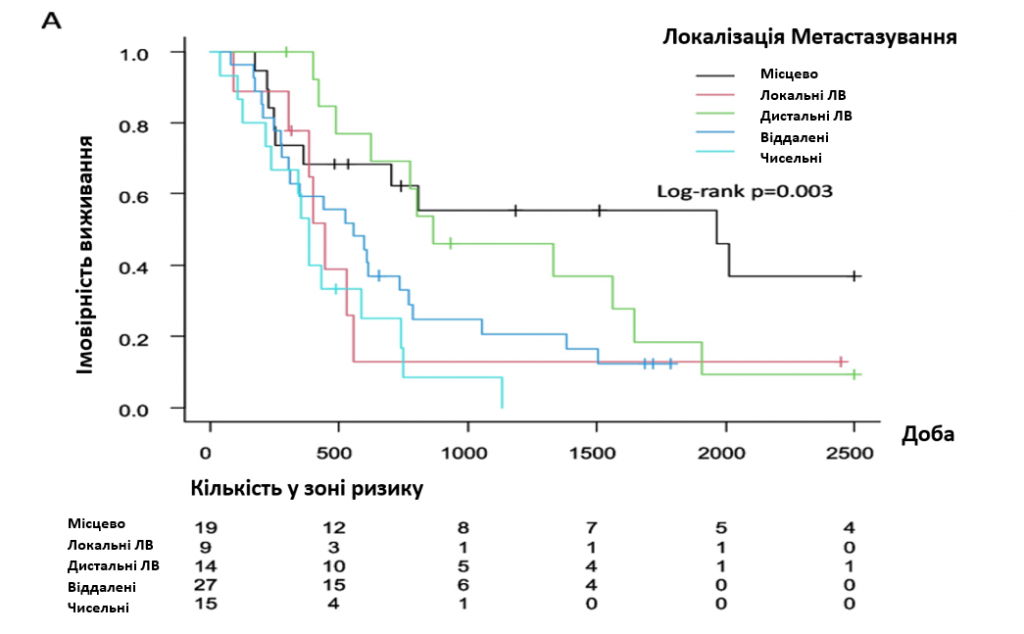
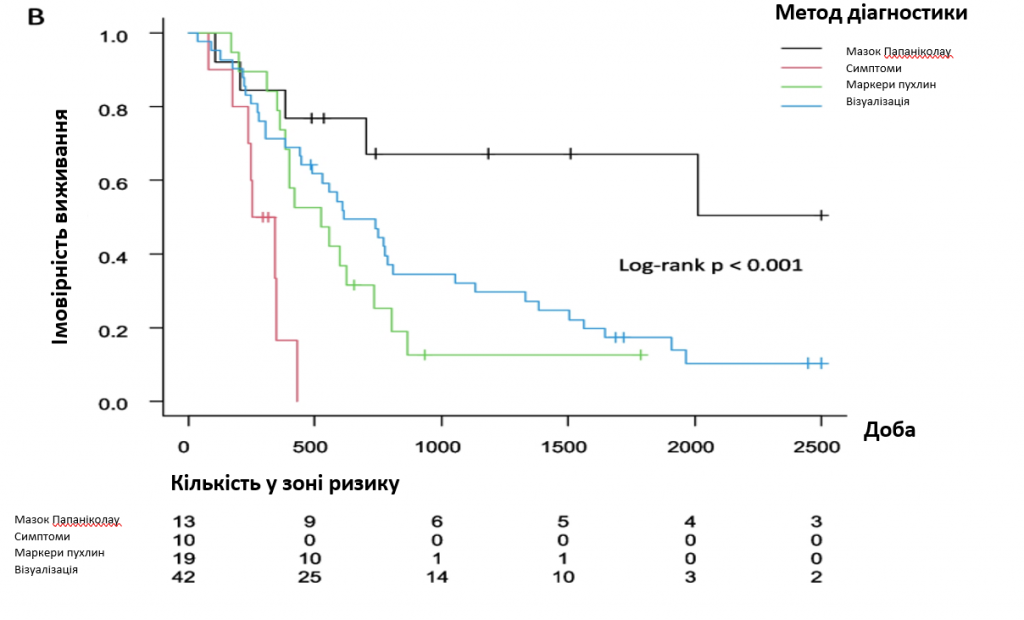
Крива Каплана-Мейєра показала інтервал безрецидивного періоду після первинного лікування (зобр. 1). Не було виявлено достовірної різниці за місцем рецидиву (p = 0776). Пацієнтки з місцевим рецидивом (зобр. 2А) (р = 0,003) або з діагнозом рецидиву за допомогою мазка Папаніколау (зобр. 2Б) (р < 0,001) мали кращу загальну виживаність після рецидиву, ніж пацієнтки з іншими локалізаціями або з діагнозом, встановленим іншими методами. ВР і 95% ДІ для виживання після рецидиву були розраховані за допомогою регресійного аналізу Кокса (табл. 2), який не виявив значущих відмінностей в залежності від стадії FIGO і гістології. Однак первинне лікування, місце рецидиву та метод діагностики були значущими факторами. Що стосується первинного лікування, то пацієнти, яким було виконано хірургічне втручання, мали значно кращий прогноз, ніж ті, яким були застосовані інші методи лікування. Пацієнти з місцевим рецидивом мали кращі результати виживання, ніж пацієнти з метастазами в тазові ЛВ, віддаленими метастазами або множинними метастазами. Симптоми, а також пухлинні маркери та аналіз зображень для діагностики рецидиву мали гірші показники виживання порівняно з мазком Папаніколау. Багатофакторний аналіз показав, що єдиним прогностичним фактором було первинне лікування.
Зображення 1. Інтервал без захворювання після первинного лікування
Зображення 2. Загальна виживаність після рецидиву. А Місце метастазування, (B) метод діагностики
Оскільки пацієнти з місцевим рецидивом мали кращі результати після рецидиву, ймовірність виживання порівнювали за допомогою кривої Каплана-Мейєра (зобр. 3), демонструючи, що пацієнти, які проходили променеву терапію, мали значно кращий прогноз, ніж ті, хто лікувався хіміотерапією (p < 0,001). Далі ми дослідили фактори, що впливають на виживання після рецидиву (табл. 3). У діагностичному методі при рецидиві мазок Папаніколау показав кращі результати виживання порівняно з симптомами та аналізом зображень. Пацієнти які не проходили променеву терапію при первинному лікуванні та отримували променеву терапію в рамках рятівної терапії мали кращі прогнози порівняно з іншими в однофакторному аналізі; променева терапія після рецидиву була єдиним прогностичним фактором у багатовимірному аналізі.
Зображення 3. Загальне виживання після локального рецидиву при проведенні рятівної терапії
Обговорення
У цьому ретроспективному багатоцентровому дослідженні ми показали, що пацієнти з місцевими рецидивами, які не отримували променеву терапію при первинному лікуванні, мали кращу загальну виживаність. Для цих пацієнтів мазок Папаніколау був ефективним методом виявлення рецидивуючих пухлин. Крім того, пацієнти з місцевим рецидивом, які могли отримати променеву терапію в якості терапії порятунку, мали шанс на повне одужання.
Більшість пацієнток з рецидивним раком шийки матки мають несприятливий прогноз, хоча деякі пацієнтки демонструють тривале виживання після рецидиву. Пацієнтки очікують, що нагляд після лікування дозволить виявити рецидив на досить ранній стадії, яка піддається лікуванню. Однак методи та концепції нагляду різняться в різних країнах та установах і навіть серед лікарів однієї лікарні через брак остаточних доказів. У цьому дослідженні проаналізовано найбільш інтенсивні методи нагляду, прийняті в повсякденній клінічній практиці в рамках державного медичного страхування Японії.
Концепція інтенсивного спостереження призводить до покращення виживаності та якості життя навіть після рецидиву. У цьому дослідженні майже всі пацієнтки спостерігалися гінекологами-онкологами протягом періоду спостереження. Згідно з протоколом інтенсивного нагляду, проаналізованим у цьому дослідженні, рецидиви через 1 і 2 роки були діагностовані у 56 і 79% відповідно, що узгоджується з попередніми повідомленнями [5, 14, 15]; не було виявлено різниці в інтервалі безрецидивного періоду залежно від локалізації метастазів (зобр. 1). Фактично, 54,7% рецидивів було діагностовано в межах 1-місячного інтервалу спостереження. Більше того, лише 16,7% пацієнтів мали більш ніж 3-місячний інтервал спостереження, а 90,5% мали безсимптомний рецидив (табл. 1). Наскільки нам відомо, цей показник є найвищим для виявлення безсимптомного рецидиву, загальної виживаності після рецидиву, безсимптомного рецидиву та симптоматичного рецидиву (ВР 4,28; 95% ДІ 1,87-9,78; р < 0,001). Нещодавнє дослідження за участю великої когорти з 4343 пацієнток з РШМ I і II стадії продемонструвало, що безсимптомний рецидив є значущим фактором виживання після рецидиву [16]. На противагу цьому, огляд 17 ретроспективних досліджень, в яких інтервали контрольних візитів становили кожні 3-4 місяці протягом перших 2 років, не показав жодних переваг у виявленні безсимптомного рецидиву [17]. Кращого прогнозу можна досягти за допомогою зміщення часу випередження. Однак у нашому дослідженні не можна виключити вплив тривалості лікування на кращу виживаність після рецидиву при безсимптомному рецидиві, оскільки більшість пацієнтів були діагностовані з інтервалом між візитами 1-2 місяці.
Для виявлення безсимптомного рецидиву в рамках рутинного нагляду використовували методи візуальної діагностики, включаючи КТ, МРТ та ПЕТ. У цьому дослідженні у 42 (50,0%) пацієнтів було діагностовано рецидив пухлини за допомогою візуалізаційних методів (табл. 1). Серед цих пацієнтів 27 мали віддалені метастази, а троє з поодинокими метастазами в легенях були повністю вилікувані хірургічним шляхом. Інші дослідження також повідомляють про успішне лікування ізольованого легеневого рецидиву [6, 18]. Італійське багатоцентрове ретроспективне дослідження продемонструвало, що 80-90% віддалених метастазів і метастазів у лімфатичні вузли були діагностовані за допомогою аналізу зображень [19], що означає, що візуальна діагностика є більш чутливою для виявлення віддалених метастазів. Хоча деяким пацієнтам, включаючи наших, рутинна візуальна діагностика допомагає виявити безсимптомний рецидив у віддалених регіонах, ТГО не рекомендує проводити рутинне візуальне діагностування як з огляду на співвідношення витрат і результатів, так і з огляду на низьку результативність у діагностиці безсимптомного рецидиву [20]. Крім того, щорічне проведення КТ може збільшити ризик раку, пов’язаний з променевим навантаженням [21]. Таким чином, без чітких показань слід уникати радіологічних методів дослідження.
Сироваткові біомаркери, такі як SCC і CA-125, використовуються для оцінки відповіді пухлини на лікування [22] і виявлення рецидиву шляхом рутинного нагляду [23]. У більш ранньому звіті було показано, що сироватковий SCC має 79% чутливість для виявлення рецидиву [24]. У цьому дослідженні у 22,6% пацієнтів було діагностовано рецидив пухлини за підвищеними рівнями онкомаркерів (табл. 1), але це не сприяло покращенню виживаності після рецидиву (зобр. 2Б). Відповідно до нашого дослідження, голландське дослідження продемонструвало, що підвищений рівень SCC в сироватці крові передує появі клінічних симптомів, в результаті чого не має кореляції з результатами виживання [9]. В цілому, через відсутність доказів на користь вимірювання біомаркерів у сироватці крові, рутинне спостереження може не включати вимірювання біомаркерів у сироватці крові, якщо це не є корисним для оцінки відповіді на лікування проти пухлин первинним лікуванням.
Відповідно до попередніх публікацій, це дослідження показало, що місцевий рецидив має кращий прогноз, ніж метастази у місцеві лімфатичні вузли, дистальні лімфатичні вузли або віддалені метастази (зобр. 2А). Навіть у цьому дослідженні у семи пацієнтів з множинними метастазами був виявлений місцевий рецидив. Хоча жоден з наших пацієнтів, у яких діагностовано лише місцевий рецидив, не зазнав тазової екзентерації для рятівної терапії, в літературі описано, що в третині випадків тазова екзентерація при лапаротомії була протипоказана через непередбачувану пухлиноподібну дисемінацію [25]. Таким чином, перед прийняттям рішення щодо методу лікування слід ретельно оцінити стан пухлини, оскільки агресивне хірургічне втручання може погіршити якість життя пацієнтки.
Для рутинного спостереження проводять огляд органів малого тазу та цитологічне дослідження піхвового склепіння. Системний огляд показав, що частота виявлення безсимптомного рецидиву за допомогою мазка Папаніколау є надзвичайно низькою (6% від медіани частоти виявлення) [17], а фізикальне обстеження виявляє місцевий рецидив частіше, ніж цитологічне дослідження [6]. Більше того, низькоякісні результати мазка Папаніколау з подальшою кольпоскопією продемонстрували меншу ефективність у виявленні рецидиву [20]. Однак у нашому дослідженні однофакторний аналіз показав, що Пап-мазок у діагностичному методі був значущим фактором виживання після рецидиву (табл. 2 і зобр. 2Б). Інтрофлексійний шов міг би полегшити проведення мазка Папаніколау для виявлення рецидиву пухлини. Однак метод накладання швів не допоміг виявити місцевий рецидив, оскільки у всіх випадках гістеректомії в нашому дослідженні було підтверджено, що пацієнткам накладали екстрофлексні шви. Променева терапія може спричинити фіброзні зміни слизової оболонки піхви, що, можливо, призводить до збільшення частоти аномальних результатів мазка Папаніколау [26]. У поточному дослідженні сім з дев’яти пацієнток з місцевим рецидивом, діагностованим за допомогою мазка Папаніколау, не отримували променеву терапію під час початкового лікування, що, можливо, пояснює, чому мазок Папаніколау сприяв точному діагностуванню рецидиву.
Як і в інших дослідженнях [27, 28], променева терапія в анамнезі як первинне лікування в однофакторному аналізі та променева терапія як рятівна терапія в багатофакторному аналізі є важливими факторами виживання після місцевого рецидиву (табл. 3). Варіанти рятівної терапії варіюють серед пацієнтів залежно від гістології пухлини, місця рецидиву та стану пацієнта. В іншій групі пацієнток з ізольованими пухлинами малого тазу, які раніше проходили променеву терапію, не було виявлено статистичної різниці в кумулятивному віддаленому метастазуванні і загальній виживаності між хіміотерапією і хірургічним втручанням, включаючи радикальну гістеректомію і екзентерацію малого тазу в рамках рятівної терапії [29]. На противагу цьому, екзентерація таза може мати прогностичний ефект у пацієнток, яким протипоказана променева терапія, з 5-річною виживаністю від 30 до 40% [30, 31]. Як спостерігалося в даному дослідженні, пацієнти, які проходили рятівну терапію у вигляді хіміотерапії, мали незадовільні результати (зобр. 3). Таким чином, агресивне хірургічне втручання розглядається для пацієнтів з непосильними ризиками, пов’язаними з повторною променевою терапією. Однак складність передопераційної оцінки резектабельності та відносно висока періопераційна захворюваність і смертність стримують від виконання радикального хірургічного втручання.
Прогностичні фактори місцевого рецидиву, пов’язані з виживанням після рятівного опромінення, включають інтервал без захворювання, гістологію, місце рецидиву (наприклад, навколо верхівки піхви або бокової стінки тазу) та розмір пухлини. Серед цих факторів розмір і локалізація пухлини з високою вірогідністю прогнозують ефективність лікування [32, 33]. У цьому дослідженні результати пацієнтів, які отримали променеву терапію з приводу місцевого рецидиву, були досить сприятливі, що підтверджується тим фактом, що медіана загальної виживаності не була досягнута на момент фіксації даних (зобр. 3). Основною метою інтенсивного спостереження є виявлення пухлин на ранній стадії рецидиву, коли вони піддаються лікувальній терапії. У зв’язку з цим мазок Папаніколау, який ефективно виявляє безсимптомний рецидив у пацієнтів без опромінення в анамнезі, може відігравати найважливішу роль серед методів інтенсивного спостереження, що в кінцевому підсумку може принести користь пацієнтам, дозволивши призначити виліковну променеву терапію замість агресивного хірургічного втручання. Більше того, раннє виявлення безсимптомного рецидиву за допомогою інтенсивного нагляду може забезпечити постраждалим психологічну підтримку та ефективний контроль симптомів.
Це дослідження було проведено з використанням багатоцентрових даних, щоб зменшити упередженість відбору пацієнтів. Однак це дослідження має деякі обмеження, включаючи невеликий розмір вибірки і те, що ретроспективний характер дослідження може спричинити упередженість. Хоча це дослідження демонструє статистичну значущість з огляду на розмір вибірки, більші дослідницькі когорти можуть надати точніші дані та менші довірчі інтервали. Клінічні результати після агресивних хірургічних втручань не оцінювалися, оскільки жоден з пацієнтів не піддавався таким операціям протягом періоду дослідження. Результати нашого дослідження потребують подальшої перевірки в майбутніх дослідженнях з більшими когортами та рандомізованими контрольованими дослідженнями.
Висновки
Результати цього дослідження підтверджують, що рутинний аналіз зображень і вимірювання біомаркерів не впливають на прогноз пацієнта після рецидиву. Однак мазок Папаніколау може покращити виживання після рецидиву в деяких групах пацієнтів. Подальший розвиток діагностичних методів допоможе адаптувати методи нагляду для окремих пацієнтів.
Абревіатури
Аналіз мазка Папаніколау:
Мазок за Папаніколау
ТГО:
Товариство гінекологічної онкології
КТ:
Комп’ютерна томографія
МРТ:
Магнітно-резонансна томографія
ПЕТ:
Позитронно-емісійна томографія
ЕТМО:
Європейське товариство медичної онкології
FIGO:
Міжнародна федерація гінекології та акушерства
Посилання на джерела
- Yoshino K, Kurita T, Takahashi F, Nagase S. Board members of the Committee on Gynecologic Oncology of the Japan Society of O, Gynecology: Annual report of the committee on gynecologic oncology, the Japan Society of Obstetrics and Gynecology: Annual patient report for 2019 and annual treatment report for 2014. J Obstet Gynaecol Res. 2022;48(7):1570–9.
- Krebs HB, Helmkamp BF, Sevin BU, Poliakoff SR, Nadji M, Averette HE. Recurrent cancer of the cervix following radical hysterectomy and pelvic node dissection. Obstet Gynecol. 1982;59(4):422–7.
- Potter ME, Alvarez RD, Gay FL, Shingleton HM, Soong SJ, Hatch KD. Optimal therapy for pelvic recurrence after radical hysterectomy for early-stage cervical cancer. Gynecol Oncol. 1990;37(1):74–7.
- Koh WJ, Greer BE, Abu-Rustum NR, Apte SM, Campos SM, Cho KR, Chu C, Cohn D, Crispens MA, Dorigo O, et al. Cervical Cancer, Version 2.2015. J Natl Compr Canc Netw. 2015;13(4):395–404 quiz 404.
- Bodurka-Bevers D, Morris M, Eifel PJ, Levenback C, Bevers MW, Lucas KR, Wharton JT. Posttherapy surveillance of women with cervical cancer: an outcomes analysis. Gynecol Oncol. 2000;78(2):187–93.
- Elit L, Fyles AW, Oliver TK, Devries-Aboud MC, Fung-Kee-Fung M. members of the Gynecology Cancer Disease Site Group of Cancer Care Ontario’s Program in Evidence-Based C: Follow-up for women after treatment for cervical cancer. Curr Oncol. 2010;17(3):65–9.
- Salani R, Khanna N, Frimer M, Bristow RE, Chen LM. An update on posttreatment surveillance and diagnosis of recurrence in women with gynecologic malignancies: Society of Gynecologic Oncology (SGO) recommendations. Gynecol Oncol. 2017;146(1):3–10.
- Marth C, Landoni F, Mahner S, McCormack M, Gonzalez-Martin A, Colombo N, Committee EG. Cervical cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28(suppl_4):iv72–83.
- Esajas MD, Duk JM, de Bruijn HW, Aalders JG, Willemse PH, Sluiter W, Pras B, ten Hoor K, Hollema H, van der Zee AG. Clinical value of routine serum squamous cell carcinoma antigen in follow-up of patients with early-stage cervical cancer. J Clin Oncol. 2001;19(19):3960–6.
- Tabata T, Takeshima N, Tanaka N, Hirai Y, Hasumi K. Clinical value of tumor markers for early detection of recurrence in patients with cervical adenocarcinoma and adenosquamous carcinoma. Tumour Biol. 2000;21(6):375–80.
- Salvatici M, Achilarre MT, Sandri MT, Boveri S, Vanna Z, Landoni F. Squamous cell carcinoma antigen (SCC-Ag) during follow-up of cervical cancer patients: Role in the early diagnosis of recurrence. Gynecol Oncol. 2016;142(1):115–9.
- Nakamura K, Kitahara Y, Yamashita S, Kigure K, Ito I, Nishimura T, Azuma A, Kanuma T. Reassessment of intensive surveillance practices adopted for endometrial cancer survivors. BMC Womens Health. 2022;22(1):355.
- Kanda Y. Investigation of the freely available easy-to-use software ‘EZR’ for medical statistics. Bone Marrow Transplant. 2013;48(3):452–8.
- Hillesheim I, Limone GA, Klimann L, Monego H, Appel M, de Souza A, Dos Reis R. Cervical Cancer Posttreatment Follow-up: Critical Analysis. Int J Gynecol Cancer. 2017;27(8):1747–52.
- Taarnhoj GA, Christensen IJ, Lajer H, Fuglsang K, Jeppesen MM, Kahr HS, Hogdall C. Risk of recurrence, prognosis, and follow-up for Danish women with cervical cancer in 2005–2013: A national cohort study. Cancer. 2018;124(5):943–51.
- Cibula D, Dostalek L, Jarkovsky J, Mom CH, Lopez A, Falconer H, Scambia G, Ayhan A, Kim SH, Isla Ortiz D, et al. Post-recurrence survival in patients with cervical cancer. Gynecol Oncol. 2022;164(2):362–9.
- Elit L, Fyles AW, Devries MC, Oliver TK, Fung-Kee-Fung M. Gynecology Cancer Disease Site G: Follow-up for women after treatment for cervical cancer: a systematic review. Gynecol Oncol. 2009;114(3):528–35.
- Samlal RA, Van Der Velden J, Van Eerden T, Schilthuis MS, Gonzalez Gonzalez D, Lammes FB. Recurrent cervical carcinoma after radical hysterectomy: an analysis of clinical aspects and prognosis. Int J Gynecol Cancer. 1998;8(1):78–84.
- Zola P, Fuso L, Mazzola S, Piovano E, Perotto S, Gadducci A, Galletto L, Landoni F, Maggino T, Raspagliesi F, et al. Could follow-up different modalities play a role in asymptomatic cervical cancer relapses diagnosis? An Italian multicenter retrospective analysis. Gynecol Oncol. 2007;107(1 Suppl 1):S150-154.
- Rimel BJ, Burke WM, Higgins RV, Lee PS, Lutman CV, Parker L. Improving quality and decreasing cost in gynecologic oncology care. Society of gynecologic oncology recommendations for clinical practice. Gynecol Oncol. 2015;137(2):280–4.
- Wen JC, Sai V, Straatsma BR, McCannel TA. Radiation-related cancer risk associated with surveillance imaging for metastasis from choroidal melanoma. JAMA Ophthalmol. 2013;131(1):56–61.
- Yoon SM, Shin KH, Kim JY, Seo SS, Park SY, Kang S, Cho KH. The clinical values of squamous cell carcinoma antigen and carcinoembryonic antigen in patients with cervical cancer treated with concurrent chemoradiotherapy. Int J Gynecol Cancer. 2007;17(4):872–8.
- Jeong BK, Huh SJ, Choi DH, Park W, Bae DS, Kim BG. Prognostic value of different patterns of squamous cell carcinoma antigen level for the recurrent cervical cancer. Cancer Res Treat. 2013;45(1):48–54.
- Forni F, Ferrandina G, Deodato F, Macchia G, Morganti AG, Smaniotto D, Luzi S, D’Agostino G, Valentini V, Cellini N, et al. Squamous cell carcinoma antigen in follow-up of cervical cancer treated with radiotherapy: evaluation of cost-effectiveness. Int J Radiat Oncol Biol Phys. 2007;69(4):1145–9.
- Estape R, Angioli R. Surgical management of advanced and recurrent cervical cancer. Semin Surg Oncol. 1999;16(3):236–41.
- Rimel BJ, Ferda A, Erwin J, Dewdney SB, Seamon L, Gao F, DeSimone C, Cotney KK, Huh W, Massad LS. Cervicovaginal cytology in the detection of recurrence after cervical cancer treatment. Obstet Gynecol. 2011;118(3):548–53.
- Qiu JT, Abdullah NA, Chou HH, Lin CT, Jung SM, Wang CC, Chen MY, Huang KG, Chang TC, Lai CH. Outcomes and prognosis of patients with recurrent cervical cancer after radical hysterectomy. Gynecol Oncol. 2012;127(3):472–7.
- Yoshida K, Kajiyama H, Utsumi F, Niimi K, Sakata J, Suzuki S, Shibata K, Kikkawa F. A post-recurrence survival-predicting indicator for cervical cancer from the analysis of 165 patients who developed recurrence. Mol Clin Oncol. 2018;8(2):281–5.
- Lin AJ, Ma S, Markovina S, Schwarz J, Mutch DG, Powell MA, Grigsby PW. Clinical outcomes after isolated pelvic failure in cervical cancer patients treated with definitive radiation. Gynecol Oncol. 2019;153(3):530–4.
- Schmidt AM, Imesch P, Fink D, Egger H. Indications and long-term clinical outcomes in 282 patients with pelvic exenteration for advanced or recurrent cervical cancer. Gynecol Oncol. 2012;125(3):604–9.
- Chiantera V, Rossi M, De Iaco P, Koehler C, Marnitz S, Ferrandina G, Legge F, Parazzini F, Scambia G, Schneider A, et al. Survival after curative pelvic exenteration for primary or recurrent cervical cancer: a retrospective multicentric study of 167 patients. Int J Gynecol Cancer. 2014;24(5):916–22.
- Ito H, Shigematsu N, Kawada T, Kubo A, Isobe K, Hara R, Yasuda S, Aruga T, Ogata H. Radiotherapy for centrally recurrent cervical cancer of the vaginal stump following hysterectomy. Gynecol Oncol. 1997;67(2):154–61.
- Ijaz T, Eifel PJ, Burke T, Oswald MJ. Radiation therapy of pelvic recurrence after radical hysterectomy for cervical carcinoma. Gynecol Oncol. 1998;70(2):241–6.