Резюме
Передумови
Щороку приблизно 15 мільйонів дітей народжуються передчасно. Дефіцит мікроелементів, у тому числі дефіцит вітаміну D (ДВД), поширений у багатьох країнах з низьким і середнім рівнем доходу (КНСД), і ці стани часто пов’язані з несприятливими наслідками вагітності. У Народній Республіці Бангладеш спостерігається високий рівень поширеності ДВД. У країні також високий рівень передчасних пологів (ПЧП). Використовуючи дані популяційної когорти вагітних, ми оцінили тягар ДВД під час вагітності та його зв’язок з передчасними пологами.
Методи
Вагітні жінки (N = 3 000) були включені в дослідження після підтвердження терміну вагітності за допомогою ультразвукового дослідження на 8-19 тижні гестації. Підготовлені медичні працівники проспективно збирали фенотипічні та епідеміологічні дані під час запланованих домашніх візитів. Підготовлені флеботомісти збирали зразки материнської крові під час реєстрації та на 24-28 тижні гестації. Аліквоти сироватки зберігали при -800 С. Ми провели вкладені дослідження “випадок-контроль” з усіма ПЧП (n = 262) і випадковою вибіркою доношених пологів (n = 668). Результат, ПЧП, визначався як народження живої дитини на терміні гестації < 37 тижнів за даними ультразвукового дослідження. Основним фактором впливу були концентрації вітаміну D у зразках крові матерів на 24-28 тижні вагітності. Аналіз був скоригований на інші фактори ризику ПЧП. Жінки були розподілені на категорії ДВД (найнижчий квартиль 25(OH)D; < = 30,25 нмоль/л) або без дефіциту (верхні три квартилі 25(OH)D; > 30,25 нмоль/л). Ми використовували логістичну регресію для визначення зв’язку ДВД з ПЧП з поправкою на потенційні заважаючі чинники (конфаундери).
Результати
Середнє значення та інтерквартильний розмах сироваткового 25(OH)D становили 38,0 нмоль/л; від 30,18 до 48,52 (нмоль/л). Після поправки на ко-змінні, ДВД був достовірно пов’язаний з ПЧП [скориговане відношення шансів (сВШ) = 1,53, 95% довірчий інтервал (ДІ) = 1,10 – 2,12]. Ризик ПЧП також був вищим серед жінок нижчого зросту (сВШ = 1,81, 95% ДІ: 1,27-2,57), першородящих (сВШ = 1,55, 95% ДІ = 1,12 – 2. 12), пасивні курці (сВШ = 1,60, 95% ДІ = 1,09 – 2,34), а також ті, хто отримував препарати заліза під час вагітності (сВШ = 1,66, 95% ДІ: 1,17, 2,37).
Висновок
ДВД часто зустрічається у вагітних жінок з Народної Республіки Бангладеш і асоціюється з підвищеним ризиком ПЧП.
Передумови
У всьому світі щороку передчасно народжуються близько 15 мільйонів дітей, і ця цифра продовжує зростати. Передчасні пологи (народження до 37 повних тижнів гестації) та їх ускладнення є основною причиною неонатальної смертності [1, 2] та смертності серед дітей у віці до 5 років, на яку припадає приблизно один мільйон дитячих смертей щороку [3, 4]. Багато передчасно народжених дітей, які виживають, залишаються з інвалідністю на все життя, включаючи проблеми з навчанням, а також проблеми із зором та слухом [5]. Країни з низьким та середнім рівнем доходу (КНСД), такі як країни Південно-Східної Азії та Африки на південь від Сахари, мають значно вищий тягар передчасних пологів (ПЧП) [6] Дані про ПЧП в Бангладеш на національному рівні відсутні. На основі моделювання Chawanpaiboon S. та співавт. підрахували, що рівень передчасних пологів у Бангладеш становить 19,1% [7].
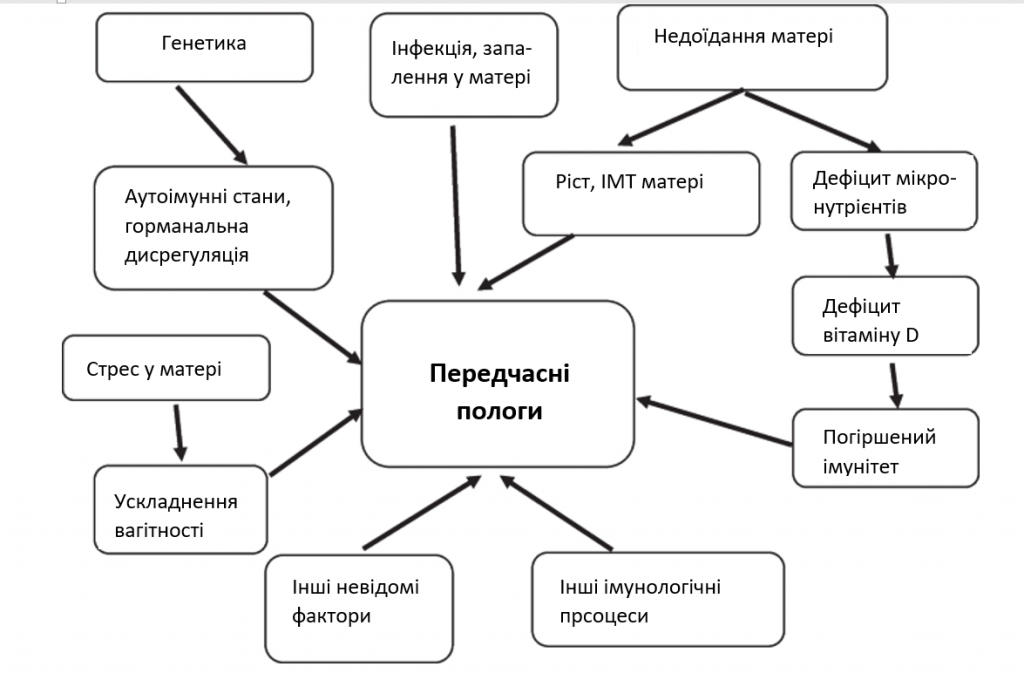
Виявлення маркерів, які корелюють з ПЧП, може допомогти знизити рівень дитячої захворюваності та смертності. ПЧП має багатофакторне походження, частково пов’язане з імунологічними, генетичними, харчовими та екологічними факторами [8,9,10]. Інші фактори включають інфекцію або запалення, ускладнення вагітності, включаючи матково-плацентарну недостатність кровопостачання або кровотечу, попередні передчасні пологи, пародонтоз, перерозтягнення матки, стрес та інші імунологічно опосередковані процеси [11, 12]. На зображенні 1 показані фактори, пов’язані з передчасними пологами, та можливі шляхи їх виникнення. Приналежність цих факторів ще недостатньо з’ясована.
Зображення. 1
Концептуальні принципи: фактори, пов’язані з передчасними пологами, та можливі шляхи їх подолання
Дефіцит мікроелементів, включаючи дефіцит вітаміну D (ДВД), є поширеним явищем при багатьох КНСД, і цей дефіцит часто асоціюється з несприятливими наслідками вагітності [13, 14]. Вагітні жінки мають підвищену потребу в мікроелементах, а дефіцит мікроелементів у матері може призвести до ускладнень [15]. Вітамін D є важливим мікроелементом, який регулює метаболізм кальцію та фосфору; він необхідний для побудови кісток. Він також є необхідною частиною вродженої імунної системи, оскільки сприяє виробленню антимікробних пептидів [16]. Недостатнє споживання вітаміну D з їжею, стани, що не дозволяють шкірі виробляти достатню кількість вітаміну D, та інші фактори, що перешкоджають метаболізму або всмоктуванню вітаміну D, можуть сприяти виникненню ДВД [17]. Сучасна література, що вивчає зв’язок між ДВД та ПЧП, є суперечливою. У деяких дослідженнях було виявлено, що низька концентрація вітаміну D у матері корелює з несприятливими наслідками вагітності, включаючи ПЧП, низьку масу тіла при народженні, гестаційний діабет і прееклампсію [18,19,20,21,22,23]. Однак інші дослідження не виявили такого зв’язку [24, 25].
В Бангладеш дуже поширена ДВД: від 66% до 94,2% дорослих жінок дітородного віку відчувають цей дефіцит [26]. У Бангладеш також спостерігається один з найвищих показників ПЧП [7]. За даними систематичного огляду, опублікованого в журналі Lancet Global Health, Бангладеш входить до п’ятірки країн з найбільшою кількістю випадків ПЧП [7]. На Індію, Китай, Нігерію, Бангладеш та Індонезію припадає 57,9 млн (41,4%) з 139-9 млн народжень живих дітей та 6,6 млн (44,6%) з 14,8 млн ПЧП по всьому світу у 2014 році [7, 27, 28]. Високий тягар ДВД, так само як і ПЧП в Бангладеш, робить цю країну підходящим місцем для подальшого дослідження того, чи існує кореляція між цими двома явищами. У цьому дослідженні ми мали на меті вивчити взаємозв’язок між концентрацією 25(OH)D у сироватці крові та ПЧП серед вагітних жінок у сільській місцевості Бангладеш.
Методи
Структура дослідження, умови та дані
Це вкладене дослідження “випадок-контроль”, в якому використовуються дані популяційної когорти вагітних жінок та їхніх дітей; дослідження відоме під назвою “Альянс за поліпшення здоров’я матерів та новонароджених” (AMANHI). У рамках AMANHI ми створили біорепозиторій і зареєстрували 3 000 вагітних жінок у період з 2014 по 2018 рік у двох підрайонах району Силхет на північному сході Бангладеш і спостерігали за ними до 42-60-го дня після пологів. Деталі методології дослідження були опубліковані раніше [29]. Підготовлені працівники охорони здоров’я на рівні громади (ПОЗ) з освітою не нижче десяти класів збирали дані після отримання письмової інформованої згоди. Вагітність виявляли під час 2-місячних візитів до жінок додому та підтверджували за допомогою смужкових тестів на вагітність, які проводили ПОЗ, а термін вагітності визначали за допомогою ультразвукового сканування, яке проводили кваліфіковані лікарі-ультрасонологи між 8 і 19 тижнями гестації. ПОЗ здійснили три антенатальних візити додому (на 8-19 тижні, 24-28 тижні та 32-36 тижні вагітності) та два післяпологових візити додому (до 7 днів та на 42-60 дні вагітності). Під час цих візитів ПОЗ збирали детальну фенотипічну, соціально-демографічну та епідеміологічну інформацію від вагітних жінок.
Забір зразків
Зразки материнської крові відбирали двічі під час вагітності (8-19 тижнів і 24-28 тижнів або 32-36 тижнів вагітності) та один раз у післяпологовий період (42-60 днів після пологів). Друга вибірка під час вагітності була зібрана приблизно у 75% випадково відібраних жінок. Третій зразок був зібраний у жінок, які не були відібрані для другого дослідження. Зразки крові збирали кваліфіковані флеботомісти в досліджуваній клініці, а зразки сироватки відокремлювали центрифугуванням, аліквотували та зберігали при температурі -80 ℃ за стандартними процедурами [30].
Популяція, клінічні випадки та контроль
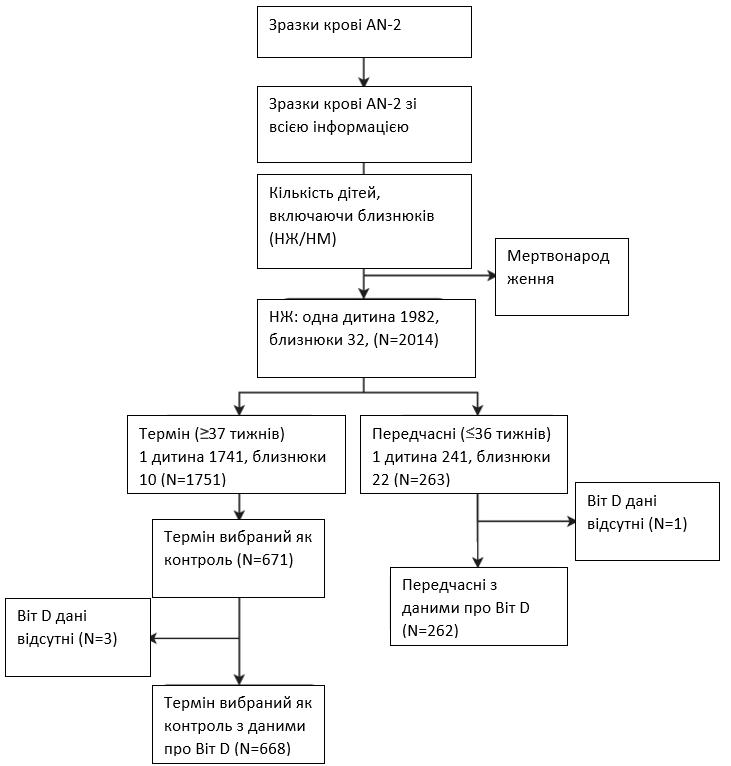
У цьому дослідженні ми розглянули всіх жінок, які здали другий антенатальний забір крові (n = 2 287), мали принаймні один антенатальний і один післяпологовий візит і дані про результат вагітності (n = 2 075), а також народили живих дітей (n = 2 014). У цьому вкладеному дослідженні “випадок-контроль” усі жінки, які перенесли ПЧП (між 24 і < 37 тижнями гестації), були включені як клінічні випадки (n = 263), а випадкова вибірка доношених пологів була включена в якості контролю (n = 671). Рівень вітаміну D вимірювали лише в основних та контрольних групах. Вимірювання рівня вітаміну D було відсутнє в однієї пацієнтки та трьох матерів з контрольної групи; ці матері були виключені з аналізу. Таким чином, до аналізу було включено 262 клінічні випадки та 668 жінок з контрольної групи (зображення 2).
Зображення 2
Блок-схема дослідження
Аналіз на рівень вітаміну D
Заморожені зразки сироватки були передані для аналізу в лабораторію імунобіології, харчування та токсикології Міжнародного центру досліджень діарейних захворювань Бангладеш (icddr,b). Концентрацію 25(OH)D у сироватці крові вимірювали методом (електро-) хемілюмінесцентного імуноферментного аналізу (ECLIA) на автоматичному імуноферментному аналізаторі Cobas e601 компанії Roche з використанням комерційного набору (Roche Diagnostics, GmbH, 68305 Mannheim, Germany) відповідно до інструкції виробника. Метод визначення вітаміну D було стандартизовано за допомогою LC MS/MS, який, у свою чергу, було стандартизовано за стандартом NIST. Діапазон вимірювання 25(OH)D становив 7,50-175 нмоль/л. Комерційний контроль на основі людської сироватки в двох діапазонах концентрацій проводився в кожній партії/день для моніторингу точності та прецизійності цього аналізу.
Вимірювання
Результат, ПЧП, визначався як народження живих дітей у терміні гестації < 37 тижнів за даними ультразвукового дослідження. Основним фактором впливу були концентрації вітаміну D у зразках крові матерів на 24-28 тижні вагітності. Використовуючи концентрацію 25(OH)D у сироватці крові, ми розподілили жінок на квартилі [найнижчий квартиль (≤ 30,25 нмоль/л), 3-й квартиль (30,25-37,99 нмоль/л), 2-й квартиль (38,0-48,52 нмоль/л) та найвищий квартиль (≥ 48,53 нмоль/л)]. Таблиця 1 показала, що близько 75% жінок мали недостатній рівень вітаміну D (< 48,53 нмоль). Потім ми проаналізували зв’язок концентрації вітаміну D з первинним результатом – ПЧП – і виявили, що порівняно з найвищим квартилем вітаміну D, всі інші квартилі мали вищий ризик ПЧП, але ризики були лише незначно вищими у другому та третьому квартилях. Найнижчий квартиль мав на 67% значно вищий ризик ПЧП. Потім ми об’єднали три верхні квартилі вітаміну D як “без дефіциту” [25(OH)D ≥ 30,25 до ≥ 48,53 нмоль/л], а найнижчий квартиль – як “дефіцит вітаміну D” [25(OH)D ≤ 30,25 нмоль/л]. Ми використовували ці дві категорії в усіх подальших аналізах (Таблиця 1).
Таблиця 1 Зв’язок між передчасними пологами та концентрацією вітаміну D
| Загалом
N = 930 (%) |
Термін
n = 668 (%) |
Передчасні
n = 262 (%) |
ВШ (95% ДІ) | P-value | |
| Концентрація 25(OH)D (квартилі) | |||||
| Найвищий квартиль (≥ 48,53 нмоль/л) | 232 (25.0) | 177 (26.5) | 56 (21.4) | Реф | |
| 2-й квартиль (38,0-48,52 нмоль/л) | 233 (25.0) | 172 (25.8) | 60 (22.9) | 1.13 (0.74–1.72) | 0.574 |
| 3-й квартиль (30,25-37,99 нмоль/л) | 232 (25.0) | 167 (25.0) | 66 (25.2) | 1.24 (0.82–1.88) | 0.306 |
| Нижній квартиль (≤ 30,25 нмоль/л) | 233 (25.0) | 152 (22.8) | 80 (30.5) | 1.67 (1.12–2.51) | 0.013 |
| Концентрації 25(OH)D (дві категорії) | |||||
| Не має дефіциту (верхні три квартилі) | 697 (75%) | 516 (77.2) | 182 (69.5) | Реф | |
| Дефіцит (найнижчий квартиль) | 233 (25%) | 152 (22.8) | 80 (30.5) | 1.49 (1.08–2.05) | 0.014 |
Вік матері поділявся на < 30 та ≥ 30 років. Паритет поділявся на 0/немає дітей, 1-3 та ≥ 4 дітей. Освіта матері та батька поділялася на 0-5 років та > 5 років навчання. Зріст матері поділявся на зріст < 145 см та > = 145 см. Індекс перенаселеності домоволодінь розраховувався шляхом ділення кількості осіб на кількість спальних кімнат. Потім ми класифікували переповненість домоволодіння на < = 2 та > 2. Використовуючи аналіз головних компонент, ми розрахували бали заможності домоволодіння на основі житлових умов та майна домоволодіння. Домоволодіння були розподілені на тертилі за рівнем добробуту.
Розмір вибірки та статистичний аналіз
Оскільки кількість випадків була фіксованою, використовуючи формулу Келсі та співавт. [31] для розрахунку розміру вибірки для незрівнянного дослідження “випадок-контроль”, ми розрахували кількість контрольних груп, необхідних для визначення відношення шансів 1,5, з такими параметрами: частка контрольних груп з експозицією = 20%; частка випадків з експозицією = 30%; двосторонній довірчий інтервал = 95% та потужність = 80%. Кількість контролів, необхідних для кожного випадку, становила 2,5. Відповідно, ми відібрали 671 контрольну групу для 262 випадків.
Ми провели дві серії двовимірного аналізу з використанням критерію хі-квадрат Пірсона для перевірки незалежності. По-перше, ми дослідили зв’язок концентрації вітаміну D (дефіцит чи відсутність дефіциту) з віком матері, освітою, професією, зростом матері, вживанням тютюну, освітою чоловіка, професією чоловіка, перенаселеністю домоволодіннь та індексом добробуту сімей. У другій серії двовимірного аналізу ми дослідили зв’язок між передчасними або доношеними пологами дитини та концентрацією вітаміну D і окремими соціально-економічними, демографічними та медичними характеристиками матерів, які звертаються за допомогою. Багатовимірна логістична регресія була використана для розрахунку нескоригованих та скоригованих відношень шансів (сВШ) та 95% довірчих інтервалів (ДІ) для виявлення факторів, які суттєво асоціюються з ПЧП. Змінні з р-значенням < 0,2 у двовимірному аналізі з ПЧП були включені в багатофакторну логістичну регресійну модель. Для аналізу даних використовували програму Stata V.17 (StataCorp 2017).
Результати
Зв’язок концентрації вітаміну D у сироватці крові матері з окремими характеристиками матерів і домоволодінь представлено в Таблиці 2. Вік матері, освіта та багатодітність домоволодіння були значуще пов’язані з концентрацією вітаміну D у сироватці крові. Молодші матері, віком < 30 років та матері з освітою > 5 років частіше мали дефіцит вітаміну D (таблиця 2).
Таблиця 2 Розподіл концентрації вітаміну D у сироватці крові матерів за окремими характеристиками матерів та домоволодінь
| Ознака | Концентрація вітаміну D | P-value | ||
| Загальна | Без дефіциту | Дефіцит | ||
| N = 930 | n = 698 (%) | n = 232 (%) | ||
| Вік матері в роках | ||||
| < 30 | 816 | 602 (86.2) | 214 (92.2) | 0.016 |
| ≥ 30 | 114 | 96 (13.8) | 18 (7.8) | |
| Освіта матері | ||||
| 0–5 років | 433 | 353 (50.6) | 80 (34.5) | 0.001 |
| > 5 років | 497 | 345 (49.4) | 152 (65.5) | |
| Рід занять матері | ||||
| Домогосподарка | 910 | 684 (98.0) | 226 (97.4) | 0.597 |
| Працє / працевлаштована | 20 | 14 (2.0) | 6 (2.6) | |
| ІМТ матері | ||||
| Зріст м | ||||
| < 145 см | 182 | 145 (20.8) | 37 (15.9) | 0.109 |
| ≥ 145 см | 748 | 553 (79.2) | 195 (84.1) | |
| Вживання тютюну під час вагітності | ||||
| Ні (Ніколи, Кинула до/під час вагітності) | 769 | 580 (83.1) | 189 (81.5) | 0.57 |
| Так (зараз нюхає/жує) | 161 | 118 (16.9) | 43 (18.5) | |
| Освіта батька | ||||
| 0–5 років | 652 | 499 (71.5) | 153 (65.9) | 0.110 |
| > 5 років | 278 | 199 (28.5) | 79 (34.1) | |
| Рід занять батька | ||||
| Державні/приватні/самозайняті (можливо, з виїздом на місце) | 260 | 193 (27.7) | 67 (28.9) | 0.718 |
| Поденна оплата праці/фермерство/інше/не працює (можливо, на вулиці) | 670 | 505 (72.3) | 165 (71.1) | |
| Наповненість домоволодіння | ||||
| ≤ 2 | 663 | 485 (69.5) | 178 (76.7) | 0.035 |
| > 2 | 276 | 213 (30.5) | 54 (23.3) | |
| Індекс добробуту ДВ | ||||
| Найбідніші | 310 | 233 (33.4) | 77 (33.2) | 0.932 |
| Середні | 312 | 232 (33.2) | 80 (34.5) | |
| Найбагатші | 308 | 233 (33.4) | 75 (32.3) | |
У біваріантному аналізі концентрація вітаміну D у сироватці крові матері, зріст матері, наявність родів у анамнезі, прийом препаратів заліза під час вагітності та пасивне куріння були пов’язані з терміном вагітності та передчасними пологами дитини (Таблиця 3).
Таблиця 3 Розподіл передчасних та доношених новонароджених за окремими соціально-економічними, демографічними характеристиками та зверненнями матерів за медичною допомогою
| Змінні | Загалом | ПЧП (< 37 тижнів) | Термін (≥ 37 тижнів) | P-value |
| N = 930 | n = 262 (%) | n = 668 (%) | ||
| Концентрація вітаміну D | ||||
| Не має дефіциту (верхні три квартилі) | 698 | 182 (69.5) | 516 (77.2) | 0.014 |
| Дефіцит (найнижчі квартилі) | 232 | 80 (30.5) | 152 (22.8) | |
| Стать дитини | ||||
| хлопчик | 458 | 132 (50.4) | 326 (48.8) | 0.665 |
| дівчинка | 472 | 130 (49.6) | 342 (51.2) | |
| Вік матері в роках | ||||
| < 30 | 816 | 233 (88.9) | 583 (87.3) | 0.489 |
| ≥ 30 | 114 | 29 (11.1) | 85 (12.7) | |
| Освіта матері | ||||
| 0–5 років | 433 | 118 (45.0) | 315 (47.2) | 0.560 |
| > 5 років | 497 | 144 (55.0) | 353 (52.8) | |
| Зріст матері | ||||
| < 145 см | 182 | 70 (26.7) | 112 (16.8) | 0.001 |
| > = 145 см | 748 | 192 (73.3) | 556 (83.2) | |
| Вагітність | ||||
| 0/Перша | 302 | 101 (38.5) | 201 (30.1) | 0.023 |
| 1–3 | 519 | 128 (48.9) | 391 (58.5) | |
| ≥ 4 | 109 | 33 (12.6) | 76 (11.4) | |
| Місце родів | ||||
| На дому | 238 | 72 (27.5) | 166 (24.9) | 0.408 |
| Лікувальний заклад | 692 | 190 (72.5) | 502 (75.1) | |
| Кваліфікована допомога під час пологів | ||||
| Кваліфікований акушер під час пологів | 911 | 256 (97.7) | 655 (98.1) | 0.739 |
| Не тренований | 19 | 6 (2.3) | 13 (1.9) | |
| Прийом таблеток заліза під час вагітності | ||||
| Ні | 250 | 52 (19.8) | 198 (29.6) | 0.002 |
| Так | 680 | 210 (80.2) | 470 (70.4) | |
| Вживання тютюну під час вагітності | ||||
| Ні (Ніколи, Кинула до/під час вагітності) | 769 | 210 (80.2) | 559 (83.7) | 0.201 |
| Так (зараз нюхає/жує) | 161 | 52 (19.8) | 109 (16.3) | |
| Пасивне або непряме куріння під час вагітності | ||||
| Ні | 197 | 44 (16.8) | 153 (22.9) | 0.04 |
| Так | 733 | 218 (83.2) | 515 (77.1) | |
| Жування листя бетелю під час вагітності | ||||
| Ні | 543 | 155 (59.2) | 388 (58.1) | 0.764 |
| Так | 387 | 107 (40.8) | 280 (41.9) | |
| Релігія | ||||
| Іслам | 808 | 230 (87.8) | 578 (86.5) | 0.609 |
| Інші | 122 | 32 (12.2) | 90 (13.5) | |
| Освіта чоловіка | ||||
| 0–5 років | 652 | 188 (71.8) | 464 (69.5) | 0.492 |
| > 5 років | 278 | 74 (28.2) | 204 (30.5) | |
| Наповненість домоволодіння | ||||
| < = 2 | 663 | 188 (71.8) | 475 (71.1) | 0.844 |
| > 2 | 267 | 74 (28.2) | 193 (28.9) | |
| Індекс добробуту ДВ | ||||
| Найбідніші | 310 | 85 (32.4) | 225 (33.7) | 0.924 |
| Середні | 312 | 90 (34.4) | 222 (33.2) | |
| Найбагатші | 308 | 87 (33.2) | 221 (33.1) | |
У нескоригованому логістичному регресійному аналізі, що вивчав фактори, пов’язані з ПЧП, матері з ДВД (ВШ, 95% ДІ: 1,49, 1,08-2,05), зріст матері (ВШ, 95% ДІ: 1,81, (1,29-2,54), перші роди (ВШ, 95% ДІ: 1,53, 1,12-2,10), матері з анамнезом пасивного куріння під час вагітності (ВШ, 95% ДІ: 1,47, 1,02-2,13) та матері, які отримували препарати заліза (ВШ, 95%ДІ: 1,70 (1,20-2,40)) мали вищий ризик ПЧП (Таблиця 4). Ризик ПЧП, пов’язаний з ДВД, залишався подібним після поправки на інші коваріанти, які були значущими в біваріантному аналізі. ДВД матері асоціювався з приблизно в 1,5 раза вищим ризиком ПЧП (сВШ, 95% ДІ: 1,53, від 1,10 до 2,12). Ризик ПЧП був приблизно в 2 рази вищим у матерів зі зростом < 145 см (сВШ, 95% ДІ: 1,81, 1,27-2,57) порівняно з матерями зі зростом > = 145 см (таблиця 4). Порівняно з матерями, які мали 1-3 дітей, первістки мали приблизно в 1,5 раза вищий ризик ПЧП (сВШ, 95% ДІ: 1,55, 1,12 -2,12) (таблиця 4). У матерів, які вживали залізо під час вагітності, ризик ПЧП був на 66% вищим (сВШ, 95% ДІ: 1,66, 1,17-2,37) порівняно з матерями, які його не вживали (таблиця 4). Порівняно з матерями, які не повідомляли про пасивне куріння, у тих, хто повідомляв про це, ризик ПЧП був у 1,60 раза (сВШ, 95% ДІ: 1,60, 1,09-2,34) вищим (таблиця 4).
Таблиця 4 Ризик передчасних пологів у матерів з дефіцитом вітаміну D після коригування з урахуванням супутніх змінних
| Ознака | Передчасні пологи | |
| Не скориговане ВШ
95%ДІ |
Скориговане ВШ
95%ДІ |
|
| Концентрація Віт D | ||
| Не має дефіциту (верхні три квартилі) | Реф | Реф |
| Дефіцит (найнижчі квартилі) | 1.49 (1.08–2.05) | 1.53 (1.10–2.12) |
| Стать дитини | ||
| Хлопчик | Реф | |
| Дівчинка | 0.94 (0.71–1.25) | |
| Вік матері в роках | ||
| < 30 | 1.17 (0.75–1.83) | |
| ≥ 30 | Реф | |
| Освіта матері | ||
| 0–5 років | 0.92 (0.69–1.22) | |
| > 5 років | Реф | |
| Зріст матері | ||
| < 145 см | 1.81 (1.29–2.54) | 1.81 (1.27–2.57) |
| ≥ 145 см | Реф | Реф |
| Вагітність | ||
| 0/Перша | 1.53 (1.12–2.10) | 1.55 (1.12–2.12) |
| 1 до3 | Реф | Реф |
| ≥ 4 | 1.33 (0.84–2.09) | 1.30 (0.82–2.08) |
| Місце пологів | ||
| На дому | 1.15 (0.83–1.58) | |
| Лікувальний заклад | Реф | |
| Кваліфікована допомога під час пологів | ||
| Кваліфікований акушер під час пологів | Реф | |
| Не тренований | 1.18 (0.44–3.14) | |
| Прийом таблеток заліза під час вагітності | ||
| Ні | Реф | |
| Так | 1.70 (1.20–2.40) | 1.66 (1.17–2.37) |
| Вживання тютюну під час вагітності | ||
| Ні | Реф | |
| Так | 1.27 (0.88–1.83) | |
| Пасивне або непряме куріння під час вагітності | ||
| Ні | Реф | Реф |
| Так | 1.47 (1.02–2.13) | 1.60 (1.09–2.34) |
| Жування листя бетелю під час вагітності | ||
| НІ | Реф | |
| Так | 0.96 (0.72–1.28) | |
| Релігія | ||
| Іслам | Реф | |
| Інші | 0.89 (0.58–1.38) | |
| Освіта батька | ||
| 0–5 років | 1.12 (0.81–1.53) | |
| > 5 років | Реф | |
| Індекс переповненості | ||
| ≤ 2 | Реф | |
| > 2 | 0.97 (0.71–1.33) | |
| Квінтилі багатства домогосподарств | ||
| Найбідніші | 0.96 (0.67–1.36) | |
| Середні | 1.03 (0.73–1.46) | |
| Найбагатші | Реф | |
Обговорення
У популяційному когортному дослідженні вагітних жінок, за якими спостерігали протягом раннього післяпологового періоду в сільській місцевості Бангладеш, ми задокументували високу поширеність дефіциту 25(OH)D у сироватці крові під час другого триместру вагітності. Концентрація вітаміну D < 50 нмоль/л або 20 нг/мл вважається дефіцитом і асоціюється з несприятливими наслідками [32]. У цьому дослідженні приблизно 3 з 4 вагітних жінок з Бангладеш мали концентрацію вітаміну D < 50 нмоль/л. Для цього аналізу ми розглядали жінок у найнижчому квартилі вітаміну D з рівнем < 30,25 нмоль/л як дефіцитних, а решту жінок – як не дефіцитних, хоча жінки в другому і третьому квартилях вітаміну D також мали тенденцію до вищого ризику ПЧП порівняно з жінками в найвищому квартилі вітаміну D. Таким чином, цей аналіз, який свідчить про приблизно п’ятдесятивідсотковий вищий ризик передчасних пологів (сВШ 1,53 95% ДІ; від 1,10 до 2,12) у жінок із ДВД порівняно з тими, які не вважалися дефіцитними, є консервативним.
Окрім ДВД, низький зріст матері, перша вагітність, пасивне куріння та вживання заліза під час вагітності також були достовірно пов’язані з підвищеним ризиком ПЧП. Значно вищий ризик ПЧП серед жінок, які вживали залізо під час вагітності, є контрінтуїтивним. Більш раннє дослідження, проведене в тій самій популяції, виявило подібний результат [33]. Переваги застосування препаратів заліза під час вагітності в популяції із дефіцитом заліза добре відомі [34]. Результати систематичного огляду, який включав 48 рандомізованих досліджень і 44 когортних дослідження, виявили значний вплив пренатального споживання заліза на зниження ризику низької ваги при народженні (ВШ: 0,81; 95% ДІ: 0,71, 0,93), але вплив на передчасні пологи не був значущим (ВШ: 0,84; 95% ДІ: 0,68, 1,03) [34]. Існують також докази того, що збільшення споживання заліза не завжди є корисним. Доступність заліза може впливати на тяжкість і хронізацію материнських інфекцій і, таким чином, може призвести до негативних наслідків вагітності, включаючи передчасні пологи [35], особливо в популяціях з високою поширеністю материнсько-плодових інфекцій.
Наше дослідження показало, що у жінок із ДВД підвищений ризик розвитку Псоріазу. Однак сучасна література про концентрацію вітаміну D та Псоріаз суперечлива. Деякі дослідження показали зв’язок між ними, а інші – ні. У дослідженні, проведеному в Південній Кароліні, США, з використанням двох наборів даних Національного інституту дитячого здоров’я та розвитку людини (n = 333) та Thrasher Research Fund (n = 154), Wagner та співавт. у 2015 р. виявили підвищений ризик розвитку ПЧП у жінок з нижчими концентраціями вітаміну D [36]. Жінки, які мали концентрацію вітаміну D < 20 нг/мл у третьому триместрі, мали в 3,3 рази більший ризик розвитку ПЧП порівняно з тими, хто мав концентрацію > 40 нг/мл [36].
У ретроспективному когортному дослідженні, також проведеному в Південній Кароліні, США, McDonnell та співавт. (2017) виявили, що вагітні жінки, які мали концентрацію вітаміну D > 40 нг/мл, мали на 62% нижчий ризик розвитку ПЧП порівняно з жінками, які мали концентрацію вітаміну D < 20 нг/мл [37]. Мета-аналіз обсерваційних досліджень, проведених за участю 10 098 жінок, також показав підвищений ризик ПЧП у жінок з концентрацією вітаміну D < 20 нг/мл (ВШ 1,29, 95% ДІ: 1,16, 1,45) [38].
Однак кілька інших досліджень не виявили зв’язку між ДВД і ПЧП. Проспективне когортне дослідження, проведене Wang S та співавт. (2021) серед 3465 вагітних жінок у лікарні охорони здоров’я матері та дитини Чжоушань, Чжецзян, Китай, не виявило значущого зв’язку між ДВД у матерів та ризиком розвитку ПЧП [39]. Ретроспективне дослідження 1641 жінки на півдні Китаю також не виявило зв’язку [40].
Рандомізовані клінічні дослідження (РКД), проведені з метою оцінки того, чи може добавка вітаміну D для тих, хто має його дефіцит, зменшити частоту ПЧП, також виявилися непереконливими. Sablok та співавт. (2015) провели РКД за участю 180 вагітних жінок у Делі, Індія, і виявили 8,3% випадків ПЧП серед жінок, які отримували вітамін D, порівняно з 21,1% серед тих, хто не отримував вітамін D [41]. Rostami та співавт. (2018) провели стратифіковане рандомізоване дослідження серед 2 500 іранських жінок і виявили на 40% (95% ДІ, від 0,40 до 0,80) нижчу частоту ПЧП у жінок, які отримували додатково вітамін D [42]. Однак інше рандомізоване контрольоване дослідження, проведене Hossain та співавт. у 2014 році в університетській лікарні в Карачі, Пакистан, не виявило ефекту. У цьому дослідженні 207 вагітних жінок, одна група отримувала сульфат заліза і кальцій, а інша – 4 000 МО вітаміну D3. Хоча концентрація вітаміну D підвищилася як у матері, так і у дитини, які отримували добавки, не було виявлено суттєвої різниці в частоті виникнення ПЧП [43]. Mojibian та співавт. (2015) провели рандомізоване клінічне дослідження за участю 500 вагітних жінок (12-16 тижнів) з дефіцитом вітаміну D і не побачили суттєвої різниці в частоті ПЧП між тими, хто отримував 400 МО вітаміну D щодня, і тими, хто отримував 50 000 МО вітаміну D кожні 2 тижні [44]. Причиною таких суперечливих результатів у різних дослідженнях, ймовірно, є багатофакторність, включаючи різні структури досліджень, різницю у часі вимірювання рівня вітаміну D, поширеність дефіциту вітаміну D та ПЧП у досліджуваній популяції, а також різні географічні регіони та расові групи. РКД, в яких не було виявлено жодних переваг щодо зниження ПЧП при застосуванні добавок, мали відносно невеликий розмір вибірки. Подальші РКД з більшою кількістю вагітних жінок у популяції з дефіцитом вітаміну D можуть допомогти з’ясувати, чи можуть добавки для матерів допомогти знизити частоту ПЧП.
Механізм виникнення дефіциту вітаміну D у матерів та ПЧП до кінця не з’ясований. Однак нещодавні дослідження запропонували кілька шляхів, включаючи оксидативний стрес, дисбаланс у регуляції запальної відповіді та порушення функції плаценти під час вагітності [45, 46]. Yamada та співавт. (2020) висунули гіпотезу, що жінки з ДВД можуть мати підвищений ризик розвитку ПЧП через дерегуляцію імунної відповіді [47]. Покращення материнського статусу вітаміну D може діяти через зниження ризику інфекцій, включаючи бактеріальний вагіноз, який був причетний до причин передчасних пологів [48].
Сильною стороною дослідження є його популяційний проспективний дизайн. Основна змінна результату, ПЧП, базувалася на визначенні терміну вагітності за допомогою ультразвукового дослідження на ранніх термінах вагітності, яке проводили кваліфіковані лікарі ультразвукової діагностики. Таким чином, класифікація доношених/недоношених вагітностей була точнішою порівняно з класифікацією на основі дати останньої менструації. Дослідження також має кілька обмежень. Це дослідження “випадок-контроль”, яке може бути схильне до упередженості та плутанини [49]. Оскільки ми збирали дані проспективно з усієї когорти, використовуючи однакові методи, упередженість, якщо вона є, повинна бути мінімальною [50]. Іншим обмеженням є те, що ми не мали даних про всі можливі фактори ризику розвитку ПЧП.
Висновок
Дослідження показало високу поширеність ДВД у вагітних жінок Бангладеш, а також те, що ці жінки мали підвищений ризик розвитку ПЧП. Ці результати дослідження “випадок-контроль” слід інтерпретувати з обережністю, щоб зробити висновок про причинно-наслідковий зв’язок. Необхідні додаткові дослідження, як обсерваційні для подальшого вивчення зв’язку між ДВД і ризиком ПЧП, так і рандомізовані дослідження для вивчення користі застосування добавок.
Абревіатури
КНСД:
Країни з низьким і середнім рівнем доходу
ПЧП:
Передчасні пологи
ВШ:
Відношення шансів
ДІ:
Довірчий інтервал
AMANHI:
Альянс за поліпшення здоров’я матерів та новонароджених
ПОЗ:
Підготовлені працівники охорони здоров’я на рівні громади
icddr,b:
Міжнародний центр досліджень діарейних захворювань Бангладеш
ECLIA:
імуноферментний аналіз
ГВ:
Гестаційний вік
ІМТ:
Індекс маси тіла
сВШ:
Скориговане відношення шансів
NICHD:
Національний інститут охорони здоров’я дитини та розвитку людини
РКД:
Рандомізоване клінічне дослідження
Посилання на джерела
- Liu L, Oza S, Hogan D, Perin J, Rudan I, Lawn JE, et al. Global, regional, and national causes of child mortality in 2000–13, with projections to inform post-2015 priorities: an updated systematic analysis. Lancet. 2015;385(9966):430–40.
- Harrison MS, Goldenberg RL. Global burden of prematurity. Semin Fetal Neonatal Med. 2016;21(2):74–9.
- Dimes Mo, PMNCH, Children St, WHO. Born too soon: the global action report on preterm birth. Geneva: World Health Organization; 2020. https://www.marchofdimes.org/materials/born-too-soon-the-global-action-report-on-preterm-.pdf.
- Perin J, Mulick A, Yeung D, Villavicencio F, Lopez G, Strong KL, et al. Global, regional, and national causes of under-5 mortality in 2000–19: an updated systematic analysis with implications for the Sustainable Development Goals. Lancet Child Adolesc Health. 2022;6(2):106–15.
- Blencowe H, Cousens S, Chou D, Oestergaard M, Say L, Moller AB, et al. Born too soon: the global epidemiology of 15 million preterm births. Reprod Health. 2013;10 Suppl 1(Suppl 1):S2.
- Walani SR. Global burden of preterm birth. Int J Gynaecol Obstet. 2020;150(1):31–3.
- Chawanpaiboon S, Vogel JP, Moller AB, Lumbiganon P, Petzold M, Hogan D, et al. Global, regional, and national estimates of levels of preterm birth in 2014: a systematic review and modelling analysis. Lancet Glob Health. 2019;7(1):e37–46.
- Romero R, Espinoza J, Kusanovic JP, Gotsch F, Hassan S, Erez O, et al. The preterm parturition syndrome. BJOG. 2006;113 Suppl 3(Suppl 3):17–42.
- Beck S, Wojdyla D, Say L, Betran AP, Merialdi M, Requejo JH, et al. The worldwide incidence of preterm birth: a systematic review of maternal mortality and morbidity. Bull World Health Organ. 2010;88(1):31–8.
- Institute of Medicine Committee on Understanding Premature B, Assuring Healthy O. The National Academies Collection: Reports funded by National Institutes of Health. In: Behrman RE, Butler AS, editors. Preterm Birth: Causes, Consequences, and Prevention. Washington (DC): National Academies Press (US); 2007. Copyright © 2007, National Academy of Sciences.
- Goldenberg RL, Culhane JF, Iams JD, Romero R. Epidemiology and causes of preterm birth. The Lancet. 2008;371(9606):75–84.
- Zhang G, Jacobsson B, Muglia LJ. Genetic Associations with Spontaneous Preterm Birth. N Engl J Med. 2017;377(24):2401–2.
- Darnton-Hill I, Mkparu UC. Micronutrients in pregnancy in low- and middle-income countries. Nutrients. 2015;7(3):1744–68.
- Gernand AD, Schulze KJ, Stewart CP, West KP Jr, Christian P. Micronutrient deficiencies in pregnancy worldwide: health effects and prevention. Nat Rev Endocrinol. 2016;12(5):274–89.
- Kanasaki K, Kumagai A. The impact of micronutrient deficiency on pregnancy complications and development origin of health and disease. J Obstet Gynaecol Res. 2021;47(6):1965–72.
- Bartley J. Vitamin D: emerging roles in infection and immunity. Expert Rev Anti Infect Ther. 2010;8(12):1359–69.
- Holick MF. Vitamin D deficiency. N Engl J Med. 2007;357(3):266–81.
- Palaniswamy S, Williams D, Järvelin MR, Sebert S. Vitamin D and the promotion of long-term metabolic health from a programming perspective. Nutr Metab Insights. 2015;8(Suppl 1):11–21.
- Chen YH, Fu L, Hao JH, Wang H, Zhang C, Tao FB, et al. Influent factors of gestational vitamin D deficiency and its relation to an increased risk of preterm delivery in Chinese population. Sci Rep. 2018;8(1):3608.
- Baczyńska-Strzecha M, Kalinka J. Assessment of correlation between vitamin D level and prevalence of preterm births in the population of pregnant women in Poland. Int J Occup Med Environ Health. 2017;30(6):933–41.
- Kalinjuma AV, Darling AM, Sudfeld CR, Mugusi F, Wright J, Abioye AI, et al. Vitamin D Concentration during Early Pregnancy and Adverse Outcomes among HIV-Negative Women in Dar-es-Salaam, Tanzania: A Case-Control Study. Nutrients. 2019;11(12):2906.
- Miliku K, Vinkhuyzen A, Blanken LM, McGrath JJ, Eyles DW, Burne TH, et al. Maternal vitamin D concentrations during pregnancy, fetal growth patterns, and risks of adverse birth outcomes. Am J Clin Nutr. 2016;103(6):1514–22.
- Amegah AK, Klevor MK, Wagner CL. Maternal vitamin D insufficiency and risk of adverse pregnancy and birth outcomes: a systematic review and meta-analysis of longitudinal studies. PLoS One. 2017;12(3):e0173605.
- Yang L, Pan S, Zhou Y, Wang X, Qin A, Huang Y, et al. The correlation between serum vitamin D deficiency and preterm birth. Med Sci Monit. 2016;22:4401–5.
- Agarwal S, Kovilam O, Agrawal DK. Vitamin D and its impact on maternal-fetal outcomes in pregnancy: a critical review. Crit Rev Food Sci Nutr. 2018;58(5):755–69.
- Islam MZ, Bhuiyan NH, Akhtaruzzaman M, Allardt CL, Fogelholm M. Vitamin D deficiency in Bangladesh: a review of prevalence, causes and recommendations for mitigation. Asia Pac J Clin Nutr. 2022;31(2):167–80.
- Purisch SE, Gyamfi-Bannerman C. Epidemiology of preterm birth. Semin Perinatol. 2017;41(7):387–91.
- Vogel JP, Chawanpaiboon S, Moller AB, Watananirun K, Bonet M, Lumbiganon P. The global epidemiology of preterm birth. Best Pract Res Clin Obstet Gynaecol. 2018;52:3–12.
- Baqui AH, Khanam R, Rahman MS, Ahmed A, Rahman HH, Moin MI, et al. Understanding biological mechanisms underlying adverse birth outcomes in developing countries: protocol for a prospective cohort (AMANHI bio-banking) study. J Glob Health. 2017;7(2):021202.
- Aftab F, Ahmed S, Ali SM, Ame SM, Bahl R, Baqui AH, et al. Cohort Profile: The Alliance for Maternal and Newborn Health Improvement (AMANHI) biobanking study. Int J Epidemiol. 2022;50(6):1780–1.
- Jennifer KL, Alice WS, Alfred ES, Douglas TW. Methods in Observational Epidemiology 2nd Edition, Table 12–15. New York Oxford: Oxford University Press; 1996.
- Amrein K, Scherkl M, Hoffmann M, Neuwersch-Sommeregger S, Köstenberger M, TmavaBerisha A, et al. Vitamin D deficiency 2.0: an update on the current status worldwide. Eur J Clin Nutr. 2020;74(11):1498–513.
- Shah R, Mullany LC, Darmstadt GL, Mannan I, Rahman SM, Talukder RR, et al. Incidence and risk factors of preterm birth in a rural Bangladeshi cohort. BMC Pediatr. 2014;14:112.
- Haider BA, Olofin I, Wang M, Spiegelman D, Ezzati M, Fawzi WW. Anaemia, prenatal iron use, and risk of adverse pregnancy outcomes: systematic review and meta-analysis. BMJ. 2013;346:f3443.
- Brabin L, Brabin BJ, Gies S. Influence of iron status on risk of maternal or neonatal infection and on neonatal mortality with an emphasis on developing countries. Nutr Rev. 2013;71(8):528–40.
- Wagner CL, Baggerly C, McDonnell SL, Baggerly L, Hamilton SA, Winkler J, et al. Post-hoc comparison of vitamin D status at three timepoints during pregnancy demonstrates lower risk of preterm birth with higher vitamin D closer to delivery. J Steroid Biochem Mol Biol. 2015;148:256–60.
- McDonnell SL, Baggerly KA, Baggerly CA, Aliano JL, French CB, Baggerly LL, et al. Maternal 25(OH)D concentrations ≥40 ng/mL associated with 60% lower preterm birth risk among general obstetrical patients at an urban medical center. PLoS One. 2017;12(7):e0180483.
- Qin LL, Lu FG, Yang SH, Xu HL, Luo BA. Does maternal vitamin D deficiency increase the risk of preterm birth: a meta-analysis of observational studies. Nutrients. 2016;8(5):301.
- Wang S, Xin X, Luo W, Mo M, Si S, Shao B, et al. Association of vitamin D and gene variants in the vitamin D metabolic pathway with preterm birth. Nutrition. 2021;89:111349.
- Yu L, Guo Y, Ke HJ, He YS, Che D, Wu JL. Vitamin D status in pregnant women in Southern China and risk of preterm birth: a large-scale retrospective cohort study. Med Sci Monit. 2019;25:7755–62.
- Sablok A, Batra A, Thariani K, Batra A, Bharti R, Aggarwal AR, et al. Supplementation of vitamin D in pregnancy and its correlation with feto-maternal outcome. Clin Endocrinol (Oxf). 2015;83(4):536–41.
- Rostami M, Tehrani FR, Simbar M, BidhendiYarandi R, Minooee S, Hollis BW, et al. Effectiveness of prenatal vitamin D deficiency screening and treatment program: a stratified randomized field trial. J Clin Endocrinol Metab. 2018;103(8):2936–48.
- Hossain N, Kanani FH, Ramzan S, Kausar R, Ayaz S, Khanani R, et al. Obstetric and neonatal outcomes of maternal vitamin D supplementation: results of an open-label, randomized controlled trial of antenatal vitamin D supplementation in Pakistani women. J Clin Endocrinol Metab. 2014;99(7):2448–55.
- Mojibian M, Soheilykhah S, FallahZadeh MA, Jannati MM. The effects of vitamin D supplementation on maternal and neonatal outcome: a randomized clinical trial. Iran J Reprod Med. 2015;13(11):687–96.
- Jha RK, Kanyal D, Dhok DA, Butola LK. Need of vitamin d beyond bone: a consise review. Eur J Mol Clin Med. 2021;8(3):1096–109.
- Sultana Z, Maiti K, Aitken J, Morris J, Dedman L, Smith R. Oxidative stress, placental ageing-related pathologies and adverse pregnancy outcomes. Am J Reprod Immunol. 2017;77:e12653. https://doi.org/10.1111/aji.12653.
- Yadama AP, Mirzakhani H, McElrath TF, Litonjua AA, Weiss ST. Transcriptome analysis of early pregnancy vitamin D status and spontaneous preterm birth. PLoS One. 2020;15(1):e0227193.
- Manns-James L. Bacterial vaginosis and preterm birth. J Midwifery Womens Health. 2011;56(6):575–83.
- Verani JR, Baqui AH, Broome CV, Cherian T, Cohen C, Farrar JL, et al. Case-control vaccine effectiveness studies: preparation, design, and enrollment of cases and controls. Vaccine. 2017;35(25):3295–302.
- Verani JR, Baqui AH, Broome CV, Cherian T, Cohen C, Farrar JL, et al. Case-control vaccine effectiveness studies: data collection, analysis and reporting results. Vaccine. 2017;35(25):3303–8.