Резюме
Предусловия
Каждый год примерно 15 миллионов детей рождаются преждевременно. Дефицит микроэлементов, в том числе дефицит витамина D (ДВД), распространен во многих странах с низким и средним уровнем дохода (СНСД), и эти состояния часто связаны с неблагоприятными последствиями беременности. В Народной Республике Бангладеш наблюдается высокий уровень распространенности ДВД. В стране также высокий уровень преждевременных родов (ПВР). Используя данные популяционной когорты беременных, мы оценили бремя ДВД во время беременности и его связь с преждевременными родами.
Методы
Беременные женщины (N = 3 000) были включены в исследование после подтверждения срока беременности с помощью ультразвукового исследования на 8-19 неделе гестации. Подготовленные медицинские работники проспективно собирали фенотипические и эпидемиологические данные во время запланированных домашних визитов. Подготовленные флеботомисты собирали образцы материнской крови во время регистрации и на 24-28 неделе гестации. Аликвоты сыворотки хранили при -800 С. Мы провели вложенные исследования “случай-контроль” со всеми ПВР (n = 262) и случайной выборкой доношенных родов (n = 668). Результат, ПВР, определялся как рождение живого ребенка на сроке гестации < 37 недель по данным ультразвукового исследования. Основным фактором влияния были концентрации витамина D в образцах крови матерей на 24-28 неделе беременности. Анализ был скорректирован на другие факторы риска ПВР. Женщины были распределены на категории ДВД (самый низкий квартиль 25(OH)D; < = 30,25 нмоль/л) или без дефицита (верхние три квартиля 25(OH)D; > 30,25 нмоль/л). Мы использовали логистическую регрессию для определения связи ДВД с ПВР с поправкой на потенциальные мешающие факторы (конфаундеры).
Результаты
Среднее значение и интерквартильный размах сывороточного 25(OH)D составляли 38,0 нмоль/л; от 30,18 до 48,52 (нмоль/л). После поправки на ко-переменные, ДВД был достоверно связан с ПВР [скорректированное отношение шансов (сОШ) = 1,53, 95% доверительный интервал (ДИ) = 1,10 – 2,12]. Риск ПВР также был выше среди женщин более низкого роста (сОШ = 1,81, 95% ДИ: 1,27-2,57), первородящих (сОШ = 1,55, 95% ДИ = 1,12 – 2.12), пассивные курильщики (сОШ = 1,60, 95% ДИ = 1,09 – 2,34), а также те, кто получал препараты железа во время беременности (сОШ = 1,66, 95% ДИ: 1,17, 2,37).
Заключение
ДВД часто встречается у беременных женщин из Народной Республики Бангладеш и ассоциируется с повышенным риском ПВР.
Предусловия
Во всем мире ежегодно преждевременно рождаются около 15 миллионов детей, и эта цифра продолжает расти. Преждевременные роды (рождение до 37 полных недель гестации) и их осложнения являются основной причиной неонатальной смертности [1, 2] и смертности среди детей в возрасте до 5 лет, на которую приходится примерно один миллион детских смертей ежегодно [3, 4]. Многие преждевременно рожденные дети, которые выживают, остаются с инвалидностью на всю жизнь, включая проблемы с обучением, а также проблемы со зрением и слухом [5]. Страны с низким и средним уровнем дохода (СНСД), такие как страны Юго-Восточной Азии и Африки к югу от Сахары, имеют значительно более высокое бремя преждевременных родов (ПВР) [6] Данные о ПВР в Бангладеш на национальном уровне отсутствуют. На основе моделирования Chawanpaiboon S. и соавт. подсчитали, что уровень преждевременных родов в Бангладеш составляет 19,1% [7].
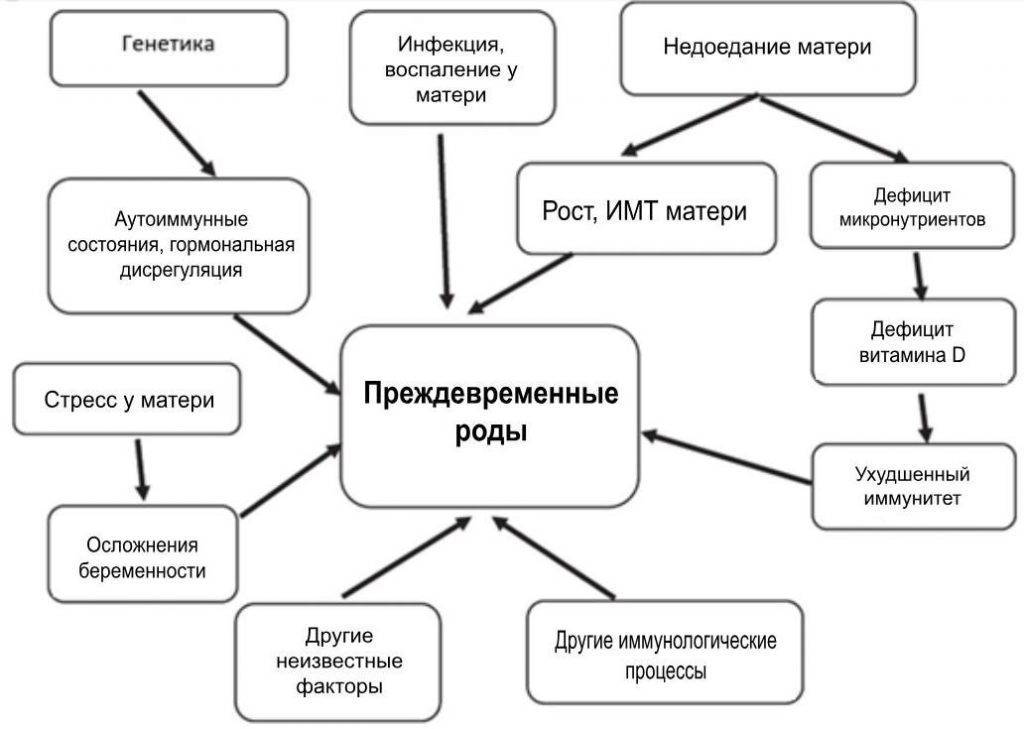
Выявление маркеров, которые коррелируют с ПВР, может помочь снизить уровень детской заболеваемости и смертности. ПВР имеет многофакторное происхождение, частично связанное с иммунологическими, генетическими, пищевыми и экологическими факторами [8,9,10]. Другие факторы включают инфекцию или воспаление, осложнения беременности, включая маточно-плацентарную недостаточность кровоснабжения или кровотечение, предыдущие преждевременные роды, пародонтоз, перерастяжение матки, стресс и другие иммунологически опосредованные процессы [11, 12]. На рисунке 1 показаны факторы, связанные с преждевременными родами, и возможные пути их возникновения. Принадлежность этих факторов еще недостаточно выяснена.
Рисунок. 1
Концептуальные принципы: факторы, связанные с преждевременными родами, и возможные пути их преодоления
Дефицит микроэлементов, включая дефицит витамина D (ДВД), является распространенным явлением при многих СНСД, и этот дефицит часто ассоциируется с неблагоприятными последствиями беременности [13, 14]. Беременные женщины имеют повышенную потребность в микроэлементах, а дефицит микроэлементов у матери может привести к осложнениям [15]. Витамин D является важным микроэлементом, который регулирует метаболизм кальция и фосфора; он необходим для построения костей. Он также является необходимой частью врожденной иммунной системы, поскольку способствует выработке антимикробных пептидов [16]. Недостаточное потребление витамина D с пищей, состояния, не позволяющие коже вырабатывать достаточное количество витамина D, и другие факторы, препятствующие метаболизму или всасыванию витамина D, могут способствовать возникновению ДВД [17]. Современная литература, изучающая связь между ДВД и ПВР, является противоречивой. В некоторых исследованиях было обнаружено, что низкая концентрация витамина D у матери коррелирует с неблагоприятными последствиями беременности, включая ПВР, низкую массу тела при рождении, гестационный диабет и преэклампсию [18,19,20,21,22,23]. Однако другие исследования не выявили такой связи [24, 25].
В Бангладеш очень распространена ДВД: от 66% до 94,2% взрослых женщин детородного возраста испытывают этот дефицит [26]. В Бангладеш также наблюдается один из самых высоких показателей ПВР [7]. По данным систематического обзора, опубликованного в журнале Lancet Global Health, Бангладеш входит в пятерку стран с наибольшим количеством случаев ПВР [7]. На Индию, Китай, Нигерию, Бангладеш и Индонезию приходится 57,9 млн (41,4%) из 139-9 млн рождений живых детей и 6,6 млн (44,6%) из 14,8 млн ПВР по всему миру в 2014 году [7, 27, 28]. Высокое бремя ДВД, так же как и ПВР в Бангладеш, делает эту страну подходящим местом для дальнейшего исследования того, существует ли корреляция между этими двумя явлениями. В этом исследовании мы имели целью изучить взаимосвязь между концентрацией 25(OH)D в сыворотке крови и ПВР среди беременных женщин в сельской местности Бангладеш.
Методы
Структура исследования, условия и данные
Это вложенное исследование “случай-контроль”, в котором используются данные популяционной когорты беременных женщин и их детей; исследование известно под названием “Альянс за улучшение здоровья матерей и новорожденных” (AMANHI). В рамках AMANHI мы создали биорепозиторий и зарегистрировали 3 000 беременных женщин в период с 2014 по 2018 год в двух подрайонах района Силхет на северо-востоке Бангладеш и наблюдали за ними до 42-60-го дня после родов. Детали методологии исследования были опубликованы ранее [29]. Подготовленные работники здравоохранения на уровне общины (РЗО) с образованием не ниже десяти классов собирали данные после получения письменного информированного согласия. Беременность выявляли во время 2-месячных визитов к женщинам домой и подтверждали с помощью полосочных тестов на беременность, которые проводили РЗО, а срок беременности определяли с помощью ультразвукового сканирования, которое проводили квалифицированные врачи-ультрасонологи между 8 и 19 неделями гестации. РЗО осуществили три антенатальных визита домой (на 8-19 неделе, 24-28 неделе и 32-36 неделе беременности) и два послеродовых визита домой (до 7 дней и на 42-60 дни беременности). Во время этих визитов РЗО собирали подробную фенотипическую, социально-демографическую и эпидемиологическую информацию от беременных женщин.
Забор образцов
Образцы материнской крови отбирали дважды во время беременности (8-19 недель и 24-28 недель или 32-36 недель беременности) и один раз в послеродовой период (42-60 дней после родов). Вторая выборка во время беременности была собрана примерно у 75% случайно отобранных женщин. Третий образец был собран у женщин, которые не были отобраны для второго исследования. Образцы крови собирали квалифицированные флеботомисты в исследуемой клинике, а образцы сыворотки отделяли центрифугированием, аликвотировали и хранили при температуре -80 ℃ по стандартным процедурам [30].
Популяция, клинические случаи и контроль
В этом исследовании мы рассмотрели всех женщин, которые сдали второй антенатальный забор крови (n = 2 287), имели по крайней мере один антенатальный и один послеродовой визит и данные об исходе беременности (n = 2 075), а также родили живых детей (n = 2 014). В этом вложенном исследовании “случай-контроль” все женщины, перенесшие ПВР (между 24 и < 37 неделями гестации), были включены как клинические случаи (n = 263), а случайная выборка доношенных родов была включена в качестве контроля (n = 671). Уровень витамина D измеряли только в основных и контрольных группах. Измерение уровня витамина D отсутствовало у одной пациентки и трех матерей из контрольной группы; эти матери были исключены из анализа. Таким образом, в анализ было включено 262 клинических случая и 668 женщин из контрольной группы (рисунок 2).
Рисунок 2
Блок-схема исследования
Анализ на уровень витамина D
Замороженные образцы сыворотки были переданы для анализа в лабораторию иммунобиологии, питания и токсикологии Международного центра исследований диарейных заболеваний Бангладеш (icddr,b). Концентрацию 25(OH)D в сыворотке крови измеряли методом (электро-) хемилюминесцентного иммуноферментного анализа (ECLIA) на автоматическом иммуноферментном анализаторе Cobas e601 компании Roche с использованием коммерческого набора (Roche Diagnostics, GmbH, 68305 Mannheim, Germany) в соответствии с инструкцией производителя. Метод определения витамина D был стандартизирован с помощью LC MS/MS, который, в свою очередь, был стандартизирован по стандарту NIST. Диапазон измерения 25(OH)D составлял 7,50-175 нмоль/л. Коммерческий контроль на основе человеческой сыворотки в двух диапазонах концентраций проводился в каждой партии/день для мониторинга точности и прецизионности этого анализа.
Измерение
Результат, ПВР, определялся как рождение живых детей в сроке гестации < 37 недель по данным ультразвукового исследования. Основным фактором влияния были концентрации витамина D в образцах крови матерей на 24-28 неделе беременности. Используя концентрацию 25(OH)D в сыворотке крови, мы распределили женщин на квартили [самый низкий квартиль (≤ 30,25 нмоль/л), 3-й квартиль (30,25-37,99 нмоль/л), 2-й квартиль (38,0-48,52 нмоль/л) и самый высокий квартиль (≥ 48,53 нмоль/л)]. Таблица 1 показала, что около 75% женщин имели недостаточный уровень витамина D (< 48,53 нмоль). Затем мы проанализировали связь концентрации витамина D с первичным результатом – ПВР – и обнаружили, что по сравнению с самым высоким квартилем витамина D, все остальные квартили имели более высокий риск ПВР, но риски были лишь незначительно выше во втором и третьем квартилях. Самый низкий квартиль имел на 67% значительно более высокий риск ПВР. Затем мы объединили три верхних квартиля витамина D как “без дефицита” [25(OH)D ≥ 30,25 до ≥ 48,53 нмоль/л], а самый низкий квартиль – как “дефицит витамина D” [25(OH)D ≤ 30,25 нмоль/л]. Мы использовали эти две категории во всех дальнейших анализах (Таблица 1).
Таблица 1 Связь между преждевременными родами и концентрацией витамина D
| В целом
N = 930 (%) |
Срок
n = 668 (%) |
Преждевременные
n = 262 (%) |
ОШ(95% ДИ) | P-value | |
| Концентрация 25(OH)D (квартили) | |||||
| Самый высокий квартиль (≥ 48,53 нмоль/л) | 232 (25.0) | 177 (26.5) | 56 (21.4) | Реф | |
| 2-й квартиль (38,0-48,52 нмоль/л) | 233 (25.0) | 172 (25.8) | 60 (22.9) | 1.13 (0.74–1.72) | 0.574 |
| 3-й квартиль (30,25-37,99 нмоль/л) | 232 (25.0) | 167 (25.0) | 66 (25.2) | 1.24 (0.82–1.88) | 0.306 |
| Нижний квартиль (≤ 30,25 нмоль/л) | 233 (25.0) | 152 (22.8) | 80 (30.5) | 1.67 (1.12–2.51) | 0.013 |
| Концентрации 25(OH)D (две категории) | |||||
| Не имеет дефицита (верхние три квартили) | 697 (75%) | 516 (77.2) | 182 (69.5) | Реф | |
| Дефицит (самый низкий квартиль) | 233 (25%) | 152 (22.8) | 80 (30.5) | 1.49 (1.08–2.05) | 0.014 |
Возраст матери делился на < 30 и ≥ 30 лет. Паритет делился на 0/нет детей, 1-3 и ≥ 4 детей. Образование матери и отца делилось на 0-5 лет и > 5 лет обучения. Рост матери делился на рост < 145 см и > = 145 см. Индекс перенаселенности домовладений рассчитывался путем деления количества человек на количество спальных комнат. Затем мы классифицировали переполненность домовладения на < = 2 и > 2. Используя анализ главных компонент, мы рассчитали баллы состоятельности домовладения на основе жилищных условий и имущества домовладения. Домовладения были распределены на тертили по уровню благосостояния.
Размер выборки и статистический анализ
Поскольку количество случаев было фиксированным, используя формулу Келси и соавт. [31] для расчета размера выборки для несравнимого исследования “случай-контроль”, мы рассчитали количество контрольных групп, необходимых для определения отношения шансов 1,5, с такими параметрами: доля контрольных групп с экспозицией = 20%; доля случаев с экспозицией = 30%; двусторонний доверительный интервал = 95% и мощность = 80%. Количество контролей, необходимых для каждого случая, составляло 2,5. Соответственно, мы отобрали 671 контрольную группу для 262 случаев.
Мы провели две серии двумерного анализа с использованием критерия хи-квадрат Пирсона для проверки независимости. Во-первых, мы исследовали связь концентрации витамина D (дефицит или отсутствие дефицита) с возрастом матери, образованием, профессией, ростом матери, употреблением табака, образованием мужа, профессией мужа, перенаселенностью домовладений и индексом благосостояния семей. Во второй серии двумерного анализа мы исследовали связь между преждевременными или доношенными родами ребенка и концентрацией витамина D и отдельными социально-экономическими, демографическими и медицинскими характеристиками матерей, обращающихся за помощью. Многомерная логистическая регрессия была использована для расчета нескорректированных и скорректированных отношений шансов (сОШ) и 95% доверительных интервалов (ДИ) для выявления факторов, которые существенно ассоциируются с ПВР. Переменные с р-значением < 0,2 в двумерном анализе с ПВР были включены в многофакторную логистическую регрессионную модель. Для анализа данных использовали программу Stata V.17 (StataCorp 2017).
Результаты
Связь концентрации витамина D в сыворотке крови матери с отдельными характеристиками матерей и домовладений представлена в Таблице 2. Возраст матери, образование и многодетность домовладения были значимо связаны с концентрацией витамина D в сыворотке крови. Молодые матери в возрасте <30 лет и матери с образованием > 5 лет чаще имели дефицит витамина D (таблица 2).
Таблица 2 Распределение концентрации витамина D в сыворотке крови матерей по отдельным характеристикам матерей и домовладений
| Признак | Концентрация витамина D | P-value | ||
| Общая | Без дефицита | Дефицит | ||
| N = 930 | n = 698 (%) | n = 232 (%) | ||
| Возраст матери в годах | ||||
| < 30 | 816 | 602 (86.2) | 214 (92.2) | 0.016 |
| ≥ 30 | 114 | 96 (13.8) | 18 (7.8) | |
| Образование матери | ||||
| 0–5 лет | 433 | 353 (50.6) | 80 (34.5) | 0.001 |
| > 5 лет | 497 | 345 (49.4) | 152 (65.5) | |
| Род занятий матери | ||||
| Домохозяйка | 910 | 684 (98.0) | 226 (97.4) | 0.597 |
| Работает / трудоустроена | 20 | 14 (2.0) | 6 (2.6) | |
| ИМТ матери | ||||
| Рост м | ||||
| < 145 см | 182 | 145 (20.8) | 37 (15.9) | 0.109 |
| ≥ 145 см | 748 | 553 (79.2) | 195 (84.1) | |
| Употребление табака во время беременности | ||||
| Нет (Никогда, Бросила до/во время беременности) | 769 | 580 (83.1) | 189 (81.5) | 0.57 |
| Да (сейчас нюхает/жует) | 161 | 118 (16.9) | 43 (18.5) | |
| Образование отца | ||||
| 0–5 лет | 652 | 499 (71.5) | 153 (65.9) | 0.110 |
| > 5 лет | 278 | 199 (28.5) | 79 (34.1) | |
| Род занятий отца | ||||
| Государственные/частные/самозанятые (возможно, с выездом на место) | 260 | 193 (27.7) | 67 (28.9) | 0.718 |
| Поденная оплата труда/фермерство/другое/не работает (возможно, на улице) | 670 | 505 (72.3) | 165 (71.1) | |
| Наполненность домовладения | ||||
| ≤ 2 | 663 | 485 (69.5) | 178 (76.7) | 0.035 |
| > 2 | 276 | 213 (30.5) | 54 (23.3) | |
| Индекс благополучия БС | ||||
| Самые бедные | 310 | 233 (33.4) | 77 (33.2) | 0.932 |
| Средние | 312 | 232 (33.2) | 80 (34.5) | |
| Самые богатые | 308 | 233 (33.4) | 75 (32.3) | |
В бивариантном анализе концентрация витамина D в сыворотке крови матери, рост матери, наличие родов в анамнезе, прием препаратов железа во время беременности и пассивное курение были связаны со сроком беременности и преждевременными родами ребенка (Таблица 3).
Таблица 3 Распределение преждевременных и доношенных новорожденных по отдельным социально-экономическим, демографическим характеристикам и обращениям матерей за медицинской помощью
| Переменные | В целом | ПВР (< 37 недель) | Срок (≥ 37 недель) | P-value |
| N = 930 | n = 262 (%) | n = 668 (%) | ||
| Концентрация витамина D | ||||
| Не имеет дефицита (верхние три квартили) | 698 | 182 (69.5) | 516 (77.2) | 0.014 |
| Дефицит (самые низкие квартили) | 232 | 80 (30.5) | 152 (22.8) | |
| Пол ребенка | ||||
| Мальчик | 458 | 132 (50.4) | 326 (48.8) | 0.665 |
| Девочка | 472 | 130 (49.6) | 342 (51.2) | |
| Возраст матери в годах | ||||
| < 30 | 816 | 233 (88.9) | 583 (87.3) | 0.489 |
| ≥ 30 | 114 | 29 (11.1) | 85 (12.7) | |
| Образование матери | ||||
| 0–5 лет | 433 | 118 (45.0) | 315 (47.2) | 0.560 |
| > 5 лет | 497 | 144 (55.0) | 353 (52.8) | |
| Рост матери | ||||
| < 145 см | 182 | 70 (26.7) | 112 (16.8) | 0.001 |
| > = 145 см | 748 | 192 (73.3) | 556 (83.2) | |
| Беременность | ||||
| 0/Перша | 302 | 101 (38.5) | 201 (30.1) | 0.023 |
| 1–3 | 519 | 128 (48.9) | 391 (58.5) | |
| ≥ 4 | 109 | 33 (12.6) | 76 (11.4) | |
| Место родов | ||||
| На дому | 238 | 72 (27.5) | 166 (24.9) | 0.408 |
| Лечебное учреждение | 692 | 190 (72.5) | 502 (75.1) | |
| Квалифицированная помощь во время родов | ||||
| Квалифицированный акушер во время родов | 911 | 256 (97.7) | 655 (98.1) | 0.739 |
| Не тренированный | 19 | 6 (2.3) | 13 (1.9) | |
| Прием таблеток железа во время беременности | ||||
| Нет | 250 | 52 (19.8) | 198 (29.6) | 0.002 |
| Да | 680 | 210 (80.2) | 470 (70.4) | |
| Употребление табака во время беременности | ||||
| Нет (Никогда, Бросила до/во время беременности) | 769 | 210 (80.2) | 559 (83.7) | 0.201 |
| Да (сейчас нюхает/жует) | 161 | 52 (19.8) | 109 (16.3) | |
| Пассивное или косвенное курение во время беременности | ||||
| Нет | 197 | 44 (16.8) | 153 (22.9) | 0.04 |
| Да | 733 | 218 (83.2) | 515 (77.1) | |
| Жевание листьев бетеля во время беременности | ||||
| Нет | 543 | 155 (59.2) | 388 (58.1) | 0.764 |
| Да | 387 | 107 (40.8) | 280 (41.9) | |
| Религия | ||||
| Ислам | 808 | 230 (87.8) | 578 (86.5) | 0.609 |
| Другие | 122 | 32 (12.2) | 90 (13.5) | |
| Образование мужчины | ||||
| 0–5 лет | 652 | 188 (71.8) | 464 (69.5) | 0.492 |
| > 5 лет | 278 | 74 (28.2) | 204 (30.5) | |
| Наполненность домовладения | ||||
| < = 2 | 663 | 188 (71.8) | 475 (71.1) | 0.844 |
| > 2 | 267 | 74 (28.2) | 193 (28.9) | |
| Индекс благополучия БС | ||||
| Самые бедные | 310 | 85 (32.4) | 225 (33.7) | 0.924 |
| Средние | 312 | 90 (34.4) | 222 (33.2) | |
| Самые богатые | 308 | 87 (33.2) | 221 (33.1) | |
В нескорректированном логистическом регрессионном анализе, изучавшем факторы, связанные с ПВР, матери с ДВД (ОШ, 95% ДИ: 1,49, 1,08-2,05), рост матери (ОШ, 95% ДИ: 1,81, (1,29-2,54), первые роды (ОШ, 95% ДИ: 1,53, 1,12-2,10), матери с анамнезом пассивного курения во время беременности (ОШ, 95% ДИ: 1,47, 1,02-2,13) и матери, получавшие препараты железа (ОШ, 95% ДИ: 1,70 (1,20-2,40)) имели более высокий риск ПВР (Таблица 4). Риск ПВР, связанный с ДВД, оставался подобным после поправки на другие коварианты, которые были значимыми в бивариантном анализе. ДВД матери ассоциировался с примерно в 1,5 раза более высоким риском ПВР (сОШ, 95% ДИ: 1,53, от 1,10 до 2,12). Риск ПВР был примерно в 2 раза выше у матерей с ростом < 145 см (сОШ, 95% ДИ: 1,81, 1,27-2,57) по сравнению с матерями с ростом > = 145 см (таблица 4). По сравнению с матерями, имевшими 1-3 детей, первенцы имели примерно в 1,5 раза выше риск ПВР (сОШ, 95% ДИ: 1,55, 1,12 -2,12) (таблица 4). У матерей, употреблявших железо во время беременности, риск ПВР был на 66% выше (сОШ, 95% ДИ: 1,66, 1,17-2,37) по сравнению с матерями, которые его не употребляли (таблица 4). По сравнению с матерями, которые не сообщали о пассивном курении, у тех, кто сообщал об этом, риск ПВР был в 1,60 раза (сОШ, 95% ДИ: 1,60, 1,09-2,34) выше (таблица 4).
Таблица 4 Риск преждевременных родов у матерей с дефицитом витамина D после корректировки с учетом сопутствующих переменных
| Признак | Преждевременные роды | |
| Не скорректированное ОШ
95%ДИ |
Скорректированное ОШ
95%ДИ |
|
| Концентрация Вит D | ||
| Не имеет дефицита (верхние три квартили) | Реф | Реф |
| Дефицит (самые низкие квартили) | 1.49 (1.08–2.05) | 1.53 (1.10–2.12) |
| Пол ребенка | ||
| Мальчик | Реф | |
| Девочка | 0.94 (0.71–1.25) | |
| Возраст матери в годах | ||
| < 30 | 1.17 (0.75–1.83) | |
| ≥ 30 | Реф | |
| Образование матери | ||
| 0–5 лет | 0.92 (0.69–1.22) | |
| > 5 лет | Реф | |
| Рост матери | ||
| < 145 см | 1.81 (1.29–2.54) | 1.81 (1.27–2.57) |
| ≥ 145 см | Реф | Реф |
| Беременность | ||
| 0/ Первая | 1.53 (1.12–2.10) | 1.55 (1.12–2.12) |
| 1 до 3 | Реф | Реф |
| ≥ 4 | 1.33 (0.84–2.09) | 1.30 (0.82–2.08) |
| Место родов | ||
| На дому | 1.15 (0.83–1.58) | |
| Лечебное учреждение | Реф | |
| Квалифицированная помощь во время родов | ||
| Квалифицированный акушер во время родов | Реф | |
| Не тренированный | 1.18 (0.44–3.14) | |
| Прием таблеток железа во время беременности | ||
| Нет | Реф | |
| Да | 1.70 (1.20–2.40) | 1.66 (1.17–2.37) |
| Употребление табака во время беременности | ||
| Нет | Реф | |
| Да | 1.27 (0.88–1.83) | |
| Пассивное или косвенное курение во время беременности | ||
| Нет | Реф | Реф |
| Да | 1.47 (1.02–2.13) | 1.60 (1.09–2.34) |
| Жевание листьев бетеля во время беременности | ||
| Нет | Реф | |
| Да | 0.96 (0.72–1.28) | |
| Религия | ||
| Ислам | Реф | |
| Другие | 0.89 (0.58–1.38) | |
| Образование отца | ||
| 0–5 лет | 1.12 (0.81–1.53) | |
| > 5 лет | Реф | |
| Индекс переполненности | ||
| ≤ 2 | Реф | |
| > 2 | 0.97 (0.71–1.33) | |
| Квинтили богатства домохозяйств | ||
| Самые бедные | 0.96 (0.67–1.36) | |
| Средние | 1.03 (0.73–1.46) | |
| Самые богатые | Реф | |
Обсуждение
В популяционном когортном исследовании беременных женщин, за которыми наблюдали в течение раннего послеродового периода в сельской местности Бангладеш, мы задокументировали высокую распространенность дефицита 25(OH)D в сыворотке крови во время второго триместра беременности. Концентрация витамина D < 50 нмоль/л или 20 нг/мл считается дефицитом и ассоциируется с неблагоприятными последствиями [32]. В этом исследовании примерно 3 из 4 беременных женщин из Бангладеш имели концентрацию витамина D < 50 нмоль/л. Для этого анализа мы рассматривали женщин в самом низком квартиле витамина D с уровнем < 30,25 нмоль/л как дефицитных, а остальных женщин – как не дефицитных, хотя женщины во втором и третьем квартилях витамина D также имели тенденцию к более высокому риску ПВР по сравнению с женщинами в самом высоком квартиле витамина D. Таким образом, этот анализ, свидетельствующий о примерно пятидесятипроцентном более высоком риске преждевременных родов (сОШ 1,53 95% ДИ; от 1,10 до 2,12) у женщин с ДВД по сравнению с теми, которые не считались дефицитными, является консервативным.
Кроме ДВД, низкий рост матери, первая беременность, пассивное курение и употребление железа во время беременности также были достоверно связаны с повышенным риском ПВР. Значительно более высокий риск ПВР среди женщин, употреблявших железо во время беременности, является контринтуитивным. Более раннее исследование, проведенное в той же популяции, выявило подобный результат [33]. Преимущества применения препаратов железа во время беременности в популяции с дефицитом железа хорошо известны [34]. Результаты систематического обзора, который включал 48 рандомизированных исследований и 44 когортных исследования, выявили значительное влияние пренатального потребления железа на снижение риска низкого веса при рождении (ОШ: 0,81; 95% ДИ: 0,71, 0,93), но влияние на преждевременные роды не было значимым (ОШ: 0,84; 95% ДИ: 0,68, 1,03) [34]. Существуют также доказательства того, что увеличение потребления железа не всегда является полезным. Доступность железа может влиять на тяжесть и хронизацию материнских инфекций и, таким образом, может привести к негативным последствиям беременности, включая преждевременные роды [35], особенно в популяциях с высокой распространенностью материнско-плодовых инфекций.
Наше исследование показало, что у женщин с ДВД повышенный риск развития Псориаза. Однако современная литература о концентрации витамина D и Псориазе противоречива. Некоторые исследования показали связь между ними, а другие – нет. В исследовании, проведенном в Южной Каролине, США, с использованием двух наборов данных Национального института детского здоровья и развития человека (n = 333) и Thrasher Research Fund (n = 154), Wagner и соавт. в 2015 г. обнаружили повышенный риск развития ПВР у женщин с более низкими концентрациями витамина D [36]. Женщины, которые имели концентрацию витамина D < 20 нг / мл в третьем триместре, имели в 3,3 раза больший риск развития ПВР по сравнению с теми, кто имел концентрацию > 40 нг / мл [36].
В ретроспективном когортном исследовании, также проведенном в Южной Каролине, США, McDonnell и соавт. (2017) обнаружили, что беременные женщины, которые имели концентрацию витамина D > 40 нг/мл, имели на 62% более низкий риск развития ПВР по сравнению с женщинами, которые имели концентрацию витамина D < 20 нг/мл [37]. Мета-анализ обсервационных исследований, проведенных с участием 10 098 женщин, также показал повышенный риск ПВР у женщин с концентрацией витамина D < 20 нг/мл (ОШ 1,29, 95% ДИ: 1,16, 1,45) [38].
Однако несколько других исследований не выявили связи между ДВД и ПВР. Проспективное когортное исследование, проведенное Wang S и соавт. (2021) среди 3465 беременных женщин в больнице охраны здоровья матери и ребенка Чжоушань, Чжэцзян, Китай, не выявило значимой связи между ДВД у матерей и риском развития ПВР [39]. Ретроспективное исследование 1641 женщины на юге Китая также не выявило связи [40].
Рандомизированные клинические исследования (РКИ), проведенные с целью оценки того, может ли добавка витамина D для тех, кто имеет его дефицит, уменьшить частоту ПВР, также оказались неубедительными. Sablok и соавт. (2015) провели РКИ с участием 180 беременных женщин в Дели, Индия, и обнаружили 8,3% случаев ПВР среди женщин, получавших витамин D, по сравнению с 21,1% среди тех, кто не получал витамин D [41]. Rostami и соавт. (2018) провели стратифицированное рандомизированное исследование среди 2 500 иранских женщин и обнаружили на 40% (95% ДИ, от 0,40 до 0,80) более низкую частоту ПВР у женщин, получавших дополнительно витамин D [42]. Однако другое рандомизированное контролируемое исследование, проведенное Hossain и соавт. в 2014 году в университетской больнице в Карачи, Пакистан, не выявило эффекта. В этом исследовании 207 беременных женщин, одна группа получала сульфат железа и кальций, а другая – 4 000 МЕ витамина D3. Хотя концентрация витамина D повысилась как у матери, так и у ребенка, получавших добавки, не было выявлено существенной разницы в частоте возникновения ПВР [43]. Mojibian и соавт. (2015) провели рандомизированное клиническое исследование с участием 500 беременных женщин (12-16 недель) с дефицитом витамина D и не увидели существенной разницы в частоте ПВР между теми, кто получал 400 МЕ витамина D ежедневно, и теми, кто получал 50 000 МЕ витамина D каждые 2 недели [44]. Причиной таких противоречивых результатов в различных исследованиях, вероятно, является многофакторность, включая различные структуры исследований, разницу во времени измерения уровня витамина D, распространенность дефицита витамина D и ПВР в исследуемой популяции, а также различные географические регионы и расовые группы. РКИ, в которых не было выявлено никаких преимуществ по снижению ПВР при применении добавок, имели относительно небольшой размер выборки. Дальнейшие РКИ с большим количеством беременных женщин в популяции с дефицитом витамина D могут помочь выяснить, могут ли добавки для матерей помочь снизить частоту ПВР.
Механизм возникновения дефицита витамина D у матерей и ПВР до конца не выяснен. Однако недавние исследования предложили несколько путей, включая оксидативный стресс, дисбаланс в регуляции воспалительного ответа и нарушение функции плаценты во время беременности [45, 46]. Yamada и соавт. (2020) выдвинули гипотезу, что женщины с ДВД могут иметь повышенный риск развития ПВР из-за дерегуляции иммунного ответа [47]. Улучшение материнского статуса витамина D может действовать из-за снижения риска инфекций, включая бактериальный вагиноз, который был причастен к причинам преждевременных родов [48].
Сильной стороной исследования является его популяционный проспективный дизайн. Основная переменная результата, ПВР, базировалась на определении срока беременности с помощью ультразвукового исследования на ранних сроках беременности, которое проводили квалифицированные врачи ультразвуковой диагностики. Таким образом, классификация доношенных/недоношенных беременностей была более точной по сравнению с классификацией на основе даты последней менструации. Исследование также имеет несколько ограничений. Это исследование “случай-контроль”, которое может быть подвержено предвзятости и путанице [49]. Поскольку мы собирали данные проспективно со всей когорты, используя одинаковые методы, предвзятость, если она есть, должна быть минимальной [50]. Другим ограничением является то, что мы не имели данных обо всех возможных факторах риска развития ПВР.
Заключение
Исследование показало высокую распространенность ДВД у беременных женщин Бангладеш, а также то, что эти женщины имели повышенный риск развития ПВР. Эти результаты исследования “случай-контроль” следует интерпретировать с осторожностью, чтобы сделать вывод о причинно-следственной связи. Необходимы дополнительные исследования, как обсервационные для дальнейшего изучения связи между ДВД и риском ПВР, так и рандомизированные исследования для изучения пользы применения добавок.
Аббревиатуры
СНСД:
Страны с низким и средним уровнем дохода
ПВР:
Преждевременные роды
ОШ:
Отношение шансов
ДИ:
Доверительный интервал
AMANHI:
Альянс за улучшение здоровья матерей и новорожденных
РЗО:
Подготовленные работники здравоохранения на уровне общины
icddr,b:
Международный центр исследований диарейных заболеваний Бангладеш
ECLIA:
Иммуноферментный анализ
ГВ:
Гестационный возраст
ИМТ:
Индекс массы тела
сОШ:
Скорректированное отношение шансов
NICHD:
Национальный институт охраны здоровья ребенка и развития человека
РКИ:
Рандомизированное клиническое исследование
Ссылки на источники
- Liu L, Oza S, Hogan D, Perin J, Rudan I, Lawn JE, et al. Global, regional, and national causes of child mortality in 2000–13, with projections to inform post-2015 priorities: an updated systematic analysis. Lancet. 2015;385(9966):430–40.
- Harrison MS, Goldenberg RL. Global burden of prematurity. Semin Fetal Neonatal Med. 2016;21(2):74–9.
- Dimes Mo, PMNCH, Children St, WHO. Born too soon: the global action report on preterm birth. Geneva: World Health Organization; 2020. https://www.marchofdimes.org/materials/born-too-soon-the-global-action-report-on-preterm-.pdf.
- Perin J, Mulick A, Yeung D, Villavicencio F, Lopez G, Strong KL, et al. Global, regional, and national causes of under-5 mortality in 2000–19: an updated systematic analysis with implications for the Sustainable Development Goals. Lancet Child Adolesc Health. 2022;6(2):106–15.
- Blencowe H, Cousens S, Chou D, Oestergaard M, Say L, Moller AB, et al. Born too soon: the global epidemiology of 15 million preterm births. Reprod Health. 2013;10 Suppl 1(Suppl 1):S2.
- Walani SR. Global burden of preterm birth. Int J Gynaecol Obstet. 2020;150(1):31–3.
- Chawanpaiboon S, Vogel JP, Moller AB, Lumbiganon P, Petzold M, Hogan D, et al. Global, regional, and national estimates of levels of preterm birth in 2014: a systematic review and modelling analysis. Lancet Glob Health. 2019;7(1):e37–46.
- Romero R, Espinoza J, Kusanovic JP, Gotsch F, Hassan S, Erez O, et al. The preterm parturition syndrome. BJOG. 2006;113 Suppl 3(Suppl 3):17–42.
- Beck S, Wojdyla D, Say L, Betran AP, Merialdi M, Requejo JH, et al. The worldwide incidence of preterm birth: a systematic review of maternal mortality and morbidity. Bull World Health Organ. 2010;88(1):31–8.
- Institute of Medicine Committee on Understanding Premature B, Assuring Healthy O. The National Academies Collection: Reports funded by National Institutes of Health. In: Behrman RE, Butler AS, editors. Preterm Birth: Causes, Consequences, and Prevention. Washington (DC): National Academies Press (US); 2007. Copyright © 2007, National Academy of Sciences.
- Goldenberg RL, Culhane JF, Iams JD, Romero R. Epidemiology and causes of preterm birth. The Lancet. 2008;371(9606):75–84.
- Zhang G, Jacobsson B, Muglia LJ. Genetic Associations with Spontaneous Preterm Birth. N Engl J Med. 2017;377(24):2401–2.
- Darnton-Hill I, Mkparu UC. Micronutrients in pregnancy in low- and middle-income countries. Nutrients. 2015;7(3):1744–68.
- Gernand AD, Schulze KJ, Stewart CP, West KP Jr, Christian P. Micronutrient deficiencies in pregnancy worldwide: health effects and prevention. Nat Rev Endocrinol. 2016;12(5):274–89.
- Kanasaki K, Kumagai A. The impact of micronutrient deficiency on pregnancy complications and development origin of health and disease. J Obstet Gynaecol Res. 2021;47(6):1965–72.
- Bartley J. Vitamin D: emerging roles in infection and immunity. Expert Rev Anti Infect Ther. 2010;8(12):1359–69.
- Holick MF. Vitamin D deficiency. N Engl J Med. 2007;357(3):266–81.
- Palaniswamy S, Williams D, Järvelin MR, Sebert S. Vitamin D and the promotion of long-term metabolic health from a programming perspective. Nutr Metab Insights. 2015;8(Suppl 1):11–21.
- Chen YH, Fu L, Hao JH, Wang H, Zhang C, Tao FB, et al. Influent factors of gestational vitamin D deficiency and its relation to an increased risk of preterm delivery in Chinese population. Sci Rep. 2018;8(1):3608.
- Baczyńska-Strzecha M, Kalinka J. Assessment of correlation between vitamin D level and prevalence of preterm births in the population of pregnant women in Poland. Int J Occup Med Environ Health. 2017;30(6):933–41.
- Kalinjuma AV, Darling AM, Sudfeld CR, Mugusi F, Wright J, Abioye AI, et al. Vitamin D Concentration during Early Pregnancy and Adverse Outcomes among HIV-Negative Women in Dar-es-Salaam, Tanzania: A Case-Control Study. Nutrients. 2019;11(12):2906.
- Miliku K, Vinkhuyzen A, Blanken LM, McGrath JJ, Eyles DW, Burne TH, et al. Maternal vitamin D concentrations during pregnancy, fetal growth patterns, and risks of adverse birth outcomes. Am J Clin Nutr. 2016;103(6):1514–22.
- Amegah AK, Klevor MK, Wagner CL. Maternal vitamin D insufficiency and risk of adverse pregnancy and birth outcomes: a systematic review and meta-analysis of longitudinal studies. PLoS One. 2017;12(3):e0173605.
- Yang L, Pan S, Zhou Y, Wang X, Qin A, Huang Y, et al. The correlation between serum vitamin D deficiency and preterm birth. Med Sci Monit. 2016;22:4401–5.
- Agarwal S, Kovilam O, Agrawal DK. Vitamin D and its impact on maternal-fetal outcomes in pregnancy: a critical review. Crit Rev Food Sci Nutr. 2018;58(5):755–69.
- Islam MZ, Bhuiyan NH, Akhtaruzzaman M, Allardt CL, Fogelholm M. Vitamin D deficiency in Bangladesh: a review of prevalence, causes and recommendations for mitigation. Asia Pac J Clin Nutr. 2022;31(2):167–80.
- Purisch SE, Gyamfi-Bannerman C. Epidemiology of preterm birth. Semin Perinatol. 2017;41(7):387–91.
- Vogel JP, Chawanpaiboon S, Moller AB, Watananirun K, Bonet M, Lumbiganon P. The global epidemiology of preterm birth. Best Pract Res Clin Obstet Gynaecol. 2018;52:3–12.
- Baqui AH, Khanam R, Rahman MS, Ahmed A, Rahman HH, Moin MI, et al. Understanding biological mechanisms underlying adverse birth outcomes in developing countries: protocol for a prospective cohort (AMANHI bio-banking) study. J Glob Health. 2017;7(2):021202.
- Aftab F, Ahmed S, Ali SM, Ame SM, Bahl R, Baqui AH, et al. Cohort Profile: The Alliance for Maternal and Newborn Health Improvement (AMANHI) biobanking study. Int J Epidemiol. 2022;50(6):1780–1.
- Jennifer KL, Alice WS, Alfred ES, Douglas TW. Methods in Observational Epidemiology 2nd Edition, Table 12–15. New York Oxford: Oxford University Press; 1996.
- Amrein K, Scherkl M, Hoffmann M, Neuwersch-Sommeregger S, Köstenberger M, TmavaBerisha A, et al. Vitamin D deficiency 2.0: an update on the current status worldwide. Eur J Clin Nutr. 2020;74(11):1498–513.
- Shah R, Mullany LC, Darmstadt GL, Mannan I, Rahman SM, Talukder RR, et al. Incidence and risk factors of preterm birth in a rural Bangladeshi cohort. BMC Pediatr. 2014;14:112.
- Haider BA, Olofin I, Wang M, Spiegelman D, Ezzati M, Fawzi WW. Anaemia, prenatal iron use, and risk of adverse pregnancy outcomes: systematic review and meta-analysis. BMJ. 2013;346:f3443.
- Brabin L, Brabin BJ, Gies S. Influence of iron status on risk of maternal or neonatal infection and on neonatal mortality with an emphasis on developing countries. Nutr Rev. 2013;71(8):528–40.
- Wagner CL, Baggerly C, McDonnell SL, Baggerly L, Hamilton SA, Winkler J, et al. Post-hoc comparison of vitamin D status at three timepoints during pregnancy demonstrates lower risk of preterm birth with higher vitamin D closer to delivery. J Steroid Biochem Mol Biol. 2015;148:256–60.
- McDonnell SL, Baggerly KA, Baggerly CA, Aliano JL, French CB, Baggerly LL, et al. Maternal 25(OH)D concentrations ≥40 ng/mL associated with 60% lower preterm birth risk among general obstetrical patients at an urban medical center. PLoS One. 2017;12(7):e0180483.
- Qin LL, Lu FG, Yang SH, Xu HL, Luo BA. Does maternal vitamin D deficiency increase the risk of preterm birth: a meta-analysis of observational studies. Nutrients. 2016;8(5):301.
- Wang S, Xin X, Luo W, Mo M, Si S, Shao B, et al. Association of vitamin D and gene variants in the vitamin D metabolic pathway with preterm birth. Nutrition. 2021;89:111349.
- Yu L, Guo Y, Ke HJ, He YS, Che D, Wu JL. Vitamin D status in pregnant women in Southern China and risk of preterm birth: a large-scale retrospective cohort study. Med Sci Monit. 2019;25:7755–62.
- Sablok A, Batra A, Thariani K, Batra A, Bharti R, Aggarwal AR, et al. Supplementation of vitamin D in pregnancy and its correlation with feto-maternal outcome. Clin Endocrinol (Oxf). 2015;83(4):536–41.
- Rostami M, Tehrani FR, Simbar M, BidhendiYarandi R, Minooee S, Hollis BW, et al. Effectiveness of prenatal vitamin D deficiency screening and treatment program: a stratified randomized field trial. J Clin Endocrinol Metab. 2018;103(8):2936–48.
- Hossain N, Kanani FH, Ramzan S, Kausar R, Ayaz S, Khanani R, et al. Obstetric and neonatal outcomes of maternal vitamin D supplementation: results of an open-label, randomized controlled trial of antenatal vitamin D supplementation in Pakistani women. J Clin Endocrinol Metab. 2014;99(7):2448–55.
- Mojibian M, Soheilykhah S, FallahZadeh MA, Jannati MM. The effects of vitamin D supplementation on maternal and neonatal outcome: a randomized clinical trial. Iran J Reprod Med. 2015;13(11):687–96.
- Jha RK, Kanyal D, Dhok DA, Butola LK. Need of vitamin d beyond bone: a consise review. Eur J Mol Clin Med. 2021;8(3):1096–109.
- Sultana Z, Maiti K, Aitken J, Morris J, Dedman L, Smith R. Oxidative stress, placental ageing-related pathologies and adverse pregnancy outcomes. Am J Reprod Immunol. 2017;77:e12653. https://doi.org/10.1111/aji.12653.
- Yadama AP, Mirzakhani H, McElrath TF, Litonjua AA, Weiss ST. Transcriptome analysis of early pregnancy vitamin D status and spontaneous preterm birth. PLoS One. 2020;15(1):e0227193.
- Manns-James L. Bacterial vaginosis and preterm birth. J Midwifery Womens Health. 2011;56(6):575–83.
- Verani JR, Baqui AH, Broome CV, Cherian T, Cohen C, Farrar JL, et al. Case-control vaccine effectiveness studies: preparation, design, and enrollment of cases and controls. Vaccine. 2017;35(25):3295–302.
- Verani JR, Baqui AH, Broome CV, Cherian T, Cohen C, Farrar JL, et al. Case-control vaccine effectiveness studies: data collection, analysis and reporting results. Vaccine. 2017;35(25):3303–8.