Резюме
Розвиток людського мозку починається в ембріональному періоді. Харчування матері до зачаття та доступність поживних речовин для ембріона можуть впливати на розвиток мозку в цей критичний період після зачаття та ранньої клітинної диференціації, тим самим впливаючи на ризик неврологічних та поведінкових розладів у нащадків. Однак вивчення цього питання є складним через труднощі з визначенням харчового статусу перед зачаттям, і лише в небагатьох дослідженнях є об’єктивні показники неврологічної візуалізації у дітей. Ми досліджували зв’язок циркулюючих у крові матері сумішей біомаркерів, пов’язаних з поживними речовинами (приблизно за 15 тижнів до зачаття), з поведінковими симптомами дитини (чекліст поведінки дитини (ЧПД), у віці 3 років) в рамках Сінгапурського преконцепційного дослідження та довгострокових наслідків для матері та дитини (S-PRESTO). Дошкільна форма ЧПД оцінює поведінку дитини на основі шкал синдромів та шкал, орієнтованих на Діагностичний і статистичний посібник з психічних розладів (ДСП). Ці шкали включають інтерналізацію проблем, екстерналізацію проблем, тривожність, поширені проблеми розвитку, опозиційну та девіантну поведінку тощо. Ми застосували кластеризацію на основі даних і метод сумішевого моделювання (байєсівська ядерна машинна регресія, БЯМР), щоб врахувати складні, нелінійні залежності між 67 біомаркерами. Ми використовували аналіз декомпозиції ефектів, щоб дослідити потенційну посередницьку роль мікроструктури мозку новонароджених (1-й тиждень), зокрема, індексів орієнтаційної дисперсії (ОДІ) 49 кіркових і підкіркових ділянок сірої речовини. Ми виявили, що вищі рівні поживних речовин, включаючи тіамін, тіамінмонофосфат (ТМФ), піридоксальфосфат, піридоксинову кислоту та піридоксаль, пов’язані з вищим показником за шкалою ЧПД для інтерналізації проблем (можливість апостеріорного включення (МАВ) = 0,768). Зокрема, тіамін незалежно впливав на ЧПД (умовна МАВ = 0,775). Вищий рівень тіаміну в крові матері також асоціювався з нижчим показником ОДІ правого субталамічного ядра (P-value = 0,01), тоді як нижчий показник ОДІ правого субталамічного ядра асоціювався з вищими показниками ЧПД для декількох доменів (P-value < 0,05). Одним із можливих механізмів є неоптимальний метаболізм вільного тіаміну до активного вітаміну В1, але необхідні додаткові дослідження в інших когортах.
Вступ
Найпоширенішими поведінковими проблемами в дитячому та підлітковому віці є тривожність, агресивна поведінка, гіперактивний розлад з дефіцитом уваги (СПАУ) та поширені проблеми розвитку, включаючи розлади аутистичного спектру (РАС) [1, 2]. Такі поведінкові проблеми загалом можна класифікувати як розлади, що інтерналізуються, такі як тривожність, та розлади, що екстерналізуються, такі як агресивна поведінка [1]. Попереднє дослідження показало, що 12,2% і 4,9% сінгапурських дітей молодшого шкільного віку (6-12 років) стикалися з проблемами інтерналізації та екстерналізації відповідно [3], що можна порівняти з глобальними оцінками поширеності [4]. Поведінкові проблеми дітей та підлітків мають значний вплив на доросле життя, включаючи гірші навчальні результати, непрацездатність, вживання наркотиків та інші види адиктивної поведінки [2, 5].
На поведінкові проблеми дітей та підлітків впливають різні фактори, включаючи генетику [6, 7], освіту матері [8], материнську депресію [9], виховання [1] та несприятливе соціально-економічне середовище [1]. Харчовий статус матері до вагітності пов’язаний з перебігом вагітності та станом здоров’я дитини [10], а харчові добавки зазвичай рекомендуються для сприяння кращому перебігу вагітності [11]. Однак незрозуміло, чи може харчовий статус до зачаття впливати на розвиток мозку плода та нащадків і, зрештою, на поведінку дитини, і якщо так, то яким чином. Механізми, що лежать в основі порушень неврологічного розвитку, включають варіації в анатомії, функціонуванні та взаємозв’язках мозку [12, 13]. Дослідження магнітно-резонансної томографії (МРТ) показують, що диференціальні структурні характеристики мозку, які можна виявити навіть у перші два роки життя, можуть лежати в основі порушень неврологічного розвитку[14, 15, 16]. Важливо, що розвиток людського мозку, наприклад, морфологія дендритів, починається в ембріональному періоді [17, 18], що робить важливим розуміння ролі модифікованих впливів навколишнього середовища в цей критичний період. Зокрема, харчування матері до зачаття та доступність поживних речовин для плода можуть впливати на розвиток мозку під час зачаття та ранньої клітинної диференціації [19], тим самим впливаючи на результати неврологічного розвитку нащадків, такі як поведінкові розлади. Однак через складність проспективного спостереження за жінками, які ще не були вагітними, лише в небагатьох дослідженнях вивчався зв’язок біомаркерів преконцепції, окремо або в комбінації, з результатами нейророзвитку дитини [20]. Важливо відзначити, що існуючі дослідження, які виявили зв’язок, не змогли оцінити роль потенційних механізмів, наприклад, через зміни в мікроструктурі мозку нащадків. Отже, багато висновків є опосередкованими, наприклад, кореляції з вагітністю або післяпологовою дієтою чи основним станом здоров’я матері, і не обов’язково вказують на потенційні причинні впливи або періоди для втручання.
Зокрема, попередні дослідження ґрунтувалися на самозвітах про вживання добавок до зачаття або враховували лише об’єктивні біомаркери під час вагітності, на які можуть впливати зміни в раціоні харчування та метаболізмі під час вагітності, або ж вони були надто пізніми, щоб охопити ранній периконцептуальний період. Крім того, дослідження зосереджувалися на біомаркерах ізольовано, не враховуючи їх взаємозалежності, зумовленої особливостями харчування та/або пов’язаними з ним метаболічними шляхами. Щоб вирішити цю проблему, ми використали проспективну когорту вагітних і дітей, щоб дослідити взаємозв’язок між біомаркерами, пов’язаними з харчуванням до зачаття, і поведінковими симптомами дитини, використовуючи нові підходи для врахування кластеризації та взаємозалежності біомаркерів. Для посилення висновків ми додатково дослідили роль мікроструктури головного мозку новонароджених в опосередкуванні таких зв’язків.
Матеріали та методи
Джерело даних
Це дослідження було проведено в рамках когорти Сінгапурського преконцептуального дослідження довгострокових наслідків для матері та дитини (S-PRESTO) [21]. Коротко кажучи, в період з лютого 2015 року по жовтень 2017 року в S-PRESTO було набрано 1032 невагітні жінки віком від 18 до 45 років (середнє значення = 31, стандартне відхилення (СВ) = 3,7) китайської, малайської або індійської етнічної приналежності, які мали намір зачати і народити дитину в Сінгапурі. За учасницями спостерігали до 3 візитів до лікарів з метою зачаття, а через 12 місяців, якщо зачаття не відбулося, вони були виключені з дослідження. Під час візитів перед зачаттям оцінювали базові характеристики, такі як рівень освіти/досягнення, дохід сім’ї та історія хвороби, за допомогою анкет, які заповнював інтерв’юер, а також заповнювали анкети для самооцінки настрою. Важливо, що зразки крові натщесерце були зібрані під час першого візиту до преконцепції.
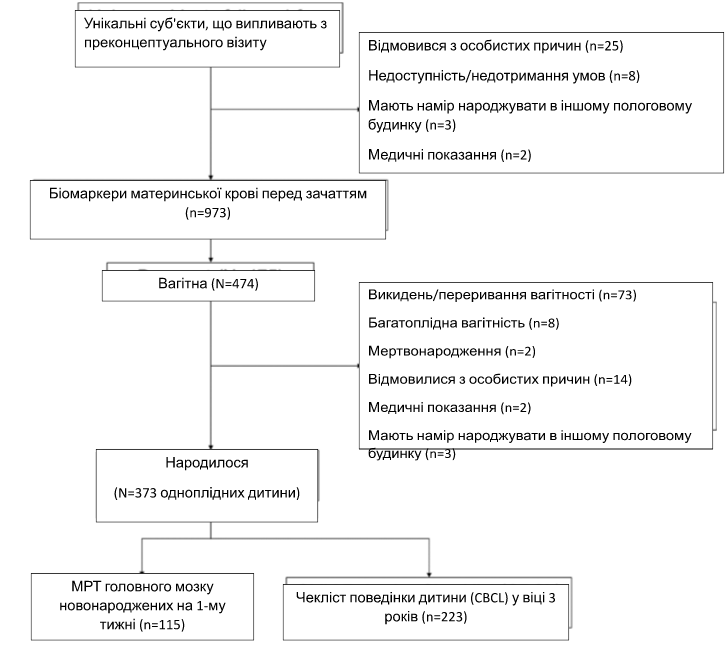
Загалом 475 жінок успішно завагітніли, серед них народилося 373 дитини від одноплідних пологів. Жінки та їхні діти спостерігалися після пологів для збору даних щодо стандартних антропометричних вимірювань, магнітно-резонансної томографії головного мозку та результатів неврологічного розвитку. На зображенні 1 показано блок-схему та розміри вибірки для біомаркерів материнської крові, МРТ головного мозку новонароджених та оцінки поведінки дитини. Від усіх учасників було отримано письмову інформовану згоду. Етичне схвалення було отримано від Централізованої інституційної оглядової ради SingHealth (посилання 2014/692/D) [21].
Зобр. 1: Блок-схема вибірки з проспективного дослідження Сінгапурського дослідження преконцепції довгострокових наслідків материнства та дитинства (S-PRESTO).
Кожна клітинка на блок-схемі вказує на розмір вибірки для даних, зібраних у різні моменти часу, а також на кількість учасників, які були виключені з дослідження.
Біомаркери матері
Рівні 72 біомаркерів, що циркулюють у крові матері, вимірювали за допомогою зразків крові натщесерце, зібраних під час першого візиту до лікаря (n = 973). Сімдесят біомаркерів вимірювали за допомогою добре валідованої мас-спектрометричної платформи (BEVITAL платформи B, C, D і H, https://bevital.no/) у зразках плазми крові з EDTA (Етилендіамінтетраоцтова кислота), яка дозволяє кількісно визначати амінокислоти, вітаміни, ацилкарнітини та інші метаболіти. Інші два біомаркери, кобаламін (вітаміни В12) і фолієву кислоту (вітамін В9), вимірювали за допомогою хемілюмінесцентного імуноаналізу (платформа Beckman) у зразках плазми крові з ЕДТА.
У понад 80% жінок були зафіксовані нульові значення для п’яти біомаркерів преконцепції: нікотинової кислоти, піридоксину, вітаміну D2, котиніну та гідроксикотиніну. Нікотинова кислота, піридоксин і вітамін D2 є формами вітаміну B3, вітаміну B6 і вітаміну D відповідно, які існують в інших формах, що вимірюються у використовуваній платформі. Котинін і гідроксикотинін є метаболітами нікотину, і низькі рівні цих метаболітів пояснюються низьким рівнем куріння серед жінок у Сінгапурі та нашій когорті [22]. Ми виключили ці біомаркери з нашого аналізу. Решта 67 біомаркерів включали 46 метаболітів, 12 мікроелементів і 9 незамінних амінокислот (НАК). Первинні значення були перетворені в натуральний логарифм після додавання одиниці, а результати представлені на одиницю SD природних логарифмічних перетворених даних.
Ми виділили 11 кластерів для 67 біомаркерів преконцепції, використовуючи кластеризацію за методом K-середніх, яка мінімізує суму квадратів всередині кластера [23]. Оскільки метаболіти та мікроелементи можуть представляти різні базові конструкти, наприклад, довгостроковий метаболізм та короткострокові дієтичні патерни відповідно, ми провели аналіз чутливості, враховуючи дві категорії біомаркерів окремо: (1) метаболіти; (2) мікроелементи/ НАК. Ми виділили вісім кластерів для метаболітів перед зачаттям та сім кластерів для мікроелементів та НАК перед зачаттям.
Чекліст поведінки дитини
Опитувальник ЧПД для дітей дошкільного віку, який заповнювали батьки, проводився у віці 3 років, і відповіді були отримані від 223 дітей (середнє значення = 3,1 року, СВ = 0,1 року). Дошкільна форма ЧПД оцінює поведінку дитини на основі синдромних шкал та шкал, орієнтованих на Діагностичний і статистичний посібник з психічних розладів (ДСП). Синдромні шкали складаються з інтерналізації проблем (емоційно реактивна, тривожна/депресивна, соматичні скарги, замкнутість) та екстерналізації проблем (проблеми з увагою та агресивна поведінка), проблем зі сном та загальних проблем. Шкали, орієнтовані на ДСП, включають СПАУ, афективні проблеми, тривожні проблеми, первазивні проблеми розвитку та девіантну поведінку. Первинні бали були перетворені в натуральний логарифм після додавання одиниці, а результати представлені в одиницях стандартного відхилення натурального логарифму балів. Вищий бал за шкалою ЧПД вказує на більші проблеми за кожною шкалою.
Магнітно-резонансна томографія головного мозку новонароджених
Неонатальна МРТ головного мозку була виконана 115 немовлятам протягом першого тижня після народження з використанням 3-Tesla сканера (Magnetom Skyra, Siemens Healthineers, Ерланген, Німеччина). Було отримано дифузійно-зважену послідовність з декількома оболонками. В аналіз було включено 109 немовлят із середньою абсолютною рухомістю менше 3 мм (середня абсолютна рухомість 0,95 мм та міжквартильний розмах 0,69-1,03 мм). Дифузійні зображення були попередньо оброблені за допомогою FMRIB’s Diffusion Toolbox, FSL v6.0.4, і підігнані до моделі Neurite Orientation Dispersion and Density Imaging (NODDI) за допомогою NODDI MATLAB Toolbox v1.05 [24]. NODDI використовує мультисегментарну модель клітинних і позаклітинних відділів кожного вокселя і забезпечує більш біологічно обґрунтоване представлення розвитку мозку [25]. У нашому аналізі ми використовували індекс орієнтаційної дисперсії (ОДІ), розрахований за допомогою моделі NODDI, щоб вказати на кутовий розподіл нейритів (діапазон від 0 до 1). ОДІ 49 зон кіркової та підкіркової сірої речовини були отримані за допомогою масок сегментації з пайплайну проекту розвитку коннектому людини (dHCP, v1.1) [26]. Вище значення ОДІ вказує на вищий ступінь складності дендритів [24]. Дендритні відростки є основними воротами збудливої синаптичної передачі в мозку. Отже, вищий ступінь складності дендритів полегшує передачу інформації між ділянками мозку [27]. І навпаки, нижчий ОДІ, який вказує на нижчий ступінь складності дендритів, може означати порушення передачі інформації між ділянками мозку, що є ймовірним механізмом, який лежить в основі таких порушень неврологічного розвитку, як РАС [18].
Статистичний аналіз
Біомаркери матері перед зачаттям та показники ЧПД нащадків
Серед діад мати-дитина, які мали дані як біомаркерів, так і ЧПД, ми виключили дві діади зі змішаним етнічним походженням. Враховуючи, що біомаркери не діють незалежно, ми застосували метод змішаної регресії (Bayesian kernel machine regression, БЯМР), щоб врахувати складну взаємодію між біомаркерами, досліджуваними в цій науковій роботі [28]. Коротко кажучи, БЯМР використовує ядрове машинне представлення для моделювання високорозмірної поверхні відгуку “експозиція-результат”, припускаючи, що особи зі схожими профілями експозиції мають схожі ризики для здоров’я [28]. Щоб зменшити кількість вхідних даних моделі серед висококорельованих експозицій, БЯМР включає байєсівський відбір змінних. Відбір змінних здійснювався за допомогою алгоритму марковського ланцюга Монте-Карло (МЛМК), а ймовірності апостеріорного включення (МАВs) оцінювалися за допомогою методу усереднення байєсівської моделі. У цьому дослідженні ми розглядали кожен з 15 показників ЧПД окремо і провели основний аналіз для біомаркерів→ЧПД, а також аналіз чутливості для метаболітів→ЧПД і мікроелементів/НАК→ЧПД. Для кожного аналізу ми виконали 60 000 ітерацій МЛМК з 12 незалежними ланцюгами з вигорянням 30 000 ітерацій МЛМК. У кожній ітерації ми припускали, що кожен біомаркер у кластері має однакову ймовірність бути включеним у модель, і що в модель за один раз відбирали тільки один біомаркер з кластера. Параметр вибору змінної оцінювався як функція щільності ймовірності від попереднього розподілу. Ми протестували гамма, рівномірний та обернено рівномірний попередні розподіли. Ефективні розміри вибірки для вибірки МЛМК були невеликими, а потенційні коефіцієнти зменшення масштабу були великими як для гамма, так і для рівномірного розподілу, що свідчить про високу кореляцію вибірок МЛМК і ненадійність оцінок. Тому ми обрали обернений рівномірний розподіл для оцінки параметрів відбору змінних. Враховуючи, що корельовані біомаркери та/або кластери біомаркерів можуть діяти на одних і тих же біологічних шляхах, ми застосували ієрархічний підхід до відбору змінних, який спочатку оцінює можливість апостеріорного включення (МАВ) для кожного кластера біомаркерів (Кластерний МАВ), а потім МАВ між біомаркерами в межах кожного кластера з урахуванням того, що кластер був відібраний в модель (Умовний МАВ). Таким чином, кластерні МАВ та умовні МАВ вказують на частки всіх моделей, в яких були відібрані певні кластери або біомаркери в межах кластера. Ми повідомили про ймовірні асоціації з порогом кластерного МАВ > 0,5 та умовного МАВ > 0,5 і виділили більш вірогідні асоціації, використовуючи поріг кластерного МАВ > 0,75 та умовного МАВ > 0,5. Ми також відфільтрували асоціації-кандидати з ефективним розміром вибірки МЛМК більше 100 і потенційним коефіцієнтом зменшення масштабу менше 1.1 щоб забезпечити надійність нашого аналізу. Потенційний коефіцієнт зменшення масштабу 1.1 вказує на те, що збільшення кількості ітерацій до нескінченності може зменшити ширину інтервалу оцінки на 10% [29].
Для зручності інтерпретації ми використовували моделі для оцінки ефектів як різниці в середньому результаті (показник ЧПД), коли одноразова експозиція була встановлена на рівні, що відповідає 75-му процентилю (спостерігався в дослідженні), порівняно з тим, коли вона була встановлена на рівні 25-го процентиля, тоді як всі інші модельні експозиції були встановлені на рівні їхніх спостережуваних середніх значень [28]. Для порівняння ми також провели стандартну багатовимірну лінійну регресію. Ми виконали лінійну регресію, використовуючи вибірки з повними даними та застосовуючи Зважування зворотної ймовірності (ЗЗЙ), щоб врахувати потенційні зсуви, пов’язані з втратою спостережень. Модель відсутності для ЗЗЙ базувалася на найвищому рівні освіти матері, доході сім’ї, віці матері та індексі маси тіла матері перед зачаттям, оскільки розподіл цих коваріатів відрізнявся між підвибіркою з даними біомаркерів та ЧПД і підвибіркою без таких даних.
Щоб дослідити, чи може етнічна приналежність та соціально-економічний статус (СЕС) змінювати ці асоціації, ми провели БЯМР та лінійні регресії, стратифіковані за (1) етнічною приналежністю матері (китаянка vs малайка; індійці не були включені через малий розмір вибірки); (2) найвищим освітнім рівнем матері (університетський ступінь або вища політехнічна освіта або нижче); та (3) сімейним доходом (група з вищим сімейним доходом (6-10 дециль) vs група з нижчим сімейним доходом (1-6 дециль)).
Преконцепційні материнські біомаркери та МРТ головного мозку новонароджених
Ми також дослідили роль показників МРТ головного мозку новонароджених серед кандидатів асоціацій біомаркерів з ЧПД. Оскільки кількість біомаркерів перевищувала розмір вибірки, доступної для цього аналізу, ми не змогли підібрати моделі БЯМР для цього аналізу. Ми досліджували асоціації біомаркерів з ОДІ та асоціації ОДІ-ЧПД за допомогою лінійної регресії. Спочатку ми дослідили асоціації тіаміну та тіамінмонофосфату (ТМФ) з ОДІ у 49 кіркових та підкіркових ділянках сірої речовини. Тіамін і ТМФ були обрані тому, що вони були найбільш перспективними в основному біомаркерному аналізі – ЧПД. Результати з первинним р-value менше 0,05 в аналізі зв’язку біомаркерів та ОДІ були відібрані для аналізу зв’язку ОДІ-ЧПД. Ми представили як первинні р-value, так і частоту помилкових виявлень (ЧПВ) на кожному етапі аналізу. Крім того, ми провели регресійний аналіз декомпозиції причинно-наслідкових зв’язків [30], щоб оцінити потенційну посередницьку роль показників МРТ в асоціації тіаміну з ЧПД. Цей підхід дозволяє обчислити чисті та сумарні (включаючи взаємодію) прямі ефекти, а також чисті та сумарні (включаючи опосередковану взаємодію) непрямі ефекти [30]. Це дозволяє дослідити як посередництво, так і взаємодію одночасно. Оскільки цей дослідницький аналіз був недостатньо потужним через природу аналізу опосередкування та необхідність мати повні дані про біомаркери, ОДІ та ЧПД, ми зосередилися на 95% ДІ та представили некориговані р-value. Ми оцінювали частку опосередкованого впливу як загальний природний непрямий ефект, поділений на загальний ефект, а відповідний 95% ДІ розраховували за допомогою дельта-методу [31].
Коваріанти
Щоб підвищити точність оцінок і врахувати потенційні перешкоди, ми скоригували коваріанти, пов’язані з впливом та/або результатом, включаючи стать дитини, вік на момент оцінки ЧПД, етнічну приналежність матері, вищу освіту матері, дохід сім’ї, вік матері на момент візиту до лікаря до зачаття, неодруженість, індекс маси тіла (ІМТ) матері до зачаття та гестаційний вік при народженні в Моделі 1. Доходи сімей були розподілені на децилі на основі даних про працевлаштованих членів сімей, які є жителями Сінгапуру, починаючи з найнижчої (менше 1622 сінгапурських доларів на місяць) і закінчуючи найвищою (16 601 сінгапурських доларів і вище на місяць) групою сімей з доходами. У нашому нестратифікованому аналізі ми використовували 10 рівнів доходу сімей як безперервну змінну. У стратифікованому аналізі за СЕС ми розділили дохід сімей на групи сімей з нижчим рівнем доходу (рівні 1-6) та групи сімей з вищим рівнем доходу (рівні 6-10). Сім’ї з рівнем доходу 6 були включені в обидві підгрупи, інакше ми не змогли б провести БЯМР принаймні в одній підгрупі через малий розмір вибірки. Серед матерів, які народжували живих дітей, дохід сім’ї був класифікований як рівень 6 (7424-S$9082) у 25%, рівні 1-6 (нижче S$9083 на місяць) у 60%, і рівні 6-10 (7424 або вище S$ на місяць) у 65%. Хоча харчовий статус перед зачаттям може впливати на психічне здоров’я матері, повідомлялося про двосторонній зв’язок між харчуванням і психічним здоров’ям, а також про посередницький шлях депресивних симптомів у матері, які через нездорове харчування обернено впливають на когнітивні функції дитини [32]. Було більш чітко показано, що більш депресивні та тривожні матері по-різному повідомляють про проблеми з поведінкою дитини [33, 34]. Тому ми додатково скоригували показник психічного здоров’я матері до зачаття дитини. Показник психічного здоров’я матері до зачаття був отриманий на основі опитувальника депресії Бека (BDI-2), Единбурзької шкали післяпологової депресії (EPDS) та опитувальника тривожності (STAI) за допомогою аналізу головних компонент (PCA). Перша головна компонента (PC) з PCA пояснювала 98% дисперсії за всіма трьома опитувальниками і використовувалася для визначення психічного здоров’я матері. Вищий бал свідчить про гірший психічний стан.
Програмне забезпечення для статистичного аналізу
Всі аналізи були виконані за допомогою R 4.1.3. БЯМР-аналіз проводився за допомогою пакету БЯМР, а регресійний аналіз декомпозиції причинно-наслідкових зв’язків – за допомогою пакету regmedint. Всі тести були двосторонніми.
Результати
Описовий аналіз
З 373 жінок, які успішно завагітніли і залишилися в нашій когорті на момент пологів, 322 мали дані про біомаркери пренатального періоду, 109 – дані неонатальних МРТ, а 223 – результати оцінки ЧПД у віці 3 років. У нашому основному аналізі 196 діад мати-дитина мали дані як про біомаркери преконцепції, так і про оцінку ЧПД . Таблиця 1 показує, що діади мати-дитина з біомаркерами пренатальної діагностики та оцінкою ЧПД були схожими за більшістю характеристик, а також без них. Ми також порівняли учасників, які мали дані біомаркерів і ЧПД для аналізу, з тими, хто успішно завагітніли, але були виключені з подальшого спостереження. Ті, хто мав дані про біомаркери та оцінку ЧПД, повідомили про вищий рівень доходу сім’ї. Порівняно з учасницями, які спочатку були набрані, але не завагітніли протягом 12 місяців або були виключені з подальшого спостереження, ті, хто мав дані для цього аналізу, були молодшими, мали вищий рівень освіти, вищий дохід сім’ї, нижчий ІМТ і кращий стан психічного здоров’я до зачаття. Ці фактори були скориговані в подальшому аналізі асоціацій. Медіани та міжквартильні діапазони для досліджуваних біомаркерів були подібними між повною вибіркою та підвибіркою, доступною для аналізу БЯМР та аналізу медіації.
Таблиця 1 Порівняння характеристик між учасницями з даними біомаркерів та ЧПД (серед тих, хто народив живих дітей) та без них
<thclass=”table_head”>КатегоріяНародження дитини без даних біомаркерів та ЧПД Народження дитини з даними біомаркерів та ЧПД P-valuea
| Коваріант | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| N | % | Середнє | СВ | N | % | Середнє | ДІ | |||
| Загалом | 177 | 196 | ||||||||
| Стать дитини | Дівчинка | 79 | 44.6% | 89 | 45.4% | 1 | ||||
| Хлопчик | 93 | 52.5% | 107 | 54.6% | ||||||
| Етнічна приналежність матері | Китаянка | 139 | 78.5% | 146 | 74.5% | 0.129 | ||||
| Індіанка | 10 | 5.6% | 16 | 8.2% | ||||||
| Малайка | 21 | 11.9% | 32 | 16.3% | ||||||
| Змішана етнічна приналежність | 7 | 4.0% | 2 | 1.0% | ||||||
| Найвищий рівень освіти матері | Вища освіта або вище | 125 | 70.6% | 143 | 73.0% | 0.699 | ||||
| Політехнічна освіта або нижче | 52 | 29.4% | 53 | 27.0% | ||||||
| Рівень доходу родини | 145 | 5.8 | 2.1 | 163 | 6.3 | 2.1 | 0.037 | |||
| Вік матері під час візиту до лікаря (років) | 177 | 30.2 | 3.2 | 196 | 30.7 | 3.3 | 0.142 | |||
| Орієнтовна кількість тижнів до вагітності | 166 | 21.9 | 17.2 | 185 | 15.6 | 15.9 | 4.2 × 10–4 | |||
| ІМТ матері до вагітності (кг/м2) | 175 | 23.2 | 4.5 | 194 | 22.8 | 4.0 | 0.402 | |||
| Ніколи раніше не народжувала | Ні | 64 | 36.2% | 76 | 38.8% | 0.710 | ||||
| Так | 112 | 63.3% | 120 | 61.2% | ||||||
| Гестаційний вік при народженні (тижні) | 177 | 38.9 | 1.3 | 196 | 38.8 | 1.4 | 0.333 | |||
| Оцінка психічного здоров’я матері | 123 | 54.3 | 14.2 | 136 | 52.8 | 13.7 | 0.400 |
- ІМТ – індекс маси тіла, ЧПД – чекліст поведінки дитини, СВ- стандартне відхилення.
- a) Р-значення відмінностей між учасницями, які народили живих дітей з даними біомаркерів та ЧПД, та учасницями, які народили живих дітей, але без даних біомаркерів та ЧПД, були оцінені за допомогою критерію хі-квадрат для категоріальних характеристик та за допомогою t-тесту для безперервних характеристик.
b) Рівні доходу сімей були розподілені на рівні 1-10, що вказують на групу сімей з найнижчим та найвищим рівнем доходу на основі когорти SPRESTO. Ми використовували 10 рівнів доходу сімей як безперервну змінну в нашому аналізі.
Материнські біомаркери та показники ЧПД у нащадків
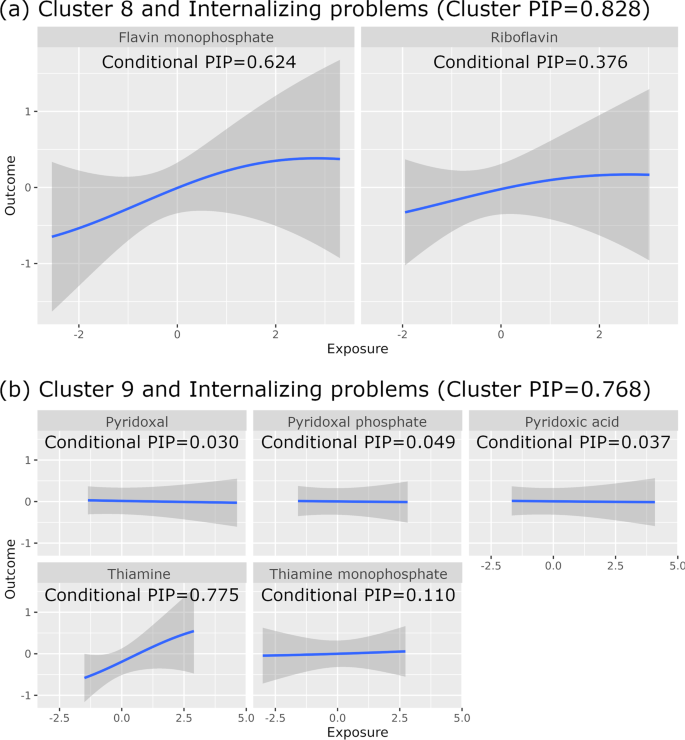
Таблиця 2 показує асоціації з кластерним МАВ більше ніж 0,75 в нашій повністю скоригованій моделі (Модель 2). Флавінмононуклеотид мав найвищий умовний МАВ для позитивного зв’язку кластера біомаркерів 8 (рибофлавін і Флавінмононуклеотид) з проблемами інтерналізації (кластерний МАВ = 0,828, умовний МАВ = 0), а тіамін мав найвищий умовний МАВ для кластера біомаркерів 8 (рибофлавін і Флавінмононуклеотид). 624), а тіамін мав найвищий умовний МАВ для позитивного зв’язку кластера біомаркерів 9 (тіамін, ТМФ, піридоксальфосфат, піридоксинова кислота та піридоксаль) з проблемами інтерналізації (кластерний МАВ = 0,768, умовний МАВ = 0,775). Наведені вище кластерні МАВ вказують на те, що кластери біомаркерів 8 і 9 були обрані у 82,8% і 76,8% ітерацій МЛМК, відповідно. Наведені вище умовні МАВ вказують на те, що Флавінмононуклеотид був обраний у 62,4% ітерацій МЛМК, де був обраний кластер біомаркерів 8, а тіамін був обраний у 77,5% ітерацій МЛМК, де був обраний кластер біомаркерів 9. На зображенні 2 показано лінійні позитивні зв’язки преконцепції Флавінмононуклеотиду і тіаміну з проблемами інтерналізації. Це узгоджується за напрямом впливу з результатами лінійної регресії з повними даними (Таблиця 2), а також лінійної регресії з ЗЗЙ. На основі лінійної регресії з повними даними ми підрахували, що на один СВ вищий рівень logx-трансформованого Флавінмононуклеотиду (що на 36% вище абсолютного рівня флавінмонофосфату) асоціюється з вищим на 0,177 СВ показником за шкалою ЧПД для інтерналізації проблем (що на 16% вище вихідного показника за шкалою ЧПД). Аналогічно, вищий на один СВ рівень logx-трансформованого тіаміну (що еквівалентно на 40% вищому абсолютному рівню тіаміну) асоціювався з вищим на 0,312 СВ балом за шкалою ЧПД для проблем з інтерналізацією (що еквівалентно на 28% вищому вихідному балу за шкалою ЧПД). Сугестивні асоціації з кластерним МАВ більше 0,5 (але менше 0,75) і умовним МАВ <0,5 для одного біомаркера в відповідному кластері. Кластер біомаркерів 8 був позитивно пов’язаний із загальними проблемами (кластерний МАВ = 0,631), соматичними скаргами (кластерний МАВ = 0,583) і тривожними проблемами (кластерний МАВ = 0,557). Кластер біомаркерів 9 позитивно пов’язаний із соматичними скаргами (кластер МАВ = 0,741), тривогою/депресією (кластер МАВ = 0,587), афективними проблемами (кластер МАВ = 0,529) та загальними проблемами (кластер МАВ = 0,529). Біомаркер кластеру 6 (диметилгліцин, холін, метилметакрилат (ММА)) був обернено пов’язаний з інтерналізацією проблем (кластер МАВ = 0,619), тривогою/депресією (кластер МАВ = 0,604), тривожними проблемами (кластер МАВ = 0,544) і загальними проблемами (кластер МАВ = 0,519).
2). Таблиця 2 Зв’язок між рівнями циркулюючих біомаркерів материнської преконцепції та балами за опитувальником дитячої поведінки (ЧПД) (Модель 2).
| Кластер | Біомаркер | ЧПД результат | БЯМРa (N = 109) | Лінійна регресія ( загальні дані, N = 117) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Кластерний МАВ | Умовний МАВ | Приблизний розрахунокb | СП | Бета | СП | P-value | 95% CI | |||
| 8 | Флавінмононуклеотид | Інтерналізація | 0.828 | 0.624 | 0.189 | 0.243 | 0.177 | 0.102 | 0.084 | −0.024 до 0.377 |
| 8 | Рибофлавін | Інтерналізація | 0.828 | 0.376 | 0.115 | 0.217 | 0.182 | 0.093 | 0.049 | 0.001 до 0.364 |
| 9 | Тіамін | Інтерналізація | 0.768 | 0.775 | 0.220 | 0.231 | 0.312 | 0.089 | 5.0 × 10–4 | 0.136 до 0.487 |
| 9 | Тіамінмонофосфат | Інтерналізація | 0.768 | 0.110 | 0.025 | 0.101 | 0.241 | 0.095 | 0.011 | 0.054 до 0.428 |
| 9 | Піридоксальфосфат | Інтерналізація | 0.768 | 0.049 | 0.004 | 0.033 | 0.149 | 0.095 | 0.118 | −0.038 до 0.336 |
| 9 | Піридоксинова кислота | Інтерналізація | 0.768 | 0.037 | 0.003 | 0.028 | 0.146 | 0.090 | 0.105 | −0.030 до 0.323 |
| 9 | Піридоксаль | Інтерналізація | 0.768 | 0.030 | 0.000 | 0.015 | 0.096 | 0.084 | 0.256 | −0.070 до 0.261 |
- БЯМР Байєсівська ядерна машинна регресія, ЧПД Чекліст поведінки дитини, ДІ довірчий інтервал, МАВ можливість апостеріорного включення, Rhat потенційний коефіцієнт зменшення шкали, SE стандартна помилка.
- a) БЯМР-аналіз для кожного результату ЧПД проводився шляхом одночасного врахування 67 біомаркерів (11 кластерів). У цій таблиці представлені асоціації, які відповідають наступним критеріям: (1) МАВ кластера більше 0,75; (2) умовний МАВ для одного біомаркера у відповідному кластері більше 0,5; (3) ефективний розмір вибірки МЛМК більше 100 для всіх біомаркерів у кластері; і (4) ПКЗБ (потенційний коефіцієнт зменшення масштабу) менше 1,1 для всіх біомаркерів у кластері. Модель 2 скоригована на стать дитини, вік на момент оцінки ЧПД, етнічну приналежність матері, вищу освіту матері, дохід сім’ї, вік матері на момент візиту до лікаря перед зачаттям, чи була раніше вагітність, індекс маси тіла матері на момент візиту до лікаря, гестаційний вік при народженні та оцінку психічного здоров’я матері на момент візиту до лікаря.
b) Оцінки ефекту від БЯМР вказують на різницю в середньому результаті, коли окремий вплив фіксується на рівні 75-го процентиля, порівняно з тим, коли він фіксується на рівні 25-го процентиля, коли всі інші впливи фіксуються на рівні їхнього медіанного значення.
Зобр. 2: Взаємозв’язок “вплив-результат” за допомогою Баєсової ядерної машинної регресії (БЯМР) для кластерів біомаркерів та балів за контрольним переліком поведінки дитини (ЧПД) (модель 2, N = 109).
Рівні біомаркерів та бали за шкалою ЧПД вказані в одиницях стандартного відхилення. Сірим кольором позначено 95% довірчий інтервал (МАВ: можливість апостеріорного включення). a Зв’язок кластеру біомаркерів 8 з інтернальними проблемами. b Зв’язок кластеру біомаркерів 9 з інтернальними проблемами.
Аналіз чутливості, що враховує лише метаболіти, також показав припустимий зв’язок між пренатальним ТМФ і проблемами інтерналізації (кластерний МАВ = 0,696, умовний МАВ = 0,683), тоді як аналіз чутливості, що враховує лише мікроелементи та НАК, показав припустимий зв’язок між пренатальним тіаміном і проблемами інтерналізації (кластерний МАВ = 0,719, умовний МАВ = 0,870). Крім того, як для ТМФ, так і для тіаміну було виявлено зв’язок з поширеними проблемами розвитку (ТМФ: кластерний МАВ = 0,893, умовний МАВ = 0,833, тіамін: Кластерний МАВ = 0,946, умовний ПІП = 0,958.
Аналіз, стратифікований за етнічною приналежністю та СЕС з використанням лінійної регресії, показав, що тіамін і ТМФ були пов’язані з інтерналізацією проблем у групі сімей з вищими доходами (βтіамін = 0,361, Птіамін = 0. 001; βТМФ = 0,327, PТМФ = 0,014 у моделі 2), але не в групі з нижчим рівнем доходу сімей (βтіамін = 0,172, Pтіамін = 0,166; βТМФ = 0,082, PТМФ = 0,355 у моделі 2.
Розподіл БЯМР за етнічною приналежністю та СЕС, що враховує всі біомаркери одночасно, не проводився через малий розмір вибірки, необхідний для коригування коваріатів Моделі 2. Тим не менш, у моделі 1 кластер біомаркерів 9 був пов’язаний з інтерналізацією проблем у групі сімей з вищими доходами (кластерний МАВ = 0,818, умовний МАВ для ТМФ = 0,893), але не в групі сімей з нижчими доходами (кластерний МАВ = 0,339, умовний МАВ для ТМФ = 0,306; додаткове зобр. 1).
Преконцепційні материнські біомаркери та показники МРТ
Вищий рівень тіаміну перед вагітністю номінально обернено пов’язаний з неонатальним ОДІ правого субталамічного ядра (N = 56, P-значення = 0,010, ЧПВ (частота помилкових відкриттів) = 0,972, додаткові зобр. 2 і 3). Неонатальний ОДІ правого субталамічного ядра був обернено пов’язаний з кількома показниками ЧПД (N = 37), включаючи проблеми з увагою (P-значення = 0,001, ЧПВ = 0,008), СПАУ (P-значення = 0,005, ЧПВ = 0,041) та проблеми з екстерналізацією (P-значення = 0,012, ЧПВ = 0,062). Аналіз причинно-наслідкових зв’язків показав, що тіамін перед вагітністю номінально пов’язаний із загальними проблемами ЧПД (N = 63, β = 0,551, P = 0,038, 95% ДІ 0,030-1,072 для загального ефекту). Однак справжній (P = 0,856) і загальні (P = 0,909) природні непрямі ефекти через неонатальну ОДІ правого субталамічного ядра для цієї асоціації не були значущими (додаткове зобр. 4). Ми оцінили, що частка, опосередкована неонатальним ОДІ правого субталамічного ядра, становила 1,8% (95% ДІ від -29% до 33%). Не було виявлено суттєвих відмінностей між чистими та загальними природними непрямими ефектами, що свідчить про те, що опосередкована взаємодія була малоймовірною.
Обговорення
У цьому дослідженні ми вперше виявили зв’язок між материнськими циркулюючими біомаркерами преконцепції та поведінковими симптомами дитини у віці 3 років. У повністю скоригованій моделі ми виявили, що кластер біомаркерів 9 (тіамін, ТМФ, піридоксальфосфат, піридоксинова кислота та піридоксаль) позитивно пов’язаний з проблемами інтерналізації, а тіамін був рушійною силою асоціації кластеру. При дослідженні метаболітів окремо від мікроелементів та НАК асоціації тіаміну та ТМФ з проблемами інтерналізації збереглися, хоча і з нижчими кластерними МАВ. Як тіамін, так і ТМФ також були послідовно пов’язані з поширеними проблемами розвитку в аналізах чутливості. Загалом, ми знайшли докази зв’язку між біомаркерами тіамінового ланцюга, пов’язаними з преконцепцією матері, та поведінкою дитини. У стратифікованому за СЕС аналізі ці зв’язки збереглися лише в групі з високим рівнем доходу сімей.
На наші висновки про вищі рівні вільного тіаміну та ТМФ, пов’язані з інтерналізацією проблем, значною мірою вплинули вищі бали за шкалами соматичних скарг та тривоги/депресії, а також поширені проблеми розвитку, які в основному характеризуються затримками в розвитку навичок соціалізації та спілкування. Це не узгоджується з клінічними даними, згідно з якими як пренатальний, так і дитячий дефіцит тіаміну пов’язаний з небажаними наслідками розвитку дитини, включаючи порушення мовних і комунікативних навичок [35, 36, 37]. Дефіцит тіаміну зазвичай розглядається як проблема здоров’я, пов’язана з поганим харчуванням у країнах з низьким та середнім рівнем доходу та надмірним споживанням алкоголю в країнах з високим рівнем доходу [38], які мають низьку поширеність у нашій популяції та когорті преконцепції. Однак справжній ризик недостатності та/або субоптимального рівня тіаміну у жінок репродуктивного віку недостатньо вивчений [39]. Тим не менш, дієти з високим вмістом вуглеводів і споживання підсолоджених цукром напоїв підвищують потребу в тіамінпірофосфаті (ТПФ), який є активною формою вітаміну В1 (становить ~80% від загального вмісту тіаміну) і важливим кофактором вуглеводного обміну [40, 41]. У крові ТПФ переважно присутній в еритроцитах, тоді як вільний тіамін і ТМФ знаходяться переважно в плазмі [41]. У нашій когорті біомаркери вимірювали за допомогою зразків плазми, і для цього дослідження були доступні лише вільний тіамін і ТМФ. Порівняно зі здоровими японськими жінками того ж вікового діапазону [42], рівні вільного тіаміну та ТМФ у нашій групі були нижчими. Це може бути пов’язано з різними дієтичними схемами в Японії та Сінгапурі, оскільки рівні вільного тіаміну та ТМФ у плазмі крові чутливі до нещодавнього споживання. Тіаміновий рівень, натомість, визначається еритроцитарним ТДП або функціональною оцінкою активності еритроцитарної транскетолази (ЕТК) [41]. Тим не менш, консенсусу щодо визначення випадків дефіциту тіаміну не досягнуто, і в попередніх дослідженнях використовувалися різні порогові значення [41]. Високе споживання кофеїну, наприклад, з кави та чаю, також перешкоджає всмоктуванню тіаміну [43]. З огляду на те, що в Сінгапурі популярна високо вуглеводна дієта і споживання підсолоджених цукром напоїв, кави та чаю [44], попит на ТДФ може бути загалом високим, а абсорбція тіаміну може бути субоптимальною у населення. Це може призвести до функціонально неоптимального рівня тіаміну. З іншого боку, враховуючи, що вільний тіамін фосфорилюється в ТДФ після всмоктування, вищий рівень вільного тіаміну може бути результатом неоптимального фосфорилювання, що інгібує синтез ТДФ [45]. В обох випадках наше спостереження може свідчити про те, що функціонально субоптимальний рівень ТДФ пов’язаний з проблемами інтерналізації та поширеними проблемами розвитку. Коефіцієнт активності ЕТК розраховується як відношення стимульованої активності ЕТК до базальної активності ЕТК і вказує на наявність ТДП [46]. Однак у нашому дослідженні коефіцієнт активності ЕТК не був доступний. Подальші дослідження, спрямовані на вивчення функціонального субоптимального рівня ТДП, є виправданими.
У нашому дослідницькому аналізі з використанням показників МРТ головного мозку тіамін був обернено пов’язаний з неонатальним ОДІ правого субталамічного ядра, тоді як неонатальний ОДІ правого субталамічного ядра був обернено пов’язаний з кількома показниками за шкалою ЧПД. Повідомлялося про гіпоактивність субталамуса у дітей з симптомами РАС [47]. Це свідчить про те, що може існувати потенційний посередницький ефект через неонатальний ОДІ для позитивних асоціацій тіаміну з проблемами інтерналізації та поширеними проблемами розвитку, обидва з яких пов’язані з аутизмом [48, 49]. Формальний аналіз опосередкування показав, що невелика частина загального ефекту преконцепційного тіаміну на загальні проблеми ЧПД була опосередкована ОДІ правого субталамічного ядра. Через менший розмір вибірки оцінки були неточними і не подолали наш поріг для багаторазового тестування.
Різний час збору зразків для вимірювання біомаркерів та оцінки поведінкових симптомів може вплинути на відмінності між нашими результатами та результатами попередніх досліджень. Жодне попереднє дослідження не розглядало показники преконцепції, які можуть мати вирішальне значення для нейророзвитку.Через значні зміни в об’ємі плазми та метаболізмі, концентрації, виміряні під час вагітності, можуть не відображати периконцептуальні рівні. Попередні дослідження повідомляли, що нижчий рівень фолатів у матері під час ранньої вагітності (<18 тижнів гестації) був пов’язаний з дитячою гіперактивністю та проблемами з однолітками [50], а також з інтерналізацією, але не екстерналізацією ЧПД у віці ~3 років [51]. У нашому аналізі кластер біомаркерів 4 (бетаїн, кобаламін, фолат, триметиламін N-оксид, вітамін D3) був припустимо пов’язаний з інтерналізацією проблем (кластерний МАВ = 0,529), але жоден з біомаркерів у кластері не був обраний у понад 50% моделей (умовний МАВ < 0,5). Це може свідчити про те, що критичне вікно для фолатів під час вагітності, а не перед зачаттям.
Вживання харчових добавок та раціон харчування матерями зазвичай оцінюють за допомогою опитувальників в епідеміологічних дослідженнях [52, 53]. Така оцінка вразлива до Спотворення пам’яті та упередженості внаслідок соціальної бажаності [54]. Крім того, питання про частоту вживання добавок часто базуються на широких визначеннях, таких як полівітаміни [53]. Таким чином, може виникнути помилкова класифікація, і точне споживання не може бути оцінене. Об’єктивні показники циркулюючих мікроелементів або метаболітів майже виключно вивчаються під час вагітності, а не до зачаття [20]. На дуже ранній стадії вагітності ембріон отримує поживні речовини з рідин репродуктивного тракту та ендометрію [55, 56]. Таким чином, материнські преконцепційні циркулюючі біомаркери можуть вказувати не тільки на споживання та метаболізм компонентів раціону матері [57], але й на забезпеченість плода поживними речовинами під час зачаття та на дуже ранній стадії вагітності [58]. Таким чином, у нашому аналізі дослідження циркулюючих біомаркерів до зачаття може бути використано як індикатор стану харчування матері, і забезпеченості плода поживними речовинами [57, 58], а також може дати уявлення про критичне вікно для дієтичних корекцій. Це не вивчалося в більшості когорт пологів, де учасники зазвичай реєструвалися або через деякий час після зачаття, або при народженні. Крім того, існуючі дослідження материнських біомаркерів та наслідків для здоров’я нащадків здебільшого досліджували біомаркери окремо або як латентний фактор декількох біомаркерів [59, 60]. Однак поживні речовини та метаболіти не діють незалежно. Ми врахували складні взаємодії між біомаркерами, застосувавши кластеризацію за методом K-середніх та БЯМР, який використовує переваги автоматичного програмного підбору для характеристики профілю впливу декількох біомаркерів та включає байєсівський відбір змінних. Це допомагає розгадати релевантність харчових компонентів і потенційний біологічний шлях, а також підвищити статистичну потужність. Тим не менш, слід також відзначити кілька обмежень нашого дослідження.
По-перше, аналізи в цьому дослідженні мали невеликий розмір вибірки і відносно велику кількість біомаркерів, що могло знизити ефективність повторної вибірки МЛМК. Тому ми розглядаємо лише результати з ефективним розміром вибірки МЛМК, що перевищує 100, і потенційним коефіцієнтом зменшення масштабу, меншим за 1,1. Ми також провели кілька додаткових аналізів, щоб оцінити узгодженість наших висновків. По-друге, аналіз БЯМР був недоступний для деяких підгруп у стратифікованих аналізах через обмежений розмір вибірки. Для тих підгруп, де було проведено як БЯМР, так і лінійну регресію, більші кластерні та умовні МАВ з БЯМР відповідали меншому P-value з лінійної регресії. Тим не менш, ці результати слід інтерпретувати з обережністю. По-третє, можуть існувати статевоспецифічні ефекти та критичні інтервали; однак ми не можемо дослідити це через малий розмір вибірки. По-четверте, вимірювання еритроцитарного ТДФ або функціонального аналізу біологічної активності тіаміну (тобто активності ЕТК) були недоступні. Це могло б допомогти перевірити, чи наше припущення про функціонально субоптимальний статус ТДФ відповідає дійсності. Тим не менш, наші результати свідчать про те, що моніторинг функціональних біомаркерів тіаміну може бути більш інформативним. І останнє, але не менш важливе: поведінкові симптоми дитини, отримані на основі опитувальника, заповненого батьками, можуть бути спотворені факторами, пов’язаними з походженням батьків. Однак оцінка дослідників або лікарів обмежена часом, який вони можуть витратити на кожну дитину, тому вона може не відображати повсякденну поведінку дитини.
Висновок
У цьому дослідженні ми звернулися до критичної прогалини в існуючій літературі, досліджуючи асоціації материнських преконцепційних біомаркерів з поведінкою дитини, про яку повідомляють батьки, щоб обійти плутанину, пов’язану зі змінами під час вагітності. Використовуючи методи кластеризації та змішування для врахування складної взаємодії між біомаркерами, ми виявили зв’язок між підвищеним рівнем тіаміну в плазмі крові матері та ТМФ з проблемами інтерналізації та поширеними проблемами розвитку, що дозволяє припустити, що функціональний метаболізм тіаміну може бути важливим для жінок, які планують вагітність. Далі ми формально оцінили, якою мірою мікроструктура головного мозку новонароджених опосередковує спостережувані взаємозв’язки. Ми не знайшли точних доказів посередництва через неонатальну ОДІ при заданих нами порогових значеннях, тому необхідні подальші дослідження, що вивчають інші потенційні механізми посередництва.
Посилання
- Ogundele MO. Behavioural and emotional disorders in childhood: a brief overview for paediatricians. World J Clin Pediatr. 2018;7:9–26.
- Narusyte J, Ropponen A, Alexanderson K, Svedberg P. Internalizing and externalizing problems in childhood and adolescence as predictors of work incapacity in young adulthood. Soc Psychiatry Psychiatr Epidemiol. 2017;52:1159–68.
- Woo BS, Ng TP, Fung DS, Chan YH, Lee YP, Koh JB, et al. Emotional and behavioural problems in Singaporean children based on parent, teacher and child reports. Singap Med J. 2007;48:1100–6.
- Polanczyk GV, Salum GA, Sugaya LS, Caye A, Rohde LA. Annual Research Review: a meta-analysis of the worldwide prevalence of mental disorders in children and adolescents. J Child Psychol Psychiatry. 2015;56:345–65.
- Shaw M, Hodgkins P, Caci H, Young S, Kahle J, Woods AG, et al. A systematic review and analysis of long-term outcomes in attention deficit hyperactivity disorder: effects of treatment and non-treatment. BMC Med. 2012;10:99.
- Mick E, McGough J, Loo S, Doyle AE, Wozniak J, Wilens TE, et al. Genome-wide association study of the child behavior checklist dysregulation profile. J Am Acad Child Adolesc Psychiatry. 2011;50:807–17.e808.
- Hess JL, Nguyen NH, Suben J, Meath RM, Albert AB, Van Orman S, et al. Gene co-expression networks in peripheral blood capture dimensional measures of emotional and behavioral problems from the Child Behavior Checklist (ЧПД). Transl Psychiatry. 2020;10:328.
- Bagner DM, Rodriguez GM, Blake CA, Linares D, Carter AS. Assessment of behavioral and emotional problems in infancy: a systematic review. Clin Child Fam Psychol Rev. 2012;15:113–28.
- Bagner DM, Pettit JW, Lewinsohn PM, Seeley JR. Effect of maternal depression on child behavior: a sensitive period? J Am Acad Child Adolesc Psychiatry. 2010;49:699–707.
- Stephenson J, Heslehurst N, Hall J, Schoenaker D, Hutchinson J, Cade JE, et al. Before the beginning: nutrition and lifestyle in the preconception period and its importance for future health. Lancet. 2018;391:1830–41.
- World Health Organization. WHO recommendations on antenatal care for a positive pregnancy experience. 2020.
- Ecker C, Bookheimer SY, Murphy DG. Neuroimaging in autism spectrum disorder: brain structure and function across the lifespan. Lancet Neurol. 2015;14:1121–34.
- Prem S, Millonig JH, DiCicco-Bloom E. Dysregulation of neurite outgrowth and cell migration in autism and other neurodevelopmental disorders. Adv Neurobiol. 2020;25:109–53.
- Castellanos FX, Giedd JN, Marsh WL, Hamburger SD, Vaituzis AC, Dickstein DP, et al. Quantitative brain magnetic resonance imaging in attention-deficit hyperactivity disorder. Arch Gen Psychiatry. 1996;53:607–16.
- McAlonan GM, Cheung V, Cheung C, Chua SE, Murphy DG, Suckling J, et al. Mapping brain structure in attention deficit-hyperactivity disorder: a voxel-based MRI study of regional grey and white matter volume. Psychiatry Res. 2007;154:171–80.
- Hazlett HC, Gu H, Munsell BC, Kim SH, Styner M, Wolff JJ, et al. Early brain development in infants at high risk for autism spectrum disorder. Nature. 2017;542:348–51.
- Stiles J, Jernigan TL. The basics of brain development. Neuropsychol Rev. 2010;20:327–48.
- Copf T. Impairments in dendrite morphogenesis as etiology for neurodevelopmental disorders and implications for therapeutic treatments. Neurosci Biobehav Rev. 2016;68:946–78.
- Fleming TP, Watkins AJ, Velazquez MA, Mathers JC, Prentice AM, Stephenson J, et al. Origins of lifetime health around the time of conception: causes and consequences. Lancet. 2018;391:1842–52.
- Li M, Francis E, Hinkle SN, Ajjarapu AS, Zhang C. Preconception and prenatal nutrition and neurodevelopmental disorders: a systematic review and meta-analysis. Nutrients. 2019;11:1628.
- Loo EXL, Soh SE, Loy SL, Ng S, Tint MT, Chan SY, et al. Cohort profile: Singapore Preconception Study of Long-Term Maternal and Child Outcomes (S-PRESTO). Eur J Epidemiol. 2021;36:129–42.
- Shahwan S, Abdin E, Shafie S, Chang S, Sambasivam R, Zhang Y, et al. Prevalence and correlates of smoking and nicotine dependence: results of a nationwide cross-sectional survey among Singapore residents. BMJ Open. 2019;9:e032198.
- Steinley D. K-means clustering: a half-century synthesis. Br J Math Stat Psychol. 2006;591:1–34.
- Zhang H, Schneider T, Wheeler-Kingshott CA, Alexander DC. NODDI: practical in vivo neurite orientation dispersion and density imaging of the human brain. Neuroimage. 2012;61:1000–16.
- Chang YS, Owen JP, Pojman NJ, Thieu T, Bukshpun P, Wakahiro ML, et al. White matter changes of neurite density and fiber orientation dispersion during human brain maturation. PLoS ONE. 2015;10:e0123656.
- Makropoulos A, Gousias IS, Ledig C, Aljabar P, Serag A, Hajnal JV, et al. Automatic whole brain MRI segmentation of the developing neonatal brain. IEEE Trans Med Imaging. 2014;33:1818–31.
- Branco T, Hausser M. The single dendritic branch as a fundamental functional unit in the nervous system. Curr Opin Neurobiol. 2010;20:494–502.
- Bobb JF, Valeri L, Claus Henn B, Christiani DC, Wright RO, Mazumdar M, et al. Bayesian kernel machine regression for estimating the health effects of multi-pollutant mixtures. Biostatistics. 2015;16:493–508.
- Brooks SP, Gelman A. General methods for monitoring convergence of iterative simulations. J Comput Graph Stat. 1998;7:434–55.
- VanderWeele TJ. A unification of mediation and interaction: a 4-way decomposition. Epidemiology. 2014;25:749–61.
- Mandel M. Simulation-based confidence intervals for functions with complicated derivatives. Am Statistician. 2013;67:76–81.
- Lindsay KL, Buss C, Wadhwa PD, Entringer S. The interplay between maternal nutrition and stress during pregnancy: issues and considerations. Ann Nutr Metab. 2017;70:191–200.
- Najman JM, Williams GM, Nikles J, Spence S, Bor W, O’Callaghan M, et al. Bias influencing maternal reports of child behaviour and emotional state. Soc Psychiatry Psychiatr Epidemiol. 2001;36:186–94.
- Chilcoat HD, Breslau N. Does psychiatric history bias mothers’ reports? An application of a new analytic approach. J Am Acad Child Adolesc Psychiatry. 1997;36:971–9.
- Kloss O, Eskin NAM, Suh M. Thiamin deficiency on fetal brain development with and without prenatal alcohol exposure. Biochem Cell Biol. 2018;96:169–77.
- Dhir S, Tarasenko M, Napoli E, Giulivi C. Neurological, psychiatric, and biochemical aspects of thiamine deficiency in children and adults. Front Psychiatry. 2019;10:207.
- Dias FM, Silva DM, Doyle FC, Ribeiro AM. The connection between maternal thiamine shortcoming and offspring cognitive damage and poverty perpetuation in underprivileged communities across the world. Med Hypotheses. 2013;80:13–16.
- Bourassa MW, Bergeron G, Brown KH. A fresh look at thiamine deficiency-new analyses by the global thiamine alliance. Ann N Y Acad Sci. 2021;1498:5–8.
- Marrs C, Lonsdale D. Hiding in plain sight: modern thiamine deficiency. Cells. 2021;10:2595.
- Gomes F, Bergeron G, Bourassa MW, Fischer PR. Thiamine deficiency unrelated to alcohol consumption in high-income countries: a literature review. Ann N Y Acad Sci. 2021;1498:46–56.
- Whitfield KC, Bourassa MW, Adamolekun B, Bergeron G, Bettendorff L, Brown KH, et al. Thiamine deficiency disorders: diagnosis, prevalence, and a roadmap for global control programs. Ann N Y Acad Sci. 2018;1430:3–43.
- Ihara H, Hirano A, Wang L, Okada M, Hashizume N. Reference values for whole blood thiamine and thiamine phosphate esters in Japanese adults. J Anal Bio-Sci. 2005;28:241–6.
- Lonsdale D. A review of the biochemistry, metabolism and clinical benefits of thiamin(e) and its derivatives. Evid Based Complement Altern Med. 2006;3:49–59.
- Research & Strategic Planning Division HPB. National Nutrition Survey (Singapore). Singapore: Health Promotion Board; 2010.
- Tylicki A, Łotowski Z, Siemieniuk M, Ratkiewicz A. Thiamine and selected thiamine antivitamins – biological activity and methods of synthesis. Biosci Rep. 2018;38:BSR20171148.
- Jones KS, Parkington DA, Cox LJ, Koulman A. Erythrocyte transketolase activity coefficient (ETKAC) assay protocol for the assessment of thiamine status. Ann N Y Acad Sci. 2021;1498:77–84.
- van Hulst BM, de Zeeuw P, Rijks Y, Neggers SFW, Durston S. What to expect and when to expect it: an fMRI study of expectancy in children with ADHD symptoms. Eur Child Adolesc Psychiatry. 2017;26:583–90.
- Bauminger N, Solomon M, Rogers SJ. Externalizing and internalizing behaviors in ASD. Autism Res. 2010;3:101–12.
- Fombonne E. Epidemiology of pervasive developmental disorders. Pediatr Res. 2009;65:591–8.
- Schlotz W, Jones A, Phillips DI, Gale CR, Robinson SM, Godfrey KM. Lower maternal folate status in early pregnancy is associated with childhood hyperactivity and peer problems in offspring. J Child Psychol Psychiatry. 2010;51:594–602.
- Steenweg-de Graaff J, Roza SJ, Steegers EA, Hofman A, Verhulst FC, Jaddoe VW, et al. Maternal folate status in early pregnancy and child emotional and behavioral problems: the Generation R Study. Am J Clin Nutr. 2012;95:1413–21.
- Wingrove K, Lawrence MA, McNaughton SA. A systematic review of the methods used to assess and report dietary patterns. Front Nutrition. 2022;9:892351.
- Park S-Y, Murphy SP, Wilkens LR, Yamamoto JF, Kolonel LN. Allowing for variations in multivitamin supplement composition improves nutrient intake estimates for epidemiologic studies. J Nutr. 2006;136:1359–64.
- Miller TM, Abdel-Maksoud MF, Crane LA, Marcus AC, Byers TE. Effects of social approval bias on self-reported fruit and vegetable consumption: a randomized controlled trial. Nutr J. 2008;7:18.
- Harris SE, Gopichandran N, Picton HM, Leese HJ, Orsi NM. Nutrient concentrations in murine follicular fluid and the female reproductive tract. Theriogenology. 2005;64:992–1006.
- Hempstock J, Cindrova-Davies T, Jauniaux E, Burton GJ. Endometrial glands as a source of nutrients, growth factors and cytokines during the first trimester of human pregnancy: a morphological and immunohistochemical study. Reprod Biol Endocrinol. 2004;2:58.
- Potischman N, Freudenheim JL. Biomarkers of nutritional exposure and nutritional status: an overview. J Nutr. 2003;133:873S–874S.
- Belkacemi L, Nelson DM, Desai M, Ross MG. Maternal undernutrition influences placental-fetal development. Biol Reprod. 2010;83:325–31.
- Irwin JL, McSorley EM, Yeates AJ, Mulhern MS, Strain JJ, Watson GE, et al. Maternal immune markers during pregnancy and child neurodevelopmental outcomes at age 20 months in the Seychelles Child Development Study. J Neuroimmunol. 2019;335:577023.
- Strom M, Halldorsson TI, Hansen S, Granstrom C, Maslova E, Petersen SB, et al. Vitamin D measured in maternal serum and offspring neurodevelopmental outcomes: a prospective study with long-term follow-up. Ann Nutr Metab. 2014;64:254–61.