Резюме
Развитие человеческого мозга начинается в эмбриональном периоде. Питание матери до зачатия и доступность питательных веществ для эмбриона могут влиять на развитие мозга в этот критический период после зачатия и ранней клеточной дифференциации, тем самым влияя на риск неврологических и поведенческих расстройств у потомков. Однако изучение этого вопроса является сложным из-за трудностей с определением пищевого статуса перед зачатием, и только в немногих исследованиях есть объективные показатели неврологической визуализации у детей. Мы исследовали связь циркулирующих в крови матери смесей биомаркеров, связанных с питательными веществами (примерно за 15 недель до зачатия), с поведенческими симптомами ребенка (чеклист поведения ребенка (ЧПР), в возрасте 3 лет) в рамках Сингапурского преконцепционного исследования и долгосрочных последствий для матери и ребенка (S-PRESTO). Дошкольная форма ЧПР оценивает поведение ребенка на основе шкал синдромов и шкал, ориентированных на Диагностическое и статистическое руководство по психическим расстройствам (ДСР). Эти шкалы включают интернализацию проблем, экстернализацию проблем, тревожность, распространенные проблемы развития, оппозиционное и девиантное поведение и тому подобное. Мы применили кластеризацию на основе данных и метод смесевого моделирования (байесовская ядерная машинная регрессия, БЯМР), чтобы учесть сложные, нелинейные зависимости между 67 биомаркерами. Мы использовали анализ декомпозиции эффектов, чтобы исследовать потенциальную посредническую роль микроструктуры мозга новорожденных (1-я неделя), в частности, индексов ориентационной дисперсии (ОДИ) 49 корковых и подкорковых участков серого вещества. Мы обнаружили, что высокие уровни питательных веществ, включая тиамин, тиаминмонофосфат (ТМФ), пиридоксальфосфат, пиридоксиновую кислоту и пиридоксаль, связанные с высоким показателем по шкале ЧПР для интернализации проблем (возможность апостериорного включения (ВАВ) = 0,768). В частности, тиамин независимо влиял на ЧПР (условная ВАВ = 0,775). Более высокий уровень тиамина в крови матери также ассоциировался с более низким показателем ОДИ правого субталамического ядра (P-value = 0,01), тогда как более низкий показатель ОДИ правого субталамического ядра ассоциировался с более высокими показателями ЧПР для нескольких доменов (P-value < 0,05). Одним из возможных механизмов является неоптимальный метаболизм свободного тиамина до активного витамина В1, но необходимы дополнительные исследования в других когортах.
Вступление
Наиболее распространенными поведенческими проблемами в детском и подростковом возрасте являются тревожность, агрессивное поведение, гиперактивное расстройство с дефицитом внимания (СДВГ) и распространенные проблемы развития, включая расстройства аутистического спектра (РАС) [1,2]. Такие поведенческие проблемы в целом можно классифицировать как интернализируемые расстройства, такие как тревожность, и экстернализируемые расстройства, такие как агрессивное поведение [1]. Предыдущее исследование показало, что 12,2% и 4,9% сингапурских детей младшего школьного возраста (6-12 лет) сталкивались с проблемами интернализации и экстернализации соответственно [3], что сопоставимо с глобальными оценками распространенности [4]. Поведенческие проблемы детей и подростков имеют значительное влияние на взрослую жизнь, включая худшие учебные результаты, нетрудоспособность, употребление наркотиков и другие виды аддиктивного поведения [2,5].
На поведенческие проблемы детей и подростков влияют различные факторы, включая генетику [6,7], образование матери [8], материнскую депрессию [9], воспитание [1] и неблагоприятную социально-экономическую среду [1]. Пищевой статус матери до беременности связан с течением беременности и состоянием здоровья ребенка [10], а пищевые добавки обычно рекомендуются для содействия лучшему течению беременности [11]. Однако непонятно, может ли пищевой статус до зачатия влиять на развитие мозга плода и потомства и, наконец, на поведение ребенка, и если да, то каким образом. Механизмы, лежащие в основе нарушений неврологического развития, включают вариации в анатомии, функционировании и взаимосвязях мозга [12,13]. Исследования магнитно-резонансной томографии (МРТ) показывают, что дифференциальные структурные характеристики мозга, которые можно обнаружить даже в первые два года жизни, могут лежать в основе нарушений неврологического развития [14, 15, 16]. Важно, что развитие человеческого мозга, например, морфология дендритов, начинается в эмбриональном периоде [17, 18], что делает важным понимание роли модифицированных воздействий окружающей среды в этот критический период. В частности, питание матери до зачатия и доступность питательных веществ для плода могут влиять на развитие мозга во время зачатия и ранней клеточной дифференциации [19], тем самым влияя на результаты неврологического развития потомков, такие как поведенческие расстройства. Однако из-за сложности проспективного наблюдения за женщинами, которые еще не были беременными, лишь в немногих исследованиях изучалась связь биомаркеров преконцепции, отдельно или в комбинации, с результатами нейроразвития ребенка [20]. Важно отметить, что существующие исследования, которые обнаружили связь, не смогли оценить роль потенциальных механизмов, например, через изменения в микроструктуре мозга потомков. Следовательно, многие выводы являются опосредованными, например, корреляции с беременностью или послеродовой диетой или основным состоянием здоровья матери, и не обязательно указывают на потенциальные причинные влияния или периоды для вмешательства.
В частности, предыдущие исследования основывались на самоотчетах об употреблении добавок до зачатия или учитывали только объективные биомаркеры во время беременности, на которые могут влиять изменения в рационе питания и метаболизме во время беременности, или же они были слишком поздними, чтобы охватить ранний периконцептуальный период. Кроме того, исследования сосредотачивались на биомаркерах изолированно, не учитывая их взаимозависимости, обусловленной особенностями питания и/или связанными с ним метаболическими путями. Чтобы решить эту проблему, мы использовали проспективную когорту беременных и детей, чтобы исследовать взаимосвязь между биомаркерами, связанными с питанием до зачатия, и поведенческими симптомами ребенка, используя новые подходы для учета кластеризации и взаимозависимости биомаркеров. Для усиления выводов мы дополнительно исследовали роль микроструктуры головного мозга новорожденных в опосредовании таких связей.
Материалы и методы
Источник данных
Это исследование было проведено в рамках когорты Сингапурского преконцептуального исследования долгосрочных последствий для матери и ребенка (S-PRESTO) [21]. Коротко говоря, в период с февраля 2015 года по октябрь 2017 года в S-PRESTO было набрано 1032 небеременные женщины в возрасте от 18 до 45 лет (среднее значение = 31, стандартное отклонение (СО) = 3,7) китайской, малайской или индийской этнической принадлежности, которые намеревались зачать и родить ребенка в Сингапуре. За участницами наблюдали до 3 визитов к врачам с целью зачатия, а через 12 месяцев, если зачатие не произошло, они были исключены из исследования. Во время визитов перед зачатием оценивали базовые характеристики, такие как уровень образования/достижения, доход семьи и история болезни, с помощью анкет, которые заполнял интервьюер, а также заполняли анкеты для самооценки настроения. Важно, что образцы крови натощак были собраны во время первого визита в преконцепцию.
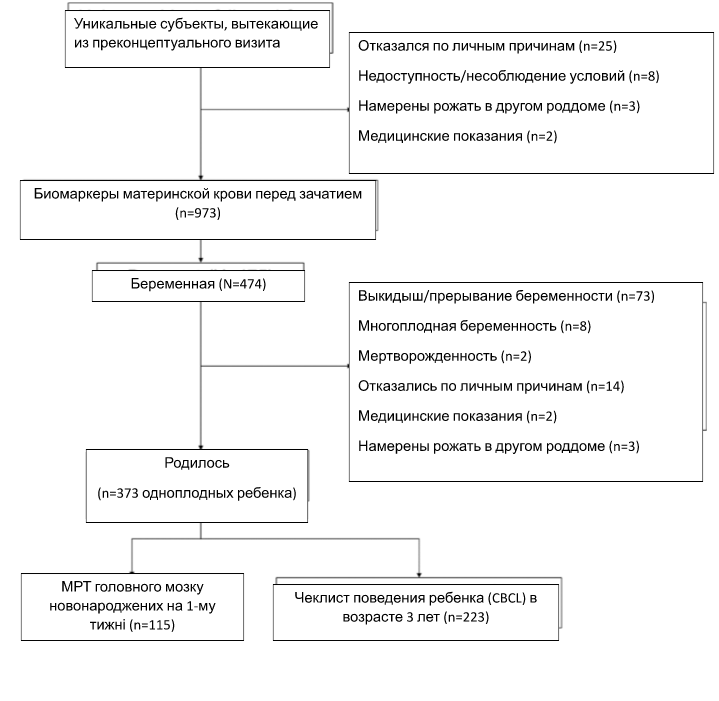
В целом 475 женщин успешно забеременели, среди них родилось 373 ребенка, которые были единственными рожденными во время одних родов. Женщины и их дети наблюдались после родов для сбора данных по стандартным антропометрическим измерениям, магнитно-резонансной томографии головного мозга и результатов неврологического развития. На рисунке 1 показано блок-схему и размеры выборки для биомаркеров материнской крови, МРТ головного мозга новорожденных и оценки поведения ребенка. От всех участников было получено письменное информированное согласие. Этическое одобрение было получено от Централизованного институционального обзорного совета SingHealth (ссылка 2014/692/D) [21].
Рис. 1: Блок-схема выборки из проспективного исследования Сингапурского исследования преконцепции долгосрочных последствий материнства и детства (S-PRESTO).
Каждая клеточка на блок-схеме указывает на размер выборки для данных, собранных в разные моменты времени, а также на количество участников, которые были исключены из исследования.
Биомаркеры матери
Уровни 72 биомаркеров, циркулирующих в крови матери, измеряли с помощью образцов крови натощак, собранных во время первого визита к врачу (n = 973). Семьдесят биомаркеров измеряли с помощью хорошо валидированной масс-спектрометрической платформы (BEVITAL платформы B, C, D и H, https://bevital.no/) в образцах плазмы крови с EDTA (этилендиаминтетрауксусная кислота), которая позволяет количественно определять аминокислоты, витамины, ацилкарнитины и другие метаболиты. Другие два биомаркера, кобаламин (витамины В12) и фолиевую кислоту (витамин В9), измеряли с помощью хемилюминесцентного иммуноанализа (платформа Beckman) в образцах плазмы крови с ЕДТК.
У более 80% женщин были зафиксированы нулевые значения для пяти биомаркеров преконцепции: никотиновой кислоты, пиридоксина, витамина D2, котинина и гидроксикотинина. Никотиновая кислота, пиридоксин и витамин D2 являются формами витамина B3, витамина B6 и витамина D соответственно, которые существуют в других формах, измеряемых в используемой платформе. Котинин и гидроксикотинин являются метаболитами никотина, и низкие уровни этих метаболитов объясняются низким уровнем курения среди женщин в Сингапуре и нашей когорте [22]. Мы исключили эти биомаркеры из нашего анализа. Остальные 67 биомаркеров включали 46 метаболитов, 12 микроэлементов и 9 незаменимых аминокислот (НАК). Первичные значения были преобразованы в натуральный логарифм после добавления единицы, а результаты представлены на единицу SD естественных логарифмических преобразованных данных.
Мы выделили 11 кластеров для 67 биомаркеров преконцепции, используя кластеризацию по методу K-средних, которая минимизирует сумму квадратов внутри кластера [23]. Поскольку метаболиты и микроэлементы могут представлять различные базовые конструкты, например, долгосрочный метаболизм и краткосрочные диетические паттерны соответственно, мы провели анализ чувствительности, учитывая две категории биомаркеров отдельно: (1) метаболиты; (2) микроэлементы / НАК. Мы выделили восемь кластеров для метаболитов перед зачатием и семь кластеров для микроэлементов и НАК перед зачатием.
Чеклист поведения ребенка
Опросник ЧПР для детей дошкольного возраста, который заполняли родители, проводился в возрасте 3 лет, и ответы были получены от 223 детей (среднее значение = 3,1 года, СО = 0,1 года). Дошкольная форма ЧПР оценивает поведение ребенка на основе синдромных шкал и шкал, ориентированных на диагностическое и статистическое руководство по психическим расстройствам (ДСР). Синдромные шкалы состоят из интернализации проблем (эмоционально реактивная, тревожная/депрессивная, соматические жалобы, замкнутость) и экстернализации проблем (проблемы с вниманием и агрессивное поведение), проблем со сном и общих проблем. Шкалы, ориентированные на ДСР, включают СДВГ, аффективные проблемы, тревожные проблемы, первазивные проблемы развития и девиантное поведение. Первичные баллы были преобразованы в натуральный логарифм после добавления единицы, а результаты представлены в единицах стандартного отклонения натурального логарифма баллов. Более высокий балл по шкале ЧПР указывает на большие проблемы по каждой шкале.
Магнитно-резонансная томография головного мозга новорожденных
Неонатальная МРТ головного мозга была выполнена 115 младенцам в течение первой недели после рождения с использованием 3-Tesla сканера (Magnetom Skyra, Siemens Healthineers, Эрланген, Германия). Была получена диффузионно-взвешенная последовательность с несколькими оболочками. В анализ было включено 109 младенцев со средней абсолютной подвижностью менее 3 мм (средняя абсолютная подвижность 0,95 мм и межквартильный размах 0,69-1,03 мм). Диффузионные изображения были предварительно обработаны с помощью FMRIB’s Diffusion Toolbox, FSL v6.0.4, и подогнаны к модели Neurite Orientation Dispersion and Density Imaging (NODDI) с помощью NODDI MATLAB Toolbox v1.05 [24]. NODDI использует мультисегментарную модель клеточных и внеклеточных отделов каждого вокселя и обеспечивает более биологически обоснованное представление развития мозга [25]. В нашем анализе мы использовали индекс ориентационной дисперсии (ОДИ), рассчитанный с помощью модели NODDI, чтобы указать на угловое распределение нейритов (диапазон от 0 до 1). ОДИ 49 зон коркового и подкоркового серого вещества были получены с помощью масок сегментации с пайплайна проекта развития коннектомы человека (dHCP, v1.1) [26]. Более высокое значение ОДИ указывает на более высокую степень сложности дендритов [24]. Дендритные отростки являются основными воротами возбуждающей синаптической передачи в мозге. Следовательно, более высокая степень сложности дендритов облегчает передачу информации между участками мозга [27]. И наоборот, более низкий ОДИ, указывающий на более низкую степень сложности дендритов, может означать нарушение передачи информации между участками мозга, что является вероятным механизмом, который лежит в основе таких нарушений неврологического развития, как РАС [18].
Статистический анализ
Биомаркеры матери перед зачатием и показатели ЧПР потомков
Среди диад мать-ребенок, которые имели данные как биомаркеров, так и ЧПР, мы исключили две диады со смешанным этническим происхождением. Учитывая, что биомаркеры не действуют независимо, мы применили метод смешанной регрессии (Bayesian kernel machine regression, БЯМР), чтобы учесть сложное взаимодействие между биомаркерами, исследуемыми в этой научной работе [28]. Коротко говоря, БЯМР использует ядровое машинное представление для моделирования высокоразмерной поверхности отклика “экспозиция-результат”, предполагая, что лица с похожими профилями экспозиции имеют схожие риски для здоровья [28]. Чтобы уменьшить количество входных данных модели среди высококоррелированных экспозиций, БЯМР включает байесовский отбор переменных. Отбор переменных осуществлялся с помощью алгоритма марковской цепи Монте-Карло (МЦМК), а вероятности апостериорного включения (ВАВ) оценивались с помощью метода усреднения байесовской модели. В этом исследовании мы рассматривали каждый из 15 показателей ЧПР отдельно и провели основной анализ для биомаркеров→ЧПР, а также анализ чувствительности для метаболитов→ЧПР и микроэлементов/НАК→ЧПР. Для каждого анализа мы выполнили 60 000 итераций МЦМК с 12 независимыми цепями с выгоранием 30 000 итераций МЦМК. В каждой итерации мы предполагали, что каждый биомаркер в кластере имеет одинаковую вероятность быть включенным в модель, и что в модель за один раз отбирался только один биомаркер из кластера. Параметр выбора переменной оценивался как функция плотности вероятности от предыдущего распределения. Мы протестировали гамма, равномерное и обратно равномерное предварительные распределения. Эффективные размеры выборки для выборки МЦМК были небольшими, а потенциальные коэффициенты уменьшения масштаба были большими как для гамма, так и для равномерного распределения, что свидетельствует о высокой корреляции выборок МЦМК и ненадежности оценок. Поэтому мы выбрали обратное равномерное распределение для оценки параметров отбора переменных. Учитывая, что коррелированные биомаркеры и/или кластеры биомаркеров могут действовать на одних и тех же биологических путях, мы применили иерархический подход к отбору переменных, который сначала оценивает возможность апостериорного включения (ВАВ) для каждого кластера биомаркеров (Кластерный ВАВ), а затем ВАВ между биомаркерами в пределах каждого кластера с учетом того, что кластер был отобран в модель (Условный ВАВ). Таким образом, кластерные ВАВ и условные ВАВ указывают на доли всех моделей, в которых были отобраны определенные кластеры или биомаркеры в пределах кластера. Мы сообщили о вероятных ассоциациях с порогом кластерного ВАВ > 0,5 и условного ВАВ > 0,5 и выделили более вероятные ассоциации, используя порог кластерного ВАВ > 0,75 и условного ВАВ > 0,5. Мы также отфильтровали ассоциации-кандидаты с эффективным размером выборки МЦМК более 100 и потенциальным коэффициентом уменьшения масштаба менее 1.1 чтобы обеспечить надежность нашего анализа. Потенциальный коэффициент уменьшения масштаба 1.1 указывает на то, что увеличение количества итераций до бесконечности может уменьшить ширину интервала оценки на 10% [29].
Для удобства интерпретации мы использовали модели для оценки эффектов как разницы в среднем результате (показатель ЧПР), когда однократная экспозиция была установлена на уровне, соответствующем 75-му процентилю (наблюдался в исследовании), по сравнению с тем, когда она была установлена на уровне 25-го процентиля, тогда как все другие модельные экспозиции были установлены на уровне их наблюдаемых средних значений [28]. Для сравнения мы также провели стандартную многомерную линейную регрессию. Мы выполнили линейную регрессию, используя выборки с полными данными и применяя взвешивание обратной вероятности (ВОВ), чтобы учесть потенциальные сдвиги, связанные с потерей наблюдений. Модель отсутствия для ВОВ базировалась на самом высоком уровне образования матери, доходе семьи, возрасте матери и индексе массы тела матери перед зачатием, поскольку распределение этих ковариатов отличалось между подвыборкой с данными биомаркеров и ЧПР и подвыборкой без таких данных.
Чтобы исследовать, может ли этническая принадлежность и социально-экономический статус (СЭС) изменять эти ассоциации, мы провели БЯМР и линейные регрессии, стратифицированные по (1) этнической принадлежности матери (китаянка vs малайка; индийцы не были включены из-за малого размера выборки); (2) самым высоким образовательным уровнем матери (университетская степень или высшее политехническое образование или ниже); и (3) семейным доходом (группа с высоким семейным доходом (6-10 дециль) vs группа с более низким семейным доходом (1-6 дециль)).
Преконцепционные материнские биомаркеры и МРТ головного мозга новорожденных
Мы также исследовали роль показателей МРТ головного мозга новорожденных среди кандидатов ассоциаций биомаркеров с ЧПР. Поскольку количество биомаркеров превышало размер выборки, доступной для этого анализа, мы не смогли подобрать модели БЯМР для этого анализа. Мы исследовали ассоциации биомаркеров с ОДИ и ассоциации ОДИ-ЧПР с помощью линейной регрессии. Сначала мы исследовали ассоциации тиамина и тиаминмонофосфата (ТМФ) с ОДИ в 49 корковых и подкорковых участках серого вещества. Тиамин и ТМФ были выбраны потому, что они были наиболее перспективными в основном биомаркерном анализе – ЧПР. Результаты с первичным р-value менее 0,05 в анализе связи биомаркеров и ОДИ были отобраны для анализа связи ОДИ-ЧПР. Мы представили как первичные р-value, так и частоту ложных обнаружений (ЧЛО) на каждом этапе анализа. Кроме того, мы провели регрессионный анализ декомпозиции причинно-следственных связей [30], чтобы оценить потенциальную посредническую роль показателей МРТ в ассоциации тиамина с ЧПР. Этот подход позволяет вычислить чистые и суммарные (включая взаимодействие) прямые эффекты, а также чистые и суммарные (включая опосредованное взаимодействие) косвенные эффекты [30]. Это позволяет исследовать как посредничество, так и взаимодействие одновременно. Поскольку этот исследовательский анализ был недостаточно мощным из-за природы анализа опосредования и необходимости иметь полные данные о биомаркерах, ОДИ и ЧПР, мы сосредоточились на 95% ДИ и представили некорректированные р-value. Мы оценивали долю опосредованного влияния как общий естественный косвенный эффект, разделенный на общий эффект, а соответствующий 95% ДИ рассчитывали с помощью дельта-метода [31].
Коварианты
Чтобы повысить точность оценок и учесть потенциальные препятствия, мы скорректировали коварианты, связанные с влиянием и/или результатом, включая пол ребенка, возраст на момент оценки ЧПР, этническую принадлежность матери, высшее образование матери, доход семьи, возраст матери на момент визита к врачу до зачатия, неженатость, индекс массы тела (ИМТ) матери до зачатия и гестационный возраст при рождении в Модели 1. Доходы семей были распределены на децили на основе данных о трудоустроенных членах семей, которые являются жителями Сингапура, начиная с самой низкой (менее 1622 сингапурских долларов в месяц) и заканчивая самой высокой (16 601 сингапурских долларов и выше в месяц) группой семей с доходами. В нашем нестратифицированном анализе мы использовали 10 уровней дохода семей в качестве непрерывной переменной. В стратифицированном анализе по СЭС мы разделили доход семей на группы семей с более низким уровнем дохода (уровни 1-6) и группы семей с более высоким уровнем дохода (уровни 6-10). Семьи с уровнем дохода 6 были включены в обе подгруппы, иначе мы не смогли бы провести БЯМР хотя бы в одной подгруппе из-за малого размера выборки. Среди матерей, которые рожали живых детей, доход семьи был классифицирован как уровень 6 (7424-S$9082) у 25%, уровни 1-6 (ниже S$9083 в месяц) у 60%, и уровни 6-10 (7424 или выше S$ в месяц) у 65%. Хотя пищевой статус перед зачатием может влиять на психическое здоровье матери, сообщалось о двусторонней связи между питанием и психическим здоровьем, а также о посредническом пути депрессивных симптомов у матери, которые из-за нездорового питания обратно влияют на когнитивные функции ребенка [32]. Было более четко показано, что более депрессивные и тревожные матери по-разному сообщают о проблемах с поведением ребенка [33, 34]. Поэтому мы дополнительно скорректировали показатель психического здоровья матери до зачатия ребенка. Показатель психического здоровья матери до зачатия был получен на основе опросника депрессии Бека (BDI-2), Эдинбургской шкалы послеродовой депрессии (EPDS) и опросника тревожности (STAI) с помощью анализа главных компонент (PCA). Первая главная компонента (PC) с PCA объясняла 98% дисперсии по всем трем опросникам и использовалась для определения психического здоровья матери. Более высокий балл свидетельствует о худшем психическом состоянии.
Программное обеспечение для статистического анализа
Все анализы были выполнены с помощью R 4.1.3. БЯМР-анализ проводился с помощью пакета БЯМР, а регрессионный анализ декомпозиции причинно-следственных связей – с помощью пакета regmedint. Все тесты были двусторонними.
Результаты
Описательный анализ
Из 373 женщин, которые успешно забеременели и остались в нашей когорте на момент родов, 322 имели данные о биомаркерах пренатального периода, 109 – данные неонатальных МРТ, а 223 – результаты оценки ЧПР в возрасте 3 лет. В нашем основном анализе 196 диад мать-ребенок имели данные как о биомаркерах преконцепции, так и об оценке ЧПР. Таблица 1 показывает, что диады мать-ребенок с биомаркерами пренатальной диагностики и оценкой ЧПР были похожими по большинству характеристик, а также без них. Мы также сравнили участников, которые имели данные биомаркеров и ЧПР для анализа, с теми, кто успешно забеременели, но были исключены из дальнейшего наблюдения. Те, кто имел данные о биомаркерах и оценку ЧПР, сообщили о более высоком уровне дохода семьи. По сравнению с участницами, которые изначально были набраны, но не забеременели в течение 12 месяцев или были исключены из дальнейшего наблюдения, те, кто имел данные для этого анализа, были моложе, имели более высокий уровень образования, высокий доход семьи, ниже ИМТ и лучшее состояние психического здоровья до зачатия. Эти факторы были скорректированы в дальнейшем анализе ассоциаций. Медианы и межквартильные диапазоны для исследуемых биомаркеров были подобными между полной выборкой и подвыборкой, доступной для анализа БЯМР и анализа медиации.
Таблица 1 Сравнение характеристик между участницами с данными биомаркеров и ЧПР (среди тех, кто родил живых детей) и без них
| Ковариант | Категория | Рождение ребенка без данных биомаркеров и ЧПР | Рождение ребенка с данными биомаркеров и ЧПР | P-valuea | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| N | % | Среднее | СВ | N | % | Среднее | ДИ | ||||
| В целом | 177 | 196 | |||||||||
| Пол ребенка | Девочка | 79 | 44.6% | 89 | 45.4% | 1 | |||||
| Мальчик | 93 | 52.5% | 107 | 54.6% | |||||||
| Этническая принадлежность матери | Китаянка | 139 | 78.5% | 146 | 74.5% | 0.129 | |||||
| Индианка | 10 | 5.6% | 16 | 8.2% | |||||||
| Малайка | 21 | 11.9% | 32 | 16.3% | |||||||
| Смешанная этническая принадлежность | 7 | 4.0% | 2 | 1.0% | |||||||
| Наивысший уровень образования матери | Высшее образование или выше | 125 | 70.6% | 143 | 73.0% | 0.699 | |||||
| Политехническое образование или ниже | 52 | 29.4% | 53 | 27.0% | |||||||
| Уровень дохода семьи | 145 | 5.8 | 2.1 | 163 | 6.3 | 2.1 | 0.037 | ||||
| Возраст матери во время визита к врачу (лет) | 177 | 30.2 | 3.2 | 196 | 30.7 | 3.3 | 0.142 | ||||
| Ориентировочное количество недель до беременности | 166 | 21.9 | 17.2 | 185 | 15.6 | 15.9 | 4.2 × 10–4 | ||||
| ИМТ матери до беременности (кг/м2) | 175 | 23.2 | 4.5 | 194 | 22.8 | 4.0 | 0.402 | ||||
| Никогда прежде не рожала | Нет | 64 | 36.2% | 76 | 38.8% | 0.710 | |||||
| Да | 112 | 63.3% | 120 | 61.2% | |||||||
| Гестационный возраст при рождении (недели) | 177 | 38.9 | 1.3 | 196 | 38.8 | 1.4 | 0.333 | ||||
| Оценка психического здоровья матери | 123 | 54.3 | 14.2 | 136 | 52.8 | 13.7 | 0.400 | ||||
- ИМТ – индекс массы тела, ЧПР – чеклист поведения ребенка, СВ- стандартное отклонение.
- а) Р-значение различий между участницами, которые родили живых детей с данными биомаркеров и ЧПР, и участницами, которые родили живых детей, но без данных биомаркеров и ЧПР, были оценены с помощью критерия хи-квадрат для категориальных характеристик и с помощью t-теста для непрерывных характеристик.
b) Уровни дохода семей были распределены на уровни 1-10, указывающие на группу семей с самым низким и самым высоким уровнем дохода на основе когорты SPRESTO. Мы использовали 10 уровней дохода семей как непрерывную переменную в нашем анализе.
Материнские биомаркеры и показатели ЧПР у потомков
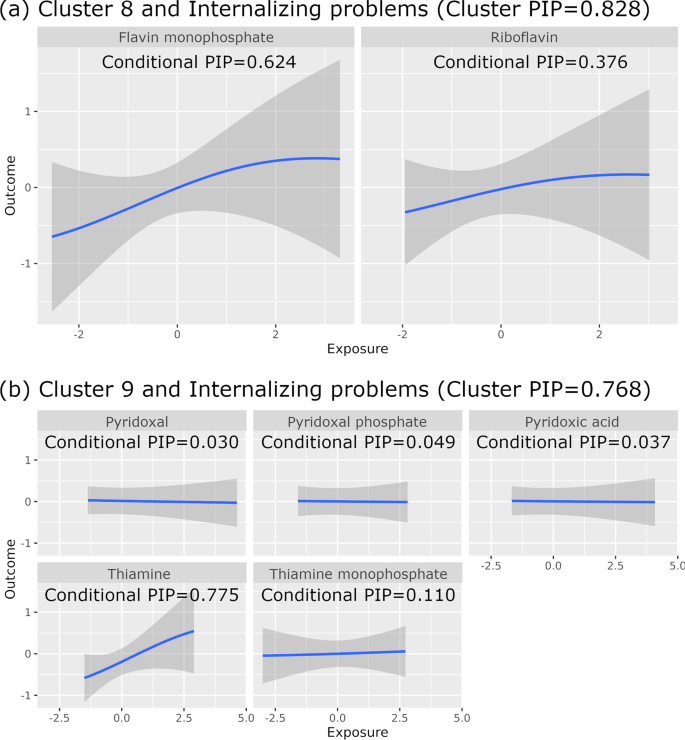
Таблица 2 показывает ассоциации с кластерным ВАВ больше чем 0,75 в нашей полностью скорректированной модели (Модель 2). Флавинмононуклеотид имел самый высокий условный ВАВ для положительной связи кластера биомаркеров 8 (рибофлавин и Флавинмононуклеотид) с проблемами интернализации (кластерный ВАВ = 0,828, условный ВАВ = 0), а тиамин имел самый высокий условный ВАВ для кластера биомаркеров 8 (рибофлавин и Флавинмононуклеотид). 624), а тиамин имел самый высокий условный ВАВ для положительной связи кластера биомаркеров 9 (тиамин, ТМФ, пиридоксальфосфат, пиридоксиновая кислота и пиридоксаль) с проблемами интернализации (кластерный ВАВ = 0,768, условный ВАВ = 0,775). Приведенные выше кластерные ВАВ указывают на то, что кластеры биомаркеров 8 и 9 были выбраны в 82,8% и 76,8% итераций МЦМК, соответственно. Приведенные выше условные ВАВ указывают на то, что Флавинмононуклеотид был выбран в 62,4% итераций МЦМК, где был выбран кластер биомаркеров 8, а тиамин был выбран в 77,5% итераций МЦМК, где был выбран кластер биомаркеров 9. На изображении 2 показаны линейные положительные связи преконцепции Флавинмононуклеотида и тиамина с проблемами интернализации. Это согласуется по направлению влияния с результатами линейной регрессии с полными данными (Таблица 2), а также линейной регрессии с ВАВ. На основе линейной регрессии с полными данными мы подсчитали, что на один СО более высокий уровень logx-трансформированного Флавинмононуклеотида (что на 36% выше абсолютного уровня флавинмонофосфата) ассоциируется с более высоким на 0,177 СО показателем по шкале ЧПР для интернализации проблем (что на 16% выше исходного показателя по шкале ЧПР). Аналогично, более высокий на один СО уровень logx-трансформированного тиамина (что эквивалентно на 40% более высокому абсолютному уровню тиамина) ассоциировался с более высоким на 0,312 СО баллом по шкале ЧПР для проблем с интернализацией (что эквивалентно на 28% более высокому исходному баллу по шкале ЧПР). Суггестивные ассоциации с кластерным ВАВ более 0,5 (но менее 0,75) и условным ВАВ <0,5 для одного биомаркера в соответствующем кластере. Кластер биомаркеров 8 был положительно связан с общими проблемами (кластерный ВАВ = 0,631), соматическими жалобами (кластерный ВАВ = 0,583) и тревожными проблемами (кластерный ВАВ = 0,557). Кластер биомаркеров 9 положительно связан с соматическими жалобами (кластер ВАВ = 0,741), тревогой / депрессией (кластер ВАВ = 0,587), аффективными проблемами (кластер ВАВ = 0,529) и общими проблемами (кластер ВАВ = 0,529). Биомаркер кластера 6 (диметилглицин, холин, метилметакрилат (ММА) был обратно связан с интернализацией проблем (кластер ВАВ = 0,619), тревогой/депрессией (кластер ВАВ = 0,604), тревожными проблемами (кластер ВАВ = 0,544) и общими проблемами (кластер ВАВ = 0,519).
Таблица 2 Связь между уровнями циркулирующих биомаркеров материнской преконцепции и баллами по опроснику детского поведения (ЧПР) (Модель 2).
| Кластер | Биомаркер | ЧПР результат | БЯМРa (N = 109) | Линейная регрессия (общие данные, N = 117) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Кластерный ВАВ | Условный ВАВ | Прибли зительный расчетb | СО | Бета | СО | P-value | 95% CI | |||
| 8 | Флавинмононуклеотид | Интернализация | 0.828 | 0.624 | 0.189 | 0.243 | 0.177 | 0.102 | 0.084 | −0.024 до 0.377 |
| 8 | Рибофлавин | Интернализация | 0.828 | 0.376 | 0.115 | 0.217 | 0.182 | 0.093 | 0.049 | 0.001 до 0.364 |
| 9 | Тиамин | Интернализация | 0.768 | 0.775 | 0.220 | 0.231 | 0.312 | 0.089 | 5.0 × 10–4 | 0.136 до 0.487 |
| 9 | Тиаминмонофосфат | Интернализация | 0.768 | 0.110 | 0.025 | 0.101 | 0.241 | 0.095 | 0.011 | 0.054 до 0.428 |
| 9 | Пиридоксальфосфат | Интернализация | 0.768 | 0.049 | 0.004 | 0.033 | 0.149 | 0.095 | 0.118 | −0.038 до 0.336 |
| 9 | Пиридоксиновая кислота | Интернализация | 0.768 | 0.037 | 0.003 | 0.028 | 0.146 | 0.090 | 0.105 | −0.030 до 0.323 |
| 9 | Пиридоксаль | Интернализация | 0.768 | 0.030 | 0.000 | 0.015 | 0.096 | 0.084 | 0.256 | −0.070 до 0.261 |
- БЯМР Байесовская ядерная машинная регрессия, ЧПР Чеклист поведения ребенка, ДИ доверительный интервал, ВАВ возможность апостериорного включения, Rhat потенциальный коэффициент уменьшения шкалы, SE стандартная ошибка.
- a) БЯМР-анализ для каждого результата ЧПР проводился путем одновременного учета 67 биомаркеров (11 кластеров). В этой таблице представлены ассоциации, которые соответствуют следующим критериям: (1) ВАВ кластера более 0,75; (2) условный ВАВ для одного биомаркера в соответствующем кластере более 0,5; (3) эффективный размер выборки МЦМК более 100 для всех биомаркеров в кластере; и (4) ПКУБ (потенциальный коэффициент уменьшения масштаба) менее 1,1 для всех биомаркеров в кластере. Модель 2 скорректирована на пол ребенка, возраст на момент оценки ЧПР, этническую принадлежность матери, высшее образование матери, доход семьи, возраст матери на момент визита к врачу перед зачатием, была ли ранее беременность, индекс массы тела матери на момент визита к врачу, гестационный возраст при рождении и оценку психического здоровья матери на момент визита к врачу.
b) Оценки эффекта от БЯМР указывают на разницу в среднем результате, когда отдельное влияние фиксируется на уровне 75-го процентиля, по сравнению с тем, когда он фиксируется на уровне 25-го процентиля, когда все другие влияния фиксируются на уровне их медианного значения.
Рис. 2: Взаимосвязь “влияние-результат” с помощью Байесовой ядерной машинной регрессии (БЯМР) для кластеров биомаркеров и баллов по контрольному перечню поведения ребенка (ЧПР) (модель 2, N = 109).
Уровни биомаркеров и баллы по шкале ЧПР указаны в единицах стандартного отклонения. Серым цветом обозначен 95% доверительный интервал (возможность апостериорного включения (ВАВ)). а Связь кластера биомаркеров 8 с интернальными проблемами. b Связь кластера биомаркеров 9 с интернальными проблемами.
Анализ чувствительности, учитывающий только метаболиты, также показал допустимую связь между пренатальным ТМФ и проблемами интернализации (кластерный ВАВ = 0,696, условный ВАВ = 0,683), тогда как анализ чувствительности, учитывающий только микроэлементы и НАК, показал допустимую связь между пренатальным тиамином и проблемами интернализации (кластерный ВАВ = 0,719, условный ВАВ = 0,870). Кроме того, как для ТМФ, так и для тиамина была обнаружена связь с распространенными проблемами развития (ТМФ: кластерный ВАВ = 0,893, условный ВАВ = 0,833; тиамин: Кластерный ВАВ = 0,946, условный ВАВ = 0,958.
Анализ, стратифицированный по этнической принадлежности и СЭС с использованием линейной регрессии, показал, что тиамин и ТМФ были связаны с интернализацией проблем в группе семей с более высокими доходами (βтиамин = 0,361, Ртиамин = 0. 001; βТМФ = 0,327, РТМФ = 0,014 в модели 2), но не в группе с более низким уровнем дохода семей (βтиамин = 0,172, Ртиамин = 0,166; βТМФ = 0,082, РТМФ = 0,355 в модели 2.
Распределение БЯМР по этнической принадлежности и СЭС, учитывающее все биомаркеры одновременно, не проводилось из-за малого размера выборки, необходимого для корректировки ковариатов модели 2. Тем не менее, в модели 1 кластер биомаркеров 9 был связан с интернализацией проблем в группе семей с более высокими доходами (кластерный ВАВ = 0,818, условный ВАВ для ТМФ = 0,893; дополнительный рис. 1), но не в группе семей с более низкими доходами (кластерный ВАВ = 0,339, условный ВАВ для ТМФ = 0,306; дополнительный рис. 1).
Преконцепционные материнские биомаркеры и показатели МРТ
Более высокий уровень тиамина перед беременностью номинально обратно связан с неонатальным ОДИ правого субталамического ядра (N = 56, P-значение = 0,010, ЧЛО (частота ложных открытий) = 0,972, дополнительные рис. 2 і 3). Неонатальный ОДИ правого субталамического ядра был обратно связан с несколькими показателями ЧПР (N = 37), включая проблемы с вниманием (P-значение = 0,001, ЧЛО = 0,008), СДВГ (P-значение = 0,005, ЧЛО = 0,041) и проблемы с экстернализацией (P-значение = 0,012, ЧЛО = 0,062). Анализ причинно-следственных связей показал, что тиамин перед беременностью номинально связан с общими проблемами ЧПР (N = 63, β = 0,551, P = 0,038, 95% ДИ 0,030-1,072 для общего эффекта). Однако истинный (P = 0,856) и общие (P = 0,909) естественные косвенные эффекты через неонатальную ОДИ правого субталамического ядра для этой ассоциации не были значимыми.
Мы оценили, что доля, опосредованная неонатальным ОДИ правого субталамического ядра, составляла 1,8% (95% ДИ от -29% до 33%). Не было выявлено существенных различий между чистыми и общими естественными косвенными эффектами, что свидетельствует о том, что опосредованное взаимодействие было маловероятным.
Обсуждение
В этом исследовании мы впервые обнаружили связь между материнскими циркулирующими биомаркерами преконцепции и поведенческими симптомами ребенка в возрасте 3 лет. В полностью скорректированной модели мы обнаружили, что кластер биомаркеров 9 (тиамин, ТМФ, пиридоксальфосфат, пиридоксиновая кислота и пиридоксаль) положительно связан с проблемами интернализации, а тиамин был движущей силой ассоциации кластера. При исследовании метаболитов отдельно от микроэлементов и НАК ассоциации тиамина и ТМФ с проблемами интернализации сохранились, хотя и с более низкими кластерными ВАВ. Как тиамин, так и ТМФ также были последовательно связаны с распространенными проблемами развития в анализах чувствительности. В общем, мы нашли доказательства связи между биомаркерами тиаминовой цепи, связанными с преконцепцией матери, и поведением ребенка. В стратифицированном по СЭС анализе эти связи сохранились только в группе с высоким уровнем дохода семей.
На наши выводы о высоких уровнях свободного тиамина и ТМФ, связанные с интернализацией проблем, в значительной степени повлияли высокие баллы по шкалам соматических жалоб и тревоги/депрессии, а также распространенные проблемы развития, которые в основном характеризуются задержками в развитии навыков социализации и общения. Это не согласуется с клиническими данными, согласно которым как пренатальный, так и детский дефицит тиамина связан с нежелательными последствиями развития ребенка, включая нарушения речевых и коммуникативных навыков [35,36,37]. Дефицит тиамина обычно рассматривается как проблема здоровья, связанная с плохим питанием в странах с низким и средним уровнем дохода и чрезмерным потреблением алкоголя в странах с высоким уровнем дохода [38], которые имеют низкую распространенность в нашей популяции и когорте преконцепции. Однако истинный риск недостаточности и/или субоптимального уровня тиамина у женщин репродуктивного возраста недостаточно изучен [39]. Тем не менее, диеты с высоким содержанием углеводов и потребление подслащенных сахаром напитков повышают потребность в тиаминпирофосфате (ТПФ), который является активной формой витамина В1 (составляет ~80% от общего содержания тиамина) и важным кофактором углеводного обмена [40, 41]. В крови ТПФ преимущественно присутствует в эритроцитах, тогда как свободный тиамин и ТМФ находятся преимущественно в плазме [41]. В нашей когорте биомаркеры измеряли с помощью образцов плазмы, и для этого исследования были доступны только свободный тиамин и ТМФ. По сравнению со здоровыми японскими женщинами того же возрастного диапазона [42], уровни свободного тиамина и ТМФ в нашей группе были ниже. Это может быть связано с различными диетическими схемами в Японии и Сингапуре, поскольку уровни свободного тиамина и ТМФ в плазме крови чувствительны к недавнему потреблению. Тиаминовый уровень, вместо этого, определяется эритроцитарным ТДФ или функциональной оценкой активности эритроцитарной транскетолазы (ЭТК) [41]. Тем не менее, консенсус относительно определения случаев дефицита тиамина не достигнут, и в предыдущих исследованиях использовались различные пороговые значения [41]. Высокое потребление кофеина, например, из кофе и чая, также препятствует всасыванию тиамина [43]. Учитывая то, что в Сингапуре популярна высокоуглеводная диета и потребление подслащенных сахаром напитков, кофе и чая [44], спрос на ТДФ может быть в целом высоким, а абсорбция тиамина может быть субоптимальной у населения. Это может привести к функционально неоптимальному уровню тиамина. С другой стороны, учитывая, что свободный тиамин фосфорилируется в ТДФ после всасывания, более высокий уровень свободного тиамина может быть результатом неоптимального фосфорилирования, что ингибирует синтез ТДФ [45]. В обоих случаях наше наблюдение может свидетельствовать о том, что функционально субоптимальный уровень ТДФ связан с проблемами интернализации и распространенными проблемами развития. Коэффициент активности ЭТК рассчитывается как отношение стимулированной активности ЭТК к базальной активности ЭТК и указывает на наличие ТДФ [46]. Однако в нашем исследовании коэффициент активности ЭТК не был доступен. Дальнейшие исследования, направленные на изучение функционального субоптимального уровня ТДФ, оправданы.
В нашем исследовательском анализе с использованием показателей МРТ головного мозга тиамин был обратно связан с неонатальным ОДИ правого субталамического ядра, тогда как неонатальный ОДИ правого субталамического ядра был обратно связан с несколькими показателями по шкале ЧПР. Сообщалось о гипоактивности субталамуса у детей с симптомами РАС [47]. Это свидетельствует о том, что может существовать потенциальный посреднический эффект через неонатальный ОДИ для положительных ассоциаций тиамина с проблемами интернализации и распространенными проблемами развития, оба из которых связаны с аутизмом [48, 49]. Формальный анализ опосредования показал, что небольшая часть общего эффекта преконцепционного тиамина на общие проблемы ЧПР была опосредована ОДИ правого субталамического ядра. Из-за меньшего размера выборки эти оценки были неточными и не преодолели наш порог для многократного тестирования.
Разное время сбора образцов для измерения биомаркеров и оценки поведенческих симптомов может повлиять на различия между нашими результатами и результатами предыдущих исследований. Ни одно предыдущее исследование не рассматривало показатели преконцепции, которые могут иметь решающее значение для нейроразвития. Из-за значительных изменений в объеме плазмы и метаболизме, концентрации, измеренные во время беременности, могут не отражать периконцептуальные уровни. Предыдущие исследования сообщали, что более низкий уровень фолатов у матери во время ранней беременности (<18 недель гестации) был связан с детской гиперактивностью и проблемами со сверстниками [50], а также с интернализацией, но не экстернализацией ЧПР в возрасте ~3 лет [51]. В нашем анализе кластер биомаркеров 4 (бетаин, кобаламин, фолат, триметиламин N-оксид, витамин D3) был предположительно связан с интернализацией проблем (кластерный ВАВ = 0,529), но ни один из биомаркеров в кластере не был выбран в более 50% моделей (условный ВАВ < 0,5). Это может свидетельствовать о том, что критическое окно для фолатов во время беременности, а не перед зачатием.
Употребление пищевых добавок и рацион питания матерями обычно оценивают с помощью опросников в эпидемиологических исследованиях [52, 53]. Такая оценка уязвима к искажению памяти и предвзятости вследствие социальной желательности [54]. Кроме того, вопросы о частоте употребления добавок часто базируются на широких определениях, таких как поливитамины [53]. Таким образом, может возникнуть ошибочная классификация, и точное потребление не может быть оценено. Объективные показатели циркулирующих микроэлементов или метаболитов почти исключительно изучаются во время беременности, а не до зачатия [20]. На очень ранней стадии беременности эмбрион получает питательные вещества из жидкостей репродуктивного тракта и эндометрия [55, 56]. Таким образом, материнские преконцепционные циркулирующие биомаркеры могут указывать не только на потребление и метаболизм компонентов рациона матери [57], но и на обеспеченность плода питательными веществами во время зачатия и на очень ранней стадии беременности [58]. Таким образом, в нашем анализе исследование циркулирующих биомаркеров до зачатия может быть использовано как индикатор состояния питания матери, и обеспеченности плода питательными веществами [57, 58], а также может дать представление о критическом окне для диетических коррекций. Это не изучалось в большинстве когорт родов, где участники обычно регистрировались либо через некоторое время после зачатия, либо при рождении. Кроме того, существующие исследования материнских биомаркеров и последствий для здоровья потомков в основном исследовали биомаркеры отдельно или как латентный фактор нескольких биомаркеров [59, 60]. Однако питательные вещества и метаболиты не действуют независимо. Мы учли сложные взаимодействия между биомаркерами, применив кластеризацию по методу K-средних и БЯМР, который использует преимущества автоматического программного подбора для характеристики профиля влияния нескольких биомаркеров и включает байесовский отбор переменных. Это помогает разгадать релевантность пищевых компонентов и потенциальный биологический путь, а также повысить статистическую мощность. Тем не менее, следует также отметить несколько ограничений нашего исследования.
Во-первых, анализы в этом исследовании имели небольшой размер выборки и относительно большое количество биомаркеров, что могло снизить эффективность повторной выборки МЦМК. Поэтому мы рассматриваем только результаты с эффективным размером выборки МЦМК, превышающим 100, и потенциальным коэффициентом уменьшения масштаба, меньше 1,1. Мы также провели несколько дополнительных анализов, чтобы оценить согласованность наших выводов. Во-вторых, анализ БЯМР был недоступен для некоторых подгрупп в стратифицированных анализах из-за ограниченного размера выборки. Для тех подгрупп, где было проведено как БЯМР, так и линейную регрессию, большие кластерные и условные ВАВ с БЯМР соответствовали меньшему P-value из линейной регрессии. Тем не менее, эти результаты следует интерпретировать с осторожностью. В-третьих, могут существовать полоспецифические эффекты и критические интервалы; однако мы не можем исследовать это из-за малого размера выборки. В-четвертых, измерения эритроцитарного ТДФ или функционального анализа биологической активности тиамина (то есть активности ЭТК) были недоступны. Это могло бы помочь проверить, соответствует ли наше предположение о функционально субоптимальном статусе ТДФ действительности. Тем не менее, наши результаты свидетельствуют о том, что мониторинг функциональных биомаркеров тиамина может быть более информативным. И последнее, но не менее важное: поведенческие симптомы ребенка, полученные на основе опросника, заполненного родителями, могут быть искажены факторами, связанными с происхождением родителей. Однако оценка исследователей или врачей ограничена временем, которое они могут потратить на каждого ребенка, поэтому она может не отражать повседневное поведение ребенка.
Заключение
В этом исследовании мы обратились к критическому пробелу в существующей литературе, исследуя ассоциации материнских преконцепционных биомаркеров с поведением ребенка, о котором сообщают родители, чтобы обойти путаницу, связанную с изменениями во время беременности. Используя методы кластеризации и смешивания для учета сложного взаимодействия между биомаркерами, мы обнаружили связь между повышенным уровнем тиамина в плазме крови матери и ТМФ с проблемами интернализации и распространенными проблемами развития, что позволяет предположить, что функциональный метаболизм тиамина может быть важным для женщин, планирующих беременность. Далее мы формально оценили, в какой степени микроструктура головного мозга новорожденных опосредует наблюдаемые взаимосвязи. Мы не нашли точных доказательств посредничества через неонатальную ОДИ при заданных нами пороговых значениях, поэтому необходимы дальнейшие исследования, изучающие другие потенциальные механизмы посредничества.
Ссылки
- Ogundele MO. Behavioural and emotional disorders in childhood: a brief overview for paediatricians. World J Clin Pediatr. 2018;7:9–26.
- Narusyte J, Ropponen A, Alexanderson K, Svedberg P. Internalizing and externalizing problems in childhood and adolescence as predictors of work incapacity in young adulthood. Soc Psychiatry Psychiatr Epidemiol. 2017;52:1159–68.
- Woo BS, Ng TP, Fung DS, Chan YH, Lee YP, Koh JB, et al. Emotional and behavioural problems in Singaporean children based on parent, teacher and child reports. Singap Med J. 2007;48:1100–6.
- Polanczyk GV, Salum GA, Sugaya LS, Caye A, Rohde LA. Annual Research Review: a meta-analysis of the worldwide prevalence of mental disorders in children and adolescents. J Child Psychol Psychiatry. 2015;56:345–65.
- Shaw M, Hodgkins P, Caci H, Young S, Kahle J, Woods AG, et al. A systematic review and analysis of long-term outcomes in attention deficit hyperactivity disorder: effects of treatment and non-treatment. BMC Med. 2012;10:99.
- Mick E, McGough J, Loo S, Doyle AE, Wozniak J, Wilens TE, et al. Genome-wide association study of the child behavior checklist dysregulation profile. J Am Acad Child Adolesc Psychiatry. 2011;50:807–17.e808.
- Hess JL, Nguyen NH, Suben J, Meath RM, Albert AB, Van Orman S, et al. Gene co-expression networks in peripheral blood capture dimensional measures of emotional and behavioral problems from the Child Behavior Checklist (ЧПР). Transl Psychiatry. 2020;10:328.
- Bagner DM, Rodriguez GM, Blake CA, Linares D, Carter AS. Assessment of behavioral and emotional problems in infancy: a systematic review. Clin Child Fam Psychol Rev. 2012;15:113–28.
- Bagner DM, Pettit JW, Lewinsohn PM, Seeley JR. Effect of maternal depression on child behavior: a sensitive period? J Am Acad Child Adolesc Psychiatry. 2010;49:699–707.
- Stephenson J, Heslehurst N, Hall J, Schoenaker D, Hutchinson J, Cade JE, et al. Before the beginning: nutrition and lifestyle in the preconception period and its importance for future health. Lancet. 2018;391:1830–41.
- World Health Organization. WHO recommendations on antenatal care for a positive pregnancy experience. 2020.
- Ecker C, Bookheimer SY, Murphy DG. Neuroimaging in autism spectrum disorder: brain structure and function across the lifespan. Lancet Neurol. 2015;14:1121–34.
- Prem S, Millonig JH, DiCicco-Bloom E. Dysregulation of neurite outgrowth and cell migration in autism and other neurodevelopmental disorders. Adv Neurobiol. 2020;25:109–53.
- Castellanos FX, Giedd JN, Marsh WL, Hamburger SD, Vaituzis AC, Dickstein DP, et al. Quantitative brain magnetic resonance imaging in attention-deficit hyperactivity disorder. Arch Gen Psychiatry. 1996;53:607–16.
- McAlonan GM, Cheung V, Cheung C, Chua SE, Murphy DG, Suckling J, et al. Mapping brain structure in attention deficit-hyperactivity disorder: a voxel-based MRI study of regional grey and white matter volume. Psychiatry Res. 2007;154:171–80.
- Hazlett HC, Gu H, Munsell BC, Kim SH, Styner M, Wolff JJ, et al. Early brain development in infants at high risk for autism spectrum disorder. Nature. 2017;542:348–51.
- Stiles J, Jernigan TL. The basics of brain development. Neuropsychol Rev. 2010;20:327–48.
- Copf T. Impairments in dendrite morphogenesis as etiology for neurodevelopmental disorders and implications for therapeutic treatments. Neurosci Biobehav Rev. 2016;68:946–78.
- Fleming TP, Watkins AJ, Velazquez MA, Mathers JC, Prentice AM, Stephenson J, et al. Origins of lifetime health around the time of conception: causes and consequences. Lancet. 2018;391:1842–52.
- Li M, Francis E, Hinkle SN, Ajjarapu AS, Zhang C. Preconception and prenatal nutrition and neurodevelopmental disorders: a systematic review and meta-analysis. Nutrients. 2019;11:1628.
- Loo EXL, Soh SE, Loy SL, Ng S, Tint MT, Chan SY, et al. Cohort profile: Singapore Preconception Study of Long-Term Maternal and Child Outcomes (S-PRESTO). Eur J Epidemiol. 2021;36:129–42.
- Shahwan S, Abdin E, Shafie S, Chang S, Sambasivam R, Zhang Y, et al. Prevalence and correlates of smoking and nicotine dependence: results of a nationwide cross-sectional survey among Singapore residents. BMJ Open. 2019;9:e032198.
- Steinley D. K-means clustering: a half-century synthesis. Br J Math Stat Psychol. 2006;591:1–34.
- Zhang H, Schneider T, Wheeler-Kingshott CA, Alexander DC. NODDI: practical in vivo neurite orientation dispersion and density imaging of the human brain. Neuroimage. 2012;61:1000–16.
- Chang YS, Owen JP, Pojman NJ, Thieu T, Bukshpun P, Wakahiro ML, et al. White matter changes of neurite density and fiber orientation dispersion during human brain maturation. PLoS ONE. 2015;10:e0123656.
- Makropoulos A, Gousias IS, Ledig C, Aljabar P, Serag A, Hajnal JV, et al. Automatic whole brain MRI segmentation of the developing neonatal brain. IEEE Trans Med Imaging. 2014;33:1818–31.
- Branco T, Hausser M. The single dendritic branch as a fundamental functional unit in the nervous system. Curr Opin Neurobiol. 2010;20:494–502.
- Bobb JF, Valeri L, Claus Henn B, Christiani DC, Wright RO, Mazumdar M, et al. Bayesian kernel machine regression for estimating the health effects of multi-pollutant mixtures. Biostatistics. 2015;16:493–508.
- Brooks SP, Gelman A. General methods for monitoring convergence of iterative simulations. J Comput Graph Stat. 1998;7:434–55.
- VanderWeele TJ. A unification of mediation and interaction: a 4-way decomposition. Epidemiology. 2014;25:749–61.
- Mandel M. Simulation-based confidence intervals for functions with complicated derivatives. Am Statistician. 2013;67:76–81.
- Lindsay KL, Buss C, Wadhwa PD, Entringer S. The interplay between maternal nutrition and stress during pregnancy: issues and considerations. Ann Nutr Metab. 2017;70:191–200.
- Najman JM, Williams GM, Nikles J, Spence S, Bor W, O’Callaghan M, et al. Bias influencing maternal reports of child behaviour and emotional state. Soc Psychiatry Psychiatr Epidemiol. 2001;36:186–94.
- Chilcoat HD, Breslau N. Does psychiatric history bias mothers’ reports? An application of a new analytic approach. J Am Acad Child Adolesc Psychiatry. 1997;36:971–9.
- Kloss O, Eskin NAM, Suh M. Thiamin deficiency on fetal brain development with and without prenatal alcohol exposure. Biochem Cell Biol. 2018;96:169–77.
- Dhir S, Tarasenko M, Napoli E, Giulivi C. Neurological, psychiatric, and biochemical aspects of thiamine deficiency in children and adults. Front Psychiatry. 2019;10:207.
- Dias FM, Silva DM, Doyle FC, Ribeiro AM. The connection between maternal thiamine shortcoming and offspring cognitive damage and poverty perpetuation in underprivileged communities across the world. Med Hypotheses. 2013;80:13–16.
- Bourassa MW, Bergeron G, Brown KH. A fresh look at thiamine deficiency-new analyses by the global thiamine alliance. Ann N Y Acad Sci. 2021;1498:5–8.
- Marrs C, Lonsdale D. Hiding in plain sight: modern thiamine deficiency. Cells. 2021;10:2595.
- Gomes F, Bergeron G, Bourassa MW, Fischer PR. Thiamine deficiency unrelated to alcohol consumption in high-income countries: a literature review. Ann N Y Acad Sci. 2021;1498:46–56.
- Whitfield KC, Bourassa MW, Adamolekun B, Bergeron G, Bettendorff L, Brown KH, et al. Thiamine deficiency disorders: diagnosis, prevalence, and a roadmap for global control programs. Ann N Y Acad Sci. 2018;1430:3–43.
- Ihara H, Hirano A, Wang L, Okada M, Hashizume N. Reference values for whole blood thiamine and thiamine phosphate esters in Japanese adults. J Anal Bio-Sci. 2005;28:241–6.
- Lonsdale D. A review of the biochemistry, metabolism and clinical benefits of thiamin(e) and its derivatives. Evid Based Complement Altern Med. 2006;3:49–59.
- Research & Strategic Planning Division HPB. National Nutrition Survey (Singapore). Singapore: Health Promotion Board; 2010.
- Tylicki A, Łotowski Z, Siemieniuk M, Ratkiewicz A. Thiamine and selected thiamine antivitamins – biological activity and methods of synthesis. Biosci Rep. 2018;38:BSR20171148.
- Jones KS, Parkington DA, Cox LJ, Koulman A. Erythrocyte transketolase activity coefficient (ETKAC) assay protocol for the assessment of thiamine status. Ann N Y Acad Sci. 2021;1498:77–84.
- van Hulst BM, de Zeeuw P, Rijks Y, Neggers SFW, Durston S. What to expect and when to expect it: an fMRI study of expectancy in children with СДВГ symptoms. Eur Child Adolesc Psychiatry. 2017;26:583–90.
- Bauminger N, Solomon M, Rogers SJ. Externalizing and internalizing behaviors in ASD. Autism Res. 2010;3:101–12.
- Fombonne E. Epidemiology of pervasive developmental disorders. Pediatr Res. 2009;65:591–8.
- Schlotz W, Jones A, Phillips DI, Gale CR, Robinson SM, Godfrey KM. Lower maternal folate status in early pregnancy is associated with childhood hyperactivity and peer problems in offspring. J Child Psychol Psychiatry. 2010;51:594–602.
- Steenweg-de Graaff J, Roza SJ, Steegers EA, Hofman A, Verhulst FC, Jaddoe VW, et al. Maternal folate status in early pregnancy and child emotional and behavioral problems: the Generation R Study. Am J Clin Nutr. 2012;95:1413–21.
- Wingrove K, Lawrence MA, McNaughton SA. A systematic review of the methods used to assess and report dietary patterns. Front Nutrition. 2022;9:892351.
- Park S-Y, Murphy SP, Wilkens LR, Yamamoto JF, Kolonel LN. Allowing for variations in multivitamin supplement composition improves nutrient intake estimates for epidemiologic studies. J Nutr. 2006;136:1359–64.
- Miller TM, Abdel-Maksoud MF, Crane LA, Marcus AC, Byers TE. Effects of social approval bias on self-reported fruit and vegetable consumption: a randomized controlled trial. Nutr J. 2008;7:18.
- Harris SE, Gopichandran N, Picton HM, Leese HJ, Orsi NM. Nutrient concentrations in murine follicular fluid and the female reproductive tract. Theriogenology. 2005;64:992–1006.
- Hempstock J, Cindrova-Davies T, Jauniaux E, Burton GJ. Endometrial glands as a source of nutrients, growth factors and cytokines during the first trimester of human pregnancy: a morphological and immunohistochemical study. Reprod Biol Endocrinol. 2004;2:58.
- Potischman N, Freudenheim JL. Biomarkers of nutritional exposure and nutritional status: an overview. J Nutr. 2003;133:873S–874S.
- Belkacemi L, Nelson DM, Desai M, Ross MG. Maternal undernutrition influences placental-fetal development. Biol Reprod. 2010;83:325–31.
- Irwin JL, McSorley EM, Yeates AJ, Mulhern MS, Strain JJ, Watson GE, et al. Maternal immune markers during pregnancy and child neurodevelopmental outcomes at age 20 months in the Seychelles Child Development Study. J Neuroimmunol. 2019;335:577023.
- Strom M, Halldorsson TI, Hansen S, Granstrom C, Maslova E, Petersen SB, et al. Vitamin D measured in maternal serum and offspring neurodevelopmental outcomes: a prospective study with long-term follow-up. Ann Nutr Metab. 2014;64:254–61.