Резюме
Мета
Валідація програмного забезпечення для УЗД, яке використовує трансперінеальне ультразвукове дослідження для діагностики опущення матки (ОМ).
Методи
Багатоцентрове, обсерваційне, проспективне дослідження за участю 155 пацієнток, які мали показання до оперативного втручання з приводу дисфункціональної патології тазового дна. Кожній пацієнтці в операційній під наркозом проводили обстеження за допомогою маткових щипців з подальшою хірургічною корекцією ОМ ІІ-ІV стадії в умовах анестезії. Для оцінки різниці у розмірах лобково-маточного дна використовували трансперінеальне ультразвукове дослідження. За допомогою багатофакторної логістичної регресійної бінарної моделі (з вимірюванням УЗД у стані спокою, проби Вальсальви та віку) з використанням неавтоматизованих методів прогнозування ОМ. З метою оцінки моделі була побудована таблиця з координатами робочої характеристики приймача (ROC), після чого була проведена оцінка чутливості та специфічності.
Результати
Всього було включено 153 пацієнти (73 з діагнозом хірургічного ОМ). Вона була отримана на основі AUC (0,89) ймовірностей, передбачених моделлю (95% довірчий інтервал, 0,84-0,95; P < 0,0005). На основі ROC-кривої для моделі було отримано чутливість 91,8% і специфічність 72,7%, що є вищими показниками, ніж для клінічного обстеження при хірургічному ОМ (чутливість: 80,8%; специфічність: 71,3%).
Висновки
Ми перевірили програмне забезпечення, яке використовує трансперінеальне ультразвукове дослідження тазового дна та вік пацієнта для встановлення більш надійного діагнозу хірургічного ОМ, ніж той, що отриманий при клінічному обстеженні.
Абревіатури
ІМТ
індекс маси тіла
ДІ
довірчий інтервал
МКТ ПОМ-К
Кількісна оцінка пролапсу органів малого тазу Міжнародного континентального товариства
ПОМ
пролапс органів малого тазу
СНС
стресове нетримання сечі
ОМ
опущення матки
ІНС
імперативне нетримання сечі
Існують індивідуальні особливості, які можуть сприяти появі та прогресуванню пролапсу органів малого тазу (ПОМ).1, 2 Підтримання механізмів підтримки таза за допомогою фізичної активності є сумнівним,3 тому хірургічне втручання іноді стає вирішенням цієї патології. Однак гістеректомія має ряд ускладнень,4 включаючи ризик рецидиву опущення тазових органів після операції.5 Існують різні типи рецидивів пролапсу органів малого тазу,6, 7 і рекомендовані різні хірургічні методики для уникнення таких подій.8 Існують численні фактори ризику, які впливають на рецидив ПОМ,9, 10 причому основним механізмом є опускання апікальної опори після вагінальної гістеректомії,11, 12 на додаток до її зв’язку з нетриманням сечі.13, 14 Тому правильний діагноз перед операцією має вирішальне значення для правильного лікування пацієнток.
Кількісна оцінка пролапсу органів малого тазу Міжнародного континентального товариства (МКТ ПОМ-К)15 є класичним методом оцінки опущення матки (ОМ) перед операцією. Однак було доведено, що візуалізаційні тести, такі як магнітно-резонансна томографія (МРТ), є порівнянними з клінічними оцінками для оцінки пролапсу матки.16 Однак обидва методи діагностики мають різні обмеження, оскільки клінічні обстеження охоплюють лише анатомічну поверхню, використовуючи дівочу пліву як рухому точку відліку,15 а МРТ, яка є більш економічно вигідним тестом, не завжди доступна для клініцистів для дослідження ПОМ.
УЗД тазового дна стало корисним інструментом у діагностиці ПОМ, встановлюючи значне опущення кожного відділу по відношенню до задньо-нижнього краю лобкового симфізу під час проби Вальсальви.17, 18 Крім того, диференціальна діагностика в межах кожного відділу була визначена сонографічно, для переднього 19–21, середнього 22, 23 та заднього 24 відділів. Ультразвукова діагностика ОМ ґрунтується на вимірюванні положення дна матки між станом спокою і пробою Вальсальви по відношенню до лобка; ОМ визначається, коли цей показник становить ≥15 мм (чутливість: 75% і специфічність: 95%).22 Однак, ОМ є багатофакторним утворенням, і цей аспект слід враховувати при постановці діагнозу. З цієї причини були запропоновані різні багатофакторні регресійні моделі, в яких для постановки діагнозу ОМ використовувалося трансперінеальне ультразвукове дослідження.25 Модель, що включає вимірювання різниці між лобково-маточним дном у стані спокою і під час маневру Вальсальви, а також вік, продемонструвала максимальну дискримінаційну здатність, при цьому була більш простою в застосуванні в рутинній клінічній практиці, правильно діагностуючи 96,7% пацієнтів з ОМ.25 Однак ця модель має ряд обмежень, оскільки популяції, які вивчалися для її розробки, включали пацієнток з ОМ і пацієнток з подовженням шийки матки без ОМ; крім того, модель не має зовнішньої валідації.25 Тому метою цього багатоцентрового дослідження була валідація програмного забезпечення для ультразвукового дослідження, яке використовує трансперінеальне ультразвукове дослідження для діагностики ОМ.
Матеріали та методи
Досліджувана група
Це було багатоцентрове, обсерваційне та проспективне дослідження. У ньому брали участь чотири лікарні (Університетська лікарня Вальме в Севільї [Іспанія], Університетський медичний комплекс Гран-Канарія [Іспанія], Університетський медичний комплекс Леона [Іспанія] та Університетська лікарня Вірхен де ла Вікторія в Малазі [Іспанія]).
Загалом 155 пацієнтів були послідовно набрані в період з 1 вересня 2021 року по 30 вересня 2022 року.
Пацієнтки були відібрані під час спеціалізованої консультації з питань тазового дна в кожному центрі і повинні були відповідати наступним критеріям включення:
- Показання до хірургічного втручання з приводу дисфункціональної патології тазового дна, корекції ПОМ або хірургічного лікування нетримання сечі з використанням безнатяжних стрічок; та
- Ознайомлення та підписання інформованої згоди на участь у дослідженні.
Всі пацієнтки, які мали в анамнезі попередні коригувальні операції з приводу патології тазового дна або попередню гістеректомію, були виключені.
Метод дослідження
Оцінка під час консультації
Всі пацієнти, включені в дослідження, були обстежені під час консультацій, де проводилося стандартизоване анкетування та клінічне обстеження з використанням системи МКТ ПОМ-К для оцінки наявності та стадії ПМО.15 Клінічний ОМ з критеріями хірургічних показань визначався як ОМ II-IV стадії (симптоматичний та такий, що впливає на якість життя), представлений під час консультації. У випадках нетримання сечі визначали тип нетримання (стресове нетримання сечі [СНС] або імперативне нетримання сечі [ІСН]), а стан СНС визначали за допомогою простого стрес-тесту. У разі сумнівів для підтвердження типу нетримання сечі проводили уродинамічне дослідження.
Оцінка в операційній
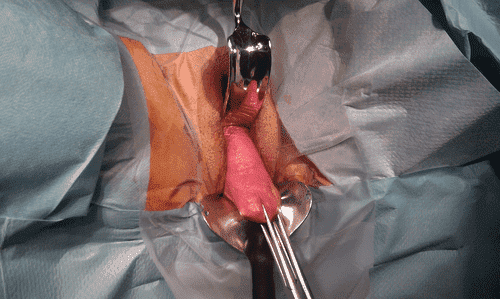
Кожній пацієнтці в операційній проводили анестезію, а перед операцією хірурги виконували повторне обстеження за допомогою маткових щипців для визначення опущення матки за системою МКТ ПОМ-К. Хірургічну корекцію ОМ проводили, коли при обстеженні за допомогою маткових щипців виявляли II-IV стадії ОМ (симптоматичні та такі, що впливають на якість життя) за системою МКТ ПОМ-К15 (Зобр. 1) (діагностика ПМ за допомогою маткових щипців з хірургічними критеріями [золотий стандарт]).
Зображення 1
Діагностика ОМ за допомогою маткових щипців.
Ультразвукова оцінка
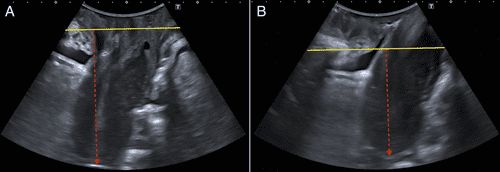
Трансперінеальні УЗД виконували фахівці з УЗД органів малого тазу з кожної лікарні; експерти не були обізнані з результатами клінічного обстеження. Використовувалися ультразвукові апарати Canon i600 Aplio® (Canon Medical Systems Corp., Токіо, Японія) з тривимірним абдомінальним датчиком PVT-675MV та ультразвукова система Voluson E8 (GE Healthcare, Zipf, Австрія) з датчиком гучності 8-4-МГц. Зображення були отримані у пацієнтів в положенні дорсальної літотомії з порожнім сечовим міхуром.26, 27 Для отримання зображень використовували раніше описану методику, проводячи вимірювання 25 в стані спокою і під час проби Вальсальви (мінімум 6 с28). Рух матки встановлювали шляхом розрахунку різниці між лобково-маточним дном (у стані спокою та за Вальсальвою)25 (Зобр. 2). Вимірювання проводили всередині задньонижнього відділу лобка, згідно з раніше встановленою методикою 25, 29 , вимірюючи лобково-маткове дно та різницю лобково-маткового дна у стані спокою та під час проби Вальсальви.
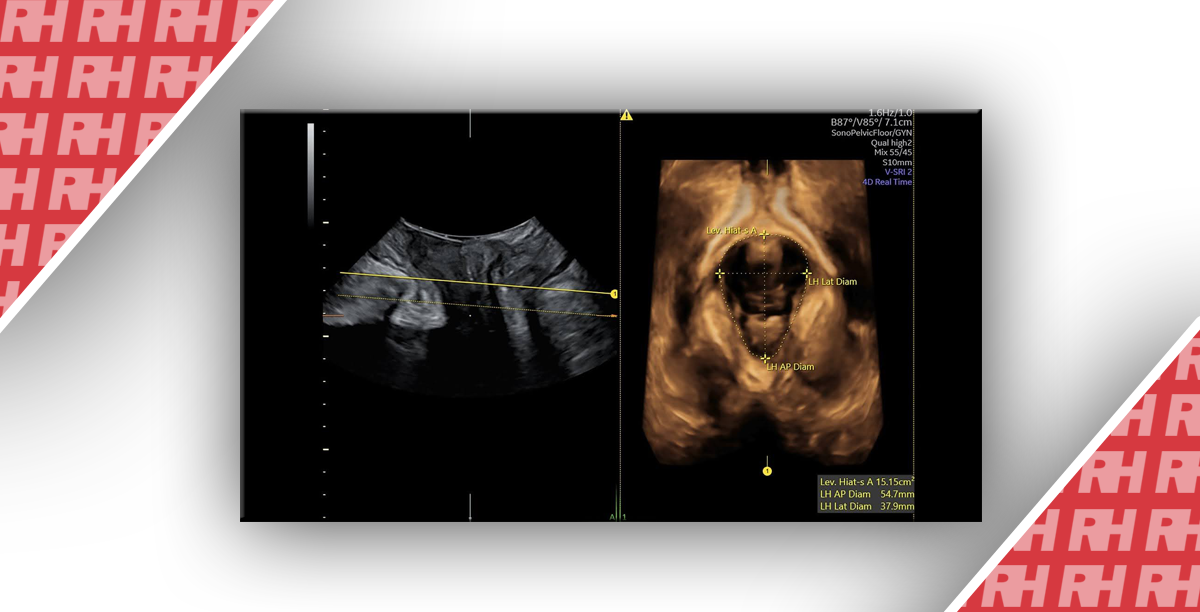
Зображення 2
Ультразвукове дослідження опущення матки. Жовта лінія обмежує задньо-нижній край лобка, а червона стрілка – відстань між лобком і лоном у стані спокою (А) та за Вальсальвою (В).
Статистичне дослідження
Для числових змінних використовували середнє значення та стандартне відхилення, а для якісних змінних – відсоток. Для порівняння числових змінних використовували t-критерій Стьюдента або U-критерій Манна-Уітні, а для якісних змінних – χ2-критерій. Для визначення індивідуальної прогностичної здатності використовували ROC та AUC. Статистично значущим для всіх порівнянь вважався показник P < .005.
З параметрами, що використовувалися в описаному раніше програмному забезпеченні 25 , ми створили багатовимірну модель бінарної логістичної регресії, використовуючи неавтоматизовані методи для прогнозування ОМ, виконавши тест на адекватність (-2LL). Калібрування цієї моделі було проведено за допомогою тесту Хосмера-Лемешоу, і були проведені подальші калібрування. Дискримінаційна здатність моделі була визначена за допомогою статистики С-індекс Харрелла (отримана як AUC).
У таблиці з координатами ROC-кривої отримано точку відсікання для аналізу чутливості і специфічності та оцінки її використання в діагностиці ОМ; включено 95% довірчі інтервали (ДІ). Статистичний аналіз проводили за допомогою статистичного програмного забезпечення IBM SPSS версії 28 (IBM, Armonk, Нью-Йорк).
Обсяг вибірки
На основі формули Педуці, враховуючи мінімальну кількість подій на змінну 10 (Harrell, 2005) і діагноз пролапсу 20%, для цього дослідження був потрібен 101 пацієнт. З цих 101 пацієнта 20 мали ОМ, а 81 не мали ОМ. Таким чином, наше дослідження відповідало вищезазначеним умовам.
Результати
Всього було набрано 155 пацієнтів, 2 з яких були виключені, оскільки обстеження не проводилося за допомогою маткових щипців. Зі 153 пацієнтів, які завершили дослідження, у 73 було виявлено хірургічну ОМ при обстеженні за допомогою маткових щипців, з приводу якої було виконано коригуючу операцію, а у 80 не було виявлено хірургічної ОМ при обстеженні за допомогою маткових щипців (Табл. 1). Між 2 групами була статистично значуща різниця за віком (62,3 проти 53,9; P < 0,001), кількістю вагінальних пологів (2,4 проти 2,0; P = 0,041), наявністю стресового нетримання сечі (21,9% проти 45. 0%; P = 0,004), цистоцеле (89,0% проти 71,3%; P = 0,008), діагностований під час консультації ОМ (80,8% проти 28,7%; P < 0,001), ректоцеле (43,8% проти 26,3%; P = 0,027) та ентероцеле (15,1% проти 1,3%; P = 0,002).
Таблиця 1. Загальна та клінічна характеристика пацієнта включно
| З правильним хірургічним втручанням з приводу опущення матки (n = 73) | Без правильного хірургічного втручанням з приводу опущення матки (n = 80) | P | 95% ДІ | |
| Вік | 62.3 ± 10.3 | 53.9 ± 10.1 | <.001 | 5.1; 11.7 |
| Вагінальні пологи | 2.4 ± 1.5 | 2.0 ± 0.8 | .041 | 0.02; 0.8 |
| Аборти | 0.4 ± 0.7 | 0.5 ± 0.8 | .845 | −0.27; 0.22 |
| Кесарів розтин | 0.1 ± 0.5 | 0.1 ± 0.3 | .581 | −0.09; 0.17 |
| ІМТ | 27.1 ± 3.7 | 27.8 ± 4.5 | .337 | −2.2; 0.7 |
| Стресове нетримання сечі | 16/73 (21.9%) | 36/80 (45.0%) | .004 | −37.5; −8.6 |
| Імперативне нетримання сечі | 27/73 (37.0%) | 35/80 (43.8%) | .414 | −21.7; 8.7 |
| Цистоцеле | 65/73 (89.0%) | 57/80 (71.3%) | .008 | 5.2; 30.4 |
| Стадія I | 4/65 (6.1%) | 3/57 (5.3%) | .027 | −8.9; 10.2 |
| Стадія II | 15/65 (23.1%) | 26/57 (45.6%) | −37.9; −5.7 | |
| Стадія III | 46/65 (70.8%) | 28/57 (49.1%) | 4.3; 37.4 | |
| Опущення матки | 59/73 (80.8%) | 23/80 (28.7%) | <.001 | 38.5; 65.6 |
| Стадія I | 4/59 (6.8%) | 7/23 (30.4%) | .020 | −44.5; −6.1 |
| Стадія II | 14/59 (23.7%) | 6/23 (26.1%) | −24.7; 15.9 | |
| Стадія III | 37/59 (62.7%) | 10/23 (43.5%) | −4.3; 40.3 | |
| Стадія IV | 4/59 (6.8%) | 0/23 (0%) | −8.1; 16.2 | |
| Ректоцеле | 32/73 (43.8%) | 21/80 (26.3%) | .027 | 2.5; 32.6 |
| Стадія I | 13/32 (40.6%) | 11/21 (52.4%) | .723 | −36.2; 14.6 |
| Стадія II | 15/32 (46.9%) | 8/21 (38.1%) | −17.6; 32.8 | |
| Стадія III | 4/32 (12.5%) | 2/21 (9.5%) | −17.8; 20.0 | |
| Ентероцеле | 11/73 (15.1%) | 1/80 (1.3%) | .002 | 5.1; 22.6 |
| Стадія I | 4/11 (36.4%) | 1/1 (100%) | .496 | −84.8; 20.6 |
| Стадія II | 6/11 (54.5%) | 0/1 (0%) | −29.1; 78.7 | |
| Стадія III | 1/11 (9.1%) | 0/1 (0%) | −70.6; 37.7 |
Розміри лобково-маткового дна у пацієнток з діагнозом хірургічного ОМ та без нього при дослідженні за допомогою маткових щипців наведені в Табл. 2. Пацієнтки з діагнозом хірургічного ОМ при обстеженні за допомогою маткових щипців мали більші показники лобково-маткового дна у стані спокою (-70,7 проти -78,1; P = 0,015) та під час проби Вальсальви (-48,5 проти -71,0; P < 0,001). Крім того, різниця у показниках лобково-маткового дна у стані спокою та під час проби Вальсальви також була більшою у пацієнток з діагнозом хірургічного ОМ при обстеженні за допомогою маткових щипців (22,2 проти 7,1; P < 0,001).
Таблиця 2. Вимірювання, отримані в середньо-сагітальній площині в стані спокою та при пробі Вальсальви
| З правильним хірургічним втручанням з приводу опущення матки (n = 73) | Без правильного хірургічного втручанням з приводу опущення матки (n = 80) | P | 95% ДІ | |
| Вимірювання лобково-маткового дна | ||||
| Стан спокою | −70.7 ± 18.8 | −78.1 ± 18.0 | .015 | 1.5; 13.2 |
| Вальсальва | −48.5 ± 21.6 | −71.0 ± 19.7 | <.001 | 15.9; 29.1 |
| Вимірювання лобково-маткового дна. Різниця між станом спокою та Вальсальвою | 22.2 ± 15.2 | 7.1 ± 6.8 | <.001 | 11.3; 19.0 |
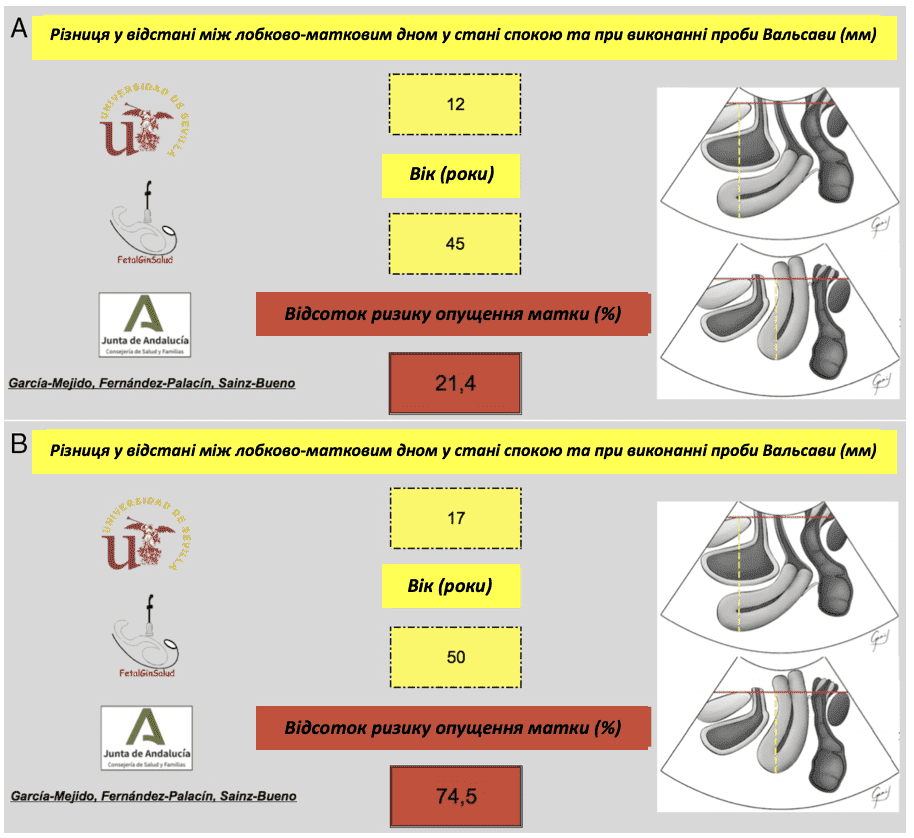
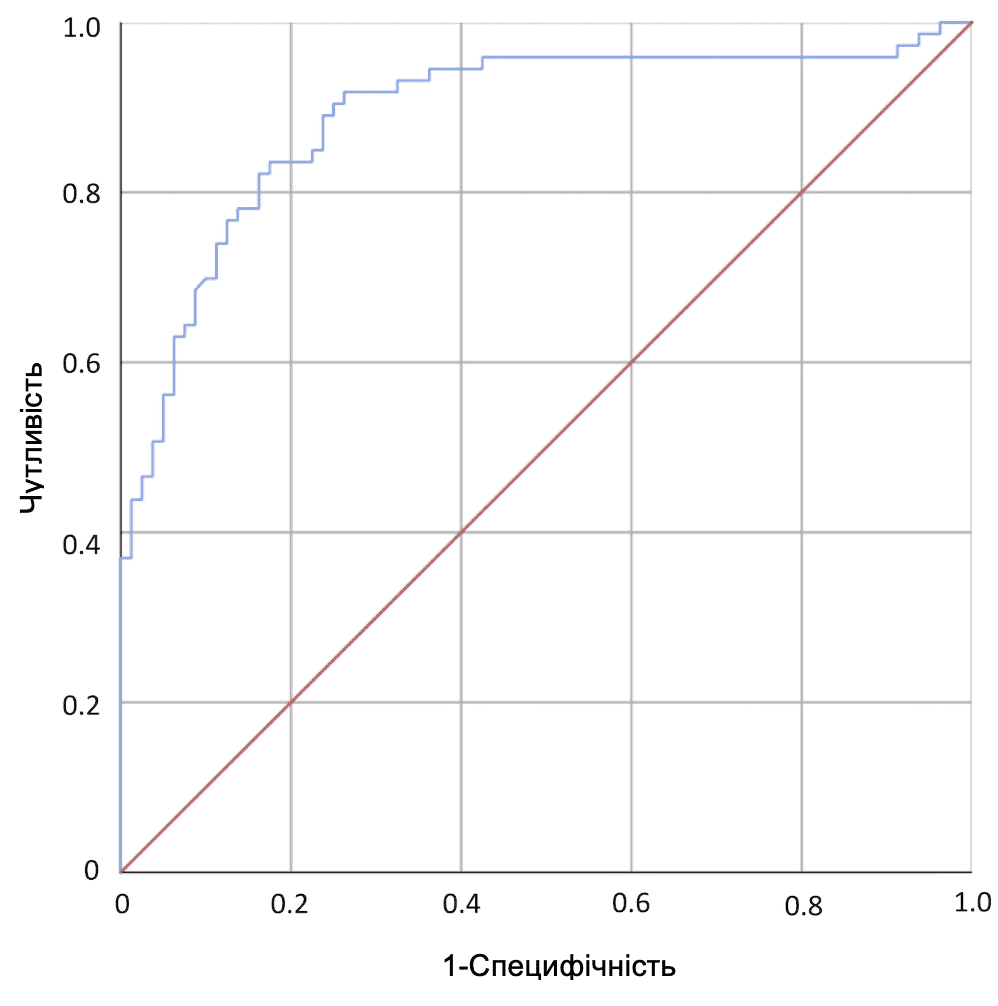
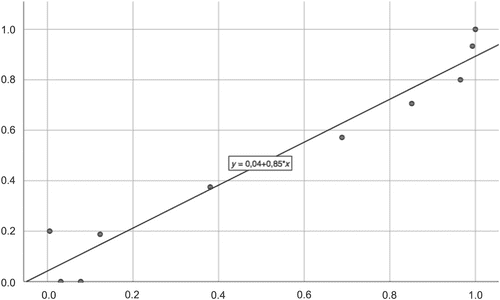
Дані, отримані для пацієнток, були застосовані до раніше опублікованої моделі, яка включає різницю у відстані між лобком та дном матки у стані спокою та під час проби Вальсальви, а також вік пацієнтки 25 (Зобр. 3). C-індекс Харрелла був отриманий з AUC (0,89) ймовірностей, передбачених моделлю (95% ДІ, 0,84-0,95; P < .0005) (Зобр. 4). Калібрування моделі було оцінено шляхом розрахунку калібрувального нахилу B, отримавши коефіцієнт детермінації 0,95 (95% ДІ, 0,86-1,00) (Зобр. 5). На основі ROC-кривої для моделі 30% було визначено як найбільш підходящу точку відсікання для ультразвукової діагностики хірургічного ОМ з чутливістю 91,8% і специфічністю 72,7%, що було вище, ніж для клінічного обстеження хірургічного ОМ (чутливість 80,8% і специфічність 71,3%) (Таблиця 3).
Зображення 3
Приклад використання бінарної моделі, що базується на різниці між лобково-маточною відстанню в стані спокою та при виконанні проби Вальсальви, а також на віці як предикторі розвитку ОМ. A, Пацієнтка віком 45 років з різницею між лобково-маточною відстанню в стані спокою та при виконанні проби Вальсальви 12 мм має персоніфікований ризик розвитку ОМ 21,4%. B, Пацієнтка віком 50 років з різницею між лобково-маточним дном у стані спокою та при проведенні проби Вальсальви 17 мм має персоніфікований ризик розвитку ОМ 74,5%.
Зображення 4
ROC-крива для логістичної регресійної моделі, отримана на основі зв’язку між різницею між відстанню між лобково-маточним дном у стані спокою та при виконанні проби Вальсальви і віком.
Зображення 5
Калібрувальний графік оригінальної логістичної регресійної моделі, отриманої для зв’язку між різницею між відстанню між лобком і дном матки в стані спокою та при виконанні проби Вальсальви і віком.
Таблиця 3. Порівняння діагностичних можливостей ультразвукового та клінічного обстеження
| Чутливість (%) | 95% ДІ | Специфічність | 95% ДІ | |
| Клінічне опущення матки з критеріями до хірургічних показань | 80.8 | 69.9; 89.1 | 71.3 | 60.1; 80.8 |
| Ультразвукове опущення матки з критеріями до хірургічних показань | 91.8 | 82.9; 96.9 | 72.5% | 61.4; 81.9 |
Обговорення
Основні висновки полягають у тому, що модель, яка враховує різницю у відстані між лобком і дном матки у стані спокою та під час проби Вальсальви, а також вік пацієнтки, має AUC 0,89 і калібрувальний нахил 0,95. За допомогою цієї моделі хірургічне ОМ можна визначити більш надійно, ніж при клінічному обстеженні, з більшою чутливістю (91,8% проти 80,8) і специфічністю (72,7 проти 71,3%). Раніше при ультразвуковому дослідженні ОМ діагностували, коли різниця між лобково-маточним дном у стані спокою і при виконанні проби Вальсальви становила ≥15 мм, з чутливістю 75%, що нижче, ніж у даному дослідженні.22 Вимірювання ≥15 мм різниці відстані між лобком і дном матки в стані спокою і під час проби Вальсальви показало в цьому багатоцентровому дослідженні дуже хорошу узгодженість з клінічними обстеженнями для виявлення ОМ з використанням системи МКТ ПОМ-К з каппа-індексом 0,826 (0,71; 0,94).30 Модель, перевірена в цьому дослідженні, має ряд переваг завдяки додаванню ізольованої точки відсікання; модель дозволяє включати різні ультразвукові вимірювання, які пов’язані з різним віком пацієнтів. Крім того, це багатоцентрове дослідження підтверджує, що ця методика може бути легко застосована під час консультацій різними експертами і в різних центрах, з відмінною надійністю між спостерігачами.23
Перші ультразвукові описи значних ПОМ середнього відділу базувалися на вимірюванні випинання шийки матки по відношенню до задньо-нижнього краю лобка під час проби Вальсальви.18 Згодом УЗД було використано для опису того, як проводити диференціальну діагностику ПОМ середнього відділу шляхом вимірювання різниці у відстані між лобком і дном матки у стані спокою та під час проби Вальсальви.22 Нарешті, за допомогою цього ж вимірювання можна було створити програмне забезпечення для персоналізації ризику ОМ у пацієнток з використанням ультразвукових вимірювань та віку.25 Вимірювання різниці відстані між лобком і дном матки в стані спокою та під час проби Вальсальви дозволяє опосередковано оцінити рівень Делансі I (прямокишково-матково-кардинальний комплекс зв’язок), встановлюючи більш достовірний діагноз ОМ, ніж при клінічному обстеженні, як показано в даному дослідженні. Одним з пояснень цього результату є те, що система МКТ ПОМ-К надає інформацію лише про анатомічну поверхню і використовує рухому точку м’яких тканин як референтну (дівочу пліву).15 Трансперінеальне УЗД дозволило визначити різні патології, які можуть впливати на диференціальну діагностику середнього відділу ПОМ.25, 30, 31 Фізіологічна основа цих досліджень базується на концепції, що ПОМ пов’язана з підтримкою зв’язок і закриттям щілини підіймача.32 Тому у пацієнтів з ПОМ з недостатньою апікальною підтримкою кардинальні зв’язки на 20% більші. Під час виконання проби Вальсальви ці зв’язки у пацієнтів з ПОМ вдвічі довші, ніж у пацієнтів з нормальною підтримкою.33 Виявлення пацієнтів з апікальною підтримкою за межами “нормального діапазону” корисно для уникнення непотрібного хірургічного лікування.31 У цьому дослідженні ми валідували раніше опубліковане програмне забезпечення, яке діагностує пацієнтів з хірургічним ОМ більш надійним способом, ніж клінічне обстеження.25 Інші попередні дослідження не описували перевагу ультразвукового дослідження над клінічною оцінкою при ПОМ менше 2 стадії, як визначено за допомогою ПОМ-К,34 або при симптоматичних ПОМ.35 Але спостерігалися різні кореляції, від хороших (r = 0,77)36 до поганих результатів,37 між клінічними обстеженнями при ПОМ середнього відділу та ультразвуковим дослідженням.
Основна перевага нашого дослідження полягає в тому, що перевірка цієї моделі була проведена в багатоцентровому дослідженні з когортою пацієнтів, які потребують хірургічного втручання з приводу різних дисфункцій тазового дна. Програмне забезпечення є простим у застосуванні (Зобр. 3), об’єктивним і має високу надійність у виявленні ймовірності страждань ОМ,25, 30 що робить його придатним для використання в типових клініках.
Аспект цього дослідження, який можна піддати критиці, – це метод оцінки апікальної підтримки.25 Апікальна підтримка визначається за нижнім кінцем шийки матки; але ми вважаємо, що, вивчаючи рухливість матки, ми опосередковано оцінюємо цю підтримку. Крім того, умови, в яких проводилися ультразвукові дослідження, були дуже специфічними. Не виключено, що таке положення може обмежувати вихід ПОМ, але не було описано жодних відмінностей між положенням дорсальної літотомії та положенням стоячи при низхідному виведенні ПОМ.38 Можна подумати, що існують випадки, коли візуалізація дна матки може бути ускладнена (наприклад, ревертована матка або ПОМ у задньому відділі). Однак, використання низьких частот і модифікації посилення ультразвукового апарату є достатнім для отримання зображення дна матки, що дозволяє отримати відмінну міжспостережну достовірність при вимірюванні різниці у відстані від лобкового симфізу до дна матки у стані спокою і під час проби Вальсальви.23
Висновки
На закінчення, ми перевірили програмне забезпечення, розроблене з використанням трансперінеального УЗД тазового дна та вік пацієнтки, яке дозволяє встановити більш надійний діагноз, ніж при клінічному обстеженні для хірургічного ОМ.
Посилання на джерела
- Orlicky DJ, Guess MK, Bales ES, et al. Using the novel pelvic organ prolapse histologic quantification system to identify phenotypes in uterosacral ligaments in women with pelvic organ prolapse. Am J Obstet Gynecol 2021; 224: 67.e1–67.e18. https://doi.org/10.1016/j.ajog.2020.10.040.
- Alperin M. Deeper dive into tissue-level events that incite and promote pelvic organ prolapse. Am J Obstet Gynecol 2021; 224: 1–2. https://doi.org/10.1016/j.ajog.2020.11.003.
- Nygaard IE, Wolpern A, Bardsley T, Egger MJ, Shaw JM. Early postpartum physical activity and pelvic floor support and symptoms 1 year postpartum. Am J Obstet Gynecol 2021; 224: 193.e1–193.e19. https://doi.org/10.1016/j.ajog.2020.08.033.
- Luchristt D, Brown O, Kenton K, Bretschneider CE. Trends in operative time and outcomes in minimally invasive hysterectomy from 2008 to 2018. Am J Obstet Gynecol 2021; 224: 202.e1–202.e12. https://doi.org/10.1016/j.ajog.2020.08.014.
- Gabriel I, Kalousdian A, Brito LG, Abdalian T, Vitonis ScM AF, Minassian VA. Pelvic organ prolapse after three modes of hysterectomy: long-term follow up. Am J Obstet Gynecol 2020; 224: 496.e1–496.e10. https://doi.org/10.1016/j.ajog.2020.11.008.
- Jelovsek JE, Gantz MG, Lukacz E, et al. Success and failure are dynamic, recurrent event states after surgical treatment for pelvic organ prolapse. Am J Obstet Gynecol 2021; 224: 362.e1–362.e11. https://doi.org/10.1016/j.ajog.2020.10.009.
- Jelovsek JE, Gantz MG, Lukacz ES, et al. Subgroups of failure after surgery for pelvic organ prolapse and associations with quality of life outcomes: a longitudinal cluster analysis. Am J Obstet Gynecol 2021; 225: 504.e1–504.e22. https://doi.org/10.1016/j.ajog.2021.06.068.
- Nager CW, Visco AG, Richter HE, et al. Effect of sacrospinous hysteropexy with graft vs vaginal hysterectomy with uterosacral ligament suspension on treatment failure in women with uterovaginal prolapse: 5-year results of a randomized clinical trial. Am J Obstet Gynecol 2021; 225: 153.e1–153.e31. https://doi.org/10.1016/j.ajog.2021.03.012.
- Schulten SF, Detollenaere RJ, IntHout J, Kluivers KB, Van Eijndhoven HW. Risk factors for pelvic organ prolapse recurrence after sacrospinous hysteropexy or vaginal hysterectomy with uterosacral ligament suspensión. Am J Obstet Gynecol 2022; 227: 252.e1–252.e9. https://doi.org/10.1016/j.ajog.2022.04.017.
- Schulten SFM, Claas-Quax MJ, Weemhoff M, et al. Risk factors for primary pelvic organ prolapse and prolapse recurrence: an updated systematic review and meta-analysis. Am J Obstet Gynecol 2022; 227: 192–208.
- Bowen ST, Moalli PA, Abramowitch SD, et al. Defining mechanisms of recurrence following apical prolapse repair based on imaging criteria. Am J Obstet Gynecol 2021; 225: 506.e1–506.e28. https://doi.org/10.1016/j.ajog.2021.05.041.
- Husby KR, Gradel KO, Klarskov N. Pelvic organ prolapse following hysterectomy on benign indication: a nationwide, nulliparous cohort study. Am J Obstet Gynecol 2022; 226: 386.e1–386.e9. https://doi.org/10.1016/j.ajog.2021.10.021.
- Mou T, Cadish LA, Gray EL, Bretschneider CE. Cost-effectiveness of prophylactic retropubic sling at the time of vaginal prolapse surgery. Am J Obstet Gynecol 2022; 227: 471.e1–471.e7. https://doi.org/10.1016/j.ajog.2022.05.044.
- Kowalski JT, Wiseman JB, Smith AR, et al. Natural history of lower urinary tract symptoms in treatment-seeking women with pelvic organ prolapse; the Symptoms of Lower Urinary Tract Dysfunction Research Network (LURN). Am J Obstet Gynecol 2022; 227: 875.e1–875.e12. https://doi.org/10.1016/j.ajog.2022.07.038.
- Bump RC, Mattiasson A, Bø K, et al. The standardization of terminology of female pelvic organ prolapse and pelvic floor dysfunction. Am J Obstet Gynecol 1996; 175: 10–17.
- Broekhuis SR, Fütterer JJ, Barentsz JO, Vierhout ME, Kluivers KB. A systematic review of clinical studies on dynamic magnetic resonance imaging of pelvic organ prolapse: the use of reference lines and anatomical landmarks. Int Urogynecol J Pelvic Floor Dysfunct 2009; 20: 721–729.
- Dietz HP, Lekskulchai O. Ultrasound assessment of prolapse: the relationship between prolapse severity and symptoms. Ultrasound Obstet Gynecol 2007; 29: 688–691.
- Shek KL, Dietz HP. What is abnormal uterine descent on translabial ultrasound? Int Urogynecol J 2015; 26: 1783–1787.
- Eisenberg VH, Chantarasorn V, Shek KL, Dietz HP. Does levator ani injury affect cystocele type? Ultrasound Obstet Gynecol 2010; 36: 618–623.
- Green TH Jr. Urinary stress incontinence: differential diagnosis, pathophysiology, and management. Am J Obstet Gynecol 1975; 122: 368–400.
- Chantarasorn V, Dietz HP. Diagnosis of cystocele type by clinical examination and pelvic floor ultrasound. Ultrasound Obstet Gynecol 2012; 39: 710–714.
- García-Mejido JA, Ramos-Vega Z, Armijo-Sánchez A, Fernández-Palacín A, García-Jimenez R, Sainz JA. Differential diagnosis of middle compartment pelvic organ prolapse with transperineal ultrasound. Int Urogynecol J 2021; 32: 2219–2225. https://doi.org/10.1007/s00192-020-04646-1.
- García-Mejido JA, Ramos Vega Z, Armijo Sánchez A, Fernández-Palacín A, Fernández CB, Sainz Bueno JA. Interobserver variability of ultrasound measurements for the differential diagnosis of uterine prolapse and cervical elongation without uterine prolapse. Int Urogynecol J 2021; 33: 2825–2831.
- Dietz HP, Steensma AB. Posterior compartment prolapse on two-dimensional and three-dimensional pelvic floor ultrasound: the distinction between true rectocele, perineal hypermotility and enterocele. Ultrasound Obstet Gynecol 2005; 26: 73–77.
- García-Mejido JA, Ramos-Vega Z, Fernández-Palacín A, et al. Predictive model for the diagnosis of uterine prolapse based on transperineal ultrasound. Tomography 2022; 8: 1716–1725.
- Dietz HP, Simpson JM. Levator trauma is associated with pelvic organ prolapse. BJOG 2008; 115: 979–984.
- Dietz HP, Shek KL. Tomographic ultrasound imaging of the pelvic floor: which levels matter most? Ultrasound Obstet Gynecol 2009; 33: 698–703.
- Orejuela F, Shek KL, Dietz HP. The time factor in the assessment of prolapse and levator ballooning. Int Urogynecol J 2012; 23: 175–178.
- Dietz H. Ultrasound imaging of the pelvic floor. Part 1: two-dimensional aspects. Ultrasound Obstet Gynecol 2004; 23: 80–92.
- García-Mejido JA, González-Diaz E, Ortega I, Borrero C, Fernández-Palacín A, Sainz-Bueno JA. 2D ultrasound diagnosis of middle compartment prolapse: a multicenter study. Quant Imaging Med Surg 2021; 12: 959.
- Swenson CW, Smith TM, Luo J, Kolenic GE, Ashton-Miller JA, DeLancey JO. Intraoperative cervix location and apical support stiffness in women with and without pelvic organ prolapse. Am J Obstet Gynecol 2017; 216: 155.e1–155.e8.
- Chen L, Ashton-Miller JA, DeLancey JO. A 3D finite element model of anterior vaginal wall support to evaluate mechanisms underlying cystocele formation. J Biomech 2009; 42: 1371–1377.
- Luo J, Betschart C, Chen L, Ashton-Miller JA, DeLancey JO. Using stress MRI to analyze the 3D changes in apical ligament geometry from rest to maximal Valsalva: a pilot study. Int Urogynecol J 2014; 25: 197–203.
- Lone FW, Thakar R, Sultan AH, Stankiewicz A. Accuracy of assessing Pelvic Organ Prolapse Quantification points using dynamic 2D transperineal ultrasound in women with pelvic organ prolapse. Int Urogynecol J 2012; 23: 1555–1560.
- Kluivers KB, Jan CM, Shek HC, Dietz HP. Pelvic organ prolapse symptoms in relation to POP-Q, ordinal stages and ultrasound prolapse assessment. Int Urogynecol J 2008; 19: 1299–1302.
- Dietz HP, Haylen BT, Broome J. Ultrasound in the quantification of female pelvic organ prolapse. Ultrasound Obstet Gynecol 2001; 18: 511–514.
- Broekhuis SR, Kluivers KB, Hendriks JCM, Futterer JJ, Barentsz JO, Vierhout ME. POP-Q, dynamic MR imaging and perineal ultrasonography: do they agree in quantification of female pelvic organ prolapse? Int Urogynecol J 2009; 20: 541–549.
- Rodríguez-Mias NL, Subramaniam N, Friedman T, Shek KL, Dietz HP. Prolapse assessment supine and standing: do we need different cutoffs for “significant prolapse”? Int Urogynecol J 2018; 29: 685–689.