Жорсткі вогнищеві ураження печінки – часте явище при абдомінальному дослідженні. Точність характеризування та диференціальна діагностика між різними типами жорстких вогнищевих уражень печінки дуже важливі. Технологія ARFI з Virtual Touch квантифікацією тканин може надати важливу додаткову інформацію про жорсткість печінки.
A. Gallotti a, M. D’Onofrioa, L. Romaninib, V. Cantisanic, R. Pozzi Mucellia
a) Department of Radiology, University Hospital G.B. Rossi, Piazzale L.A. Scuro 10, 37134, University of Verona, Verona, Italy;
b) Department of Radiology, Spedali Civili, P. le Spedali Civili 1, 25123, University of Brescia, Italy;
c) Department of Radiology, Ospedale La Sapienza, Viale dell’Università 00185, University of Roma, Italy.
Резюме
Мета. Метою цього дослідження було оцінити можливість застосування ARFI ультразвукової візуалізації та її потенційну цінність для характеристики жорстких вогнищевих уражень печінки.
Матеріал та методи. В цьому багатоцентровому перспективному дослідженні, яке тривало 4 місяці, всім пацієнтам провели ARFI УЗД. Два незалежних оператори провели 5 вимірювань кожного патологічного вогнища і два вимірювання навколишньої здорової тканини печінки. Дані остаточного діагнозу, середньостатистичні значення швидкості і стандартні відхилення, отримані для кожного типу жорсткого вогнищевого ураження, порівнювали з t-тестом. Узгодженість висновків серед дослідників оцінювали за допомогою t-тесту Стьюдента. Також провели порівняння між середньостатистичними показниками загалом, а також між кожним типом патологічних вогнищ і середньостатистичними значеннями паренхіми.
Результати. Провели оцінку сорока патологічних вогнищ і отримали 400 вимірювань. Визначили наступні патологічні вогнища: 6/40 (15%) – гепатоцелюлярна карцинома (ГЦК), 7/40 (17,5%) – гемангіома, 5/40 (12,5%) – аденома, 9/40 (22,5 %) – метастази і 13/40 (32,5%) – фокальна нодулярна гіперплазія (ФНГ). Підраховані наступні середньостатистичні значення: 2,17 м/с для ГЦК, 2,30 м/с для гемангіом, 1,25 м/с для аденом, 2,87 м/с для метастаз і 2,75 м/с для ФНГ. Узгодженість серед дослідників статистично не відрізнялася (p > 0,05). Помічена значна різниця (p > 0,05) при порівнянні аденоми з іншими патологічними вогнищами. Також провели 160 вимірювань навколишньої паренхіми. Була визначена незначна різниця між значеннями вимірів в аденомах і в навколишніх ділянках паренхіми печінки.
Висновки. Технологія ARFI з Virtual Touch квантифікацією тканин може надати важливу додаткову інформацію про жорсткість печінки, що матиме велике значення для диференціальної діагностики жорстких вогнищевих уражень.
ВСТУП
Жорсткі вогнищеві ураження печінки – часте явище при абдомінальному дослідженні. Точність характеризування та диференціальна діагностика між різними типами жорстких вогнищевих уражень печінки дуже важливі, і всі режими візуалізації повинні задовольняти ці вимоги. В таких клінічних випадках, як цироз та карцинома печінки, виявлення жорсткого осередкового ураження печінки може вважатися злоякісним поки не доведено зворотне. Однак, у пацієнтів у яких в анамнезі була злоякісна пухлина, приблизно 50% патологічних вогнищ менше 2 см доброякісні. З іншого боку, в деяких випадках метастази печінки є першою знахідкою у пацієнтів із невідомим примітивним раком.
Звичайне ультразвукове дослідження (УЗД) часто є першим методом візуалізації, який застосовується для скринінгу або обстеження патологічних вогнищ печінки, тому що він є відносно дешевим і широкодоступним. Кольоровий доплер, гармонійна візуалізація тканини (Tissue Harmonic Imaging – THI) і (зовсім віднедавна) використання мікропухирців в контрастних препаратах – значно покращують опис характеру жорстких вогнищевих уражень печінки. Комп’ютерна томографія (КТ) та магнітно-резонансна томографія (МРТ) – методи діагностики другої лінії, що дозволяють точно описати і охарактеризувати раніше виявлені патологічні вогнища, але ці методи є дорожчими і менш доступними. Методи візуалізації із застосуванням контрастних препаратів здатні оцінити морфологію патологічного вогнища і васкуляризацію з високою діагностичною точністю, що добре описано в літературі. Проте, для встановлення остаточного діагнозу іноді необхідні інвазивні дослідження.
Акустичне імпульсно-хвильове (ARFI) УЗД – це новий метод візуалізації, інтегрований в звичайну УЗД систему, яка здатна неінвазивно оцінити жорсткість глибоких тканин. З часу його впровадження, всього в декількох літературних джерелах описувались можливості його застосування в дослідженні здорових людей і дифузних патологій. Всього в двох роботах описували застосування ARFI технології для дослідження жорстких вогнищевих уражень печінки, з різними результатами. ARFI дослідження дозволяє робити кількісні та якісні виміри в режимі реального часу, що дає інноваційну та додаткову інформацію до УЗД.
В даній роботі за мету ставиться оцінити застосування ARFI УЗД методу візуалізації та його потенційну цінність для опису характеру жорстких вогнищевих уражень печінки.
МАТЕРІАЛИ І МЕТОД
Це багатоцентрове дослідження було схвалене ревізійною комісією кожної установи та проведене згідно принципів Гельсінської Декларації. Письмова інформована згода була отримана від всіх пацієнтів до проведення ARFI дослідження.
2.1. Пацієнти
Протягом чотирьох місяців (з перервами), всім пацієнтам в трьох установах (відповідно позначені – I, II, III) провели ARFI дослідження. Перервність періоду дослідження пояснюється тим, що в деяких установах тимчасово була недоступна ARFI система.
Критерії включення пацієнта в дослідження були наступними: 1) наявність жорсткого вогнищевого ураження печінки, патологічно підтвердженого або заключно продіагностованого не менше ніж двома методами візуалізації (контрастно-підсилене УЗД, КТ або МРТ), як описано в посібнику; 2) відсутність проведених місцевих методів лікування (таких, як крізьшкірна ін’єкція етанолу, радіочастотна абляція, трансартеріальна хіміоемболізація); 3) патологічне вогнище добре візуалізується на звичайному УЗД із мінімальним діаметром ≤1,5 см, локалізується на максимальній глибині 5,5 см. Більше того, пацієнти повинні дотримуватися правил і вміти затримувати дихання для того, щоб зарахуватися в дослідження.
2.2. Методи візуалізації
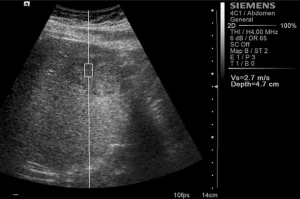
ARFI дослідження проводили за допомогою ультразвукової системи SIEMENS S2000 (Siemens, Erlanger, Germany), використовуючи конвексні датчики (4С1), гармонійну візуалізацію тканини (THI; 4 мГц) і механічний індекс 1,7. В В-режимі встановлювалась досліджувана ділянка (ДД) патологічного вогнища розміром 1х0,5 см і максимальною глибиною 5,5 см для визначення еластичних властивостях тканини. ДД охоплювала весь патологічний осередок, при потребі її положення мінялося для охоплення якомога більшої площі утворення, не включаючи судинні або біліарні структури. В ДД не включали ділянки дегенерації (некротичну, кістозну, геморагічну чи кальциновану ділянки), або будь-які інші макроскопічні структури, такі як фіброзні рубці. Також проводили вимірювання в навколишній паренхімі на відстані 2-3 см від вогнищевого ураження, враховуючи те, що васкулярні або біліарні структури не повинні включатись. Тканина-мішень механічним способом «підштовхується» короткочасними силовими імпульсами (менше 1 мс), які генерують локалізовані зміщення. Сформовані зсувні хвилі проникають перпендикулярно до акустичного імпульсу в націлену ДД. Обчислення швидкості зсувної хвилі виражається в метрах за секунду.
2.3. Аналіз даних
Два незалежні дослідники в кожній установі, без даних про заключний діагноз та результати інших методів діагностики, проводили ARFI дослідження. Всі вимірювання проводилися після короткочасного вдиху для того, щоб поліпшити візуалізацію патологічного вогнища. Всі дослідники робили п’ять вимірів кожного вогнища і два виміри навколишньої тканини. Як написано вище, ДД встановлювалася на різних ділянках патологічного вогнища, щоб оцінити утворення в цілому. Оскільки Virtual Touch квантифікація тканини виражає швидкість зсувних хвиль в твердих матеріалах як цифрові значення, лише цифрові значення враховувалися в даній роботі. Таким чином, невірні виміри через неправильне позиціонування ДД (некротизована або кістозна ділянка, судинні або біліарні структури в ДД) або рух пацієнта, система розпізнавала як «N/A» (не доступно – not available) або «ХХХХ» або «0», і ці результати виключалися.
Всі дані від трьох установ зібрали і проаналізували в установі «I», яка скоординувала дослідження. Значення швидкостей хвиль і заключні діагнози порівнювалися.
2.4. Статистика
Згідно остаточного діагнозу, у всіх вимірах було отримано значення середньостатистичної швидкості хвилі (дослідження виконані кожним дослідником для кожного типу жорсткого вогнищевого ураження печінки). Узгодженість висновків серед дослідників обчислювалася шляхом порівняння середньостатистичних значень всіх вимірювань в кожній установі. Статистичний аналіз проводився за допомогою t-тесту Стьюдента, значення p < 0,05 вважалося статистично достовірним.
Крім того, обчислювалося загальне середньостатистичне значення і стандартні відхилення для кожної групи патологічних вогнищ.
І врешті-решт, проводилося порівняння між загальними середньостатистичними значеннями кожного типу патологічного вогнища і середньостатистичними значеннями навколишньої паренхіми.
РЕЗУЛЬТАТИ
Загалом, 40 патологічних вогнищ досліджували за допомогою Virtual Touch Tissue Quantification: 20/40 (50%) в установі «I», 15/40 (37,5%) в установі «II» і 5/40 (12,5%) в установі «III». У пацієнтів з численною кількістю патологічних вогнищ, оцінювалось найбільше з них, яке візуалізується найкраще. Загалом, було отримано 400 достовірних вимірювань (5 на кожне вогнище для кожного дослідника).
Згідно остаточного діагнозу, визначили наступні патологічні вогнища: 6/40 (15%) – гепатоцелюлярна карцинома (ГЦК; середній розмір 38 мм, діапазон 18-85 мм), 7/40 (17,5%) – гемангіома (середній розмір 25 мм, діапазон 15-45 мм), 5/40 (12,5%) – аденома (середній розмір 31 мм, діапазон 16-45 мм), 9/40 (22,5%) – метастази (середній розмір 35 мм, діапазон 15-55 мм) і 13/40 (32,5%) – фокальна нодулярна гіперплазія (ФНГ; середній розмір 38 мм, діапазон 19-78 мм). Метастатичні осередки були похідними від різних первинних пухлин, включаючи аденокарциному підшлункової залози, нейроендокринну пухлину підшлункової залози, пухлину жовчного міхура, рак кишківника і молочних залоз. Всі гемангіоми, 10/13 ФНГ, 2/6 ГЦК та 2/9 метастазів діагностували на підставі типових даних на контрастно-підсиленому УЗД і/або КТ та/або МРТ. Інші патологічні вогнища підтвердили після біопсії (4/6 ГЦК і 7/9 метастази) або хірургічної резекції (3/13 ФНГ, через великі розміри), проведеної безпосередньо після ARFI дослідження.
Середньостатистичні значення швидкості хвилі і їх стандартні відхилення, помічені дослідниками для кожного типу вогнища, представлені в таблиці 1. Загальні середньостатистичні значення швидкості хвилі були наступними: 2,14 ± 0,85 м/с для ГЦК (рис. 1), 2,30 ± 0,95 м/с для гемангіом (рис. 2), 1,25 ± 0,37 м/с для аденом (рис. 3), 2,87 ± 1,13 м/с для метастаз (рис. 4) та 2,75 ± 0,95 м/с для ФНГ (рис. 5). Не було статистично достовірної різниці в заключеннях серед дослідників у всіх випадках (p>0,05).
Таблиця 1. Середньостатистичні значення швидкості хвилі обчислені з усіх вимірів, проведених дослідниками на патологічних осередках із встановленим діагнозом.
|
Вогнище |
Кількість |
Середньостатистичне значення (м/с) |
||
|
Дослідник 1 |
Дослідник 2 |
Загалом (СВ) |
||
|
ГЦК |
6 |
2,14 |
2,19 |
2,17 (0,85) |
|
Гемангіома |
7 |
2,27 |
2,32 |
2,30 (0,95) |
|
Аденома |
5 |
1,27 |
1,23 |
1,23 (0,37) |
|
Метастази |
9 |
2,84 |
2,89 |
2,87 (1,13) |
|
ФНГ |
13 |
2,77 |
2,73 |
2,75 (0,95) |
Примітка: ГЦК – гепатоцеллюлярна карцинома; ФНГ – фокальна нодулярна гіперплазія; СВ – стандартне відхилення.
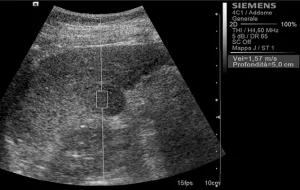
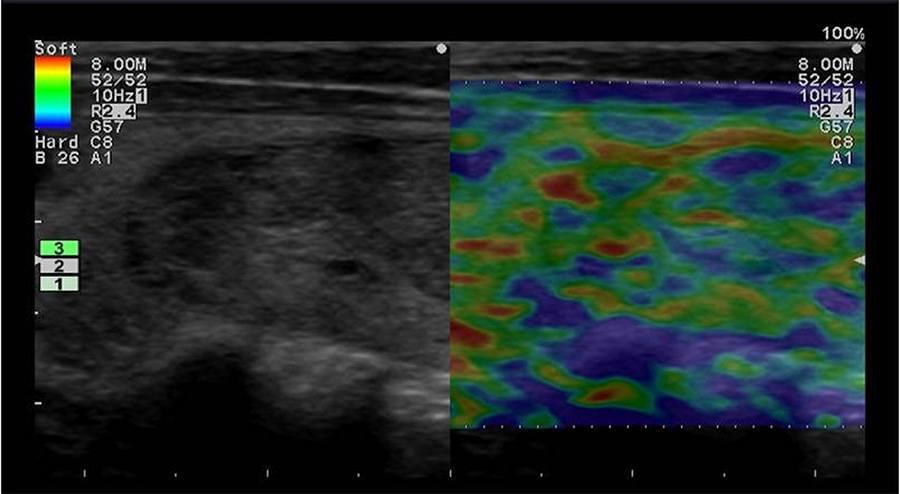
Рис. 1. Ультразвуковий ARFI метод з Virtual Touch квантифікацією тканини (гепатоцеллюлярна карцинома).
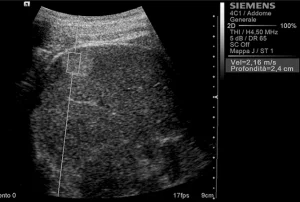
Рис. 2. Ультразвуковий ARFI метод з Virtual Touch квантифікацією тканини (гемангіома).
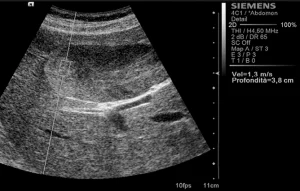
Рис. 3. Ультразвуковий ARFI метод з Virtual Touch квантифікацією тканини (аденома).
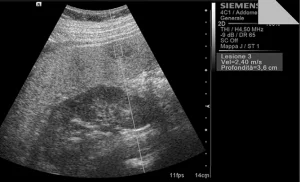
Рис. 4. Ультразвуковий ARFI метод з Virtual Touch квантифікацією тканини (метастази).
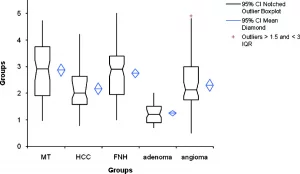
Результати похідні від статистичних порівнянь між загальними середньостатистичними значеннями для кожної групи вогнищ представлені в таблиці 2. Існує перекриття між значеннями різних осередків, крім аденом, а також була визначена значна різниця при всіх порівняннях, крім: гемангіоми і ГЦК, метастази і ФНГ. Значна різниця (p < 0,05) завжди спостерігалася при порівнянні аденом з іншими патологічними вогнищами.
І нарешті, загалом було отримано 160 вимірювань (2 на пацієнта, проведені кожним дослідником) із паренхіми, яка оточувала жорстке вогнище.
Загальні середньостатистичні значення для кожного виду вогнища і навколишньої паренхіми порівнювалися, і представлені в таблиці 3. Середньостатистичні значення для аденом (1,25 ± 0,37 м/с) і навколишньої тканини печінки (1,40 м/с) виявилися схожими, а в інших випадках вони значно відрізнялися.
ОБГОВОРЕННЯ
Технологія ARFI – відносно новий метод візуалізації, який здатний неінвазивно давати інформацію про еластичні властивості тканин-мішеней. Ця технологія відрізняється від попередніх методів, оскільки вона дозволяє робити оцінку глибоких тканин без зовнішньої компресії. Ці кількісні можливості мають назву Visual Touch Tissue Quantification та надають об’єктивну чисельну оцінку її жорсткості. Оскільки ARFI інтегрується в звичайну УЗД систему, вона може давати додаткову інформацію під час дослідження в реальному часі. Обчислення швидкості зсувної хвилі відображає еластичність і в’язкість тканини-мішені. М’які матеріали дозволяють велике зміщення амплітуд, а тверді матеріали зазвичай мають низьке зміщення.
Рис. 5. Ультразвуковий ARFI метод з Virtual Touch квантифікацією тканини (фокальна нодулярна гіперплазія).
Таблиця 2. Коробчата діаграма дає уявлення про різні групи патологічних вогнищ.
Примітка: МТ – метастази; HCC – ГЦК гепатоцеллюлярна карцинома; FNH – ФНГ фокальна нодулярна гіперплазія.
До теперішнього часу, всього дві (in vivo) роботи описували застосування ARFI технології для дослідження жорстких вогнищевих уражень печінки. Fahey et al. в 2008 р. проаналізували сім вогнищ, включаючи ГЦК, які були м’якшими та метастази, котрі були жорсткішими, ніж навколишня паренхіма печінки. Cho et al. у 2010 році досліджували швидкість зсувних хвиль в 36 жорстких вогнищевих ураженнях печінки, включаючи метастази і холангіокарциноми, ГЦК і гемангіоми. За даними Fahey, більшість метастаз і холангіокарцином були жорсткішими, ніж навколишня тканина печінки. Всього 24% з усіх ГЦК були м’якшими, ніж навколишня циротично-змінена печінка, а 76% характеризувалися такою ж, або більшою жорсткістю. У нашій роботі, всі метастатичні вогнища були жорсткішими, ніж навколишня тканина печінки. Це, швидше за все, – наслідок наявності фіброзної тканини в багатьох метастатичних вогнищах. Оскільки метою нашої роботи була оцінка жорсткості жорстких ділянок уражень печінки, в ДД не включали некротичні ділянки, не зважаючи на те, що некротична дегенерація не впливає на результати.
Згідно з даними Fahey, однак не збігаючись з даними Cho, не зважаючи на схожі діаметри вогнищ, в нашій роботі майже всі оцінені ГЦК були м’якшими порівняно з навколишньою циротично-зміненою печінкою, і середньостатистичне значення було значно нижче, ніж у навколишній паренхімі. Як було описано в інших роботах, присвячених дифузному фіброзу печінки, циротичні зміни мали більше значення швидкості хвилі, ніж нормальна тканина, залежно від ступеня фіброзування. Однак, значної різниці в значеннях швидкості хвиль між різними ступенями фіброзу печінки не було продемонстровано для ARFI технології. Деякі роботи показали, що ARFI може проводити диференціацію між циротичною і нециротичною печінкою, але можливість оцінки потенційної різниці між ступенями фіброзу все ще під питанням. Таким чином, низьке значення швидкості хвилі, яке спостерігалось при дослідженні ГЦК, порівняно з навколишньою тканиною, може бути причиною низького скупчення в них фібротичних тканин і значного фіброзу в навколишній тканині печінки (паренхіма майже завжди була циротично зміненою).
Cho et al. повідомили, що 78% м’яких вогнищ на ARFI знімках були гемангіомами, їх середньостатистичне значення становило 1,51 ± 0,71 м/с, але за даними аналізу Virtual Touch квантифікації тканин, вогнища такого виду мали однакову кількість як більш жорстких, так і більш м’яких по відношенню до навколишньої тканини печінки. Наші результати не зовсім збігаються з Cho et al., тому що майже у всіх випадках ми спостерігали більш високі значення в гемангіомах, ніж у навколишній паренхімі. Однак, ми згодні з Cho et al. щодо потенційної варіабельності цього виду вогнища залежно від кількості фіброзних септ, які поділяють розширений судинний простір.
Вперше, в нашій роботі досліджувались ФНГ і аденоми. ФНГ виявились найжорсткішими вогнищами, після метастазів, незалежно від їх розмірів і від наявності або відсутність центрального рубця. До того ж, при наявності, ДД встановлювали за межами фіброваного центрального рубця. Таким чином, якщо наші результати підтвердяться іншими роботами, порогове значення 2 м/с (за даними дослідження Cho et al.), не можна застосовувати для диференціації добро- і злоякісних вогнищ. З іншого боку, аденоми показали схожі з навколишньою тканиною печінки значення швидкості хвилі: найм’якші осередки, які аналізувалися. Відсутність портальних просторів і біліарних протоків, наявність клітин, схожих на нормальні гепатоцити і невелика кількість строми пояснює низьке середньостатистичне значення швидкості хвилі, визначене в аденомах, порівняно з іншими жорсткими вогнищами. Ця статистично значуща різниця між ФНГ і аденомами грає важливу клінічну роль.
Враховуючи середньостатистичні значення патологічних вогнищ і паренхіми, аденома показала схожі результати з навколишньою тканиною печінки завдяки більш м’якій тканині цього виду вогнища. З іншого боку, середньостатистичні значення швидкості хвилі паренхіми печінки у пацієнтів з ГЦК були схожими з даними, описаними в літературі (F4 стадія цирозу – 2,56 ± 0,75 м/с [11] і 2,38 ± 0,74 м/с), і майже завжди асоціювалися з ГЦК. Решта показали середні значення швидкості хвилі, що схожі на описані в літературі, як типові для здорового пацієнта (1,59 м/с).
Таблиця 3. Значення середніх швидкостей хвилі загалом, для кожного виду патологічного вогнища і навколишньої паренхіми.
|
Вид вогнища |
Вогнище (м/с) |
Паренхіма (м/с) |
|
ГЦК |
2,17 |
2,99 |
|
Гемангіома |
2,30 |
1,45 |
|
Аденома |
1,25 |
1,40 |
|
Метастази |
2,87 |
1,63 |
|
ФНГ |
2,75 |
1,57 |
Примітка: ФНГ – фокальна нодулярна гіперплазія; ГЦК – гепатоцелюлярна карцинома.
Дане багатоцентрове дослідження підтверджує потенційні можливості застосування ARFI технології для характеристики жорстких вогнищевих уражень печінки. За попередніми даними, була отримана значна різниця між загальними значеннями швидкості хвилі, типовими для кожного виду вогнища. В клінічній сфері, метод ARFI може стати корисним інструментом для УЗД візуалізації печінки в трьох випадках. Перший – це диференційна діагностика між аденомами і ФНГ. Насправді контрастно-підсилене МРТ з гепатоцит-специфічною контрастною речовиною – метод вибору для неінвазивної диференціальної діагностики і є обов’язковим, оскільки ФНГ доброякісне утворення, яке не вимагає хірургічного лікування, а аденоми з добре відомими ускладненнями можуть потребувати хірургічної резекції. ARFI візуалізація з Virtual Touch квантифікацією тканини може надати додаткову до УЗД інформацію, показуючи високі значення середніх швидкостей для ФНГ і низькі значення для аденом. Другий випадок – це диференційна діагностика між аденомами і ГЦК. Virtual Touch квантифікація тканини надає важливу інформацію: менші середньостатистичні значення швидкості хвилі для аденом порівняно з ГЦК. Третій випадок – це диференційна діагностика між аденомами і метастазами. При оцінці за допомогою Virtual Touch квантифікації тканин, більш високі середні значення швидкості хвилі були знайдені в метастазах в порівнянні з аденомами.
Це багатоцентрове дослідження повідомляє про попередні результати. Існують властиві обмеження, такі як незмінний розмір ДД (обмежує діаметр досліджуваних вогнищ і лімітує максимальну глибину), що змусило нас виключити деякі глибокі патологічні вогнища. Іншими обмеженнями є відносно невелика кількість вогнищ та оцінювання тільки деяких видів жорстких вогнищевих уражень печінки (таких, як ФНГ і аденоми), що раніше не досліджувалися. Більше того, деякі результати не збігаються з даними літератури. Тому подальше вивчення більшої популяції необхідне для встановлення клінічної цінності ARFI візуалізації для диференціальної діагностики жорстких вогнищевих уражень печінки.
ВИСНОВКИ
Автори зробили висновок, що застосування ARFI технології з Virtual Touch Tissue Quantification для дослідження жорстких вогнищевих уражень печінки може являтися джерелом неінвазивної, значущої додаткової інформації відносно жорсткості тканин, а також цей метод буде досить ефективним для диференціальної діагностики.






14.10.2019
Валентина