Плотные очаговые поражения печени – частое явление при абдоминальном исследовании. Точность характеризирования и дифференциальная диагностика между различными типами плотных очаговых поражений печени очень важны. Технология ARFI с Virtual Touch квантификацией ткани, может предоставить значительную дополнительную информацию по данным жесткости печени.
A. Gallotti a, M. D’Onofrioa, L. Romaninib, V. Cantisanic, R. Pozzi Mucellia
a) Department of Radiology, University Hospital G.B. Rossi, Piazzale L.A. Scuro 10, 37134, University of Verona, Verona, Italy;
b) Department of Radiology, Spedali Civili, P. le Spedali Civili 1, 25123, University of Brescia, Italy;
c) Department of Radiology, Ospedale La Sapienza, Viale dell’Università 00185, University of Roma, Italy.
Резюме
Цель. Целью этого исследования было оценить возможность применения ARFI ультразвуковой визуализации и ее потенциальную ценность для характеристики плотных очаговых поражений печени.
Материалы и методы. В этом многоцентровом перспективном исследовании на протяжении 4 месяцев всем пациентам провели ARFI УЗИ. Два независимых оператора провели 5 измерений каждого патологического очага и два измерения окружающей здоровой ткани печени. Данные заключительного диагноза, среднестатистические значения скорости и стандартные отклонения, полученные для каждого типа плотного очагового поражения, сравнивали с t-тестом. Согласованность заключений среди исследователей оценивали с помощью t-теста Стьюдента. Кроме того, провели сравнение между среднестатистическими показателями в общем, а также для каждого типа патологического очага и среднестатистическими значениями паренхимы.
Результаты. Провели оценку сорока патологических очагов и получили 400 измерений. Определили следующие патологические очаги: 6/40 (15%) – гепатоцеллюлярная карцинома (ГЦК), 7/40 (17,5%) – гемангиома, 5/40 (12,5%) – аденома, 9/40 (22,5%) – метастазы и 13/40 (32,5%) – фокальная нодулярная гиперплазия (ФНГ). Подсчитаны следующие среднестатистические значения: 2,17 м/с для ГЦК, 2,30 м/с для гемангиом, 1,25 м/с – для аденом, 2,87 м/с – для метастаз и 2,75 м/с – для ФНГ. Согласованность среди исследователей статистически не отличалась (p>0,05). Замечена значительная разница (p>0,05) при сравнении аденомы с другими патологическими очагами. Также провели 160 измерений окружающей паренхимы. Была определена незначительная разница между значениями измерений в аденомах и в окружающей области печени.
Выводы. Технология ARFI с Virtual Touch квантификацией ткани, может предоставить значительную дополнительную информацию по данным жесткости печени, что будет особо важно для дифференциальной диагностики плотных очаговых поражений.
ВВЕДЕНИЕ
Плотные очаговые поражения печени – частое явление при абдоминальном исследовании. Точность характеризирования и дифференциальная диагностика между различными типами плотных очаговых поражений печени очень важны, и все режимы визуализации должны удовлетворять эти требования. В таких клинических случаях как цирроз и выявленная карцинома печени, обнаружение плотного очагового поражения печени может считаться злокачественным пока не доказано обратное. Однако, у пациентов у которых в анамнезе была злокачественная опухоль, примерно 50% патологических очагов меньше 2 см – доброкачественные. С другой стороны, в некоторых случаях метастазы печени являются первой находкой у пациентов с неизвестным примитивным раком.
Обычное ультразвуковое исследование (УЗИ) часто является первым методом визуализации, который применяется для скрининга или обследования патологических очагов печени потому, что он относительно дешевый и широкодоступный. Цветной-доплер, гармоническая визуализация ткани (Tissue Harmonic Imaging – THI) и, совсем недавно, использование микропузырьков в контрастных препаратах значительно улучшают описание характера плотных очаговых поражений печени. Компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) являються методами диагностики второй линии. Они позволяют точно описать и охарактеризовать ранее обнаруженные патологические очаги, но эти методы более дорогие и менее доступные. Методы визуализации с применением контрастных препаратов способны оценить морфологию патологического очага и васкуляризацию с высокой диагностической точностью, что хорошо описано в литературе. Тем не менее, инвазивные исследования иногда бывают необходимы для установления заключительного диагноза.
Акустическое импульсно-волновое (ARFI) УЗИ – это новый метод визуализации, интегрированный в обычную УЗИ систему, который способен неинвазивно оценить жесткость глубоких тканей [8]. Со времени его внедрения, всего в нескольких литературных источниках описывали способности его применения в исследовании здоровых людей и диффузных патологий. Всего в двух работах описывали применение ARFI технологии для исследования плотных очаговых поражений печени, с разными результатами. ARFI исследование позволяет делать количественные и качественные измерения в режиме реального времени, что дает инновационную и дополнительную информацию к УЗИ.
Данная работа нацелена оценить применение ARFI УЗИ метода визуализации и его потенциальную ценность для описания характера плотных очаговых поражений печени.
МАТЕРИАЛЫ И МЕТОДЫ
Это многоцентровое исследование было одобрено ревизионной комиссий каждого учреждения и проведено согласно принципам Хельсинской декларации. Письменное информационное согласие было получено от всех пациентов до проведения ARFI исследования.
2.1. Пациенты
На протяжении четырех месяцев (с перерывами), всем пациентам задействованных трех учреждений (соответственно обозначенные – I, II, III) провели ARFI исследование. Прерывность периода исследования объясняется тем, что в некоторых учреждениях временно не была доступна ARFI система.
Критерии включения пациента в исследование были следующими: 1) наличие плотного очагового поражения печени, патологически подтвержденного или заключительно продиагностированного не менее чем двумя методами визуализации (контрастно-усиленное УЗИ, КТ или МРТ) как описано в руководстве [7]; 2) отсутствие проведенных местных методов лечения (таких как перкутанная инъекция этанола, радиочастотная абляция, трансартериальная химиоэмболизация); патологический очаг хорошо визуализируется на обычном УЗИ, с минимальным диаметром меньше или равно 1,5 см, локализируется на максимальной глубине 5,5 см. Более того, пациенты должны были придерживаться правил и уметь задерживать дыхание для того, чтобы быть зачисленными в исследование.
2.2. Методы визуализации
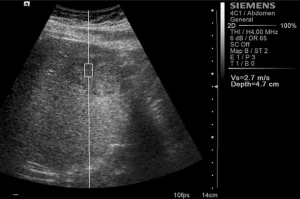
ARFI исследование проводили с помощью ультразвуковой системы SIEMENS S2000 (Siemens, Erlanger, Germany), используя конвексные датчики (4С1), гармоническую визуализацию ткани (THI; 4 мГц) и механический индекс 1,7. В В-режиме, устанавливалась исследуемая область (ИО) патологического очага размером 1х0,5 см и максимальной глубиной 5,5 см для определения эластических свойств ткани. ИО охватывала весь патологический очаг, при потребности ее положение менялось для охвата как можно большей площади образования, не включая сосудистые или билиарные структуры. В ИО не включают участки дегенерации (некротический, кистозный, геморрагический или кальцинированный участок) или любые другие макроскопические структуры, такие как фиброзные рубцы. Также проводились измерения в окружающей паренхиме на расстоянии 2-3 см от очагового поражения, учитывая то, что не должны включатся васкулярные или билиарные структуры. Ткань-мишень механическим способом «подталкивается» кратковременными силовимы импульсами (меньше 1 мс), которые генерируют локализированные смещения. Сформированные сдвиговые волны проникают перпендикулярно к акустическому импульсу в нацеленную ИО. Вычисление скорости сдвиговой волны выражается в метрах за секунду.
2.3. Анализ данных
Два независимые исследователя в каждом учреждении, без данных о заключительном диагнозе и результатов других методов диагностики, проводили ARFI исследования. Все измерения проводились после кратковременного вдоха для того, чтобы улучшить визуализацию патологического очага. Все исследователи делали пять измерений каждого очага и два измерения окружающей ткани. Как написано выше, ИО устанавливалась на разных участках патологического очага, чтобы оценить образование в целом. Поскольку Virtual Touch квантификация ткани выражает скорость сдвиговых волн в твердых материалах как цифровые значения, только цифровые значения учитывались в данной работе. Таким образом, неверные измерения из-за неправильного позиционирования ИО (некротический или кистозный участок очага, сосудистые или билиарные структуры находящейся в ИО) или движение пациента, система распознавала как «N/A» (не доступно – not available) или «ХХХХ» или «0», и эти результаты исключались.
Все данные от трех учреждений собрали и проанализировали в учреждении «I», которое скоординировало исследование. Значения скоростей волн и заключительные диагнозы сравнивались.
2.4. Статистика
Согласно заключительному диагнозу, значение среднестатистической скорости волны было получено во всех измерениях, выполнены каждым исследователем каждого типа плотного очагового поражения печени. Согласованность заключений среди исследователей вычислялась путем сравнения среднестатистических значений всех измерений в каждом учреждении. Статистический анализ проводился с помощью t-теста Стьюдента, значение p <0,05 считалось статистически значимым.
Кроме того, вычислялось общее среднестатистическое значение и стандартные отклонения для каждой группы патологических очагов.
И, наконец, проводилось сравнение между общими среднестатистическими значениями каждого типа патологического очага и среднестатистическими значениями окружающей паренхимы.
РЕЗУЛЬТАТЫ
В общем, 40 патологических очагов исследовали с помощью Virtual Touch Tissue Quantification, 20/40 (50%) в учреждении «I», 15/40 (37,5%) в учреждении «II» и 5/40 (12,5%) в учреждении «III». У пациентов с многочисленными патологическими очагами, оценивался самый большой из них, который лучше всех визуализируется. В общем, было получено 400 достоверных измерений (5 на каждый очаг для каждого исследователя).
Согласно заключительному диагнозу, определили следующие патологические очаги: 6/40 (15%) – гепатоцеллюлярная карцинома (ГЦК; средний размер 38 мм, диапазон 18-85 мм), 7/40 (17,5%) – гемангиома (средний размер 25 мм, диапазон 15-45 мм), 5/40 (12,5%) – аденома (средний размер 31 мм, диапазон 16-45 мм), 9/40 (22,5%) – метастазы (средний размер 35 мм, диапазон 15-55 мм) и 13/40 (32,5%) – фокальная нодулярная гиперплазия (ФНГ; средний размер 38 мм, диапазон 19-78 мм). Метастатические очаги были производными, от разных первичных опухолей, включая аденокарциному поджелудочной железы, нейроэндокринную опухоль поджелудочной железы, опухоль желчного пузыря, рак кишечника и молочных желез. Все гемангиомы, 10/13 ФНГ, 2/6 ГЦК и 2/9 метастазы диагностировали на основании типических данных на контрастно-усиленном УЗИ и/или КТ и/или МРТ. Другие патологические очаги подтвердили после биопсии (4/6 ГЦК и 7/9 метастазы) или хирургической резекции (3/13 ФНГ, из-за больших размеров), проведенной непосредственного после ARFI исследования.
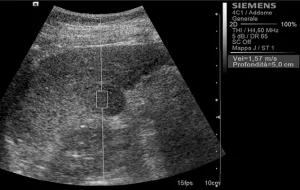
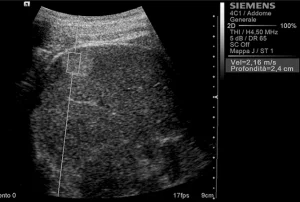
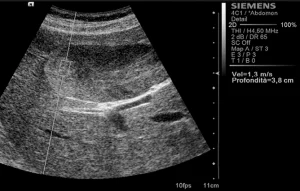
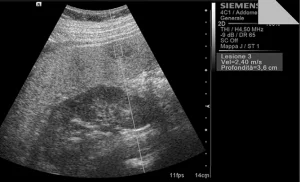
Среднестатистические значения скорости волны и их стандартные отклонения, проведенные исследователями для каждого типа очага, представлены в таблице 1. Общие среднестатистические значения скорости волны были следующими: 2,14±0,85 м/с для ГЦК (рис. 1), 2,30±0,95 м/с для гемангиом (рис. 2), 1,25±0,37 м/с для аденом (рис. 3), 2,87±1,13 м/с для метастаз (рис. 4) и 2,75±0,95 м/с для ФНГ (рис. 5). Не было статистически значимой разницы в заключениях среди исследователей во всех случаях (p>0,05).
Таблица 1. Среднестатистические значения скорости волны вычислены со всех измерений, проведенные исследователями на патологических очагах с установленным диагнозом
|
Очаг |
Количество |
Среднестатистическое значение (м/с) |
||
|
Исследователь 1 |
Исследователь 2 |
В общем (СО) |
||
|
ГЦК |
6 |
2,14 |
2,19 |
2,17 (0,85) |
|
Гемангиома |
7 |
2,27 |
2,32 |
2,30 (0,95) |
|
Аденома |
5 |
1,27 |
1,23 |
1,23 (0,37) |
|
Метастазы |
9 |
2,84 |
2,89 |
2,87 (1,13) |
|
ФНГ |
13 |
2,77 |
2,73 |
2,75 (0,95) |
Примечание: ГЦК – гепатоцеллюлярная карцинома; ФНГ – фокальная нодулярная гиперплазия; СО – стандартное отклонение.
Рис. 1. Ультразвуковой ARFI метод с Virtual Touch квантификацией ткани (гепатоцеллюлярная карцинома)
Рис. 2. Ультразвуковой ARFI метод с Virtual Touch квантификацией ткани (гемангиома)
Рис. 3. Ультразвуковой ARFI метод с Virtual Touch квантификацией ткани (аденома)
Рис. 4. Ультразвуковой ARFI метод с Virtual Touch квантификацией ткани (метастазы)
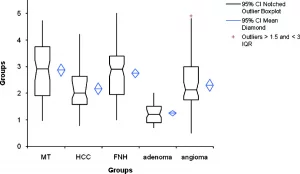
Результаты, производные от статистических сравнений между общими среднестатистическими значениями для каждой группы очагов представлены в таблице 2. Существует перекрытие между значениями разных очагов, кроме аденом, а также была определена значительная разница при всех сравнениях кроме: гемангиомы и ГЦК, метастазы и ФНГ. В особенности, значительная разница (p<0,05) всегда наблюдалась при сравнении аденом с другими патологическими очагами.
И, наконец: в общем, 160 измерений (2 на пациента, проведенные каждым исследователем) были получены с паренхимы, окружающей плотный очаг.
Общие среднестатистические значения для каждого вида очага и окружающей паренхимы сравнивались, и представленные в таблице 3. Среднестатистические значения для аденом (1,25±0,37 м/с) и окружающей ткани печени (1,40 м/с) оказалась похожими, а в других случаях они значительно отличались.
ОБСУЖДЕНИЕ
Технология ARFI представляет собой относительно новый метод визуализации, который способен неинвазивно давать информацию об эластических свойствах тканей-мишеней. Эта технология отличается от предыдущих методов, поскольку она позволяет делать оценку глубоких тканей без наружной компрессии. Ее количественные возможности Visual Touch Tissue Quantification предоставляют объективную численную оценку ее жесткости [9,10]. Поскольку ARFI интегрируется в обычную УЗ систему, она может давать дополнительную информацию во время исследования в реальном времени. Вычисление скорости сдвиговой волны отражает эластичность и вязкость ткани-мишени. Мягкие материалы позволяют большое смещение амплитуд, а твердые материалы обычно имеют низкое смещение.
Рис. 5. Ультразвуковой ARFI метод с Virtual Touch квантификацией ткани (фокальная нодулярная гиперплазия)
Таблица 2. Коробчатая диаграмма дает представление о разных группах патологических очагов
Примечание: МТ – метастазы; HCC – ГЦК гепатоцеллюлярная карцинома; FNH – ФНГ фокальная нодулярная гиперплазия.
До настоящего времени, всего две in vivo работы описывали применение ARFI технологии для исследования плотных очаговых поражений печени. Fahey et al. в 2008 г. проанализировали семь очагов, включая ГЦК, которые были мягче и метастазы, которые были жестче окружающей паренхимы печени. Cho et al. в 2010 году исследовали скорость сдвиговых волн в 36 плотных очаговых поражениях печени, включая метастазы и холангиокарциномы, ГЦК и гемангиомы. По данным Fahey, большинство метастаз и холангиокарцином были плотнее, чем окружающая ткань печени. Всего 24% из всех ГЦК были мягче, чем окружающая цирротическая печень, а 76% характеризировались равной или большей жесткостью. В нашей работе все метастатические очаги были плотнее, чем окружающая ткань печени. Это, скорее всего, последствие наличия фиброзной ткани во многих метастатических очагах. Поскольку целью нашей работы была оценка жесткости плотных участков поражений печени, в ИО не включали некротические участки, несмотря на то, что некротическая дегенерация не влияет на результаты.
Согласно данным Fahey, но не совпадая с данными Cho, несмотря на схожие диаметры очагов, в нашей работе почти все оцененные ГЦК были мягче по сравнению с окружающей цирротической печенью, и среднестатистическое значение было значительно ниже, чем в окружающей паренхиме. Как было описано в других работах, посвященных диффузному фиброзу печени, цирротические изменения имели значение скорости волны больше, чем нормальная ткань, зависимо от степени фиброзирования. Однако, значительной разницы в значениях скорости волн между разными степенями фиброза печени не было продемонстрировано для ARFI технологии. Некоторые работы показали, что ARFI может проводить дифференциацию между цирротической и нецирротической печенью, но возможность оценки потенциальной разницы между степенями фиброза все еще под вопросом. Таким образом, низкое значение скорости волны, наблюдаемое при исследовании ГЦК, по сравнению с окружающей тканью, может быть причиной низкого скопления фибротической ткани в них и значительного фиброза в окружающей ткани печени (паренхима почти всегда была цирротически измененной).
Cho et al. сообщили, что 78% мягких очагов на ARFI снимках были гемангиомами, и вычислили среднестатистическое значение 1,51±0,71 м/с, но по данным анализа Virtual Touch квантификации ткани, очаги такого вида имели одинаковое количество как более плотных, так и более мягих по отношению к окружающей ткани печени. Наши результаты не совсем совпадают с Cho et al. потому, что почти во всех случаях мы наблюдали более высокие значения в гемангиомах, чем в окружающей паренхиме. Однако, мы согласны с Cho et al. относительно потенциальной вариабельности этого вида очага, в зависимости от количества фиброзных септ, которые разделяют расширенные сосудистые пространства.
Впервые в нашей работе исследовались ФНГ и аденомы. ФНГ оказались самыми жесткими очагами, после метастазов, независимо от их размеров и от наличия или отсутствия центрального рубца. К тому же, при наличии, ИО устанавливали за границами фибротического центрального рубца. Таким образом, если наши результаты подтвердятся другими работами, пороговое значение 2 м/с (за данными Cho et al.) [14], нельзя применять для дифференциации добро- и злокачественных очагов. С другой стороны, аденомы показали схожие значения скорости волны с наблюдаемыми в окружающей ткани печени: самые мягкие очаги, которые анализировались. Отсутствие портальных пространств и билиарных протоков, наличие клеток, похожих на нормальные гепатоциты и небольшое количество стромы объясняет низкое среднестатистическое значение скорости волны, определенное в аденомах по сравнению с другими плотными очагами. Эта статистически значимая разница между ФНГ и аденомами играет важную клиническую роль.
Учитывая среднестатистические значения патологических очагов и паренхимы, аденома показала похожие результаты с окружающей тканью печени, благодаря более мягкой ткани этого вида очага. С другой стороны, среднестатистическое значение скорости волны паренхимы печени у пациентов с ГЦК было похоже на данные, описанные в литературе (F4 стадия цирроза – 2,56 ± 0,75 м/с и 2,38 ± 0,74 м/с [12]), и почти всегда ассоциировались с ГЦК. Остальные показали среднего значения скорости волны похожие на описанные данные в литературе как типические для здорового пациента (1,59 м/с).
Таблица 3. Значения средних скоростей волны в общем, для каждого вида патологического очага и окружающей паренхимы.
|
Вид очага |
Очаг (м/с) |
Паренхима (м/с) |
|
ГЦК |
2,17 |
2,99 |
|
Гемангиома |
2,30 |
1,45 |
|
Аденома |
1,25 |
1,40 |
|
Метастазы |
2,87 |
1,63 |
|
ФНГ |
2,75 |
1,57 |
Примечание: ФНГ – фокальная нодулярная гиперплазия; ГЦК – гепатоцеллюлярная карцинома.
Данное многоцентровое исследование подтверждает потенциальные возможности применения ARFI технологии для характеризирования плотных очаговых поражений печени. По предварительным данным, были получены значительные отличия между общими значениями скорости волны, типичными для каждого вида очага. В клинической сфере метод ARFI может стать полезным инструментом для УЗИ визуализации печени в трех случаях. Первый – это дифференциальная диагностика между аденомами и ФНГ. На самом деле контрастно-усиленное МРТ с гепатоцит-специфическим контрастным веществом – это метод выбора для неинвазивной дифференциальной диагностики и есть обязательным, поскольку ФНГ – доброкачественное образование, которое не требует хирургического лечения, а аденомы с хорошо известными осложнениями могут требовать хирургической резекции. ARFI визуализация с Virtual Touch квантификацией ткани может показать информацию в дополнение к УЗИ, предоставляя высокие значения средних скоростей для ФНГ и низкие значения для аденом. Второй случай – это дифференциальная диагностика между аденомами и ГЦК. Virtual Touch квантификация ткани предоставляет важную информацию: меньшие среднестатистические значения скорости волны для аденом по сравнению с ГЦК. Третий случай – это дифференциальная диагностика между аденомами и метастазами. При оценке с помощью Virtual Touch квантификации тканей, более высокие средние значения скорости волны были найдены в метастазах по сравнению с аденомами.
Это многоцентровое исследование сообщает о предварительных результатах. Существуют свойственные ограничения, такие как неизменимый размер ИО (ограничивает диаметр исследуемых очагов и лимитирует максимальную глубину), что вынудило нас исключить некоторые глубокие патологические очаги. Другими ограничениями являются относительно небольшое количество очагов и оценивание только некоторых видов плотных очаговых поражений печени, даже если такие поражения печени как ФНГ и аденомы ранее не исследовались. Более того, некоторые результаты не совпадают с данными литературы. Поэтому необходимо дальнейшее изучение в большей популяции для установления клинической ценности ARFI визуализации для дифференциальной диагностики плотных очаговых поражений печени.
ВЫВОДЫ
Авторы сделали вывод, что применение ARFI технология с Virtual Touch Tissue Quantification для исследования плотных очаговых поражений печени может служить источником неинвазивной, значимой дополнительной информации касательно жесткости тканей, а также этот метод будет весьма эффективным для дифференциальной диагностики.




14.10.2019
Валентина